Проекционни формули на Фишер. Практическо ръководство по химия. Структурна формула на Фишер
Наричат се вещества, които могат да въртят равнината на поляризация на светлината, преминаваща през тях оптически активен. Самото това явление се нарича оптична дейност. Оптично активните вещества съществуват под формата на двойки оптични антиподиили енантиомери, които се различават (при равни други условия - еднаква концентрация, еднаква дължина на пътя на светлинния лъч в веществото) по знака на въртене на равнината на поляризация на светлината.
Молекулите на оптически активните вещества имат свойството хиралност- енантиомерите се отнасят един към друг като оригинала и неговия огледален образ (несъвместими при всяка ротация). Най-често за възникване на хиралност е необходимо присъствие в молекулата. хираленвъглероден атом ( хираленили асиметриченцентър) - в състояние на sp 3 хибридизация и с четири различни заместителя:
Еквимоларна смес от енантиомери няма оптична активност. Тази смес се нарича рацемична смесили рацемат.
Ако една молекула съдържа няколко хирални центъра, е много трудно да се изобрази в проекция, подобна на предишната фигура. В този случай се използват проекционните формули на Е. Фишер.
Броят на стереоизомерите в случай на няколко хирални центъра може да се определи по формулата 2n, където n е броят на хиралните въглеродни атоми. В случай на алдотетрози, които имат два хирални центъра, има 4 стереоизомера:

Молекули 1 и 2, 3 и 4 са енантиомери. Молекули 2 и 4, 1 и 3, 2 и 3 не са енантиомери; въпреки това те са стереоизомери.
Стереоизомерите, които не са енантиомери, се наричат диастереомери.
Диастереомерите се различават по химични и физични свойства и могат да бъдат разделени чрез конвенционални химични методи.
Броят на стереоизомерите може да бъде по-малък от 2 n, ако има мезоформи. Мезоформата възниква, ако молекулата има вътрешни равнини на симетрия. Например винената киселина има три стереоизомера:

Ако изомери 1 и 2 са двойка енантиомери, тогава 3 и 4 са едно и също нещо - молекулата има вътрешна равнина на симетрия, показана с пунктираната линия. Мезоформата е по същество вътрешномолекулен рацемат. Наистина, горната част 3 (над пунктираната линия) е огледален образ на долната част. Мезоформа на оптична активност не притежава.
Номенклатура на оптичните изомери
Първите вещества, за които е открито и изследвано явлението оптичен изомеризъм, са въглехидратите и аминокиселините. Следователно, исторически се е развило, че стереоизомерите на тези съединения се определят от принадлежността към една или друга пространствена серия и към еритро-трео изомери. За връзки на други класове използвайте концепцията абсолютен конфигурация на хиралния център.
Проекционни формули на Фишер
Формулите на Фишер са един от начините за изобразяване на триизмерната структура на хирален център върху равнина. Нека вземем двойка енантиомери и конструираме проекцията на Фишер за дясната молекула:
Нека изберем посоката, от която ще разглеждаме молекулата - тя е показана със стрелката:
В този случай връзките C-A и C-E са насочени към нас; те, в съответствие с правилата за писане на формулата на Фишер, са изобразени с хоризонтална линия. Връзките C-B и C-D са насочени встрани от нас и са представени с вертикална линия. В резултат на това проекцията на Фишер ще изглежда така (1):

Понастоящем както вертикалните, така и хоризонталните линии са изобразени като твърди, въглеродният атом не е начертан - пресечната точка на линиите предполага хирален център, в резултат на което проекцията (2) е общоприета.
Ако разгледаме същата молекула от другата страна, можем да получим друга проекция на Фишер:

Като цяло, дванадесет проекции на Фишер могат да бъдат начертани за дадена молекула. За да се сравнят получените проекции една с друга, е необходимо да се вземе предвид, че проекциите на Фишър позволяват редица трансформации върху себе си.
Трансформации, които запазват оригиналната формула1. Четен брой пермутации. Под пренареждане имаме предвид размяната на местата на всеки два заместителя. Например във формула 2b можете първо да промените D и A (първата пермутация), а след това E и D (което сега стои на мястото на A) - това ще бъде втората пермутация, в резултат на което 2b се трансформира в 2. Прави впечатление, че това е едно и също нещо.

2. Завъртете проекцията в чертожната равнина на 180, 360, 540 и т.н. степени:

3. Циклично пренареждане: оставете един заместител (който и да е) на място, пренаредете останалите три в кръг - по или обратно на часовниковата стрелка. Тази операция е еквивалентна на две пермутации, но понякога се оказва по-удобна.
 Трансформации, водещи до енантиомер
Трансформации, водещи до енантиомер
1. Нечетен брой пермутации - разменете D и E - една пермутация, с помощта на огледало, изобразено с вертикална пунктирана линия, лесно се проверява, че това са енантиомери.

2. Завъртете в чертожната равнина на 90, 270, 450 и т.н. степени. Нека завъртим 2b на 90 o обратно на часовниковата стрелка:

В получената формула ще направим четен брой пермутации - ще разменим B и E, A и D. Сравнявайки 2b и случилото се, виждаме, че това е енантиомер.
3. Отражение в огледало или гледане на светлината.
Стандартна проекция на ФишерВ стандартната проекционна нотация на Фишер основната верига или цикъл се изобразява като вертикална линия, а номерирането на въглеродните атоми (IUPAC) във веригата върви отгоре надолу.
Тези формули обикновено се използват за пространствено представяне на молекули, съдържащи асиметричен въглероден атом : това е тетраедър ( sp 3-хибриден) въглероден атом, свързан с четири различни атома или групи от атоми.
За да се изобрази формулата на проекцията, тетраедричният модел на молекулата е позициониран така, че асиметричният атом да е в равнината на чертежа, а две връзки от асиметричния въглероден атом лежат в хоризонтална равнина, стърчаща към наблюдателя от равнината на чертежа . Другите две връзки трябва да бъдат разположени във вертикална равнина, простираща се от наблюдателя извън равнината на чертежа.
Когато се използват проекции на Фишер, символът за асиметричния въглероден атом обикновено се пропуска:
Винаги трябва да се има предвид, че формулите на Фишер са проекции върху равнина и не трябва да се разглеждат като пространствени модели.
Следователно трябва да се спазват следните правила:
проекционната формула, съответстваща на конкретен стереоизомер, не може да бъде премахната от чертожната равнина и не може да бъде завъртяна в равнината на 90 o и 270 o;
формулата може да се завърти на 180°

Ако позицията на една атомна група не се промени, тогава другите три могат да се завъртят по посока на часовниковата стрелка или обратно на часовниковата стрелка:

4.2. Оптична активност* и хиралност
Оптичната активност се отнася до свойството, способността на веществото да върти (отклонява под определен ъгъл) равнината на поляризирана светлина.
Въртенето на равнината на поляризация се извършва или по посока на часовниковата стрелка (дясно въртене), или обратно на часовниковата стрелка (ляво въртене).
За съединение, съдържащо един асиметричен въглероден атом, са възможни два изомера, които са свързани един с друг като обект и негов огледален образ, както може да се види в примера на млечната киселина.


Два изомера, всеки от които е огледален образ на другия, се наричат оптични или огледални изомери .
Такава двойка огледални изомери се нарича енантиомери или оптични антиподи .
Енантиомерите имат същите физични свойства, с изключение на посоката на въртене на поляризационната равнина: те отклоняват поляризираната светлина под същия ъгъл, но в противоположни посоки.
Съединенията, които са несъвместими с огледалния си образ, се наричат хирален .
Хиралността (от cheir - ръка) е основно понятие от стереохимията, обозначаващо свойството на даден обект да бъде несъвместим с огледалния си образ; е предпоставка за оптичната активност на молекулите.
Нарича се смес от вещества, състояща се от равни количества от двата енантиомера рацемична смес . Оптичната активност на такава смес е 0.
Стереоизомерите, които не са енантиомери, се наричат диастереомери (за подробности вижте по-долу, раздел 4.4.).
По този начин всички хирални молекули са молекули на оптично активни съединения.
Съществува едно към едно съответствие между хиралността и оптичната активност. Характерна особеност на хиралните молекули е липсата на ос, център и равнина на симетрия, които са елементи на симетрия .
Ос на симетрия.Ако въртенето около ос, минаваща през молекулата под ъгъл 2π/n=360 o/n отново я доведе до първоначалното й състояние, тогава такава ос се нарича ос на симетрия от n-ти ред С n . Ясно е, че при стойност n=1 във всеки случай въртенето около оста връща молекулата в първоначалното й състояние.
Например, водна молекула (a) има ос на симетрия от втори ред (n=2), хлорометан (b) има трети ред, а в бензена (c) заедно с шест оси, разположени в равнината на цикъла (n =2), има още една ос (n=6), която е перпендикулярна на равнината на цикъла.

Равнина на симетрия.Ако равнина, преминаваща през молекула (обект), я разделя на две части, свързани една с друга като огледални изомери, тогава тя се нарича равнина на симетрия . Водата има две равнини на симетрия, а хлорометанът има три.

Център на симетрия i- това е точка в центъра на молекула, на еднакво разстояние от която две еквивалентни, еквивалентни точки на дадена молекула са разположени на една и съща права линия.
Една молекула не може да има повече от един център на симетрия.
По този начин, от гледна точка на наличието или отсъствието на елементи на симетрия в молекулите, е обичайно да се говори за хиралност И ахиралност . В повечето случаи значението им съвпада с понятията „асиметрия“ и „симетрия“. Въпреки това хиралността е много по-широко понятие от асиметрията, тъй като хиралната молекула може да съдържа някои елементи на симетрия. По същата причина в стереохимията терминът "асиметричен" атом много често се заменя с термина "център на хиралност". Следователно хиралността трябва да се разбира като свойството на даден обект да бъде несъвместим с огледалния си образ. Една ахирална молекула съдържа поне един елемент на симетрия (или център, или равнина на симетрия). Специален случай на ахиралност е хиралност: способността, свойството на ахирална молекула да се трансформира в хирална чрез еднократна промяна в един структурен фрагмент. По правило такава операция е възможна, ако има прохирален център – т.е. център, съдържащ два различни и два еднакви заместителя. Замяната на един от тези идентични заместители с друг, различен от всички съществуващи, превръща този център в хирален:

Конфигурация и конформация
Стереоизомерите могат да варират конфигурации (конфигурационни изомери) или конформации (конформационни изомери).
Конфигурация– пространственото разположение на атомите и/или атомните групи около хиралния център, равнината на двойната връзка или равнината на пръстена и характеризиране на определен стереоизомер. Тази концепция е до голяма степен качествена по природа и по същество отразява стереохимичната характеристика на специфичното разположение на атомите в пространството около хиралния център на дадена молекула.
По-долу са показани двойки съединения, които са конфигурационни изомери:

Потвърждение*- определена геометрия на молекулата, дължаща се на вътрешно въртене на атоми или атомни групи около прости връзки. В този случай стереохимичната конфигурация на молекулата остава непроменена.
Проекциите на Нюман се използват за изобразяване на конформации. За етана са възможни две гранични конформации: затъмнена (I) и инхибирана (II).

Бутанът се различава от етана по наличието на две метилови групи и следователно за тази молекула са възможни по-голям брой инхибирани конформации, както е показано по-долу. По-стабилната конформация на I е обозначена като анти-: тук метиловите групи са възможно най-отдалечени една от друга (двустенният ъгъл е 180 o). Другите две конформации са наклонени или по друг начин голи конформации (II и III), в които метиловите групи образуват ъгъл от 60°:

3.Проекционни формули на Фишер
За изобразяване на молекули с асиметрични въглеродни атоми в i-равнината често се използват проекции, предложени в 18E1 от Е. Фишер.
Нека разгледаме принципа на тяхната конструкция, използвайки примера на молекула бромофлуорохлорометан. Отправна точка за конструиране на проекции на Fischeoa е пространственият модел на молекулата или нейната клиновидна проекция.
Нека позиционираме молекулата по такъв начин, че само въглеродният атом на бромофлуорохлорометановата молекула да остане в равнината на чертежа, както е показано на фигурата:
Нека проектираме всички атоми върху чертожната равнина (Br и CL отдолу нагоре, тъй като те са разположени под чертожната равнина, и F и H отгоре надолу). За да може получената проекция да се различава от структурната формула, ние се съгласяваме да не изобразяваме асиметричния въглероден атом. Той подразбира сев проекцията на Фишер в пресечната точка на вертикалната и хоризонталната линия:

Както може да се види от горния пример, проекцията на Фишер е конструирана по такъв начин, че връзките на асиметричен атом със заместители са изобразени с вертикални и хоризонтални (но не наклонени!) Линии.
Когато използвате проекциите на Fisher, важно е да запомните, че вертикалната линия в тях изобразява връзки, които се отдалечават от нас, а хоризонталната линия изобразява връзки, насочени към нас . Това води до следните правила за използване на проекции на Фишер:
Изброените операции с проекции на Фишер не могат да бъдат извършени, тъй като водят до проекция на антипод.
Примери.
а) Четен брой по двойки пермутации. Нека разменим позициите на атомите F и CI, Br и H в молекулата на бромофлуорохлорметан:

б) Кръгово пренареждане на три заместителя. Нека извършим кръгово пренареждане на халогенните атоми. Оставяме водородния атом недокоснат:

Когато се конструират проекционни формули на Фишер за молекули, които съдържат няколко въглеродни атома, молекулата се позиционира така, че въглеродната верига да е разположена вертикално. Поставен най-отгоре най-окисленивъглероден атом (като правило този атом е част от карбонилните CH=O или карбоксилни COOH групи):

IV. R,S - Номенклатура на стереоизомерите.
Тъй като енантиомерите имат различни абсолютни конфигурации, тази разлика трябва да бъде предадена в техните имена. Най-често срещаният подход към номенклатурата на стереозомерите е предложена от R. Cahn, C. Ingold и V. Prelog (R.S.Cahn, C.Ingold, V.Prelog, Angew.Chem. (1966), B.78, S.413-447, V. Prelog, G.Helmehen, Angew.Chem (1982), B.94, S.614-631). Техният подход се основава на така нареченото правило за последователност, според което заместителите на асиметричен атом се определя различен стаж. След това се разглежда посоката, в която старшинството на заместителите намалява за определена ориентация на молекулата спрямо наблюдателя. В зависимост от това как пада предимството (по посока на часовниковата стрелка или обратно на часовниковата стрелка), конфигурацията на центъра на хиралността се обозначава като R или S.
1.Принципи на R,S-номенклатурата
Нека разгледаме основните етапи на процедурата за именуване на абсолютната конфигурация, използвайки примера на бромофлуорохлорометан енантиомери (12) и (13).
Първият етапе да се определи редът на приоритет на заместителите на асиметричен атом.
Старшинството на изотопите на даден елемент се увеличава с увеличаване на масовото им число.
В съответствие с това имаме следния ред на приоритет на заместителите в бромофлуорохлорметановите молекули:
Br>CI>F>H
Най-старшият заместник ще се обозначава с буквата а, следващият по старшинство с буквата b и т.н. (тоест по време на прехода a b c d приоритетът намалява):

Втора фаза. Ние позиционираме молекулата по такъв начин, че най-ниският заместител да бъде отстранен от наблюдателя (в този случай той ще бъде скрит от въглеродния атом) и разглеждаме молекулата по оста на връзката на въглерода с най-ниския заместител:

Трети етап. Определете в каква посока ПАДАстаршинството на депутатите, които са в нашето полезрение. Ако намаляването на старшинството става по посока на часовниковата стрелка, ние го обозначаваме с буквата R (от латинското "rectus" дясно). Ако старшинството пада обратно на часовниковата стрелка, тогава конфигурацията се обозначава с буквата S (от латинското „зловещо“ - ляво).

Съществува и мнемонично правило, според което намаляването на старшинството на заместителите в R-изомера става в същата посока, в която е написана горната част на буквата R, а в S-изомера - в същата посока, в която в горната част на буквата S е изписано:
Сега можем да напишем пълните имена на енантиомерите, които ясно показват тяхната абсолютна конфигурация:
Трябва да се подчертае, че обозначението на конфигурацията на стерцоизомера като R или S зависи от реда на предшестване на всичките четири заместителя на асиметричния атом. По този начин в молекулите, показани по-долу, пространственото разположение на F, CI и Br атомите спрямо група X е същото:

В дадените примери не може да се говори за конверсия абсолютна конфигурация, тъй като изходното съединение и реакционният продукт не са изомери (виж по-горе, стр. 20). В същото време трансформацията на един енантиомер в друг е обръщане на абсолютната конфигурация:

СЪССред органичните съединения има вещества, които могат да въртят равнината на поляризация на светлината. Това явление се нарича оптична активност, а съответните вещества са оптически активен. Оптично активните вещества се срещат по двойки оптични антиподи- изомери, чиито физични и химични свойства са еднакви при нормални условия, с изключение на едно нещо - знакът на въртене на равнината на поляризация: един от оптичните антиподи отклонява равнината на поляризация надясно (+, дясновъртящ изомер), другият наляво (-, лявовъртящ).
Оптичната изомерия се появява, когато молекулата съдържа асиметричен въглероден атом. Това е името, дадено на въглероден атом, свързан с четири различни заместителя. Възможни са две тетраедрични подредби на заместители около асиметричен атом. И двете пространствени форми не могат да бъдат комбинирани с никакво въртене; единият от тях е огледален образ на другия.
Разглежданият тип изомерия се нарича оптична изомерия
, огледална изомерия
или енантиомеризъм
. И двете огледални форми образуват чифт оптични антиподи или енантиомери
.
Броят на пространствените изомери се определя от формулата на Фишер N = 2 n, където n е броят на асиметричните центрове.
Проекционни формули
За да изобразите условно асиметричен атом в равнина, използвайте проекционни формули на Е. Фишер. Те се получават чрез проектиране върху равнина на атомите, към които е свързан асиметричният атом. В този случай самият асиметричен атом обикновено се пропуска, като се запазват само пресичащите се линии и заместващите символи. За да се запомни пространственото разположение на заместителите, прекъснатата вертикална линия често се запазва в проекционните формули (горните и долните заместители се отстраняват извън равнината на чертежа), но това често не се прави. По-долу са различни начини за записване на формулата за проекция, съответстваща на левия модел на предишната фигура:

Ето няколко примера за проекционни формули:

Имената на веществата показват техните знаци за въртене. Това означава например, че левият антипод на бутанол-2 има пространствена конфигурация, изразена точно с горната формула, и неговият огледален образ съответства на десния бутанол-2. Конфигурацията на оптичните антиподи се определя експериментално.
Нарича се смес, състояща се от равни количества от двата антипода рацемат. Той е оптически неактивен и има отлични стойности на физически константи.
По принцип всеки оптичен антипод може да бъде изобразен с дванадесет (!) различни проекционни формули – в зависимост от това как е разположен моделът при построяването на проекцията, от коя страна го гледаме. За стандартизиране на проекционните формули са въведени определени правила за писането им. Така основната функция, ако е в края на веригата, обикновено се поставя отгоре, основната верига е изобразена вертикално.
Правила за конвертиране на проекционни формули:
1. Формулите могат да се завъртат на 180° в чертожната равнина, без да се променя тяхното стереохимично значение:

2. Две (или всеки четен брой) пренареждания на заместители на един асиметричен атом не променят стереохимичния смисъл на формулата:

3. Една (или който и да е нечетен брой) пермутации на заместители в асиметричния център води до формулата за оптичния антипод:

4. Завъртане на 90° в чертожната равнина превръща формулата в антипод, освен ако в същото време не се промени условието за разположението на заместителите спрямо чертожната равнина, т.е. не смятайте, че сега страничните заместители са разположени зад чертожната равнина, а горните и долните са пред нея. Ако използвате формула с пунктирана линия, тогава променената ориентация на пунктираната линия директно ще ви напомни за това:

5. Вместо пермутации, проекционните формули могат да бъдат трансформирани чрез завъртане на всеки три заместителя по или обратно на часовниковата стрелка; четвъртият заместител не променя позицията си (тази операция е еквивалентна на две пермутации):

6. Проекционните формули не могат да бъдат изведени от чертожната равнина.
Други видове оптически активни вещества
Този раздел изброява някои други класове органични съединения, които също проявяват оптична активност (т.е. съществуват като двойки оптични антиподи).
Въглеродният атом няма монопол върху създаването на хирални центрове в молекулите на органичните съединения. Центърът на хиралност може също да бъде силициев, калаен и тетраковалентен азотни атоми в кватернерни амониеви соли и третични аминооксиди:

В тези съединения центърът на асиметрия има тетраедрична конфигурация, като асиметричния въглероден атом. Съществуват обаче и съединения с различна пространствена структура на хиралния център.
пирамидаленконфигурацията е хирални центрове, образувани от атоми на тривалентен азот, фосфор, арсен, антимон и сяра. По принцип центърът на асиметрия може да се счита за тетраедричен, ако несподелената електронна двойка на хетероатома се приеме като четвърти заместител:

Може да възникне и оптична активност без хирален център, поради хиралността на структурата на цялата молекула като цяло ( молекулярна хиралност или молекулярна асиметрия ). Най-характерните примери са наличието хирална ос или хирална равнина .
Хиралната ос се появява, например, в алени, съдържащи различни заместители при sp 2-хибридни въглеродни атоми. Лесно е да се види, че съединенията по-долу са несъвместими огледални образи и следователно оптични антиподи:

Друг клас съединения с хирална ос са оптично активни бифенили, които имат орто-позициите имат обемисти заместители, които възпрепятстват свободното въртене около C-C връзката, свързваща бензеновите пръстени:

Хирална равнинахарактеризира се с това, че може да се разграничи между „горна“ и „долна“, както и „дясна“ и „лява“ страна. Пример за съединения с хирална равнина е оптично активният транс-циклооктен и оптично активно производно на фероцен:

Диастереомерия
Съединенията с няколко асиметрични атома имат важни характеристики, които ги отличават от обсъжданите по-рано по-прости оптически активни вещества с един център на асиметрия.
Да приемем, че в една молекула на определено вещество има два асиметрични атома; нека ги обозначим условно като A и B. Лесно се вижда, че са възможни молекули със следните комбинации (N = 2 2 = 4):
Молекули 1 и 2 са двойка оптични антиподи; същото важи и за двойка молекули 3 и 4. Ако сравним молекули от различни двойки антиподи - 1 и 3, 1 и 4, 2 и 3, 2 и 4 - една с друга, тогава ще видим, че изброените двойки не са оптични антиподи: конфигурацията на единия асиметричен атом е еднаква, конфигурацията на другия не е същата. Това са двойки диастереомери , т.е. пространствени изомери, Не съставляващи оптически антиподи помежду си.
Диастереомерите се различават един от друг не само по оптично въртене, но и по всички други физични константи: те имат различни точки на топене и кипене, различна разтворимост и т.н. Разликите в свойствата на диастереомерите често са не по-малки от разликите в свойствата между структурните изомери .
Пример за съединение от този тип би била хлоромалова киселина (2 различни хирални центъра):

Неговите стереоизомерни форми имат следните проекционни формули:

| еритро-форми | трео-форми |
Заглавия еритро- И трио- идват от наименованията на въглехидратите еритроза и треоза. Тези имена се използват за обозначаване на относителната позиция на заместителите в съединения с два асиметрични атома: еритро -изомери са тези, при които два еднакви странични заместителя се появяват в стандартната проекционна формула от едната страна (дясно или ляво, два края на буквата Е); трио -изомерите имат еднакви странични заместители от различни страни на проекционната формула. две еритро-изомерите са двойка оптични антиподи; когато се смесят, се образува рацемат. Двойка оптични изомери са и трео-форми; те също произвеждат рацемат при смесване, който се различава по свойства от рацемата еритро-форми. По този начин има общо четири оптично активни изомера на хлоромалова киселина и два рацемата.
Броят на стереоизомерите може да намалее поради частична симетрия, появяваща се в някои структури. Пример за това е винената киселина, в която броят на отделните стереоизомери е намален до три. Техните проекционни формули:

| аз | Ia | II | III |
Формула I е идентична с формула Ia, тъй като се превръща в нея при завъртане на 180° в равнината на чертежа и следователно не представлява нов стереоизомер. Тази оптически неактивна модификация се нарича мезо форма . Всички оптично активни вещества имат мезоформи с няколко идентични (т.е. свързани с идентични заместители) асиметрични центрове. Проекционните формули на мезоформите винаги могат да бъдат разпознати по това, че могат да бъдат разделени с хоризонтална линия на две половини, които, когато са написани на хартия, формално са идентични, но в действителност са огледални (равнина на вътрешна симетрия):

Формули II и III изобразяват оптичните антиподи на винената киселина; при смесването им се образува оптически неактивен рацемат - гроздова киселина.
Номенклатура на оптичните изомери
Най-простата, най-старата, но все още използвана система от номенклатура на оптични антиподи се основава на сравнение на проекционната формула на наречения антипод с проекционната формула на определено стандартно вещество, избрано като „ключ“. По този начин, за α-хидрокси киселини и α-аминокиселини, ключът е горната част на тяхната проекционна формула (в стандартна нотация):

Конфигурацията на всички α-хидрокси киселини, които имат хидроксилна група отляво в стандартната писмена проекционна формула на Фишер, се обозначава със знака Л; ако хидроксилът е разположен в проекционната формула вдясно - знак д
Ключът за обозначаване на конфигурацията на съединенията е глицералдехидът:

В захарните молекули обозначението Д-или Л-се отнася за конфигурация нисъкасиметричен център.
Система Д-,Л-обозначението има значителни недостатъци: първо, обозначението Д-или Л-показва конфигурацията само на един асиметричен атом, второ, за някои съединения се получават различни символи, в зависимост от това дали ключът на глицералдехид или хидроксикиселина е взет като ключ, например:

Тези недостатъци на ключовата система ограничават нейната употреба в момента до три класа оптически активни вещества: захари, аминокиселини и хидрокси киселини. Проектиран за обща употреба R,S-система Кан, Инголд и Прелог.
За да се определи R- или S-конфигурацията на оптичния антипод, е необходимо да се подреди тетраедърът от заместители около асиметричния въглероден атом по такъв начин, че най-ниският заместител (обикновено водород) да има посока „далеч от наблюдателя“. Ако по време на прехода в кръг на останалите трима заместници от най-възрастния към средния по старшинство и след това към най-младия се случи обратно на часовниковата стрелка - Това С -изомер (свързан със същото движение на ръката при писане на буквата S), ако по часовниковата стрелка - Това Р- изомер (свързва се с движението на ръката при писане на буквата R).
За да се определи старшинството на заместителите на асиметричен атом, се използват правилата за изчисляване на атомните номера, които вече обсъдихме във връзка с Z,E номенклатурата на геометричните изомери.
За да изберете R, S-нотации според проекционната формула, е необходимо чрез четен брой пермутации (които, както знаем, не променят стереохимичния смисъл на формулата), да подредите заместителите така, че най-младият от тях (обикновено водород) е в долната част на проекционната формула. Тогава старшинството на останалите три заместителя, падащи по посока на часовниковата стрелка, съответства на обозначението R, обратно на часовниковата стрелка - обозначението S:

II.1. Конформации (ротационен изомеризъм)
Преходът от най-простия органичен въглеводород, метан, към неговия най-близък хомолог, етан, поставя проблеми на пространствената структура, за решаването на които не е достатъчно да се познават параметрите, разгледани в раздела. Всъщност, без да се променят нито ъглите на връзката, нито дължините на връзката, човек може да си представи много геометрични форми на молекулата на етана, различаващи се една от друга във взаимното въртене на въглеродните тетраедри около С-С връзката, която ги свързва. В резултат на тази ротация, ротационни изомери (конформери) . Енергията на различните конформери не е еднаква, но енергийната бариера, разделяща различните ротационни изомери, е малка за повечето органични съединения. Следователно, при нормални условия, като правило, е невъзможно да се фиксират молекули в една строго определена конформация: обикновено няколко ротационни форми, които лесно се трансформират една в друга, съществуват в равновесие.
Методите за графично изобразяване на конформациите и тяхната номенклатура са както следва. Да започнем с молекулата на етана. За него може да се предвиди съществуването на две конформации, които се различават максимално по енергия. Те са показани по-долу като перспективни проекции (1) („кози от дъскорезница“), странични проекции (2) и Формули на Нюман (3).
В перспективната проекция (1a, 1b) връзката C-C трябва да си представим отиваща в далечината; Въглеродният атом отляво е близо до наблюдателя, а въглеродният атом отдясно е по-далеч от него.
В страничната проекция (2а, 2b) четири Н-атома лежат в равнината на чертежа; Въглеродните атоми всъщност се простират донякъде извън тази равнина, но обикновено се смята, че те също лежат в равнината на чертежа. „Удебелените“ клиновидни връзки чрез удебеляването на клина показват излизане от равнината към наблюдателя на атома, към който е обърнато удебелението. Прекъснатите клиновидни връзки маркират разстоянието от наблюдателя.
В проекцията на Нюман (3a, 3b) молекулата се разглежда по дължината на C-C връзката (в посоката, посочена от стрелката във формули 1a, b). Три линии, отклоняващи се под ъгъл 120° от центъра на кръга, показват връзките на въглеродния атом, който е най-близо до наблюдателя; линиите, "стърчащи" зад кръга, са връзките на отдалечения въглероден атом.
Показаната вляво конформация се нарича затъмнен : Това име ни напомня, че водородните атоми на двете CH 3 групи са един срещу друг. Затъмнената конформация има повишена вътрешна енергия и следователно е неблагоприятна. Показаната вдясно конформация се нарича инхибиран , което означава, че свободното въртене около C-C връзката е „инхибирано“ в тази позиция, т.е. молекулата съществува предимно в тази конформация.
Минималната енергия, необходима за пълно завъртане на молекула около определена връзка, се нарича ротационна бариера за тази връзка. Ротационната бариера в молекула като етан може да бъде изразена по отношение на промяната в потенциалната енергия на молекулата като функция на промяната двустенен (усукващ) ъгъл системи. Двустенният ъгъл (означен като тау) е изобразен на фигурата по-долу:

Енергийният профил на въртене около C-C връзката в етан е показан на следващата фигура. Въртенето на "задния" въглероден атом е изобразено чрез промяната в двустенния ъгъл между двата показани водородни атома. За простота, останалите водородни атоми са пропуснати. Ротационната бариера, разделяща двете форми на етан, е само 3 kcal/mol (12,6 kJ/mol). Минимумите на кривата на потенциалната енергия съответстват на инхибирани конформации, а максимумите съответстват на оклудирани конформации. Тъй като при стайна температура енергията на някои молекулярни сблъсъци може да достигне 20 kcal/mol (около 80 kJ/mol), тази бариера от 12,6 kJ/mol се преодолява лесно и въртенето в етан се счита за свободно.

Подчертаваме, че всяка точка от кривата на потенциалната енергия съответства на специфична конформация. Точките, съответстващи на минимумите, съответстват на конформационни изомери, т.е преобладаващите компоненти в смес от всички възможни конформации .
Тъй като молекулата става по-сложна, броят на възможните конформации, които се различават значително по енергия, се увеличава. Да, за н-бутанът вече може да бъде изобразен в шест конформации, различаващи се в относителното разположение на СН 3 групите, т.е. въртене около централната връзка C-C. По-долу конформациите на n-бутан са изобразени като проекции на Нюман. Конформациите, показани вляво (защриховани), са енергийно неблагоприятни; практически се реализират само инхибираните.

Различните затъмнени и инхибирани конформации на бутана не са еднакви по отношение на енергията. Съответните енергии на всички конформации, образувани по време на въртене около централната C-C връзка, са представени по-долу:



Тъй като една молекула става по-сложна, броят на възможните конформации се увеличава.
И така, конформациите са различни неидентични пространствени форми на молекула, които имат определена конфигурация. Конформерите са стереоизомерни структури, които са в подвижно равновесие и са способни на взаимно преобразуване чрез въртене около прости връзки.
Понякога бариерата за такива трансформации става достатъчно висока, за да се разделят стереоизомерните форми (пример: оптично активни бифенили;). В такива случаи те вече не говорят за конформери, а за действително съществуващи стереоизомери .
II.2. Геометрична изомерия
Важно следствие от твърдостта на двойната връзка (отсъствието на ротация около нея) е съществуването геометрични изомери . Най-често срещаните от тях са цис-транс изомери съединения от етиленовата серия, съдържащи неравномерни заместители при ненаситени атоми. Най-простият пример са изомерите на бутен-2.

Геометричните изомери имат една и съща химична структура (един и същ ред на химични връзки), различаващи се в пространственото разположение на атомите, в конфигурации . Тази разлика създава разлика във физичните (както и химичните) свойства. Геометричните изомери, за разлика от конформерите, могат да бъдат изолирани в чиста форма и да съществуват като отделни, стабилни вещества. Взаимната им трансформация обикновено изисква енергия от порядъка на 125-170 kJ/mol (30-40 kcal/mol). Тази енергия може да бъде придадена чрез нагряване или облъчване.
В най-простите случаи номенклатурата на геометричните изомери не създава никакви затруднения: цис- формите са геометрични изомери, в които идентични заместители лежат от една и съща страна на равнината на връзката pi, транс- изомерите имат идентични заместители от различни страни на равнината на връзката pi. В по-сложни случаи се използва Z,E-номенклатура . Неговият основен принцип: да посочи конфигурацията, да посочи цис-(Z, от немски Zusammen - заедно) или транс-(E, от немски Entgegen - срещуположно) местоположение висши зам с двойна връзка.
В системата Z,E заместителите с по-висок атомен номер се считат за старши. Ако атомите, директно свързани с ненаситените въглероди, са еднакви, тогава те преминават към „втория слой“, ако е необходимо - към „третия слой“ и т.н.
Нека разгледаме прилагането на правилата на Z,E-номенклатурата, използвайки два примера.

| аз | II |
Да започнем с формула I, където всичко се решава от атомите на „първия слой“. След като подредим техните атомни номера, откриваме, че старшите заместители на всяка двойка (бром в горната част на формулата и азот в долната част) са в транс-позиция, оттук и стереохимичното обозначение E:
 Е-1-бромо-1-хлоро-2-нитроетен
Е-1-бромо-1-хлоро-2-нитроетен
За да се определи стереохимичното обозначение на структура II, е необходимо да се търсят разлики в „по-високите слоеве“. В първия слой групите CH 3, C 2 H 5, C 3 H 7 не се различават. Във втория слой групата CH3 има сбор от атомни числа от три (три водородни атома), докато групите C2H5 и C3H7 имат по 8. Това означава, че групата CH3 не се разглежда -. по-млада е от другите две. По този начин, старшите групи са C 2 H 5 и C 3 H 7, той е в цис-позиция; стереохимично обозначение Z.
 Z-3-метилхептен-3
Z-3-метилхептен-3
Ако беше необходимо да се определи коя група е по-стара - C 2 H 5 или C 3 H 7, трябва да се отиде до атомите на „третия слой“; сумата от атомни номера в този слой за двете групи би била равна съответно на 3 и 8, т.е. C3H7 е по-стар от C2H5. При по-сложни случаи на определяне на приоритета трябва да се вземат предвид допълнителни условия, като: атом, свързан с двойна връзка, се брои два пъти, свързан с тройна връзка - три пъти; От изотопите по-тежкият е по-стар (деутерият е по-стар от водорода) и някои други.
Обърнете внимание, че нотацията Z Не са синоними цис-обозначенията, като обозначенията E, не винаги съответстват на местоположението транс-, Например:

цис- 1,2-дихлоропропен-1 цис- 1,2-дихлоро-1-бромопропен-1
Z-1,2-дихлоропропен-1 E-1,2-дихлоро-1-бромопропен-1
Контролни задачи
1. Bombicol - феромон (сексуален атрактант) на копринената буба - е E-10-Z-12-hexadecadienol-1. Начертайте неговата структурна формула.
2. Наименувайте следните съединения, използвайки Z,E номенклатурата:

II.3. Оптичен изомеризъм (енантиомеризъм)
Сред органичните съединения има вещества, които могат да въртят равнината на поляризация на светлината. Това явление се нарича оптична активност, а съответните вещества са оптически активен . Оптично активните вещества се срещат по двойки оптични антиподи - изомери, чиито физични и химични свойства са идентични при нормални условия, с изключение на едно нещо - знакът на въртене на равнината на поляризация. (Ако един от оптичните антиподи има, например, специфично въртене [ЗАБЕЛЕЖКА 1] +20 o, тогава другият има специфично въртене от -20 o).
II.4. Проекционни формули
За да изобразите условно асиметричен атом в равнина, използвайте проекционни формули на Е. Фишер . Те се получават чрез проектиране върху равнина на атомите, към които е свързан асиметричният атом. В този случай самият асиметричен атом обикновено се пропуска, като се запазват само пресичащите се линии и заместващите символи. За да се запомни пространственото разположение на заместителите, прекъснатата вертикална линия често се запазва в проекционните формули (горните и долните заместители се отстраняват извън равнината на чертежа), но това често не се прави. По-долу са различни начини за записване на формулата за проекция, съответстваща на левия модел на предишната фигура:

Ето няколко примера за проекционни формули:

(+)-аланин (-)-бутанол (+)-глицералдехид
Имената на веществата показват техните знаци на въртене: това означава например, че левият антипод на бутанол-2 има пространствена конфигурация , изразен точно с горната формула, и неговият огледален образ съответства на дясновъртящия бутанол-2. Определение на конфигурацията оптични антиподи се извършва експериментално [ЗАБЕЛЕЖКА 3].
По принцип всеки оптичен антипод може да бъде изобразен с дванадесет (!) различни проекционни формули – в зависимост от това как е позициониран моделът при проекцията и от коя страна го гледаме. За стандартизиране на проекционните формули са въведени определени правила за писането им. Така основната функция, ако е в края на веригата, обикновено се поставя отгоре, основната верига е изобразена вертикално.
За да сравните „нестандартни“ писмени проекционни формули, трябва да знаете следните правила за трансформиране на проекционни формули.
1. Формулите могат да се завъртат на 180° в чертожната равнина, без да се променя тяхното стереохимично значение:

2. Две (или всеки четен брой) пренареждания на заместители на един асиметричен атом не променят стереохимичния смисъл на формулата:

3. Една (или който и да е нечетен брой) пермутации на заместители в асиметричния център води до формулата за оптичния антипод:

4. Завъртане на 90° в чертожната равнина превръща формулата в антиподна, освен ако в същото време не се промени условието за разположението на заместителите спрямо чертожната равнина, т.е. не смятайте, че сега страничните заместители са разположени зад чертожната равнина, а горните и долните са пред нея. Ако използвате формула с пунктирана линия, тогава променената ориентация на пунктираната линия директно ще ви напомни за това:

5. Вместо пермутации, проекционните формули могат да бъдат трансформирани чрез завъртане на всеки три заместителя по или обратно на часовниковата стрелка; четвъртият заместител не променя позицията си (тази операция е еквивалентна на две пермутации):

6. Проекционните формули не могат да бъдат извлечени от равнината на чертежа (т.е. не можете, например, да ги разгледате „на светлина“ от гърба на хартията - в този случай стереохимичното значение на формулата ще се промени).
II.5. Рацемати
Ако формулата на дадено вещество съдържа асиметричен атом, това не означава, че такова вещество ще има оптична активност. Ако по време на нормална реакция възникне асиметричен център (заместване в СН2 групата, добавяне при двойна връзка и т.н.), тогава вероятността за създаване на двете антиподни конфигурации е еднаква. Следователно, въпреки асиметрията на всяка отделна молекула, полученото вещество се оказва оптически неактивно. Този вид оптически неактивна модификация, състояща се от равно количество от двата антипода, се нарича рацемати [БЕЛЕЖКА 4] .
II.6. Диастереомерия
Съединенията с няколко асиметрични атома имат важни характеристики, които ги отличават от обсъжданите по-рано по-прости оптически активни вещества с един център на асиметрия.
Да приемем, че в една молекула на определено вещество има два асиметрични атома; Нека ги наречем условно А и Б. Лесно се вижда, че са възможни молекули със следните комбинации:
Молекули 1 и 2 са двойка оптични антиподи; същото важи и за двойка молекули 3 и 4. Ако сравним молекули от различни двойки антиподи - 1 и 3, 1 и 4, 2 и 3, 2 и 4 - една с друга, тогава ще видим, че изброените двойки не са оптични антиподи: конфигурацията на единия асиметричен атом е еднаква, конфигурацията на другия не е същата. Това са всички двойки диастереомери , т.е. пространствени изомери, Не съставляващи оптически антиподи помежду си.
Диастереомерите се различават един от друг не само по оптично въртене, но и по всички други физични константи: те имат различни точки на топене и кипене, различна разтворимост и т.н. Разликите в свойствата на диастереомерите често са не по-малки от разликите в свойствата между структурните изомери .
Пример за съединение от този тип е хлоромалова киселина

Неговите стереоизомерни форми имат следните проекционни формули:

еритро-форми трео-форми
Заглавия еритро- И трио- идват от наименованията на въглехидратите еритроза и треоза. Тези имена се използват за обозначаване на относителната позиция на заместителите в съединения с два асиметрични атома: еритро -изомерите са тези, за които два идентични странични заместителя се появяват в стандартната проекционна формула от едната страна (дясно или ляво); трио -изомериимат идентични странични заместители от различни страни на проекционната формула [ЗАБЕЛЕЖКА 5].
две еритро-изомерите са двойка оптични антиподи; когато се смесят, се образува рацемат. Двойка оптични изомери са и трео-форми; те също произвеждат рацемат при смесване, който се различава по свойства от рацемата еритро-форми. По този начин има общо четири оптично активни изомера на хлоромалова киселина и два рацемата.
С по-нататъшно увеличаване на броя на асиметричните центрове, броят на пространствените изомери се увеличава и всеки нов асиметричен център удвоява броя на изомерите. Определя се по формулата 2 n, където n е броят на асиметричните центрове.
Броят на стереоизомерите може да намалее поради частична симетрия, появяваща се в някои структури. Пример за това е винената киселина, в която броят на отделните стереоизомери е намален до три. Техните проекционни формули:

Формула I е идентична с формула Ia: тя се превръща в нея при завъртане на 180° в равнината на чертежа и следователно не представлява нов стереоизомер. Това е оптически неактивна модификация - мезо форма . За разлика от рацемат, който може да се раздели на оптичен антиподи, мезо-формата е фундаментално неразрушима: всяка от нейните молекули има един асиметричен център на една конфигурация, а втората - противоположна. В резултат на това възниква вътрешномолекулна компенсация на въртенето на двата асиметрични центъра.
мезо-Всички оптично активни вещества имат форми с няколко идентични (т.е. свързани с идентични заместители) асиметрични центрове [ЗАБЕЛЕЖКА 6]. Проекционни формули мезо-формулярите винаги могат да бъдат разпознати по това, че винаги могат да бъдат разделени с хоризонтална линия на две половини, които, когато са написани на хартия, формално са идентични, но в действителност са огледални:

Формули II и III изобразяват оптичните антиподи на винената киселина; при смесването им се образува оптически неактивен рацемат - гроздова киселина.
II.7. Номенклатура на оптичните изомери
Най-простата, най-старата, но все още използвана система от номенклатура на оптични антиподи се основава на сравнение на проекционната формула на наречения антипод с проекционната формула на определено стандартно вещество, избрано като „ключ“. По този начин, за алфа хидрокси киселини и алфа аминокиселини, ключът е горната част на тяхната проекционна формула (в стандартна нотация):

Л-хидрокси киселини (X = OH) Д-хидрокси киселини (X = OH)
L-аминокиселини (X = NH 2) Д-аминокиселини (X = NH 2)
Конфигурацията на всички алфа-хидрокси киселини, които имат хидроксилна група вляво в стандартната писмена проекционна формула на Фишер, се обозначава със знака Л; ако хидроксилът е разположен в проекционната формула вдясно - знак д[БЕЛЕЖКА 7] .
Ключът за определяне на конфигурацията на захарите е глицералдехидът:

L-(-)-глицералдехид Д-(+)-глицералдехид
В захарните молекули обозначението Д-или Л-се отнася за конфигурация нисъкасиметричен център.
Система Д-,Л-обозначението има значителни недостатъци: първо, обозначението Д-или Л-показва конфигурацията само на един асиметричен атом, второ, за някои съединения се получават различни символи, в зависимост от това дали ключът на глицералдехид или хидроксикиселина е взет като ключ, например:

Тези недостатъци на ключовата система ограничават нейната употреба в момента до три класа оптически активни вещества: захари, аминокиселини и хидрокси киселини. Проектиран за обща употреба „R,S-система Кан, Инголд и Прелог [БЕЛЕЖКА 8].
За да се определи R- или S-конфигурацията на оптичния антипод, е необходимо да се подреди тетраедърът от заместители около асиметричния въглероден атом по такъв начин, че най-ниският заместител (обикновено водород) да има посока „далеч от наблюдателя“. Тогава, ако движението по време на прехода в кръг на трите останали заместителя от най-възрастния към средния по старшинство и след това към най-младия обратно на часовниковата стрелка - Това Р -изомер (свързан със същото движение на ръката при писане на буквата R), ако по часовниковата стрелка - Това С- изомер (свързан със същото движение на ръката при писане на буквата S).
За да се определи старшинството на заместителите на асиметричен атом, се използват правилата за изчисляване на атомните номера, които вече разгледахме във връзка с Z,E номенклатурата на геометричните изомери (виж).
За да изберете R, S-нотации според проекционната формула, е необходимо чрез четен брой пермутации (които, както знаем, не променят стереохимичния смисъл на формулата), да подредите заместителите така, че най-младият от тях (обикновено водород) е в долната част на проекционната формула. Тогава старшинството на останалите три заместителя, падащи по посока на часовниковата стрелка, съответства на обозначението R, обратно на часовниковата стрелка - обозначението S [ЗАБЕЛЕЖКА 9]:

Контролни задачи
3. Определете конфигурацията на асиметричния център на аскорбиновата киселина (витамин С) (по R,S-номенклатура и в сравнение с глицералдехид):

4. Алкалоидът ефедрин има формулата:

Дайте име за тази връзка с помощта R,S- номенклатура.
5. Цистеин - неесенциална аминокиселина, участваща в регулирането на метаболитните процеси Л-1-амино-2-меркаптопропионова киселина. Начертайте неговата структурна формула и дайте името му R,S- номенклатура.
6. Левомицетин (широкоспектърен антибиотик) е д(-)-трео-1-р-нитрофенил-2-дихлороацетиламино-пропандиол-1,3. Начертайте структурата му под формата на проекционната формула на Фишер.
7. Synestrol е синтетично естрогенно лекарство с нестероидна структура. Дайте името му, като посочите неговата стереохимична конфигурация:

II.8. Стереохимия на цикличните съединения
Когато верига от въглеродни атоми е затворена в планарен цикъл, ъглите на връзката на въглеродните атоми са принудени да се отклоняват от нормалната си тетраедрична стойност и големината на това отклонение зависи от броя на атомите в цикъла. Колкото по-голям е ъгълът на отклонение на валентните връзки, толкова по-голям е енергийният резерв на молекулата, толкова по-малко стабилен е цикълът. Въпреки това, само тричленен цикличен въглеводород (циклопропан) има плоска структура; Започвайки от циклобутана, молекулите на циклоалкана имат неравнинна структура, което намалява „напрежението“ в системата.
Молекулата на циклохексан може да съществува в няколко конформации, в които "нормалните" ъгли на връзката се запазват (за простота са показани само въглеродни атоми):

Енергийно най-изгодната конформация е конформация I – т.нар "фотьойли". Конформация II - "усукване" - заема междинна позиция: тя е по-малко благоприятна от конформацията на стола (поради наличието на затъмнени водородни атоми в нея), но по-благоприятна от конформация III. Конформация III - "баня" - най-неблагоприятният от трите поради значителното отблъскване на насочените нагоре водородни атоми.
Разглеждането на дванадесетте C-H връзки в конформацията на стола ни позволява да ги разделим на две групи: шест аксиален връзки, насочени последователно нагоре и надолу, и шест екваториален връзки, насочени към страните. В монозаместените циклохексани заместителят може да бъде или в екваториална, или в аксиална позиция. Тези две конформации обикновено са в равновесие и бързо преминават една в друга чрез конформацията на усукване:

Екваториалната конформация (e) обикновено е по-бедна на енергия и следователно е по-изгодна от аксиалната конформация (a).
Когато заместители (странични вериги) се появяват в пръстени, в допълнение към проблема с конформацията на самия пръстен, изследователят също е изправен пред проблеми заместителни конфигурации : така, в случай на наличие на два еднакви или различни заместителя, цис-транс-изомер. Имайте предвид, че говорим за цис-транс- конфигурацията на заместителите има смисъл само когато се прилага към наситени малки и средни пръстени (до С 8): в пръстени с голям брой единици подвижността става толкова значителна, че дискусиите за цис-или транс- позициите на депутатите губят смисъл.
Така, класически пример са стереоизомерните циклопропан-1,2-дикарбоксилни киселини. Има две стереоизомерни киселини: едната от тях има т.т. 139 o C, е способен да образува цикличен анхидрид и следователно е цис-изомер. Друга стереоизомерна киселина с т.т. 175 o C, не образува цикличен анхидрид; Това транс-изомер [БЕЛЕЖКА 10]:

Две стереоизомерни 1,2,2-триметилциклопентан-1,3-дикарбоксилни киселини са в същата връзка една с друга. Една от тях, камфорна киселина, т.т. 187 o C, образува анхидрид и следователно е цис-изомер. Другата е изокамфорна киселина, т.т. 171 o C, - не образува анхидрид, това транс-изомер:
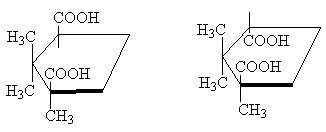
цис-транс-
Въпреки че молекулата на циклопентана всъщност не е равнинна, за по-голяма яснота е удобно да се изобрази в плоска форма, както е на фигурата по-горе, като се има предвид, че в цис-изомерът има два заместителя от едната страна на цикъла , и в транс-изомер - от противоположните страни на цикъла .
Дизаместените производни на циклохексан могат също да съществуват в цис или транс форма:
Въглеродният атом няма монопол върху създаването на хирални центрове в молекулите на органичните съединения. Центърът на хиралност може също да бъде силициев, калаен и тетраковалентен азотни атоми в кватернерни амониеви соли и третични аминооксиди:

В тези съединения центърът на асиметрия има тетраедрична конфигурация, като асиметричния въглероден атом. Съществуват обаче и съединения с различна пространствена структура на хиралния център.
Хиралните центрове, образувани от атоми на тривалентен азот, фосфор, арсен, антимон и сяра, имат пирамидална конфигурация. По принцип центърът на асиметрия може да се счита за тетраедричен, ако несподелената електронна двойка на хетероатома се приеме като четвърти заместител:

Може да възникне и оптична активност без хирален център, поради хиралността на структурата на цялата молекула като цяло ( молекулярна хиралност или молекулярна асиметрия ). Най-характерните примери са наличието хирална ос или хирална равнина .
Хиралната ос се появява, например, в алени, съдържащи различни заместители при sp 2-хибридни въглеродни атоми. Лесно е да се види, че съединенията по-долу са огледални изображения и следователно оптични антиподи:

Оста на хиралност е показана на фигурите със стрелка.
Друг клас съединения с хирална ос са оптично активни бифенили, които имат орто-позициите имат обемисти заместители, които пречат на свободното въртене около C-C връзката, свързваща ареновите пръстени:

Хирална равнина характеризира се с това, че може да се разграничи между „горна“ и „долна“, както и „дясна“ и „лява“ страна. Пример за съединения с хирална равнина е оптично активният транс-циклооктен и оптично активно производно на фероцен.
 Образът на Тарас Булба в историята "Тарас Булба"
Образът на Тарас Булба в историята "Тарас Булба" Образът и характеристиките на Остап от разказа „Тарас Булба“ на Гогол с цитати
Образът и характеристиките на Остап от разказа „Тарас Булба“ на Гогол с цитати Откъде е по-добре да започне начинаещ?
Откъде е по-добре да започне начинаещ?