Fluoridi u pasti za zube: biti ili ne biti (karijesu).
slajd 2
TEMA ČASA:
slajd 3
slajd 4
VELES - bog divljači i životinja PERUN - tvorac zemaljskih useva, davalac hrane, utemeljitelj i zaštitnik poljoprivrede.
slajd 5
Vodeni Goblin
slajd 6
Ograničen broj ljudi koji žive na planeti omogućio je zadovoljavanje njihovih potreba bez pribjegavanja značajnim promjenama u prirodi.
Slajd 7
Slajd 8
U 20. vijeku odnosi s prirodom su se značajno pogoršali.
Slajd 9
Zahvaljujući ogromnom broju lijekova, sve manje bolesti se svrstavaju u neizlječive. Istovremeno su se pojavile i nove bolesti povezane s posljedicama upotrebe lijekova, poput alergija.
Slajd 10
gmo
Genetski modificirani proizvodi donose ogromne ekonomske koristi, ALI uzrokuju štetu okolišu, utičući na formiranje sorti i, moguće, na zdravlje ljudi. 10
slajd 11
Mirni atom?
Korištenje nuklearnih elektrana donosi ekonomsku korist i štetu okolišu.
slajd 12
A sada momci, pokušajte formulirati problem kojim ćemo se baviti na lekciji.
FLUOR I NJEGOVA JEDINJENJA
slajd 13
Dakle, tema naše lekcije: „JEDINJENJA FLUORA. KORIST I ŠTETA".
Slajd 14
Predlažem da se raspravlja o problemu upotrebe spojeva fluora u obliku suda.
SUDIJA Službenik porote Možete se obratiti sudiji riječima: "Časni sude". Tokom procesa, sudija može dati riječ timu ili je oduzeti. Na sva pitanja može odgovoriti sekretar Suda. Porotnici su dužni da izaberu poslovođu, pomno prate tok procesa i na kraju sastanka donesu svoju presudu. advokati tužioci
slajd 15
Za upoznavanje sa predmetom, Sud daje materijale na numerisanim listovima i uputstva. Broj lista odgovara broju žetona koji ste izvukli kada ste ušli u razred. Vrijeme za upoznavanje sa slučajem i pripremu za prezentaciju je 10 minuta. Uputstva su priložena uz svaki slučaj.
slajd 16
Sudska pravila
Sud će razmatrati samo naučno dokazane činjenice. Svaki nastup je potreban. počnite riječima: Moj stav ... Obrazloženje ... Primjer ... Dakle ... U toku procesa sudija vam može dati riječ ili je oduzeti. Porotnici su dužni da pomno prate tok procesa i daju svoje mišljenje o ovom pitanju.
Slajd 17
instrukcije
Rastavite listove sa predloženim materijalom o svojstvima fluora u skladu sa brojem tokena. Odaberite vođu grupe. Razgovarajte o zadatku zajedno. Definirajte temu. Od predloženih činjenica odaberite najznačajnije, da ih iskoristite kao argumente za odbranu svog gledišta. Podijelite odgovornosti (napravite poster, napišite slogan). Obratite pažnju na činjenice koje neće biti uključene u govor, ali su od interesa. Odredite redosled govora Svaki govor treba da počne rečima: Moj stav .... Obrazloženje - (argument) ... Primjer - (činjenice koje ilustruju argument); Stoga (zaključak) Sudiji se možete obratiti riječima: “Časni sude.” Sudija može dati riječ ekipi ili je oduzeti.
Slajd 18
Na primjer:
Časni Sude, (Pozicija) Zalažem se za upotrebu jedinjenja fluora (Obrazloženje) jer je fluor vitalni element za tijelo. (Primjer) U slučaju nedovoljne (manje od 0,5 mg/l vode za piće) konzumacije fluora, u organizmu se mogu razviti različite bolesti zuba. (Stoga) vjerujem da su jedinjenja fluora korisna. ILI: (Stav) Časni Sude, ja sam za zabranu upotrebe fluora, (Obrazloženje) jer je fluor neurotropni otrov (Primjer) Prekomjerne količine fluora ometaju metaboličke procese u tijelu, inhibiraju disanje tkiva (dakle) Jedinjenja fluora bi trebala ne koristiti u industriji.
Slajd 19
Pozicije se brane u obliku "linije uživo"
Duž dijagonala klase se crtaju linije na kojima se na istoj udaljenosti stavljaju oznake. Svaki od učenika, govoreći sa svojim gledištem, ako ga odobri sudija, pomjera se za jednu ocjenu naprijed. Na podu u centru razreda prikazan je krug do kojeg mora doći predstavnik svake od grupa.
Slajd 20
"linija uživo"
slajd 21
Kreirajte poster
Uz materijale svakog slučaja priloženi su crteži koji odgovaraju činjenicama koje se razmatraju.Za izradu postera potrebno je od predloženih crteža izabrati onaj koji odgovara činjenici odabranoj za oglašavanje Izrežite crtež i zalijepite na A3 list Napišite slogan (ideju, glavnu ideju)
slajd 22
Rezimirajući.
Slijedi diskusija. Sekretar: Časni sude, dešava se da je broj argumenata za korištenje fluora jednak broju argumenata protiv upotrebe, a posteri koje su izradile grupe savršeno odražavaju gledište tima. Sudija: Predlažem da se sasluša mišljenje žirija. Govori predradnik žirija... Sudija: Vođe grupa, da li se slažete sa ovom odlukom žirija? Odgovor vođa grupa... Sudija: A sada da čujemo naše uvažene porotnike:...
slajd 23
Analiza grupnog rada:
Učitelj: Ljudi, danas smo imali neobičan čas. Šta je bilo neobično kod njega? Odgovori... Nastavnik: Da li imate neki stav u vezi sa upotrebom naučnih dostignuća, posebno upotrebe jedinjenja fluora? Odgovori... Učitelj: Onda hajde da procenimo naš rad koristeći "Pravila ocenjivanja" koja su na vašim tabelama. Sada pokaži šta imaš. Dobro urađeno! Hvala svima! Bilo je zadovoljstvo raditi s vama.
Pogledajte sve slajdove
Halogeni se nalaze lijevo od plemenitih plinova u periodnom sistemu. Ovih pet toksičnih nemetalnih elemenata nalazi se u grupi 7 periodnog sistema. To uključuje fluor, hlor, brom, jod i astatin. Iako je astat radioaktivan i ima samo kratkotrajne izotope, ponaša se kao jod i često se klasifikuje kao halogen. Budući da halogeni elementi imaju sedam valentnih elektrona, potreban im je samo jedan dodatni elektron da formiraju puni oktet. Ova karakteristika ih čini aktivnijim od drugih grupa nemetala.
opšte karakteristike
Halogeni formiraju dvoatomne molekule (oblika X 2, gdje X označava atom halogena) - stabilan oblik postojanja halogena u obliku slobodnih elemenata. Veze ovih dvoatomskih molekula su nepolarne, kovalentne i jednostruke. omogućavaju im da se lako kombinuju sa većinom elemenata, tako da se u prirodi nikada ne pojavljuju nepovezani. Fluor je najaktivniji halogen, dok je astat najmanje.
Svi halogeni formiraju soli grupe I sa sličnim svojstvima. U ovim jedinjenjima, halogeni su prisutni u obliku halogenih anjona sa nabojem od -1 (na primjer, Cl - , Br -). Završetak -id označava prisustvo halogenih anjona; na primjer Cl - naziva se "hlorid".
Osim toga, hemijska svojstva halogena omogućavaju im da djeluju kao oksidanti - da oksidiraju metale. Većina hemijskih reakcija koje uključuju halogene su redoks reakcije u vodenom rastvoru. Halogeni formiraju jednostruke veze sa ugljikom ili dušikom pri čemu je njihovo oksidacijsko stanje (CO) -1. Kada je atom halogena zamijenjen kovalentno vezanim atomom vodika u organskom spoju, prefiks halo- može se koristiti u opštem smislu, ili prefiksi fluor-, kloro-, brom-, jod-- za specifične halogene. Halogeni elementi mogu biti umreženi kako bi se formirale dvoatomne molekule s polarnim kovalentnim jednostrukim vezama.
Klor (Cl 2) je bio prvi halogen otkriven 1774. godine, zatim jod (I 2), brom (Br 2), fluor (F 2) i astat (At, posljednji otkriven 1940.). Naziv "halogen" dolazi od grčkih korijena hal- ("sol") i -gen ("formirati"). Zajedno, ove riječi znače "formiranje soli", naglašavajući činjenicu da halogeni reagiraju s metalima i formiraju soli. Halit je naziv kamene soli, prirodnog minerala koji se sastoji od natrijum hlorida (NaCl). I na kraju, halogeni se koriste u svakodnevnom životu - fluor se nalazi u pasti za zube, hlor dezinficira vodu za piće, a jod potiče proizvodnju hormona štitnjače.
Hemijski elementi
Fluor je element s atomskim brojem 9, označen simbolom F. Elementarni fluor je prvi put otkriven 1886. izolacijom iz fluorovodonične kiseline. U slobodnom stanju, fluor postoji kao dvoatomski molekul (F2) i najzastupljeniji je halogen u zemljinoj kori. Fluor je najelektronegativniji element u periodnom sistemu. Na sobnoj temperaturi, to je blijedožuti plin. Fluor takođe ima relativno mali atomski radijus. Njegov CO je -1, osim elementarnog dvoatomskog stanja, u kojem je njegovo oksidacijsko stanje nula. Fluor je izuzetno reaktivan i direktno stupa u interakciju sa svim elementima osim helijuma (He), neona (Ne) i argona (Ar). U rastvoru H 2 O, fluorovodonična kiselina (HF) je slaba kiselina. Iako je fluor jako elektronegativan, njegova elektronegativnost ne određuje kiselost; HF je slaba kiselina zbog činjenice da je jon fluora bazičan (pH > 7). Osim toga, fluor proizvodi vrlo moćne oksidatore. Na primjer, fluor može reagovati sa inertnim gasom ksenonom i formirati jako oksidaciono sredstvo, ksenon difluorid (XeF 2 ). Fluor ima mnogo namjena.

Klor je element sa atomskim brojem 17 i hemijskim simbolom Cl. Otkriven 1774. izolacijom iz hlorovodonične kiseline. U svom elementarnom stanju, formira dvoatomski Cl 2 molekul. Hlor ima nekoliko CO: -1, +1, 3, 5 i 7. Na sobnoj temperaturi je svijetlozeleni plin. Budući da je veza koja se stvara između dva atoma hlora slaba, molekula Cl 2 ima vrlo visoku sposobnost da uđe u spojeve. Hlor reaguje sa metalima i formira soli koje se nazivaju hloridi. Joni hlora su najčešći ioni koji se nalaze u morskoj vodi. Hlor takođe ima dva izotopa: 35 Cl i 37 Cl. Natrijum hlorid je najčešće jedinjenje od svih hlorida.
Brom je hemijski element sa atomskim brojem 35 i simbolom Br. Prvi put je otkriven 1826. U svom elementarnom obliku, brom je dvoatomski molekul Br 2 . Na sobnoj temperaturi, to je crvenkasto-smeđa tečnost. Njegov CO je -1, +1, 3, 4 i 5. Brom je aktivniji od joda, ali manje aktivan od hlora. Osim toga, brom ima dva izotopa: 79 Br i 81 Br. Brom se nalazi u bromidu otopljenom u morskoj vodi. Posljednjih godina proizvodnja bromida u svijetu značajno je porasla zbog njegove dostupnosti i dugog vijeka trajanja. Kao i drugi halogeni, brom je oksidant i vrlo je toksičan.

Jod je hemijski element sa atomskim brojem 53 i simbolom I. Jod ima oksidaciona stanja: -1, +1, +5 i +7. Postoji kao dvoatomski molekul, I 2 . Na sobnoj temperaturi je ljubičasta čvrsta supstanca. Jod ima jedan stabilan izotop, 127 I. Prvi put je otkriven 1811. koristeći morske alge i sumpornu kiselinu. Trenutno se jodni joni mogu izolovati u morskoj vodi. Iako jod nije jako rastvorljiv u vodi, njegova rastvorljivost se može povećati upotrebom odvojenih jodida. Jod igra važnu ulogu u tijelu jer učestvuje u proizvodnji hormona štitnjače.

Astatin je radioaktivni element sa atomskim brojem 85 i simbolom At. Njegova moguća oksidaciona stanja su -1, +1, 3, 5 i 7. Jedini halogen koji nije dvoatomski molekul. U normalnim uslovima, to je crna metalna čvrsta materija. Astatin je vrlo rijedak element, tako da se o njemu malo zna. Osim toga, astat ima vrlo kratko vrijeme poluraspada, ne duže od nekoliko sati. Primljen 1940. kao rezultat sinteze. Vjeruje se da je astat sličan jodu. Drugačije je
Donja tabela prikazuje strukturu atoma halogena, strukturu vanjskog sloja elektrona.
Slična struktura vanjskog sloja elektrona određuje da su fizička i kemijska svojstva halogena slična. Međutim, prilikom poređenja ovih elemenata uočavaju se i razlike.
Periodična svojstva u halogenoj grupi
Fizička svojstva jednostavnih halogenih tvari mijenjaju se s povećanjem atomskog broja elementa. Za bolju asimilaciju i veću preglednost nudimo vam nekoliko tabela.
Tačke topljenja i ključanja grupe rastu kako veličina molekula (F Tabela 1. Halogeni. Fizička svojstva: tačke topljenja i ključanja Halogen T topljenja (˚C) Tačka ključanja (˚C) Veličina kernela se povećava (F< Cl < Br < I < At), так как увеличивается число протонов и нейтронов. Кроме того, с каждым периодом добавляется всё больше уровней энергии. Это приводит к большей орбитали, и, следовательно, к увеличению радиуса атома. Tabela 2. Halogeni. Fizička svojstva: atomski radijusi Kovalentni radijus (pm) Jonski (X -) radijus (pm) Ako vanjski valentni elektroni nisu blizu jezgra, tada neće biti potrebno mnogo energije da se uklone iz njega. Dakle, energija potrebna za izbacivanje vanjskog elektrona nije tako visoka na dnu grupe elemenata, jer postoji više nivoa energije. Osim toga, visoka energija jonizacije uzrokuje da element pokazuje nemetalne kvalitete. Jod i astat pokazuju metalna svojstva jer je energija jonizacije smanjena (At< I < Br < Cl < F). Tabela 3. Halogeni. Fizička svojstva: energija jonizacije Broj valentnih elektrona u atomu raste sa povećanjem nivoa energije na progresivno nižim nivoima. Elektroni se progresivno udaljuju od jezgra; Dakle, jezgro i elektroni se ne privlače jedno drugom. Uočeno je povećanje zaštite. Stoga se elektronegativnost smanjuje s povećanjem perioda (At< I < Br < Cl < F). Tabela 4. Halogeni. Fizička svojstva: elektronegativnost Budući da se veličina atoma povećava s povećanjem perioda, afinitet elektrona ima tendenciju smanjenja (B< I < Br < F < Cl). Исключение - фтор, сродство которого меньше, чем у хлора. Это можно объяснить меньшим размером фтора по сравнению с хлором. Tabela 5. Elektronski afinitet halogena Reaktivnost halogena opada sa povećanjem perioda (At Halid nastaje kada halogen reaguje sa drugim, manje elektronegativnim elementom da bi se formiralo binarno jedinjenje. Vodik reaguje sa halogenima i formira HX halogenide: Halogenidi vodonika se lako rastvaraju u vodi i formiraju halogenovodonične (fluorovodonične, hlorovodonične, bromovodonične, jodovodične) kiseline. Svojstva ovih kiselina su data u nastavku. Kiseline nastaju sljedećom reakcijom: HX (aq) + H 2 O (l) → X - (aq) + H 3 O + (aq). Svi halogenidi vodonika formiraju jake kiseline, sa izuzetkom HF. Povećava se kiselost halogenovodoničnih kiselina: HF Fluorovodonična kiselina može dugo vremena da gravira staklo i neke neorganske fluoride. Može se činiti kontraintuitivnim da je HF najslabija halogenvodična kiselina, budući da fluor ima najveću elektronegativnost. Međutim, H-F veza je vrlo jaka, što rezultira vrlo slabom kiselinom. Jaka veza je određena kratkom dužinom veze i visokom energijom disocijacije. Od svih halogenovodonika, HF ima najkraću dužinu veze i najveću energiju disocijacije veze. Halogene okso kiseline su kiseline sa atomima vodika, kiseonika i halogena. Njihova kiselost se može odrediti analizom strukture. Halogene oksokiseline su navedene u nastavku: U svakoj od ovih kiselina, proton je vezan za atom kiseonika, tako da je poređenje dužina protonskih veza ovde beskorisno. Elektronegativnost ovdje igra dominantnu ulogu. Aktivnost kiseline raste sa povećanjem broja atoma kiseonika povezanih sa centralnim atomom. Glavna fizička svojstva halogena mogu se sažeti u sljedećoj tabeli. Stanje materije (na sobnoj temperaturi) Halogen Izgled ljubičasta crveno-braon gasoviti blijedo žuto braon blijedo zelena Boja halogena je rezultat apsorpcije vidljive svjetlosti od strane molekula, što uzrokuje pobudu elektrona. Fluor apsorbira ljubičasto svjetlo i stoga izgleda svijetlo žuto. Jod, s druge strane, apsorbira žutu svjetlost i izgleda ljubičasto (žuta i ljubičasta su komplementarne boje). Boja halogena postaje tamnija kako se period povećava. U zatvorenim posudama tečni brom i čvrsti jod su u ravnoteži sa svojim parama, što se može posmatrati kao obojeni gas. Iako je boja astatina nepoznata, pretpostavlja se da mora biti tamniji od joda (tj. crne boje) u skladu sa uočenim uzorkom. Sada, ako vas pitaju: "Okarakterizirajte fizička svojstva halogena", imat ćete nešto za reći. Oksidacijsko stanje se često koristi umjesto koncepta "halogene valencije". U pravilu, oksidacijsko stanje je -1. Ali ako je halogen vezan za kisik ili neki drugi halogen, može poprimiti druga stanja: CO kisika-2 ima prednost. U slučaju dva različita atoma halogena povezana zajedno, elektronegativniji atom prevladava i prihvata CO-1. Na primjer, u jod hloridu (ICl), hlor ima CO -1, a jod +1. Klor je elektronegativniji od joda, tako da je njegov CO -1. U bromovoj kiselini (HBrO 4), kiseonik ima CO -8 (-2 x 4 atoma = -8). Vodonik ima ukupno stanje oksidacije +1. Dodavanje ovih vrijednosti daje CO -7. Pošto konačni CO jedinjenja mora biti nula, CO broma je +7. Treći izuzetak od pravila je oksidacijsko stanje halogena u elementarnom obliku (X 2), gdje je njegov CO jednak nuli. Halogen CO u jedinjenjima 1, +1, +3, +5, +7 1, +1, +3, +4, +5 1, +1, +3, +5, +7 Elektronegativnost se povećava sa povećanjem perioda. Dakle, fluor ima najveću elektronegativnost od svih elemenata, o čemu svjedoči i njegova pozicija u periodnom sistemu. Njegova elektronska konfiguracija je 1s 2 2s 2 2p 5 . Ako fluor dobije još jedan elektron, najudaljenije p-orbitale su potpuno popunjene i čine cijeli oktet. Budući da fluor ima visoku elektronegativnost, lako može ukrasti elektron od susjednog atoma. Fluor je u ovom slučaju izoelektronski prema inertnom plinu (sa osam valentnih elektrona), sve njegove vanjske orbitale su popunjene. U ovom stanju, fluor je mnogo stabilniji. U prirodi su halogeni u stanju aniona, pa se slobodni halogeni dobijaju oksidacijom elektrolizom ili upotrebom oksidacionih sredstava. Na primjer, hlor se proizvodi hidrolizom otopine soli. Upotreba halogena i njihovih spojeva je raznolika. Prosečan sadržaj fluora u zemljinoj kori je 6,25 * 10 -2% po težini; u kiselim magmatskim stijenama (granitima) iznosi 8 * 10 -2%, u bazičnim - 3,7 * 10 -2%, u ultrabazičnim - 10 -2%. Fluor je prisutan u vulkanskim gasovima i termalnim vodama. Najvažnija jedinjenja fluora su fluorit, kriolit i topaz. Poznato je ukupno 86 minerala koji sadrže fluor. Jedinjenja fluora se također nalaze u apatitima, fosforitima i drugima. Fluor je važan biogeni element. U istoriji Zemlje, proizvodi vulkanskih erupcija (gasovi, itd.) bili su izvor fluora koji je ulazio u biosferu. Plinoviti fluor ima gustinu od 1,693 g / l (0 C i 0,1 Mn / m 2, ili 1 kgf / cm 2), tečni - 1,5127 g / cm 3 (na tački ključanja); t pl -219,61 °C; t kip -188,13 °S. Molekul fluora se sastoji od dva atoma (F 2); na 1000 °C, 50% molekula se disocira, energija disocijacije je oko 155±4 kJ/mol (37±1 kcal/mol). Fluor je slabo rastvorljiv u tečnom vodonik fluoridu; rastvorljivost 2,5 * 10 -3 g u 100 g HF na -70 °C i 0,4 * 10 -3 g na -20 °C; u tečnom obliku, beskonačno je rastvorljiv u tečnom kiseoniku i ozonu. Konfiguracija vanjskih elektrona atoma fluora je 2s 2 2r 5 . U jedinjenjima, pokazuje oksidacijsko stanje od -1. Kovalentni radijus atoma je 0,72A, jonski radijus je 1,33A. Elektronski afinitet 3,62 eV, energija jonizacije (F F+) 17,418 eV. Visoke vrijednosti afiniteta elektrona i energije ionizacije objašnjavaju snažnu elektronegativnost atoma fluora, najveću među svim ostalim elementima. Visoka reaktivnost fluora određuje egzotermnost fluoriranja, koja je, zauzvrat, određena anomalno niskom energijom disocijacije molekula fluora i velikim vrijednostima energije veze atoma fluora s drugim atomima. Direktna fluorizacija ima lančani mehanizam i lako se može pretvoriti u sagorijevanje i eksploziju. Fluor reaguje sa svim elementima osim helijuma, neona i argona. Interagira sa kiseonikom u usijanom pražnjenju, formirajući pri niskim temperaturama kiseonik fluoride O 2 R 3 , O 3 F 2 i dr. Reakcije fluora sa drugim halogenima su egzotermne, što rezultira stvaranjem interhalogenih jedinjenja. Hlor reaguje sa fluorom kada se zagreje na 200-250 C, dajući hlor monofluorid SlF i hlor trifluorid SlF 3 . Poznat je i ClF 3 dobijen fluoracijom ClF 3 na visokoj temperaturi i pritisku od 25 MN/m 2 (250 kgf/cm 2). Brom i jod se zapale u atmosferi fluora pri normalnoj temperaturi i mogu se dobiti BrF 3 , BrF 5 , IF 5 , IF 7 . Fluor se direktno ostvaruje sa kriptonom, ksenonom i radonom, formirajući odgovarajuće fluoride (na primjer, XeF 4 , XeF 6 , KrF 2 ). Poznati su i oksifluorid i ksenon. Interakcija fluora sa sumporom je praćena oslobađanjem toplote i dovodi do stvaranja brojnih sumpornih fluorida.Selen i telur formiraju više fluoride SeF 6 i TeF 6 . Reakcija fluora i vodika sa paljenjem; ovo proizvodi fluorovodonik. Fluor reaguje sa dušikom samo u električnom pražnjenju. Ugljen, kada je u interakciji sa fluorom, zapali se na običnoj temperaturi; grafit sa njim reaguje pri jakom zagrevanju, dok je moguće stvaranje čvrstog grafitnog fluorida ili gasovitih perfluorougljenika CF 4 i C 2 F 6. Sa bromom, silicijumom, fosforom, arsenom, fluor interaguje na hladnoći, formirajući odgovarajuće fluoride. Fluor se snažno kombinuje sa većinom metala; alkalni i zemnoalkalni metali se pale u atmosferi fluora na hladnom, Bi, Sn, Ti, Mo, W - uz blago zagrijavanje. Hg, Pb, U, V reaguju sa fluorom na sobnoj temperaturi, Pt - na tamnocrvenoj toploti. Kada metali stupaju u interakciju sa fluorom, u pravilu nastaju viši fluoridi, na primjer, UF 6 , MoF 6 , HgF 2 . Neki metali (Fe, Cu, Al, Ni, Mg, Zn) reaguju sa fluorom i formiraju zaštitni fluoridni film koji sprečava dalju reakciju. Kada fluor stupi u interakciju s metalnim oksidima na hladnoći, nastaju metalni fluoridi i kisik; takođe je moguće stvaranje metalnih oksifluorida (npr. MoO 2 F 2). Nemetalni oksidi ili dodaju fluor, na primjer SO 2 + F 2 = SO 2 F 2, ili se kisik u njima zamjenjuje fluorom, na primjer SiO 2 + 2F 2 \u003d SiF 4 + O 2. Staklo vrlo sporo reaguje sa fluorom; u prisustvu vode, reakcija se odvija brzo. Voda stupa u interakciju s fluorom: 2H 2 O + 2F 2 = 4HF + O 2; u ovom slučaju nastaju i OF 2 i vodonik peroksid H 2 O 2. Oksidi dušika NO i NO 2 lako dodaju fluor da bi formirali nitrozil fluorid FNO i nitril fluorid FNO 2 . Ugljenmonoksid dodaje fluor kada se zagreva da bi se formirao karbonil fluorid: CO + F 2 = COF 2. Metalni hidroksidi reaguju sa fluorom i formiraju metalni fluorid i kiseonik, na primer 2Va(ON) 2 + 2F 2 = 2VaF 2 + 2N 2 O + O 2 . Vodeni rastvori NaOH i KOH reaguju sa fluorom na 0°C i formiraju OF 2 . Halogenidi metala ili nemetala stupaju u interakciju s fluorom na hladnoći, a fluor će pomiješati sve halogene. Sulfidi, nitridi i karbidi se lako fluorišu. Metalni hidridi formiraju metalni fluorid i HF sa fluorom na hladnom; amonijak (u pari) - N 2 i HF. Fluor zamjenjuje vodonik u kiselinama ili metalima u njihovim solima, na primjer HNO 3 (ili NaNO 3) + F 2 FNO 3 + HF (ili NaF); u težim uslovima, fluor istiskuje kiseonik iz ovih jedinjenja, formirajući sulfuril fluorid. Karbonati alkalijskih i zemnoalkalnih metala reaguju sa fluorom na uobičajenim temperaturama; ovo daje odgovarajući fluor, CO 2 i O 2 . U reakcijama spajanja iz više tvari nastaje jedna. Dajte jednačine reakcije jedinjenja u kojima je zbir koeficijenata jednak: a) 5; b) 7; c) 9. Podsjetimo da koeficijenti moraju biti cijeli brojevi. Koliki je najmanji mogući zbir koeficijenata u jednadžbi složene reakcije? Navedite primjer. Može li ovaj zbir biti paran broj? Ako da, navedite primjer. a) 2Cu + O 2 = 2CuO ili 2H 2 + O 2 = 2H 2 O b) 4Li + O 2 = 2Li 2 O c) 4Al + 3O 2 = 2Al 2 O 3 ili 4Fe + 3O 2 = 2Fe 2 O 3 Minimalni mogući zbir koeficijenata je 3 (dva reagensa i jedan proizvod), na primjer C + O 2 = CO 2 ili S + O 2 \u003d SO 2 Naravno, zbir koeficijenata može biti paran, na primjer: Na 2 O + H 2 O \u003d 2NaOH ili H 2 + Cl 2 \u003d 2HCl N 2 + 3H 2 = 2NH 3 ili 3Fe + 2O 2 = Fe 3 O 4 Kriterijum ocjenjivanja: po 2 boda za svaku jednačinu (u svakom paragrafu se broji samo jedna jednačina). Svaka razumna jednačina koja zadovoljava uslov problema je prihvaćena. Ukupno 10 bodova Složena tvar, u čijoj molekuli ima jedan atom vodika po atomu kisika, je nestabilna tekućina koja se neograničeno miješa s vodom. U medicini se koristi razrijeđena (3%) otopina ove tvari. Napišite molekularnu i strukturnu formulu ove supstance. Šta se događa ako se u vodenu otopinu ove tvari doda prstohvat mangan(IV) oksida? Zapišite jednačinu reakcije. Riječ je o vodikovom peroksidu. Njegova molekularna formula je H 2 O 2 . (3 boda). Da biste ga sastavili, dovoljno je znati da kiseonik ima konstantnu valenciju jednaku 2. Strukturna formula 4 poena Kada se unese mangan oksid, vodikov peroksid se razgrađuje: 2H 2 O 2 \u003d 2H 2 O + O 2: 3 boda (1 bod, ako je napisana pogrešna jednačina širenja u jednostavne tvari). Mangan oksid djeluje kao katalizator. Ukupno 10 bodova Prirodni mineral fluorit ima zanimljiva svojstva. Ima širok spektar boja od ružičaste do ljubičaste. Boju mineralu daju nečistoće jedinjenja različitih metala. Nakon zagrijavanja ili zračenja ultraljubičastim svjetlom, mineral počinje svijetliti u mraku. Hemijski sastav minerala: sadržaj kalcija - 51,28%, sadržaj fluora - 48,72% po težini. 1) Ca: F = (51,28 / 40) : (48,72: 19) \u003d 1: 2. Najjednostavnija formula fluorita je CaF 2 . Definicija formule sa proračunima - 5 bodova Definicija formule bez izračunavanja, po valentnosti - 1 bod 2) Jedinjenja fluora su dio pasta za zube (2 boda), takve paste se koriste sa nedostatkom fluora (1 bod). Sa nedostatkom jedinjenja fluora u organizmu nastaje bolest zuba - karijes (2 boda). Ukupno 10 bodova Novo eksperimentalno raketno gorivo je mješavina fino usitnjenog leda i aluminijskog praha, čije su čestice 500 puta manje od debljine vlasi. Kada se zapali, dolazi do kemijske reakcije u kojoj nastaju oksid i jednostavna tvar. Napišite jednačinu za ovu reakciju. Kao rezultat reakcije nastaju aluminij oksid i vodik. Jednačina reakcije: 2Al + 3H 2 O \u003d Al 2 O 3 + 3H 2 4 poena Za 2 atoma aluminija mase 2 27 \u003d 54 a. e.m. postoje 3 molekula vode sa masom 3 18 = 54 am. e. m. Omjer mase 1:1. 4 poena Reakcija se odvija velikom brzinom, mlazni potisak se stvara oslobađanjem vodika. 1 bod AL + ICE = ALICE 1 bod Ukupno 10 bodova Kada je složena tvar spaljena u zraku, nastali su dušik, ugljični dioksid i voda. Napišite formulu ove tvari ako je poznato da sadrži atom ugljika, atom dušika i najveći mogući broj atoma vodika. Zapamtite da je valencija ugljika 4, dušika 3, a vodika 1. Napišite jednačinu za reakciju sagorijevanja. Formula supstance, sastavljena prema valenciji, je CH 5 N (5 bodova za bilo koju ispravnu formulu - molekularnu ili strukturnu). (ako rastvor sadrži HCN formulu - 2 boda od 5) Jednačina reakcije sagorevanja: 4CH 5 N + 9O 2 \u003d 4CO 2 + 2N 2 + 10H 2 O 5 bodova (ako je data ispravna jednačina sagorevanja HCN-a - 5 bodova) Ukupno 10 bodova Prazna boca je zatvorena čepom sa cijevi za odvod plina, čiji je kraj spušten u čašu s vodom (vidi sliku 1). Kada se boca čvrsto uhvatila rukom, iz otvora cijevi su počeli izlaziti mjehurići plina (vidi sliku 2). 1) Od toplote ruke zagrevaju se zidovi tikvice i gas unutar tikvice. Kada se zagrijavaju (ako se tlak praktički ne mijenja), plinovi se šire, njihov volumen se povećava. 2 poena Oslobađaju se mjehurići zraka, tj. plina kojim je tikvica (i cijev za izlaz plina) bila napunjena prije eksperimenta. 1 bod 2) Ovo je fizički proces, jer gasovi koji sačinjavaju vazduh ne prolaze nikakve hemijske transformacije. Povećava se samo zapremina vazduha. 1 bod 3) Učenik je možda sastavio instrument koji curi. Zrak bi mogao proći kroz labav spoj između tikvice i čepa ili čepa sa cijevi za izlaz plina. Drugo moguće objašnjenje je da je tikvica prethodno zagrijana. Toplina ruke nije bila dovoljna. 2 boda za svako razumno i opravdano objašnjenje 4) Da, moguće je. Da biste to učinili, tikvica se mora ohladiti, na primjer, ledom ili hladnom vodom. Također, tikvica se može prethodno zagrijati, a zatim spustiti kraj cijevi za izlaz plina u čašu vode.

Vodik + halogeni
Halogene okso kiseline
Izgled i stanje materije
Objašnjenje izgleda

Oksidacijsko stanje halogena u spojevima
Zašto je SD fluora uvijek -1?
Proizvodnja i upotreba halogena

Rasprostranjenost u prirodi
Fizička i hemijska svojstva
Rješenje:
Problem 2. Supstanca iz vodonika i kiseonika
Rješenje
Zadatak 3. Fluoridi u prirodi i svakodnevnom životu

Rješenje
Zadatak 4. Novo raketno gorivo

Rješenje
Zadatak 5. Reakcija sagorevanja
Rješenje

Problem 6. Eksperimenti sa gasovima


Rješenje
 Pretvaranje decimalnog razlomka u obični razlomak i obrnuto: pravilo, primjeri
Pretvaranje decimalnog razlomka u obični razlomak i obrnuto: pravilo, primjeri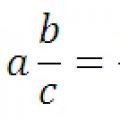 Pretvaranje decimalnih brojeva u obične razlomke
Pretvaranje decimalnih brojeva u obične razlomke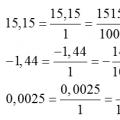 Pretvaranje običnog razlomka u decimalni razlomak i obrnuto, pravila, primjeri
Pretvaranje običnog razlomka u decimalni razlomak i obrnuto, pravila, primjeri