Predmet i metode fizičke hemije. Predmet fizička hemija
Ministarstvo obrazovanja Ruske Federacije Politehnički univerzitet Tomsk NA Kolpakova, VA Kolpakov, SV Romanenko FIZIČKA HEMIJA Udžbenik I dio Tomsk 2004 UDK 541.1 Fizička hemija. Udžbenik / N.A. Kolpakova, V.A. Kolpakov, S.V. Romanenko. - Tomsk: Ed. TPU, 2004. - 1. dio. - 168 str. Udžbenik pokriva sljedeće dijelove "Fizičke hemije": osnovne zakone termodinamike, hemijsku i faznu ravnotežu, termodinamiku neelektrolitnih rastvora. Priručnik je pripremljen na Katedri za fizičku i analitičku hemiju TPU i namenjen je studentima dopisnih smerova hemijskih specijalnosti. Objavljeno po nalogu Uređivačkog i izdavačkog saveta Tomskog politehničkog univerziteta Recenzenti: Kurina L.N. – Prof. Katedra za fizičku hemiju TSU, doktor hem. nauke; Buinovski A.S. - Glava. cafe hemija TPU STU, doktor hem. nauke. © Tomsk Politehnički univerzitet, 2004. © Autori, 2004. POGLAVLJE 1. UVOD U FIZIČKU HEMIJU 1.1. KRATAK ISTORIJSKI PREGLED RAZVOJA FIZIČKE HEMIJE Naziv i definiciju sadržaja fizičke hemije prvi je dao M. V. Lomonosov (1752): „Fizička hemija je nauka koja mora, na osnovu odredbi i eksperimenata naučnika fizike, da objasni razlog za ono što se dešava kroz hemijske operacije u složenim tijelima.” Nastavu fizičke hemije u Rusiji kao samostalnu nauku uveo je prof. N. N. Beketov 1860. na Univerzitetu u Harkovu. Najvažnije teorijske i eksperimentalne studije Lomonosova dovele su ga do otkrića koja ni danas nisu izgubila na značaju. Lomonosov se približio ispravnoj definiciji principa očuvanja materije i kretanja, kinetičke prirode toplote, a takođe je primetio nemogućnost spontanog prenosa toplote sa hladnijeg tela na toplije, što je trenutno jedna od formulacija. drugog zakona termodinamike. Tokom sljedećeg stoljeća vršena su istraživanja na osnovu kojih su napravljena mnoga važna otkrića i generalizacije. K. V. Scheele u Švedskoj (1773) i Fontana u Francuskoj (1777) otkrili su adsorpciju gasova; T. E. Lovits u Rusiji (1785) otkrio je adsorpciju iz otopina. A. L. Lavoisier i P. S. Laplace u Francuskoj (1779–1784) proučavali su toplotne kapacitete supstanci i toplotne efekte reakcija. Početkom XIX veka. G. Davy u Engleskoj i L. J. Tenard u Francuskoj otkrili su katalitičke reakcije, a J. J. Berzelius u Švedskoj (1835) dalje je razvio ideju katalize. Temelji elektrohemije postavljeni su istraživanjem galvanskih ćelija, elektrolize i prijenosa struje u elektrolitima. Galvani i A. Volta u Italiji su 1799. godine stvorili galvansku ćeliju. VV Petrov u Rusiji (1802) otkrio je fenomen električnog luka. T. Grotgus je u Rusiji 1805. godine postavio temelje za teoriju elektrolize. Godine 1800. G. Davy je unapredio elektrohemijsku teoriju interakcije supstanci: naširoko je koristio elektrolizu za hemijska istraživanja. M. Faraday, Davyjev učenik, 1833-1834 formulisao kvantitativne zakone elektrolize. B. S. Jacobi u Rusiji, rješavajući probleme praktične upotrebe procesa elektrolize, otkrio je galvanoplastiku 1836. U prvoj polovini XIX veka. zahvaljujući radovima D. Daltona u Engleskoj (1801–1803), J. L. Gay-Lussaca u Francuskoj (1802) i A. Avogadra u Italiji (1811), koji su otkrili najvažnije zakone plinovitog stanja, atomističke ideje su bile široko rasprostranjene. razvijen. Radovi G. I. Hessa (1802–1856) o termohemiji pripadaju istom periodu. C. Guldberg i P. Waage u Norveškoj (1864–1867), J. W. Gibbs u SAD (1873–1878) razvili su termodinamičku doktrinu hemijske ravnoteže, a A. L. Le Chatelier u Francuskoj (1884) otkrio je opći princip ravnoteže pomaka pod ravnotežom promjenjivi vanjski uslovi. U radovima holandskog hemičara J. H. van't Hoffa razvijena je termodinamička teorija hemijske ravnoteže. Takođe je razvio kvantitativnu teoriju razblaženih rastvora (1885–1889). Prijenos električne energije u otopinama proučavali su u Njemačkoj I. V. Gittorf i F. V. G. Kohlrausch. Švedski naučnik S. A. Arrhenius razvio je 1883–1887. teorija elektrolitičke disocijacije. A. M. Butlerov, koji je stvorio teoriju strukture organskih jedinjenja, ostavio je dubok trag u razvoju fizičke hemije. Veliki ruski hemičar D. I. Mendeljejev (1834–1907) otkrio je postojanje kritične temperature (1860), izveo opštu jednačinu stanja gasova (1874) i razvio hemijsku teoriju rastvora (1887). D. P. Konovalov (1889), Mendeljejev učenik, jedan je od osnivača teorije rješenja. Krajem XIX veka. došlo je do niza velikih otkrića u oblasti doktrine strukture materije, koja su dokazala složenost strukture atoma i odigrala ogromnu ulogu u razvoju fizičke hemije. To uključuje otkrića elektrona J. B. Perrina (1895) i J. Thomsona (1897), kvantnu prirodu svjetlosti R. Plancka (1900), postojanje svjetlosnog pritiska P. N. Lebedeva (1899), proučavanje (od 1898 od ) fenomeni radioaktivnosti P. Curie i M. Sklodowska-Curie. Do početka XX veka. fizička hemija je definisana kao nauka koja proučava strukturu materije, hemijsku termodinamiku, uključujući termohemiju i teoriju ravnoteže, rastvore, hemijsku kinetiku i elektrohemiju. Primijenjene su nove teorijske metode, a do izražaja su došla proučavanja strukture atoma, molekula i kristala. Doktrina o strukturi materije, posebno o strukturi atoma i molekula, najbrže se razvijala u 20. veku. Glavno dostignuće u ovoj oblasti bila je nuklearna teorija atoma, koju je predložio E. Rutherford (1911) i razvijena u prvoj kvantitativnoj teoriji atoma vodika, koju je razvio danski fizičar N. Bohr (1913). Proučavanje prirode hemijske veze i strukture molekula razvijalo se paralelno sa proučavanjem strukture atoma. Do ranih 1920-ih, W. Kossel i G. N. Lewis razvili su osnove elektronske teorije hemijskog vezivanja. VG Geitler i F. London (1927) razvili su kvantno-mehaničku teoriju hemijskog vezivanja. Na osnovu najvećih otkrića fizike u oblasti atomske strukture i korišćenjem teorijskih metoda kvantne mehanike i statističke fizike, kao i novih eksperimentalnih metoda, kao što su rendgenska analiza, spektroskopija, masena spektroskopija, magnetne metode, metoda označeni atomi i drugi, fizičari i fizički hemičari su napravili veliki napredak u proučavanju strukture molekula i kristala i u razumijevanju prirode kemijske veze. Teorija brzina kemijskih reakcija, odnosno kemijska kinetika, je uvelike razvijena, a sada se posebno povezuje sa proučavanjem strukture molekula i jačine veza između atoma u molekulu. Nastale su i uspešno se razvijaju nove grane fizičke hemije: magnetohemija, hemija zračenja, fizička hemija visokih polimera, fizička hemija silikata, gasna elektrohemija itd. Kao i druge nauke, fizička hemija i njene pojedinačne grane su nastale ili su se posebno uspešno počele razvijati. u periodima kada je jedna ili ona praktična potreba zahtijevala brzi razvoj neke grane industrije, a taj razvoj zahtijevao je čvrstu teorijsku osnovu. Ovdje je potrebno napomenuti glavne studije N. S. Kurnakova o fizičko-hemijskoj analizi, rad u oblasti elektrohemije A. N. Frumkina, stvaranje teorije lančanih reakcija N. N. Semenova i razvoj teorije heterogene katalize A. A. Balandin. Fizička hemija ima vodeću ulogu u rješavanju brojnih problema s kojima se suočava kemijska nauka i praksa. Trenutno je fizička hemija samostalna disciplina sa sopstvenim istraživačkim metodama i teorijska je osnova za primenjene discipline hemijskog inženjerstva. 1.2. PREDMET I CILJEVI FIZIČKE HEMIJE Fizička hemija je nauka o pravilnostima hemijskih procesa i fizičkih pojava. Osnovni zadatak fizičke hemije je proučavanje i objašnjenje glavnih zakonitosti koje određuju pravac hemijskih procesa, njihovu brzinu, uticaj sredine, nečistoća, zračenja i uslove za dobijanje maksimalnog prinosa korisnog proizvoda. Proučavanje fizičke hemije omogućava razumevanje zakona hemije, kao i predviđanje i kontrolu hemijskih pojava. Savremena fizička hemija omogućava rešavanje problema efikasne kontrole proizvodnje, intenziviranja i automatizacije proizvodnih procesa. Služi kao teorijski temelj hemijske tehnologije. Tako važni proizvodni procesi u hemijskoj tehnologiji kao što su sinteza i oksidacija amonijaka, kontaktna proizvodnja sumporne kiseline, proizvodnja etanola iz prirodnog gasa, krekiranje nafte i mnogi drugi zasnivaju se na rezultatima fizičko-hemijskih studija reakcija u osnovi ovih procesa. 5 procesa. Bez fizičke hemije nemoguće je riješiti problem stvaranja supstanci sa željenim svojstvima, razviti nove izvore struje i mnoga druga pitanja efikasne proizvodnje. Stoga poznavanje fizičke hemije budućim procesnim inženjerima otvara velike mogućnosti za rješavanje različitih problema sa kojima se susreću u praktičnoj djelatnosti inženjera u fabrikama i istraživačkim institutima. Naziv nauke - "fizička hemija" - odražava kako istoriju njenog nastanka na spoju dve nauke - fizike i hemije, tako i činjenicu da naširoko koristi teorijske zakone i eksperimentalne metode fizike u proučavanju hemijske pojave. 1.3. KLASIFIKACIJA METODA FIZIČKE HEMIJE U fizičkoj hemiji koristi se nekoliko teorijskih metoda. Kvantno hemijska metoda koristi svojstva elementarnih čestica da opiše hemijske transformacije. Koristeći zakone kvantne mehanike, opisana su svojstva i reaktivnost molekula, kao i priroda hemijske veze na osnovu svojstava elementarnih čestica koje čine molekule. Termodinamička (fenomenološka) metoda se zasniva na nekoliko zakona (postulata), koji su generalizacija eksperimentalnih podataka. Omogućava da se na osnovu njih saznaju energetska svojstva sistema, da se predvidi tok hemijskog procesa i njegov rezultat do trenutka ravnoteže. Kvantno-statistički metod objašnjava svojstva supstanci na osnovu svojstava molekula koji čine ove supstance. Kinetička metoda vam omogućava da uspostavite mehanizam i stvorite teoriju hemijskih procesa proučavanjem promene brzine hemijskih reakcija od različitih faktora. Fizičku hemiju karakterizira široka upotreba matematike, koja ne samo da omogućava najpreciznije izražavanje teorijskih zakona, već je i neophodan alat za njihovo utvrđivanje. 6 POGLAVLJE 2 . OSNOVNI ZAKONI TERMODINAMIJE Reč "termodinamika" dolazi od grčkog therme - toplota i dynamis - sila. Termodinamika je nauka o transformaciji različitih vrsta energije iz jedne u drugu. Hemijska termodinamika proučava transformaciju različitih vrsta energije koja se javlja tokom hemijskih reakcija. 2.1. OSNOVNI POJMOVI HEMIJSKE TERMODINAMIKE Sistem je zasebno tijelo ili grupa tijela koja su u interakciji i odvojena od okoline realnom ili imaginarnom ljuskom (granicom). Otvoreni sistem je sistem koji razmjenjuje tvari (masu) i energiju (na primjer, toplinu) sa vanjskim okruženjem. Izolovani sistem (ili zatvoreni sistem) je sistem koji ne razmenjuje toplotu i ne radi sa okolinom. Energija i zapremina izolovanog sistema su konstantni u vremenu. Primjer takvog sistema je, na primjer, termos. Ako granica ne propušta toplinu, tada se proces koji se odvija u sistemu naziva adijabatskim. Kada sistem razmenjuje toplotu i rad sa okolinom, dolazi do promena kako u sistemu tako iu okolini. Termodinamički sistemi mogu biti homogeni ili heterogeni. Ako unutar sistema nema interfejsa koji razdvajaju delove sistema različitog sastava ili strukture, onda se ovaj sistem naziva homogenim. Prema tome, sistem koji se sastoji od različitih dijelova koji se razlikuju po strukturi ili hemijskom sastavu naziva se heterogen. Ovi dijelovi se nazivaju fazama. Prema tome, faza je dio heterogenog sistema ograničenog interfejsom i karakteriziran istim fizičkim i hemijskim svojstvima u svim tačkama. Svaki sistem se sastoji od jedne ili više supstanci. Pojedinačne hemikalije koje se mogu izolovati iz sistema i egzistirati izvan njega same kao zasebna faza nazivaju se sastavnim supstancama sistema. Na primjer, u čaši se nalazi voda u koju je spuštena platinasta ploča. Iznad stakla je mešavina gasova: kiseonik, vodonik i azot. Ovaj sistem je trofazni, sadrži pet sastavnih supstanci. 7 Termodinamičko stanje sistema je skup vrijednosti nezavisnih varijabli (parametara sistema) koje određuju njegova svojstva. Bilo koje svojstvo sistema može se nazvati parametrom termodinamičkog stanja ako se smatra jednom od nezavisnih varijabli koje određuju stanje sistema. Termodinamika materiju posmatra kao kontinuirani medij i za istraživanje koristi takve termodinamičke parametre koji su rezultat djelovanja velikog broja čestica (makroparametara). Na primjer, makroparametri hemijske reakcije koja se odvija čak i pod "normalnim uslovima" su temperatura, pritisak, zapremina, koncentracija, jačina gravitacionog, magnetnog, električnog i elektromagnetnog polja, itd. "Normalni uslovi" su temperatura od 20-25 °C, atmosferski pritisak, tj. oko 101 kPa, ubrzanje gravitacije - u prosjeku oko 9,8 m/s2, jačina magnetnog polja - u prosjeku oko 40 A/m, jačina električnog polja - u prosjeku oko 130 V/m, osvijetljenost vidljivom svjetlošću - u prosjeku oko 500 luksa. Da bi se okarakterisalo termodinamičko stanje sistema, potrebno je poznavati ne sva svojstva, već samo najmanji broj njih, takozvane nezavisne parametre sistema. Po pravilu, kada se opisuje hemijski proces koji se odvija na Zemlji, ne navodimo karakteristike polja, jer su one konstantne i stoga ne utiču na sastav i prinos produkta reakcije. Ako se hemijski proces izvodi u uslovima jakih magnetnih ili električnih polja, ili pod intenzivnim zračenjem ultraljubičastim, rendgenskim ili čak vidljivim svetlom, tada će parametri polja imati značajan uticaj na sastav i prinos produkta reakcije. . U ovom slučaju, parametri polja moraju biti specificirani. Termodinamički parametri se dijele na ekstenzivne i intenzivne. Količine proporcionalne masi (ili količini supstance) razmatranog radnog fluida ili termodinamičkog sistema nazivaju se ekstenzivne, to su zapremina, unutrašnja energija, entalpija itd. Intenzivne veličine ne zavise od mase termodinamičkog sistema. To su, na primjer, temperatura i pritisak. Pritisak je fizička veličina jednaka omjeru sile ravnomjerno raspoređene po površini tijela i površine koja se nalazi okomito na silu: p \u003d S Jedinica tlaka u SI - paskalu (Pa) je pritisak uzrokovan sila od 1 N, ravnomjerno raspoređena na površini od 1 m2 koja se nalazi okomito na smjer sile: 1 N/m2 = 1 Pa. U praksi se koriste višestruke i podvišestruke jedinice pritiska: kilopaskal 8 (103 Pa = 1 kPa); megapaskal (106 Pa = 1 MPa); hektapaskal (102 Pa = 1 hPa), kao i vansistemska jedinica - bar (1 bar = 105 Pa). Prema zaključcima molekularno-kinetičke teorije, pritisak plina je rezultat udara nasumično kontinuiranih molekula o zid posude. Najjednostavniji odnosi između parametara i ponašanja molekula dobiveni su za idealni plin. Pod idealnim gasom se podrazumeva gas koji se sastoji od elastičnih molekula, između kojih ne postoje sile interakcije, koje imaju zanemarljivo malu unutrašnju zapreminu u odnosu na zapreminu koju zauzima gas. Svaki pravi gas na relativno niskom pritisku (blizu atmosferskom) ponaša se praktično kao idealan (strogo pri p → 0). Jednačina stanja idealnog gasa - Mendeljejeva - Klapejronova jednačina ima oblik: pV = nRT, gde je p pritisak gasa, Pa; V - zapremina, m3; n količina gasa, mol; R je univerzalna plinska konstanta jednaka 8,314 J/(mol K); T je apsolutna temperatura, K. Temperatura karakterizira termičko stanje sistema. Eksperimentalno se mogu uspostaviti koncepti toplijeg i hladnijeg tijela, ali temperatura se ne može direktno izmjeriti. Određuje se iz brojčanih vrijednosti drugih fizičkih parametara koji ovise o temperaturi, što je osnova za konstruiranje empirijskih temperaturnih skala. Kao takvi parametri (termometrijski parametri) mogu poslužiti različite fizičke veličine. Među njima su zapremina tela pri konstantnom pritisku, pritisak pri konstantnoj zapremini, električna provodljivost, termoelektromotorna sila, geometrijski parametri tela, jačina sjaja itd. Uređaj za merenje temperature naziva se termometar. Za izgradnju bilo koje empirijske temperaturne skale koriste se tri pretpostavke: 1) veličina stepena se postavlja izborom numeričke vrijednosti ∆T između dvije referentne temperaturne tačke – temperaturnih standarda; 2) položaj nule temperature u empirijskim skalama je proizvoljan; 3) pretpostavlja se da je termometrijska funkcija linearna u datom temperaturnom opsegu. Kao referentne tačke koriste se fazni prelazi čistih supstanci. Na primjer, za empirijsku Celzijusovu skalu, tačke topljenja i ključanja vode pri atmosferskom pritisku (0 i 100 stepeni, respektivno) uzimaju se kao referentne tačke. Interval između ovih temperatura podijeljen je na sto jednakih dijelova (stepeni Celzijusa - °C). Iako se objektivna temperaturna skala može konstruirati korištenjem bilo koje teoretski definirane termometričke funkcije, termodinamika koristi jednadžbu idealnog plina kao takvu funkciju. Plinski termometar omogućava izvođenje najpreciznijih (blizu apsolutnoj temperaturnoj skali - Kelvinove skale) mjerenja temperature. Međutim, određivanje temperature na skali plinskog termometra je prilično težak posao, koji se provodi samo radi utvrđivanja apsolutnih temperatura nekoliko referentnih tačaka faznih prijelaza uzetih kao referentnih. Međutemperature se obično određuju empirijskim termometrijskim metodama. Međunarodna praktična temperaturna skala (IPTS), usvojena 1954. godine, najtačnija je aproksimacija apsolutnoj temperaturnoj skali u sadašnjoj fazi. Za razliku od empirijskih skala, MPSH koristi jednu eksperimentalnu referentnu temperaturnu tačku. Kao takva je korišćena temperatura trostruke tačke vode (kada su led, voda i vodena para u isto vreme u ravnoteži). Temperatura trostruke tačke vode uzima se u IPTS kao 273,16 K (tačno). Pri atmosferskom pritisku led se topi 0,01° niže. Referentna tačka na Celzijusovoj skali - 0 °C - odgovara 273,15 K. Numerička vrijednost temperatura za sve ostale referentne tačke (osim za trostruku tačku vode) kontinuirano se poboljšava kako se povećava tačnost rada s plinskim termometrom. Godine 1968., dvanaest referentnih tačaka preporučeno je kao referentne temperaturne tačke, koje pokrivaju interval od trostruke tačke vodonika do tačke topljenja zlata. Trenutno se temperatura Celzijusa (t) izražava kao odnos sa apsolutnom temperaturom (T), koja je: T = 273,15 + t. Svojstva sistema koja se nedvosmisleno mogu izraziti kao funkcije temperature, pritiska i koncentracije supstanci koje čine sistem nazivaju se termodinamičkim funkcijama. Na primjer, toplinski kapacitet, unutrašnja energija, entropija itd. Ako promjena termodinamičke funkcije zavisi samo od početnog i krajnjeg stanja sistema i ne zavisi od putanje procesa, onda se takva funkcija naziva stanje funkcija sistema. Termodinamički proces je svaka promjena u sistemu povezana s promjenom barem jednog od termodinamičkih parametara. Kružni proces ili ciklus je proces u kojem se termodinamički sistem, nakon što je napustio neko početno stanje i podvrgnut nizu promjena, vraća u isto stanje; u ovom procesu, promjena bilo kojeg parametra stanja jednaka je nuli. 10
Sadržaj članka
HEMIJA FIZIČKA, grana hemije koja proučava hemijska svojstva supstanci na osnovu fizičkih svojstava njihovih sastavnih atoma i molekula. Moderna fizička hemija je široko interdisciplinarno polje koje se graniči sa različitim granama fizike, biofizike i molekularne biologije. Ima mnogo dodirnih tačaka sa granama hemijske nauke kao što su organska i neorganska hemija.
Posebnost hemijskog pristupa (za razliku od fizičkog i biološkog) je da se, uz opis makroskopskih pojava, objašnjava njihova priroda na osnovu svojstava pojedinih molekula i interakcija među njima.
Novi instrumentalni i metodološki razvoji u oblasti fizičke hemije koriste se u drugim granama hemije i srodnim naukama, kao što su farmakologija i medicina. Primjeri uključuju elektrohemijske metode, infracrvenu (IR) i ultraljubičastu (UV) spektroskopiju, tehnike lasera i magnetne rezonancije, koje se široko koriste u terapiji i dijagnostici raznih bolesti.
Tradicionalno se smatraju glavnim dijelovima fizičke hemije: 1) hemijska termodinamika; 2) kinetička teorija i statistička termodinamika; 3) pitanja strukture molekula i spektroskopije; 4) hemijska kinetika.
Hemijska termodinamika.
Hemijska termodinamika je direktno povezana sa primjenom termodinamike - nauke o toploti i njenim transformacijama - na problem hemijske ravnoteže. Suština problema je formulisana na sledeći način: ako postoji mešavina reagensa (sistem) i poznati su fizički uslovi u kojima se nalazi (temperatura, pritisak, zapremina), onda koji spontani hemijski i fizički procesi mogu dovesti do ovog sistema do ravnoteže? Prvi zakon termodinamike kaže da je toplota oblik energije i da ukupna energija sistema (zajedno sa njegovom okolinom) ostaje nepromenjena. Dakle, ovaj zakon je jedan od oblika zakona održanja energije. Prema drugom zakonu, spontano nastali proces dovodi do povećanja ukupne entropije sistema i njegovog okruženja. Entropija je mjera količine energije koju sistem ne može iskoristiti da obavi koristan rad. Drugi zakon ukazuje na smjer u kojem će se reakcija odvijati bez ikakvih vanjskih utjecaja. Da biste promijenili prirodu reakcije (na primjer, njen smjer), morate potrošiti energiju u jednom ili drugom obliku. Dakle, nameće stroga ograničenja na količinu rada koji se može obaviti kao rezultat konverzije toplotne ili hemijske energije oslobođene u reverzibilnom procesu.
Značajna dostignuća u hemijskoj termodinamici dugujemo J. Gibbsu, koji je postavio teorijske temelje ove nauke, što je omogućilo spajanje rezultata mnogih istraživača prethodne generacije u jednu celinu. Pristup koji je razvio Gibbs ne daje nikakve pretpostavke o mikroskopskoj strukturi materije, već razmatra svojstva ravnoteže sistema na makro nivou. Zbog toga se može misliti da su prvi i drugi zakon termodinamike univerzalni i da će ostati na snazi čak i kada naučimo mnogo više o svojstvima molekula i atoma.
Kinetička teorija i statistička termodinamika.
Statistička termodinamika (kao i kvantna mehanika) omogućava da se predvidi položaj ravnoteže za neke reakcije u gasnoj fazi. Uz pomoć kvantnomehaničkog pristupa moguće je opisati ponašanje složenih molekula niza supstanci koje se nalaze u tekućem i čvrstom stanju. Međutim, postoje reakcije čije se brzine ne mogu izračunati ni u okviru kinetičke teorije ni uz pomoć statističke termodinamike.
Prava revolucija u klasičnoj statističkoj termodinamici dogodila se 1970-ih. Novi koncepti kao što su univerzalnost (pojam da članovi određenih širokih klasa jedinjenja imaju ista svojstva) i princip sličnosti (procjena nepoznatih količina prema poznatim kriterijima) doveli su do boljeg razumijevanja ponašanja tekućina blizu kritične tačke, kada ne postoji razlika između tečnosti i gasa. Pomoću računara simulirana su svojstva jednostavnih (tečni argon) i složenih (voda i alkohol) tečnosti u kritičnom stanju. U novije vreme, svojstva tečnosti kao što je tečni helijum (čije ponašanje je savršeno opisano u terminima kvantne mehanike) i slobodni elektroni u molekularnim tečnostima su sveobuhvatno istražena korišćenjem kompjuterskih simulacija (SUPERPROVODNOST). Ovo je omogućilo bolje razumevanje svojstava običnih tečnosti. Kompjuterske metode u kombinaciji sa najnovijim teorijskim dostignućima intenzivno se koriste za proučavanje ponašanja rastvora, polimera, micela (specifičnih koloidnih čestica), proteina i jonskih rastvora. Za rješavanje problema fizičke hemije, posebno za opisivanje nekih svojstava sistema u kritičnom stanju i za proučavanje pitanja fizike visokih energija, sve se više koristi matematička metoda renormalizacijske grupe.
Struktura molekula i spektroskopija.
Organski hemičari 19. veka. razvila jednostavna pravila za određivanje valencije (sposobnosti kombinovanja) mnogih hemijskih elemenata. Na primjer, otkrili su da je valencija ugljika 4 (jedan atom ugljika može spojiti četiri atoma vodika da formira molekulu metana CH 4), kisika - 2, vodika - 1. Na osnovu empirijskih ideja zasnovanih na eksperimentalnim podacima, napravljene su pretpostavke o prostornom rasporedu atoma u molekulima (na primjer, molekul metana ima tetraedarsku strukturu, dok se atom ugljika nalazi u centru trokutaste piramide, a vodonik u njena četiri vrha). Međutim, ovaj pristup nije omogućio otkrivanje mehanizma formiranja kemijskih veza, pa stoga i procjenu veličine molekula, određivanje tačne udaljenosti između atoma.
Koristeći spektroskopske metode razvijene u 20. veku, određena je struktura molekula vode (H 2 O), etana (C 2 H 6), a potom i mnogo složenijih molekula, poput proteina. Metode mikrotalasne spektroskopije (EPR, NMR) i difrakcije elektrona omogućile su da se utvrde dužine veza, uglovi između njih (valentni uglovi) i međusobni raspored atoma u jednostavnim molekulima, kao i analiza difrakcije rendgenskih zraka - slični parametri za veće molekule koje formiraju molekularne kristale. Sastavljanje kataloga molekularnih struktura i korištenje jednostavnih koncepata valencije postavili su temelje strukturne hemije (L. Pauling je bio njen pionir) i omogućili korištenje molekularnih modela za objašnjenje složenih fenomena na molekularnom nivou. Ako molekuli nisu imali određenu strukturu, ili ako su parametri C–C i C–H veza u hromozomima bili veoma različiti od onih u molekulima metana ili etana, onda bi uz pomoć jednostavnih geometrijskih modela J. Watson i F. Crick početkom 1950-ih nisu mogli napraviti njegov poznati model dvostruke spirale deoksiribonukleinske kiseline (DNK). Proučavajući vibracije atoma u molekulima pomoću IR i UV spektroskopije, bilo je moguće utvrditi prirodu sila koje drže atome u sastavu molekula, što je, zauzvrat, dovelo do ideje o prisutnosti unutarmolekulskog kretanja. i omogućio je proučavanje termodinamičkih svojstava molekula ( vidi gore). Ovo je bio prvi korak ka određivanju brzina hemijskih reakcija. Nadalje, spektroskopske studije u UV području pomogle su da se uspostavi mehanizam stvaranja hemijskih veza na elektronskom nivou, što je omogućilo opisivanje hemijskih reakcija na osnovu ideje o prelasku reaktanata u pobuđeno stanje (često pod dejstvom). vidljivog ili UV svjetla). Postojala je čak i čitava naučna oblast - fotohemija. Spektroskopija nuklearne magnetne rezonance (NMR) je omogućila hemičarima da proučavaju pojedinačne faze složenih hemijskih procesa i da identifikuju aktivne centre u molekulima enzima. Ova metoda je također omogućila dobivanje trodimenzionalnih slika netaknutih stanica i pojedinačnih organa. FOTOHEMIJA.
Teorija valencije.
Koristeći empirijska pravila valencije koje su razvili organski hemičari, periodični sistem elemenata i Rutherfordov planetarni model atoma, G. Lewis je otkrio da je ključ za razumijevanje hemijske veze elektronska struktura materije. Lewis je došao do zaključka da kovalentna veza nastaje kao rezultat socijalizacije elektrona koji pripadaju različitim atomima; pritom je pošao od ideje da se vezujući elektroni nalaze na striktno definisanim elektronskim ljuskama. Kvantna teorija omogućava predviđanje strukture molekula i prirode kovalentnih veza koje nastaju u najopštijem slučaju.
Naše ideje o strukturi materije, koje su nastale zahvaljujući uspesima kvantne fizike u prvoj četvrtini 20. veka, mogu se sažeti na sledeći način. Struktura atoma određena je ravnotežom električnih sila odbijanja (između elektrona) i privlačenja (između elektrona i pozitivno nabijenog jezgra). Gotovo sva masa atoma koncentrirana je u jezgri, a njegova veličina je određena količinom prostora koji zauzimaju elektroni koji kruže oko jezgara. Molekule se sastoje od relativno stabilnih jezgara koje zajedno drže elektroni koji se brzo kreću, tako da se sva hemijska svojstva supstanci mogu objasniti u smislu električne interakcije elementarnih čestica koje čine atome i molekule. Dakle, glavne odredbe kvantne mehanike, koje se tiču strukture molekula i formiranja hemijskih veza, stvaraju osnovu za empirijski opis elektronske strukture supstance, prirode hemijske veze i reaktivnosti atoma i molekula. .
Pojavom kompjutera velike brzine, bilo je moguće izračunati (sa malom, ali dovoljnom preciznošću) sile koje djeluju između atoma u malim poliatomskim molekulima. Teorija valencije, zasnovana na kompjuterskoj simulaciji, trenutno je radno sredstvo za proučavanje struktura, prirode hemijskih sila i reakcija u slučajevima kada su eksperimenti teški ili dugotrajni. Ovo se odnosi na proučavanje slobodnih radikala prisutnih u atmosferi i plamenu ili formiranih kao međuprodukti reakcije. Postoji nada da će jednog dana teorija zasnovana na kompjuterskim proračunima moći da odgovori na pitanje: kako hemijske strukture "izračunavaju" svoje najstabilnije stanje u vremenu reda pikosekundi, dok dobijaju odgovarajuće procene, barem u nekoj aproksimaciji , zahtijeva ogromnu količinu mašinskog vremena.
Hemijska kinetika
bavi se proučavanjem mehanizma hemijskih reakcija i određivanjem njihovih brzina. Na makroskopskom nivou, reakcija se može predstaviti kao uzastopne transformacije, tokom kojih se druge formiraju iz jedne supstance. Na primjer, naizgled jednostavna transformacija
H 2 + (1/2) O 2 → H 2 O
zapravo se sastoji od nekoliko uzastopnih faza:
H + O 2 → OH + O
O + H 2 → HO + H
H + O 2 → HO 2
HO 2 + H 2 → H 2 O + OH
a svaki od njih karakterizira vlastita konstanta brzine k. S. Arrhenius je predložio da apsolutna temperatura T i konstanta brzine reakcije k povezane omjerom k = A exp(- E akt)/ RT, Gdje A– predeksponencijalni faktor (tzv. faktor frekvencije), E akt - energija aktivacije, R je gasna konstanta. Za merenje k I T instrumenti su potrebni za praćenje događaja koji se dešavaju u periodu od oko 10-13 s, s jedne strane, i tokom decenija (pa čak i milenijuma), s druge (geološki procesi); također je potrebno moći mjeriti zanemarljive koncentracije ekstremno nestabilnih reagensa. U zadatak hemijske kinetike spada i predviđanje hemijskih procesa koji se odvijaju u složenim sistemima (reč je o biološkim, geološkim, atmosferskim procesima, sagorevanju i hemijskoj sintezi).
Za proučavanje reakcija u gasnoj fazi "u čistom obliku" koristi se metoda molekularnih zraka; u ovom slučaju, molekule sa strogo definiranim kvantnim stanjima reagiraju formiranjem proizvoda koji su također u određenim kvantnim stanjima. Takvi eksperimenti daju informacije o silama koje uzrokuju određene reakcije. Na primjer, u postavljanju molekularnog snopa, čak i tako male molekule kao što je CH 3 I mogu se orijentirati na određeni način i mogu se mjeriti stope sudara u dvije „različite“ reakcije:
K + ICH 3 → KI + CH 3
K + CH 3 I → KI + CH 3
gdje je CH 3 grupa drugačije orijentirana u odnosu na atom kalija koji se približava.
Jedno od pitanja kojima se fizička hemija (kao i hemijska fizika) bavi je izračunavanje konstanti brzine reakcije. Ovdje se široko koristi teorija prijelaznog stanja razvijena 1930-ih, koja koristi termodinamičke i strukturne parametre. Ova teorija, u kombinaciji sa metodama klasične fizike i kvantne mehanike, omogućava simulaciju toka reakcije kao da se odvija u uslovima eksperimenta sa molekularnim snopovima. Izvode se eksperimenti na laserskom pobuđivanju određenih hemijskih veza, koji omogućavaju proveru ispravnosti statističkih teorija razaranja molekula. Razvijaju se teorije koje generalizuju moderne fizičke i matematičke koncepte haotičnih procesa (na primjer, turbulencija). Nismo tako daleko od potpunog razumijevanja prirode i intra- i intermolekularnih interakcija, otkrivanja mehanizma reakcija koje se odvijaju na površinama sa željenim svojstvima i uspostavljanja strukture katalitičkih centara enzima i kompleksa prijelaznih metala. Na mikroskopskom nivou mogu se uočiti radovi na kinetici formiranja tako složenih struktura kao što su pahuljice ili dendriti (kristali sa strukturom drveta), koji su podstakli razvoj kompjuterskih simulacija zasnovanih na jednostavnim modelima teorije nelinearne dinamike; ovo otvara izglede za stvaranje novih pristupa opisivanju strukture i razvoja složenih sistema.
FIZIČKI, nauka o općim zakonima koji određuju strukturu i hem. transformacije u-u na dec. lok. uslovima. Istraživanje hem. fenomena uz pomoć teorijskih i eksperiment. metode fizike.
Kao nezavisna, fizička nauka se oblikovala u. 18. vijek Termin "fizički" pripada M.V. Lomonosov, koji je 1752. godine studentima Sankt Peterburgskog univerziteta prvi put dao kurs fizike. On je vlasnik traga. definicija: "Fizika je nauka koja objašnjava, na osnovu odredbi i eksperimenata fizike, šta se dešava u mešovitim telima tokom hemijskih operacija." Prvi naučni časopis namijenjen objavljivanju članaka o fizici osnovali su 1887. W. Ostwald i J. van't Hoff.
F fizička je glavna teorijska. temelj modernog , zasnovan na tako važnim granama fizike kao što je statistika. fiziku i, nelinearnu dinamiku, teoriju polja, itd. Uključuje doktrinu o strukturi ostrva, uklj. oh i . Kao zasebne odjeljke u fizičkom, oni također često izdvajaju fizičku (uključujući), doktrinu fizičke hemije, visokomol. conn. i drugi.. Oni su usko povezani sa fizičkim i ponekad se smatraju nezavisnim od njega. sekcije , i . Većina dijelova fizičkog ima prilično jasne granice za objekte i metode istraživanja, za metodološke. karakteristike i oprema koja se koristi.
Moderna fazu razvoja fizičkog karakteriše dubinska analiza opštih zakona hem. prenamjene u pristanište. nivo, široka upotreba mat. , proširenje opsega ekst. efekti na hem. sistem (visoke i kriogene temperature, visoka, jaka radijacija i magnetni efekti), proučavanje ultrabrzih procesa, metode skladištenja energije u hemij. in-wah, itd.
Primjena kvantne teorije prvenstveno je u objašnjenju hem. fenomeni podrazumevaju sredstva. povećala pažnju na nivo interpretacije i dovela do odabira dva pravca u . Pravac zasnovan na kvantnoj mehanici. teorija i rad na mikroskopskom. nivo objašnjenja fenomena, koji se često naziva hem. fizike, i pravac koji operiše sa ansamblima velikog broja čestica, pri čemu statistički. zakoni, - fizički. Sa takvom podjelom, granica između fizičke hemije i hem. fizika ne može. izvedeno oštro, što je posebno vidljivo u teoriji hemijskih brzina. okruzi.
Doktrina o strukturi ostrva i rezimira opsežan eksperiment. materijal dobiven korištenjem takvih fizičkih. metode, kao što su molekularne, proučavanje interakcije. elektromagnetna zračenje sa in-cijom u dekomp. opsezi talasnih dužina, foto-i i metode difrakcije rendgenskih zraka, metode zasnovane na magneto-optičkim metodama. efekti, itd. Ove metode omogućavaju dobijanje strukturnih podataka o elektronu, o ravnotežnim pozicijama i amplitudama oscilacija jezgara u kondenzatoru. in-ve, o energetskom sistemu. nivoa i prelaza između njih, o promeni geom. konfiguracije prilikom promjene okruženja ili njegovih pojedinačnih fragmenata itd.
Uz zadatak povezivanja svojstava in-in sa njihovom strukturom, moderne. Fizička nauka je takođe aktivno uključena u inverzni problem predviđanja strukture jedinjenja sa datim svojstvima.
Vrlo važan izvor informacija o njihovim karakteristikama u dekomp. stanja i karakteristike kem. transformacije su rezultati kvantne hemije. kalkulacije. daje sistem pojmova i ideja, koji se koristi u fizičkom kada se razmatra ponašanje hem. spojeva po molu. nivou i prilikom uspostavljanja korelacija između karakteristika koje čine in-in, i St. vas ovog in-va. Zahvaljujući rezultatima kvantne hemije. proračuni pov-stey potencijalne energije kemijske. sistema u različitim i eksperiment. mogućnosti posljednjih godina, posebno razvoj, fizički približio se opsežnoj studiji St. Comm. u pobuđenim i visoko pobuđenim stanjima, na analizu strukturnih karakteristika Comm. u takvim stanjima i specifičnostima ispoljavanja ovih osobina u dinamici hem. transformacije.
Ograničenje uobičajenog je to što omogućava da se opiše samo ravnotežna stanja i reverzibilni procesi. Pravi ireverzibilni procesi su predmet problema koji se pojavio 1930-ih. 20ti vijek . Ova oblast fizike proučava neravnotežno makroskopsko. sistemi u kojima se stopa pojavljivanja lokalno održava konstantnom (takvi sistemi su lokalno blizu ravnoteže). Omogućava nam da razmotrimo sisteme sa hemijom. p-cije i prijenos mase (), toplinski, električni. naknade itd.
proučava hemijske transformacije. u vremenu, odnosno brzini hemikalije. p-cije, mehanizme ovih transformacija, kao i zavisnost hemikalije. procesa od uslova njegove implementacije. Ona postavlja obrasce promjenenija sastava transformacionog sistema u vremenu, otkriva odnos između brzine hem. p-cije i spoljašnjih uslova, a takođe proučava faktore koji utiču na brzinu i smer hemikalije. okruzi.
Većina chem. p-cije je složen višestepeni proces, koji se sastoji od pojedinačnih elementarnih hem. transformacija, transport i prijenos energije. Teorijski chem. kinetika uključuje proučavanje mehanizama elementarnih p-cija i izračunava takve procese na osnovu ideja i aparata klasičnog. mehanike i kvantne teorije, bavi se izgradnjom modela složenih hemijskih. procesa, uspostavlja odnos između strukture hemikalije. spojeva i njihovih reakcija. sposobnost. Identifikacija kinetike obrasci za složene p-cije (formalna kinetika) se često zasnivaju na mat. i omogućava vam da testirate hipoteze o mehanizmima složenih p-cija, kao i da uspostavite sistem diferencijala. ur-cije, opisujući rezultate implementacije procesa na dekom. lok. uslovima.
Za hem. kinetiku karakterizira korištenje mnogih fizičkih. istraživačke metode koje omogućavaju izvođenje lokalnih pobuda reaktanata, proučavanje brzih (do femtosekundnih) transformacija, automatiziranje registracije kinetičkih. podataka sa njihovom istovremenom obradom na računaru itd. Intenzivno akumulira kinet. informacije putem kinetike , uklj. za kem. okruga u ekstremnim uslovima.
Vrlo važan dio fizičkog, usko povezan s kemijskim. kinetika je doktrina, tj. promjena brzine i smjera hemikalije. p-cija kada je izložena in-in (
Termodinamički sistem- tijelo ili grupa tijela koja su u interakciji, mentalno ili stvarno izolirana od okoline.
homogeni sistem- sistem unutar kojeg ne postoje površine koje razdvajaju dijelove sistema (faze) koji se razlikuju po svojstvima.
heterogeni sistem- sistem unutar kojeg postoje površine koje razdvajaju dijelove sistema koji se razlikuju po svojstvima.
Faza- skup homogenih delova heterogenog sistema, identičnih fizičkih i hemijskih svojstava, odvojenih od ostalih delova sistema vidljivim interfejsima.
izolovani sistem Sistem koji ne razmjenjuje materiju ili energiju sa svojom okolinom.
zatvoreni sistem- sistem koji razmjenjuje energiju sa okolinom, ali ne razmjenjuje materiju.
otvoreni sistem- sistem koji razmjenjuje materiju i energiju sa okolinom.
State Options su veličine koje karakterišu neka makroskopska svojstva sistema koji se razmatra.
Termodinamički proces– svaka promjena termodinamičkog stanja sistema (promjene barem jednog parametra stanja).
Reverzibilni proces- proces koji omogućava sistemu da se vrati u prvobitno stanje bez ostavljanja ikakvih promjena u okruženju.
ravnotežni proces- proces u kojem sistem prolazi kroz kontinuirani niz stanja koja su beskonačno bliska stanju ravnoteže. Karakteristične karakteristike procesa ravnoteže:
1) beskonačno mala razlika između djelujućih i suprotstavljenih sila: Fex-Fin > 0;
2) performanse sistema u direktnom procesu maksimalnog rada | W| = max;
3) beskonačno spor tok procesa povezan sa beskonačno malom razlikom u delujućim silama i beskonačno velikim brojem međustanja t > ?.
Spontani proces- proces koji se može odvijati bez utroška rada izvana, a kao rezultat može se dobiti rad u količini proporcionalnoj nastaloj promjeni stanja sistema. Može doći do spontanog procesa reverzibilan ili nepovratno.
Nespontani proces- proces čiji tok zahtijeva troškove rada izvana u iznosu proporcionalnom promjeni stanja sistema.
Energija je mjera sposobnosti sistema da radi; opća kvalitativna mjera kretanja i interakcije materije. Energija je svojstvo materije. Razlikovati potencijalna energija zbog položaja tijela u polju nekih sila, i kinetička energija uzrokovano promjenom položaja tijela u prostoru.
Unutrašnja energija sistema U je zbir kinetičke i potencijalne energije svih čestica koje čine sistem. Unutrašnja energija sistema se takođe može definisati kao njegova ukupna energija minus kinetička i potencijalna energija sistema kao celine. [ U]= J.
Toplota Q - oblik prijenosa energije nesređenim kretanjem molekula, haotičnim sudarima molekula dvaju susjednih tijela, odnosno provođenjem topline (i istovremeno zračenjem). Q > 0 ako sistem prima toplinu iz okoline. [ Q]= J.
Posao W - oblik prijenosa energije uređenim kretanjem čestica (makroskopskih masa) pod djelovanjem bilo koje sile. W > 0 ako okruženje radi na sistemu. [W] = J.
Sav posao je podeljen na mehanički rad ekspanzije (ili kontrakcije) i druge vrste poslova (korisni rad): ? W = -pdV + ?W?.
Standardno stanje čvrstih materija i tečnosti je stabilno stanje čiste supstance na datoj temperaturi pod pritiskom p = 1 atm.
Standardno stanje čisti gas- stanje gasa, prema jednačini stanja idealnog gasa pri pritisku od 1 atm.
Standardne vrijednosti– količine definisane za supstance u standardnom stanju (označene superskriptom 0).
1.1. Prvi zakon termodinamike
Energija je neuništiva i nestvorena; može se mijenjati samo iz jednog oblika u drugi u jednakim proporcijama.
Prvi zakon termodinamike je postulat – ne može se logički dokazati ili izvesti iz nekih opštijih odredbi.
Prvi zakon termodinamike uspostavlja odnos između toplote Q, rad W i promjena unutrašnje energije sistema? U.
izolovani sistem
Unutrašnja energija izolovanog sistema ostaje konstantna.
U= const ili dU= 0zatvoreni sistem
Promena unutrašnje energije zatvorenog sistema nastaje usled toplote koja se prenosi na sistem i/ili rada na sistemu.
?U=Q+W ili dU=? Q+? Wotvoreni sistem
Promena unutrašnje energije otvorenog sistema nastaje usled toplote koja je data sistemu i/ili rada na sistemu, kao i zbog promene mase sistema.
?U = Q + W + ?U m ili dU=? Q+? W+ i?U i dn iUnutrašnja energija je funkcija stanja; to znači da je promjena unutrašnje energije? U ne zavisi od puta prelaska sistema iz stanja 1 u stanje 2 i jednaka je razlici između vrednosti unutrašnje energije U 2 I U 1 u ovim državama:
?U \u003d U 2 - U 1Za neki proces:
?U = ?(v i U i) npod - ?(v i U i) ref1.2. Primjena prvog zakona termodinamike na homogene jednokomponentne zatvorene sisteme
Izohorni proces (V = const; ?V = 0)U najjednostavnijem slučaju, nema nikakvog korisnog posla.
dU=? Q+? W=? Q- pdV dU = ?Q v = C V dT = nC V dTSva količina toplote koju primi sistem ide na promjenu unutrašnje energije.
– toplotni kapacitet pri konstantnoj zapremini, tj. količina toplote potrebna da se temperatura sistema podigne za jedan stepen pri konstantnoj zapremini. [ ŽIVOTOPIS] = J/deg.
ŽIVOTOPIS je molarni toplotni kapacitet pri konstantnoj zapremini, J/(mol? deg). Za idealne gasove:
C V = 2 / 3 R je jednoatomni gas;
C V = 5 / 2 R je dvoatomski gas.
izobarni proces (R = const) dU=? Q+? W = ?Q – pdV ?Q p = dU + pdV = d(U + pV) = dHH \u003d U + pV - entalpija je funkcija stanja sistema.
?N = ?(? i U i) prod - ?(? i U i) ref?Q p = dU + pdV =dH = C p dT – toplinski efekat izobarnog procesa jednak je promjeni entalpije sistema.

– toplotni kapacitet pri konstantnom pritisku. [WITH] = J/deg.
C str je molarni toplotni kapacitet pri konstantnom pritisku, J/(mol? deg).
Za idealne gasove: C p = C V + R; C p, C V =[J/(mol K)].
Toplotni efekat (toplota) hemijske reakcije- količina toplote koja se oslobađa ili apsorbuje tokom reakcije na konstantnoj temperaturi.
Qv = ?UV Qp = ?Up Ovisnost termičkog efekta reakcije o temperaturi. Kirchhoffov zakonTemperaturni koeficijent toplotnog efekta hemijske reakcije jednak je promeni toplotnog kapaciteta sistema tokom reakcije.
Kirchhoffov zakon:
Za hemijski proces, promena toplotnog kapaciteta je data promenom sastava sistema:
?C p= ?(? i C p,i) prod – ?(? i C p,i) ref ili? C V =?(? i C V,i) prod – ?(? i C V,i) refIntegralni oblik Kirchhoffovog zakona:
?H T2 \u003d ?H T1 + ?C p (T 2 - T 1) ili? U T2 \u003d? U Ti +? C V (T 2 - T 1)1.3. Drugi zakon termodinamike. Entropija
1) Toplota ne može spontano preći sa manje zagrejanog tela na više zagrejano.
2) Nemoguć je proces čiji je jedini rezultat pretvaranje toplote u rad.
3) Postoji neka funkcija stanja sistema koja se zove entropijačija je promena povezana sa apsorbovanom toplotom i temperaturom sistema na sledeći način:
u neravnotežnom procesu
u ravnotežnom procesu
S je entropija, J/deg,
je smanjena toplota.
Statistička interpretacija entropijeSvako stanje sistema je dodijeljeno termodinamička verovatnoća(definisano kao broj mikrostanja koja čine dato makrostanje sistema), što je veće, to je ovo stanje neuređenije ili neodređenije. Entropija je funkcija stanja koja opisuje stepen poremećaja u sistemu.
S=k ln W je Boltzmannova formula.
Sistem teži da spontano pređe u stanje sa maksimalnom termodinamičkom verovatnoćom.
Izračun apsolutne entropije
Promjena entropije tijekom kemijskog procesa određena je samo vrstom i stanjem početnih tvari i produkta reakcije i ne ovisi o putu reakcije:
?S = ?(? i S i) prod - ?(?iSi) refVrijednosti apsolutne entropije u standardnim uvjetima date su u referentnoj literaturi.
1.4. Termodinamički potencijali
Potencijal je vrijednost čiji pad određuje rad sistema.
Samo oni procesi koji dovode do smanjenja slobodne energije sistema mogu se odvijati spontano; sistem dolazi u stanje ravnoteže kada slobodna energija dostigne svoju minimalnu vrijednost.
F = U – TS – Helmholtzova slobodna energija – izohorno-izotermni potencijal(J) - određuje pravac i granicu spontanog toka procesa u zatvorenom sistemu u izohorno-izotermnim uslovima.
dF = dU – TdS ili? F = ?U - T?SG = H – TS = U + pV – TS – Gibbsova slobodna energija – izobarično-izotermni potencijal(J) - određuje pravac i granicu spontanog toka procesa u zatvorenom sistemu u izobarično-izotermnim uslovima.
dG = dH – TdS ili? G = ?H - T?S ?G= ?(? i G i) prod - ?(? i G i) ref ?G0 = ?(? i ?G arr 0) prod - ?(? i ?G arr 0) ref Uslovi za spontane procese u zatvorenim sistemimaIzobarično-izotermno (P = const, T = const):
?G< 0, dG < 0Izohorno-izotermno (V = const, T = const):
?F< 0, dF< 0Termodinamička ravnoteža naziva se takvo termodinamičko stanje sistema sa minimalnom slobodnom energijom, koje se pod stalnim spoljnim uslovima ne menja u vremenu, a ta nepromenljivost nije posledica bilo kakvog spoljašnjeg procesa.
Uslovi termodinamičke ravnotežeu zatvorenom sistemuIzobarično-izotermno (P = const, T = const):
?G = 0, dG= 0, d 2 G > 0Izohorno-izotermno (V = const, T = const):
?F=0, dF = 0, d 2 F >0 Jednadžbe izoterme kemijske reakcije:Za reakciju v 1 A 1 + v 2 A 2+ … = v? 1 B 1 + v? 2 B 2 + …

Evo C i ,p i- koncentracija, pritisak reagujućih supstanci u bilo kom trenutku, različit od stanja ravnoteže.
Uticaj spoljašnjih uslova na hemijsku ravnotežuLe Chatelier-Brown princip pomaka ravnoteže
Ako se na sistem koji je u stanju prave ravnoteže izvrši spoljni uticaj, tada u sistemu nastaje spontani proces koji kompenzuje ovaj uticaj.
Utjecaj temperature na ravnotežni položaj
Egzotermne reakcije: ?H°< 0 (?U° < 0). Повышение температуры уменьшает величину константы равновесия, т. е. смещает равновесие влево.
Endotermne reakcije: ?H° > 0 (?U°> 0). Povećanje temperature povećava vrijednost konstante ravnoteže (pomiče ravnotežu udesno).
2. Fazne ravnoteže
Komponenta- hemijski homogena komponenta sistema, koja se može izolovati od sistema i postojati izvan njega. Broj nezavisnih komponenti sistema jednak je broju komponenti umanjenom za broj mogućih hemijskih reakcija između njih.
Broj stepeni slobode je broj parametara stanja sistema koji se mogu istovremeno proizvoljno mijenjati u određenim granicama bez promjene broja i prirode faza u sistemu.
Pravilo faze J. Gibbs:
Broj stepeni slobode ravnotežnog termodinamičkog sistema C jednak je broju nezavisnih komponenti sistema K minus broj faza F plus broj spoljnih faktora koji utiču na ravnotežu: C \u003d K - F + n.
Za sistem na koji utiču samo spoljni faktori temperatura i pritisak, može se napisati: C \u003d K - F+ 2.
Princip kontinuiteta- uz kontinuiranu promjenu parametara stanja, kontinuirano se mijenjaju i sva svojstva pojedinih faza; svojstva sistema kao celine se neprekidno menjaju sve dok se ne promeni broj ili priroda faza u sistemu, što dovodi do nagle promene svojstava sistema.
Prema princip usklađenosti, na dijagramu stanja sistema svaka faza odgovara dijelu ravni - polju faze. Linije preseka ravni odgovaraju ravnoteži između dve faze. Bilo koja tačka na dijagramu stanja (tzv. figurativna poenta) odgovara određenom stanju sistema sa određenim vrijednostima parametara stanja.
2.1. Dijagram statusa vode
K = 1. U sistemu su moguće trofazne ravnoteže: između tečnosti i gasa (linija OA), čvrstog i gasa (linija OB), čvrstog i tečnog (linija OC). Tri krive imaju presječnu tačku O tzv trostruka tačka vode,– odgovaraju ravnoteži između tri faze i S = 0; tri faze mogu biti u ravnoteži samo pri strogo određenim vrijednostima temperature i pritiska (za vodu trostruka tačka odgovara stanju sa P = 6,1 kPa i T = 273,16 K).

Unutar svake od oblasti dijagrama (AOB, BOC, AOC) sistem je jednofazni; C = 2 (sistem je bivarijantan).
Na svakoj od linija, broj faza u sistemu je dvije, a prema pravilu faza, sistem je monovarijantan: C \u003d 1 - 2 + 2 \u003d 1, tj. postoji samo jedna vrijednost pritiska za svaku vrijednost temperature.
Utjecaj pritiska na temperaturu faznog prijelaza je opisan sa Clausius-Clapeyron jednadžba:

V2, V1 je promjena molarne zapremine supstance tokom faznog prelaza.
Ravnotežna kriva "čvrsta materija - tečnost" na dijagramu stanja vode nagnuta je ulevo, a na dijagramima stanja ostalih supstanci - udesno, pošto je gustina vode veća od gustine leda, tj. praćeno smanjenjem zapremine (AV< 0). U ovom slučaju, povećanje pritiska će sniziti temperaturu faznog prelaza "čvrsto - tečno" (voda - anomalna supstanca). Za sve ostale supstance (tzv. normalne supstance) ?V pl> 0 i, prema Clausius-Clapeyron jednadžbi, povećanje pritiska dovodi do povećanja temperature topljenja.
3. Svojstva rješenja
3.1. Termodinamika rastvora
Rješenje- homogeni sistem koji se sastoji od dvije ili više komponenti, čiji sastav se može kontinuirano mijenjati u određenim granicama bez nagle promjene njegovih svojstava.
Difuzija u rastvorima
Difuzija- spontani proces izjednačavanja koncentracije supstance u rastvoru usled toplotnog kretanja njenih molekula ili atoma.
Fikov zakon: količina tvari koja difundira u jedinici vremena kroz jediničnu površinu proporcionalna je njenom koncentracijskom gradijentu:
Gdje j je difuzijski tok; D je koeficijent difuzije.
Einstein-Smoluchowski jednadžba:

Gdje? je viskoznost medija; R je radijus difuznih čestica.
Rastvorljivost gasova u gasovimaDaltonov zakon: ukupni pritisak gasne mešavine jednak je zbiru parcijalnih pritisaka svih njenih sastavnih gasova:
R ukupno = ? pi I pi = xi P ukupnoZakon Henryja Daltona: Rastvorljivost gasa u tečnosti direktno je proporcionalna njegovom pritisku nad tečnošću: C i = kp i , Gdje C i je koncentracija otopine plina u tekućini; k je koeficijent proporcionalnosti, u zavisnosti od prirode gasa.
U pravilu, kada se plin otopi u tekućini, oslobađa se toplina (Za< 0), dakle sa povećanjem temperature, rastvorljivost opada.
Sečenovljeva formula:
X \u003d X 0 e -kC elGdje X I X 0 je topljivost plina u čistom otapalu i otopini elektrolita s koncentracijom WITH.
3.2. Koligativna svojstva neelektrolitnih otopina
koligativan (kolektivni) nazivaju se svojstva rastvora u odnosu na svojstva rastvarača, koja uglavnom zavise od broja otopljenih čestica.
Pritisak zasićene pare razblaženih rastvoraPara u ravnoteži sa tečnošću naziva se zasićen. Pritisak ove pare p 0 pozvao pritisak ili elastičnost zasićene parečisti rastvarač.
Raoultov prvi zakon. Parcijalni pritisak zasićene pare komponente rastvora direktno je proporcionalan njenom molskom udjelu u rastvoru, a koeficijent proporcionalnosti jednak je pritisku zasićene pare nad čistom komponentom:
p i = p i 0 x iZa binarnu otopinu koja se sastoji od komponenti A i B: relativno smanjenje tlaka pare otapala nad otopinom jednako je molskom udjelu otopljene tvari i ne ovisi o prirodi otopljene tvari:

Rješenja za koja vrijedi Raoultov zakon nazivaju se idealnim rješenjima.
Pritisak pare idealnih i realnih rješenja
Ako su komponente binarnog (sastoji se od dvije komponente) otopine isparljive, tada će para iznad otopine sadržavati obje komponente. Opšti sastav, mol. frakcije u (x in) tlak pare:
p = pA0 x A + pB0 x B = p A 0 (1 – x B) + p B 0 x B = p A 0 – x B (p A 0 – p B 0)
Ako molekuli date komponente međusobno djeluju jače nego s molekulima druge komponente, tada će pravi parcijalni pritisci pare nad mješavinom biti veći od onih izračunatih korištenjem Raoultovog prvog zakona (pozitivna odstupanja, ?N TV > 0). Ako homogene čestice međusobno djeluju slabije od heterogenih čestica, parcijalni pritisci pare komponenti bit će manji od izračunatih (negativna odstupanja, ?H rješenje< 0).
Temperatura kristalizacije razrijeđenih otopinaRaoultov drugi zakon. Smanjenje tačke smrzavanja rastvora?T zamenik je direktno proporcionalno molarnoj koncentraciji rastvora:?T zamenik \u003d T 0 - T \u003d KS m, Gdje T 0 - tačka smrzavanja čistog rastvarača; T je tačka smrzavanja rastvora; TO je krioskopska konstanta rastvarača, deg/kg mol,

T 0 2 je temperatura smrzavanja rastvarača; M je molekulska težina rastvarača, ?Nm je molarna toplota fuzije rastvarača.
Tačka ključanja razrijeđenih otopinaTemperatura ključanja je temperatura na kojoj tlak zasićene pare postaje jednak vanjskom tlaku.
Povećanje tačke ključanja rastvora neisparljivih supstanci? T K \u003d T k - T k 0 proporcionalno smanjenju tlaka zasićene pare i direktno proporcionalno molarnoj koncentraciji otopine: EU m , Gdje E - ebulioskopska konstanta rastvarač, deg/kg mol,
 Osmotski pritisak razblaženih rastvora
Osmotski pritisak razblaženih rastvora
Osmoza- pretežno jednostrani prolaz molekula rastvarača kroz polupropusnu membranu u rastvor ili molekula rastvarača iz rastvora niže koncentracije u rastvor veće koncentracije.
Pritisak koji se mora primijeniti na otopinu kako bi se spriječilo da se rastvarač pomakne u otopinu kroz membranu koja odvaja otopinu od čistog otapala numerički je jednak osmotski pritisak?(Pa).
Van't Hoff princip: Osmotski pritisak idealne otopine jednak je pritisku koji bi otopljena tvar imala kada bi, u plinovitom stanju na istoj temperaturi, zauzimala isti volumen koji zauzima otopina: = CRT.
Izotonična rješenja– dva rastvora sa istim osmotskim pritiskom (?1 = ?2).
Hipertonični fiziološki rastvor- rastvor čiji je osmotski pritisak veći od onog drugog (? 1 > ? 2).
Hipotonični rastvor- rastvor čiji je osmotski pritisak manji od drugog (? 1< ? 2).
3.3. Otopine elektrolita
Stepen disocijacije? je omjer broja molekula n, raspada se na jone, na ukupan broj molekula N:
Izotonični koeficijent i Van Hoff je omjer stvarnog broja čestica u otopini elektrolita i broja čestica u ovoj otopini bez disocijacije.
Ako od N molekuli disocirani n, i svaki se molekul raspao na joni, dakle

Za neelektrolite i = 1.
Za elektrolite 1< i? ?.
3.4. Koligativna svojstva rastvora elektrolita:
 Arrheniusova teorija elektrolitičke disocijacije
Arrheniusova teorija elektrolitičke disocijacije
1. Elektroliti u rastvorima se raspadaju na jone – disociraju.
2. Disocijacija je reverzibilan proces ravnoteže.
3. Sile interakcije jona sa molekulima rastvarača i međusobno su male (tj. rastvori su idealni).
Disocijacija elektrolita u rastvoru nastaje pod dejstvom polarnih molekula rastvarača; prisustvo jona u rastvoru određuje njegovu električnu provodljivost.
Prema stepenu disocijacije, elektroliti se dijele u tri grupe: jaka(? ? 0,7), srednje snage(0,3 < ? < 0,7) и slab(? ? 0,3).
Slabi elektroliti. Konstanta disocijacijeZa neki elektrolit koji se u otopini raspada na ione u skladu s jednačinom:
A a B b - aA x- + bB y+
Za binarni elektrolit:

- Ostwaldov zakon razblaženja: stepen disocijacije slabog elektrolita raste sa razblaživanjem rastvora.
Solute aktivnost– empirijska vrijednost koja zamjenjuje koncentraciju, – aktivnost (efektivna koncentracija) A, vezano za koncentraciju preko koeficijenta aktivnosti f, što je mjera odstupanja svojstava realnog rješenja od idealnog:
a = fC; a + = f+ C + ; a_ = f_C_.Za binarni elektrolit:
je prosječna aktivnost elektrolita;
je prosječni koeficijent aktivnosti.
Debye-Hückel granični zakon za binarni elektrolit: lg f = -0.51z2I?, Gdje z je naboj jona za koji se izračunava koeficijent aktivnosti;
I je jonska snaga rastvora I = 0,5? (C i r i 2).
4. Električna provodljivost otopina elektrolita
Dirigenti prve vrste- metali i njihove taline, u kojima se električna energija prenosi elektronima.
Dirigenti II vrste– rastvori i taline elektrolita sa jonskim tipom provodljivosti.
Struja je uredno kretanje nabijenih čestica.
Svaki provodnik kroz koji teče struja predstavlja određenu otpor R, koji je prema Ohmovom zakonu direktno proporcionalan dužini provodnika l i obrnuto proporcionalna površini poprečnog presjeka S; faktor proporcionalnosti je otpornost materijal? - otpor provodnika dužine 1 cm i poprečnog presjeka 1 cm 2:

Vrijednost W, suprotan otpor se zove električna provodljivost- kvantitativna mjera sposobnosti otopine elektrolita da provodi električnu struju.

Električna provodljivost? (k) - električna provodljivost vodiča prve vrste dužine 1 m s površinom poprečnog presjeka od 1 m 2 ili električna provodljivost od 1 m 3 (1 cm 3) otopine elektrolita (provodnika druge vrste) sa razmakom između elektroda od 1 m (1 cm) i površinom od elektroda 1 m 2 (1 cm 2).
Molarna električna provodljivost rastvora) ? je električna provodljivost otopine koja sadrži 1 mol otopljene tvari i postavljena između elektroda koje se nalaze na udaljenosti od 1 cm jedna od druge.

Molarna električna provodljivost i jakih i slabih elektrolita raste sa smanjenjem koncentracije (tj. razblaživanje rastvora V = 1 / C) dostizanje neke granične vrijednosti? 0 (? ?), zvao molarna električna provodljivost pri beskonačnom razrjeđivanju.
Za binarni elektrolit s jednostruko nabijenim ionima na konstantnoj temperaturi i jakosti polja od 1 V m -1:
? = ?F(u + + i?),Gdje F je Faradejev broj; i + , i? - apsolutne pokretljivosti (m 2 V -1 s -1) kation i anion - brzina kretanja ovih jona u standardnim uslovima, sa potencijalnom razlikom od 1 V po 1 m dužine rastvora.
? + = Fu + ; ?? = Fu?,Gdje? + , ?? – mobilnost kation i anion, Ohm m 2 mol -1 (Ohm cm 2 mol -1).
? = ?(? + + ??)Za jake elektrolite? ?1 i ? = ? + + ??
Sa beskonačnim razblaživanjem rastvora (V > ?, ? + > ? ? + , ?? > ? ? ?, ? > 1) za jake i slabe elektrolite? ? = ? ? + – ? ? ? - Kolraušev zakon: je li molarna električna provodljivost pri beskonačnom razrjeđenju jednaka zbroju elektrolitičkih pokretljivosti? ? + , ? ? ? kationa i anjona datog elektrolita.
Joni H+ i OH? imaju abnormalno visoku pokretljivost, što je povezano sa posebnim mehanizmom prijenosa naboja od strane ovih jona - relejni mehanizam. Između hidronij jona H 3 O + i molekula vode, kao i između molekula vode i OH? protoni se kontinuirano razmjenjuju prema jednadžbi:
H 3 O + + H 2 O > H 2 O + H 3 O +
H 2 O + OH? >OH? + H 2 O
5. Elektrohemijski procesi
5.1. Potencijali elektroda. Galvanski elementi. EMF
Kada dva hemijski ili fizički različita materijala dođu u kontakt (metal 1 (provodnik prve vrste) - metal 2 (provodnik prve vrste), metal (provodnik prve vrste) - rastvor soli metala (provodnik druge vrste) , otopina elektrolita 1 (provodnik druge vrste) - otopina elektrolita 2 (provodnik druge vrste), itd.) između njih nastaje električni dvoslojni (DES). DES je rezultat uređene distribucije suprotno nabijenih čestica na sučelju.
Formiranje DEL dovodi do potencijalnog skoka?, koji se, u uslovima ravnoteže, naziva metal (provodnik prve vrste) - rastvor soli metala (provodnik druge vrste). galvanski potencijal.
Sistem: metal (Me) - vodeni rastvor soli datog Me - naziva se elektroda ili poluelement i shematski je prikazano kako slijedi:
Elektroda (p / e) je napisana tako da su sve tvari u otopini smještene lijevo, a materijal elektrode desno od okomite linije.
? > 0, ako se reakcija redukcije dogodi na elektrodi Me n+ + ne? - ja 0 ,
? < 0, если на электроде протекает реакция окисления Ме 0 - Ме n+ + ne?.
Potencijal elektrode E Me n+ / Me je ravnotežna razlika potencijala koja se javlja na graničnom faznom vodiču prve vrste / provodniku druge vrste i mjerena u odnosu na standardnu vodoničnu elektrodu.
Nernstova jednadžba, Gdje n je broj elektrona uključenih u elektrodnu reakciju; WITH Me n+ je koncentracija kationa; E Me n+ /Me je standardni potencijal elektrode.
kontakt potencijal? ?- skok ravnotežnog potencijala koji se javlja na granici između dva provodnika prve vrste.
Potencijal difuzije? dif je ravnotežna razlika potencijala koja se javlja na graničnom faznom vodiču druge vrste / provodniku druge vrste.
Galvanska ćelija (npr.)- električno kolo koje se sastoji od dva ili više p.e. i proizvodnju električne energije zbog hemijske reakcije koja se u njemu odvija, a faze oksidacije i redukcije hemijske reakcije su prostorno odvojene.
Elektroda na kojoj dolazi do procesa oksidacije tokom rada galvanske ćelije naziva se anoda, elektroda na kojoj se odvija proces oporavka, - katoda.
IUPAC pravila za snimanje galvanskih ćelija i reakcija koje se u njima dešavaju1. U g. e. rad je obavljen, pa se EMF elementa smatra pozitivnom vrijednošću.
2. Vrijednost EMF galvanskog kola E je određen algebarskim zbirom potencijalnih skokova na sučeljima svih faza, ali budući da se oksidacija događa na anodi, EMF se izračunava oduzimanjem vrijednosti potencijala anode (lijeva elektroda) od numeričke vrijednosti katode (desne elektrode). ) potencijal - pravilo desnog pola. Dakle, kolo elementa je zapisano tako da je lijeva elektroda negativna (dolazi do oksidacije), a desna pozitivna (dolazi do procesa redukcije).
3. Interfejs između provodnika prve vrste i provodnika druge vrste je označen jednom linijom.
4. Granica između dva provodnika druge vrste prikazana je isprekidanom linijom.
5. Elektrolitski most na granici dva provodnika II vrste označen je sa dvije isprekidane linije.
6. Komponente jedne faze pišu se odvojene zarezima.
7. Jednačina reakcije elektrode je napisana tako da se tvari u oksidiranom obliku (Ox) nalaze na lijevoj strani, a u reduciranom obliku (Red) na desnoj strani.
Daniel-Jacobi galvanska ćelija sastoji se od ploča cinka i bakra uronjenih u odgovarajuće otopine ZnSO 4 i CuSO 4 , koje su odvojene solnim mostom s otopinom KCl: elektrolitički most osigurava električnu provodljivost između otopina, ali sprječava njihovu međusobnu difuziju.
(-) Zn | Zn2+ :: Cu2+ | Cu(+)Reakcije na elektrodama:
Zn0 > Zn2+ + 2e? Cu 2+ + 2e? > Cu 0Ukupni redoks proces:
Cu 2+ + Zn 0 > Cu 0 + Zn 2+Rad struje galvanske ćelije (a samim tim i potencijalna razlika) bit će maksimalan za vrijeme njegovog reverzibilnog rada, kada se procesi na elektrodama odvijaju beskonačno sporo, a jačina struje u kolu je beskonačno mala.
Maksimalna razlika potencijala koja se javlja tokom reverzibilnog rada galvanske ćelije je elektromotorna sila (EMF) galvanske ćelije E.
element emf E Zn/Cu = ? Cu2+ /Cu+? Zn2+ /Zn + ? na +? diff.
Isključujući? diff i? Za: E Zn/Cu = ? Cu2+ /Cu+? Zn2+ /Zn = E Cu 2+ /Cu + E Zn 2+ /Zn - galvanske ćelije koje se sastoje od dvije identične metalne elektrode uronjene u rastvor soli ovog metala različitih koncentracija S 1 > S 2 . U ovom slučaju, katoda će biti elektroda veće koncentracije, budući da su standardni elektrodni potencijali obje elektrode jednaki.

lancima koncentracije

Jedini rezultat rada elementa koncentracije je prijenos metalnih iona iz koncentriranije otopine u manje koncentriranu.
Rad električne struje u koncentracijskoj galvanskoj ćeliji je rad procesa difuzije, koji se odvija reverzibilno kao rezultat njegove prostorne podjele na dva reverzibilna elektrodna procesa suprotna u smjeru.
5.2. Klasifikacija elektroda
Elektrode prve vrste. Metalna ploča uronjena u rastvor soli istog metala. Tokom reverzibilnog rada elementa u koji je uključena elektroda, na metalnoj ploči odvija se proces prelaska kationa iz metala u rastvor ili iz rastvora u metal.
Elektrode druge vrste. Metal je prekriven slabo rastvorljivom soli ovog metala i nalazi se u rastvoru koji sadrži drugu rastvorljivu so sa istim anjonom. Elektrode ovog tipa su reverzibilne u odnosu na anion.
Referentne elektrode– elektrode s točno poznatim i ponovljivim vrijednostima potencijala.
Vodikova elektroda je platinasta ploča isprana plinovitom vodonikom, uronjena u otopinu koja sadrži vodikove ione. Vodik koji adsorbuje platina je u ravnoteži sa gasovitim vodonikom.
Pt, N 2 / N +Elektrohemijska ravnoteža na elektrodi:
2H++ 2e? - H 2 .Potencijal standardne vodonične elektrode (sa aktivnošću jona H + 1 mol/l i tlakom vodonika od 101,3 kPa) je nula.
Potencijal elektrode nestandardne vodikove elektrode:

Kalomel elektroda sastoji se od živine elektrode postavljene u otopinu KCl određene koncentracije i zasićene Hg 2 Cl 2 kalomelom:
Hg / Hg 2 Cl 2 , KClKalomel elektroda je reverzibilna u odnosu na hloridne anjone
Srebrna hloridna elektroda– reverzibilno u odnosu na anjone hlora:
Ag/AgCl, KClAko je otopina KCl zasićena, tada E AgC l = 0,2224 - 0,00065 (t - 25), V.
indikatorske elektrode. Za određivanje aktivnosti ovih jona u rastvoru u praksi se koriste elektrode koje su reverzibilne u odnosu na jon vodonika.
Kinhidronska elektroda je platinasta žica spuštena u posudu sa ispitnim rastvorom, u koju se prvo stavlja višak kinhidrona C 6 H 4 O 2 C 6 H 4 (OH) 2 - jedinjenja kinona C 6 H 4 O 2 i hidrokinona C 6 H 4 (OH ) 2 sposoban za međukonverziju u ravnotežnom redoks procesu u kojem učestvuju vodikovi joni:
C 6 H 4 O 2 + 2H + + 2e? > C 6 H 4 (OH) 2Najčešće korišteni staklena elektroda u obliku cijevi koja se završava staklenom kuglom tankih stijenki. Lopta se puni puferskom otopinom određene pH vrijednosti u koju je uronjena pomoćna elektroda (obično srebrni klorid). Za mjerenje pH, staklena elektroda je uronjena u ispitni rastvor zajedno sa referentnom elektrodom. Kuglica staklene elektrode je prethodno dugo tretirana otopinom kiseline. U ovom slučaju, ioni vodonika se uvode u zidove kugle, zamjenjujući katjone alkalnih metala. Elektrodni proces se svodi na razmjenu vodonikovih jona između dvije faze - ispitnog rastvora i stakla: H rastvor - H st + .
standardni kapacitet E st 0 za svaku elektrodu ima svoju vrijednost, koja se mijenja tokom vremena; stoga se staklena elektroda kalibrira prije svakog pH mjerenja u odnosu na standardne puferske otopine s tačno poznatim pH.
Redox elektrodeElektroda koja se sastoji od inertnog provodnika 1. vrste, postavljenog u rastvor elektrolita koji sadrži jedan element u različitim oksidacionim stanjima, naziva se redoks ili redoks elektroda.
Reakcija elektrode: Oh n+ + ne? - crvena.
U ovom slučaju inert Me indirektno sudjeluje u elektrodnoj reakciji, kao posrednik u prijenosu elektrona iz reduciranog oblika Me (Red) u oksidirani oblik (Ox) ili obrnuto.

6. Površinski fenomeni i adsorpcija
6.1. Površinska napetost i Gibbsova adsorpcija
Površinski fenomeni nazivaju procesi koji se odvijaju na granici i zbog posebnosti sastava i strukture površinskog (graničnog) sloja.
Gs = ?s,Gdje Gs je površinska Gibbsova energija sistema, J; ? - koeficijent proporcionalnosti, nazvan površinski napon, J/m 2; s je međufazna površina, m2.

Površinski naponO je veličina mjerena Gibbsovom energijom po jedinici površine površinskog sloja. Numerički je jednak radu koji se mora obaviti protiv sila međumolekularne interakcije da bi se formirao jedinični interfejs na konstantnoj temperaturi.

Od Dupre modela, površinski napon jednaka sili koja teži smanjenju interfejsa i povezana sa jediničnom dužinom konture koja ograničava površinu

Sposobnost otopljenih tvari da mijenjaju površinski napon rastvarača naziva se površinska aktivnost g:
Klasifikacija supstanci prema uticaju na površinski napon rastvarača1. Surfaktanti (tenzidi)– smanjiti površinski napon rastvarača (? rastvora< ? 0) g >0 (u odnosu na vodu - organska jedinjenja amfifilne strukture).
2. Površinski neaktivne supstance (SID)– blago povećati površinski napon rastvarača (? rastvor > ? 0) g< 0 (неорганические кислоты, основания, соли, глицерин, ?-аминокислоты и др).
3. Površinski neaktivne supstance (NSV)- praktično ne mijenjaju površinski napon rastvarača (? rr = ? 0) g = 0 (u odnosu na vodu, tvari su saharoza i niz drugih).
Duclos-Traube pravilo: u bilo kojoj homolognoj seriji pri niskim koncentracijama, produljenje ugljikovog lanca za jednu CH2 grupu povećava površinsku aktivnost za 3-3,5 puta:

Za vodene rastvore masnih kiselina (jednačina Šiškovskog):
Gdje b I TO su empirijske konstante, b isto za ceo homologni niz, K se povećava za svakog sledećeg člana serije za 3-3,5 puta.
Proces spontane promjene koncentracije tvari na granici između dvije faze naziva se adsorpcija. Adsorbent naziva se tvar na čijoj površini dolazi do promjene koncentracije druge tvari - adsorbat.
Gibbsova izoterma adsorpcije:

Karakterizira višak adsorbata u površinskom sloju u odnosu na njegovu početnu količinu u ovom sloju višak ili tzv Gibbs, adsorpcija(G).
6.2. Adsorpcija na granici čvrstog gasa
fizička adsorpcija nastaje zbog van der Waalsovih interakcija adsorbirane molekule s površinom, karakterizira je reverzibilnost i smanjenje adsorpcije s povećanjem temperature, odnosno egzotermnost (termički efekat fizičke adsorpcije je obično blizak toplini ukapljivanja adsorbata, 10–80 kJ/mol).
Hemijska adsorpcija (kemisorpcija) izvedeno hemijskom interakcijom molekula adsorbenta i adsorbata, obično nepovratnih; je lokalizovan tj. molekuli adsorbata ne mogu se kretati po površini adsorbenta. Pošto je hemisorpcija hemijski proces koji zahteva energiju aktivacije reda 40-120 kJ/mol, povećanje temperature doprinosi njenom nastanku.
Henrijeva jednačina(monomolekularna adsorpcija na homogenoj površini pri niskim pritiscima ili niskim koncentracijama):
G = Ks ili G \u003d Kr,TO je konstanta ravnoteže adsorpcije, koja ovisi o prirodi adsorbenta i adsorbata; C, r je koncentracija otopljene tvari ili tlak plina.
Langmuirova teorija monomolekularne adsorpcije
1. Adsorpcija je lokalizovana i uzrokovana je silama bliskim hemijskim.
2. Adsorpcija se odvija na homogenoj površini adsorbenta.
3. Na površini se može formirati samo jedan sloj adsorbiranih molekula.
4. Proces adsorpcije je reverzibilan i ravnotežan.
Langmuir adsorpciona izoterma:

Gdje G 0 – jednoslojni kapacitet je konstanta jednaka graničnoj adsorpciji uočenoj pri relativno visokim ravnotežnim koncentracijama, mol/m 2 ; b je konstanta jednaka omjeru konstante brzine adsorpcije i konstante brzine desorpcije.
Freundlichova jednadžba(adsorpcija na nehomogenoj površini): G = K F sa n , Gdje. K F je konstanta brojčano jednaka adsorpciji pri ravnotežnoj koncentraciji jednakoj jedinici; n je konstanta koja određuje zakrivljenost izoterme adsorpcije (n= 0,1–0,6).
Molekularna adsorpcija iz otopina:

gdje je C 0 početna koncentracija adsorbata; WITH je ravnotežna koncentracija adsorbata; V je zapremina rastvora adsorbata; m je masa adsorbenta.
Square S 0 , po molekuli u zasićenom adsorpcionom sloju, područje slijetanja:

m 2 /molekul.
Debljina adsorpcionog sloja:

Gdje M je molekulska težina surfaktanta; ? je gustina surfaktanta.
Rebinderovo pravilo: na polarnim adsorbentima, polarni adsorbati iz rastvarača niskog polariteta se bolje adsorbiraju; na polarnim adsorbentima, nepolarnim adsorbatima iz polarnih rastvarača.
Orijentacija molekula surfaktanta na površini adsorbenta je shematski prikazana na slici:

6.3. Adsorpcija iz otopina elektrolita
Izmjenjiva adsorpcija- proces ionske izmjene između otopine i čvrste faze, u kojem čvrsta faza apsorbira ione bilo kojeg predznaka (katione ili anione) iz otopine i umjesto njih može osloboditi ekvivalentan broj drugih jona istog predznaka u rješenje. Zauvijek specifično tj., za dati adsorbent, samo su određeni joni sposobni za razmjenu; adsorpcija izmene je obično nepovratna.
Paket-Peskov-Faience pravilo: na površini kristalne čvrste supstance, ion se specifično adsorbuje iz rastvora elektrolita, koji može da kompletira svoju kristalnu rešetku ili može da formira slabo rastvorljivo jedinjenje sa jednim od jona koji čine kristal.
7. Koloidni (disperzni) sistemi
Koloidni (disperzni) sistem naziva se heterogeni sistem, u kojem je jedna od faza predstavljena malim česticama ravnomjerno raspoređenim u zapremini druge homogene faze. To su ultramikroheterogeni sistemi koji se sastoje od čestica disperzovana faza- agregati zdrobljenih čestica čija je veličina unutar 10 -9 -10 -5 m i kontinuirani disperzioni medij, u kojoj su ove čestice raspoređene.
znakovi koloidno stanje materije - disperzija i heterogenost.
Stepen disperzije? je recipročna vrednost srednjeg prečnika ili, za nesferične čestice, recipročna vrednost srednjeg ekvivalentnog prečnika d(m -1):
Specifična površina je omjer ukupne površine dispergirane faze S DF i njenog ukupnog volumena ili mase:

7.1. Klasifikacija i metode za dobijanje disperznih sistema
Klasifikacija prema stanju agregacije faza


Disperzni sistem u kojem su i disperzna faza i disperzioni medij gasovi ne postoji, jer su gasovi beskrajno rastvorljivi jedan u drugom.
Klasifikacija sistema prema veličini čestica dispergovane faze:
1) visoko disperziran, 10 -9_ 10 -7 m (rubinsko staklo);
2) srednje raspršena, 10 -7_ 10 -5 m (instant kafa);
3) grubi, > 10 -5 m (kapi kiše).
Metode za dobijanje koloidnih sistema disperzijaFizička disperzija: mehaničko mljevenje pomoću koloidnih mlinova; električno prskanje tvari; ultrazvučna disperzija i druge metode. Kako bi se spriječilo lijepljenje formiranih čestica, disperzija se vrši u prisustvu stabilizator– elektrolit ili supstanca adsorbovana na granici (tenzidi).
Hemijska disperzija (peptizacija): pretvaranje svježe pripremljenog taloga u koloidno stanje pomoću peptizatora.
KondenzacijaFizička kondenzacija: 1) način zamjene rastvarača, koji se sastoji u tome da se u pravi rastvor supstance dodaje tečnost koja se pomeša sa rastvaračem, u kojoj je sama supstanca slabo rastvorljiva; zbog smanjenja topljivosti tvari u novom otapalu, otopina postaje prezasićena, a dio tvari se kondenzira, formirajući čestice dispergirane faze; 2) metoda kondenzacije pare; originalna supstanca je u paru; kako temperatura opada, para postaje prezasićena i djelomično se kondenzira, formirajući dispergiranu fazu.
Hemijska kondenzacija: svaka hemijska reakcija koja rezultira stvaranjem slabo rastvorljivog jedinjenja; da bi se dobila koloidna otopina, reakcija se mora provesti u razrijeđenoj otopini uz nisku brzinu rasta čestica, jedan od početnih materijala se uzima u višku i predstavlja stabilizator.
7.2. Optička svojstva dispergovanih sistema
Kada svjetlost padne na disperzni sistem, mogu se uočiti sljedeće pojave:
svjetlosni prolazčestice dispergirane faze (primjećeno za transparentne sisteme u kojima su čestice mnogo manje od talasne dužine upadne svjetlosti (r<< ?);
prelamanje svjetlostičestice dispergirane faze (ako su te čestice prozirne);
refleksija svetlostičestice dispergirane faze (ako su čestice neprozirne);
prelamanja i refleksije svetlost se posmatra za sisteme u kojima su čestice mnogo veće od talasne dužine upadne svetlosti (r >> ?). Vizuelno, ova pojava se izražava u zamućenosti ovih sistema;
rasipanje svetlosti uočeno za sisteme u kojima su čestice dispergirane faze manje, ali srazmjerno sa talasnom dužinom upadne svetlosti (r ? 0,1 ?);
adsorpcija(apsorpcija) svjetlosti disperznom fazom uz konverziju svjetlosne energije u toplinu.
Rayleighova jednadžba:

gdje su I, I 0 intenzitet raspršene i upadne svjetlosti; V je zapremina jedne čestice; ? – parcijalna koncentracija (broj čestica po jedinici zapremine); ? je talasna dužina; n 1 , n 0 su indeksi prelamanja čestica i medija, respektivno.
Fenomen različitih boja koloidnog rastvora u propuštenoj i rasejanoj (reflektovanoj) svetlosti naziva se opalescencija. U slučaju obojenih otopina dolazi do preklapanja vlastite boje i boje uzrokovane opalescencijom (fenomen dikroizam svetlosti).
7.3. Molekularna kinetička svojstva
Karakteriziraju se koloidni sistemi Brownovo kretanje- kontinuirano nasumično kretanje čestica mikroskopskih i koloidnih veličina. Ovo kretanje je intenzivnije, što je viša temperatura i što je manja masa čestice i viskozitet disperzijskog medija.
Difuzija je spontani proces izjednačavanja koncentracije čestica.
Fikov zakon:

Zbog velike veličine koloidnih čestica, difuzija u koloidnim sistemima je sporija nego u pravim otopinama.
osmotski pritisak:

gdje je mtot masa otopljene tvari; m je masa jedne čestice; V je zapremina sistema; N / A je Avogadro broj; T je apsolutna temperatura; ? – djelomična koncentracija; k je Boltzmannova konstanta.
Za sferne čestice:

Gdje? m masa dispergovane faze po jedinici zapremine rastvora; ? je gustina disperzione sredine; r je polumjer čestice.
7.4. Struktura micele
Liofobna micela Sistem se naziva heterogeni mikrosistem, koji se sastoji od mikrokristala dispergovane faze, okruženog solvatiranim stabilizatorskim jonima.
Određivanje potencijala nazivaju se joni adsorbirani na površini čestice čvrste faze (jedinica) i naplati ga. Agregat, zajedno sa jonima koji određuju potencijal, jeste jezgro micela.
Counterions su joni koji se grupišu u blizini jezgra micele.
Položaj protujona u disperzijskom mediju određuju dva suprotna faktora: termičko kretanje (difuzija) i elektrostatičko privlačenje.

Protivjoni koji čine gusto adsorpcioni sloj, nazivaju se "povezanim" i zajedno sa jezgrom čine koloidna čestica ili granula. Koloidna čestica (granula) ima naboj, čiji je predznak posljedica predznaka naboja jona koji određuju potencijal.
Kontrajoni koji se formiraju difuzni sloj,- "mobilno" ili "besplatno".
Koloidna čestica s okolnim difuznim slojem solvatiranih protujona je micelle. Za razliku od koloidne čestice, micela je električno neutralna i nema striktno određene dimenzije.

U miceli s ionskim stabilizatorom, na granici faze postoji DES, nastaje razlika potencijala između dispergirane faze i disperzijskog medija - termodinamički potencijal f (interfaza),što je određeno svojstvima datog disperznog sistema, kao i nabojom i koncentracijom jona koji određuju potencijal adsorbovanih na čvrstoj fazi.

Kretanje nabijenih koloidnih čestica u nepokretnoj tekućini do jedne od elektroda pod djelovanjem vanjskog električnog polja naziva se elektroforeza.
Površina na kojoj se događa kretanje naziva se klizna površina. Veličina skoka potencijala na granici faza koje su u kretanju jedna u odnosu na drugu tokom elektroforeze i kod Brownovog kretanja, odnosno na kliznoj površini, naziva se elektrokinetički ili?-potencijal (zeta potencijal).
7.5. Stabilnost i koagulacija
Stabilnost dispergovanih sistema karakterizira sposobnost dispergirane faze da održi stanje ujednačene distribucije čestica po volumenu disperzione sredine.
Postoje dvije vrste relativne stabilnosti dispergiranih sistema: sedimentacije i agregacije.
Otpornost na sedimentaciju- sposobnost sistema da se odupre djelovanju gravitacije. Sedimentacija je taloženje čestica u rastvoru pod uticajem gravitacije.
Stanje sedimentaciona ravnoteža:čestica se kreće konstantnom brzinom, tj. ravnomjerno, sila trenja uravnotežuje silu gravitacije:
6??rU = 4/3?r 3 (? - ? 0)g,Gdje? je gustina dispergovane faze, ? 0 je gustina disperzijskog medija, g je ubrzanje gravitacije, ? je viskoznost medija.
Agregatna stabilnost karakterizira sposobnost čestica dispergirane faze da se odupru njihovom lijepljenju i na taj način zadrže svoju veličinu.
Dolazi do kršenja agregatne stabilnosti koagulacija je proces sljepljivanja čestica uz stvaranje velikih agregata. Kao rezultat koagulacije, sistem gubi stabilnost sedimentacije, jer čestice postaju prevelike i ne mogu učestvovati u Brownovom kretanju.
Razlozi za koagulaciju:
> promjena temperature;
> djelovanje električnih i elektromagnetnih polja;
> djelovanje vidljive svjetlosti;
> izloženost elementarnim česticama;
> mehanički udar;
> dodavanje elektrolita itd.
Od najvećeg praktičnog interesa je koagulacija elektrolitima.
Vrste koagulacije elektrolitimakoncentracija pod uticajem nastaje koagulacija indiferentan elektroliti. indiferentan naziva se elektrolit, pri čijem uvođenju nastaje međufazni potencijal<р не изменяется. Данный электролит не содержит таких ионов, которые были бы способны к специфической адсорбции на частицах по правилу Па-нета-Фаянса, т. е. не способны достраивать кристаллическую решетку агрегата:

Stanje u kojem difuzni sloj nestaje i koloidna čestica postaje električno neutralna naziva se izoelektrični– elektrokinetički potencijal (?) jednak je nuli, dolazi do koagulacije. Formula micela u ovom stanju ima oblik: (mnAg + nNO 3 ?) 0 .
Neutralizacija koagulacija se javlja kada se doda rastvoru neravnodušni elektrolit. Neravnodušni elektrolit se naziva elektrolit sposoban da mijenja međufazne (?) i linearno povezane elektrokinetičke (?) potencijale, tj. ovaj elektrolit sadrži ione koji se mogu specifično adsorbirati na površini agregata, kompletirati njegovu kristalnu rešetku ili kemijski stupiti u interakciju s potencijalom -određivanje jona.

Reverzibilni proces u kojem koagulat ponovo prelazi u koloidno stanje naziva se peptizacija ili dezagregacija.
pravila koagulacije1. Svi jaki elektroliti dodani sol u dovoljnim količinama uzrokuju koagulaciju. Minimalna koncentracija elektrolita koja uzrokuje koagulaciju sola u određenom kratkom vremenskom periodu naziva se prag koagulacije:

gdje je C el koncentracija elektrolita-koagulanta; V el je zapremina dodatog elektrolita; V sol (obično 10 ml) je zapremina sola.
2. Koagulacijski efekat ima jon čiji se naboj po predznaku poklapa sa nabojem kontrajona micela liofobnog sola (naboj koagulacionog jona je suprotan naboju koloidne čestice). Ovaj ion se zove koagulantni jon.
3. Koagulaciona sposobnost jona - koagulanta je veća, što je veći naboj jona:
Pravilo značaja:
? 1: ? 2: ? 3 = 1/1 6: 1/2 6: 1/3 6 = 729: 11: 1Sposobnost koagulacije jona sa istim nabojem je veća, što je veći njegov kristalni radijus. Ag + > Cs + > Rb + > NH 4 + > K + > Na + > Li+ - liotropne serije.
Koloidna zaštita naziva se povećanjem agregativne stabilnosti sola uvođenjem u njega spirale (visoke molekularne mase) ili surfaktanta (surfaktanta).
broj čuvara naziva se minimalni broj miligrama suhe tvari koji je neophodan za zaštitu 10 ml sola kada mu se doda elektrolit u količini koja je jednaka pragu koagulacije.
FIZIČKA HEMIJA
Predmet fizičke hemije. Njegovo značenje
Odnos proučavanja hemijskih i fizičkih fenomena fizička hemija. Ova grana hemije je granica između hemije i fizike. Koristeći teorijske i eksperimentalne metode obje nauke, kao i sopstvene metode, fizička hemija se bavi višestrukim proučavanjem hemijskih reakcija i fizičkih procesa koji ih prate. Budući da, međutim, ni višeznačna studija nikada nije potpuna i ne pokriva fenomen na iscrpan način, zakoni i zakonitosti fizičke hemije, kao i zakoni drugih prirodnih nauka, uvijek pojednostavljuju fenomen i ne odražavaju ga u potpunosti.
Brzi razvoj i rastući značaj fizičke hemije povezani su sa njenim graničnim položajem između fizike i hemije. Glavni opšti zadatak fizičke hemije je predviđanje vremenskog toka procesa i konačnog rezultata (ravnotežnog stanja) pod različitim uslovima na osnovu podataka o strukturi i svojstvima supstanci koje čine sistem koji se proučava.
Kratak pregled istorije razvoja fizičke hemije
Termin "fizička hemija" i definiciju ove nauke prvi je dao M.V. Lomonosov, koji je 1752-1754. pročitao kurs fizičke hemije studentima Akademije nauka i ostavio rukopis ovog kursa "Uvod u pravu fizičku hemiju" (1752). Lomonosov je sproveo mnoga istraživanja, čije teme odgovaraju "Planu kursa fizičke hemije" koji je sastavio (1752) i programu eksperimentalnog rada "Iskustvo u fizičkoj hemiji" (1754). Pod njegovim rukovodstvom održana je i studentska radionica fizičke hemije.
Lomonosov je dao sledeću definiciju fizičke hemije: "Fizička hemija je nauka koja objašnjava, na osnovu odredbi i eksperimenata fizike, šta se dešava u mešovitim telima tokom hemijskih operacija." Ova definicija je bliska modernoj.
Za razvoj fizičke hemije od velike je važnosti otkriće dva zakona termodinamike sredinom 19. veka (S. Carnot, Yu.R. Mayer, G. Helmholtz, D.P. Joule, R. Clausius, W. Thomson). važnost.
Broj i raznovrsnost istraživanja, koja se nalaze u oblasti koja se graniči između fizike i hemije, stalno se povećavala u 19. veku. Razvijena je termodinamička teorija hemijske ravnoteže (K.M. Guldberg, P. Waage, D.W. Gibbs). Studije L.F. Wilhelmija postavile su temelje za proučavanje brzina hemijskih reakcija (hemijska kinetika). Proučavan je prenos električne energije u rastvorima (I.V. Gittorf, F.V.G. Kolrausch), proučavani su zakoni ravnoteže rastvora sa parom (D.P. Konovalov) i razvijana teorija rešenja (D.I. Mendeljejev).
Priznanje fizičke hemije kao samostalne nauke i akademske discipline izraženo je osnivanjem na Univerzitetu u Lajpcigu (Nemačka) 1887. godine prvog odseka za fizičku hemiju na čelu sa W. Ostwaldom i osnivanjem prvog naučnog časopisa o fizičkoj hemiji. hemija tamo. Krajem 19. stoljeća Univerzitet u Lajpcigu bio je centar razvoja fizičke hemije, a vodeći fizikalni hemičari bili su W. Ostwald, J. H. Van't Hoff, S. Arrhenius i W. Nernst. Do tada su definisana tri glavna odeljka fizičke hemije - hemijska termodinamika, hemijska kinetika i elektrohemija.
Najvažnije oblasti nauke, čiji je razvoj neophodan uslov za tehnički napredak, uključuju proučavanje hemijskih procesa; fizička hemija igra vodeću ulogu u razvoju ovog problema.
Sekcije fizičke hemije. Metode istraživanja
Hemijska termodinamika. U ovom odeljku, na osnovu zakona opšte termodinamike, izlažu se zakoni hemijske ravnoteže i doktrina faznih ravnoteža.
Doktrina rastvora ima za cilj da objasni i predvidi svojstva rastvora (homogene smeše više supstanci) na osnovu svojstava supstanci koje čine rastvor.
Doktrina površinskih pojava. Proučavaju se različita svojstva površinskih slojeva čvrstih materija i tečnosti (međufaza); jedan od glavnih proučavanih fenomena u površinskim slojevima je adsorpcija(akumulacija materije u površinskom sloju).
U sistemima u kojima su granice između tečne, čvrste i gasovite faze visoko razvijene (emulzije, magle, dimovi, itd.), svojstva površinskih slojeva postaju od primarne važnosti i određuju mnoga jedinstvena svojstva čitavog sistema kao cijeli. Takve raspršen (mikroheterogena) sistemi se proučavaju koloidna hemija, koja je glavna nezavisna grana fizičke hemije.
Navedena lista glavnih odjeljaka fizičke hemije ne pokriva neke oblasti i manje dijelove ove nauke, koji se mogu smatrati dijelovima većih odjeljaka ili samostalnim dijelovima fizičke hemije. Treba još jednom naglasiti blisku međusobnu povezanost različitih grana fizičke hemije. U proučavanju bilo koje pojave potrebno je koristiti arsenal ideja, teorija i metoda za proučavanje mnogih grana hemije (a često i drugih nauka). Tek uz početno upoznavanje fizičke hemije moguće je u obrazovne svrhe materijal rasporediti u naznačene rubrike.
Metode fizičko-hemijskog istraživanja. Osnovne metode fizičke hemije su naravno metode fizike i hemije. Ovo je, prije svega, eksperimentalna metoda - proučavanje ovisnosti svojstava tvari o vanjskim uvjetima, eksperimentalno proučavanje zakona toka različitih procesa i zakona kemijske ravnoteže.
Teorijsko razumijevanje eksperimentalnih podataka i stvaranje koherentnog sistema znanja zasniva se na metodama teorijske fizike.
Termodinamička metoda, koja je jedna od njih, omogućava kvantitativno povezivanje različitih svojstava tvari („makroskopska“ svojstva) i izračunavanje nekih od ovih svojstava na osnovu eksperimentalnih vrijednosti drugih svojstava.
POGLAVLJE I
PRVI ZAKON TERMODINAMIJE
Toplina i rad
Promjene u oblicima kretanja tokom njegovog prelaska iz jednog tijela u drugo i odgovarajuće transformacije energije su vrlo raznolike. Oblici samog prijelaza kretanja i s njim povezani prijelazi energije mogu se podijeliti u dvije grupe.
Prva grupa uključuje samo jedan oblik tranzicije kretanja haotičnim sudarima molekula dvaju susjednih tijela, tj. provođenjem (i u isto vrijeme zračenjem). Mjera kretanja koja se prenosi na ovaj način je toplota .
Druga grupa uključuje različite oblike tranzicije kretanja, čija je zajednička karakteristika kretanje makroskopskih masa pod djelovanjem bilo kakvih vanjskih sila koje imaju usmjereni karakter. Takvi su izdizanje tijela u gravitacionom polju, prijelaz određene količine električne energije iz većeg elektrostatičkog potencijala u manji, širenje plina pod pritiskom itd. Opšta mjera kretanja koja se prenosi takvim sredstvima je Posao .
Toplina i rad karakteriziraju kvalitativno i kvantitativno dva različita oblika prenošenja kretanja iz jednog dijela materijalnog svijeta u drugi.
Prenos kretanja je vrsta složenog kretanja materije, čija dva glavna oblika razlikujemo. Toplota i rad su mjere ova dva složena oblika kretanja materije i treba ih smatrati vrstama energije.
Zajedničko svojstvo toplote i rada je da su bitni samo u vremenskim intervalima u kojima se ti procesi odvijaju. U toku ovakvih procesa kod nekih tijela se kretanje u jednom ili drugom obliku smanjuje i odgovarajuća energija se smanjuje, dok se kod drugih tijela povećava kretanje u istim ili drugim oblicima i povećavaju odgovarajuće vrste energije.
Ne govorimo o zalihama toplote ili radu u bilo kom telu, već samo o toploti i radu poznatog procesa. Nakon njegovog završetka ne treba govoriti o prisutnosti topline ili rada u tijelima.
Unutrašnja energija
Za ne-kružni proces, jednakost (I, 1) se ne poštuje, jer se sistem ne vraća u prvobitno stanje. Umjesto toga, mogu se napisati jednakosti za ne-kružni proces (izostavljajući koeficijent k):
Pošto su granice integracije generalno proizvoljne, onda za elementarne veličine dW I dQ:
d Q¹d W,
dakle:
d Q– d W ¹ 0
Označite razliku dQ - dW za bilo koji elementarni termodinamički proces dU:
dUº d Q– d W(I, 2)
ili za završni proces:
– (I, 2a)
Vraćajući se na kružni proces, dobijamo (iz jednačine I, 1):
= – = 0 (I, 3)
Dakle, vrijednost dU je ukupni diferencijal neke funkcije stanja sistema. Kada se sistem vrati u prvobitno stanje (nakon ciklične promjene), vrijednost ove funkcije dobiva svoju prvobitnu vrijednost.
Funkcija stanja sistema u, definisana jednakostima (I, 2) ili (I, 2a) naziva se unutrašnja energija sistemima .
Očigledno, izraz (I, 2a) se može napisati na sljedeći način:
\u003d U 2 - U 1 \u003d ∆U \u003d -(I, 2b)
U 2 – U 1 = ∆U \u003d Q - W
Ovo rezonovanje empirijski potkrepljuje postojanje određene funkcije stanja sistema, koja ima značenje ukupne mere svih kretanja koje sistem ima.
Drugim riječima, unutrašnja energija uključuje translacijsku i rotacijsku energiju molekula, energiju vibracija atoma i grupa atoma u molekuli, energiju kretanja elektrona, intranuklearnu i druge vrste energije, odnosno ukupnost svih vrsta čestica energije u sistemu, sa izuzetkom potencijalne i kinetičke energije samog sistema.
Pretpostavimo da se ciklički proces odvijao na način da nakon povratka sistema u početno stanje unutrašnja energija sistema nije poprimila početnu vrijednost, već se povećala. U tom slučaju bi ponavljanje kružnih procesa izazvalo akumulaciju energije u sistemu. Ovu energiju bilo bi moguće pretvoriti u rad i na taj način dobiti rad ne na račun topline, već „ni iz čega“, budući da su u kružnom procesu rad i toplina ekvivalentni jedno drugom, što pokazuju direktni eksperimenti. .
Nemogućnost završetka navedenog ciklusa izgradnje perpetuum mobile (perpetuum mobile) prve vrste, koji daje rad bez trošenja ekvivalentne količine druge vrste energije, dokazuje se negativnim rezultatom hiljada godina ljudskog iskustva. Ovaj rezultat dovodi do istog zaključka koji smo dobili u posebnom, ali rigoroznijem obliku analizom Jouleovih eksperimenata.
Formulirajmo još jednom dobijeni rezultat. Ukupna energija sistema (njegova unutrašnja energija) kao rezultat cikličkog procesa vraća se na svoju prvobitnu vrijednost, tj. unutrašnja energija sistema u datom stanju ima jednu određenu vrijednost i ne zavisi od toga šta mijenja sistem. prošao prije dolaska u ovo stanje.
Drugim riječima, unutrašnja energija sistema je nedvosmislena, kontinuirana i konačna funkcija stanja sistema.
Promena unutrašnje energije sistema određena je izrazom (I, 2b); izraz (I, 3) vrijedi za kružni proces. Sa beskonačno malom promenom nekih svojstava (parametara) sistema, beskonačno se menja i unutrašnja energija sistema. Ovo je svojstvo kontinuirane funkcije.
Unutar termodinamike, nema potrebe koristiti opštu definiciju pojma unutrašnje energije. Formalna kvantitativna definicija kroz izraze (I, 2) ili (I, 2a) dovoljna je za sva daljnja termodinamička razmišljanja i zaključke.
Pošto je unutrašnja energija sistema funkcija njegovog stanja, onda, kao što je već pomenuto, povećanje unutrašnje energije sa beskonačno malim promenama parametara stanja sistema predstavlja totalni diferencijal funkcije stanja. Rastavljanje integrala u jednadžbi (I, 3) na dva integrala po odsjecima puta od stanja 1 do države 2 (put "a") (vidi sliku I) i obrnuto - iz stanja 2 do države 1 (na drugi način "b" ), - dobijamo:
 (ja, 4)
(ja, 4)
 (ja, 5)
(ja, 5)
Do istog rezultata doći ćemo upoređujući puteve "a" i "c", ili "b" i "c", itd.

Rice. I. Šema kružnog (cikličkog) procesa.
Izraz (I, 5) to pokazuje povećanje unutrašnje energije sistema tokom njegovog prelaska iz jednog stanja u drugo ne zavisi od putanje procesa, već zavisi samo od početnog i konačnog stanja sistema.
Prvi zakon termodinamike
Prvi zakon termodinamike je direktno povezan sa zakonom održanja energije. Omogućava vam da izračunate ravnotežu energije u toku različitih procesa, uključujući hemijske reakcije.
Iz zakona održanja energije slijedi:
Q = ∆U + W
Rezultirajući izraz za zatvoreni sistem može se pročitati na sljedeći način: toplota koja se dovodi u sistem troši se samo na promenu unutrašnje energije i obavljanje posla.
Gornja izjava, vezana za jednačine (I, 3) i (I, 5), služi formulacija prvog zakona termodinamike(u kombinaciji sa jednačinom (I, 2) koja kvantificira unutrašnju energiju).
Prvi zakon termodinamike je kvantitativna formulacija zakona održanja energije primenjenog na procese povezane sa transformacijom toplote i rada.
Druga formulacija prvog zakona termodinamike može se dobiti iz izraza (I, 2a). U izolovanom sistemu dQ = 0 I dW = 0, zatim i dU=0; dakle, za sve procese koji se dešavaju u izolovanom sistemu:
![]() (I.6)
(I.6)
tj. unutrašnja energija izolovanog sistema je konstantna . Ova formulacija prvog zakona termodinamike je kvantitativni izraz opšteg zakona održanja energije primenjenog na specifične uslove i konačne sisteme, prema kojima se energija ne stvara ili nestaje.
Treba napomenuti da prvi zakon termodinamike ne omogućava da se pronađe ukupna vrijednost unutrašnje energije sistema u bilo kojem stanju, jer jednačine koje izražavaju prvi zakon vode do izračunavanja samo promjene energije sistema u raznim procesima. Slično, ne može se direktno mjeriti promjena unutrašnje energije u makroskopskim procesima; ovu promjenu je moguće samo izračunati pomoću jednačine (I, 2b), uzimajući u obzir mjerljive veličine - toplinu i rad ovog procesa.
Imajte na umu da toplota i rad (svaki posebno) nemaju svojstvo funkcije stanja izraženo jednadžbom (I, 3) ili (I, 5) i svojstveno unutrašnjoj energiji. Toplota i rad procesa koji sistem prenosi iz stanja 1 u stanje 2 zavise u opštem slučaju od putanje procesa i vrednosti δQ I δW nisu diferencijali funkcije stanja, već su jednostavno beskonačno male veličine, koje ćemo nazvati elementarna toplota I elementarni rad.
Dakle, razlika unutrašnje energije dU ima druga matematička svojstva osim elementarne toplote dQ i rad dW. Ovo je bitno za konstruisanje sistema termodinamike.
Jednačine stanja
Mnoga svojstva sistema u ravnoteži i njegovih sastavnih faza su međusobno zavisna. Promjena u jednom od njih uzrokuje promjenu u ostalima. Kvantitativne funkcionalne zavisnosti između svojstava sistema (faze) mogu se odraziti jednadžbama različitih tipova.
Od ovih jednačina, najvažnija je jednačina stanja faza, povezujući u integralni oblik pritisak, temperaturu, gustinu (ili zapreminu), sastav i druga svojstva svake faze sistema u ravnoteži.
Jednačina stanja je usko povezana sa termodinamičkim jednačinama sistema i njegovih homogenih delova (faza), ali se ne može u određenom obliku izvesti iz osnovnih jednačina termodinamike i mora se naći empirijski ili dobijena metodama statističke fizike, zasnovana na na molekularne parametre (tj. količine koje karakteriziraju strukturu i svojstva pojedinačnih molekula). Najjednostavnije jednačine stanja su jednadžbe za plinove pri niskim pritiscima: Clapeyron-Mendeleev jednačina, van der Waalsova jednačina itd.
Prisustvo jednačina stanja i drugih jednačina koje povezuju različita svojstva faze dovodi do činjenice da je za nedvosmislenu karakterizaciju stanja sistema dovoljno poznavati samo nekoliko, nekoliko nezavisnih svojstava. Ova svojstva se nazivaju nezavisne varijable ili parametri stanja sistemima. Preostala svojstva su funkcije parametara stanja i jednoznačno su određena ako su date vrijednosti potonjih. U ovom slučaju, za mnoge probleme nije važno da li znamo specifične jednačine stanja faza koje se proučavaju; važno je samo da odgovarajuće zavisnosti uvek zaista postoje.
Dakle, stanje sistema određuju nezavisne varijable (parametri stanja), čiji broj zavisi od prirode konkretnog sistema, a njihov izbor je, u principu, proizvoljan i povezan sa razmatranjima svrsishodnosti. Za određivanje stanja najjednostavnijih sistema - homogenih i konstantnih u vremenu po masi i sastavu (sastoje se od jedne faze i ne mijenjaju se kemijski) - dovoljno je poznavati dvije nezavisne varijable od tri (volumen V, pritisak P i temperaturu T). U složenijim sistemima, nezavisne varijable mogu uključivati koncentracije, električni naboj, elektrostatički potencijal, jačinu magnetnog polja i druge.
Kalorijski koeficijenti
Unutrašnja energija sistema, budući da je funkcija stanja, funkcija je nezavisnih varijabli (parametara stanja) sistema.
U najjednostavnijim sistemima
U = f (V, T) (I, 7)
odakle ukupni diferencijal U :
dU = dV + dT (1,8)
Zamjena vrijednosti dU od jednačine (I, 8) do jednačine (I, 2), nalazimo:
δQ = dV + dT + δW(I, 9)
Ako se u ispitivanom sistemu odvija samo rad ekspanzije i nema električnog rada, gravitacije, površinskih sila itd., tada d W = PDF. Onda
δQ = + P dV + dT(I, 9a)
Označavanje koeficijenata na diferencijalima nezavisnih varijabli u jednadžbi (I, 9a) simbolima l I ŽIVOTOPIS , dobijamo:
δQ = ldV + C V dT(1,10)
Jednačine (I, 9a) i (I, 10) impliciraju:
= l = + P(I.11)
= C V =
Količine I nisu derivati nijedne funkcije. Prvi je toplota izotermnog širenja tijelo. Ova veličina, čija se dimenzija poklapa sa dimenzijom pritiska, je zbir vanjskog pritiska i člana ; što odražava međusobnu privlačnost molekula. Ovaj pojam je mali za stvarne plinove i vrlo velik (u poređenju sa uobičajenim vrijednostima vanjskog tlaka) za tekućine i čvrste tvari.
Vrijednost ŽIVOTOPIS, prema jednačini (I, 11), je toplotni kapacitet pri konstantnoj zapremini. Toplina koju apsorbira sistem pri konstantnoj zapremini u potpunosti se troši na povećanje unutrašnje energije (pod uslovom da su odsutne sve vrste rada, uključujući rad ekspanzije).
Koeficijenti ukupnog diferencijala unutrašnje energije sa varijablama V I T imaju jednostavno fizičko značenje, kao što je prikazano gore.
Odabir kao nezavisne varijable P I T ili V I P i razmatrajući unutrašnju energiju kao funkciju ovih parova varijabli, možemo na sličan način dobiti:
d Q = HDP + C P dT(I, 10a)
d Q= c dV+ l dp(I, 10b)
gde su količine h, C P , c i l su povezani sa derivatima unutrašnje energije složenijim odnosima od onih prikazanih u jednačini (I, 11). Zapiši to C p = Tu je toplotni kapacitet pri konstantnom pritisku, A h = – toplota izotermnog povećanja pritiska. Posljednja vrijednost je u suštini negativna.
Odds l, h, C V , C P , c i λ se nazivaju omjeri kalorija. Imati nezavisno fizičko značenje (posebno C P,C V and l), one su također korisne pomoćne veličine u termodinamičkim zaključcima i proračunima.
Rad raznih procesa
Pod nazivom rada kombinuju se mnogi energetski procesi; zajedničko svojstvo ovih procesa je utrošak energije sistema za savladavanje sile koja djeluje izvana. Takvi procesi uključuju, na primjer, kretanje masa u potencijalnom polju. Ako je kretanje protiv gradijenta sile, tada sistem troši energiju u obliku rada; količina posla je pozitivna. Kada se kreće duž gradijenta sile, sistem prima energiju u obliku rada izvana; količina posla je negativna. Takav je rad podizanja poznate mase u gravitacionom polju. Elementarni rad u ovom slučaju:
d W = – mgdH
Gdje m- tjelesna masa; H je visina iznad početne nulte razine. Kada se sistem širi pod vanjskim pritiskom P, sistem radi , elementarni rad je u ovom slučaju jednak PdV (V 1 I V 2 - početni i konačni volumen sistema, respektivno).
Kada se električni naboj kreće q u električnom polju suprotno smjeru pada potencijala j i to u oblasti gde je potencijalna promena jednaka dj, kao i sa povećanjem naboja tijela koje ima potencijal j, po vrijednosti dq radi se na sistemu, njegova vrijednost je jednaka u prvom slučaju - qdj, au drugom slučaju jdq.
Na sličan način može se izraziti rad povećanja površine sučelja S između homogenih delova sistema (faze): d W=-s dS,
gdje je s površinski napon.
Generalno, elementarni rad dW je zbir nekoliko kvalitativno različitih elementarnih radova:
d W = Pd V- mgdH-s dS– j d q + … (1.12)
Evo P, -mg, -σ, -j su sile u generalizovanom smislu (generalizovane snage) ili faktori intenziteta; V, H, S, q – generalizovane koordinate ili faktori kapacitivnosti.
U svakom konkretnom slučaju potrebno je utvrditi koji su tipovi rada mogući u sistemu koji se proučava i, nakon što se sastave odgovarajući izrazi za dW, koristiti ih u jednadžbi (I, 2a). Integracija jednačine (I, 12) i proračun rada za određeni proces mogući su samo u slučajevima kada je proces u ravnoteži i jednačina stanja je poznata.
Za veliki broj sistema moguće je ograničiti niz jednačina (I, 12) na jedan pojam – rad ekspanzije.
Rad ekspanzije u ravnotežnim procesima izražava se različitim jednačinama koje slijede iz jednačine stanja. Evo nekih od njih:
1) Proces se odvija konstantnom zapreminom (izohorni proces; V = konst):
W = ∫δW = ∫PdV = 0(I, 13)
2) Proces se odvija pod konstantnim pritiskom (izobarski proces; P = konst):
W= = P (V 2 - V 1) \u003d PDV(I, 14)
3) Proces koji se odvija na konstantnoj temperaturi (izotermni proces, T = konst). Rad ekspanzije idealnog gasa, za koji PV=nRT:
W = dV = nRT log(I, 15)
Entalpija
Jednadžba prvog zakona termodinamike za procese u kojima se izvodi samo rad ekspanzije ima oblik:
δQ = dU + PdV(I, 19)
Ako se proces odvija pri konstantnom pritisku, tada integracijom dobijamo:
Q P \u003d U 2 - U 1 + P (V 2 - V 1)(ja, 20)
Q P \u003d (U 2 + PV 2) - (U 1 + PV 1)(I, 21)
Jer P I V– parametri stanja, a U je funkcija stanja, zatim zbir U+PV je također funkcija stanja i njena promjena u procesu ne zavisi od putanje procesa, već samo od početnog i konačnog stanja. Ova funkcija se zove entalpija i označen je simbolom H. Određivanje vrijednosti H identitet služi:
H U + PV(I, 22)
Iz jednadžbe (I, 21) slijedi da je toplina apsorbirana pri konstantnom pritisku jednaka povećanju entalpije D H i ne zavisi od putanje procesa:
![]() (I, 21a)
(I, 21a)
Drugi zakon termodinamike
Najčešći i svakako spontani procesi su prenos toplote sa toplog tela na hladno (toplotno provođenje) i prelazak rada u toplotu (trenje). Vekovna svakodnevna, tehnička i naučna praksa čovečanstva pokazala je svakodnevnu realnost ovih procesa, kao i nemogućnost spontanog nastajanja obrnutih procesa, koji su sa praktične tačke gledišta veoma primamljivi (dobivanje posla odvođenjem toplote od tela koja okružuju radno telo). To daje osnovu za tvrdnju da jedini rezultat bilo kojeg skupa procesa ne može biti prijenos topline sa manje zagrijanog tijela na više zagrijano. (Clausiusov postulat).
Obrnuta indikacija prijelaza topline sa više zagrijanog tijela na manje zagrijano je uobičajeni neravnotežni proces prijenosa topline vođenjem topline. Ne može se obrnuti, odnosno ne može se povući kroz isti niz stanja. Ali to nije dovoljno: ako bi se u sistemu odvijao proces direktnog prenosa toplote, onda se ni na koji način ne može izvršiti takav niz bilo kakvih procesa usled kojih bi se sva tela koja učestvuju u prenosu toplote vratila u svoje izvorno stanje i ne bi došlo do promjena u drugim tijelima. Proces provođenja toplote je nepovratan.
Drugi opšti stav, koji ima istu eksperimentalnu osnovu, kaže sledeće: jedini rezultat bilo kog skupa procesa ne može biti pretvaranje toplote u rad (tj. apsorpcija toplote iz okoline od strane sistema i oslobađanje ekvivalentnog rada na ovu vrućinu). Dakle, spontani proces pretvaranja rada u toplotu (trenjem) je nepovratan (baš kao i provođenje toplote).
Posljednju tvrdnju možemo navesti drugačije: toplina najhladnijih tijela koja učestvuju u procesu ne može poslužiti kao izvor rada (Tomsonov postulat).
Oba stava (postulati Clausiusa i Thomsona) su formulacije drugog zakona termodinamike i ekvivalentne su jedna drugoj, odnosno svaka od njih se može dokazati na osnovu druge.
Budući da se kao jedini rezultat procesa smatra prijenos topline ili njena transformacija u rad, očigledno je neophodno da se sistem koji učestvuje u razmjeni topline kao rezultat procesa ili kombinacije procesa vrati u prvobitno stanje. U takvom cikličnom procesu, unutrašnja energija sistema se neće promijeniti.
Pretpostavimo da je druga od gornjih formulacija (naročito u svom posljednjem obliku) netačna. Tada bi bilo moguće napraviti mašinu koja radi u ciklusima, čije bi se „radno telo“ povremeno vraćalo u prvobitno stanje, a ova mašina bi davala rad zbog toplote koja se apsorbuje spolja iz tela koje nije toplije od sistema. sebe i sva druga tela koja okružuju sistem. Takav proces bi se odvijao bez kršenja prvog zakona termodinamike (rad zbog toplote), ali za praksu je ekvivalentan dobijanju rada ni iz čega, budući da bi svaka mašina imala gotovo neiscrpan izvor toplote u okolini. Tako se brod mogao kretati, oduzimajući toplinu okeanske vode i ne treba mu gorivo. Takva mašina se zove perpetuum mobile (perpetuum mobile) druge vrste. Na osnovu ove definicije možemo formulisati drugi zakon termodinamike, dajući Thomsonovom postulatu drugačiji oblik: perpetuum mobile druge vrste je nemoguć.
Treba naglasiti da se i odredbe Clausiusa i Thomsona i tvrdnja da je perpetuum mobile druge vrste nemoguć, ne mogu dokazati na osnovu drugih zakona ili odredbi. To su pretpostavke koje su opravdane svim posljedicama koje iz njih proizlaze, ali se ne mogu dokazati za sve moguće slučajeve.
Dajemo još jednu formulaciju drugog zakona termodinamike, koja je, naravno, prilično tačna i sažeta. Ova formulacija sadrži postulat o postojanju nove funkcije stanja, kroz koji se izražava razlika između reverzibilnih i ireverzibilnih procesa:
Metode za izračunavanje entropije
Jednačine (II, 1) i (II, 1a), koje određuju entropiju, jedine su početne jednačine za termodinamički proračun promjene entropije sistema. Zamjenom elementarne topline u jednačini (II, 1a) njenim izrazima u terminima kalorijskih koeficijenata (vidi jednačine (I, 10) i (I, 10a)), dobijamo za ravnotežne procese:
kJ/mol; temperatura topljenja t sq. \u003d 5,5 ° C ( T= 278,5 TO). Dakle, promena entropije je 1 krtica benzen tokom topljenja (entropija topljenja) jednaka je:
DS sq. = 35,06J/mol
2. Zagrijavanje pri konstantnom pritisku (izobarni proces; P = konst). Iz jednačina (I, 18a) i (II, 1a) dobijamo:
D.S. =(II, 6)
Nađimo promjenu entropije jednog mola aluminija kada se zagrije od 25 do 600°C. Pravi molarni toplotni kapacitet aluminijuma može se izraziti jednadžbom:
C p = 565,5 + 0,290 T. Prema jednačini (II, 6), promjena entropije će biti jednaka:
DS = = 565,5 + 0,290 (873 - 298) = 607,8 + 166,8 = 774,6 J/molK
Plankov postulat. Apsolutne vrijednosti entropije
Po jednačini (II, 3) nemoguće je izračunati apsolutnu vrijednost entropije sistema. Ovu mogućnost pruža nova, nedokaziva pozicija koja ne sledi iz dva zakona termodinamike, koju je formulisao M. Planck (1912). Prema ovoj odredbi, tzv Plankov postulat, entropija pojedinačne kristalne supstance na apsolutnoj nuli je nula:
Strogo govoreći, Planckov postulat vrijedi samo za pojedinačne tvari čiji su kristali idealno građeni (u kristalnoj rešetki su svi čvorovi zauzeti molekulima ili atomima, koji se redovito izmjenjuju i pravilno orijentirani). Takvi kristali se nazivaju idealne čvrste materije. Pravi kristali nisu takvi, jer njihova kristalna rešetka nije savršeno izgrađena.
Entropija kristalne rešetke izgrađene do neke mjere nasumično je veća od entropije savršeno izgrađene kristalne rešetke. Stoga, pravi kristali čak i na 0 K imaju entropiju veću od nule. Međutim, entropije pravih dobro formiranih kristala pojedinačnih supstanci na apsolutnoj nuli su male.
U skladu s Planckovim postulatom, jednačina (II, 6) za idealno kruto tijelo imat će oblik:
Planckov postulat se koristi u termodinamičkom proučavanju kemijskih procesa za izračunavanje apsolutnih vrijednosti entropije kemijskih spojeva - veličina koje su od velike važnosti u proračunu kemijskih ravnoteža.
Entropija se široko koristi u tehničkoj termodinamici (inženjering topline), kao jedan od važnih parametara radnog fluida u toplotnom stroju, na primjer, vodene pare. Entropijske vrijednosti vodene pare u datom stanju izračunavaju se u poređenju sa nekim standardnim stanjem - obično 0°C i 1 amm. Ove vrijednosti entropije se koriste za konstruiranje tzv dijagrami entropijskog stanja vodena para u koordinatama S-T ili S-H(Mollierov dijagram). U takvim dijagramima, poput dijagrama V-P moguće je prikazati različite procese koji se dešavaju u radnom telu toplotnog motora i koji čine radne cikluse mašine.
U zaključku, treba napomenuti da ne moramo ulaziti u područje termodinamike. Naša svrha je samo da ilustrujemo glavne ideje ove nauke i objasnimo razloge zbog kojih je moguće graditi na njenim argumentima.
Konačno, dva zakona termodinamike se često formuliraju na sljedeći način:
Prvi zakon: Energija univerzuma je uvijek konstantna.
Drugi zakon: Entropija univerzuma se uvek povećava.
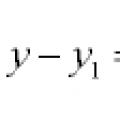 Jednačine linija i krivulja u ravnini
Jednačine linija i krivulja u ravnini Uopštene homogene jednačine Generalizovane homogene jednačine drugog reda
Uopštene homogene jednačine Generalizovane homogene jednačine drugog reda Hvala zarezu Zbog činjenice da je u njihovoj
Hvala zarezu Zbog činjenice da je u njihovoj