Značaj saharoze za organizam. Hemijska svojstva saharoze
Pitanje 1. Saharoza. Njegova struktura, svojstva, priprema i primjena.
Odgovori. Eksperimentalno je dokazano da je molekularni oblik saharoze
– C 12 H 22 O 11 . Molekul sadrži hidroksilne grupe i sastoji se od međusobno povezanih ostataka molekula glukoze i fruktoze.
Čista saharoza – bezbojna kristalna supstanca slatkog ukusa, veoma rastvorljiv u vodi.
1. Podložno hidrolizi:
C 12 H 22 O 11 + H2O C 6 H 12 O 6 + C 6 H 12 O 6
2. Saharoza je nereducirajući šećer. Ne daje reakciju „srebrnog ogledala“, ali reaguje sa bakar (II) hidroksidom kao polihidričnim alkoholom, bez redukcije Cu (II) u Cu (I).
Biti u prirodi
Saharoza je dio soka šećerne repe (16-20%) i šećerne trske (14-26%). Nalazi se u malim količinama zajedno sa glukozom u plodovima i lišću mnogih zelenih biljaka.
Potvrda:
1. Šećerna repa ili šećerna trska se melju u sitne strugotine i stavljaju u difuzore kroz koje prolazi topla voda.
2. Dobijeni rastvor se tretira krečnim mlekom, formira se rastvorljivi saharat kalcijum alkoholata.
3. Za razgradnju kalcijum saharoze i neutralizaciju viška kalcijum hidroksida, ugljični monoksid (IV) se propušta kroz otopinu:
C 12 H 22 O 11 CaO 2H 2 + CO 2 = C 12 H 22 O 11 + CaCO 3 + 2H 2 O
4. Rastvor dobijen nakon taloženja kalcijum karbonata se filtrira, zatim upari u vakuum aparatu i kristali šećera se odvajaju centrifugiranjem.
5. Izolirani granulirani šećer obično ima žućkastu boju, jer sadrži tvari za bojenje. Da bi se odvojili, saharoza se otapa u vodi i propušta kroz aktivni ugljen.
primjena:
Saharoza se uglavnom koristi kao prehrambeni proizvod i u konditorskoj industriji. Od njega se hidrolizom dobiva umjetni med.
Pitanje 2. Osobine smještaja elektrona u atomima elemenata malih i velikih perioda. Stanja elektrona u atomima.
Odgovori. Atom je kemijski nedjeljiva, električno neutralna čestica materije. Atom se sastoji od jezgra i elektrona koji se kreću po određenim orbitalama oko njega. Atomska orbitala je prostor oko jezgra unutar kojeg će se najvjerovatnije naći elektron. Orbitale se takođe nazivaju elektronskim oblacima. Svaka orbitala ima specifičnu energiju, kao i oblik i veličinu oblaka elektrona. Grupi orbitala za koje su energetske vrijednosti bliske dodjeljuje se jednom energetskom nivou. Energetski nivo ne može sadržavati više od 2n 2 elektrona, gdje je n broj nivoa.
Vrste elektronskih oblaka: sferni - s-elektroni, po jedna orbitala na svakom energetskom nivou; u obliku bučice - p-elektroni, tri orbitale p x, p y, p z; u obliku nalik na dva ukrštena gantea, - d- elektrona, pet orbitala d xy, d xz, d yz, d 2 z, d 2 x – d 2 y.
Distribucija elektrona je završena nivoi energije odražava elektronsku konfiguraciju elementa.
Pravila za punjenje energetskih nivoa elektronima i
podnivoa.
1. Punjenje svakog nivoa počinje sa s-elektronima, zatim se p-, d- i f-energetski nivoi popunjavaju elektronima.
2. Broj elektrona u atomu jednak je njegovom atomskom broju.
3. Broj energetskih nivoa odgovara broju perioda u kojem se element nalazi.
4. Maksimalni broj elektrona na energetskom nivou određen je formulom
Gdje je n broj nivoa.
5. Ukupan broj elektrona per atomske orbitale jedan energetski nivo.
Na primjer, aluminij, nuklearno punjenje je +13
Distribucija elektrona po energetskim nivoima – 2,8,3.
13 Al:1s 2 2s 2 2p 6 3s 2 3p 1 .
U atomima nekih elemenata uočen je fenomen curenja elektrona.
Na primjer, u hromu, elektroni sa 4s podnivoa skaču na 3d podnivo:
24 Cr 1s 2 2s 2 2p 6 3s 2 3d 5 3d 5 4s 1 .
Elektron se kreće sa 4s podnivoa na 3d jer su 3d 5 i 3d 10 konfiguracije energetski povoljnije. Elektron zauzima poziciju u kojoj je njegova energija minimalna.
Do popunjavanja energetskog f-podnivoa elektronima dolazi u elementu 57La -71 Lu.
Pitanje 3. Prepoznati supstance KOH, HNO 3, K 2 CO 3.
odgovor: KOH + fenolftalen → grimizna boja rastvora;
NHO 3 + lakmus → crvena boja rastvora,
K 2 CO 3 + H 2 SO 4 = K 2 SO 4 + H 2 0 + CO 2
Ulaznica broj 20
pitanje 1 . Genetska veza organska jedinjenja raznih klasa.
odgovor: Dijagram lanca hemijske transformacije:
C 2 H 2 → C 2 H 4 → C 2 H 6 → C 2 H 5 Cl → C 2 H 5 OH → CH 3 CHO → CH 3 COOH
C 6 H 6 C 2 H 5 OH CH 2 =CH-CH=CH 2 CH 3 COOC 2 H 5
C 6 H 5 Cl CH 3 O-C 2 H 5 C 4 H 10
C 2 H 2 + H 2 = C 2 H 4,
alkin alken
C 2 H 4 + H 2 = C 2 H 6,
alken alkan
C 2 H 6 + Cl 2 = C 2 H 5 Cl + HCl,
C 2 H 5 Cl + NaOH = C 2 H 5 OH + NaCl,
hloroalkan alkohol
C 2 H 5 OH + 1/2O 2 CH 3 CHO + H 2 O,
aldehidni alkohol
CH 3 CHO + 2Cu(OH) 2 = CH 3 COOH + 2CuOH + H 2 O,
C 2 H 4 + H 2 O C 2 H 5 OH,
alkenski alkohol
C 2 H 5 OH + CH 3 OH = CH 3 O-C 2 H 5 + H 2 O,
alkohol alkohol etar
3C 2 H 2 C 6 H 6,
alkin aren
C 6 H 6 + Cl 2 = C 6 H 5 Cl + HCl,
C 6 H 5 Cl + NaOH = C 6 H 5 OH + NaCl,
C 6 H 5 OH + 3Br 2 = C 6 H 2 Br 3 OH + 3HBr;
2C 2 H 5 OH = CH 2 = CH-CH = CH 2 + 2H 2 O + H 2,
alkohol dien
CH 2 = CH-CH = CH 2 + 2H 2 = C 4 H 10.
dien alkane
Alkani - ugljovodonici sa općom formulom C n H 2 n +2, koji ne dodaju vodonik i druge elemente.
Alkeni su ugljikovodici opće formule C n H 2 n, u čijim molekulima postoji jedna dvostruka veza između atoma ugljika.
Dienski ugljovodonici uključuju organska jedinjenja sa općom formulom C n H 2 n -2, čiji molekuli imaju dvije dvostruke veze.
Ugljovodonici opšte formule C n H 2 n -2, čiji molekuli imaju jednu trostruku vezu, pripadaju nizu acetilena i nazivaju se alkini.
Spojevi ugljika s vodikom, čije molekule sadrže benzenski prsten, klasifikovani su kao aromatični ugljovodonici.
Alkoholi su derivati ugljikovodika u čijim je molekulima jedan ili više atoma vodika zamijenjeno hidroksilnim grupama.
Fenoli uključuju derivate aromatični ugljovodonici, u čijim molekulima su hidroksilne grupe povezane sa benzenskim prstenom.
aldehidi- organska materija koji sadrže funkcionalnu grupu CHO (aldehidnu grupu).
Karboksilne kiseline su organske supstance čije molekule sadrže jednu ili više karboksilnih grupa povezanih sa ugljikovodičnim radikalom ili atomom vodika.
TO estri To uključuje organske tvari koje nastaju u reakcijama kiselina s alkoholima i sadrže skupinu C(O)-O-C atoma.
Pitanje 2. Vrste kristalne rešetke. Karakteristike supstanci sa razne vrste kristalne rešetke.
Odgovori. Kristalna rešetka je prostorna struktura, uređena relativnim rasporedom čestica supstance, koja ima nedvosmislen, prepoznatljiv motiv.
U zavisnosti od vrste čestica koje se nalaze na mestima rešetke, razlikuju se: jonske (ICR), atomske (ACR), molekularne (MCR), metalne (Met. KR), kristalne rešetke.
MKR – čvorovi sadrže molekul. Primjeri: led, vodonik sulfid, amonijak, kisik, dušik u čvrstom stanju. Sile koje djeluju između molekula su relativno slabe, tako da tvari imaju malu tvrdoću, niske temperature ključanja i topljenja, slaba rastvorljivost u vodi. IN normalnim uslovima to su plinovi ili tekućine (dušik, vodikov peroksid, čvrsti CO 2). Supstance sa MCR su klasifikovane kao dielektrici.
AKR - atomi u čvorovima. Primeri: bor, ugljenik (dijamant), silicijum, germanijum. Atomi su čvrsto povezani kovalentne veze, dakle, supstance su okarakterisane visoke temperature ključanja i topljenja, visoke čvrstoće i tvrdoće. Većina ovih supstanci je nerastvorljiva u vodi.
IFR – kationi i anjoni u čvorovima. Primjeri: NaCl, KF, LiBr. Ova vrsta mreže nalazi se na spojevima sa jonski tip veze (metal-nemetal). Supstance su vatrostalne, slabo isparljive, relativno jake, dobre provodljivosti električna struja, visoko rastvorljiv u vodi.
Met. KR je rešetka tvari koja se sastoji samo od atoma metala. Primjeri: Na, K, Al, Zn, Pb, itd. Stanje agregaciječvrsta, nerastvorljiva u vodi. Pored alkalnih i zemnoalkalnih metala, provodnici električne struje, tačke ključanja i topljenja kreću se od srednjih do veoma visokih.
Pitanje 3. Zadatak. Za sagorevanje 70 g sumpora potrebno je 30 litara kiseonika. Odredite zapreminu i količinu supstance koja je nastala sumpordioksidom.
Dato: Pronađite:
m(S) = 70 g, V(SO 2) = ?
V(O 2) = 30 l. v(SO 2) = ?
Rješenje:
m=70 G V= 30 l x l
S + O 2 = SO 2.
v: 1 mol 1 mol 1 mol
M: 32 g/mol -- --
V: -- 22,4 l 22,4 l
V(O 2) teor. = 70 * 22,4/32 = 49 l (O 2 nedostaje, računa se na osnovu toga).
Kako je V(SO 2) = V(O 2), onda je V(SO 2) = 30 l.
v(SO 2) = 30/22,4 = 1,34 mol.
Odgovori. V(SO 2) = 30 l, v = 1,34 mol.
Struktura i izgled saharoze
Disaharidi se sastoje od dva monosaharidna ostatka povezana glikozidnom vezom. Mogu se smatrati O-glikozidima, u kojima je aglikon ostatak monosaharida. Opšta formula disaharida je obično C12H22O11.
Postoje dvije moguće opcije za formiranje glikozidne veze:
- 1) zbog glikozidnog hidroksila jednog monosaharida i alkoholnog hidroksila drugog monosaharida;
- 2) zbog glikozidnih hidroksila oba monosaharida.
Disaharid formiran prvom metodom sadrži slobodni glikozidni hidroksil, zadržava sposobnost podvrgavanja ciklo-okso-tautomerizmu i ima redukciona svojstva (laktoza, maltoza, celobioza).
Disaharid formiran drugom metodom ne sadrži slobodni glikozidni hidroksil. Takav disaharid nije sposoban za ciklo-okso-tautomerizam i nereducira (saharoza, trehaloza) /1/.
Saharoza C12H22O11, ili šećer od repe, šećer od trske, u svakodnevnom životu samo šećer - disaharid koji se sastoji od dva monosaharida - b-glukoze i b-fruktoze, izuzetno je rasprostranjen u biljkama, a posebno ga ima u korijenu repe (od 14. do 20%), kao i u stabljikama šećerne trske (od 14 do 25%). Saharoza je transportni šećer u obliku kojeg se ugljik i energija transportuju kroz biljku. Upravo u obliku saharoze ugljikohidrati se kreću od mjesta sinteze (listova) do mjesta gdje se skladište (plodovi, korijenje, sjemenke).
Saharoza je vrlo čest disaharid u prirodi; nalazi se u velikom broju voća, voća i bobica. Sadržaj saharoze posebno je visok u šećernoj repi i šećernoj trsci za koje se koristi industrijska proizvodnja stolni šećer. Saharoza svira ogromnu ulogu u ishrani ljudi. Feature saharoza - lakoća njene hidrolize u kiseli rastvor- brzina njene hidrolize je približno 1000 puta veća od brzine hidrolize maltoze ili laktoze. Saharoza ima visoku rastvorljivost. Hemijski je fruktoza prilično inertna, tj. kada se kreće s jednog mjesta na drugo, gotovo da ne učestvuje u metabolizmu. Ponekad se saharoza pohranjuje kao rezervni nutrijent.
Saharoza, ulazeći u crijevo, brzo se hidrolizira alfa-glukozidazom u tankom crijevu u glukozu i fruktozu, koje se zatim apsorbiraju u krv. Inhibitori alfa-glukozidaze, kao što je akarboza, inhibiraju razgradnju i apsorpciju saharoze, kao i drugih ugljikohidrata hidroliziranih alfa-glukozidazom, posebno škroba. Koristi se u liječenju dijabetesa tipa 2.
Sinonimi: alfa-D-glukopiranozil-beta-D-fruktofuranozid, šećer od repe, šećer od trske.
Kristali saharoze su bezbojni monoklinski kristali. Kada se rastopljena saharoza stvrdne, formira se amorfna providna masa - karamela /7/.
Saharoza se sastoji od a-D-glukopiranoze i b-D-fruktofuranoze, povezanih a-1>b-2 vezom zbog glikozidnih hidroksila (slika 1):
Rice. 1
Saharoza ne sadrži slobodni hemiacetal hidroksil, pa nije sposobna za oksi-okso tautomerizam i predstavlja neredukcioni disaharid /2/.
Kada se zagrije s kiselinama ili pod djelovanjem enzima a-glukozidaze i b-fruktofuranozidaze (invertaze), saharoza se hidrolizira da nastane mješavina jednakih količina glukoze i fruktoze, koja se naziva invertni šećer (slika 2).
Rice. 2 Hidroliza saharoze zagrijavanjem sa kiselinama ili pod djelovanjem enzima
Hemijska svojstva saharoze
U rastvoru saharoze ne dolazi do otvaranja prstena, tako da nema svojstva aldehida.
1) Hidroliza (u kiseloj sredini):
C 12 H 22 O 11 + H 2 O → C 6 H 12 O 6 + C 6 H 12 O 6.
saharoza glukoza fruktoza
2) Pošto je polihidrični alkohol, saharoza daje plavu boju rastvoru kada reaguje sa Cu(OH) 2.
3) Interakcija sa kalcijum hidroksidom da bi se formirala kalcijum saharoza.
4) Saharoza ne reaguje sa rastvorom amonijaka srebrnog oksida, pa se naziva neredukcioni disaharid.
Polisaharidi.
Polisaharidi– ugljikohidrati visoke molekularne težine koji nisu slični šećeru koji sadrže od deset do stotine hiljada ostataka monosaharida (obično heksoza) povezanih glikozidnim vezama.
Najvažniji polisaharidi su škrob i celuloza (vlakna). Izgrađeni su od ostataka glukoze. Opšta formula ovih polisaharida je (C 6 H 10 O 5) n. U formiranju molekula polisaharida najčešće učestvuju glikozidni (na C 1 atomu) i alkoholni (na C 4 atomu) hidroksili, tj. formira se (1–4)-glikozidna veza.
Sa tačke gledišta opšti principi Strukturno, polisaharidi se mogu podijeliti u dvije grupe, i to: homopolisaharidi, koji se sastoje od monosaharidnih jedinica samo jedne vrste, i heteropolisaharidi koje karakterizira prisustvo dvije ili više vrsta monomernih jedinica.
Sa funkcionalnog gledišta, polisaharidi se također mogu podijeliti u dvije grupe: strukturne i rezervne polisaharide. Važni strukturni polisaharidi su celuloza i hitin (u biljkama i životinjama, odnosno u gljivama), a glavne rezervne polisaharidi su glikogen i škrob (kod životinja, kao i u gljivama, odnosno biljkama). Ovdje će se razmatrati samo homopolisaharidi.
celuloza (vlakna)− najrasprostranjeniji strukturni polisaharid biljnog svijeta.
Dom komponenta biljna ćelija, sintetiziran u biljkama (drvo sadrži do 60% celuloze). Celuloza ima veliku mehaničku čvrstoću i djeluje kao potporni materijal za biljke. Drvo sadrži 50-70% celuloze, pamuk je skoro čista celuloza.
Čista celuloza je bijela vlaknasta tvar, bez ukusa i mirisa, nerastvorljiva u vodi i drugim rastvaračima.
Molekule celuloze imaju linearnu strukturu i veliku molekulsku masu, sastoje se samo od nerazgranatih molekula u obliku niti, jer oblik ostataka β-glukoze onemogućava helikalizaciju Celuloza se sastoji od molekula nalik na niti koji vodonične veze hidroksilne grupe unutar lanca, kao i između susjednih lanaca, skupljaju se u snopove. Upravo ovo pakovanje lanaca obezbeđuje visoku mehaničku čvrstoću, vlaknastost, nerastvorljivost u vodi i hemijsku inertnost, što celulozu čini idealnim materijalom za izgradnju ćelijskih zidova.
Celuloza se sastoji od ostataka α,D-glukopiranoze u njihovom obliku β-piranoze, tj. u molekuli celuloze monomerne jedinice β-glukopiranoze su linearno povezane jedna s drugom β-1,4-glukozidnim vezama:
Djelomičnom hidrolizom celuloze nastaje celobiozni disaharid, a s potpuna hidroliza- D-glukoza. Molekularna masa celuloza 1 000 000-2 000 000. Vlakna se ne vare enzimima gastrointestinalnog trakta, jer skup ovih enzima ljudskog gastrointestinalnog trakta ne sadrži β-glukozidazu. Međutim, poznato je da prisustvo optimalnih količina vlakana u hrani potiče stvaranje fecesa. At potpuno isključenje vlakna iz hrane ometaju stvaranje fecesa.
Škrob- polimer istog sastava kao i celuloza, ali sa elementarnom jedinicom koja predstavlja ostatak α-glukoze:

Molekuli škroba su umotani večina molekuli su razgranati. Molekularna težina škroba je manja od molekulske težine celuloze.
Škrob je amorfna supstanca, Bijeli prah, koji se sastoji od sitnih zrna, nerastvorljivih u hladnom vodom, ali djelimično rastvorljiv u vrućem.
Škrob je mješavina dva homopolisaharida: linearnog - amiloze i razgranatog - amilopektina, opšta formula od kojih (C 6 H 10 O 5) n.
Kada se škrob obradi toplom vodom, moguće je izdvojiti dvije frakcije: frakciju topljivu u toploj vodi i koja se sastoji od amiloznog polisaharida i frakciju koja samo bubri u toploj vodi i formira pastu i koja se sastoji od amilopektin polisaharida.
Amiloza ima linearnu strukturu, ostaci α, D-glukopiranoze su povezani (1–4)-glikozidnim vezama. Jedinična ćelija amiloze (i skroba općenito) predstavljena je na sljedeći način:

Molekul amilopektina je izgrađen na sličan način, ali ima grane u lancu, što stvara prostornu strukturu. Na tačkama grananja, ostaci monosaharida su povezani (1-6)-glikozidnim vezama. Između tačaka grananja obično se nalazi 20-25 ostataka glukoze.
 (amilopektin)
(amilopektin)
U pravilu, sadržaj amiloze u škrobu je 10-30%, amilopektina - 70-90%. Škrobni polisaharidi se grade od ostataka glukoze povezanih u amilozu i u linearne lance amilopektina α-1,4-glukozidnim vezama, a na tačkama grananja amilopektina međulančanim α-1,6-glukozidnim vezama.
Molekul amiloze sadrži u prosjeku oko 1000 ostataka glukoze; pojedinačni linearni dijelovi molekule amilopektina sastoje se od 20-30 takvih jedinica.
U vodi amiloza ne daje pravi rastvor. Lanac amiloze u vodi formira hidratizirane micele. U rastvoru, kada se doda jod, amiloza postaje obojena Plava boja. Amilopektin također proizvodi micelarne otopine, ali je oblik micela malo drugačiji. Polisaharid amilopektin je obojen jodom u crveno-ljubičasto.
Škrob ima molekulsku težinu od 10 6 -10 7. Sa djelimičnim kisela hidrolizaŠkrob proizvodi polisaharide nižeg stepena polimerizacije - dekstrine; potpunom hidrolizom - glukozu. Škrob je najvažniji ugljikohidrat u ishrani za ljude. Škrob se formira u biljkama tokom fotosinteze i deponuje se kao „rezervni“ ugljeni hidrat u korenu, krtolama i semenu. Na primjer, zrna pirinča, pšenice, raži i drugih žitarica sadrže 60-80% škroba, gomolji krompira - 15-20%. Srodnu ulogu u životinjskom svijetu igra i polisaharid glikogen, koji se „pohranjuje“ uglavnom u jetri.
Glikogen− glavni rezervni polisaharid viših životinja i ljudi, izgrađen od ostataka α-D-glukoze. Empirijska formula glikogen, poput škroba (C 6 H 10 O 5) n. Glikogen se nalazi u gotovo svim organima i tkivima životinja i ljudi; najveći broj nalazi se u jetri i mišićima. Molekularna težina glikogena je 10 7 -10 9 i više. Njegov molekul je izgrađen od razgranatih poliglukozidnih lanaca, u kojima su ostaci glukoze povezani α-1,4-glukozidnim vezama. Na tačkama grananja postoje α-1,6-glukozidne veze. Glikogen je po strukturi blizak amilopektinu.
U molekuli glikogena postoje unutrašnje grane - sekcije poliglukozidnih lanaca između tačaka grananja, i spoljašnje grane - delovi od periferne tačke grananja do neredukcionog kraja lanca. Tokom hidrolize, glikogen se, kao i skrob, razgrađuje da bi se prvo formirali dekstrini, zatim maltoza i, konačno, glukoza.
Chitin− strukturni polisaharid nižih biljaka, posebno gljiva, kao i beskičmenjaka (uglavnom člankonožaca). Hitin se sastoji od ostataka 2-acetamido-2-deoksi-D-glukoze povezanih β-1,4-glukozidnim vezama.
Uobičajeni slatki šećer koji se koristi u svakodnevnom životu naziva se saharoza. To je oligosaharid koji pripada grupi disaharida. Formula saharoze je C 12 H 22 O 11.
Struktura
Molekul sadrži ostatke dva ciklična monosaharida - α-glukoze i β-fruktoze. Strukturna formula Supstanca se sastoji od cikličkih formula fruktoze i glukoze povezanih atomom kisika. Strukturne jedinice međusobno povezani glikozidnom vezom formiranom između dva hidroksila.

Rice. 1. Strukturna formula.
Molekuli saharoze formiraju molekularnu kristalnu rešetku.
Potvrda
Saharoza je najčešći ugljikohidrat u prirodi. Ovo jedinjenje se nalazi u voću, bobicama i listovima biljaka. Velika količina gotove supstance nalazi se u repi i šećernoj trsci. Dakle, saharoza se ne sintetizira, već se izoluje fizičkim djelovanjem, probavom i pročišćavanjem.

Rice. 2. Šećerna trska.
Cvekla ili šećerna trska se sitno izrendaju i stavljaju u velike kotlove sa vruća voda. Saharoza se ispere kako bi se formirao rastvor šećera. Sadrži razne nečistoće - pigmente za bojenje, proteine, kiseline. Da bi se odvojila saharoza, rastvoru se dodaje kalcijum hidroksid Ca(OH) 2. Kao rezultat, formiraju se talog i kalcijum saharat C 12 H 22 O 11 CaO 2H 2 O kroz koji se propušta ugljični dioksid ( ugljen-dioksid). Kalcijum karbonat se taloži, a preostali rastvor se ispari dok se ne formiraju kristali šećera.
Fizička svojstva
Basic fizičke karakteristike supstance:
- molekulska težina - 342 g/mol;
- gustina - 1,6 g/cm 3 ;
- tačka topljenja - 186°C.

Rice. 3. Kristali šećera.
Ako se rastopljena tvar nastavi zagrijavati, saharoza će se početi raspadati i mijenjati boju. Kada se rastopljena saharoza stvrdne, formira se karamela - amorfna prozirna tvar. U 100 ml vode na normalnim uslovima Može se rastvoriti 211,5 g šećera, na 0°C - 176 g, na 100°C - 487 g. U 100 ml etanola pod normalnim uslovima može se rastvoriti samo 0,9 g šećera.
Kada uđe u crijeva životinja i ljudi, saharoza se pod djelovanjem enzima brzo razlaže na monosaharide.
Hemijska svojstva
Za razliku od glukoze, saharoza ne pokazuje svojstva aldehida zbog odsustva aldehidne grupe -CHO. Zbog toga kvalitativna reakcija nema „srebrnog ogledala“ (interakcija sa rastvorom amonijaka Ag 2 O). Oksidacija bakar(II) hidroksidom ne proizvodi crveni bakar(I) oksid, već svijetlo plavu otopinu.
Glavna hemijska svojstva su opisana u tabeli.
Saharoza nije sposobna za oksidaciju (nije redukciono sredstvo u reakcijama) i naziva se nereducirajući šećer.
Aplikacija
Šećer unutra čista forma koristi se u Prehrambena industrija za proizvodnju vještačkog meda, slatkiša, konditorskih proizvoda, alkohola. Za proizvodnju se koristi saharoza razne supstance: limunska kiselina, glicerin, butanol.
U medicini se saharoza koristi za pravljenje mješavina i praha za maskiranje neugodnog okusa.
Šta smo naučili?
Saharoza ili šećer je disaharid koji se sastoji od ostataka glukoze i fruktoze. Slatkastog je ukusa i lako se rastvara u vodi. Supstanca je izolirana iz repe i šećerne trske. Saharoza je manje aktivna od glukoze. Podvrgava se hidrolizi, reagira s bakar (II) hidroksidom, formirajući bakar saharat i ne oksidira. Šećer se koristi u hrani hemijska industrija, lijek.
Testirajte na temu
Evaluacija izvještaja
prosječna ocjena: 4.3. Ukupno primljenih ocjena: 29.
Saharoza C 12 H 22 O 11, ili šećer od repe, šećer od trske, u svakodnevnom životu to je jednostavno šećer - disaharid iz grupe oligosaharida, koji se sastoji od dva monosaharida - α-glukoze i β-fruktoze.

 Hemijska svojstva saharoze
Hemijska svojstva saharoze
Važna hemijska osobina saharoze je njena sposobnost da se podvrgne hidrolizi (kada se zagreva u prisustvu jona vodonika).
Budući da vezu između monosaharidnih ostataka u saharozi formiraju oba glikozidna hidroksila, nema obnavljajuća svojstva i ne daje reakciju "srebrnog ogledala". Saharoza zadržava svojstva polihidričnih alkohola: stvara saharate rastvorljive u vodi sa hidroksidima metala, posebno kalcijum hidroksidom. Ova reakcija se koristi za izolaciju i pročišćavanje saharoze u tvornicama šećera, o čemu ćemo govoriti nešto kasnije.
Kada se zagreje vodeni rastvor saharoza u prisustvu jakih kiselina ili pod dejstvom enzima invertaza se dešava hidroliza ovaj disaharid stvara mješavinu jednakih količina glukoze i fruktoze. Ova reakcija je obrnuta od procesa stvaranja saharoze iz monosaharida:
Dobivena smjesa se zove invertni šećer a koristi se za proizvodnju karamela, zaslađivanje namirnica, za sprečavanje kristalizacije saharoze, za proizvodnju vještačkog meda i za proizvodnju polihidričnih alkohola.
Odnos prema hidrolizi

Hidrolizu saharoze je lako pratiti pomoću polarimetra, jer otopina saharoze ima pravu rotaciju, a rezultirajuća smjesa D- glukoze i D- fruktoza ima lijevu rotaciju zbog dominantne lijeve rotacije D-fruktoze. Posljedično, kako se saharoza hidrolizira, ugao desne rotacije postepeno se smanjuje, prolazeći kroz null vrijednost, a na kraju hidrolize, otopina koja sadrži jednake količine glukoze i fruktoze dobija stabilnu lijevu rotaciju. S tim u vezi, hidrolizirana saharoza (mješavina glukoze i fruktoze) naziva se invertni šećer, a sam proces hidrolize naziva se inverzija (od latinskog inversia - prevrtanje, preuređivanje).
Struktura maltoze i celobioze. Odnos prema hidrolizi






Maltoza i skrob. Sastav, struktura i svojstva. Odnos prema hidrolizi


Fizička svojstva
Maltoza je lako rastvorljiva u vodi i slatkog je ukusa. Molekularna težina maltoze je 342,32. Tačka topljenja maltoze je 108 (bezvodna).
Hemijska svojstva
Maltoza je redukcijski šećer jer ima nesupstituiranu hemiacetalnu hidroksilnu grupu.
Kuvanjem maltoze sa razblaženom kiselinom i pod dejstvom enzima maltoza hidrolizuje (nastaju dva molekula glukoze C 6 H 12 O 6).

Škrob (C 6 H 10 O 5) n polisaharidi amiloze i amilopektina, čiji je monomer alfa-glukoza. Škrob, koji sintetiziraju različite biljke u hloroplastima pod uticajem svetlosti tokom fotosinteze, donekle se razlikuje po strukturi zrna, stepenu polimerizacije molekula, strukturi polimernih lanaca i fizičko-hemijskim svojstvima.



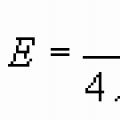 Ostrogradsky–Gaussova teorema
Ostrogradsky–Gaussova teorema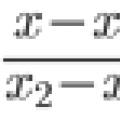 Kako naučiti rješavati probleme u analitičkoj geometriji?
Kako naučiti rješavati probleme u analitičkoj geometriji? Značenje riječi merkantilan Značenje riječi trgovački
Značenje riječi merkantilan Značenje riječi trgovački