Aplikacija skandija. Značenje riječi skandij Tačka topljenja skandijuma
Jednostavna supstanca
heksagonalni (α-Sc)
a=3,309 c=5,268 (α-Sc)
(300 K) 15,8 W/(mK)
| 21 | |
| 3d 1 4s 2 | |
Biti u prirodi
Geohemija i mineralogija
Prosječan sadržaj skandijuma u zemljinoj kori je 10 g/t. Po hemijskim i fizičkim svojstvima bliski skandiju su itrijum, lantan i lantanidi. U svim prirodnim jedinjenjima, skandij, baš kao i njegovi analozi aluminijum, itrijum, lantan, pokazuje pozitivnu valencu tri, stoga ne učestvuje u redoks procesima. Skandij je element u tragovima i nalazi se u mnogim mineralima. Naime, poznata su 2 minerala skandija: tortveit (Sc, Y) 2 Si 2 O 7 (Sc 2 O 3 do 53,5%) i steretit Sc 2H 2 O (Sc 2 O 3 do 39,2%). Relativno male koncentracije nalaze se u oko 100 minerala. Zbog činjenice da su svojstva skandijuma bliska , , , 2+ , 2+ , TR (retkozemni elementi), , , , , najveći dio je raspršen u mineralima koji sadrže ove elemente. Dolazi do izovalentne supstitucije skandijuma za elemente TR grupe, posebno u suštinski itrijumskim mineralima (ksenotim, Sc - Y asocijacija u tortvejtu i supstitucija Al u berilu). Heterovalentna supstitucija Fe 2+ i magnezijuma skandijem u piroksenima, amfibolima, olivinu i biotitu rasprostranjena je u mafičnim i ultramafičnim stijenama, a supstitucija cirkonija se javlja u kasnim fazama magmatskog procesa i u pegmatitima.
Glavni mineralni nosači skandijuma: fluorit (do 1% Sc 2 O 3), kasiterit (0,005-0,2%), volframit (0-0,4%), ilmenorutil (0,0015-0,3%), torijanit (0,46% Sc 2 O 3), samarskit (0,45%), viikit (1,17%), ksenotim (0,0015-1,5%), beril (0,2%), bazit (skandijum beril, 3-14,44%). Tokom formiranja magmatskih stijena i njihovih venskih derivata, glavnina skandijuma je raspršena uglavnom u tamno obojenim mineralima magmatskih stijena i u maloj mjeri koncentrirana u pojedinačnim mineralima postmagmatskih formacija. Najveće (30 g/t Sc 2 O 3) koncentracije skandijuma su ograničene na ultramafične i mafične stijene, u kojima vodeću ulogu imaju željezo-magnezijumski minerali (piroksen, amfibol i biotit). U stijenama prosječnog sastava prosječan sadržaj Sc 2 O 3 je 10 g/t, u kiselim stijenama 2 g/t. Ovdje je skandij također raspršen u tamno obojenim mineralima (hornblende, biotit) i nalazi se u muskovitu, cirkonu i sfenu. Koncentracija u morskoj vodi je 0,00004 mg/l.
Mjesto rođenja
Najznačajnija nalazišta tortveitita (minerala najbogatijeg skandijem) nalaze se na Madagaskaru i Norveškoj.
Priča
Fizička svojstva
Hemijska svojstva
Hemijska svojstva skandijuma su slična onima aluminijuma. U većini jedinjenja, skandij pokazuje oksidaciono stanje od +3. Kada je izložen zraku, kompaktni metal postaje obložen na površini oksidnim filmom. Kada se zagrije na crvenu toplinu, reagira s fluorom, kisikom, dušikom, ugljikom i fosforom. Na sobnoj temperaturi reaguje sa hlorom, bromom i jodom. Reaguje sa razrijeđenim jakim kiselinama; koncentrirane oksidirajuće kiseline i HF se pasiviraju. Reaguje sa koncentrovanim rastvorima alkalija.
Jon Sc 3+ je bezbojan, dijamagnetičan, koordinacioni broj u vodenim rastvorima je 6. Kao iu slučaju aluminijuma, skandijev hidroksid je amfoteričan i rastvara se iu višku kiselina i u višku lužina; ne reaguje sa razblaženim rastvorom amonijaka. Skandijev hlorid, bromid, jodid i sulfat su vrlo topljivi u vodi, otopina ima kiselu reakciju zbog djelomične hidrolize, a hidratacija bezvodnih soli je praćena brzim oslobađanjem topline. Skandijev fluorid i fosfat su nerastvorljivi u vodi, ali fluorid će se rastvoriti u prisustvu viška fluoridnih jona i formirati ScF 6 3-. Skandijev karbid, nitrid, fosfid, sulfid i karbonat se potpuno hidroliziraju vodom. Organska jedinjenja skandijuma su relativno termički stabilna, ali burno reaguju sa vodom i vazduhom. Izgrađeni su uglavnom pomoću Sc-C σ veza i predstavljeni su alkil derivatima i polimernim ciklopentadienidima.
Poznata su i jedinjenja sa nižim stepenom oksidacije skandijuma (+2, +1, 0). Jedan od najjednostavnijih je tamnoplavi čvrsti CsScCl 3 . Ova tvar sadrži veze između atoma skandijuma. Skandijev monohidrid ScH je poznat u gasnoj fazi. Takođe, niža oksidaciona stanja skandijuma nalaze se u organometalnim jedinjenjima. .
Potvrda
Treba napomenuti da postoje značajni resursi skandijuma u pepelu od uglja i problem razvoja tehnologije izdvajanja skandijuma pri preradi uglja u vještačko tekuće gorivo.
Svjetski resursi skandija
Skandij je dispergovani litofilni element (stimenski element), stoga je za tehnologiju ekstrakcije ovog elementa važno da se u potpunosti ekstrahuje iz prerađenih ruda, a razvojem metalurgije ruda koje sadrže skandij povećavaće se njegov godišnji obim proizvodnje. Ispod su glavne rude nosača i masa povezanog skandijuma oslobođenog iz njih:
- Boksiti - 71 milion tona prerade godišnje, sadrže prateći skandij u količini od 710-1420 tona;
- Rude uranijuma - 50 miliona tona godišnje, prateći skandij 50-500 tona godišnje;
- Ilmeniti - 2 miliona tona godišnje, povezani skandij 20-40 tona godišnje;
- Volframiti - povezani skandij oko 30-70 tona godišnje;
- Kasiterit - 200 hiljada tona godišnje, povezani skandij 20-25 tona godišnje;
- Cirkoni - 100 hiljada tona godišnje, povezani skandij 5-12 tona godišnje.
Ukupno je poznato više od stotinu minerala koji sadrže skandij, a vlastiti minerali (tortveitit, jervisit) su vrlo rijetki.
Skandij je prisutan u uglju, a njegovo vađenje se može postići preradom visokopećne troske koja je započeta posljednjih godina u nizu razvijenih zemalja.
Proizvodnja i potrošnja skandija
Godine 1988. svjetska proizvodnja skandijevog oksida bila je:
| Zemlja | Obim proizvodnje, ni manje ni više kg/god |
|---|---|
| kina | 50 |
| Francuska | 100 |
| Norveška | 120 |
| SAD | 500 |
| Japan | 30 |
| Kazahstan | 700 |
| Ukrajina | 610 |
| Rusija | 958 |
Treba uzeti u obzir kolosalne resurse skandijuma u Rusiji i bivšem Sovjetskom Savezu (podaci o proizvodnji su vrlo raštrkani, ali obim proizvodnje, prema nezavisnim stručnjacima, jednak je ili veći od službene svjetske proizvodnje). Generalno, prema nezavisnim stručnjacima, trenutno su glavni proizvođači skandijuma (skandijevog oksida) Rusija, Kina, Ukrajina i Kazahstan. Količine skandij/skandij oksida objavljene u štampi u SAD-u, Japanu i Francuskoj su uglavnom sekundarni metali i metali koji se kupuju na svjetskom tržištu. U određenoj mjeri, u narednim godinama se očekuje značajan obim sirovina skandijuma iz Australije, Kanade i Brazila.
Također treba napomenuti da su rezerve rijetkih zemnih sirovina u Mongoliji koje sadrže skandij također obećavajući izvor skandijuma za industriju skandijuma i razvoj metalurgije skandijuma.
Skandij se sa sigurnošću može nazvati metalom 21. stoljeća i može se predvidjeti nagli porast njegove proizvodnje, rast cijena i potražnje zbog prerade ogromne količine kamenog uglja (posebno prerade ruskog kamenog uglja) u tekuće gorivo.
Aplikacija
metalurgija
Upotreba skandijuma u obliku nečistoće za mikrolegiranje ima značajan uticaj na niz praktično važnih legura, na primer, dodavanje 0,4% skandijuma aluminijum-magnezijum legurama povećava vlačnu čvrstoću za 35%, a granicu tečenja za 65-84%, a istovremeno relativno izduženje ostaje na nivou od 20-27%. Dodatak 0,3-0,67% hromu povećava njegovu otpornost na oksidaciju do temperature od 1290°C, a sličan, ali još izraženiji efekat ima i na toplotno otporne legure kao što je "nihrom" iu ovoj oblasti upotreba skandij je mnogo efikasniji od itrijuma. Skandijev oksid ima niz prednosti u odnosu na druge okside za proizvodnju visokotemperaturne keramike, na primjer, čvrstoća skandijevog oksida se povećava kada se zagrije i dostiže maksimum na 1030 °C, dok u isto vrijeme skandijev oksid ima minimalnu toplinsku provodljivost i najveća otpornost na termički udar. Itrijum skandat je jedan od najboljih materijala za konstrukcije koje rade na visokim temperaturama. Određena količina skandijevog oksida se stalno troši za proizvodnju germanatnih stakala za optoelektroniku.
Legure skandija
Glavna primjena skandijuma u smislu zapremine je njegova upotreba u aluminij-skandij legurama koje se koriste u sportskoj opremi (motocikli, bicikli, bejzbol palice, itd.) - gdje god su potrebni materijali visoke čvrstoće. Kada je legiran aluminijumom, skandij daje dodatnu snagu i savitljivost.
Na primjer, legiranje aluminijum-magnezij legure AMg6 sa skandijem u nedostatku dodatnog otvrdnjavanja povećava vlačnu čvrstoću sa 32 na 36 kgf/mm 2, a granicu tečenja - sa 16 na 24 kgf/mm 2 (nakon 30% hladnog otvrdnjavanja isti pokazatelji su 42 i 33 kgf/mm 2 za AMg6NPP naspram 45 i 36 kgf/mm 2 za leguru 01570N). Za usporedbu, vlačna čvrstoća čistog skandijuma je oko 400 MPa (40 kgf/mm 2), za titan, na primjer, 250-350 MPa, a za nelegirani itrij - 300 MPa. Upotreba legura skandijuma u vazduhoplovstvu i civilnom raketiranju značajno će smanjiti troškove transporta i dramatično povećati pouzdanost operativnih sistema, dok će istovremeno, uz smanjenje cena skandijuma, njegova upotreba i za proizvodnju automobilskih motora značajno produžavaju njihov vijek trajanja i djelomično efikasnost. Takođe je veoma važno da skandij ojačava aluminijumske legure legirane hafnijem.
Važno i praktično neistraženo područje primjene skandijuma je činjenica da, kao i legiranje aluminija sa itrijumom, legiranje čistog aluminija sa skandijem također povećava električnu provodljivost žica, a efekat oštrog ojačanja ima velike izglede za upotrebu. takve legure za prijenos električne energije (elektrovodi). Legure skandija su najperspektivniji materijali u proizvodnji vođenih projektila. Brojne posebne legure skandijuma i kompoziti skandijskih veza su vrlo perspektivni u oblasti projektovanja skeleta kiborga. Posljednjih godina otkrivena je važna uloga skandijuma (i dijelom itrijuma i lutecija) u proizvodnji nekih super-čvrstih marage čelika, čiji su neki uzorci pokazali čvrstoću preko 700 kg/mm2 (preko 7000 MPa ).
Određena količina skandijuma se koristi za legiranje legura nikla otpornih na toplinu sa hromom i željezom (nikrom i fechral) kako bi se dramatično produžio vijek trajanja kada se koristi kao namotaj za grijanje otpornih peći.
Supertvrdi materijali
Skandij se koristi za proizvodnju supertvrdih materijala. Na primjer, legiranje titanovog karbida sa skandij karbidom vrlo naglo povećava mikrotvrdoću (2 puta), što ovaj novi materijal čini četvrtim najtvrđim nakon dijamanta (oko 98,7-120 GPa), nitrida bora (borazona), (oko 77-87 GPa) , legura bor-ugljik-silicijum (oko 68-77 GPa), i znatno veća od bor karbida (43,2-52 GPa), silicijum karbida (37 GPa), mikrotvrdoća legure skandij karbida i titanijum karbida je oko 53 ,4 GPa (za titanijum karbid, na primer, 29,5 GPa). Posebno su zanimljive legure skandijuma sa berilijumom, koje imaju jedinstvene karakteristike u pogledu čvrstoće i otpornosti na toplotu.
Laserski materijali
Visokotemperaturna supravodljivost, proizvodnja laserskih materijala (HSGG). Galij-skandij-gadolinijum granat (GSGG), kada je dopiran jonima hroma i neodimijuma, omogućio je postizanje efikasnosti od 4,5% i snimanje parametara u frekvencijskom režimu generisanja ultrakratkih impulsa, što pruža veoma optimistične preduslove za stvaranje ultra-moćnih laserski sistemi za proizvodnju termonuklearnih mikroeksplozija na bazi čistog deuterijuma (inercijalna fuzija) u vrlo bliskoj budućnosti. Na primjer, očekivano je [od koga?] da će u narednih 10-13 godina laserski materijali na bazi GSGG i skandij borata preuzeti vodeću ulogu u razvoju i opremanju aktivnih odbrambenih laserskih sistema za avione i helikoptere u razvijenim zemljama, a paralelno s tim i razvoj velikih -razmjerna termonuklearna energija korištenjem helijuma-3, u mješavinama s helijumom-3 već je dobivena laserska termonuklearna mikroeksplozija.
Proizvodnja solarnih panela
Skandijev oksid legiran holmijum oksidom koristi se u proizvodnji fotokonvertera na bazi silicija kao premaz. Ovaj premaz ima širok raspon prozirnosti (400-930 nm) i smanjuje spektralnu refleksiju svjetlosti sa silicijuma na 1-4%, a kada se koristi u ovako modificiranoj fotoćeliji, struja kratkog spoja se povećava za 35-70% , što vam zauzvrat omogućava povećanje izlazne snage fotokonvertera za 1,4 puta.
MHD generatori
Skandijev kromit se koristi kao jedan od najboljih i najtrajnijih materijala za izradu elektroda MHD generatora; u glavnu keramičku masu dodaje se prethodno oksidirani krom i sinterira, što daje materijalu povećanu čvrstoću i električnu provodljivost. Uz cirkonijum dioksid kao elektrodni materijal za MHD generatore, skandij kromit ima veću otpornost na eroziju spojevima cezija (koristi se kao aditiv za formiranje plazme).
Rendgenska ogledala
Skandij se široko koristi za proizvodnju višeslojnih rendgenskih ogledala (kompozicije: skandij-volfram, skandij-hrom, skandij-molibden). Skandijev telurid je vrlo perspektivan materijal za proizvodnju termoelemenata (visoke toplotne emf, 255 μV/K i niske gustine i velike čvrstoće).
Poslednjih godina, vatrostalne legure (intermetalna jedinjenja) skandijuma sa renijumom (tačka topljenja do 2575 °C), rutenijumom (tačka topljenja do 1840 °C), gvožđem (tačka topljenja do 1600 °C), (otpornost na toplotu, umjerene gustine itd.).
Vatrootporni materijali
Skandijev oksid (tačka topljenja 2450 °C) igra važnu ulogu kao vatrostalni materijal posebne namjene u proizvodnji mlaznica za izlivanje čelika za livenje visokolegiranih čelika.Po otpornosti u strujanju tečnog metala, skandijev oksid nadmašuje sve poznati i korišteni materijali (na primjer, najstabilniji itrijum oksid inferiorniji od skandijevog oksida za faktor 8,5) i može se reći da su nezamjenjivi u ovoj oblasti. Njegovu rasprostranjenu upotrebu sputava samo veoma visoka cijena, a u određenoj mjeri alternativno rješenje u ovoj oblasti je upotreba itrijum skandata, ojačanih brkovima aluminijevog oksida radi povećanja čvrstoće), kao i upotreba skandijevog tantalata .
Proizvodnja kubnog cirkonija
Skandijev oksid igra važnu ulogu u proizvodnji kubnog cirkonija, gdje je najbolji stabilizator.
Fosfori
Skandij borat, kao i itrijum borat, koristi se u elektronskoj industriji kao matrica za fosfor.
Biološka uloga
Skandij ne igra nikakvu biološku ulogu.
vidi takođe
Napišite recenziju o članku "Skandij"
Bilješke
- Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O'Connor, Thomas Walczyk, Shige Yoneda, Xiang-Kun Zhu.(engleski) // Pure and Applied Chemistry. - 2013. - Vol. 85, br. 5 . - P. 1047-1078. - DOI:10.1351/PAC-REP-13-03-02.
- Urednički tim: Zefirov N. S. (glavni urednik). Hemijska enciklopedija: u 5 tomova - Moskva: Sovjetska enciklopedija, 1995. - T. 4. - P. 360. - 639 str. - 20.000 primeraka. - ISBN 5-85270-039-8.
- J.P. Riley i Skirrow G. Chemical Oceanography V. 1, 1965
- Mendeljejev D. I.// Časopis ruskog hemijskog društva. - 1871. - T. III. - str. 25-56.
- Corbett, J.D. (1981). "Produžena veza metal-metal u halogenidima ranih prelaznih metala." Acc. Chem. Res. 14 (8): 239–246. DOI:10.1021/ar00068a003.
- Smith, R. E. (1973). "Dijatomski hidridni i deuteridni spektri prelaznih metala drugog reda." Proceedings of the Royal Society of London. Serija A, Matematičke i fizičke nauke 332 (1588): 113–127. DOI:10.1098/rspa.1973.0015. Bibcode:.
- (1996) “Prvi primjer formalnog skandija(I) kompleksa: sinteza i molekularna struktura trostrukog skandija s 22 elektrona koji uključuje novi 1,3,5-trifosfabenzenski prsten.” J. Am. Chem. Soc. 118 (32): 7630–7631. DOI:10.1021/ja961253o.
- (1991) “η-Aren kompleksi skandijuma(0) i skandijuma(II).” J. Chem. Soc., Chem. Commun.(19): 1372-1373. DOI:10.1039/C39910001372.
- (2002) “Stabilizacija dijamagnetskog Sc I Br molekula u strukturi nalik sendviču.” Organometali 21 (13): 2590–2592. DOI:10.1021/om020090b.
- (1998) “Prvi stabilni skandocen: sinteza i karakterizacija bis(η-2,4,5-tri-tert-butil-1,3-difosfaciklopentadienil)skandijuma(II).” Chem. Commun.(7): 797-798. DOI:10.1039/A800089A.
- makeyev.msk.ru/pub/msys/1997/technology.html
- (engleski) . www.lenntech.com. Pristupljeno 19. septembra 2009. .
Književnost
- Kogan. B.I., Nazvanova. V.A. Scandium. - M.: Izdavačka kuća Akademije nauka Ukrajinske SSR, 1963. - 304 str. iz illus.
Linkovi
| Periodni sistem hemijskih elemenata D. I. Mendeljejeva | |||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Sc | |||||||||||||||||||||||||||||||||||
| Uut | Uup | Uus | Uuo | ||||||||||||||||||||||||||||||||
| Uue | Ubn | Ubu | Ubb | Ubt | Ubq | UBP | Ubh | ||||||||||||||||||||||||||||
Izvod koji karakterizira skandijOna se graciozno, ali i dalje nasmijana, povukla, okrenula i pogledala svog muža. Oči princa Andreja bile su zatvorene: delovao je tako umorno i pospano.- Spreman si? – upitao je suprugu, osvrćući se oko nje. Princ Hipolit je žurno obukao kaput, koji je na njegov novi način bio duži od njegovih potpetica, i, zaplevši se u njega, otrčao je na trijem za princezom, koju je lakaj podizao u kočiju. "Princezo, au revoir, [Princezo, zbogom", viknuo je, petljajući se jezikom kao i nogama. Princeza je, podigavši haljinu, sjela u mrak kočije; njen muž je ispravljao sablju; Princ Ipolit je, pod izgovorom da služi, svima smetao. „Izvinite, gospodine“, rekao je princ Andrej suvo i neprijatno na ruskom princu Ipolitu, koji ga je sprečavao da prođe. "Čekam te, Pjer", reče isti glas princa Andreja nežno i nežno. Kočija je krenula, a kočija je zveckala točkovima. Princ Hipolit se naglo nasmijao, stojeći na trijemu i čekajući vikonta, kojeg je obećao da će odvesti kući. "Eh bien, mon cher, votre petite princesse est tres bien, tres bien," rekao je vikont ulazeći u kočiju s Hipolitom. – Mais très bien. - Poljubio je vrhove prstiju. - Et tout a fait francaise. [Pa, draga moja, tvoja mala princeza je jako slatka! Veoma slatka i savršena Francuskinja.] U susjednoj prostoriji zašuštala je ženska haljina. Kao da se probudio, knez Andrej se stresao, a lice mu je poprimilo isti izraz kao u dnevnoj sobi Ane Pavlovne. Pjer je spustio noge sa sofe. Princeza je ušla. Već je bila u drugačijoj, domaćoj, ali jednako elegantnoj i svježoj haljini. Princ Andrej je ustao, ljubazno pomerajući stolicu za nju. Prijatelji su ćutali. Ni jedan ni drugi nisu počeli da govore. Pjer je bacio pogled na princa Andreja, princ Andrej je malom rukom protrljao čelo. Bilo je već dva sata ujutro kada je Pjer napustio svog prijatelja. Bila je to junska noć, noć Sankt Peterburga, mračna noć. Pjer je ušao u taksi s namjerom da ode kući. Ali što se više približavao, više je osjećao da je nemoguće zaspati te noći, koja je više ličila na večer ili jutro. Vidjelo se u daljini kroz prazne ulice. Dragi Pjer se prisjetio da se te večeri uobičajeno kockarsko društvo trebalo okupiti kod Anatola Kuragina, nakon čega bi obično bilo piće koje bi se završavalo jednom od Pjerovih omiljenih zabava. | |||||||||||||||||||||||||||||||||||
Scandium(Skandij) Sc, hemijski element III gr. periodni sistem, atomski broj 21, atomska masa 44,9559; pripada retkim zemljanim elementima. Jedan poznati prirodni stabilni izotop je 45Sc. Presjek zahvata termičkih neutrona je 1,66,10-21 m2. Konfiguracija vanjskih elektronskih omotača atoma je 3d14s2; stabilno oksidaciono stanje + 3, rijetko + 1, + 2; energija jonizacije pri sukcesivnom prelaz iz Sc0 u Sc3+ jednaki su 6,5616, 12,80 i 24,76 eV, respektivno; afinitet elektrona - 0,73 eV; Paulingova elektronegativnost 1,3; atomski radijus 0,164 nm, jonski radijus Sc3+ 0,089 nm (koordinacioni broj 6), 0,101 nm (8).
Skandij je rasprostranjeni litofilni element, geohemijski blizak itrij grupi REE, Mg, Al, Mh, Zr i Ti. Prosječan sadržaj skandijuma u zemljinoj kori 1. 10-3% težinski, koncentracija skandijuma u riječnim vodama 4,10-8 g/l. pod zemljom (2,2-5) x x 10-8 g/l, u okeanskoj vodi -8,10-10 g/l. Poznato je više od 120 mineralnih nosača SCANDIUM Proprietary. SCANDIUM minerali (veoma rijetki): tortveitit (Sc,Y)2Si2O7, bazzit Sc2Be3Si6Ol8, jervisit NaScSi2O6, kaskandit CaScSi3O8(OH), kolbekit (egonit) ScPO4. 2H2 O.
|
Biti u prirodiGeohemija i mineralogija Prosječan sadržaj skandijuma u zemljinoj kori je 10 g/t. Po hemijskim i fizičkim svojstvima bliski skandiju su itrijum, lantan i lantanidi. U svim prirodnim jedinjenjima, skandij, kao i njegovi analozi aluminijum, itrijum, lantan, pokazuje pozitivnu valencu tri, stoga ne učestvuje u redoks procesima. Skandij je element u tragovima i nalazi se u mnogim mineralima. Naime, poznata su 2 minerala skandija: tortveit (Sc, Y)2 Si2O7 (Sc2O3 do 53,5%) i steretit Sc. 2H2O (Sc2O3 do 39,2%). Relativno male koncentracije nalaze se u oko 100 minerala. Zbog činjenice da su svojstva skandijuma bliska Mg, Al, Ca, Mn2+, Fe2+, TR (retkozemni elementi), Hf, Th, U, Zr, njegov najveći dio je raspršen u mineralima koji sadrže ove elemente. Dolazi do izovalentne supstitucije skandijuma za elemente TR grupe, posebno u suštinski itrijumskim mineralima (ksenotim, Sc-Y asocijacija u Thorthwaite-u i Al supstitucija u berilu). Heterovalentna supstitucija Fe2+ i magnezijuma skandijem u piroksenima, amfibolima, olivinu i biotitu rasprostranjena je u mafičnim i ultramafičnim stijenama, a supstitucija cirkonija se javlja u kasnim fazama magmatskog procesa i u pegmatitima. Glavni mineralni nosači skandijuma: fluorit (do 1% Sc2O3), kasiterit (0,005-0,2%), volframit (0-0,4%), ilmenorutil (0,0015-0,3%), torijanit (0,46% Sc2O3), samarskit (0,45%), viikit (1,17%), ksenotim (0,0015-1,5%), beril (0,2%), bazit (skandijum beril, 3-14, 44%). Tokom formiranja magmatskih stijena i njihovih venskih derivata, glavnina skandijuma je raspršena pretežno u tamno obojenim mineralima magmatskih stijena i u maloj mjeri koncentrirana u pojedinačnim mineralima postmagmatskih formacija. Najveće (30 g/t Sc2O3) koncentracije skandijuma su ograničene na ultramafične i mafične stijene, u kojima vodeću ulogu imaju željezo-magnezijumski minerali (piroksen, amfibol i biotit). U stijenama prosječnog sastava prosječan sadržaj Sc2O3 je 10 g/t, u kiselim stijenama 2 g/t. Ovdje je skandij također raspršen u tamno obojenim mineralima (hornblende, biotit) i nalazi se u muskovitu, cirkonu i sfenu. Koncentracija u morskoj vodi je 0,00004 mg/l. Hemijska svojstvaHemijska svojstva skandijuma su slična onima aluminijuma. U svim jedinjenjima, skandij pokazuje oksidacijsko stanje od +3. Kada je izložen zraku, kompaktni metal postaje obložen na površini oksidnim filmom. Kada se zagrije na crvenu toplinu, reagira s fluorom, kisikom, dušikom, ugljikom i fosforom. Na sobnoj temperaturi reaguje sa hlorom, bromom i jodom. Reaguje sa razrijeđenim jakim kiselinama; koncentrirane oksidirajuće kiseline i HF se pasiviraju. Reaguje sa koncentrovanim rastvorima alkalija. Jon Sc3+ je bezbojan, dijamagnetičan, koordinacioni broj u vodenim rastvorima je 6. Kao iu slučaju aluminijuma, skandijev hidroksid je amfoteričan i rastvara se iu višku kiselina i u višku lužina; ne reaguje sa razblaženim rastvorom amonijaka. Skandijev hlorid, bromid, jodid i sulfat su vrlo topljivi u vodi, otopina ima kiselu reakciju zbog djelomične hidrolize, a hidratacija bezvodnih soli je praćena brzim oslobađanjem topline. Skandijev fluorid i fosfat su nerastvorljivi u vodi, ali fluorid će se rastvoriti u prisustvu viška fluoridnih jona i formirati ScF63-. Skandijev nitrid, sulfid i karbonat potpuno su hidrolizirani vodom. Organska jedinjenja skandijuma su relativno termički stabilna, ali burno reaguju sa vodom i vazduhom. Izgrađeni su uglavnom pomoću Sc-C σ veza i predstavljeni su alkil derivatima i polimernim ciklopentadienidima. PotvrdaTreba napomenuti da postoje značajni resursi skandijuma u pepelu od uglja i problem razvoja tehnologije izdvajanja skandijuma pri preradi uglja u vještačko tekuće gorivo. Svjetski resursi skandijaSkandij je dispergovani litofilni element (stimenski element), stoga je za tehnologiju ekstrakcije ovog elementa važno da se u potpunosti ekstrahuje iz prerađenih ruda, a razvojem metalurgije ruda koje sadrže skandij povećavaće se njegov godišnji obim proizvodnje. Ispod su glavne rude nosača i masa povezanog skandijuma oslobođenog iz njih: Boksiti - 71 milion tona prerade godišnje, sadrže prateći skandij u količini od 710-1420 tona; Scandium Prisutan je u uglju i za njegovo vađenje je moguće prerađivati ljevačku šljaku iz visokih peći, koja je započeta posljednjih godina u nizu razvijenih zemalja. Aplikacija1. Metalurgija |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
metalurgija
Upotreba skandijuma u obliku nečistoće za mikrolegiranje ima značajan uticaj na niz praktično važnih legura, na primer, dodavanje 0,4% skandijuma legurama aluminijum-magnezijum povećava vlačnu čvrstoću za 35%, a granicu tečenja za 65-84%, a istovremeno relativno izduženje ostaje na nivou od 20-27%. Dodatak 0,3-0,67% hromu povećava njegovu otpornost na oksidaciju do temperature od 1290 °C, a sličan ali još izraženiji efekat ima i na toplotno otporne legure kao što je „nihrom” i u ovoj oblasti upotreba skandijuma je mnogo efikasniji od itrijuma. Skandijev oksid ima niz prednosti u odnosu na druge okside za proizvodnju visokotemperaturne keramike, budući da se čvrstoća skandijevog oksida povećava pri zagrijavanju i dostiže maksimum na 1030 °C, dok istovremeno skandijev oksid ima minimalnu toplinsku provodljivost i najveća otpornost na termički udar. Itrijum skandat je jedan od najboljih materijala za konstrukcije koje rade na visokim temperaturama. Određena količina skandijevog oksida se stalno troši za proizvodnju germanatnih stakala za optoelektroniku.
Glavna primjena skandijuma u smislu zapremine je njegova upotreba u aluminij-skandij legurama koje se koriste u sportskoj opremi (motocikli, bejzbol palice, itd.) - gdje god su potrebni materijali visoke čvrstoće. Kada je legiran aluminijumom, skandij daje dodatnu snagu i savitljivost. Zatezna čvrstoća čistog skandijuma je oko 400 MPa (40 kgf/mm2), za titan, na primjer, 250-350 MPa, a za nelegirani itrij 300 MPa. Upotreba legura skandijuma u vazduhoplovstvu i raketnoj industriji značajno će smanjiti troškove transporta i naglo povećati pouzdanost operativnih sistema, dok će istovremeno, uz niže cene skandijuma i njegove upotrebe za proizvodnju automobilskih motora, značajno povećati njihov vijek trajanja i djelomično njihovu efikasnost. Takođe je veoma važno da skandij ojačava aluminijumske legure legirane hafnijem. Važno i praktično neistraženo područje primjene skandijuma je činjenica da, kao i legiranje aluminija sa itrijumom, legiranje čistog aluminija sa skandijem također povećava električnu provodljivost žica, a efekat oštrog ojačanja ima velike izglede za upotrebu. takve legure za prijenos električne energije (elektrovodi). Legure skandija su najperspektivniji materijali u proizvodnji vođenih projektila. Brojne posebne legure skandijuma i kompoziti vezani za skandij su vrlo perspektivni u oblasti projektovanja skeleta kiborga. Posljednjih godina otkrivena je značajna uloga skandijuma (i djelimično itrijuma i lutecija) u proizvodnji nekih super-čvrstih marage čelika, čiji su neki uzorci pokazali čvrstoću od preko 700 kg/mm2 (preko 7000 MPa).
Određena količina skandijuma se koristi za legiranje legura nikla otpornih na toplinu sa hromom i željezom (nikrom i fechral) kako bi se dramatično produžio vijek trajanja kada se koristi kao namotaj za grijanje otpornih peći.
Supertvrdi materijali
Skandij se koristi za proizvodnju supertvrdih materijala. Na primjer, legiranje titanovog karbida sa skandij karbidom vrlo naglo povećava mikrotvrdoću (2 puta), što ovaj novi materijal čini četvrtim najtvrđim nakon dijamanta (oko 98,7 - 120 GPa), borovog nitrida (borazona), (oko 77-87 GPa) , legura bor-ugljik-silicijum (oko 68-77 GPa), i znatno veća od bor karbida (43,2 - 52 GPa), silicijum karbida (37 GPa), mikrotvrdoća legure skandij karbida i titanijum karbida je oko 53 ,4 GPa (za titanijum karbid, na primer, 29,5 GPa). Posebno su zanimljive legure skandijuma sa berilijumom, koje imaju jedinstvene karakteristike u pogledu čvrstoće i otpornosti na toplotu.
Na primjer, skandijev berilid (1 atom skandijuma i 13 atoma berilija) ima najveću povoljnu kombinaciju gustine, čvrstoće i visoke tačke topljenja, te može biti najbolji materijal za konstrukciju zrakoplovne tehnologije, nadmašujući u tom pogledu najbolji na bazi titana. legure koje su poznate čovječanstvu i niz kompozitnih materijala (uključujući niz materijala na bazi ugljičnih i borovih filamenata).
Mikroelektronika
Skandijev oksid (tačka topljenja 2450 °C) igrao je vitalnu ulogu u proizvodnji superkompjutera: feriti niske indukcije, kada se koriste u uređajima za skladištenje informacija, omogućavaju nekoliko puta povećanje brzine razmjene podataka zbog smanjenja preostale indukcije od 2 - 3 kGauss do 0. 8 - 1 kGauss.)
Izvori svjetlosti
Oko 80 kg skandijuma (kao dio Sc2O3) godišnje se koristi za proizvodnju rasvjetnih elemenata visokog intenziteta. Skandijum jodid se dodaje živinim gasnim lampama, stvarajući veoma realistične izvore veštačke svetlosti blizu sunca, koji daju dobar prikaz boja kada se snimaju televizijskom kamerom.
Izotopi skandija
Radioaktivni izotop 46Sc (vrijeme poluraspada 83,83 dana) koristi se kao „oznaka“ u industriji prerade nafte, za kontrolu metalurških procesa i liječenje tumora raka.
Izotop skandij-47 (poluživot 3,35 dana) jedan je od najboljih izvora pozitrona.
Nuklearna energija
Nuklearna industrija uspješno koristi skandij hidrid i deuterid - odlične moderatore neutrona i metu (booster) u moćnim i kompaktnim neutronskim generatorima.
Skandijev diborid (tačka topljenja 2250 °C) koristi se kao komponenta legura otpornih na toplinu, kao i kao materijal za katode elektronskih uređaja. U nuklearnoj industriji, skandij berilid se koristi kao reflektor neutrona, a posebno je ovaj materijal, kao i itrijum berilid, predložen kao reflektor neutrona u dizajnu atomske bombe.
Lijek
Skandijev oksid može igrati važnu ulogu u medicini (visokokvalitetne proteze).
Laserski materijali
Visokotemperaturna supravodljivost, proizvodnja laserskih materijala (HSGG). Galij-skandij-gadolinijum granat (GSGG), kada je dopiran jonima hroma i neodimijuma, omogućio je postizanje efikasnosti od 4,5% i snimanje parametara u frekvencijskom režimu generisanja ultrakratkih impulsa, što pruža veoma optimistične preduslove za stvaranje ultra-moćnih laserski sistemi za proizvodnju termonuklearnih mikroeksplozija na bazi čistog deuterijuma (inercijalna fuzija) u vrlo bliskoj budućnosti. Na primjer, očekuje se [koga?] da će u narednih 10-13 godina laserski materijali na bazi GSGG i skandij borata preuzeti vodeću ulogu u razvoju i opremanju aktivnih odbrambenih laserskih sistema za avione i helikoptere u razvijenim zemljama , a paralelno s tim razvojem termonuklearne energije velikih razmjera sa privlačenjem helijuma-3, već je dobivena laserska termonuklearna mikroeksplozija u smjesama s helijumom-3.
Proizvodnja solarnih panela
Skandijev oksid legiran holmijum oksidom koristi se u proizvodnji fotokonvertera na bazi silicija kao premaz. Ovaj premaz ima širok raspon prozirnosti (400-930 nm) i smanjuje spektralnu refleksiju svjetlosti sa silicijuma na 1-4%, a kada se koristi u ovako modificiranoj fotoćeliji, struja kratkog spoja se povećava za 35-70% , što zauzvrat omogućava povećanje izlazne snage fotokonvertera za 1,4 puta.
MHD generatori
Skandijev kromit se koristi kao jedan od najboljih i najtrajnijih materijala za izradu elektroda MHD generatora; u glavnu keramičku masu dodaje se prethodno oksidirani krom i sinterira, što daje materijalu povećanu čvrstoću i električnu provodljivost. Uz cirkonijum dioksid kao elektrodni materijal za MHD generatore, skandij kromit ima veću otpornost na eroziju spojevima cezija (koristi se kao aditiv za formiranje plazme).
Rendgenska ogledala
Skandij se široko koristi za proizvodnju višeslojnih rendgenskih ogledala (kompozicije: skandij-volfram, skandij-hrom, skandij-molibden). Skandijev telurid je vrlo perspektivan materijal za proizvodnju termoelemenata (visoke toplotne emf, 255 μV/K i niske gustine i velike čvrstoće).
Poslednjih godina, vatrostalne legure (intermetalna jedinjenja) skandijuma sa renijumom (tačka topljenja do 2575 °C), rutenijumom (tačka topljenja do 1840 °C), gvožđem (tačka topljenja do 1600 °C), (otpornost na toplotu, umjerene gustine itd.).
Vatrootporni materijali
Skandijev oksid (tačka topljenja 2450 °C) igra važnu ulogu kao vatrostalni materijal posebne namjene u proizvodnji mlaznica za izlivanje čelika za livenje visokolegiranih čelika.Po otpornosti u strujanju tečnog metala, skandijev oksid nadmašuje sve poznati i korišteni materijali (na primjer, najstabilniji itrijum oksid inferiorniji od skandijevog oksida za faktor 8,5) i može se reći da su nezamjenjivi u ovoj oblasti. Njegovu rasprostranjenu upotrebu sputava samo veoma visoka cijena, a u određenoj mjeri alternativno rješenje u ovoj oblasti je upotreba itrijum skandata ojačanih brkovima aluminijevog oksida za povećanje čvrstoće), kao i upotreba skandij tantalata.
Proizvodnja kubnog cirkonija
Skandijev oksid igra važnu ulogu u proizvodnji kubnog cirkonija, gdje je najbolji stabilizator.
Fosfori
Skandij borat, kao i itrijum borat, koristi se u elektronskoj industriji kao matrica za fosfor.
skandij (Sc)– rijetki zemni metal, atomski broj 21, atomska masa 44,96, tačka topljenja 1539°C, gustina 2,99 g/cm3.
Skandij je prvi od tri, po rastućem atomskom broju, nelantanidnih rijetkih zemnih metala (skandij, itrij i lantan).
Skandij je jedan od hemijskih elemenata koje je D. I. Mendeljejev predvidio na osnovu periodičnog zakona, a to je, kasnije, bila jasna potvrda validnosti ovog suštinskog obrasca prirode. Osobine skandijuma - atomska masa, hemijski sastav oksida, gustoća, svojstva njegovih soli, predvideo je D. I. Mendeljejev osam godina pre njegovog otkrića 1888. godine i u potpunosti su potvrđeni nakon otkrića i izolovanja ovog elementa.
U zemljinoj kori ima dosta skandijuma (2,2x10-3%), koji je blizu sadržaja olova u njoj, ali je veoma raspršen, što značajno otežava i poskupljuje njegovu ekstrakciju. Skandij je glavna komponenta (do 43%) samo jednog prirodnog minerala, tortveitita, au ostalim mineralima (steretiti, kolbekit, bolcit) se nalazi u malom postotku. Takođe se nalazi u rudama gvožđa i uranijuma, te u uglju niskog kvaliteta. Spektroskopske studije su pokazale značajne količine toga u sastavu nekih zvijezda.
Metalni skandij nabavljen je 1914. godine u vrlo malim količinama. Skandij je lagan srebrnast metal, mekan, dobro reaguje sa kiselinama, slabo oksidira na vazduhu, vrlo je krhak i ima paramagnetna svojstva.
RECEPT.

Dobijanje skandijuma je vrlo radno intenzivan proces u više faza.
Postoji način za dobijanje skandijuma, kada se skandijev hidroksid prvo dobije sagorevanjem otpada rude volframa, a zatim se tretira sumpornom kiselinom, uz dodatak vode i amonijaka. Zatim se hidroksid osuši, kalcinira (600-700°C) i dobije se skandijev oksid sa nečistoćama, koje se zatim uklanjaju otapanjem u hlorovodoničnoj kiselini i izolovanjem različitih frakcija. Zatim, nakon složenog procesa rafiniranja i rekalcinacije, dobija se skandijev oksid.
Druga metoda uključuje pretvaranje skandijevog oksida u fluorid tretiranjem fluorovodonikom. Ovaj proces se ponovo ponavlja, pri čemu se Sc2O3 gotovo u potpunosti pretvara u ScF3. Skandij fluorid se zatim redukuje metalnim kalcijumom u neutralnoj atmosferi. Nakon toga se mješavina metalnog skandijuma i šljake topi i odvaja u vakuumu, a zatim se provodi proces vakuum destilacije nakon čega se dobija 95% skandijuma, koji se naknadnim složenim procesima dovodi do 99%.
PRIMJENA.
Proizvodnja raketa i aviona. Skandij se koristi za izradu aluminijskih konstrukcijskih materijala visoke čvrstoće, jer legure legirane skandijem kao dio mikroligatura imaju nisku gustoću i visoku tačku topljenja.
Računarska tehnologija. Skandij, u obliku mikroaditiva, koristi se za stvaranje ferita za kompjuterske memorijske elemente.
Fosfori. Mikroaditivi skandijuma u sastavu fosfora povećavaju efikasnost njihovog sjaja. Koristi se u proizvodnji fluorescentnih lampi, za izradu ekrana za uređaje sa elektronskim snopom i ekrana za rendgenske aparate.
Proizvodnja stakla i keramike. Mikroaditivi skandijuma u staklenim i keramičkim proizvodima daju im visok stepen otpornosti na toplotu i otpornost na toplotni udar.
Nuklearna energija. Mikroaditivi skandijuma u elemente nuklearnih reaktora daju im visokoefikasna svojstva kao moderatora neutrona.
-
1. Istorija otkrića skandijuma
kvantni mineral atoma skandijuma
Postojanje skandijuma prvi je predvidio D.I. Mendeljejev. Na osnovu periodičnog zakona došao je do zaključka da bi pored galijuma trebao postojati još jedan analog bora i aluminija - ekaboron.
Godine 1871, u članku „Periodični zakon hemijskih elemenata“ D.I. Mendeljejev je napisao: „Oni predlažu da se ovaj element provizorno nazove ekabor, izvodeći ovo ime iz činjenice da slijedi bor kao prvi element parnih grupa, a slog eka je izveden iz sanskritske riječi koja znači jedan... Ekabor pojedinačno treba da predstavlja metal... dok bi specifična težina ovog metala trebala biti blizu 3,0... Ovaj metal neće biti isparljiv, jer svi metali u parnim redovima u svim grupama (osim i) nisu isparljivi; stoga se teško može otkriti običnom spektralnom analizom. U svakom slučaju, neće razgraditi vodu na uobičajenim temperaturama, ali će se pri određenom porastu temperature razgraditi, baš kao što to čine mnogi metali smješteni u ovoj regiji, formirajući osnovni oksid. Naravno da će se rastvoriti u kiselinama.”
Prođe osam godina, a švedski hemičar Nilsson otkriva novi element u jednom od vrlo rijetkih minerala, koji je nazvao skandij u čast skandinavskog poluotoka. Nakon proučavanja novog elementa, Nilsson je opisao svojstva skandijuma. Zamislite Nilssonovo iznenađenje kada je, upoređujući karakteristike skandijuma sa Mendeljejevljevim ekaboronom, ustanovio gotovo potpunu sličnost ovih karakteristika. „Nema sumnje da je ekabor otkriven u skandiju...“ napisao je Nilsson i dalje, šokiran ovim događajem, naglasio: „Ovako se na najvizuelniji način potvrđuju misli ruskog hemičara, što je omogućilo da se ne samo da predvidi postojanje imenovanog jednostavnog tijela, ali i da mu unaprijed ukaže na najvažnija svojstva."
Poređenja radi, navodimo neke podatke da je D.I. Mendeljejev je karakterizirao skandij (ekabor) prije njegovog otkrića, a Nilsson - nakon proučavanja svojstava elementa koji je otkrio.
Atomska težina 45
Ekaboron oksid se sastoji od dva atoma ekaborona i tri atoma kiseonika.
Specifična težina oksida je 3,5.
Ekabor sulfatna sol sastoji se od dva atoma eka-bora i tri ostatka sumporne kiseline.
Dvostruke sulfatne soli neće biti slične kristalnom obliku sa stipsom.
Atomska težina 45,1.
Skandijev oksid se sastoji od dva atoma skandijuma i tri atoma kisika.
Specifična težina oksida je 3,8.
Skandijev sulfat se sastoji od dva atoma skandijuma i tri ostatka sumporne kiseline,
Dvostruka sulfatna sol skandijuma i kalija po obliku svojih kristala nije slična stipsi.
Kao što se vidi iz navedenih karakteristika, među njima nema primjetne razlike. Skandij je bio drugi od brojnih hemijskih elemenata otkrivenih nakon predviđanja njihovog postojanja i svojstava od strane D.I. Mendeljejev na osnovu periodičnog zakona. Skandij je jasna potvrda valjanosti ovog najvažnijeg zakona prirodnih nauka.
2. Elektronska struktura skandijuma
Redni broj elementa Z = 21 označava: naelektrisanje jezgra atoma elementa (skandijuma): 21 Sc - 21 p 1 1 - +21; broj protona p 1 1: 21 Sc - 21 p 1 1; broj elektrona e: 21 Sc - 21e; broj neutrona n 1 0 = Ar - Z = 65 - 21 = 44 - 44n 1 0
Formula atomskog sastava
ili kao skraćenica: 3d 1 4s 2
Elektronska formula u obliku kvantnih ćelija
Skandij je d element. Elektronska struktura atoma završava s - elektronima, pa će element pokazivati metalna svojstva.
Formula višeg oksida je Sc 2 O 3, a hidroksida je Sc(OH) 3 i ima slaba bazična svojstva. Ne stvara spojeve sa vodonikom.
Serijski broj 34 ima selen Se. Element je u periodu IV, što znači da postoje 4 energetska nivoa u atomu. Nalazi se u glavnoj podgrupi grupe VI; njegovi valentni elektroni su raspoređeni u 4s i 4p podnivoima.3. Hemijska svojstva skandijuma
Hemijski, skandij je prilično aktivan, pokazuje oksidacijsko stanje od +3. U ovom slučaju prvo se gube 4S2 elektroni, a tek onda 3d elektroni. Ne stupa u interakciju s vodom čak ni kada se zagrije, ali se dobro otapa u kiselinama stvarajući Sc3+ soli. U pogledu sposobnosti stvaranja soli, skandij je sličan zemnoalkalnim metalima; kao i kalcij, formira teško rastvorljivi karbonat, fosfat, fluor i slabo rastvorljiv sulfat, dok su skandijev hlorid i nitrat visoko rastvorljivi. Osobitosti spojeva skandijuma povezane su s njihovom amfoternom prirodom: soli u otopinama su donekle hidrolizirane. U vodenoj otopini skandijev ion se hidratizira da nastane kompleksni ion 3+, a kada alkalija djeluje na otopine njegovih soli, taloži se nerastvorljivi hidroksid Sc(OH) 3, njegovo taloženje počinje već pri pH = 4,8.Elektropozitivna priroda skandij određuje njegov visok afinitet za nemetale. Na vazduhu je, kao i aluminijum, prekriven debelim (150-600A) zaštitnim filmom od Sc2O3 oksida, a tek iznad 200-250 °C film gubi zaštitna svojstva i dolazi do dalje oksidacije skandijuma;
4Sc + 3 O2 = 2Sc203 + ~1500 kJ
Čisti oksid se dobija razgradnjom hidroksida kada se zagrije:
2Sc(OH) 3 Sc203 + 3p0
Slabo je rastvorljiv u kiselinama, a sa vodom stvara bijeli hidroksidni talog. Karakteristika jedinjenja skandijuma je amfoternost - posledica blizine aluminijuma i malog jonskog radijusa od 0,83 A. Amfoternost se manifestuje u sposobnosti skandijuma da se otapa (iako s poteškoćama) u alkalijama sa formiranjem kompleksnog hidroksoskandata:
Sc(OH) 3 + 3 NaOH = Na3,
Hidroksid se lako otapa u kiselinama:
Sc(OH) 3 + 3 HN08 = Sc(N03) 3 + 3 p0
Kada se zagrije, skandij lako reagira s halogenima i drugim nemetalima:
2Sc + 3CI2 = 2ScCl3 + 1800 kJ
Halogenidi se obično dobijaju taloženjem soli
Sc(N03) 3 + 3 HF = ScF3 + 3 HN03
ili kalciniranjem SC2O3 oksida sa ugljem u mlazu hlora. Skandijeve halogenidne soli su relativno vatrostalna jedinjenja sposobna da formiraju stabilna kompleksna jedinjenja tipa M, MI, Mi (gde je G-F, u manjoj meri, C1), kao i dvostruke sulfate M i Mi slične stipsi (iako se razlikuju od stipse u njihovoj stereometrijskoj strukturi). Postojanje drugih oksidacijskih stanja skandijuma osim +3 nije potpuno jasno. Jedinjenja skandijuma su dobijena u čvrstom obliku, u kojem je njegovo oksidaciono stanje formalno jednako +2 - ScC2 karbidu (sastoji se, pretpostavlja se, od jona Sc2+ i C2~2), Scp hidrid, ScCl2 subhlorid. Sva ova jedinjenja imaju veoma visoku električnu provodljivost, što se može objasniti samo činjenicom da sadrže hohl^Sc3* i slobodne elektrone (formalno Sc2+ = Sc3+ + e). Istina, postoji razlog za vjerovanje da pri elektrolizi Sc3+ otopina nastaju ioni Sc2+ kao međuprodukti, ali oni su vrlo nestabilni.
4. Pronalaženje skandijuma u prirodi
U prirodi su jedinjenja skandijuma prisutna u mnogim mineralima koji sadrže itrijum, lantan, lantanide i druge elemente u dominantnim količinama. Ovi minerali su prilično rijetki - nalaze se u Skandinaviji, na Uralu, u Brazilu i rjeđe u SAD-u i Australiji. Od sopstvenih minerala skandijuma poznati su samo steretit Sc(P04) * 2H2O i torveitit Sc2 (Si2O7), koji se nalaze u Norveškoj i na Madagaskaru, donekle kontaminirani uglavnom itrijumom. Ali tortveitit je zanimljiv i na druge načine: to je jedini mineral u kojem ima više hafnija nego cirkonija. Joni ovih metala djelimično zamjenjuju skandij u kristalnoj rešetki torthveitita. Potpuno neobičan odnos između hafnija i cirkonija objašnjava se činjenicom da su ionski radijusi Hf 4+ i Sc 3+ bliži od onih Zr4+ i Sc3+. Zbog toga se hafnijev jon lakše „ugrađuje“ u kristal tortveitita nego cirkonijum. Međutim, oni su takođe veoma retki. Od 1911. do 1952. pronađeno je samo 22 kg tortveitita, a u cijelom periodu, čak i ako se uzme u obzir povećan interes za skandij, jedva više od 100 kg. Dakle, skandij spada u grupu retkih zemalja. Međutim, to je prije element u tragovima - ima klark od 6 * 10 -4 (ima ga mnogo više od zlata), ali njegov sadržaj u zemljinoj kori nije sasvim jasno definiran. Prirodni skandij je „čisti“ element – sastoji se od samo jednog neradioaktivnog izotopa 45 Sc. Umjetno je dobiveno još 14 već radioaktivnih izotopa, od kojih je najstabilniji p-aktivni 46 Sc, čije je vrijeme poluraspada 84 dana.
5. Tehnologije ekstrakcije skandija
Trenutno, glavni proizvođači skandijuma (skandij oksida) u svijetu su sljedeće zemlje: Rusija, Kina, Ukrajina i Kazahstan. Također treba napomenuti da su rezerve rijetkih zemnih sirovina u Mongoliji koje sadrže skandij također obećavajući izvor skandijuma za industriju skandijuma i razvoj metalurgije skandijuma.
Ispod su glavne rude nosača i masa povezanog skandijuma oslobođenog iz njih:
Boksiti - 71 milion tona prerade godišnje, sadrže prateći skandij u količini od 710-1420 tona;
Rude uranijuma - 50 miliona tona godišnje, prateći skandij 50-500 tona godišnje;
Ilmeniti - 2 miliona tona godišnje, povezani skandij 20-40 tona godišnje;
Volframiti - povezani skandij oko 30-70 tona godišnje;
Kasiterit - 200 hiljada tona godišnje, povezani skandij 20-25 tona godišnje;
Cirkoni - 100 hiljada tona godišnje, povezani skandij 5-12 tona godišnje.
Postoje sljedeće tehnologije ekstrakcije skandijuma: elektroliza taline skandij hlorida, koja proizvodi najčistiji metal skandijuma; postoji metoda za ekstrakciju skandijuma iz rastvora koji sadrže skandij ekstrakcijom čvrstim ekstraktantom (TVEX); Metalni skandij se trenutno proizvodi redukcijom skandij fluorida sa metalnim kalcijumom u atmosferi azota.
6. Primena skandijuma
Zbog svojih svojstava, skandij ima izglede za upotrebu u nuklearnoj energiji, raketnoj industriji, vazduhoplovstvu itd. Ovaj element ima rijetku i sretnu kombinaciju svojstava, ali je njegovu upotrebu donedavno ometala visoka cijena metala skandijuma. Razmotrimo glavna područja primjene skandijuma i njegovih spojeva:
metalurgija.
Upotreba skandijuma u obliku nečistoće za mikrolegiranje ima značajan uticaj na niz praktično važnih legura, na primer, dodavanje 0,4% skandijuma legurama aluminijum-magnezijum povećava vlačnu čvrstoću za 35%, a granicu tečenja za 65-84%, a istovremeno relativno izduženje ostaje na nivou od 20-27%. Dodatak 0,3-0,67% hromu povećava njegovu otpornost na oksidaciju do temperature od 1290 °C, a sličan ali još izraženiji efekat ima i na toplotno otporne legure kao što je „nihrom” i u ovoj oblasti upotreba skandijuma je mnogo efikasniji od itrijuma. Skandijev oksid ima niz prednosti u odnosu na druge okside za proizvodnju visokotemperaturne keramike, budući da se čvrstoća skandijevog oksida povećava pri zagrijavanju i dostiže maksimum na 1030 °C, dok istovremeno skandijev oksid ima minimalnu toplinsku provodljivost i najveća otpornost na termički udar. Itrijum skandat je jedan od najboljih materijala za konstrukcije koje rade na visokim temperaturama. Određena količina skandijevog oksida se stalno troši za proizvodnju germanatnih stakala za optoelektroniku.
Legure skandija.
Glavna primjena skandijuma u smislu zapremine je njegova upotreba u aluminij-skandij legurama koje se koriste u sportskoj opremi (motocikli, bejzbol palice, itd.) - gdje god su potrebni materijali visoke čvrstoće. Kada je legiran aluminijumom, skandij daje dodatnu snagu i savitljivost. Upotreba legura skandijuma u vazduhoplovstvu i raketnoj industriji značajno će smanjiti troškove transporta i naglo povećati pouzdanost operativnih sistema, dok će istovremeno, uz niže cene skandijuma i njegove upotrebe za proizvodnju automobilskih motora, značajno povećati njihov vijek trajanja i djelomično njihovu efikasnost. Legure skandija su najperspektivniji materijali u proizvodnji vođenih projektila. Posljednjih godina otkrivena je važna uloga skandijuma (i djelimično itrijuma i lutecijuma) u proizvodnji nekih super-jakih maragežnih čelika, čiji su neki uzorci pokazali čvrstoću od preko 700 kg/mm² (preko 7000 MPa).
Supertvrdi materijali
Skandij se koristi za proizvodnju supertvrdih materijala. Posebno su zanimljive legure skandijuma sa berilijumom, koje imaju jedinstvene karakteristike u pogledu čvrstoće i otpornosti na toplotu. Na primjer, skandijev berilid (1 atom skandijuma i 13 atoma berilija) ima najveću povoljnu kombinaciju gustine, čvrstoće i visoke tačke topljenja, te može biti najbolji materijal za konstrukciju zrakoplovne tehnologije, nadmašujući u tom pogledu najbolji na bazi titana. legure koje su poznate čovječanstvu i niz kompozitnih materijala (uključujući niz materijala na bazi ugljičnih i borovih filamenata).
Mikroelektronika
Skandijev oksid (tačka topljenja 2450 °C) igrao je vitalnu ulogu u proizvodnji superkompjutera: feriti niske indukcije, kada se koriste u uređajima za pohranu informacija, mogu nekoliko puta povećati brzinu razmjene podataka.
Izvori svjetlosti.
Oko 80 kg skandijuma (kao dio Sc2O3) godišnje se koristi za proizvodnju rasvjetnih elemenata visokog intenziteta. Skandijum jodid se dodaje živinim gasnim lampama, stvarajući veoma realistične izvore veštačke svetlosti blizu sunca, koji daju dobar prikaz boja kada se snimaju televizijskom kamerom.
Izotop skandij-47 (poluživot 3,35 dana) jedan je od najboljih izvora pozitrona.
Nuklearna energija.
Nuklearna industrija uspješno koristi skandij hidrid i deuterid - odlične moderatore neutrona i metu (booster) u moćnim i kompaktnim neutronskim generatorima.
Skandijev diborid (tačka topljenja 2250 °C) koristi se kao komponenta legura otpornih na toplinu, kao i kao materijal za katode elektronskih uređaja. U nuklearnoj industriji, skandij berilid se koristi kao reflektor neutrona, a posebno je ovaj materijal, kao i itrijum berilid, predložen kao reflektor neutrona u dizajnu atomske bombe.
Lijek.
Skandijev oksid može igrati važnu ulogu u medicini (visokokvalitetne proteze).
Laserski materijali.
Visokotemperaturna supravodljivost, proizvodnja laserskih materijala (HSGG).
Proizvodnja solarnih panela.
Skandijev oksid legiran holmijum oksidom koristi se u proizvodnji fotokonvertera na bazi silicija kao premaz. Ovaj premaz ima širok raspon prozirnosti (400-930 nm) i smanjuje spektralnu refleksiju svjetlosti sa silicijuma na 1-4%, a kada se koristi u ovako modificiranoj fotoćeliji, struja kratkog spoja se povećava za 35-70% , što zauzvrat omogućava povećanje izlazne snage fotokonvertera za 1,4 puta.
Rendgenska ogledala.
Skandij se široko koristi za proizvodnju višeslojnih rendgenskih ogledala (kompozicije: skandij-volfram, skandij-hrom, skandij-molibden). Skandijev telurid je vrlo perspektivan materijal za proizvodnju termoelemenata (visoke toplotne emf, 255 μV/K i niske gustine i velike čvrstoće).
Poslednjih godina, vatrostalne legure (intermetalna jedinjenja) skandijuma sa renijumom (tačka topljenja do 2575°C), rutenijumom (tačka topljenja do 1840°C), gvožđem (tačka topljenja do 1600°C), (otpornost na toplotu, umjerene gustine itd.).
Vatrootporni materijali.
Skandijev oksid (tačka topljenja 2450 °C) igra važnu ulogu kao vatrostalni materijal posebne namjene u proizvodnji mlaznica za izlivanje čelika za livenje visokolegiranih čelika.Po otpornosti u strujanju tečnog metala, skandijev oksid nadmašuje sve poznati i korišteni materijali (na primjer, najstabilniji itrijum oksid inferiorniji od skandijevog oksida za faktor 8,5) i može se reći da su nezamjenjivi u ovoj oblasti.
Zaključak
Zaključno, skandij je prilično zanimljiv element, od istorije njegovog otkrića do njegovih hemijskih svojstava i primene. Skandij se sa sigurnošću može nazvati metalom 21. stoljeća i može se predvidjeti nagli porast njegove proizvodnje, rast cijena i potražnje zbog prerade ogromne količine kamenog uglja (posebno prerade ruskog kamenog uglja) u tekuće gorivo. Njegovu rasprostranjenu upotrebu sputava samo veoma visoka cijena, a u određenoj mjeri alternativno rješenje u ovoj oblasti je upotreba itrijum skandata ojačanih brkovima aluminijevog oksida za povećanje čvrstoće), kao i upotreba skandij tantalata. Skandij ima prilično širok spektar primjena, što ne može a da ne motivira nauku da stvara i razvija nove metode rudarenja i vađenja ovog elementa.
Bibliografija
struktura atoma skandijuma mineral
1. Mendeljejev D.I. Periodična valjanost hemijskih elemenata M, Zhurn. ruski Phys.-Chem. društvo, 1871.
2. Prokofjev N. B., Buchachenko M. S. Buchachenko Izdavačka kuća "Nauka" 117864 GSP-7, Moskva, B-S85, Profsoyuznaya st., 90 2. štamparija izdavačke kuće "Nauka" 121099, Moskva, G-99, Shubinsky per.
3. Figurovski N.A. F49 Istorija hemije: Udžbenik. priručnik za studente pedagogije. Institut za hemiju. i biol. specijalista. - M.: Prosveta, 1979. - 311 str., ilustr.
4. Šalinec Aleksandar Borisovič Glasnici atomskog doba. Elementi grupe III periodnog sistema D.I. Mendeljejev. Priručnik za studente. M., “Prosvjeta”, 1975. 192 str. sa bolesnim.
Slični dokumenti
Fazne ravnoteže i prijelazi. Kalorimetrijske metode istraživanja. Termodinamičke karakteristike topljenja skandij tris-2,2,6,6-tetrametil-4-fluoroheptan-3,5-dionata, njegova upotreba za dobijanje skandijevog oksida, koji ima primjenu u elektrofizici.
kurs, dodan 16.11.2012
Istorija otkrića gvožđa. Položaj hemijskog elementa u periodnom sistemu i struktura atoma. Pojava željeza u prirodi, njegova jedinjenja, fizička i hemijska svojstva. Metode dobijanja i upotrebe gvožđa, njegovo dejstvo na ljudski organizam.
prezentacija, dodano 04.01.2015
Elektronska formula molibdena. Objašnjenje fizičkog značenja svih indeksa za dati hemijski element. Valentni podnivoi. Skupovi kvantnih brojeva. Predviđanje vrijednosti oksidacijskog stanja. Karakteristike jedinjenja sa nemetalima. Oksidi. Aplikacija.
kurs, dodan 24.06.2008
Supstance sa jonskim tipom veze. Dvobazne kiseline bez kiseonika. Proizvod reakcije propena sa hlorom. Maksimalni atomski radijus među elementima grupe VI A. Hemijska veza između molekula vode. Broj elektronskih slojeva i d-elektrona u atomu skandija.
test, dodano 31.10.2012
Istorija otkrića vodonika. Opće karakteristike tvari. Položaj elementa u periodnom sistemu, struktura njegovog atoma, hemijska i fizička svojstva, pojava u prirodi. Praktična primjena plina u korisne i štetne svrhe.
prezentacija, dodano 19.05.2014
Organske tvari koje sadrže ugljik, kisik i vodik. Opća formula za hemijski sastav ugljikohidrata. Struktura i hemijska svojstva monosaharida, disaharida i polisaharida. Glavne funkcije ugljikohidrata u ljudskom tijelu.
prezentacija, dodano 23.10.2016
Ideja o strukturi metana (molekularne, elektronske i strukturne formule). Fizička svojstva, pojava u prirodi, tip hemijske veze i prostorna struktura molekula i atoma ugljenika u tri valentna stanja, koncept hibridizacije.
teza, dodana 31.03.2009
Istorija proizvodnje i upotrebe gvožđa. Opće karakteristike elementa, struktura atoma. Oksidacijska stanja i primjeri spojeva, osnovne reakcije. Pronalaženje željeza u prirodi, primjena. Sadržaj gvožđa u zemljinoj kori. Biološka uloga gvožđa.
prezentacija, dodano 05.09.2012
Struktura atoma oksida sumpora, njegova molekularna formula, valencija, tip kristalne rešetke. Pojava sumpor-dioksida SO2 u prirodi. Njegova fizička i hemijska svojstva. Proizvodnja sumpordioksida u industriji iu laboratorijskim uslovima.
prezentacija, dodano 13.05.2015
Opće karakteristike hemijskog elementa. Hemijska aktivnost fluora. Interakcija sa većinom nemetala. Istorija otkrića fluora. Biti u prirodi. Proizvodnja teflona, fluoroplastike, fluorne gume, organskih supstanci koje sadrže fluor.
FEDERALNA AGENCIJA ZA OBRAZOVANJE RF
MOSKVSKI DRŽAVNI TEHNIČKI UNIVERZITET "MAMI"
TEST
u disciplini "HEMIJA"
na temu: “Hemijski element - skandij”
Pripremio student
4 EF 2 Tarasov S.V.
naučni savjetnik:
Patrusheva O.A.
MOSKVA 2010
· Istorija Skandije i porijeklo njenog imena
Fizička svojstva skandijuma
Hemijska svojstva skandija
· Svjetski resursi Scandia
Rasprostranjenost skandijuma u prirodi
· Dobivanje i proizvodnja skandijuma
Primjena skandija
metalurgija
Legure skandija
· Supertvrdi materijali
Mikroelektronika
· Izvori svjetlosti
Izotopi skandija
· Nuklearna energija
· Lijek
Laserski materijali
· Proizvodnja solarnih panela
MHD generatori
· Rendgenska ogledala
Vatrootporni materijali
· Proizvodnja kubnog cirkonija
· Fosfori
· Književnost
Priča Skandija i porijeklo njenog imena
Scandium
Skandij postoji u dvije kristalne modifikacije: α i β; na uobičajenim temperaturama α-modifikacija sa heksagonalnom rešetkom je stabilna (a = 3,3080 Å i c = 5,2653 Å), iznad 1350 °C stabilna je β-modifikacija sa kubičnom rešetkom centriranom na tijelo. Gustina skandija u α-obliku na 25 °C 3,020 g/cm 3 , atomski radijus 1,64 Å, jonski radijus 0,75 Å, (tapanje 1539 °C, t ključanja 2700 °C, isparljivo iznad 1600 °C specifično na 25 °C. toplotni kapacitet 25,158 kJ/(kg K), specifični električni otpor (54-70,7) 10 -6 ohm cm;
U vodi, spojevi skandijuma primjetno hidroliziraju i formiraju bazične soli. Sc 3+ joni su skloni polimerizaciji, stvaranju kompleksnih jona raznih vrsta, čiji sastav zavisi od prirode anjona i pH sredine, na primer Sc(CO 3) 2 -, Sc (SO 4 ) 3 3-. Bazne soli u rastvoru lako se pretvaraju u amorfni hidroksid.
Metal se lako otapa u hlorovodoničkoj, azotnoj i sumpornoj kiselini (kako se koncentracija kiseline smanjuje, brzina rastvaranja skandijuma naglo opada i on ne reaguje sa 0,001 N rastvorima). U vodi su dobro rastvorljive soli hlorovodonične, sumporne, azotne, hidrotiocijanatne i sirćetne kiseline, dok su soli fosforne, oksalne i fluorovodonične kiseline slabo rastvorljive; Acetilacetonat i njegovi derivati fluora imaju određenu volatilnost. Razrijeđeni rastvori NaOH (10%) i mješavina koncentriranog HNO 3 i HF (1:1) praktično ne podliježu skandijumu.
Ogromni resursi skandijuma koncentrisani su u Rusiji i bivšem Sovjetskom Savezu (podaci o proizvodnji su veoma raštrkani, ali obim proizvodnje, prema nezavisnim stručnjacima, jednak je ili veći od službene svjetske proizvodnje). Generalno, prema nezavisnim stručnjacima, trenutno su glavni proizvođači skandijuma (skandijevog oksida) Rusija, Kina, Ukrajina i Kazahstan. U određenoj mjeri, u narednim godinama se očekuje značajan obim sirovina skandijuma iz Australije, Kanade i Brazila.
Također treba napomenuti da su rezerve rijetkih zemnih sirovina u Mongoliji koje sadrže skandij također obećavajući izvor skandijuma za industriju skandijuma i razvoj metalurgije skandijuma.
Rasprostranjenost skandijuma u prirodi
U pogledu hemijskih i fizičkih svojstava, itrijum, lantan i lantanidi su bliski skandijumu. U svim prirodnim jedinjenjima, skandij, kao i njegovi analozi aluminijum, itrijum, lantan, pokazuje pozitivnu valencu tri, stoga ne učestvuje u redoks procesima.
Glavni mineralni nosači skandijuma: fluorit (do 1% Sc2O3), kasiterit (0,005-0,2%), volframit (0-0,4%), ilmenorutil (0,0015-0,3%), torijanit (0,46% Sc2O3), samarskit (0,45%), viikit (1,17%), ksenotim (0,0015-1,5%), beril (0,2%), bazit (skandijum beril, 3-14, 44%). Ukupno je poznato više od stotinu minerala koji sadrže skandij
Najveće (30 g/t Sc 2 O 3) koncentracije skandijuma su ograničene na ultrabazične i bazične stijene, u kojima vodeću ulogu imaju željezo-magnezijski minerali (piroksen, amfibol i biotit), u kojima je heterovalentna supstitucija Fe 2 + i skandij je rasprostranjen magnezijum, a do zamjene cirkonija dolazi u kasnijim fazama magmatskog procesa iu pegmatitima.
U stijenama prosječnog sastava prosječan sadržaj Sc 2 O 3 je 10 g/t, u kiselim stijenama 2 g/t; ovdje je skandij dispergovan i u tamno obojenim mineralima (rožnica, biotit) i nalazi se u muskovitu. , cirkon i sfen.
Izovalentna supstitucija skandijuma za elemente TR grupe se takođe dešava, posebno u suštinski itrijumskim mineralima (ksenotim, Sc–Y asocijacija u thorthwaite-u i Al supstitucija u berilu).
Skandij se uglavnom ekstrahuje u obliku oksida tokom hidro- i pirometalurške obrade volframa, kalaja, titanijuma, uranijuma i boksita. Oksidi se hlorišu ili fluorišu na povišenim temperaturama, a zatim se dobije kompaktni metalni skandij (prinos ~99,5%) termičkom redukcijom njegovog hlorida ili fluorida metalnim kalcijumom, nakon čega sledi destilacija (sublimacija) Sc u visokom vakuumu od 133,3· 10 -6 n/m 2 (10 -6 mm Hg) na 1600-1700 °C.
Primjena skandija
Skandij je monoizotopni element i 100% se sastoji od skandij-45 atoma.
metalurgija
Upotreba skandijuma u obliku nečistoće za mikrolegiranje ima značajan utjecaj na niz praktično važnih legura, na primjer, dodavanjem 0,4% skandijuma u aluminij-magnezijske legure povećava se vlačna čvrstoća za 35%, a granica popuštanja za 65-84 %, a istovremeno relativno izduženje ostaje na nivou od 20-27%. Dodatak 0,3-0,67% hromu povećava njegovu otpornost na oksidaciju do temperature od 1290°C, a sličan, ali još izraženiji efekat ima i na toplotno otporne legure kao što je "nihrom" iu ovoj oblasti upotreba skandijum je mnogo efikasniji itrijum. Skandijev oksid ima niz prednosti u odnosu na druge okside za proizvodnju visokotemperaturne keramike, budući da se čvrstoća skandijevog oksida povećava pri zagrijavanju i dostiže maksimum na 1030 °C, dok istovremeno skandijev oksid ima minimalnu toplinsku provodljivost i najveća otpornost na termički udar. Itrijum skandat je jedan od najboljih materijala za konstrukcije koje rade na visokim temperaturama. Određena količina skandijevog oksida se stalno troši za proizvodnju germanatnih stakala za optoelektroniku.
Legure skandija
Glavna primjena skandijuma je njegova upotreba u aluminij-skandij legurama koje se koriste u sportskoj opremi (motocikli, bejzbol palice, itd.) - gdje god su potrebni materijali visoke čvrstoće. Kada je legiran aluminijumom, skandij daje dodatnu snagu i savitljivost. Vlačna čvrstoća čistog skandijuma je oko 400 MPa (40 kg/mm), za titanijum, na primer, 250-350 MPa, a za nelegirani itrijum 300 MPa. Upotreba legura skandijuma u vazduhoplovstvu i raketnoj industriji značajno će smanjiti troškove transporta i naglo povećati pouzdanost operativnih sistema, dok će istovremeno, uz niže cene skandijuma i njegove upotrebe za proizvodnju automobilskih motora, značajno povećati njihov vijek trajanja i djelomično njihovu efikasnost. Takođe je veoma važno da skandij ojačava aluminijumske legure legirane hafnijem. Važno i praktično neproučeno područje primjene skandijuma je činjenica da, kao i legiranje aluminija sa itrijumom, legiranje čistog aluminija sa skandijem također povećava električnu provodljivost žica, a efekat oštrog ojačanja ima velike izglede za korištenje takva legura za prijenos električne energije (električni vodovi). Legure skandija su najperspektivniji materijali u proizvodnji vođenih projektila. Brojne posebne legure skandijuma i kompoziti skandijskih veza su vrlo perspektivni u oblasti projektovanja skeleta kiborga. Posljednjih godina otkrivena je značajna uloga skandijuma (i dijelom itrijuma i lutecija) u proizvodnji nekih super-čvrstih marražnih čelika, od kojih su neki uzorci pokazali čvrstoću od preko 700 kg/mm (preko 7000 MPa) .
Supertvrdi materijali
Skandij se koristi za proizvodnju supertvrdih materijala. Na primjer, legiranje titanovog karbida sa skandij karbidom vrlo naglo povećava mikrotvrdoću (2 puta), što ovaj novi materijal čini četvrtim najtvrđim nakon dijamanta (oko 98,7 - 120 GPa), nitrida bora (borazona), (oko 77-87 GPa) , legura bor-ugljik-silicijum (oko 68-77 GPa), i znatno više od bor karbida (43,2 - 52 GPa), silicijum karbida (37 GPa), mikrotvrdoća legure skandij karbida i titanijum karbida je oko 53,4 GPa (za titanijum karbid, na primjer, 29,5 GPa). Posebno su zanimljive legure skandijuma sa berilijumom, koje imaju jedinstvene karakteristike u pogledu čvrstoće i otpornosti na toplotu. Na primjer, skandijev berilid (1 atom skandijuma i 13 atoma berilija) ima najveću povoljnu kombinaciju gustine, čvrstoće i visoke tačke topljenja, te može biti najbolji materijal za konstrukciju zrakoplovne tehnologije, nadmašujući u tom pogledu najbolji na bazi titana. legure koje su poznate čovječanstvu i niz kompozitnih materijala (uključujući niz materijala na bazi ugljičnih i borovih filamenata).
Mikroelektronika
Skandijev oksid (tačka topljenja 2450°C) igra vitalnu ulogu u proizvodnji superkompjutera: feriti niske indukcije, kada se koriste u uređajima za skladištenje informacija, omogućavaju nekoliko puta povećanje brzine razmjene podataka zbog smanjenja preostale indukcije od 2 - 3 KGauss do 0. 8 - 1 KGauss.)
Izvori svjetlosti
Oko 80 kg skandijuma (sastavljenog od Sc 2 O 3) godišnje se koristi za proizvodnju rasvjetnih elemenata visokog intenziteta. Skandijum jodid se dodaje živinim gasnim lampama, stvarajući veoma realistične izvore veštačke svetlosti blizu sunca, koji daju dobar prikaz boja kada se snimaju televizijskom kamerom.
Izotopi skandija
Radioaktivni izotop Sc-46 (poluraspad 83,83 dana) koristi se kao „oznaka“ u industriji prerade nafte, za praćenje metalurških procesa i liječenje raka. najbolji izvori pozitrona.
Nuklearna energija
Nuklearna industrija uspješno koristi skandij hidrid i deuterid - odličan moderator neutrona, i metu (pojačivač) u moćnim i kompaktnim neutronskim generatorima. Skandijev diborid (tačka topljenja 2250 °C) koristi se kao komponenta legura otpornih na toplinu, kao i kao materijal za katode elektronskih uređaja. U nuklearnoj industriji, skandij berilid se koristi kao reflektor neutrona, a posebno je ovaj materijal, kao i itrijum berilid, predložen kao reflektor neutrona u dizajnu atomske bombe.
Lijek
Skandijev oksid može igrati važnu ulogu u medicini (visokokvalitetne proteze).
Laserski materijali
Visokotemperaturna supravodljivost, proizvodnja laserskih materijala (HSGG). Galij-skandij-gadolinijum granat, kada je dopiran jonima hroma i neodimijuma, omogućio je postizanje efikasnosti od 4,5% i snimanje parametara u frekventnom režimu generisanja ultrakratkih impulsa, što pruža veoma optimistične preduslove za stvaranje ultra-moćnih laserskih sistema za proizvodeći termonuklearne mikroeksplozije na bazi čistog deuterija (inercijalna fuzija) u vrlo bliskoj budućnosti. Na primjer, očekuje se da će u narednim godinama laserski materijali na bazi GSGG i skandij borata preuzeti vodeću ulogu u razvoju i opremanju laserskih aktivnih odbrambenih sistema za avione i helikoptere u razvijenim zemljama, a paralelno s tim, razvoj termonuklearne energije velikih razmjera korištenjem helijuma-3 (iskopanog na Mjesecu), u mješavinama sa helijumom-3, već je dobivena laserska termonuklearna mikro eksplozija.
Proizvodnja solarnih panela
Skandijev oksid legiran holmijum oksidom koristi se u proizvodnji fotokonvertera na bazi silicija kao premaz. Ovaj premaz ima širok raspon prozirnosti (400-930 nm) i smanjuje spektralnu refleksiju svjetlosti sa silicijuma na 1-4%, a kada se koristi u ovako modificiranoj fotoćeliji, struja kratkog spoja se povećava za 35-70% , što zauzvrat omogućava povećanje izlazne snage fotokonvertera za 1,4 puta.
MHD generatori
Skandijev kromit se koristi kao jedan od najboljih i najtrajnijih materijala za izradu elektroda MHD generatora; u glavnu keramičku masu dodaje se prethodno oksidirani krom i sinterira, što daje materijalu povećanu čvrstoću i električnu provodljivost. Uz cirkonijum dioksid kao elektrodni materijal za MHD generatore, skandij kromit ima veću otpornost na eroziju spojevima cezija (koristi se kao aditiv za formiranje plazme).
Rendgenska ogledala
Skandij se široko koristi za proizvodnju višeslojnih rendgenskih ogledala (kompozicije: skandij-volfram, skandij-hrom, skandij-molibden). Skandijev telurid je vrlo perspektivan materijal za proizvodnju termoelemenata (visoke toplotne emf, 255 μV/K i niske gustine i velike čvrstoće).
Vatrootporni materijali
Poslednjih godina, vatrostalne legure (intermetalna jedinjenja) skandijuma sa renijumom (tačka topljenja do 2575 °C), rutenijumom (tačka topljenja do 1840 °C), gvožđem (tačka topljenja do 1600 °C), (otpornost na toplotu, umjerene gustine itd. Skandijev oksid (talište 2450 °C) igra važnu ulogu kao vatrostalni materijal posebne namjene u proizvodnji mlaznica za izlivanje čelika za livenje visokolegiranih čelika, a skandijev oksid po svojoj kvaliteti nadmašuje sve poznate i korišćene materijale. otpornost na protok tekućih metala (na primjer, najstabilniji itrijum oksid je 8,5 puta inferiorniji od skandijevog oksida) i može se reći da je nezamjenjiv u ovoj oblasti. Njegovu rasprostranjenu upotrebu sputava samo veoma visoka cijena, a u određenoj mjeri alternativno rješenje u ovoj oblasti je upotreba itrijum skandata ojačanih brkovima aluminijevog oksida za povećanje čvrstoće, kao i upotreba skandij tantalata.
Proizvodnja kubnog cirkonija
Skandijev oksid igra važnu ulogu u proizvodnji kubnog cirkonija, gdje je najbolji stabilizator. Određena količina skandijuma se koristi za legiranje legura nikla otpornih na toplinu sa hromom i željezom (nikrom i fechral) kako bi se dramatično produžio vijek trajanja kada se koristi kao namotaj za grijanje otpornih peći.
Fosfori
Skandij borat, kao i itrijum borat, koristi se u elektronskoj industriji kao matrica za fosfor.
Književnost
http://ru.wikipedia.org/wiki
http://www.chem100.ru/index.htm
Za zaštitu apstraktnog
Skandij je element sekundarne podgrupe treće grupe, četvrtog perioda periodnog sistema hemijskih elemenata. I. Mendeljejev, sa atomskim brojem 21 i atomskom masom 44,9559, označen je simbolom Sc (lat. Scandium). Jednostavna supstanca skandij (CAS broj: 7440-20-2) je metal svetlo srebrne boje sa karakterističnom žutom nijansom koja se pojavljuje kada metal dođe u kontakt sa vazduhom.
Poznat je jedan prirodni stabilni izotop, 45 Sc. Od umjetnih radioaktivnih izotopa najvažniji je 46 Sc s poluživotom od 84 dana.
Skandij je predvidio D. I. Mendeljejev 1870., a izolovao ga 1879. L. F. Nilson iz minerala gadolinita i euksenita pronađenih u Skandinaviji (latinski Scandia), otuda i naziv elementa.
Skandij postoji u dvije kristalne modifikacije: α i β; na uobičajenim temperaturama α-modifikacija sa heksagonalnom rešetkom je stabilna (a = 3,3080 Å i c = 5,2653 Å), iznad 1350 °C stabilna je β-modifikacija sa kubičnom rešetkom centriranom na tijelo.
Skandij je slab paramagnetik, njegova atomska magnetna susceptibilnost je 236·10 -6 (20 °C). Skandij je mekan metal, u svom čistom stanju može se lako obrađivati - kovati, valjati, štancati.
Sc je prvi prelazni element sa jednim 3d elektronom; konfiguracija vanjskih elektrona atoma je 3d 1 4s 2. Njegovo hemijsko ponašanje je slično ostalim prijelaznim elementima u +3 oksidacionom stanju (na primjer Ti 3+, Fe 3+, Mn 3+), elementima podgrupe Al, Be, kao i elementima podgrupe itrijuma, zajedno sa kojima se ponekad klasifikuje kao retki zemljani elementi .
Na zraku je prekriven zaštitnim oksidnim filmom debljine do 600Å; primjetna oksidacija počinje na 250°C. Pri interakciji sa vodonikom (450 °C) nastaje ScH 2 hidrid, sa azotom (600-800 °C) - ScN nitrid, sa halogenima (400-600 °C) - jedinjenja tipa ScCl 3.
Skandij takođe reaguje sa borom i silicijumom na temperaturama iznad 1000 °C.
U vodi, spojevi skandijuma primjetno hidroliziraju i formiraju bazične soli. Sc 3+ joni su skloni polimerizaciji, stvaranju kompleksnih jona različitih tipova, čiji sastav zavisi od prirode anjona i pH sredine. Bazne soli u rastvoru lako se pretvaraju u amorfni hidroksid.
Metal se lako otapa u hlorovodoničkoj, azotnoj i sumpornoj kiselini (kako se koncentracija kiseline smanjuje, brzina rastvaranja skandijuma naglo opada i on ne reaguje sa 0,001 N rastvorima).
Razrijeđeni rastvori NaOH (10%) i mješavina koncentriranog HNO 3 i HF (1:1) praktično ne podliježu skandijumu.
Ogromni resursi skandijuma koncentrisani su u Rusiji i bivšem Sovjetskom Savezu (podaci o proizvodnji su veoma raštrkani, ali obim proizvodnje, prema nezavisnim stručnjacima, jednak je ili veći od službene svjetske proizvodnje). Generalno, prema nezavisnim stručnjacima, trenutno su glavni proizvođači skandijuma (skandijevog oksida) Rusija, Kina, Ukrajina i Kazahstan.
Poznata su dva skandijeva vlastita minerala: tortveit (Sc, Y)2 Si 2 O 7 (Sc2O3 do 53,5%) i steretit Sc 2H 2 O (Sc 2 O 3 do 39,2%), ali su izuzetno rijetki.
Skandij je tipičan element u tragovima i slab migrant i nalazi se u mnogim mineralima.
Tokom formiranja magmatskih stijena i njihovih venskih derivata, glavnina skandijuma je raspršena pretežno u tamno obojenim mineralima magmatskih stijena i u maloj mjeri koncentrirana u pojedinačnim mineralima postmagmatskih formacija.
Budući da je sadržaj skandijuma u stijenama različit, te zbog činjenice da su svojstva skandijuma bliska Mg, Al, Ca, Mn 2 +, Fe 2 +, TR, Hf, Th, U, Zr, onda je njegova glavna masa raspršena u mineralima koji sadrže ove elemente.
Skandij je dispergovani litofilni element (stimenski element), stoga je za tehnologiju ekstrakcije ovog elementa važno da se u potpunosti ekstrahuje iz prerađenih ruda, a razvojem metalurgije ruda koje sadrže skandij povećavaće se njegov godišnji obim proizvodnje.
Skandij se uglavnom ekstrahuje u obliku oksida tokom hidro- i pirometalurške obrade volframa, kalaja, titanijuma, uranijuma i boksita.
Skandij se sa sigurnošću može nazvati metalom 21. stoljeća i može se predvidjeti nagli porast njegove proizvodnje, rast cijena i potražnje zbog prerade ogromne količine kamenog uglja (posebno prerade ruskog kamenog uglja) u tekuće gorivo.
Skandijev oksid se koristi za proizvodnju ferita za memorijske elemente brzih računara. Radioaktivni 46 Sc se koristi u analizi neutronske aktivacije i u medicini. Legure skandija, koje imaju malu gustinu i visoku tačku topljenja, perspektivne su kao konstrukcijski materijali u konstrukciji raketa i aviona, a brojna jedinjenja skandijuma mogu naći primenu u proizvodnji fosfora, oksidnih katoda, u proizvodnji stakla i keramike, u hemijskoj industriji (kao katalizatori) iu drugim oblastima.
metalurgija. Skandij, kao metal visoke tačke topljenja, koristi se u mikroligaturama za proizvodnju vatrostalnih legura. Skandijev oksid se koristi za proizvodnju lonca za izlivanje čelika pri lijevanju visokolegiranih čelika. Skandij daje aluminijumskim legurama dodatnu snagu. Izotop skandij-46 koristi se za kontrolu procesa u metalurgiji.

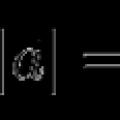 Pronalaženje dužine vektora, primjeri i rješenja Radnje s vektorima
Pronalaženje dužine vektora, primjeri i rješenja Radnje s vektorima Udaljenost od tačke do ravni - definicija i primjeri pronalaženja Udaljenost od početka koordinata do ravnine formule
Udaljenost od tačke do ravni - definicija i primjeri pronalaženja Udaljenost od početka koordinata do ravnine formule Vrste i svojstva vodenih masa
Vrste i svojstva vodenih masa