Što je karakteristično za kovalentnu vezu? Vrste kemijskih veza: ionske, kovalentne, metalne
Kovalentna veza je najčešći tip kemijske veze, koja se provodi interakcijama s istim ili sličnim vrijednostima elektronegativnosti.
Kovalentna veza je veza između atoma pomoću zajedničkih elektronskih parova.
Nakon otkrića elektrona, učinjeni su mnogi pokušaji da se razvije elektronička teorija kemijske veze. Najuspješniji su bili radovi Lewisa (1916.), koji je predložio razmatranje stvaranja veze kao posljedice pojave zajedničkih elektronskih parova za dva atoma. Da bi to učinio, svaki atom daje isti broj elektrona i pokušava se okružiti oktetom ili dubletom elektrona karakterističnim za vanjsku elektronsku konfiguraciju plemenitih plinova. Grafički, stvaranje kovalentnih veza zbog nesparenih elektrona korištenjem Lewisove metode prikazano je točkama koje označavaju vanjske elektrone atoma.
Stvaranje kovalentne veze prema Lewisovoj teoriji
Mehanizam stvaranja kovalentne veze
Glavna značajka kovalentne veze je prisutnost zajedničkog elektronskog para koji pripada obama kemijski povezanim atomima, jer je prisutnost dva elektrona u polju djelovanja dviju jezgri energetski povoljnija od prisutnosti svakog elektrona u polju svoju vlastitu jezgru. Do stvaranja zajedničkog elektronskog veznog para može doći različitim mehanizmima, najčešće izmjenom, a ponekad i donor-akceptorskim mehanizmima.
Prema principu razmjenskog mehanizma stvaranja kovalentne veze, svaki od atoma u interakciji dovodi isti broj elektrona s antiparalelnim spinovima za stvaranje veze. npr.:
 Opća shema nastanka kovalentne veze: a) prema mehanizmu izmjene; b) prema donor-akceptorskom mehanizmu
Opća shema nastanka kovalentne veze: a) prema mehanizmu izmjene; b) prema donor-akceptorskom mehanizmu Prema donor-akceptorskom mehanizmu, dvoelektronska veza nastaje kada različite čestice međusobno djeluju. Jedan od njih je i donator A: ima nepodijeljeni par elektrona (tj. onaj koji pripada samo jednom atomu), a drugi je akceptor U— ima praznu orbitalu.
Čestica koja daje dva elektrona (nedijeljeni par elektrona) za vezanje naziva se donor, a čestica s praznom orbitalom koja prihvaća taj elektronski par naziva se akceptor.
Mehanizam nastanka kovalentne veze zbog dvoelektronskog oblaka jednog atoma i prazne orbitale drugog naziva se donor-akceptorski mehanizam.
Donorsko-akceptorska veza inače se naziva semipolarna, jer se na atomu donora javlja djelomični efektivni pozitivni naboj δ+ (zbog činjenice da je njegov nepodijeljeni par elektrona odstupio od njega), a djelomični efektivni negativni naboj δ- se pojavljuje na akceptorski atom (zbog , da postoji pomak nepodijeljenog elektronskog para donora u njegovom smjeru).
Primjer jednostavnog donora elektronskog para je H ion — , koji ima nepodijeljeni elektronski par. Kao rezultat dodavanja negativnog hidridnog iona molekuli čiji središnji atom ima slobodnu orbitalu (na dijagramu označenu kao prazna kvantna ćelija), na primjer BH 3, nastaje kompleksni kompleksni ion BH 4 — s negativnim nabojem (N — + VN 3 ⟶⟶ [VN 4 ] -) :

Akceptor elektronskog para je vodikov ion ili jednostavno H + proton. Njegovo dodavanje molekuli čiji središnji atom ima nepodijeljeni elektronski par, na primjer NH3, također dovodi do stvaranja kompleksnog iona NH4+, ali s pozitivnim nabojem:

Metoda valentne veze
Prvi kvantno mehanička teorija kovalentne veze stvorili su Heitler i London (1927.) kako bi opisali molekulu vodika, a kasnije ju je primijenio Pauling na poliatomske molekule. Ova teorija se zove metoda valentne veze, čije se glavne odredbe mogu ukratko sažeti kako slijedi:
- svaki par atoma u molekuli drži zajedno jedan ili više zajedničkih parova elektrona, pri čemu se elektronske orbitale atoma u interakciji preklapaju;
- čvrstoća veze ovisi o stupnju preklapanja elektronskih orbitala;
- uvjet za nastanak kovalentne veze je protusmjer spinova elektrona; zbog toga nastaje generalizirana elektronska orbitala s najvećom gustoćom elektrona u internuklearnom prostoru, što osigurava međusobno privlačenje pozitivno nabijenih jezgri i popraćeno je smanjenjem ukupne energije sustava.
Hibridizacija atomskih orbitala
Unatoč činjenici da elektroni iz s-, p- ili d-orbitala, koji imaju različite oblike i različite orijentacije u prostoru, sudjeluju u stvaranju kovalentnih veza, u mnogim se spojevima te veze ispostavljaju kao ekvivalentne. Kako bi se objasnio ovaj fenomen, uveden je koncept "hibridizacije".
Hibridizacija je proces miješanja i poravnavanja orbitala po obliku i energiji, pri čemu dolazi do redistribucije gustoće elektrona bliskih orbitala po energiji, čime one postaju ekvivalentne.
Osnovne odredbe teorije hibridizacije:
- Tijekom hibridizacije početni oblik i orbitale se međusobno mijenjaju i nastaju nove, hibridizirane orbitale, ali iste energije i istog oblika, koje podsjećaju na nepravilnu osmicu.
- Broj hibridiziranih orbitala jednak je broju izlaznih orbitala uključenih u hibridizaciju.
- U hibridizaciji mogu sudjelovati orbitale sličnih energija (s- i p-orbitale vanjske energetske razine i d-orbitale vanjske ili preliminarne razine).
- Hibridizirane orbitale su više izdužene u smjeru stvaranja kemijskih veza i stoga omogućuju bolje preklapanje s orbitalama susjednog atoma, kao rezultat toga, postaju jače od one koju tvore elektroni pojedinačnih nehibridnih orbitala.
- Zbog stvaranja jačih veza i simetričnije raspodjele gustoće elektrona u molekuli, dobiva se energetski dobitak, koji s maržom kompenzira potrošnju energije potrebnu za proces hibridizacije.
- Hibridizirane orbitale moraju biti orijentirane u prostoru na način da osiguraju međusobnu najveću udaljenost; u ovom slučaju energija odbijanja je minimalna.
- Vrsta hibridizacije određena je vrstom i brojem izlaznih orbitala te mijenja veličinu veznog kuta kao i prostornu konfiguraciju molekula.
 Oblik hibridiziranih orbitala i vezni kutovi (geometrijski kutovi između osi simetrije orbitala) ovisno o vrsti hibridizacije: a) sp-hibridizacija; b) sp 2 hibridizacija; c) sp 3 hibridizacija
Oblik hibridiziranih orbitala i vezni kutovi (geometrijski kutovi između osi simetrije orbitala) ovisno o vrsti hibridizacije: a) sp-hibridizacija; b) sp 2 hibridizacija; c) sp 3 hibridizacija Pri formiranju molekula (ili pojedinačnih fragmenata molekula) najčešće se javljaju sljedeće vrste hibridizacije:
 Opća shema sp hibridizacije
Opća shema sp hibridizacije Veze koje nastaju uz sudjelovanje elektrona iz sp-hibridiziranih orbitala također su postavljene pod kutom od 180 0, što dovodi do linearnog oblika molekule. Ova vrsta hibridizacije uočena je u halogenidima elemenata druge skupine (Be, Zn, Cd, Hg), čiji atomi u valentnom stanju imaju nesparene s- i p-elektrone. Linearni oblik karakterističan je i za molekule drugih elemenata (0=C=0,HC≡CH), u kojima veze tvore sp-hibridizirani atomi.
 Shema sp 2 hibridizacije atomskih orbitala i ravnog trokutastog oblika molekule, koji je posljedica sp 2 hibridizacije atomskih orbitala
Shema sp 2 hibridizacije atomskih orbitala i ravnog trokutastog oblika molekule, koji je posljedica sp 2 hibridizacije atomskih orbitala Ova vrsta hibridizacije najtipičnija je za molekule p-elemenata treće skupine, čiji atomi u pobuđenom stanju imaju vanjsku elektronsku strukturu ns 1 np 2, gdje je n broj razdoblja u kojem se element nalazi. . Dakle, u molekulama BF 3, BCl 3, AlF 3 i druge veze nastaju zahvaljujući sp 2 hibridiziranim orbitalama središnjeg atoma.
 Shema sp 3 hibridizacije atomskih orbitala
Shema sp 3 hibridizacije atomskih orbitala Postavljanje hibridiziranih orbitala središnjeg atoma pod kut od 109 0 28` uzrokuje da molekule imaju tetraedarski oblik. Ovo je vrlo tipično za zasićene spojeve četverovalentnog ugljika CH 4, CCl 4, C 2 H 6 i drugih alkana. Primjeri spojeva drugih elemenata s tetraedarskom strukturom zbog sp 3 -hibridizacije valentnih orbitala središnjeg atoma su sljedeći ioni: BH 4 -, BF 4 -, PO 4 3-, SO 4 2-, FeCl 4 - .
 Opća shema sp 3d hibridizacije
Opća shema sp 3d hibridizacije Ovaj tip hibridizacije najčešće se nalazi u halogenidima nemetala. Primjer je struktura fosfornog klorida PCl 5, tijekom čijeg stvaranja atom fosfora (P ... 3s 2 3p 3) prvo prelazi u pobuđeno stanje (P ... 3s 1 3p 3 3d 1), a zatim podvrgava se s 1 p 3 d-hibridizaciji - pet jednoelektronskih orbitala postaju ekvivalentne i usmjerene su svojim izduženim krajevima prema uglovima mentalne trigonalne bipiramide. To određuje oblik molekule PCl 5, koja nastaje preklapanjem pet s 1 p 3 d-hibridiziranih orbitala s 3p-orbitalama pet atoma klora.
- sp - Hibridizacija. Kada se spoje jedna s-i i jedna p-orbitala, nastaju dvije sp-hibridizirane orbitale, smještene simetrično pod kutom od 180 0.
- sp 2 - Hibridizacija. Kombinacija jedne s- i dvije p-orbitale dovodi do stvaranja sp 2 -hibridiziranih veza smještenih pod kutom od 120 0, pa molekula poprima oblik pravilnog trokuta.
- sp 3 - Hibridizacija. Kombinacija četiri orbitale - jedne s- i tri p - dovodi do sp 3 - hibridizacije, u kojoj su četiri hibridizirane orbitale simetrično orijentirane u prostoru prema četiri vrha tetraedra, odnosno pod kutom od 109 0 28 ` .
- sp 3 d - Hibridizacija. Kombinacija jedne s-, tri p- i jedne d-orbitale daje sp 3 d-hibridizaciju, koja određuje prostornu orijentaciju pet sp 3 d-hibridiziranih orbitala prema vrhovima trigonalne bipiramide.
- Ostale vrste hibridizacije. U slučaju sp 3 d 2 hibridizacije, šest sp 3 d 2 hibridiziranih orbitala usmjereno je prema vrhovima oktaedra. Orijentacija sedam orbitala prema vrhovima pentagonalne bipiramide odgovara sp 3 d 3 hibridizaciji (ili ponekad sp 3 d 2 f) valentnih orbitala središnjeg atoma molekule ili kompleksa.
Metoda hibridizacije atomskih orbitala objašnjava geometrijsku strukturu velikog broja molekula, međutim, prema eksperimentalnim podacima, češće se opažaju molekule s malo drugačijim kutovima veze. Na primjer, u molekulama CH 4, NH 3 i H 2 O, središnji atomi su u sp 3 hibridiziranom stanju, pa bi se moglo očekivati da su vezni kutovi u njima tetraedarski (~ 109,5 0). Eksperimentalno je utvrđeno da je vezni kut u molekuli CH 4 zapravo 109,5 0. Međutim, u molekulama NH 3 i H 2 O vrijednost veznog kuta odstupa od tetraedarske: jednaka je 107,3 0 u molekuli NH 3 i 104,5 0 u molekuli H 2 O. Takva odstupanja se objašnjavaju prisutnost nepodijeljenog elektronskog para na atomima dušika i kisika. Dvoelektronska orbitala, koja sadrži nepodijeljeni par elektrona, zbog svoje povećane gustoće odbija jednoelektronske valentne orbitale, što dovodi do smanjenja veznog kuta. Za atom dušika u molekuli NH 3, od četiri sp 3 -hibridizirane orbitale, tri jednoelektronske orbitale tvore veze s tri atoma H, a četvrta orbitala sadrži nepodijeljeni par elektrona.
Nevezani elektronski par koji zauzima jednu od sp 3 -hibridiziranih orbitala usmjerenih prema vrhovima tetraedra, odbijajući jednoelektronske orbitale, uzrokuje asimetričnu raspodjelu gustoće elektrona koja okružuje atom dušika i, kao rezultat, komprimira vezu kut do 107,3 0. Slična slika smanjenja veznog kuta sa 109,5 0 na 107 0 kao rezultat djelovanja nepodijeljenog elektronskog para atoma N opaža se u molekuli NCl 3 .
 Odstupanje veznog kuta od tetraedra (109,5 0) u molekuli: a) NH3; b) NCl3
Odstupanje veznog kuta od tetraedra (109,5 0) u molekuli: a) NH3; b) NCl3 Atom kisika u molekuli H 2 O ima dvije jednoelektronske i dvije dvoelektronske orbitale na četiri sp 3 -hibridizirane orbitale. Jednoelektronske hibridizirane orbitale sudjeluju u stvaranju dviju veza s dva atoma H, a dva dvoelektronska para ostaju nepodijeljena, odnosno pripadaju samo atomu H. Time se povećava asimetrija distribucije gustoće elektrona oko atoma O i smanjuje vezni kut u usporedbi s tetraedarskim na 104,5 0.
Posljedično, broj nevezanih elektronskih parova središnjeg atoma i njihov smještaj u hibridiziranim orbitalama utječe na geometrijsku konfiguraciju molekula.
Karakteristike kovalentne veze
Kovalentna veza ima skup specifičnih svojstava koja određuju njezina specifična obilježja ili karakteristike. To, uz već spomenute karakteristike "energije veze" i "duljine veze", uključuje: kut veze, zasićenost, usmjerenost, polaritet i slično.
1. Vezni kut- ovo je kut između susjednih osi veze (to jest, uvjetne linije nacrtane kroz jezgre kemijski povezanih atoma u molekuli). Veličina veznog kuta ovisi o prirodi orbitala, tipu hibridizacije središnjeg atoma i utjecaju nepodijeljenih elektronskih parova koji ne sudjeluju u stvaranju veza.
2. Zasićenost. Atomi imaju sposobnost stvaranja kovalentnih veza, koje mogu nastati, prvo, mehanizmom izmjene zbog nesparenih elektrona neuzbuđenog atoma i zbog onih nesparenih elektrona koji nastaju kao rezultat njegove ekscitacije, i drugo, donorom - akceptorski mehanizam. Međutim, ukupan broj veza koje atom može formirati je ograničen.
Zasićenost je sposobnost atoma nekog elementa da tvori određeni, ograničeni broj kovalentnih veza s drugim atomima.
Dakle, druge periode, koje imaju četiri orbitale na vanjskoj energetskoj razini (jedna s- i tri p-), tvore veze, čiji broj ne prelazi četiri. Atomi elemenata drugih perioda s većim brojem orbitala na vanjskoj razini mogu tvoriti više veza.
3. Usredotočite se. Prema metodi, kemijska veza među atomima nastaje zbog preklapanja orbitala koje, s izuzetkom s-orbitala, imaju određenu orijentaciju u prostoru, što dovodi do usmjerenosti kovalentne veze.
Smjer kovalentne veze je raspored gustoće elektrona između atoma, koji je određen prostornom orijentacijom valentnih orbitala i osigurava njihovo maksimalno preklapanje.
Budući da elektronske orbitale imaju različite oblike i različite orijentacije u prostoru, njihovo međusobno preklapanje može se ostvariti na različite načine. Ovisno o tome razlikuju se σ-, π- i δ-veze.
Sigma veza (σ veza) je preklapanje elektronskih orbitala tako da je najveća gustoća elektrona koncentrirana duž zamišljene linije koja povezuje dvije jezgre.
Sigma vezu mogu formirati dva s elektrona, jedan s i jedan p elektron, dva p elektrona ili dva d elektrona. Takvu σ vezu karakterizira prisutnost jednog područja preklapanja elektronskih orbitala; ona je uvijek jednostruka, odnosno tvori je samo jedan elektronski par.

Raznolikost oblika prostorne orijentacije "čistih" orbitala i hibridiziranih orbitala ne dopušta uvijek mogućnost preklapanja orbitala na osi veze. Preklapanje valentnih orbitala može se dogoditi s obje strane osi veze - takozvano "lateralno" preklapanje, koje se najčešće događa tijekom stvaranja π veza.
Pi veza (π veza) je preklapanje elektronskih orbitala u kojem je najveća gustoća elektrona koncentrirana s obje strane linije koja povezuje atomske jezgre (tj. osi veze).
Pi veza može nastati međudjelovanjem dviju paralelnih p orbitala, dviju d orbitala ili drugih kombinacija orbitala čije se osi ne poklapaju s osi veze.
 Sheme za stvaranje π-veza između uvjetnih A i B atoma s bočnim preklapanjem elektronskih orbitala
Sheme za stvaranje π-veza između uvjetnih A i B atoma s bočnim preklapanjem elektronskih orbitala 4. Višestrukost. Ova karakteristika određena je brojem zajedničkih elektronskih parova koji povezuju atome. Kovalentna veza može biti jednostruka (jednostruka), dvostruka ili trostruka. Veza između dva atoma koja koristi jedan zajednički elektronski par naziva se jednostruka veza, dva elektronska para dvostruka veza, a tri elektronska para trostruka veza. Dakle, u molekuli vodika H 2 atomi su povezani jednostrukom vezom (H-H), u molekuli kisika O 2 - dvostrukom vezom (B = O), u molekuli dušika N 2 - trostrukom vezom (N ≡N). Višestrukost veza je od posebne važnosti u organskim spojevima - ugljikovodicima i njihovim derivatima: u etanu C 2 H 6 postoji jednostruka veza (C-C) između C atoma, u etilenu C 2 H 4 postoji dvostruka veza (C = C) u acetilenu C 2 H 2 - trostruki (C ≡ C)(C≡C).
Višestrukost veze utječe na energiju: s povećanjem množine raste i njezina snaga. Povećanje višestrukosti dovodi do smanjenja međunuklearne udaljenosti (duljine veze) i povećanja energije vezanja.
 Višestrukost veza između ugljikovih atoma: a) jednostruka σ-veza u etanu H3C-CH3; b) dvostruka σ+π veza u etilenu H2C = CH2; c) trostruka σ+π+π veza u acetilenu HC≡CH
Višestrukost veza između ugljikovih atoma: a) jednostruka σ-veza u etanu H3C-CH3; b) dvostruka σ+π veza u etilenu H2C = CH2; c) trostruka σ+π+π veza u acetilenu HC≡CH 5. Polaritet i polarizabilnost. Elektronska gustoća kovalentne veze može se različito locirati u međunuklearnom prostoru.
Polaritet je svojstvo kovalentne veze, koje je određeno položajem gustoće elektrona u međunuklearnom prostoru u odnosu na povezane atome.
Ovisno o položaju elektronske gustoće u međunuklearnom prostoru, razlikuju se polarne i nepolarne kovalentne veze. Nepolarna veza je veza u kojoj se zajednički elektronski oblak nalazi simetrično u odnosu na jezgre spojenih atoma i pripada podjednako oba atoma.
Molekule s ovom vrstom veze nazivaju se nepolarne ili homonuklearne (to jest one koje sadrže atome istog elementa). Nepolarna veza obično se očituje u homonuklearnim molekulama (H 2 , Cl 2 , N 2 itd.) ili, rjeđe, u spojevima formiranim od atoma elemenata sa sličnim vrijednostima elektronegativnosti, na primjer, karborund SiC. Polarna (ili heteropolarna) je veza u kojoj je ukupni elektronski oblak asimetričan i pomaknut prema jednom od atoma.
Molekule s polarnom vezom nazivamo polarnim ili heteronuklearnim. U molekulama s polarnom vezom, generalizirani elektronski par je pomaknut prema atomu s većom elektronegativnošću. Zbog toga se na tom atomu javlja određeni djelomični negativni naboj (δ-), koji se naziva efektivnim, a atom s manjom elektronegativnošću ima djelomični pozitivni naboj (δ+) iste veličine, ali suprotnog predznaka. Primjerice, eksperimentalno je utvrđeno da je efektivni naboj na atomu vodika u molekuli klorovodika HCl δH=+0,17, a na atomu klora δCl=-0,17 apsolutnog naboja elektrona.
Da bi se odredilo u kojem smjeru će se pomaknuti gustoća elektrona polarne kovalentne veze, potrebno je usporediti elektrone obaju atoma. Prema rastućoj elektronegativnosti, najčešći kemijski elementi poredani su sljedećim redom:
Polarne molekule nazivaju se dipola — sustavi u kojima se težišta pozitivnih naboja jezgri i negativnih naboja elektrona ne podudaraju.
Dipol je sustav koji je kombinacija dvaju točkastih električnih naboja, jednakih po veličini i suprotnog predznaka, smještenih na određenoj udaljenosti jedan od drugog.
Udaljenost između centara privlačenja naziva se duljina dipola i označava se slovom l. Polarnost molekule (ili veze) kvantitativno je obilježena dipolnim momentom μ, koji je kod dvoatomne molekule jednak umnošku duljine dipola i naboja elektrona: μ=el.
U SI jedinicama, dipolni moment se mjeri u [C × m] (Coulomb metri), ali se češće koristi izvansistemska jedinica [D] (debye): 1D = 3,33 · 10 -30 C × m. Vrijednost dipolnih momenata kovalentnih molekula varira unutar 0-4 D, a ionskih - 4-11 D. Što je dipol duži, to je molekula polarnija.
Zajednički elektronski oblak u molekuli može se pomaknuti pod utjecajem vanjskog električnog polja, uključujući polje druge molekule ili iona.
Polarizabilnost je promjena polariteta veze kao rezultat pomaka elektrona koji tvore vezu pod utjecajem vanjskog električnog polja, uključujući polje sile druge čestice.
Polarizabilnost molekule ovisi o pokretljivosti elektrona, koja je to jača što je udaljenost od jezgri veća. Osim toga, polarizabilnost ovisi o smjeru električnog polja i sposobnosti elektronskih oblaka da se deformiraju. Pod utjecajem vanjskog polja nepolarne molekule postaju polarne, a polarne još polarnije, odnosno u molekulama se inducira dipol koji se naziva reducirani ili inducirani dipol.
 Shema nastanka induciranog (reduciranog) dipola iz nepolarne molekule pod utjecajem polja sila polarne čestice - dipola.
Shema nastanka induciranog (reduciranog) dipola iz nepolarne molekule pod utjecajem polja sila polarne čestice - dipola. Za razliku od trajnih, inducirani dipoli nastaju samo pod djelovanjem vanjskog električnog polja. Polarizacija može izazvati ne samo polarizabilnost veze, već i njezino pucanje, pri čemu dolazi do prijenosa veznog elektronskog para na jedan od atoma i stvaranja negativno i pozitivno nabijenih iona.
Polarnost i polarizabilnost kovalentnih veza određuje reaktivnost molekula prema polarnim reagensima.
Svojstva spojeva s kovalentnom vezom
Tvari s kovalentnim vezama dijele se u dvije nejednake skupine: molekularne i atomske (ili nemolekularne), kojih je mnogo manje od molekularnih.
U normalnim uvjetima molekularni spojevi mogu biti u različitim agregatnim stanjima: u obliku plinova (CO 2, NH 3, CH 4, Cl 2, O 2, NH 3), vrlo hlapljivih tekućina (Br 2, H 2 O, C 2 H 5 OH ) ili čvrste kristalne tvari od kojih se većina, čak i uz vrlo lagano zagrijavanje, može brzo rastopiti i lako sublimirati (S 8, P 4, I 2, šećer C 12 H 22 O 11, "suhi led" CO 2).
Niske temperature taljenja, sublimacije i vrelišta molekulskih tvari objašnjavaju se vrlo slabim silama međumolekularnog međudjelovanja u kristalima. Zato se molekularni kristali ne odlikuju velikom čvrstoćom, tvrdoćom i električnom vodljivošću (led ili šećer). U tom slučaju tvari s polarnim molekulama imaju viša tališta i vrelišta od onih s nepolarnima. Neki od njih su topljivi u drugim polarnim otapalima. Naprotiv, tvari s nepolarnim molekulama bolje se otapaju u nepolarnim otapalima (benzen, ugljikov tetraklorid). Tako se jod, čije su molekule nepolarne, ne otapa u polarnoj vodi, ali se otapa u nepolarnom CCl 4 i niskopolarnom alkoholu.
Nemolekularne (atomske) tvari s kovalentnim vezama (dijamant, grafit, silicij Si, kvarc SiO 2, karborund SiC i dr.) tvore izuzetno čvrste kristale, s izuzetkom grafita koji ima slojevitu strukturu. Na primjer, kristalna rešetka dijamanta pravilan je trodimenzionalni okvir u kojem je svaki sp 3 -hibridizirani ugljikov atom povezan s četiri susjedna atoma σ vezama. Zapravo, cijeli kristal dijamanta jedna je ogromna i vrlo jaka molekula. Kristali silicija, koji se naširoko koriste u radioelektronici i elektroničkom inženjerstvu, imaju sličnu strukturu. Ako polovicu C atoma u dijamantu zamijenite Si atomima bez narušavanja okvirne strukture kristala, dobit ćete kristal karborunda - silicijevog karbida SiC - vrlo tvrde tvari koja se koristi kao abrazivni materijal. A ako se u kristalnoj rešetki silicija jedan atom O umetne između svaka dva atoma Si, tada nastaje kristalna struktura kvarca SiO 2 - također vrlo tvrde tvari, čija se vrsta također koristi kao abrazivni materijal.
Kristali dijamanta, silicija, kvarca i sličnih struktura su atomski kristali; oni su ogromne "supermolekule", pa se njihove strukturne formule ne mogu prikazati u cijelosti, već samo u obliku zasebnog fragmenta, na primjer:
 Kristali dijamanta, silicija, kvarca
Kristali dijamanta, silicija, kvarca Nemolekularni (atomski) kristali, koji se sastoje od atoma jednog ili dva elementa međusobno povezanih kemijskim vezama, klasificiraju se kao vatrostalne tvari. Visoke temperature taljenja uzrokovane su potrebom utroška velike količine energije za kidanje jakih kemijskih veza pri taljenju atomskih kristala, a ne slabim međumolekularnim interakcijama, kao u slučaju molekulskih tvari. Iz istog razloga se mnogi atomski kristali zagrijavanjem ne tale, već se raspadaju ili odmah prelaze u stanje pare (sublimacija), npr. grafit sublimira na 3700 o C.
Nemolekularne tvari s kovalentnim vezama netopljive su u vodi i drugim otapalima; većina ih ne provodi električnu struju (osim grafita, koji je sam po sebi vodljiv, i poluvodiča - silicija, germanija itd.).
Kovalentna veza
Obilježja kemijskih veza. Hibridizacija.
PREDAVANJE br.3. Kemijska veza i molekularna struktura. Valencija.
Samo je nekoliko kemijskih elemenata u prirodnim uvjetima u monoatomskom stanju (primjerice, inertni plinovi). Slobodni atomi drugih elemenata tvore složenije sustave – molekule koje imaju stabilnije elektronske konfiguracije. Taj se fenomen naziva stvaranje kemijske veze.
Kemijska veza - To je međudjelovanje dvaju ili više atoma, uslijed čega nastaje kemijski stabilan dvo- ili poliatomski sustav. Stvaranje kemijske veze prati smanjenje ukupne energije sustava.
Teorija kemijske veze temelji se na idejama o elektroničkim interakcijama. Najstabilnije (jake) skupine elektrona su završeni vanjski elektronski slojevi atoma plemenitih plinova (dvoelektronski za helij i osmoelektronski za ostale plemenite plinove). Nepotpuni vanjski elektronički slojevi svih ostalih elemenata su nestabilni i kada se takvi atomi kombiniraju s drugim atomima, dolazi do restrukturiranja njihovih elektroničkih ljuski. Kemijsku vezu tvore valentni elektroni, ali se javlja na različite načine.
Valencija nazivaju se elektroni koji sudjeluju u stvaranju kemijskih veza, uglavnom elektroni zadnje ili pretposljednje energetske razine.
Postoji nekoliko vrsta kemijskih veza: ionska, metalna, kovalentna i vodikova.
Najjednostavniji primjer kovalentne veze je stvaranje molekule vodika. Atomi vodika imaju elektronsku ljusku od jednog nesparenog s-elektrona, tj. Jedan elektron nedostaje za dovršetak razine. Kada se atomi vodika približe određenoj udaljenosti, elektroni s antiparalelnim spinovima stupaju u interakciju s formacijom Općenito elektronski par. Zajednički elektronski par nastaje kao rezultat djelomičnog preklapanja s-orbitala, a najveća gustoća nastaje u području preklapajućih orbitala.
Povezivanje atoma pomoću zajedničkih elektronskih parova naziva se kovalentni.
Molekula s kovalentnom vezom može se napisati u obliku dviju formula: elektronske (elektron je označen točkom) i strukturne (zajednički elektronski par označen je crticom).
1. Duljina veze je udaljenost između jezgri atoma. Izraženo u nm. Što je kemijska veza kraća, to je jača. Međutim, mjera snage veze je njezina energija.
2. Komunikacijska energija - to je količina energije koja se oslobađa tijekom stvaranja kemijske veze i, prema tome, to je rad koji se mora potrošiti na prekid veze. Izraženo u kJ/mol. Energija veze raste kako se duljina veze smanjuje.
3. Ispod zasićenost razumjeti sposobnost atoma da stvaraju ograničeni broj kovalentnih veza. Na primjer, atom vodika, koji ima jedan nespareni elektron, može formirati jednu vezu, a atom ugljika u pobuđenom stanju ne može formirati više od četiri veze. Zbog zasićenosti veza molekule imaju određeni sastav. Međutim, čak i kod zasićenih kovalentnih veza, donor-akceptorskim mehanizmom mogu nastati složenije molekule.
4. Mnoštvo određen brojem zajedničkih elektronskih parova između atoma, tj. broj kemijskih veza. U razmatranoj molekuli vodika, kao iu molekulama fluora i klora, veza između atoma ostvaruje se zahvaljujući jednom elektronskom paru, takva se veza naziva singl. U molekuli kisika - dvostruko, a u molekuli dušika – utrostručiti.
Štoviše, kovalentne veze mogu biti dvije vrste:
1) Ako se elektronski oblaci preklapaju u smjeru ravne linije koja spaja jezgre atoma (tj. duž komunikacijska os ), takva se kovalentna veza naziva sigma veza . Kovalentne sigma veze nastaju preklapanjem orbitala: s-s (molekula vodika), s-p (klorovodik) i p-p (molekula klora).
2) Ako se p-orbitale usmjerene okomito na os veze preklapaju, nastaju dva preklapajuća područja s obje strane osi veze i takva se veza naziva pi veza .
Unatoč činjenici da je energija pi veze manja od sigma, ukupna energija dvostruke, a još više trostruke veze veća je od jednostruke.
5. Polaritet veza je određena položajem zajedničkog elektronskog para; ako je raspoređena u prostoru simetrično u odnosu na jezgre oba atoma, tada se takva kovalentna veza naziva nepolarni . Primjer su dvoatomne molekule koje se sastoje od atoma istog elementa, tj. jednostavne tvari.
U slučaju polarna kovalentna veza , molekulu tvore atomi različitih elemenata i oblak elektronske veze, u ovom slučaju, pomaknut je na atom s većom relativnom elektronegativnošću. Na primjer, tijekom formiranja molekule HCl, zajednički elektronski par je pomaknut na atom klora, budući da ima veći EO.
EO je sposobnost atoma elemenata da privuku zajedničke elektronske parove. Atom više EO elementa preuzima efektivni negativni naboj d-, a drugi atom preuzima efektivni pozitivni naboj d+. Kao rezultat toga, postoji dipol. Mjera polariteta veze je električni dipolni moment .
6. Usredotočite se kovalentna veza određuje prostornu strukturu molekula, tj. njihov geometrijski oblik. Smjer se određuje kvantitativno vezni kut je kut između kemijskih veza. Kovalentne veze koje tvore viševalentni atomi uvijek imaju prostornu orijentaciju.
Osim karakteristika koje su zajedničke svakoj kemijskoj vezi (energija, duljina), kovalentna veza ima i dodatne značajke: mnogostrukost, zasićenost, usmjerenost, konjugacija, polaritet I polarizabilnost.
Mnoštvo
Između atoma koji se spajaju mogu se formirati jedna, dvije ili tri kovalentne veze.
Višestrukost (ili red) kovalentne veze karakterizira broj zajedničkih elektronskih parova između spojenih atoma.
Par elektrona između atoma predstavljen je spojnom linijom - valentni udar.
Ako između spojenih atoma postoji jedan elektronski par, govori se o jednostavnoj (običnoj ili jednostrukoj) kovalentnoj vezi.
Na primjer, u molekulama H 2, F 2, HF, H 2 O, NH 3, CH 4, CH 3 CH 3 ili složenim ionima OH -, +, 2-, 2+, sve veze među atomima su jednostruke i σ - obveznice.
Ako atomi koji se povezuju imaju dva ili tri zajednička elektronska para između sebe, postoji dvostruka ili trostruka kovalentna veza, pri čemu je jedna veza nužno σ-veza, a ostale su π-veze.
![]()
Primjeri su molekule ili poliatomski ioni, gdje postoje višestruke (dvostruke ili trostruke) veze između atoma: N≡N (dušik), H 2 C=CH 2 (etilen), H 2 C=O (formaldehid), HC≡CH ( acetilen), O=N-O - , C≡N - (cijanidni ion).
Kako se višestrukost kovalentne veze povećava, njezina se duljina smanjuje, a njezina snaga raste:
Međutim, porast energije kovalentne veze, kao što se vidi iz navedenih vrijednosti, nije proporcionalan porastu njezine mnogostrukosti, što ukazuje na razliku u energijama σ- i π-veza, a E σ > E π . To je zbog činjenice da je učinkovitost preklapanja atomskih orbitala pri formiranju σ-molekulske orbitale veća nego kod formiranja π-molekulske orbitale.
Zasićenost
Svaki atom je sposoban formirati određeni broj kovalentnih veza, zahvaljujući čemu molekule imaju određeni sastav: H 2, H 2 O, PCl 5, CH 4.
Broj mogućih kovalentnih veza koje tvori dani atom ovisi, u mehanizmu izmjene, o broju nesparenih elektrona na vanjskoj energetskoj razini atoma u osnovnom i pobuđenom stanju, a u donorno-akceptorskom stanju također o broj slobodnih orbitala u vanjskim razinama.
Pri određivanju broja kovalentnih veza koje atom određenog elementa može stvoriti mehanizmom izmjene, treba uzeti u obzir da kada atom prijeđe u pobuđeno stanje, broj njegovih nesparenih elektrona može se povećati kao rezultat sparivanje nekih elektronskih parova i prijelaz elektrona na više energetske podrazine. Ako je energija utrošena na pobuđivanje atoma mala, tada se može kompenzirati energijom nastale kemijske veze, a pobuđeno stanje atoma se stabilizira.
Mali utrošci energije praćeni su prijelazima elektrona na više energetske podrazine unutar razine. Prijelazi elektrona s energetskih podrazina jedne razine na podrazine druge razine zahtijevaju velike količine energije, stoga pobuđena stanja atoma elemenata prve tri periode periodnog sustava kemijskih elemenata D. I. Mendeljejeva, koja nastaju kao rezultat takvih prijelaza, ne može se stabilizirati kemijskim vezama.
Odredimo valencije 1 atoma elemenata prve i druge periode periodnog sustava kemijskih elemenata u osnovnom i pobuđenom stanju.
Atom vodika ima jedan elektron, pa je njegova valencija uvijek jednaka I.
U atomu helija dva elektrona zauzimaju l s- orbitalni. Uparivanje i pomicanje jednog od tih elektrona na višu energetsku razinu zahtijeva mnogo energije, tako da je atom helija kemijski inertan.
Valencije atoma litija Li, dušika N, kisika O, fluora F i neona Ne jednake su broju nesparenih elektrona u osnovnom stanju, budući da je sparivanje elektronskih parova atoma ovih elemenata moguće samo kada se elektron pomakne na viša razina energije:

Iz danih dijagrama elektroničkih formula jasno je da je valencija atoma litija jednaka I, dušika - III, kisika - II, fluora - I, neona - 0. U atomima berilija Be, bora B i ugljika C , može doći do sparivanja elektronskih parova i prijenosa elektrona iz 2 s- podrazina do slobodnih orbitala 2 R- podnivo.
Prijelaz na višu energetsku podrazinu unutar razine ne zahtjeva veliki utrošak energije, a može se nadoknaditi stvaranjem kemijske veze. Stoga se takvi prijelazi provode u uvjetima uobičajenih kemijskih reakcija. Stoga su valencije II, III i IV, svojstvene atomima Be, B i C u pobuđenom stanju, karakterističnije od valencija I i II u atomima B i C, određene brojem nesparenih R- elektroni u svom osnovnom stanju:

Počevši od treće periode, atomi R- elemenata pri ekscitaciji vanjskih elektrona s- I R- podrazine se mogu pomaknuti na prazne d- podrazine, što uzrokuje povećanje broja mogućih kemijskih veza. To objašnjava sposobnost atoma fosfora P da tvore pet kemijskih veza (PCl 5), atoma sumpora S - četiri (SO 2) ili šest (SO 3), a atoma klora Cl - tri, pet pa čak i sedam (tzv. dolazi do proširenja okteta):
![]()
U većini slučajeva, kada se formira veza, elektroni vezanih atoma se dijele. Ova vrsta kemijske veze naziva se kovalentna veza (prefiks "co-" na latinskom znači kompatibilnost, "valens" znači imati snagu). Vezni elektroni nalaze se prvenstveno u prostoru između vezanih atoma. Zbog privlačenja atomskih jezgri tim elektronima nastaje kemijska veza. Dakle, kovalentna veza je kemijska veza koja nastaje zbog povećanja gustoće elektrona u području između kemijski povezanih atoma.
Prva teorija kovalentnih veza pripada američkom fizikalnom kemičaru G.-N. Lewis. Godine 1916. predložio je da se veze između dva atoma odvijaju pomoću para elektrona, s ljuskom od osam elektrona koja se obično formira oko svakog atoma (pravilo okteta).
Jedno od bitnih svojstava kovalentne veze je njezina zasićenost. S ograničenim brojem vanjskih elektrona u područjima između jezgri, u blizini svakog atoma formira se ograničen broj elektronskih parova (a time i broj kemijskih veza). Upravo je taj broj usko povezan s pojmom valencije atoma u molekuli (valencija je ukupan broj kovalentnih veza koje tvori atom). Drugo važno svojstvo kovalentne veze je njezina usmjerenost u prostoru. To se očituje u približno istoj geometrijskoj strukturi kemijskih čestica sličnog sastava. Značajka kovalentne veze je i njena polarizabilnost.
Za opisivanje kovalentnih veza uglavnom se koriste dvije metode koje se temelje na različitim aproksimacijama pri rješavanju Schrödingerove jednadžbe: metoda molekularnih orbitala i metoda valentnih veza. Trenutačno teorijska kemija koristi gotovo isključivo metodu molekularne orbite. Međutim, metoda valentne veze, unatoč velikoj složenosti izračuna, daje jasniju ideju o formiranju i strukturi kemijskih čestica.
Parametri kovalentne veze
Skup atoma koji tvore kemijsku česticu značajno se razlikuje od skupa slobodnih atoma. Stvaranje kemijske veze dovodi, posebice, do promjene polumjera atoma i njihove energije. Dolazi i do preraspodjele gustoće elektrona: povećava se vjerojatnost pronalaska elektrona u prostoru između povezanih atoma.
Duljina kemijske veze
Kada se formira kemijska veza, atomi se uvijek približavaju - udaljenost između njih manja je od zbroja polumjera izoliranih atoma:
r(A−B) r(A) + r(B)
Polumjer atoma vodika je 53 pm, atoma fluora 71 pm, a udaljenost jezgri atoma u molekuli HF je 92 pm:
Međujezgreni razmak između kemijski povezanih atoma naziva se duljina kemijske veze.
U mnogim slučajevima, duljina veze između atoma u molekuli tvari može se predvidjeti poznavanjem udaljenosti između tih atoma u drugim kemijskim tvarima. Duljina veze između atoma ugljika u dijamantu je 154 pm, a između atoma halogena u molekuli klora - 199 pm. Poluzbroj udaljenosti između atoma ugljika i klora, izračunat iz ovih podataka, iznosi 177 pm, što se poklapa s eksperimentalno izmjerenom duljinom veze u molekuli CCl 4 . U isto vrijeme, to se ne radi uvijek. Na primjer, udaljenost između atoma vodika i broma u dvoatomnim molekulama je 74, odnosno 228 pm. Aritmetička sredina tih brojeva je 151 pm, ali stvarna udaljenost između atoma u molekuli bromovodika je 141 pm, dakle osjetno manje.
Udaljenost između atoma značajno se smanjuje kada se stvaraju višestruke veze. Što je višestrukost veze veća, to je kraća međuatomska udaljenost.
Duljine nekih jednostavnih i višestrukih veza
Vezni kutovi
Smjer kovalentnih veza karakteriziraju vezni kutovi – kutovi između linija koje povezuju vezane atome. Grafička formula kemijske čestice ne sadrži podatke o veznim kutovima. Na primjer, u sulfatnom ionu SO 4 2− vezni kut između veza sumpor-kisik iznosi 109,5 o, a u tetrakloropaladatnom ionu 2− − 90 o. Ukupnost duljina veza i veznih kutova u kemijskoj čestici određuje njezinu prostornu strukturu. Za određivanje veznih kutova koriste se eksperimentalne metode proučavanja strukture kemijskih spojeva. Vrijednosti veznih kutova mogu se teoretski procijeniti na temelju elektronske strukture kemijske čestice.Energija kovalentne veze
Kemijski spoj nastaje iz pojedinih atoma samo ako je to energetski povoljno. Ako privlačne sile prevladaju nad odbojnim silama, potencijalna energija međudjelovanja atoma se smanjuje, au suprotnom se povećava. Na određenoj udaljenosti (jednakoj duljini veze r 0) ova energija je minimalna.

Dakle, kada se kemijska veza stvara, energija se oslobađa, a kada se ona prekine, energija se apsorbira. energija E 0, koji je potreban za odvajanje atoma i njihovo udaljavanje jedan od drugoga na udaljenosti na kojoj ne međusobno djeluju, naziva se energija vezanja. Za dvoatomne molekule, energija vezanja je definirana kao energija disocijacije molekule na atome. Može se izmjeriti eksperimentalno.
U molekuli vodika energija vezanja brojčano je jednaka energiji koja se oslobađa tijekom stvaranja molekule H2 iz H atoma:
H + H = H2 + 432 kJ
Za raskid H-H veze potrebno je utrošiti istu energiju:
H 2 = H + H − 432 kJ
Za poliatomske molekule ova je vrijednost uvjetna i odgovara energiji procesa u kojem određena kemijska veza nestaje, a sve ostale ostaju nepromijenjene. Ako postoji nekoliko identičnih veza (na primjer, za molekulu vode koja sadrži dvije veze kisik-vodik), njihova se energija može izračunati pomoću Hessov zakon. Poznate su energetske vrijednosti za razgradnju vode na jednostavne tvari, kao i energija za disocijaciju vodika i kisika na atome:
2H20 = 2H2 + O2; 484 kJ/mol
H2 = 2H; 432 kJ/mol
O2 = 20; 494 kJ/mol
S obzirom da dvije molekule vode sadrže 4 veze, energija veze kisik-vodik jednaka je:
E(O−H) = (2,432 + 494 + 484) / 4 = 460,5 kJ/mol
U molekulama sastava AB n uzastopnu apstrakciju B atoma prati određeni (ne uvijek identični) utrošak energije. Na primjer, vrijednosti energije (kJ/mol) za sekvencijalno uklanjanje atoma vodika iz molekule metana značajno se razlikuju:
| 427 | 368 | 519 | 335 | |||||
| CH 4 | → | CH 3 | → | CH 2 | → | CH | → | S |
U ovom slučaju, energija veze A-B definirana je kao prosječna količina energije potrošene u svim fazama:
CH4 = C + 4H; 1649 kJ/mol
E(C−H) = 1649 / 4 = 412 kJ/mol
Što je veća energija kemijske veze, to je veza jača. Veza se smatra jakom ili snažnom ako njezina energija prelazi 500 kJ/mol (na primjer, 942 kJ/mol za N 2), slaba - ako je njezina energija manja od 100 kJ/mol (na primjer 69 kJ/mol za NE 2). Ako se međudjelovanjem atoma oslobađa energija manja od 15 kJ/mol, tada se smatra da ne dolazi do kemijske veze, ali se promatra međumolekulsko međudjelovanje (npr. 2 kJ/mol za Xe 2). Snaga veze općenito se smanjuje kako se duljina veze povećava.Jednostruka veza uvijek je slabija od višestrukih veza – dvostrukih i trostrukih – između istih atoma.
Energije nekih jednostavnih i višestrukih veza
Polaritet kovalentne veze
Polaritet kemijske veze ovisi o razlici u elektronegativnosti vezanih atoma.
Elektronegativnost- uvjetna vrijednost koja karakterizira sposobnost atoma u molekuli da privuče elektrone. Ako u dvoatomnoj molekuli A−B elektrone koji tvore vezu privlači atom B jače nego atom A, tada se atom B smatra elektronegativnijim.
Skalu elektronegativnosti koristio je L. Pauling kvantitativno karakterizirati sposobnost atoma da polariziraju kovalentne veze. Za kvantitativno opisivanje elektronegativnosti, osim termokemijskih podataka, koriste se i podaci o geometriji molekula (Sandersonova metoda) ili spektralnim karakteristikama (Gordyjeva metoda). Allredova i Rochowova ljestvica također se široko koristi, u kojoj se u izračunima koriste efektivni nuklearni naboj i atomski kovalentni radijus. Metoda koju je predložio američki fizikalni kemičar R. Mulliken (1896.-1986.) ima najjasnije fizičko značenje. On je definirao elektronegativnost atoma kao polovicu zbroja njegovog afiniteta prema elektronu i potencijala ionizacije. Vrijednosti elektronegativnosti temeljene na Mullikenovoj metodi i proširene na širok raspon različitih objekata nazivaju se apsolutnim.
Najveću vrijednost elektronegativnosti ima fluor. Najmanje elektronegativan element je cezij. Što je veća razlika u elektronegativnosti između dva atoma, to je kemijska veza između njih polarnija.
Ovisno o tome kako se elektronska gustoća preraspoređuje tijekom stvaranja kemijske veze, razlikuje se nekoliko vrsta. Granični slučaj polarizacije kemijske veze je potpuni prijenos elektrona s jednog atoma na drugi. U tom slučaju nastaju dva iona između kojih nastaje ionska veza. Kako bi dva atoma tvorila ionsku vezu, njihove elektronegativnosti moraju biti vrlo različite. Ako je elektronegativnost atoma jednaka (kada su molekule sastavljene od identičnih atoma), veza se naziva nepolarni kovalentni. Najčešće polarni kovalentni veza - nastaje između bilo kojih atoma koji imaju različite vrijednosti elektronegativnosti.
Kvantitativna procjena polaritet("ionicity") veze mogu poslužiti efektivnim nabojima atoma. Efektivni naboj atoma karakterizira razlika između broja elektrona koji pripadaju danom atomu u kemijskom spoju i broja elektrona slobodnog atoma. Atom elektronegativnijeg elementa jače privlači elektrone. Stoga su mu elektroni bliži, a on dobiva neki negativni naboj, koji se naziva efektivnim, a njegov partner ima isti pozitivan naboj. Ako su elektroni koji tvore vezu između atoma jednako podijeljeni, efektivni naboji su nula. U ionskim spojevima efektivni naboji moraju odgovarati nabojima iona. A za sve ostale čestice imaju srednje vrijednosti.
Najbolja metoda za procjenu naboja atoma u molekuli je rješavanje valne jednadžbe. Međutim, to je moguće samo ako postoji mali broj atoma. Raspodjela naboja može se kvalitativno ocijeniti pomoću skale elektronegativnosti. Koriste se i razne eksperimentalne metode. Za dvoatomne molekule, polaritet veze može se karakterizirati i efektivni naboji atoma mogu se odrediti na temelju mjerenja dipolnog momenta:
μ = q r,
Gdje q− naboj dipolnog pola, jednak efektivnom naboju za dvoatomnu molekulu, r− međunuklearna udaljenost.
Dipolni moment sprege je vektorska veličina. Usmjeren je od pozitivno nabijenog dijela molekule prema njenom negativnom dijelu. Na temelju mjerenja dipolnog momenta utvrđeno je da u molekuli klorovodika HCl atom vodika ima pozitivan naboj od +0,2 udjela naboja elektrona, a atom klora negativan naboj od -0,2. To znači da je H–Cl veza 20% ionske prirode. Veza Na–Cl je 90% ionska.
1. Orijentacija u prostoru. Ako se elektronski oblaci preklapaju u smjeru linije koja spaja jezgre atoma, takva se veza naziva s-veza(s–s preklapanje H2, r–rCl2, s–rHC1).
Kada se p-orbitale usmjerene okomito na os veze preklapaju, formiraju se dva područja preklapanja s obje strane osi veze. Ova kovalentna veza naziva se p-veza. Na primjer, u molekuli dušika atomi su povezani jednom s-vezom i dvije p-veze.
Smjer veze određuje prostornu strukturu molekula, tj. njihov oblik i karakteriziran je prisutnošću strogo definiranog kuta između veza. Na primjer, kut između s-veza u molekuli vode je 104,5°.

2. Polaritet komunikacije određena je asimetrijom u raspodjeli ukupnog elektronskog oblaka duž osi veze.
Ako su zajednički elektronski parovi smješteni simetrično u odnosu na obje jezgre, tada se takva kovalentna veza naziva nepolarnom.
Ako su zajednički elektronski parovi pomaknuti na jedan od atoma (raspoređeni asimetrično u odnosu na jezgre različitih atoma), tada se takva kovalentna veza naziva polarnom.
U slučaju kada se elektronski par pomakne prema elektronegativnijem atomu, središta (+) i (–) naboja se ne poklapaju i nastaje sustav (električni dipol) od dva naboja jednaka po veličini, ali suprotnog predznaka, udaljenost između kojih je ( l) naziva se duljina dipola. Mjera molekularne polarnosti je električni dipolni moment m, jednak umnošku apsolutne vrijednosti naboja elektrona
(q = 1,6 × 10 –19 C) po duljini dipola l:
m = q× l.
Jedinica za m je debye D, 1 D = 3,33×10 –30 C×m.
Vježbajte. Duljina dipola molekule HCl je 2,2 × 10 –9 cm Izračunajte električni moment dipola.
2,2×10 –9 cm = 2,2×10 –11 m
m = 1,6 × 10 –19 × 2,2 × 10 –11 = 3,52 × 10 –30 Kl × m = 3,52 × 10 –30 / 3,33 × 10 –30 = 1,06 D.
3. Mnoštvo Kovalentna veza određena je brojem zajedničkih elektronskih parova koji povezuju atome. Veza između dva atoma pomoću jednog para elektrona naziva se jednostavan(veze H – C1, C – H, H – O, itd.). Vezivanje pomoću dva elektronska para naziva se dvostruko(etilen H 2 C = CH 2) , pomoću tri elektronska para - utrostručiti(dušik N N, acetilen N – C C – H).
4.Duljina veze je ravnotežna udaljenost između atomskih jezgri. Duljina veze izražava se u nanometrima (nm). 1 nm = 10 –9 m. Što je duljina veze kraća, to je kemijska veza jača.
5. Komunikacijska energija jednak radu potrebnom za prekid veze. Izrazite energiju vezanja u kilodžulima po molu (kJ/mol). Energija veze raste sa smanjenjem duljine veze i povećanjem višestrukosti veze. Proces stvaranja veze događa se uz oslobađanje energije (egzotermni proces), a proces kidanja veze uključuje apsorpciju energije (endotermni proces).
Hibridizacija
Hibridizacija– poravnanje orbitala po obliku i energiji.
Sp hibridizacija
Razmotrimo primjer berilijevog hidrida BeH 2. Elektronska struktura Be atoma u normalnom stanju je 1s 2 2s 2. Atom berilija može djelovati s atomima vodika samo u pobuđenom stanju (s ® p-prijelaz).
Budi – 1s 2 2s 1 2p 1

Dvije formirane veze moraju biti različite energije, jer je stvaranje jedne povezano s preklapanjem dviju s-orbitala, druge
roj – s- i p-orbitale. Tada atomi vodika u molekuli moraju biti kemijski nejednaki: jedan je pokretljiviji i reaktivniji od drugog. Eksperimentalno, to nije slučaj - oba atoma vodika su energetski ekvivalentna. Kako bi objasnio ovaj fenomen, J.K. Slater i L. Pauling predložili su da je "prilikom tumačenja i izračunavanja veznih kutova i duljina veza, preporučljivo zamijeniti veze koje su bliske po energiji s jednakim brojem energetski ekvivalentnih veza." Veze koje nastaju na taj način su hibridne.
Dakle, jedna s- i jedna p-orbitala atoma berilija zamijenjene su dvjema energetski ekvivalentnim sp-orbitalama koje se nalaze pod kutom od 180 o jedna prema drugoj, t.j. molekula ima linearnu strukturu.

sp 2 hibridizacija
Razmotrimo primjer molekule bor hidrida BH 3. Elektronska struktura atoma bora u normalnom stanju je B – 1s 2 2s 2 2p 1. Može tvoriti samo jednu kovalentnu vezu. Tri kovalentne veze za atom bora karakteristične su samo u pobuđenom stanju B* – 1s 2 2s 1 2p 2

Jedna veza, nastala preklapanjem dviju s-orbitala atoma B i H, energetski se ne razlikuje od druge dvije, nastale preklapanjem s- i p-orbitala. Tri sp 2 -hibridne orbitale smještene pod kutom od 120 o jedna prema drugoj, molekula ima ravnu strukturu. Slična je slika tipična za sve tetraatomske molekule formirane od tri sp 2 hibridne veze, na primjer, bor klorid (BCl 3).

sp 3 hibridizacija
Pogledajmo primjer metana CH4. U normalnom stanju atom ugljika s elektronskom strukturom 1s 2 2s 2 2p 2 može tvoriti samo dvije kovalentne veze. U pobuđenom stanju može biti četverovalentan s elektronskom strukturom 1s 2 2s 1 2p 3.

Jedna s- i tri p-orbitale ugljikovog atoma postaju hibridne, a nastaju četiri sp 3 -hibridne, energetski ekvivalentne orbitale. Molekula metana dobiva tetraedarsku strukturu. U središtu tetraedra, čiji su svi vrhovi geometrijski jednaki, nalazi se atom ugljika, au njegovim vrhovima atomi vodika. Kut između veza je 109°28¢.

Sile međudjelovanja između molekula nazivaju se van der Waalsove ili međumolekularne. Ova interakcija uzrokovana je elektrostatskim privlačenjem između pojedinačnih molekula i karakterizirana je sljedećim značajkama:
Djeluje na relativno velikim udaljenostima, znatno premašujući veličinu samih molekula;
Karakterizira ga niska energija, stoga značajno slabi s povećanjem temperature;
Ona je nezasićena, tj. interakcija određene molekule s drugom ne isključuje sličan učinak u odnosu na treću, četvrtu itd.
Povećanjem relativnih molarnih masa rastu sile međumolekularnog međudjelovanja i posljedično se povećavaju tališta i vrelišta tvari.
Vježbajte. Izračunajte razliku elektronegativnosti atoma ΔEO za veze O–H i O–Mg u spoju Mg(OH) 2 i odredite koja je od tih veza polarnija. EO(H) = 2,1 eV, EO(O) = 3,5 eV, EO(Mg) = 1,2 eV.
Riješenje:
ΔEO(O–H) = 3,5 – 2,1 = 1,4; ΔEO(O–Mg) = 3,5 – 1,2 = 2,3.
Stoga je Mg–O veza polarnija.
Kada se spojevi formiraju od elemenata koji su vrlo različiti u elektronegativnosti (tipični metali i tipični nemetali), zajednički elektronski parovi potpuno se pomiču prema elektronegativnijem atomu. Na primjer, kada natrij izgara u kloru, nespareni 3s elektron atoma natrija sparen je s 3p elektronom atoma klora. Zajednički elektronski par potpuno je pomaknut na atom klora (Δχ(Cl) = 2,83 eV, Δχ(Cl) = 0,93 eV). Za postojanje ionske veze potrebno je:
1. Prisutnost atoma s jasno izraženom težnjom da odustane od elektrona za stvaranje pozitivno nabijenog iona (kationa), t.j. s niskim EI. Potencijal ionizacije je energija koja se mora potrošiti da se ukloni 1 elektron iz vanjske orbite. Što je niži potencijal ionizacije, atom lakše gubi elektrone, to su metalna svojstva elementa izraženija. Potencijal ionizacije raste unutar razdoblja s lijeva na desno i smanjuje se od vrha prema dolje.
Proces gubljenja elektrona naziva se oksidacija.
2. Prisutnost atoma s jasno izraženom tendencijom dodavanja elektrona za stvaranje negativno nabijenih iona (aniona), t.j. s velikim SE. Proces dodavanja elektrona naziva se redukcija.
Cl + e ® Cl –
Tipični ionski spojevi nastaju spajanjem atoma metala glavnih podskupina skupina I i II s atomima nemetala glavne podskupine VII skupine (NaCl, KF, CaCl 2).
Ne postoji oštra granica između ionske i kovalentne veze. U plinovitoj fazi tvari karakteriziraju čisto kovalentne polarne veze, ali iste tvari u čvrstom stanju karakteriziraju ionske veze.
 Diplomski rad: Analiza troškova proizvodnje na primjeru JSC "Vostochnaya Verf"
Diplomski rad: Analiza troškova proizvodnje na primjeru JSC "Vostochnaya Verf" Opća formula i karakteristike arena
Opća formula i karakteristike arena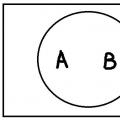 Suština logike. Vrste logike. Što je logika i zašto je potrebna? Vrste logike u filozofiji
Suština logike. Vrste logike. Što je logika i zašto je potrebna? Vrste logike u filozofiji