Plinski zakoni. Disanje Boyle-Mariotteov zakon Boyle-Mariotteov zakon odvija se pri konstantnoj
Zakon je formuliran na sljedeći način: umnožak volumena dane mase plina i njegovog tlaka pri konstantnoj temperaturi je konstantna vrijednost. Matematički se ovaj zakon može napisati ovako:
P 1 V 1 = P 2 V 2 ili PV = const (1)
Iz Boyle-Marriottovog zakona proizlaze sljedeće posljedice: gustoća i koncentracija plina pri konstantnoj temperaturi izravno je proporcionalna tlaku pod kojim se plin nalazi:
(2);
 (3) ,
(3) ,
Gdje d 1 – gustoća, C 1 – koncentracija plina pod tlakom P 1; d 2 i C 2 su odgovarajuće vrijednosti pod pritiskom P 2 .
Primjer 1. Plinska boca zapremine 0,02 m 3 sadrži plin pod tlakom od 20 atm. Koliki će volumen zauzeti plin ako se ventil cilindra otvori bez promjene njegove temperature? Konačni tlak 1 atm.
Primjer 2. Komprimirani zrak se dovodi u spremnik plina (spremnik za sakupljanje plina) zapremine 10 m3. Koliko će vremena trebati da se pumpa do tlaka od 15 atm ako kompresor usisava 5,5 m 3 atmosferskog zraka u minuti pri tlaku od 1 atm? Pretpostavlja se da je temperatura konstantna.
Primjer 3. 112 g dušika pod tlakom od 4 atm zauzima volumen od 20 litara. Koliki tlak treba primijeniti da koncentracija dušika postane 0,5 mol/l, uz uvjet da temperatura ostane nepromijenjena?
1.1.2 Gay-Lussacov i Charlesov zakon
Gay-Lussac je otkrio da se pri konstantnom tlaku, s porastom temperature od 1°C, volumen dane mase plina povećava za 1/273 njegovog volumena pri 0°C.
Matematički, ovaj zakon je napisan:
 (4)
,
(4)
,
Gdje V- volumen plina na temperaturi t°S, a V 0 – volumen plina na 0°C.
Charles je pokazao da se tlak dane mase plina, kada se zagrije za 1°C pri konstantnom volumenu, povećava za 1/273 tlaka koji plin ima pri 0°C. Matematički, ovaj zakon je zapisan na sljedeći način:
 (5)
,
(5)
,
gdje su P 0 i P tlakovi plina, redom, na temperaturama 0S i tS.
Prilikom zamjene Celzijeve skale Kelvinovom, veza između njih se uspostavlja relacijom T = 273 + t, formule Gay-Lussacovog i Charlesovog zakona znatno su pojednostavljene.
Gay-Lussacov zakon: pri konstantnom tlaku, volumen dane mase plina izravno je proporcionalan njegovoj apsolutnoj temperaturi:
 (6)
.
(6)
.
Charlesov zakon: pri konstantnom volumenu, tlak dane mase plina izravno je proporcionalan njegovoj apsolutnoj temperaturi:
 (7)
.
(7)
.
Iz zakona Gay-Lussaca i Charlesa slijedi da su pri konstantnom tlaku gustoća i koncentracija plina obrnuto proporcionalne njegovoj apsolutnoj temperaturi:
 (8)
,
(8)
,
 (9) .
(9) .
Gdje d 1 i C 1 - gustoća i koncentracija plina pri apsolutnoj temperaturi T 1, d 2 i C 2 su odgovarajuće vrijednosti pri apsolutnoj temperaturi T 2 .
Primjer 4. Pri 20ºC volumen plina je 20,4 ml. Koliki će volumen zauzeti plin kad se ohladi na 0°C ako tlak ostane konstantan?
Primep 5. Pri 9°C tlak u boci s kisikom bio je 94 atm. Izračunajte koliko se povećao tlak u cilindru ako je temperatura porasla na 27ºC?
Primjer 6. Gustoća plinovitog klora pri 0ºS a tlak 760 mm Hg. Umjetnost. jednako 3,220 g/l. Odredite gustoću klora, uzimajući ga kao idealni plin, pri 27ºS pri istom tlaku.
Primjer 7. U normalnim uvjetima koncentracija ugljičnog monoksida iznosi 0,03 kmol/m3. Izračunajte pri kojoj će temperaturi masa 10 m 3 ugljičnog monoksida biti jednaka 7 kg?
Kombinirani zakon Boyle-Mariotte-Charles-Gay-Lussac.
Formulacija ovog zakona: za danu masu plina, umnožak tlaka i volumena podijeljen s apsolutnom temperaturom konstantan je za sve promjene koje se događaju u plinu. Matematička notacija:
 (10)
(10)
gdje je V 1 volumen, a P 1 tlak dane mase plina pri apsolutnoj temperaturi T 1 , V 2 - volumen i P 2 - tlak iste mase plina pri apsolutnoj temperaturi T 2.
Jedna od najvažnijih primjena jedinstvenog zakona o plinu je "dovođenje volumena plina u normalne uvjete."
Primjer 8. Plin na 15°C i tlaku 760 mmHg. Umjetnost. zauzima volumen od 2 litre. Dovedite volumen plina u normalne uvjete.
Kako biste olakšali takve izračune, možete koristiti faktore pretvorbe dane u tablicama.
Primjer 9. U plinometru iznad vode nalazi se 7,4 litre kisika pri temperaturi od 23°C i tlaku od 781 mm Hg. Umjetnost. Tlak vodene pare pri ovoj temperaturi je 21 mmHg. Umjetnost. Koliki će volumen zauzimati kisik u plinometru u normalnim uvjetima?
Promjena jednog od makroskopskih parametara tvari određene mase – tlaka R, volumen V odnosno temperaturu t - uzrokuje promjene drugih parametara.
Ako se sve veličine koje karakteriziraju stanje plina mijenjaju istodobno, tada je teško eksperimentalno ustanoviti bilo kakve definitivne obrasce. Lakše je prvo proučiti procese u kojima masa i jedan od tri parametra - R,V ili t - ostaju nepromijenjeni. Kvantitativni odnosi između dva parametra plina iste mase uz konstantnu vrijednost trećeg parametra nazivaju se plinski zakoni.
Boyle-Marriott zakon
Prvi zakon o plinu otkrio je engleski znanstvenik R. Boyle (1627.-1691.) 1660. godine. Boyleov rad nazvan je "Novi eksperimenti koji se tiču zračne opruge". Doista, plin se ponaša kao komprimirana opruga;
Boyle je proučavao promjenu tlaka plina kao funkciju volumena pri konstantnoj temperaturi. Proces promjene stanja termodinamičkog sustava pri stalnoj temperaturi naziva se izoterma (od grčkih riječi isos - jednak, therme - toplina). Za održavanje stalne temperature plina potrebno je da on može izmjenjivati toplinu s velikim sustavom u kojem se održava stalna temperatura – termostatom. Atmosferski zrak može poslužiti kao termostat ako se tijekom pokusa njegova temperatura značajno ne mijenja.
Boyle je promatrao promjenu volumena zraka zarobljenog u dugoj zakrivljenoj cijevi stupcem žive (slika 3.6, a). U početku su razine žive u oba kraka cijevi bile iste, a tlak zraka bio je jednak atmosferskom tlaku (760 mm Hg). Dok je dodavao živu u dugačko koljeno cijevi, Boyle je primijetio da se volumen zraka prepolovio kada se pokazalo da je razlika u razinama u oba koljena jednaka h = 760 mm, a posljedično, tlak zraka se udvostručio (Sl. 3.6, b). To je dovelo Boylea do ideje da su volumen dane mase plina i njegov tlak obrnuto proporcionalni.
A) b)
Daljnja promatranja promjene volumena pri dodavanju različitih udjela žive potvrdila su ovaj zaključak.
Neovisno o Boyleu, nešto kasnije, do istih je zaključaka došao francuski znanstvenik E. Marriott (1620.-1684.). Stoga je pronađeni zakon nazvan Boyle-Mariotteov zakon. Prema ovom zakonu, tlak dane mase (ili količine) plina pri konstantnoj temperaturi obrnuto je proporcionalan volumenu plina:  .
.
Ako str 1 - tlak plina u volumenu V 1 , I str 2 - njegov tlak u volumenu V 2 , Da
 (3.5.1)
(3.5.1)
Iz toga slijedi da str 1 V l = str 2 V 2 , ili
 (3.5.2)
(3.5.2)
na t = konst.
Umnožak tlaka plina određene mase i njegovog volumena je konstantan ako se temperatura ne mijenja.
Ovaj zakon vrijedi za sve plinove, kao i za mješavine plinova (na primjer, zrak).
Valjanost Boyle-Mariotteovog zakona možete provjeriti pomoću uređaja prikazanog na slici 3.7. Zatvorena valovita posuda spojena je na manometar koji bilježi tlak unutar posude. Okretanjem vijka možete mijenjati volumen posude. Volumen se može procijeniti pomoću ravnala. Promjenom volumena i mjerenjem tlaka možete vidjeti da je jednadžba (3.5.2) zadovoljena.

Kao i drugi fizikalni zakoni, Boyle-Mariotteov zakon je približan. Pri tlakovima koji su nekoliko stotina puta veći od atmosferskog tlaka, odstupanja od ovog zakona postaju značajna.
Na grafu ovisnosti tlaka o volumenu, svako stanje plina odgovara jednoj točki.
Izoterme
Proces promjene tlaka plina ovisno o volumenu grafički se prikazuje pomoću krivulje koja se naziva izoterma (slika 3.8). Plinska izoterma izražava obrnuti odnos između tlaka i volumena. Krivulja ove vrste naziva se hiperbola. Različite izoterme odgovaraju različitim konstantnim temperaturama, budući da viša temperatura pri istom volumenu odgovara višem tlaku*. Prema tome, izoterma koja odgovara višoj temperaturi t2, leži iznad izoterme koja odgovara nižoj temperaturi t 1.
* O tome će biti više riječi kasnije.

Boyle-Mariotteov zakon jedan je od temeljni zakoni fizike i kemije, koji povezuje promjene tlaka i volumena plinovitih tvari. Pomoću našeg kalkulatora lako je riješiti jednostavne probleme iz fizike ili kemije.
Boyle-Marriott zakon
Zakon o izotermnom plinu otkrio je irski znanstvenik Robert Boyle, koji je provodio eksperimente s plinovima pod pritiskom. Koristeći cijev u obliku slova U i običnu živu, Boyle je uspostavio jednostavan princip da je u bilo kojem trenutku umnožak tlaka i volumena plina konstantan. Govoreći suhoparnim matematičkim jezikom, Boyle-Mariotteov zakon to tvrdi pri konstantnoj temperaturi umnožak tlaka i volumena je konstantan:
Da bi se omjer održao stalnim, količine se moraju mijenjati u različitim smjerovima: za koliko se puta jedna veličina smanji, za toliko se puta poveća druga. Prema tome, tlak i volumen plina su obrnuto proporcionalni i zakon se može prepisati na sljedeći način:
P1×V1 = P2×V2,
gdje su P1 i V1 početne vrijednosti tlaka odnosno volumena, a P2 i V2 konačne vrijednosti.
Primjena Boyle-Mariotteovog zakona
Najbolja ilustracija manifestacije zakona koji je otkrio Boyle je uranjanje plastične boce u vodu. Poznato je da ako se plin stavi u cilindar, tada će pritisak na tvar određivati samo stijenke cilindra. Druga je stvar kada se radi o plastičnoj boci koja lako mijenja svoj oblik. Na površini vode (tlak 1 atmosfera) zatvorena boca će zadržati svoj oblik, ali kada se uroni na dubinu od 10 m, na stijenke posude će djelovati pritisak od 2 atmosfere, boca će se početi skupljati , a volumen zraka smanjit će se za pola. Što je plastični spremnik dublje uronjen, to će zrak u njemu zauzimati manji volumen.
Ova jednostavna demonstracija zakona o plinu ilustrira važnu stvar za mnoge ronioce. Ako na površini vode zračni cilindar ima kapacitet od 20 litara, tada će se pri ronjenju na dubinu od 30 m zrak u unutrašnjosti komprimirati tri puta, dakle, zrak za disanje na takvoj dubini bit će tri puta manje nego na površini.
Osim teme ronjenja, Boyle-Marriottov zakon na djelu može se promatrati u procesu komprimiranja zraka u kompresoru ili u ekspanziji plinova pri korištenju pumpe.
Naš program je online alat koji olakšava izračunavanje udjela za bilo koji plinski izotermni proces. Za korištenje alata morate znati bilo koje tri veličine, a kalkulator će automatski izračunati traženu.
Primjeri rada kalkulatora
Školski zadatak
Razmotrimo jednostavan školski zadatak u kojem trebate pronaći početni volumen plina ako se tlak promijeni s 1 na 3 atmosfere, a volumen se smanji na 10 litara. Dakle, imamo sve podatke za izračun koje je potrebno unijeti u odgovarajuće ćelije kalkulatora. Kao rezultat toga, nalazimo da je početni volumen plina bio 30 litara.
Više o ronjenju
Sjetimo se plastične boce. Zamislimo da smo bocu napunjenu s 19 litara zraka potopili na dubinu od 40 m. Kako će se promijeniti volumen zraka na površini? Ovo je teži problem, ali samo zato što dubinu moramo pretvoriti u pritisak. Znamo da je na površini vode atmosferski tlak 1 bar, a kada se uroni u vodu tlak se povećava za 1 bar svakih 10 m. To znači da će na dubini od 40 m boca biti pod tlakom od približno 5 atmosfera . Imamo sve podatke za izračun, a kao rezultat ćemo vidjeti da će se volumen zraka na površini povećati na 95 litara.
Zaključak
Boyle-Marriottov zakon vrlo se često pojavljuje u našim životima, tako da će vam nedvojbeno trebati kalkulator koji automatizira izračune pomoću ove jednostavne proporcije.
Osnovne zakonitosti idealnih plinova koriste se u tehničkoj termodinamici za rješavanje niza inženjerskih problema u procesu izrade projektne i tehnološke dokumentacije za zrakoplovnu opremu i zrakoplovne motore; njihovu proizvodnju i rad.
Ti su zakoni izvorno dobiveni eksperimentalno. Naknadno su izvedeni iz molekularne kinetičke teorije strukture tijela.
Boyle-Mariotteov zakon utvrđuje ovisnost volumena idealnog plina o tlaku pri konstantnoj temperaturi. Tu je ovisnost izveo engleski kemičar i fizičar R. Boyle 1662. godine, mnogo prije pojave kinetičke teorije plina. Neovisno o Boyleu, isti je zakon otkrio E. Marriott 1676. godine. Zakon Roberta Boylea (1627. - 1691.), engleskog kemičara i fizičara koji je uspostavio ovaj zakon 1662. godine, i Edmea Mariottea (1620. - 1684.), francuskog fizičara koji je ustanovio ovaj zakon 1676. godine: umnožak volumena dane mase idealnog plina i njegovog tlaka konstantan je pri konstantnoj temperaturi ili.
Boyle-Mariotta zakon se zove i kaže da pri konstantnoj temperaturi tlak plina je obrnuto proporcionalan njegovom volumenu.
Pretpostavimo da pri konstantnoj temperaturi određene mase plina:
V 1 – volumen plina pri tlaku R 1 ;
V 2 – volumen plina pod tlakom R 2 .
Onda, po zakonu, možemo pisati
Zamjenom vrijednosti specifičnog volumena u ovu jednadžbu i uzimanjem mase ovog plina T= 1kg, dobivamo
str 1 v 1 =str 2 v 2 ili pv= konst .(5)
Gustoća plina je recipročna vrijednost njegovog specifičnog volumena:
tada će jednadžba (4) poprimiti oblik
odnosno gustoće plinova izravno su proporcionalne njihovim apsolutnim tlakovima. Jednadžba (5) se može smatrati novim izrazom Boyle-Mariotteovog zakona koji se može formulirati na sljedeći način: umnožak tlaka i specifičnog volumena određene mase istog idealnog plina za njegova različita stanja, ali pri istoj temperaturi, konstantna je vrijednost.
Taj se zakon lako može dobiti iz osnovne jednadžbe kinetičke teorije plinova. Zamjena broja molekula po jedinici volumena u jednadžbi (2) omjerom N/V (V– volumen zadane mase plina, N– broj molekula u volumenu) dobijemo
Budući da za određenu masu plina vrijednosti N I β su konstantne, zatim pri konstantnoj temperaturi T=konst za proizvoljnu količinu plina Boyle-Mariotteova jednadžba će imati oblik
pV = konst, (7)
a za 1 kg plina
pv = konst.
Prikažimo grafički u koordinatnom sustavu R – v promjena stanja plina.
Na primjer, tlak zadane mase plina volumena 1 m 3 jednak je 98 kPa, tada pomoću jednadžbe (7) određujemo tlak plina volumena 2 m 3
Nastavljajući izračune, dobivamo sljedeće podatke: V(m3) jednako 1; 2; 3; 4; 5; 6; odnosno R(kPa) jednako 98; 49; 32.7; 24,5; 19.6; 16.3. Koristeći te podatke gradimo grafikon (slika 1).
Riža. 1. Ovisnost tlaka idealnog plina o volumenu pri
stalna temperatura
Rezultirajuća krivulja - hiperbola dobivena pri konstantnoj temperaturi - naziva se izoterma, a proces koji se odvija pri konstantnoj temperaturi naziva se izoterma. Boyle-Mariotteov zakon je približan i pri vrlo visokim tlakovima i niskim temperaturama neprihvatljiv je za termotehničke proračune.
Gay-Lussak zakon određuje ovisnost volumena idealnog plina o temperaturi pri konstantnom tlaku. (Zakon Josepha Louisa Gay-Lussaca (1778. - 1850.), francuskog kemičara i fizičara koji je prvi uspostavio ovaj zakon 1802. godine: volumen dane mase idealnog plina pri stalnom tlaku raste linearno s porastom temperature, to je , gdje je specifični volumen; β je koeficijent ekspanzije volumena jednak 1/273,16 po 1 o C.) Zakon je 1802. eksperimentalno ustanovio francuski fizičar i kemičar Joseph Louis Gay-Lussac, po kojem je i dobio ime. Eksperimentalno istražujući toplinsko širenje plinova, Gay-Lussac je otkrio da se pri konstantnom tlaku volumeni svih plinova povećavaju kada se zagrijavaju gotovo jednako, tj. s porastom temperature za 1 ° C, volumen određene mase plina povećava se za 1/273 volumena koji je ovaj plin zauzimao pri 0°C.
Povećanje volumena pri zagrijavanju za 1 °C za isti iznos nije slučajno, već se čini kao posljedica Boyle-Mariotteovog zakona. U početku se plin pri konstantnom volumenu zagrije za 1 °C, njegov tlak poraste za 1/273 od početnog. Tada se plin pri stalnoj temperaturi širi, te mu se tlak smanjuje na početni, a za toliko mu se povećava i volumen. Označavajući volumen određene mase plina pri 0°C sa V 0 , a na temperaturi t°C in V t Napišimo zakon na sljedeći način:
Gay-Lussacov zakon može se prikazati i grafički.
Riža. 2. Ovisnost volumena idealnog plina o temperaturi pri konstanti
pritisak
Koristeći jednadžbu (8) i uzimajući temperaturu jednaku 0°C, 273°C, 546°C, izračunavamo volumen plina jednak, respektivno V 0 , 2V 0 , 3V 0 . Nacrtajmo temperature plina duž apscisne osi u određenom konvencionalnom mjerilu (slika 2), a volumene plina koji odgovaraju tim temperaturama duž ordinatne osi. Spajanjem dobivenih točaka na grafu dobivamo ravnu liniju koja predstavlja ovisnost volumena idealnog plina o temperaturi pri konstantnom tlaku. Ova linija se zove izobara, a proces koji se odvija pri konstantnom tlaku je izobarni.
Vratimo se još jednom na grafikon promjene volumena plina u odnosu na temperaturu. Nastavimo ravnu liniju dok se ne presiječe s osi x. Točka sjecišta će odgovarati apsolutnoj nuli.
Pretpostavimo da je u jednadžbi (8) vrijednost V t= 0, tada imamo:
ali budući da V 0 ≠ 0, dakle, gdje je t= – 273°C. Ali – 273°C=0K, što je trebalo dokazati.
Predstavimo Gay-Lussacovu jednadžbu u obliku:
Sjećajući se da je 273+ t=T, i 273 K=0°C, dobivamo:
Zamjenom vrijednosti specifičnog volumena u jednadžbu (9) i uzimanjem T=1 kg, dobivamo:
Relacija (10) izražava Gay-Lussacov zakon koji se može formulirati na sljedeći način: pri konstantnom tlaku, specifični volumeni identičnih masa istog idealnog plina izravno su proporcionalni njegovim apsolutnim temperaturama. Kao što se može vidjeti iz jednadžbe (10), Gay-Lussacov zakon kaže da da je kvocijent specifičnog volumena dane mase plina podijeljen s njegovom apsolutnom temperaturom konstantna vrijednost pri danom konstantnom tlaku.
Jednadžba koja izražava Gay-Lussacov zakon ima opći oblik
a može se dobiti iz osnovne jednadžbe kinetičke teorije plinova. Jednadžbu (6) ćemo prikazati u obliku
na str=konst dobivamo jednadžbu (11). Gay-Lussacov zakon se široko koristi u tehnologiji. Tako je na temelju zakona o volumetrijskom širenju plinova izgrađen idealan plinski termometar za mjerenje temperatura u rasponu od 1 do 1400 K.
Charlesov zakon utvrđuje ovisnost tlaka određene mase plina o temperaturi pri stalnom volumenu. Zakon Jeana Charlesa (1746. - 1823.), francuskog znanstvenika koji je prvi put utvrdio ovaj zakon 1787. godine, a doradio ga J. Gay. -Lussaccombe 1802. godine: tlak idealnog plina stalne mase i volumena linearno raste pri zagrijavanju, odnosno gdje R o – tlak pri t= 0°C.
Charles je utvrdio da pri zagrijavanju u stalnom volumenu tlak svih plinova raste gotovo jednako, tj. s povećanjem temperature za 1 °C, tlak bilo kojeg plina raste točno za 1/273 tlaka koji je određena masa plina imala na 0 °C. Označimo tlak određene mase plina u posudi pri 0°C sa R 0 , a na temperaturi t° kroz str t. Pri porastu temperature za 1°C tlak se poveća za, a pri porastu temperature za t°C tlak raste za. Tlak pri temperaturi t°Jednak početnom plus porastu tlaka ili
Formula (12) vam omogućuje izračunavanje tlaka na bilo kojoj temperaturi ako je poznat tlak na 0°C. U inženjerskim proračunima vrlo se često koristi jednadžba (Charlesov zakon) koja se lako dobiva iz relacije (12).
Od, i 273 + t = T odnosno 273 K = 0°C = T 0
Pri konstantnom specifičnom volumenu, apsolutni tlakovi idealnog plina izravno su proporcionalni apsolutnim temperaturama. Obrćući srednje članove proporcije, dobivamo
Jednadžba (14) je izraz Charlesovog zakona u općem obliku. Ova se jednadžba može lako izvesti iz formule (6)
Na V=konst dobivamo opću jednadžbu Charlesovog zakona (14).
Za crtanje ovisnosti dane mase plina o temperaturi pri konstantnom volumenu koristimo se jednadžbom (13). Neka je, na primjer, pri temperaturi od 273 K = 0°C tlak određene mase plina 98 kPa. Prema jednadžbi, tlak na temperaturama od 373, 473, 573 °C će redom biti 137 kPa (1,4 kgf/cm2), 172 kPa (1,76 kgf/cm2), 207 kPa (2,12 kgf/cm2). Koristeći te podatke gradimo grafikon (slika 3). Rezultirajuća ravna linija naziva se izohorom, a proces koji se odvija pri konstantnom volumenu naziva se izohornom.
Riža. 3. Ovisnost tlaka plina o temperaturi pri konstantnom volumenu
Boyle-Mariotteov zakon (izoterma), jedan od osnovnih plinskih zakona koji opisuje izotermne procese u idealnim plinovima. Ustanovili su ga znanstvenici R. Boyle 1662. i E. Marriott 1676. neovisno jedan o drugom tijekom eksperimentalnog proučavanja ovisnosti tlaka plina o njegovom volumenu pri konstantnoj temperaturi.
Prema Boyle-Mariotteovom zakonu pri konstantnoj temperaturi (T=const), volumen (V) dane mase (m) idealnog plina obrnuto je proporcionalan njegovom tlaku (p):
pV = const = C pri T = const i m = const
Konstanta C proporcionalna je masi plina (broju molova) i njegovoj apsolutnoj temperaturi. Drugim riječima: umnožak volumena dane mase idealnog plina i njegovog tlaka konstantan je pri konstantnoj temperaturi. Boyle-Mariotteov zakon vrijedi strogo za idealni plin. Za prave plinove, Boyle-Mariotteov zakon je približno zadovoljen. Gotovo svi plinovi ponašaju se kao idealni plinovi pri ne previsokim tlakovima i ne preniskim temperaturama.
Boyle-Mariotteov zakon proizlazi iz kinetičke teorije plinova, kada se pretpostavlja da su veličine molekula zanemarive u odnosu na udaljenost među njima i da ne postoji međumolekulska interakcija. Pri visokim tlakovima potrebno je uvesti korekcije za sile privlačenja između molekula i za volumen samih molekula. Poput Clayperonove jednadžbe, Boyle-Mariotteov zakon opisuje granični slučaj ponašanja stvarnog plina, točnije opisanog van der Waalsovom jednadžbom. Primjena zakona može se približno promatrati u procesu kompresije zraka kompresorom ili kao rezultat širenja plina ispod klipa pumpe pri ispumpavanju iz posude.
Termodinamički proces koji se odvija pri konstantnoj temperaturi naziva se izotermnim. Njena slika na grafu (slika 1) naziva se izoterma.
Sl. 1
Gay-Lussacov zakon. Izobara
Godine 1802. francuski znanstvenik J. Gay-Lussac eksperimentalno je otkrio ovisnost volumena plina o temperaturi pri stalnom tlaku. Podaci su osnova Gay-Lussacovog zakona o plinu.
Formulacija Gay-Lussacovog zakona je sljedeća: za određenu masu plina, omjer volumena plina i njegove temperature je konstantan ako se tlak plina ne mijenja. Ovaj odnos se matematički piše na sljedeći način:
V/T=konst, ako je P=konst i m=konst
Taj se zakon može približno promatrati kada se plin širi kada se zagrijava u cilindru s pomičnim klipom. Stalni tlak u cilindru osigurava atmosferski tlak na vanjskoj površini klipa. Još jedna manifestacija Gay-Lussacovog zakona na djelu je balon. Gay-Lussacov zakon se ne poštuje u području niskih temperatura blizu temperature ukapljivanja (kondenzacije) plinova.
Zakon vrijedi za idealan plin. Dobro radi za razrijeđene plinove, koji su po svojim svojstvima blizu idealnih. Temperatura plina mora biti dovoljno visoka.
Grafički je ova ovisnost u V-T koordinatama prikazana kao ravna linija koja se proteže iz točke T=0. Ova ravna crta naziva se izobara. Različitim pritiscima odgovaraju različite izobare. Proces promjene stanja termodinamičkog sustava pri konstantnom tlaku naziva se izobarski (slika 2. graf izobarnog procesa).

sl.2
Charlesov zakon. Izohora
Godine 1787. francuski znanstvenik J. Charles eksperimentalno je otkrio ovisnost tlaka plina o temperaturi pri konstantnom volumenu. Podaci su osnova Charlesovog zakona o plinu.
Formulacija Charlesovog zakona je sljedeća: za određenu masu plina, omjer tlaka plina i njegove temperature je konstantan ako se volumen plina ne mijenja. Ovaj odnos se matematički piše na sljedeći način:
P/T=konst, ako je V=konst i m=konst
Taj se zakon može približno promatrati kada se tlak plina povećava u bilo kojoj posudi ili u električnoj žarulji kada se zagrijava. Izohorni proces se koristi u plinskim termometrima konstantnog volumena. Charlesov zakon se ne poštuje u području niskih temperatura blizu temperature ukapljivanja (kondenzacije) plinova.
Zakon vrijedi za idealan plin. Dobro radi za razrijeđene plinove, koji su po svojim svojstvima blizu idealnih. Temperatura plina mora biti dovoljno visoka. Proces mora biti vrlo spor
Grafički je ova ovisnost u P-T koordinatama prikazana kao ravna linija koja se proteže iz točke T=0. Ova ravna linija naziva se izohorom. Različite izohore odgovaraju različitim volumenima. Proces promjene stanja termodinamičkog sustava pri konstantnom volumenu naziva se izohornim. Slika 3 (graf izohornog procesa).
 Gdje ići studirati: pregled sveučilišta Kursk Sveučilišta Kursk na međunarodnim i nacionalnim ljestvicama
Gdje ići studirati: pregled sveučilišta Kursk Sveučilišta Kursk na međunarodnim i nacionalnim ljestvicama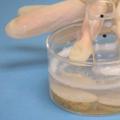 Kako i kada se tekućine pretvaraju u plinove?
Kako i kada se tekućine pretvaraju u plinove? Nuklearna izomerija "nuklearna izomerija" u knjigama
Nuklearna izomerija "nuklearna izomerija" u knjigama