Količina vode u različitim stanicama. Voda i njen biološki značaj
Voda je najčešći kemijski spoj na Zemlji, njena masa je najveća u živom organizmu. Procjenjuje se da voda čini 85% ukupne mase prosječne stanice. Dok u ljudskim stanicama vode u prosjeku ima oko 64%. Međutim, sadržaj vode u različitim stanicama može značajno varirati: od 10% u stanicama zubne cakline do 90% u embrionalnim stanicama sisavaca. Štoviše, mlade stanice sadrže više vode nego stare. Tako u stanicama bebe voda čini 86%, u stanicama stare osobe samo 50%.
Kod muškaraca, sadržaj vode u stanicama je u prosjeku 63%, kod žena - nešto manje od 52%. Što uzrokuje ovo? Ispada da je sve jednostavno. Žensko tijelo sadrži mnogo masnog tkiva, čije stanice imaju malo vode. Stoga je sadržaj vode u ženskom tijelu približno 6-10% manji nego u muškom tijelu.
Jedinstvena svojstva vode posljedica su strukture njezine molekule. Iz kolegija kemije znate da je različita elektronegativnost atoma vodika i kisika razlog stvaranja polarne kovalentne veze u molekuli vode. Molekula vode ima oblik trokuta (87), u kojem su električni naboji smješteni asimetrično, i dipol je (sjetite se definicije ovog pojma).
Zbog elektrostatskog privlačenja atoma vodika jedne molekule vode prema atomu kisika druge molekule, između molekula vode nastaju vodikove veze.
Razmatraju se strukturne značajke i fizikalno-kemijska svojstva vode (sposobnost vode da bude univerzalno otapalo, promjenjiva gustoća, veliki toplinski kapacitet, velika površinska napetost, fluidnost, kapilarnost i dr.) koja određuju njezino biološko značenje.
Koje funkcije voda obavlja u tijelu? Voda je otapalo. Polarna struktura molekule vode objašnjava njezina svojstva kao otapala. Molekule vode u interakciji s kemijskim tvarima, čiji elementi imaju elektrostatske veze, razgrađuju ih na anione i katione, što dovodi do kemijskih reakcija. Kao što znate, mnoge kemijske reakcije odvijaju se samo u vodenoj otopini. U isto vrijeme, sama voda ostaje inertna, tako da se može više puta koristiti u tijelu. Voda služi kao medij za prijenos raznih tvari unutar tijela. Osim toga, konačni proizvodi metabolizma izlučuju se iz tijela uglavnom u otopljenom obliku.
U živim bićima postoje dvije glavne vrste otopina. (Zapamtite klasifikaciju rješenja.)
Takozvana prava otopina, kada su molekule otapala iste veličine kao i molekule topive tvari, one se otapaju. Kao rezultat toga dolazi do disocijacije i stvaranja iona. U ovom slučaju otopina je homogena i znanstveno rečeno sastoji se od jedne - tekuće faze. Tipični primjeri su otopine mineralnih soli, kiselina ili lužina. Budući da takve otopine sadrže nabijene čestice, sposobne su provoditi električnu struju i elektroliti su, kao i sve otopine koje se nalaze u tijelu, uključujući i krv kralježnjaka, koja sadrži mnoge mineralne soli.
Koloidna otopina je slučaj kada su molekule otapala puno manje veličine od molekula otopljene tvari. U takvim otopinama čestice tvari, koje se nazivaju koloidne, slobodno se kreću u vodenom stupcu, jer sila njihove privlačnosti ne prelazi snagu njihovih veza s molekulama otapala. Takva se otopina smatra heterogenom, odnosno sastoji se od dvije faze - tekuće i čvrste. Sve biološke tekućine su smjese koje uključuju prave i koloidne otopine, budući da sadrže i mineralne soli i velike molekule (na primjer, proteine) koje imaju svojstva koloidnih čestica. Stoga citoplazma bilo koje stanice, krv ili limfa životinja i mlijeko sisavaca istovremeno sadrže ione i koloidne čestice.
Kao što se vjerojatno sjećate, biološki sustavi poštuju sve zakone fizike i kemije, stoga se u biološkim otopinama promatraju fizikalni fenomeni koji igraju značajnu ulogu u životu organizama.
Svojstva vode
Difuzija (od lat. Diffusion - širenje, širenje, raspršivanje) u biološkim otopinama očituje se kao težnja izjednačavanja koncentracija strukturnih čestica otopljenih tvari (iona i koloidnih čestica), što u konačnici dovodi do jednolike raspodjele tvari u riješenje. Zahvaljujući difuziji mnoga se jednostanična stvorenja hrane, kisik i hranjive tvari prenose se tijelom životinja u nedostatku krvožilnog i dišnog sustava (sjetite se o kakvim se životinjama radi). Osim toga, transport mnogih tvari u stanice događa se upravo difuzijom.
Drugi fizikalni fenomen je osmoza (od grčkog Osmosis - guranje, pritisak) - kretanje otapala kroz polupropusnu membranu. Osmoza uzrokuje kretanje vode iz otopine s niskom koncentracijom otopljene tvari i visokim sadržajem H20 u otopinu s visokom koncentracijom otopljene tvari i niskim sadržajem vode. U biološkim sustavima to nije ništa više od transporta vode na staničnoj razini. Zbog toga osmoza igra značajnu ulogu u mnogim biološkim procesima. Snaga osmoze osigurava kretanje vode u biljnim i životinjskim organizmima, tako da njihove stanice dobivaju hranjive tvari i održavaju stalan oblik. Treba napomenuti da što je veća razlika u koncentraciji tvari, to je veći osmotski tlak. Stoga, ako se stanice stave u hipotoničnu otopinu, one će zbog naglog protoka vode nabubriti i puknuti.
Voda je najčešći spoj na Zemlji iu živim organizmima. Sadržaj vode u stanicama ovisi o prirodi metaboličkih procesa: što su oni intenzivniji, to je sadržaj vode veći.
U prosjeku stanice odrasle osobe sadrže 60-70% vode. Gubitkom od 20% vode organizmi umiru. Bez vode čovjek ne može živjeti više od 7 dana, a bez hrane više od 40 dana.

Riža. 4.1. Prostorna građa molekule vode (H 2 O) i stvaranje vodikove veze
Molekula vode (H 2 O) sastoji se od dva atoma vodika, koji su kovalentnom vezom povezani s atomima kisika. Molekula je polarna jer je savijena pod kutom i jezgra atoma kisika vuče zajedničke elektrone prema tom kutu, tako da kisik dobiva djelomično negativan naboj, a atomi vodika koji se nalaze na otvorenim krajevima imaju djelomično pozitivan naboj . Molekule vode mogu privlačiti jedna drugu s pozitivnim i negativnim nabojem, stvarajući vodikova veza (slika 4.1.).
Zbog jedinstvene strukture molekula vode i njihove sposobnosti međusobnog povezivanja vodikovim vezama, voda ima niz svojstava koja određuju njezinu važnu ulogu u stanici i tijelu.
Vodikove veze određuju relativno visoke temperature vrelišta i isparavanja, visok toplinski kapacitet i toplinsku vodljivost vode te svojstvo univerzalnog otapala.
Vodikove veze su 15-20 puta slabije od kovalentnih veza. U tekućem stanju dolazi do stvaranja i kidanja vodikovih veza što uvjetuje kretanje molekula vode i njezinu fluidnost.
Biološka uloga H 2 O
Voda određuje fizikalna svojstva stanice – njezin volumen, elastičnost (turgor). Stanica sadrži 95-96% slobodne vode i 4-5% vezane vode. Vezana voda stvara vodene (solvatne) ljuske oko određenih spojeva (na primjer, proteina), sprječavajući njihovu međusobnu interakciju.
Besplatna voda je dobro otapalo za mnoge anorganske i organske polarne tvari. Tvari koje su dobro topive u vodi nazivaju se hidrofilni. Na primjer, alkoholi, kiseline, plinovi, većina natrijevih i kalijevih soli itd. Za hidrofilne tvari energija veze između njihovih atoma manja je od energije privlačenja tih atoma na molekule vode. Stoga se njihove molekule ili ioni lako integriraju u opći sustav vodikovih veza vode.
Voda kao univerzalno otapalo ima izuzetno važnu ulogu jer se većina kemijskih reakcija odvija u vodenim otopinama. Prodiranje tvari u stanicu i uklanjanje otpadnih tvari iz nje u većini je slučajeva moguće samo u otopljenom obliku.
Voda ne otapa nepolarne (bez naboja) tvari jer s njima ne može stvarati vodikove veze. Tvari koje su netopljive u vodi nazivaju se hidrofobni . To uključuje masti, tvari slične mastima, polisaharide i gumu.
Neke organske molekule imaju dvostruka svojstva: u nekim područjima imaju polarne skupine, au drugim - nepolarne. Takve tvari nazivaju se amfipatski ili amfifilni. To uključuje proteine, masne kiseline, fosfolipide i nukleinske kiseline. Amfifilni spojevi imaju važnu ulogu u organizaciji bioloških membrana i složenih supramolekulskih struktura.
Voda je izravno uključena u reakcije hidroliza– razgradnja organskih spojeva. U ovom slučaju, pod djelovanjem posebnih enzima, OH ioni se dodaju slobodnim valencijama organskih molekula. - i N + voda. Kao rezultat toga nastaju nove tvari s novim svojstvima.
Voda ima visok toplinski kapacitet (tj. sposobnost upijanja topline uz manje promjene vlastite temperature) i dobru toplinsku vodljivost. Zahvaljujući tim svojstvima, temperatura unutar ćelije (i tijela) održava se na određenoj razini unatoč značajnim promjenama temperature okoline.
Važan biološki značaj za funkcioniranje biljaka i hladnokrvnih životinja je da pod utjecajem otopljenih tvari (ugljikohidrata, glicerola) voda može promijeniti svoja svojstva, posebice ledište i vrelište.
Svojstva vode toliko su važna za žive organizme da je nemoguće zamisliti postojanje života, kakvog poznajemo, ne samo na Zemlji, već i na bilo kojem drugom planetu bez dovoljne količine vode.
MINERALNA SOL
Mogu biti u otopljenom i neotopljenom stanju. Molekule mineralnih soli u vodenoj otopini raspadaju se na katione i anione.
Sat traje 80-90 minuta. Tema lekcije omogućuje učenicima da pokažu međusobnu povezanost predmeta poput biologije, geografije, kemije i fizike. U zagradama su mogući odgovori na pitanja koja bih želio dobiti od učenika.
Ciljevi: upoznavanje učenika s podacima o sadržaju vode u stanicama različitih tkiva i metabolizmu vode u različitim organizmima, sa suvremenim predodžbama o građi i svojstvima vode, njezinim biološkim funkcijama; poboljšanje vještina logičkog mišljenja.
Oprema: fizička karta Zemlje, epruvete, čaše, kapilare; kuhinjska sol, etilni alkohol, saharoza, biljno ulje, parafin, bjelanjak, želučani sok, led; referentne knjige iz fizike i kemije.
Organiziranje vremena
Učitelj informira učenike o temi i ciljevima sata te redoslijedu njegove provedbe.
Provjera znanja studenti na temu “Elementni i kemijski (molekularni) sastav stanice.” Tri učenika rade za pločom, ostali (prema mogućnostima) rade s karticama.
Rad za pločom
1. Na ploči je napisan popis elemenata: F, Zn, N, Ca, J, Cl, Na, H, Mn, Cu, P, C, K, Fe, O, Mg, Co od kojih treba odabrati organogene (biogene), makroelemente, mikroelemente. Označite njihov postotak u ćeliji.
(Odgovor učenika: a) organogene: N, H, C, O; b) makroelementi: Ca, Cl, Na, Mn, P, K, Fe, Mg; c) elementi u tragovima: F, Zn, J, Cu, Co).
2. Okarakterizirati organogene elemente. Objasnite zašto su se tijekom razvoja života na Zemlji ovi elementi pokazali "pogodnima" za kemiju života.
3. Zapišite na ploču podatke o kemijskom (molekularnom) sastavu stanice, navodeći postotak glavnih klasa tvari.
Rad s karticama
Odgovorite na pitanje pismeno.
Opcija 1. Kako nedostatak nekog od potrebnih elemenata (organogenih, makroelemenata, mikroelemenata) utječe na životnu aktivnost stanice ili organizma? Kako bi se to moglo manifestirati? Navedite primjere.
opcija 2.Što se može zaključiti iz činjenice da stanice imaju sličan elementarni i kemijski (molekularni) sastav?
Opcija 3. Kakvo je znanstveno značenje podataka o sličnostima i razlikama u elementarnom sastavu (kvalitativnom i kvantitativnom) žive i nežive prirode?
Učenje novog gradiva
Sadržaj vode u stanicama i organizmima
1. Pročitajte poetske retke Mihaila Dudnika i recite jesu li istiniti s biološkog gledišta. (Pjesma je napisana na ploči.)
Kažu da se čovjek sastoji od osamdeset posto vode,
Iz vode, mogao bih dodati, njegovih rodnih rijeka,
Od vode, dodaću, kiše koja ga je napojila,
Iz vode, mogao bih dodati, iz drevne vode, izvire.
Iz kojeg su pili njegovi djedovi i pradjedovi...
(Odgovor učenika. Pjesnički stihovi su točni, jer. više od 2/3 osobe sastoji se od vode.)
2. Gledajući fizičku kartu, prisjetite se koliki je omjer kopnenih površina i oceana na našem planetu.
(Odgovor učenika. Svjetski oceani, tj. Voda koja okružuje kontinente i otoke zauzima oko 71% Zemljine površine.)
Komentar učitelja. Voda ne samo da pokriva najveći dio zemljine površine, već čini i većinu svih živih bića: mikroorganizama, biljaka, životinja, ljudi.
3. Je li voda važna u životu čovjeka?
(Odgovor učenika. Čovjek pije vodu, umiva se njome, koristi je u raznim industrijama i poljoprivredi. Sada mnoge zemlje svijeta doživljavaju nedostatak svježe vode; moraju graditi posebne tvornice i postrojenja za obradu.)
Komentar učitelja. Voda, tako poznata tvar, ima apsolutno nevjerojatna svojstva. Samo zahvaljujući tim svojstvima vode život na Zemlji postao je moguć. Kada se traga za životom na drugim planetima, jedno od najvažnijih pitanja je ima li tamo dovoljno vode. Jedinstvena važnost vode za biološke sustave posljedica je njezinog jednostavnog kvantitativnog sadržaja u živim organizmima.
4. Navedite primjere sadržaja vode u stanicama različitih organizama, njihovim tkivima i organima, koji su vam poznati iz kolegija botanike, zoologije, anatomije i fiziologije čovjeka.
(Odgovor učenika. Voda čini 80% stanične mase u tijelu mladog čovjeka ili životinje i 60% u stanicama starog. U stanicama mozga to je 85%, au stanicama embrija u razvoju – 90%. Ako osoba izgubi 20% vode, nastupa smrt. Istina, nemaju sve ljudske stanice tako visok sadržaj vode. Recimo da u stanicama zubne cakline ima samo 10–15%. U stanicama pulpe sočnog voća i lišća biljaka ima puno vode, ali je ima vrlo malo u stanicama suhih sjemenki ili spora biljaka i mikroorganizama, pa se mogu vrlo dugo čuvati. dok se ponovno ne zalijevaju u uvjetima pogodnim za njihovo klijanje.)
5. Što određuje razlike u sadržaju vode u stanicama?
(Odgovor učenika. Više vode ima u onim stanicama u kojima se metabolizam intenzivnije odvija.)
Ulazak vode u tijela životinja i biljaka
Na koje načine znate kako različiti organizmi dobivaju vodu?
(Odgovor učenika. Načini na koje voda ulazi u tijelo vrlo su raznoliki:
a) kroz površinu tijela - kod jednostaničnih organizama, nižih biljaka, ličinki nekih kukaca, žaba, riba i drugih vodenih organizama;
b) s hranom i pićem – kod većine životinja;
c) postoje životinje koje gotovo ne piju ili piju vrlo malo. To je moguće zahvaljujući: metaboličkoj vodi, t.j. voda nastala u tijelu tijekom oksidacije, uglavnom, masti (s oksidacijom 1 g masti nastaje 1,1 g vode); ekonomično korištenje vode, što je u nekima osigurano prisutnošću vodonepropusnih poklopaca, u drugima - visokom koncentracijom urina (na primjer, kod deva, urin je 8 puta koncentriraniji od plazme); rezerve vode (na primjer, u ličinkama);
d) biljke upijaju vodu iz tla pomoću korijenovih dlačica;
e) neobične metode dobivanja vode imaju: epifiti - biljke koje se naseljavaju uglavnom na deblima i granama drugog drveća - upijaju vodu iz zraka; mnoge kišobranke zadržavaju vlagu u čašičastim ovojnicama lišća, odakle se postupno upija kroz pokožicu.
Struktura molekula i svojstva vode
Brojne biološke funkcije koje voda obavlja osigurane su njezinim jedinstvenim svojstvima, a jedinstvena svojstva vode određena su strukturom njezine molekule.
1. Prisjetite se strukturnih značajki molekule vode koje su vam poznate iz kolegija kemije.
(Odgovor učenika. U molekuli vode (empirijska formula H 2 O) jedan atom kisika kovalentno je vezan na dva atoma vodika. Molekula ima oblik trokuta, na jednom od vrhova nalazi se atom kisika, a na druga dva - atom vodika.)
2. Kakva je priroda kovalentne veze između atoma kisika i atoma vodika?
(Odgovor učenika. Veza između atoma kisika i atoma vodika je polarna, jer Kisik privlači elektrone jače od vodika.)
Komentar učitelja. Dapače, atom kisika, zbog svoje veće elektronegativnosti, jače privlači elektrone od atoma vodika. Posljedica toga je polaritet molekule vode. Općenito, molekula vode je električki neutralna, ali je električni naboj unutar molekule raspoređen neravnomjerno, te u području vodikovih atoma prevladava pozitivan naboj, a u području gdje se nalazi kisik prevladava negativni naboj (slika 1. ). Stoga je takva molekula električni dipol.

Riža. 1. Molekula vode u kojoj je jedan atom kisika kovalentno vezan na dva atoma vodika. Molekula je polarna
Negativno nabijeni atom kisika jedne molekule vode privlači pozitivno nabijene atome vodika druge dvije molekule, pa su molekule vode međusobno povezane vodikovim vezama. Već ste upoznati s pojmom vodikove veze (slika 2).

Riža. 2. Vodikove veze (linije) između molekula vode; Atomi kisika (bijeli kružići) nose djelomične negativne naboje, pa stvaraju vodikove veze s atomima vodika (crni kružići) drugih molekula, koje nose djelomične pozitivne naboje
U tekućoj vodi te se slabe veze brzo stvaraju i jednako brzo se uništavaju nasumičnim sudarima molekula. Upravo zahvaljujući sposobnosti molekula vode da se međusobno vežu pomoću vodikovih veza, voda ima niz svojstava važnih za život.
Zadaci za grupe učenika
Razred je podijeljen u pet skupina od kojih svaka s unaprijed pripremljenim priborom radi prema kartici s uputama koja sadrži zadatak.
Zadatak grupi 1
Nudi vam se niz tvari: kuhinjska sol, etilni alkohol, saharoza, biljno ulje, parafin. Pokušajte otopiti ove tvari u vodi. Koje su od predloženih tvari topive u vodi, a koje ne? Pokušajte objasniti zašto se neke tvari mogu otopiti u vodi, a druge ne. Koje ste svojstvo vode upoznali?
Zadatak grupi 2
U epruvetu s bijelim listićima netopljivog bjelanjka dodajte želučani sok, zagrijan u vodenoj kupelji na 37 °C. Što promatraš? Do koje reakcije je došlo i zbog kojeg enzima u želučanom soku? Koje ste svojstvo vode upoznali?
Zadatak za grupu 3
Stavite kockice leda u čašu vode. Što promatraš? Što možete reći o gustoći vode i leda? Specifične informacije o gustoći vode i leda mogu se dobiti iz Handbook of Elementary Physics (Enochovich). Koja ste svojstva vode upoznali?
Zadatak grupi 4
Znate da voda na temperaturi od 100 °C vrije i prelazi u stanje pare. Pomoću Priručnika za elementarnu fiziku usporedite vrelište vode s vrelištem drugih tekućina. Pokušajte objasniti svoje rezultate.
Zadatak za grupu 5
Pokušajte uliti vodu u čašu s otvorenim vrhom. Zašto je to moguće? Polako spustite staklenu cijev malog promjera u čašu vode. Što promatraš? Objasnite rezultate pokusa. Koje ste svojstvo vode upoznali?
Izvješće 1. grupe
U vodi se otapaju sljedeće tvari: kuhinjska sol, etilni alkohol, saharoza (šećer od trske). Ne otapati: biljno ulje i parafin. Iz dobivenih rezultata možemo zaključiti da se u vodi otapaju tvari s ionskim kemijskim vezama (kuhinjska sol), kao i neionski spojevi (šećeri, alkoholi), čije molekule vjerojatno sadrže nabijene (polarne) skupine. Voda je jedno od najuniverzalnijih otapala: u njoj se otapaju gotovo sve tvari, barem u tragovima.
Komentar učitelja. Ako je energija privlačenja između molekula vode i molekula bilo koje tvari veća od energije privlačenja između molekula vode, tada se tvar otapa. Tvari topljive u vodi nazivamo hidrofilnim (soli, lužine, kiseline itd.). Nepolarni (bez naboja) spojevi praktički su netopljivi u vodi. Nazivaju se hidrofobnim (masti, tvari slične mastima, guma itd.).
Izvješće 2. skupine
Netopljive pahuljice bjelanjaka otapaju se pod djelovanjem pepsina želučanog soka. Dolazi do reakcije enzimske hidrolize (cijepanja) proteina u aminokiseline uz dodatak molekule vode kada se svaka peptidna veza prekida. Slične reakcije javljaju se u gastrointestinalnom traktu ljudi i životinja:
Dakle, voda može ulaziti u kemijske reakcije, tj. je reagens.
Vitalna aktivnost biljnih stanica, tkiva i organa određena je prisutnošću vode. Voda je konstitucionalna tvar. Određujući strukturu citoplazme stanica i njezinih organela, zbog polariteta molekula ona je otapalo organskih i anorganskih spojeva koji sudjeluju u metabolizmu, te djeluje kao pozadinsko okruženje u kojem se odvijaju svi biokemijski procesi. Lako prodirući kroz stanične membrane i membrane, voda slobodno cirkulira kroz biljku, osiguravajući prijenos tvari i time promičući jedinstvo metaboličkih procesa u tijelu. Zbog svoje visoke prozirnosti, voda ne ometa apsorpciju sunčeve energije pomoću klorofila.
Stanje vode u biljnim stanicama
Voda u stanici dolazi u nekoliko oblika koji su bitno različiti. Glavne su ustavna, solvatna, kapilarna i rezervna voda.
Neke od molekula vode koje ulaze u stanicu stvaraju vodikove veze s određenim brojem radikala molekula organskih tvari. Sljedeći radikali posebno lako tvore vodikove veze:
Ovaj oblik vode se obično naziva ustavna . Sadrži ga ćelija snage do 90 tisuća barela.
Zbog činjenice da su molekule vode dipoli, one tvore integralne agregate s nabijenim molekulama organskih tvari. Takva voda, vezana za molekule organskih tvari u citoplazmi silama električnog privlačenja, naziva se solvat . Ovisno o vrsti biljne stanice, udio solvatne vode iznosi od 4 do 50% njezine ukupne količine. Solvatna voda, kao i konstitucionalna voda, nema mobilnost i nije otapalo.
Značajan dio vode u stanici je kapilarna , budući da se nalazi u šupljinama između makromolekula. Solvat i kapilarnu vodu stanica drži silom koja se naziva matrični potencijal. Jednako je 15-150 bara.
rezerva zove voda koja se nalazi unutar vakuola. Sadržaj vakuola je otopina šećera, soli i niza drugih tvari. Stoga stanica zadržava pričuvnu vodu snagom koja je određena veličinom osmotskog potencijala vakuolnog sadržaja.
Apsorpcija vode biljnim stanicama
Budući da u stanicama nema aktivnih prijenosnika za molekule vode, njezino kretanje u i iz stanica, kao i između susjednih stanica, odvija se samo prema zakonima difuzije. Stoga su gradijenti koncentracije otopljene tvari glavni pokretači molekula vode.
Biljne stanice, ovisno o svojoj starosti i stanju, apsorbiraju vodu pomoću sekvencijalne aktivacije tri mehanizma: imbibicije, solvatacije i osmoze.
Imbibicija . Kad sjeme proklija, ono počinje apsorbirati vodu putem mehanizma imbibicije. U tom se slučaju popunjavaju prazne vodikove veze organskih tvari protoplasta, a voda aktivno ulazi u stanicu iz okoline. U usporedbi s drugim silama koje djeluju u stanicama, imbibicijske sile su kolosalne. Za neke vodikove veze one dosežu vrijednost od 90 tisuća barela. U tom slučaju sjeme može nabubriti i proklijati u relativno suhim tlima. Nakon što se popune sve slobodne vodikove veze, imbibicija prestaje i aktivira se sljedeći mehanizam apsorpcije vode.
Solvatacija . Tijekom procesa solvatacije dolazi do apsorpcije vode izgradnjom hidratacijskih slojeva oko molekula organskih tvari protoplasta. Ukupni sadržaj vode u stanici nastavlja rasti. Intenzitet solvatacije značajno ovisi o kemijskom sastavu protoplasta. Što je više hidrofilnih tvari u stanici, to se potpunije koriste sile solvatacije. Hidrofilnost se smanjuje redom: bjelančevine -> ugljikohidrati -> masti. Dakle, najveću količinu vode po jedinici mase otapanjem apsorbiraju sjemenke bjelančevina (grašak, bob, bob), međukoličinu apsorbira škrob (pšenica, raž), a najmanju količinu apsorbiraju uljarice (lan, suncokret). ).
Sile solvatacije su slabije u snazi od sila imbibicije, ali su još uvijek prilično značajne i dosežu 100 bara. Do kraja procesa solvatacije, sadržaj vode u stanici je toliko velik da kapilarna vlaga nestaje i počinju se pojavljivati vakuole. Međutim, od trenutka njihovog nastanka otapanje prestaje, a daljnja apsorpcija vode moguća je samo zahvaljujući osmotskom mehanizmu.
Osmoza . Osmotski mehanizam apsorpcije vode djeluje samo u stanicama koje imaju vakuolu. Smjer kretanja vode određen je omjerom osmotskih potencijala otopina uključenih u osmotski sustav.
Osmotski potencijal staničnog soka označava se sa R, određuje se formulom:
R = iRCT,
Gdje R - osmotski potencijal staničnog soka
R- plinska konstanta jednaka 0,0821;
T - temperatura na Kelvinovoj skali;
ja- izotonični koeficijent, koji pokazuje prirodu elektrolitičke disocijacije otopljenih tvari.
Sam izotonični koeficijent je jednak
I= 1 + α ( n + 1),
gdje je α - stupanj elektrolitičke disocijacije;
P - broj iona na koje molekula disocira. Za neelektrolite P = 1.
Osmotski potencijal otopine tla obično se označava grčkim slovom π.
Molekule vode uvijek se kreću iz okoline s nižim osmotskim potencijalom u okolinu s višim osmotskim potencijalom. Dakle, ako je stanica u zemljišnoj (vanjskoj) otopini na P>π, tada voda ulazi u stanice. Dotok vode u stanicu prestaje kada su osmotski potencijali potpuno izjednačeni (vakuolni sok na ulazu u apsorpciju vode je razrijeđen) ili kada stanična membrana dosegne granice rastezljivosti.
Dakle, stanice dobivaju vodu iz okoline samo pod jednim uvjetom: osmotski potencijal staničnog soka mora biti veći od osmotskog potencijala okolne otopine.
Ako R< π, dolazi do istjecanja vode iz ćelije u vanjsku otopinu. Tijekom gubitka vode, volumen protoplasta postupno se smanjuje, odmiče se od ljuske, au stanici se pojavljuju male šupljine. Ovo stanje se zove Plazmoliza . Faze plazmolize prikazane su na sl. 3.18.
Ako omjer osmotskih potencijala odgovara uvjetu P = π, uopće ne dolazi do difuzije molekula vode.
Velika količina činjeničnog materijala pokazuje da osmotski potencijal soka biljnih stanica varira u prilično širokim granicama. U poljoprivrednim biljkama, u stanicama korijena obično leži u amplitudi od 5-10 bara, u stanicama lista može porasti do 40 bara, au stanicama voća - do 50 bara. Kod slanih biljaka osmotski potencijal staničnog soka doseže 100 bara.

Riža. 3.18.
A - stanica u stanju turgora; B - kut; B - konkavan; G - konveksan; D - konvulzivno; E - kapa. 1 - školjka; 2 - vakuola; 3 - citoplazma; 4 - jezgra; 5 - Hecht niti
Sadržaj vode u različitim biljnim organima varira u prilično širokim granicama. Razlikuje se ovisno o okolišnim uvjetima, starosti i vrsti biljaka. Dakle, sadržaj vode u listovima salate je 93-95%, kukuruz - 75-77%. Količina vode varira u različitim biljnim organima: lišće suncokreta sadrži 80-83% vode, stabljike - 87-89%, korijenje - 73-75%. Sadržaj vode od 6-11% tipičan je uglavnom za sjemenke sušene na zraku, u kojima su vitalni procesi inhibirani.
Voda se nalazi u živim stanicama, mrtvim elementima ksilema i međustaničnim prostorima. U međustaničnim prostorima voda je u parovitom stanju. Glavni evaporativni organi biljke su listovi. S tim u vezi, prirodno je da najveća količina vode ispunjava međustanične prostore lišća. U tekućem stanju voda se nalazi u raznim dijelovima stanice: staničnoj membrani, vakuoli, citoplazmi. Vakuole su najbogatiji dio stanice vodom, gdje njezin sadržaj doseže 98%. Pri najvećem sadržaju vode, sadržaj vode u citoplazmi je 95%. Najniži sadržaj vode karakterističan je za stanične membrane. Kvantitativno određivanje sadržaja vode u staničnim membranama je teško; prividno se kreće od 30 do 50%.
Oblici vode u različitim dijelovima biljne stanice također su različiti. Vakuolarnim staničnim sokom dominira voda koju zadržavaju spojevi relativno niske molekularne težine (osmotski vezani) i slobodna voda. U ovojnici biljne stanice vodu vežu uglavnom visokopolimerni spojevi (celuloza, hemiceluloza, pektinske tvari), odnosno koloidno vezana voda. U samoj citoplazmi nalazi se slobodna voda, koloidno i osmotski vezana. Voda koja se nalazi na udaljenosti do 1 nm od površine proteinske molekule je čvrsto vezana i nema pravilnu heksagonalnu strukturu (koloidno vezana voda). Osim toga, u citoplazmi postoji određena količina iona, pa je dio vode osmotski vezan.
Fiziološki značaj slobodne i vezane vode je različit. Prema većini istraživača, intenzitet fizioloških procesa, uključujući i stopu rasta, prvenstveno ovisi o sadržaju slobodne vode. Postoji izravna korelacija između sadržaja vezane vode i otpornosti biljaka na nepovoljne vanjske uvjete. Ove fiziološke korelacije nisu uvijek uočene.
Za normalno postojanje stanice i biljni organizam u cjelini moraju sadržavati određenu količinu vode. Međutim, to je lako izvedivo samo za biljke koje rastu u vodi. Za kopnene biljke ovaj je zadatak kompliciran činjenicom da se voda u tijelu biljke kontinuirano gubi isparavanjem. Isparavanje vode od strane biljke doseže ogromne razmjere. Možemo navesti sljedeći primjer: jedna biljka kukuruza ispari do 180 kg vode tijekom vegetacije, a 1 hektar šume u Južnoj Americi ispari u prosjeku 75 tisuća kg vode dnevno. Velika potrošnja vode posljedica je činjenice da većina biljaka ima značajnu lisnu površinu koja se nalazi u atmosferi koja nije zasićena vodenom parom. Istodobno, razvoj opsežne lisne površine je neophodan i razvijen u procesu duge evolucije kako bi se osigurala normalna prehrana ugljičnim dioksidom sadržanim u zraku u neznatnoj koncentraciji (0,03%). U svojoj poznatoj knjizi “Borba biljaka protiv suše” K.A. Timirjazev je istaknuo da je kontradikcija između potrebe za hvatanjem ugljičnog dioksida i smanjenja potrošnje vode ostavila traga na strukturi cijelog biljnog organizma.
Da bi se nadoknadio gubitak vode zbog isparavanja potrebno je kontinuirano dovoditi veliku količinu vode u postrojenje. Nazivaju se dva procesa koji se neprekidno odvijaju u biljci - ulazak i isparavanje vode ravnoteža vode biljaka. Za normalan rast i razvoj biljaka potrebno je da potrošnja vode približno odgovara dotoku, odnosno da biljka smanjuje vodnu bilancu bez velikog deficita. Da bi to postigla, biljka je kroz proces prirodne selekcije razvila prilagodbe za upijanje vode (kolosalno razvijen korijenov sustav), za premještanje vode (poseban provodni sustav) i smanjenje isparavanja (sustav pokrovnih tkiva i sustav automatskih zatvaranje stomatalnih otvora).
Unatoč svim tim prilagodbama, biljka često doživljava deficit vode, odnosno opskrba vodom nije uravnotežena s njezinom potrošnjom tijekom procesa transpiracije.
Fiziološki poremećaji javljaju se u različitim biljkama s različitim stupnjevima nedostatka vode. Postoje biljke koje su u procesu evolucije razvile različite prilagodbe da podnose dehidraciju (biljke otporne na sušu). Pojašnjenje fizioloških karakteristika koje određuju otpornost biljaka na nedostatak vode je najvažniji zadatak, čije rješenje ima veliki ne samo teorijski, već i poljoprivredni praktični značaj. Istovremeno, da bi se to riješilo, potrebno je poznavati sve aspekte izmjene vode u biljnom organizmu.
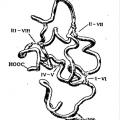 Proteini: struktura, svojstva i funkcije Opća svojstva proteinskih molekula
Proteini: struktura, svojstva i funkcije Opća svojstva proteinskih molekula Baze su složeni spojevi koji disocijacijom tvore samo hidroksidne ione kao anione. Pojam elektronskih orbitalnih i kvantnih brojeva
Baze su složeni spojevi koji disocijacijom tvore samo hidroksidne ione kao anione. Pojam elektronskih orbitalnih i kvantnih brojeva Kemija (građa atoma) (prezentacija)
Kemija (građa atoma) (prezentacija)