Какой ученый впервые получил чистый водород. Кто открыл состав воды
После работ Дж. Блэка многие химики в различных лабораториях Англии, Швеции, Франции, Германии занялись изучением газов. Больших успехов достиг Г. Кавендиш. Все экспериментальные работы этого скрупулезного ученого были основаны на количественном методе исследования. Он широко использовал взвешивание веществ и измерение газовых объемов, руководствуясь законом сохранения массы. В первой работе Г. Кавенднша по химии газов (1766) описаны способы получения и свойства .
«Горючий воздух» был известен и раньше (Р. Бойль, Н. Лемери). В 1745 г. М. В. Ломоносов, например, отмечал, что «при растворении какого-либо неблагородного металла, особенно , в кислотных спиртах из отверстия склянки вырывается горючий пар, который представляет собой не что иное, как флогистон». Это примечательно в двух отношениях: во-первых, за много лет до Кавендиша М. В. Ломоносов пришел к выводу, что «горючий воздух» (т. е. водород) представляет собой флогистон; во-вторых, из приведенной цитаты следует, что М. В. Ломоносов принимал учение о флогистоне.
Но выделить «горючий воздух» и изучить его свойства никто до Г. Кавендиша не пытался. В химическом трактате «Три работы, содержащие опыты с искусственными видами воздуха» (1766) он показал, что существуют газы, которые отличаются от воздуха, а именно, с одной стороны, «лесной, или связанный, воздух», который, как установил Г. Кавендиш, оказался в 1,57 раза тяжелее обычного воздуха, с другой стороны, «горючий воздух» - водород. Г. Кавендиш получал его действием разбавленных и кислот на различные металлы. Тот факт, что при действии на (цинк, железо) выделялся один и тот же газ (водород), окончательно убедил Г. Кавендиша в том, что все металлы содержат флогистон, который выделяется при превращении металлов в «земли». Английский ученый принимал водород за чистый флогистон, поскольку газ горит, не оставляя остатка, и оксиды металлов, обрабатываемые этим газом, при нагревании восстанавливаются в соответствующие металлы.
 Генри Кавендиш
Генри Кавендиш
Г. Кавендиш как сторонник теории флогистона считал, что не вытесняется металлом из кислоты, а выделяется вследствие разложения «сложного» металла. Реакцию получения «горючего воздуха» из металлов он представлял так:
Какими способами и приборами пользовался «отец химии газообразных веществ», можно видеть из следующего. Покидая Лидс, Дж. Пристли по просьбе одного из знакомых оставил ему глиняное корыто, которое он применял как пневматическую ванну в своих опытах по изучению состава воздуха и которое, иронически замечает Дж. Пристли, «ничем не отличалось от корыт, в которых прачки стирают белье». В 1772 г. Дж. Пристли заменил в пневматической ванне воду ртутью, что позволило ему впервые получить в чистом виде и изучить растворимые в воде газы: «солянокислый воздух» () и «летучий щелочной воздух» - бесцветный газ с удушливым резким запахом. Это был , который он получил при нагревании хлорида аммония:
2NH 4 Cl + CaO = 2NH 3 + CaCl 2 + H 2
«Золотая россыпь, открытая Пристли, была… ртутная ванна,- писал В. Оствальд. - Один шаг вперед в технической стороне дела-замена воды - вот ключ к большинству открытий Пристли». Дж. Пристли наблюдал, что если через аммиак пропускать электрическую искру, то объем его резко увеличивается. В 1785 г. К.- Л. Бертолле установил, что это объясняется разложением аммиака на азот и водород. Дж. Пристли наблюдал, что при взаимодействии двух резко пахнущих, газов (НСl и NH 3) образуется белый порошок без запаха, (NH 4 Cl). В 1775 г. Дж. Пристли получил , а в. 1796 г. - , который принял за чистый флогистон.
История открытия водорода
Многие исследователи проводили опыты с кислотами. Было замечено, что при действии кислот на некоторые металлы выделяются пузырьки газа. Полученный газ легко воспламенялся, и его назвали «горючим воздухом».
Подробно свойства этого газа были изучены английским ученым Г. Кавендишем в 1766г. Он помещал металлы в растворы серной и соляной кислот и во всех случаях получал одно и то же легкое газообразное вещество, которое позже назвали водородом.
Странным на первый взгляд делом занялся однажды английский ученый Генри Кавендиш: он стал пускать мыльные пузыри. Но это не было развлечением. Перед этим он заметил, что, когда железные опилки обливают серной кислотой, появляется много пузырьков какого-то газа. Что это за газ?
Ученый вывел его по трубочкам из сосуда. Газ был невидим. Имеет ли он запах? Нет. Тогда он наполнил им мыльные пузыри. Они легко поднялись вверх! Значит, газ легче воздуха! А если поджечь газ то, он загорится голубоватым огоньком. Но удивительно то, что при горении получилась вода! Генри Кавендиш назвал новый газ горючим воздухом. Ведь он, как и обычный воздух, был без цвета и запаха. Все это происходило во второй половине 18-го в.
Позже французский химик Антуан Лоран Лавуазье сделал обратное: получил «горючий газ» из воды. Он же дал новому газу и другое имя -- водород, то есть «рождающий воду». Потом ученые установили, что водород -- самое легкое из всех известных людям веществ, а его атомы устроены проще всех других.
Водород очень распространен. Он входит в состав всех живых существ, организмов, растений, горных пород. Он есть везде: не только на Земле, но и на других планетах и звездах, на Солнце; особенно много его в космическом пространстве. Превращения, которые происходят с водородом при гигантском давлении и температуре в десятки миллионов градусов, дают возможность Солнцу излучать тепло и свет. Больше всего различных соединений водород образует с углеродом: нефть и горючие сланцы, бензин и черный асфальт. Такие соединения называются углеводородами. Водород широко применяется при сварке и резке металлов. Если к соединениям углерода и водорода добавить кислород, получаются новые, соединения -- углеводы, например, такие не похожие друг на друга вещества, как крахмал и сахар. А если водород соединить с азотом, получится тоже газ -- аммиак. Он необходим для изготовления удобрений. Многие достоинства водорода -- экологически безвреден, энергоемок, находится в природе в изобилии -- позволили использовать его как ракетное топливо. Те же особенности водорода делают его перспективным и в качестве топлива авиационного.
Водород -- самый легкий, самый простой и самый распространенный химический элемент во Вселенной. Он составляет примерно 75% от всей массы элементов в ней. В больших количествах водород обнаружен в звездах и планетах типа «газовый гигант». Он играет ключевую роль в протекающих в звездах реакциях синтеза. Водород является газом с молекулярной формулой H2. При комнатной температуре и нормальном давлении водород является безвкусным, бесцветным и лишенным запаха газом. Под давлением и при сильном холоде водород переходит в жидкое состояние. Хранимый в этом состоянии водород занимает меньше места, чем в своей «нормальной» газообразной форме. Жидкий водород используется в том числе и в качестве ракетного топлива. При сверхвысоком давлении водород переходит в твердое состояние и становится металлическим водородом. В этом направлении ведутся научные исследования. Водород используется в качестве альтернативного топлива для транспорта. Химическая энергия водорода высвобождается при его сжигании способом, подобным тому, который применяется в традиционных двигателях внутреннего сгорания. На его основе также создаются топливные элементы, в которых задействован процесс образования воды и электричества путем осуществления химической реакции водорода с кислородом. Он потенциально опасен для человека, поскольку может возгораться при соприкосновении с воздухом. Кроме того, этот газ не годится для дыхания.
С 1852 года -- с тех самых пор, как первый дирижабль на основе водорода был создан Генри Гиффардом -- водород использовался в воздухоплавании. Позднее водородные дирижабли называли «цеппелинами». Их использование было прекращено после крушения дирижабля «Гинденбург» в 1937 году. Авария произошла в результате возгорания.
Так же водород широко применяется в нефтяной и химической отраслях, а также часто используется для различных физических и инженерных задач: например, в сварочном деле и в качестве охлаждающего вещества. Молекулярная формула перекиси водорода H2O2. Это вещество часто используется для отбеливания волос и в качестве чистящего средства. В виде медицинского раствора оно используется также для обработки ран.
Так как водород в 14 раз легче воздуха, если вы наполните им воздушные шары, они будут отдаляться от Земли со скоростью 85 км в час, что в два раза превышает скорость шаров, наполненных гелием, и в шесть раз - скорость шаров, наполненных природным газом.
химический водород перекись газ
Список используемой литературы
- 1. http://www.5.km.ru/
- 2. http://hi-news.ru/science/ximiya-14-faktov-o-vodorode.html.
03.10.2015
Всем нам известно, что самый распространенный элемент в нашей Вселенной - это водород. Он является основной составляющей звезд. От всех атомов его доля составляет 88,6 %. Происходящие на Земле процессы просто не возможны без действия водорода. Он, в отличие от многих других элементов, находится в виде различных соединениях. Его массовая доля простого вещества в воздухе ничтожно мала.
Название элемента на латинском языке Hydrogenium состоит из двух греческих слов, в переводе означающих вода и рождаю - то есть рождающий воду. Так назвал его Лавуазье, но в XVII в. академик В.М. Севергин решил ознаменовать этот элемент как «водотворное вещество». Название водород в России было предложено в 1824 году химик Соловьев, по схожести как «кислород». В химической литературе России до XIX века можно увидеть такие названия элемента - горючий газ , загораемый воздух или водотвор , водородный газ , воодтворное существо .
Опыты по изучению и открытию многих газов долгое время оставались без внимания, так как экспериментаторы попросту не замечали этих невидимых веществ. Лишь со временем было закреплено убеждение, что газ - это такой же материал, без исследования которого не возможно полностью понять химическую основу мира. Открытие водорода произошло еще в самом развитии химии как науки. В XI-XII веках был выделен газ, во время взаимодействия металла с кислотами. Парацельс, Ломоносов, Бойл и другие ученые и изобретатели наблюдали его горение. Но основная их часть в те годы была привержена теории о флогистоне.
Ломоносов, в 1745 году, при написании диссертации описал получение газа при действии кислот на металлы. Гипотеза о флогистоне была также высказана и химиком Генри Кавендишем, который более подробно исследовал свойства водорода, дав ему название «горючий воздух». Только к концу XII века, используя современные лабораторные приборы, Лавуазье, совместно с Менье, осуществили водный синтез. Ими был сделан анализ водяного пара, который был разложен с применением горячего железа. Благодаря этому опыту стало понятно, что водород присутствует в составе воды, ко всему он может быть получении из нее.
Рубеж XIII-XIX века ознаменовался одним открытием - было обнаружено, что атом водорода достаточно легок, наравне с другими элементами, было принято считать вес этого элемента как единицу сравнения. Его атомной массе было предписано значение 1. Когда Лавуазье представил таблицу простых веществ, он отнес туда водород к 5 простым телам (водород, кислород, азот, свет, тепло). Было принято считать - эти вещества были из 3-х природных царств и считались элементами тел.
Помимо открытия самого элемента в дальнейшем учеными были обнаружены его изотопы. Произошло это в более современное время, в 1931 году. Группа ученых занималась исследованием остатка, который образовался в ходе продолжительного выпаривания водорода в жидком состоянии. В ходе опыта был обнаружен водород, атомное число которого равнялось 2. Ему дали название Дейтерий (второй). По истечении всего 4-х лет, при длительном электролизе воды был обнаружен еще более тяжелый изотоп, который получил название Тритий (третий).
– это газ, важное значение которого в существовании жизни на планете началось еще миллиарды лет назад. По современным догадкам, водород (H2) появился около 14 миллиардов лет назад. Он не обладает цветом или запахом, а также является самым легким элементом периодической системы химических элементов, имея атомную массу 1.00794. Водород имеет гексагональную кристаллическую структуру и при 0° по Цельсию его плотность составляет 0.09099 г/л.
Можно считать «аристократическим» газом, так как он был открыт в 1766 году британским философом, физиком и химиком дворянского происхождения Генри Кавендишем, а свое название он получил в 1783 году благодаря французскому физику, также дворянского происхождения, Антуану Лавуазье. Лорд Кавендиш предпочитал называть свое открытие –«горючий воздух». Фантастически богатый Лорд Каведиш был настолько застенчивым и замкнутым, что в одном из его имений даже была установлена отдельная лестница на вход по причине того, что он не мог общаться со слугами, особенно женского пола, с которыми он был особенно стеснителен и общался только с помощью записок. По современным предположениям Генри Кавендиш страдал синдромом Аспергера.
Что касается Антуана Лавуазье, то его конец был печален: после всех важных научных трудов он был лишен французскими крестьянами головы с помощью гильотины во время Французской революции. Спустя несколько недель после случившегося, они признали свою ошибку и принесли извинения семье Антуана Лавуазье, а позже даже воздвигли статую в его честь. Но из-за недостатка средств, к статуи Лавуазье приделали голову другого господина. Это кажется весьма ироничным, не правда ли?
Адаптивность просто поражает. Водород способен производить электричество, поэтому он используется в топливных элементах и, будучи наиболее чистым вариантом, в двигателях внутреннего сгорания.
Водород возник в результате большого взрыва и, с тех пор, действует в самых различных сферах на Земле. За последние три с половиной миллиарда лет он активно участвует в производстве воды, а также рождении и поддержании клеточной жизни.
На сегодняшний день водород (Н2) находится под пристальным вниманием в медицинских исследованиях. Сотни научных исследований доказали терапевтический потенциал воды, обогащенной водородом, для более, чем 140 моделей различных болезней.
Вот краткий обзор некоторых терапевтических возможностей водорода и водородной воды:
- снижает поверхностное натяжение клеток, позволяя им лучше поглощать питательные вещества.
- Это самый маленький , обладающий высокой биодоступностью.
- Водород ликвидирует только самые разрушительные , превращая их в безопасную воду без каких-либо токсичных отходов.
- усиливает действие таких антиоксидантов, как глутатион и супероксиддисмутаза.
- помогает в осуществлении правильной гидратации клеток.
- Водородная вода способствует уменьшению молочной кислоты и, таким образом, избавляет от боли в мышцах во время и после физических тренировок.
- способствует производству АТФ в митохондриях.
- Водородная вода усиливает функцию митохондрий в головном мозге, улучшая тем самым мозговую активность. Также поддерживает баланс сахара и холестерина.
- Водородная вода обладает противовоспалительным действием и защищает от вредного воздействия радиации. Поэтому употребление
Водород в природе
Много ли в природе водорода? Смотря где. В космосе водород – главный элемент. На его долю приходится около половины массы Солнца и большинства других звезд. Он содержится в газовых туманностях, в межзвездном газе, входит в состав звезд. В недрах звезд происходит превращение ядер атомов водорода в ядра атомов гелия. Этот процесс протекает с выделением энергии; для многих звезд, в том числе для Солнца, он служит главным источником энергии.
Например, ближайшая к нам звезда Галактики, которую мы знаем под именем «Солнце», на 70 % своей массы состоит из водорода. Атомов водорода во вселенной в несколько десятков тысяч раз больше, чем всех атомов всех металлов, вместе взятых.
Водород широко распространен в природе, его содержание в земной коре (литосфера и гидросфера) составляет по массе 1%. Водород входит в состав самого распространенного вещества на Земле - воды (11,19% водорода по массе), в состав соединений, слагающих угли, нефть, природные газы, глины, а также организмы животных и растений (то есть в состав белков, нуклеиновых кислот, жиров, углеводов и других). В свободном состоянии Водород встречается крайне редко, в небольших количествах он содержится в вулканических и других природных газах. Ничтожные количества свободного Водорода (0,0001% по числу атомов) присутствуют в атмосфере.
Задание № 1. Заполните таблицу «Нахождение водорода в природе».
| В свободжном состоянии | В связанном состоянии |
| Гидросфера - | |
| Литосфера - | |
| Биосфера - |
Открытие водорода.
Водород был открыт в первой половине XVI века немецким врачом и естествоиспытателем Парацельсом. В трудах химиков XVI–XVIII вв. упоминался «горючий газ» или «воспламеняемый воздух», который в сочетании с обычным, давал взрывчатые смеси. Получали его, действуя на некоторые металлы (железо, цинк, олово) разбавленными растворами кислот - серной и соляной.
Первым ученым, описавшим свойства этого газа, был английский ученый Генри Кавендиш. Он определил его плотность и изучил горение на воздухе, однако приверженность теории флогистона помешала исследователю разобраться в сути происходящих процессов.
В 1779 г. Антуан Лавуазье получил водород при разложении воды, пропуская ее пары через раскаленную докрасна железную трубку. Лавуазье также доказал, что при взаимодействии «горючего воздуха» с кислородом образуется вода, причем газы реагируют в объемном соотношении 2:1. Это позволило ученому определить состав воды - Н 2 О. Название элемента – Hydrogenium – Лавуазье и его коллеги образовали от греческих слов «гидро » - вода и «геннио » – рождаю. Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году - по аналогии с ломоносовским «кислородом».
Задание №2. Напишите реакцию получения водорода из цинка и соляной кислоты в молекулярном и ионном виде, составьте ОВР.
 Корпускулярные и волновые свойства частиц
Корпускулярные и волновые свойства частиц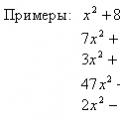 Уравнения онлайн X 5 0 решение
Уравнения онлайн X 5 0 решение Предельные монокарбоновые кислоты
Предельные монокарбоновые кислоты