Produk akhir metabolisme nitrogen. Asid urik dalam darah: norma dan penyelewengan, mengapa ia meningkat, diet untuk mengurangkannya Hasil akhir metabolisme nitrogen adalah
Institusi pendidikan negeri
Akademi Perubatan Negeri Chita
L.P. Nikitina, A.Ts. Gomboeva, N.S. Kuznetsova
Metabolisme nitrogen biokimia dalam keadaan normal dan patologi
Disunting oleh prof. B.S. Khyshyktueva
L.P. Nikitina
A.Ts. Gomboeva
N.S. Kuznetsova
Manual ini ditujukan untuk pelajar universiti perubatan. Ia membentangkan maklumat tentang pelbagai sebatian yang mengandungi nitrogen, terutamanya mengenai asid amino, nukleotida dan biopolimernya - protein, asid nukleik, dalam bahasa yang agak ringkas dan mudah diakses.
|
Senarai singkatan. . . . . . . . . . . . . . . . . . . . . . . | |||
|
. . . . . . . . . . . . . . . . . . . . . . . | |||
|
pengenalan. | |||
|
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . | |||
|
. . . . . . . . . . . . . . . . . . . . . . | |||
|
Bab 1. Pengelasan dan keluasan peranan sebatian yang mengandungi nitrogen. . | |||
|
Bab 2. Metabolisme asid amino. . . . . . . . . . | |||
|
. . . . . . . . . . . . . . . . . . . . . . . . | |||
|
2.1. | |||
|
Peringkat hidrolitik katabolisme polipeptida. . . . . . . . . . | |||
|
2.2. | |||
|
Nasib asid amino dalam sel. . . . . . . | |||
|
. . . . . . . . . . . . . . . . . . . . . . . | |||
|
2.2.1. | |||
|
Pilihan untuk transformasi bukan khusus. . . . . . . . . . . . . . . | |||
|
2.2.1.1. | |||
|
Tindak balas dekarboksilasi. . . . . . | |||
|
. . . . . . . . . . . . . . . . . . . | |||
|
3.2.2. | |||
|
Maksud dinukleotida. . . . . . . . . . . | |||
|
. . . . . . . . . . . . . . . . . . . . | |||
|
3.2.3. | |||
|
Polinukleotida. . . . . . . . . . . . . . . . . . . | |||
|
. . . . . . . . . . . . . . . . . . . | |||
|
3.2.3.1. | |||
|
Jenis-jenis RNA. . . . . . . . . . . . . . . . . . . . . . . . . | |||
|
. . . . . . . . . . . . . . . . | |||
|
3.2.3.2. | |||
|
varian DNA. . . . . . . . . . . . . . . . . . . . . | |||
|
. . . . . . . . . . . . . . . . | |||
|
3.2.3.3. | |||
|
Sifat fizikokimia dan biologi nukleotida kompleks | |||
|
3.3. | |||
|
Fasa katabolik pertukaran struktur nukleik. . . . . . . . . . | |||
|
3.3.1. | |||
|
Perpecahan nukleoprotein dalam saluran gastrousus dan tisu. . . . . . . . . . . . . . . . . | |||
|
3.3.2. | |||
|
Laluan khusus transformasi nukleosida. . . . . . . . . | |||
|
3.3.2.1. | |||
|
Hasil akhir metabolisme purin ialah asid urik. . . | |||
|
3.3.2.2. | |||
|
Skim pemusnahan cincin pirimidin. . . . . . . . . . . . . . | |||
|
3.4. | |||
|
Laluan untuk sintesis mononukleotida. . . . . . | |||
|
. . . . . . . . . . . . . . . . . . . . . . | |||
|
3.4.1. | |||
|
Kamus istilah genetik. . . . . . . . . . . . | |||
. . . . . . . . . . . . . . . . . . . . . . . .
Senarai singkatan
ADP - adenosin trifosfat
ALT - alanine aminotransferase
AMP - adenosin monofosfat
AO – antioksidan
ARZ – perlindungan anti-radikal
AST - aspartat aminotransferase
ATP - adenosin trifosfat
HFA - asid lemak yang lebih tinggi
GABA - asid gamma-aminobutyric
HGPRT - hypoxanthine guanine phosphoribosyltransferase
KDNK – guanosin difosfat
GMP - guanosin monofosfat
GNG - glukoneogenesis
GP – gliserol fosfatida
HSE - unsur sensitif hormon
hRNA - asid ribonukleik nuklear heterogen
DHAP - dihidroksiaseton fosfat
DOPA – di(hidr)oxyphenylalanine
Saluran gastrousus - saluran gastrousus
IMP – inosin monofosfat
iRNA - asid ribonukleik utusan
CoA – koenzim asilasi
NAD + – nicotinamide adenine dinucleotide
NAD + P – nicotinamide adenine dinucleotide phosphate
NTP - nukleosida trifosfat
OA – oksaloasetat
OMP - oritidine monofosfat
PVA - asid piruvik
PPP – laluan pentosa fosfat
RNDP – ribonukleosida difosfat
RMNP – ribonucleoside monofosfat
RNA - asid ribonukleik
rRNA - asid ribonukleik ribosom
RNTP - ribonukleosida trifosfat
STH - hormon somatotropik
THFA - asid tetrahidrofolik
TDP - tiamin difosfat
TMP - timidin monofosfat
tRNA – mengangkut asid ribonukleik
UMP – uridin monofosfat
UTP - uridin trifosfat
FAD – flavin adenine dinucleotide
FAPS - fosfoadenosin fosfosulfat
FMN – flavin mononukleotida
PRPP - fosforibosil pirofosfat
c-AMP – kitaran adenosin monofosfat
CDP - cytidine diphosphate
CMP - sitidin monofosfat
Kitaran TCA - kitaran asid trikarboksilik
DLL – rantaian pengangkutan elektron
H – histon
SAM – S-adenosylmethionine
pengenalan
Kemasukan atom nitrogen yang mampu menerima proton disebabkan oleh pasangan elektron tunggal, i.e. memiliki sifat asas, membawa kepada perubahan kualitatif dalam fungsi yang dilakukan. Badan tidak dapat menggunakan molekul yang mengandungi amino sebagai sumber tenaga;
Sistem perkumuhan amfibia dewasa diwakili oleh sepasang buah pinggang batang - mesonephros, yang terletak di sisi bahagian sakral lajur tulang belakang, tetapi, tidak seperti ikan, mereka tidak mempunyai bentuk seperti reben, tetapi bujur dan sangat padat. Ureter adalah saluran Wolffian (pada lelaki ia juga berfungsi sebagai vas deferens), yang mengalir ke kloaka. Dalam bentuk terestrial yang lebih tinggi, pundi kencing yang luas terbuka ke dalam kloaka, di mana air kencing masuk dari kloaka dan disimpan sementara.
Apabila pundi kencing melimpah, ia mengosongkan kandungannya ke dalam kloaka yang sama, dan dari situ air kencing dikeluarkan. Buah pinggang amfibia mengeluarkan bahan buangan daripada darah dan mengekalkan keseimbangan air-garam (keseimbangan). Bilangan nefron dalam buah pinggang bergantung pada seberapa rapat haiwan itu disambungkan dengan air. Dalam amfibia ekor yang kebanyakannya akuatik, terdapat kira-kira 400 - 500 nefron dalam kedua-dua buah pinggang, dan dalam amfibia tanpa ekor - kira-kira 2000. Ini dijelaskan oleh fakta bahawa akuatik amfibia mengeluarkan sebahagian daripada produk metabolik mereka melalui insang mereka
dan penutup badan ke dalam air sekeliling.
Hasil akhir metabolisme nitrogen dalam amfibia ialah urea.
Lebihan air dikeluarkan melalui buah pinggang, yang memasuki badan haiwan melalui kulit, manakala garam diserap semula (diserap semula) daripada air kencing, jadi kebanyakan ion - sehingga 99% - kembali ke darah.
Melalui banyak tubul seminiferus nipis yang memanjang dari testis, produk pembiakan melalui bahagian anterior buah pinggang dan memasuki saluran Wolffian, yang dalam amfibia (dan juga dalam ikan cartilaginous) menggabungkan fungsi ureter dan vas deferens. Saluran Wolffian kosong ke dalam kloaka, tetapi tidak lama sebelum setiap daripada mereka membentuk lanjutan kecil - vesikel mani, di mana sperma terkumpul buat sementara waktu. Seperti testis dan badan gemuk, vesikel mani mengecut di luar musim pembiakan.
Amfibia tidak mempunyai saluran pembiakan sendiri dalam sistem pembiakan lelaki;
Sistem pembiakan wanita dibentuk oleh dua ovari yang digantung pada mesenterium, di atasnya terletak badan gemuk (375). Saiz ovari berbeza dengan ketara bergantung pada musim, meningkat dengan ketara semasa musim pembiakan. Pada musim bunga, ovari sangat besar; telur besar yang kaya dengan kuning telur boleh dilihat melalui dinding nipis.
Telur matang meninggalkan ovari melalui pecahnya membran folikel dan berakhir di rongga badan, dari mana ia kemudiannya memasuki corong oviduk. Dalam amfibia betina, oviduk ialah saluran Müllerian yang berpasangan, yang membuka pada satu hujung (corong) ke dalam rongga badan, dan pada satu lagi ke dalam kloaka. Semasa musim pembiakan, oviduk menjadi sangat memanjang dan dindingnya menebal.
Banyak amfibia dicirikan oleh tingkah laku mengawan, selalunya disertai dengan isyarat vokal (jantan beberapa katak boleh mengeluarkan bunyi yang sangat kuat). Ini adalah perlu untuk merangsang pembebasan serentak produk pembiakan daripada pasangan seksual. Persenyawaan boleh menjadi dalaman atau luaran.
Amfibia dicirikan oleh perkembangan dengan metamorfosis, dengan larva muncul dari telur, yang dalam organisasinya lebih dekat dengan ikan daripada amfibia dewasa. Ia mempunyai ciri bentuk seperti ikan, jadi ia bergerak menggunakan selekoh membujur badan. Organ pernafasan mula-mula berfungsi sebagai insang luar, yang merupakan hasil daripada kulit; Anggota badan tidak hadir pada peringkat awal. Dalam amfibia berekor, insang luar berfungsi sepanjang tempoh larva, tetapi yang dalaman tidak berkembang.
Semasa perkembangan larva amfibia, sistem dalamannya dibina semula: pernafasan, peredaran darah, perkumuhan dan pencernaan..
Anggota badan secara beransur-ansur berkembang. Metamorfosis berakhir dengan pembentukan salinan kecil individu dewasa dalam haiwan tanpa ekor, ekor dikurangkan.
Ambystos dicirikan oleh neoteny, iaitu mereka membiak dengan larva, yang untuk masa yang lama disalah anggap sebagai spesies bebas, itulah sebabnya mereka mempunyai nama mereka sendiri - axolotl. Saiz larva sedemikian lebih besar daripada orang dewasa. Satu lagi kumpulan amfibia yang menarik ialah proteas, yang hidup secara kekal di dalam air dan mengekalkan insang luaran sepanjang hayat mereka, iaitu, mereka mengekalkan ciri-ciri larva.
Kami akan bercakap tentang keanehan metabolisme asas purin. Ini tidak bermakna bagi kebanyakan orang. Tetapi jika anda sudah biasa dengan perkataan "gout", urolithiasis, rintangan insulin, diabetes jenis 2, maka anda perlu mengetahui intipati metabolisme purin. Nampaknya: apakah kaitan pembedahan dengannya? Dan walaupun fakta bahawa ramai pakar mendiagnosis "gout" dengan sakit pada sendi dan asid urik yang tinggi. Pada hakikatnya, semuanya jauh lebih rumit. Sebagai contoh, arthritis gout boleh berlaku dengan paras asid urik yang normal, dan sebaliknya: asid urik yang tinggi boleh berlaku dalam beberapa kes pada orang yang sihat.
Tubuh manusia terutamanya terdiri daripada empat unsur kimia, yang menyumbang 89% daripada komposisi: C-karbon (50%), O-oksigen (20%), H-hidrogen (10%) dan N-nitrogen (8.5%). ). Seterusnya datang beberapa makroelemen: kalsium, fosforus, kalium, sulfur, natrium, klorin, dll. Kemudian unsur mikro, jumlahnya sangat kecil, tetapi ia penting: mangan, besi, iodin, dll.
Organisma hidup ialah sistem dinamik. Ringkasnya: bahan sentiasa memasukinya (menjadi sebahagian daripada badan) dan dikeluarkan daripadanya. Sumber utama nitrogen untuk badan adalah protein. Protein yang dibekalkan dengan makanan dalam saluran gastrousus terurai kepada asid amino, yang kemudiannya dimasukkan ke dalam metabolisme. Nah, bagaimanakah bahan yang mengandungi nitrogen dikeluarkan dari badan?
Dalam proses evolusi, haiwan telah membangunkan ciri-ciri tertentu metabolisme nitrogen.
Selain itu, kunci dalam menentukan ciri-ciri ini ialah: keadaan hidup dan akses kepada air.
Haiwan dibahagikan kepada tiga kumpulan yang mempunyai perbezaan dalam metabolisme nitrogen:
Ammoniolitik. Hasil akhir metabolisme nitrogen ialah ammonia, NH3. Ini termasuk kebanyakan invertebrata akuatik dan ikan.
Masalahnya ialah ammonia adalah bahan toksik. Dan untuk mengeluarkannya anda memerlukan banyak, banyak cecair. Nasib baik, ia sangat larut dalam air. Dengan akses kepada tanah semasa evolusi, timbul keperluan untuk mengubah metabolisme. Ini adalah bagaimana mereka muncul:
Ureolitik. Haiwan ini membangunkan apa yang dipanggil "kitaran urea." Ammonia bergabung dengan CO2 (karbon dioksida). Produk akhir terbentuk - urea. Urea bukanlah bahan toksik dan ketara kurang cecair diperlukan untuk mengeluarkannya. By the way, awak dan saya tergolong dalam kumpulan ini. Asid urik juga terbentuk semasa metabolisme dalam kuantiti yang lebih kecil, tetapi terurai kepada allantoin yang rendah toksik dan sangat larut. Tapi... Kecuali manusia dan beruk. Ini sangat penting dan kami akan kembali kepada perkara ini.
Uricotelic. Nenek moyang amfibia dengan metabolisme ureolitik terpaksa menyesuaikan diri dengan kawasan gersang. Ini adalah reptilia dan nenek moyang langsung dinosaur - burung. Hasil akhir mereka ialah asid urik. Ia sangat larut dalam air dan tidak memerlukan banyak air untuk mengeluarkannya dari badan. Dalam najis burung yang sama, jumlah asid urik adalah sangat besar, ia sebenarnya dikumuhkan dalam bentuk separa pepejal Oleh itu, najis burung ("guano") adalah punca utama hakisan dan kemusnahan struktur logam jambatan. . Cat kereta juga merosot - berhati-hati dan basuh dengan segera.
Ini adalah lobul hati heksagon klasik. Secara umum, ini adalah rupa hati di bawah mikroskop. Sama seperti Moscow City, hanya sebagai ganti Kremlin terdapat vena pusat. Dan kami akan berminat dengan "rumah" yang berdekatan antara satu sama lain. Ini adalah hepatosit - sel utama hati.
Perkataan Slavic hati berasal dari perkataan "ketuhar". Sesungguhnya, suhu organ adalah satu darjah lebih tinggi daripada suhu badan. Sebab untuk ini adalah metabolisme yang sangat aktif dalam hepatosit. Sel benar-benar unik; kira-kira 2 ribu tindak balas kimia berlaku di dalamnya.
Hati adalah organ utama yang menghasilkan asid urik. 95% nitrogen yang dikumuhkan adalah sintesis asid urik sebagai hasil akhir tindak balas kimia dalam hati. Dan hanya 5% adalah pengoksidaan bes purin yang datang dari luar dengan makanan. Oleh itu, pembetulan pemakanan untuk hiperurisemia bukanlah kunci kepada rawatan.
Gambar rajah metabolisme asid urik
 Dari mana datangnya purin?
Dari mana datangnya purin?
1. Purin yang berasal dari makanan
. Seperti yang telah dinyatakan, ini adalah jumlah yang kecil - kira-kira 5%. Mereka purin yang terkandung dalam makanan (yang paling penting, sudah tentu, dalam hati dan buah pinggang, daging merah).
2. Sintesis asas purin oleh badan itu sendiri
. Kebanyakannya disintesis dalam hepatosit hati. Perkara yang sangat penting, kami akan kembali kepadanya. Dan juga apa kaitan fruktosa dengannya, yang disyorkan oleh pesakit kencing manis dan tidak memerlukan insulin untuk penyerapan.
3. Asas purin, yang terbentuk di dalam badan akibat kerosakan tisu: semasa proses onkologi, psoriasis
. Mengapa paras asid urik boleh meningkat dalam kalangan atlet? Ini adalah cara ketiga. Aktiviti fizikal yang berat membawa kepada peningkatan proses pemecahan dan sintesis tisu. Jika anda melakukan kerja fizikal berat sehari sebelumnya dan menjalani ujian pada waktu pagi, paras asid urik anda mungkin lebih tinggi daripada purata anda.  Mari kita berkenalan: adenine dan guanin. Ini adalah asas purin. Bersama-sama dengan timin dan sitosin, mereka membentuk heliks DNA. Pelajar perubatan tidak suka menjejalkan diri untuk kursus biokimia :). Seperti yang anda tahu, DNA terdiri daripada dua rantai. Bertentangan dengan adenin sentiasa timin, dan bertentangan dengan guanin ialah sitosin. Kedua-dua helai DNA melekat bersama seperti dua bahagian zip. Jumlah bahan ini meningkat dengan kerosakan tisu aktif, seperti yang berlaku, contohnya, semasa proses kanser
Mari kita berkenalan: adenine dan guanin. Ini adalah asas purin. Bersama-sama dengan timin dan sitosin, mereka membentuk heliks DNA. Pelajar perubatan tidak suka menjejalkan diri untuk kursus biokimia :). Seperti yang anda tahu, DNA terdiri daripada dua rantai. Bertentangan dengan adenin sentiasa timin, dan bertentangan dengan guanin ialah sitosin. Kedua-dua helai DNA melekat bersama seperti dua bahagian zip. Jumlah bahan ini meningkat dengan kerosakan tisu aktif, seperti yang berlaku, contohnya, semasa proses kanser
Melalui satu siri tindak balas kimia berturut-turut, purin ditukar kepada asid urik.

Metabolisme asid urik pada manusia dan primata
Saya bercadang untuk membuat rajah itu semudah mungkin untuk difahami. Biar pelajar perubatan tahun 2 mengajar :). Tetapi dia meninggalkan nama enzim. Perkara yang paling penting ialah enzim xanthine oksidase
. Ia adalah aktivitinya yang berkurangan semasa rawatan allopurinol(lebih tepat lagi, keberkesanan, kerana allopurinol bersaing dengannya untuk reseptor), yang mengurangkan sintesis asid urik.
Jarang sekali, penyakit kongenital berlaku, disertai dengan gangguan genetik dalam sintesis xanthine oxidase, di mana tahap asid urik berkurangan. Dalam kes ini, xanthine dan hypoxanthine terkumpul. Xanthinuria. Nampak bagus, kurang asid urik. Walau bagaimanapun, ternyata asid urik bukan sahaja berbahaya, tetapi juga bermanfaat...
Perbualan tentang bahaya dan kebaikan asid urik harus bermula dari jauh. Kemudian, 17 juta tahun dahulu, semasa era Miosen, nenek moyang kita mengalami mutasi dalam gen yang menghasilkan enzim uricase. Dan kami mendapat versi "memotong" metabolisme purin.
 Dalam mamalia lain, uricase menukarkan asid urik kepada allantoin, yang larut dan mudah dikeluarkan dari badan. Dan haiwan ini tidak pernah mengalami gout. Mungkin ada andaian bahawa mutasi ini tidak masuk akal. Tetapi evolusi tidak mengecualikan gen ini: mutasi ternyata perlu.
Dalam mamalia lain, uricase menukarkan asid urik kepada allantoin, yang larut dan mudah dikeluarkan dari badan. Dan haiwan ini tidak pernah mengalami gout. Mungkin ada andaian bahawa mutasi ini tidak masuk akal. Tetapi evolusi tidak mengecualikan gen ini: mutasi ternyata perlu.
Penyelidikan moden telah menunjukkan bahawa asid urik adalah hasil sampingan daripada pecahan fruktosa dalam hati dan pengumpulan garam asid urik menyumbang kepada penukaran fruktosa yang cekap kepada lemak. Oleh itu, gen untuk "berjimat cermat" telah ditetapkan dalam genom nenek moyang kita. Kemudian gen itu diperlukan untuk mencipta rizab untuk tempoh lapar. Telah terbukti bahawa ketidakaktifan terakhir uricase bertepatan dengan penyejukan global iklim Bumi. Ia adalah perlu untuk "memakan" sebanyak mungkin rizab lemak subkutan untuk tempoh sejuk dan menukar fruktosa yang terkandung dalam buah-buahan kepada rizab lemak. Beberapa eksperimen kini sedang dijalankan dengan pengenalan enzim uricase ke dalam sel hati. Ada kemungkinan bahawa pada masa akan datang, ubat untuk rawatan gout akan muncul berdasarkan enzim uricase. Jadi kecenderungan kita untuk menjadi gemuk adalah dalam gen kita. Malangnya bagi ramai lelaki dan wanita yang mengalami obesiti. Tetapi masalahnya bukan hanya genetik. Sifat pemakanan manusia moden telah berubah.
Mengenai kemudaratan dan faedah asid urik, serta tentang pemakanan untuk hiperurisemia
Adalah diketahui bahawa paras asid urik yang berterusan boleh meningkatkan risiko beberapa penyakit dengan ketara. Walau bagaimanapun, telah terbukti bahawa peningkatan berkala dalam paras asid urik boleh memberi kesan yang baik. Dari segi sejarah, akses kepada makanan daging (sumber utama purin) adalah tidak teratur. Makanan utama: pelbagai akar, buah pokok. Nah, jika pemburu primitif membawa mangsa, maka ia adalah percutian. Oleh itu, makan produk daging secara berkala adalah cara hidup yang biasa. Ada mangsa - kita makan sepuas-puasnya. Tiada mangsa - kita makan makanan tumbuhan. Kini telah ditetapkan bahawa peningkatan jangka pendek dan berkala dalam paras asid urik mempunyai kesan yang baik terhadap perkembangan dan fungsi sistem saraf. Mungkin itulah sebabnya otak mula berkembang?
Bagaimanakah asid urik ini disingkirkan daripada badan?
Dua cara: buah pinggang dan hati
Laluan utama adalah perkumuhan melalui buah pinggang - 75%
25 peratus dikumuhkan oleh hati menggunakan hempedu. Asid urik yang masuk ke dalam lumen usus dimusnahkan (berkat bakteria kita dalam usus).
Asid urik memasuki buah pinggang dalam bentuk garam natrium. Dengan asidosis (pengasidan air kencing), mikrolit boleh terbentuk dalam pelvis buah pinggang. "Pasir" dan "batu" yang sama. Dengan cara ini, alkohol sangat mengurangkan perkumuhan urat dalam air kencing. Inilah sebabnya ia membawa kepada serangan gout.
Jadi, apakah kesimpulan yang perlu dibuat? Kaedah untuk mengurangkan asid urik
1. Cuba jadikan 1-2 hari seminggu sebagai vegetarian semata-mata
2. Jumlah purin terbesar terdapat dalam tisu asal haiwan. Lebih-lebih lagi, dalam sel haiwan dengan metabolisme aktif: hati, buah pinggang - kebanyakannya.
3. Anda harus makan kurang makanan berlemak, kerana lemak tepu yang berlebihan menekan keupayaan tubuh untuk memproses asid urik.
4. Kurangkan makan fruktosa. Asid urik adalah hasil metabolisme fruktosa. Sebelum ini, pesakit diabetes disyorkan untuk menggantikan glukosa dengan fruktosa. Sesungguhnya, fruktosa tidak memerlukan penyertaan insulin untuk penyerapannya. Tetapi fruktosa lebih sukar untuk dihadam. Perhatian: dalam gula, molekul sukrosa adalah disakarida - glukosa + fruktosa. Jadi kita kurangkan makan gula.
5. Elakkan minum alkohol, terutamanya bir. Wain dalam kuantiti yang kecil tidak menjejaskan tahap asid urik.
6. Senaman yang sangat sengit meningkatkan paras asid urik.
7. Anda perlu minum banyak air. Ini akan membolehkan anda mengeluarkan asid urik dengan berkesan.
Jika anda mempunyai asid urik yang tinggi
Nah, pertama sekali, mujurlah, ini tidak selalu menjadi patologi: kenaikan jangka pendek mungkin merupakan variasi norma
Sekiranya masih terdapat masalah, anda perlu memikirkan pada tahap mana terdapat pelanggaran (skim pertama itu): gangguan dalam sintesis purin (sindrom metabolik yang sama), faktor pemakanan (kita makan banyak daging, minum bir), fungsi buah pinggang terjejas (asid perkumuhan kencing terjejas) atau penyakit bersamaan yang disertai dengan pemusnahan tisu.
Semoga berjaya kepada anda dan doktor yang berwibawa.
Jika anda mendapati kesilapan menaip dalam teks, sila beritahu saya. Pilih sekeping teks dan klik Ctrl+Enter.
Sebatian nitrogen termasuk protein, peptida, asid amino dan derivatifnya, asid nukleik, nukleotida dan terbitannya, serta derivatif nitrogen gula. Sebahagian besar nitrogen tetap diambil kira oleh protein, jadi metabolisme nitrogen sering dikenal pasti dengan metabolisme protein. Walaupun asid amino yang terbentuk semasa pecahan protein boleh digunakan semula untuk biosintesis protein (secara purata 5 kali ganda), bekalan asid amino yang berterusan dalam makanan adalah perlu untuk kehidupan normal. Akibat daripada pengambilan produk protein yang tidak mencukupi digambarkan oleh kwashiorkor, penyakit kanak-kanak akibat kekurangan nutrisi protein apabila keperluan untuk karbohidrat dan lipid biasanya dipenuhi (Rajah 8-1).
nasi. 8-1. Lingkaran ganas kwashiorkor
Secara amnya diterima bahawa keperluan harian minimum orang dewasa untuk protein adalah kira-kira 100 g Keperluan ini meningkat dengan pertumbuhan intensif, pemulihan daripada penyakit, kehamilan, dan penyusuan. Imbangan nitrogen (iaitu nisbah nitrogen yang digunakan untuk dikumuhkan) adalah penunjuk penting keadaan badan dan, khususnya, proses pertumbuhan.
Jangka hayat protein dalam badan berbeza dari puluhan minit hingga beberapa bulan, purata 3 minggu. Tempoh ini boleh dikurangkan oleh faktor yang merangsang katabolisme, seperti glukokortikoid atau sitokin proinflamasi.
PENCERNAAN PROTEIN
Pepsin perut. Pepsin proteinase gastrik utama (keluarga proteinase aspartat, berdasarkan kehadiran dua residu asid aspartik di pusat aktif) terbentuk di bawah pengaruh persekitaran berasid rongga perut dari dua prekursor - pepsinogen I dan II (atau A dan C), dirembeskan oleh sel-sel utama perut. Pengambilan makanan merangsang pembebasan pepsinogen daripada butiran rembesan dengan peningkatan selari dalam sintesis de novo. Kesan merangsang pada rembesan pepsinogen pelbagai faktor saraf dan humoral direalisasikan terutamanya dengan meningkatkan tahap cAMP (secretin, vasoactive intestinal peptide (VIP), catecholamines) atau intraselular Ca 2+ (cholecystokinin - CCK, gastrin, gastrin-releasing). peptida - GRP, bombesin, asetilkolin). Somatostatin menyekat rembesan. Kesan ulserogenik yang diketahui dari dos farmakologi glukokortikoid mungkin sebahagiannya disebabkan oleh kesan rangsangannya pada ekspresi gen pepsinogen C, di kawasan kawal selia yang GKSE berfungsi ditemui. Tahap basal glukokortikoid diperlukan untuk tahap normal ekspresi pepsinogen.
Proteinase pankreas. Produk peptida pencernaan oleh pepsin yang memasuki usus dari perut dihidrolisiskan lagi oleh beberapa proteinase yang terbentuk dalam lumen duodenum daripada prekursor tidak aktif (zymogen) yang datang dari pankreas. Lata pengaktifan dimulakan oleh enteropeptidase (atau enterokinase), yang dinyatakan dalam enterosit dan sel goblet duodenum. Enzim ini mengeluarkan serpihan perencatan daripada polipeptida trypsinogen (3 isoform). Trypsin (keluarga proteinase serin) yang terhasil seterusnya memangkinkan autoaktivasi dan pengaktifan chymotrypsinogen (keluarga proteinase serine) dan procarboxypeptidase (2 isoform). Sintesis dan rembesan zymogen dalam pankreas dirangsang secara adaptif oleh makanan protein, mungkin
khususnya dengan penyertaan cholecystokinin. Kesan rangsangan asetilkolin, insulin, secretin, bombesin pada rembesan zymogen juga telah ditunjukkan. Adalah dipercayai bahawa salah satu sebab untuk perkembangan pankreatitis mungkin adalah pengaktifan zymogen intraselular (iaitu pramatang).
PENGANGKUTAN OLIGOPEPTIDA DAN ASID AMINO
Oligopeptida. Bahagian utama produk pencernaan protein dalam perut dan usus diwakili oleh di- dan tripeptida. Oligopeptida ini diserap oleh sel-sel membran mukus usus kecil, di mana ia dihidrolisiskan kepada asid amino di bawah tindakan peptidases. Pengangkutan oligopeptida merentasi membran apikal sel usus adalah bergantung kepada tenaga dan ditentukan oleh kotransporter H+-peptida, PepT1.
Pengangkut ini adalah protein glikosilasi yang mengandungi 12 domain transmembran. Ia dicirikan oleh kekhususan substrat yang rendah (mampu mengangkut 400 dipeptida berbeza, 8000 tripeptida, sejumlah ubat yang meniru struktur di- dan tripeptida, contohnya, antibiotik β-laktam) dan pertalian rendah untuk substrat. Tenaga untuk pengangkutan disediakan oleh kerja Na + ,K + -ATPase, disetempat pada permukaan basolateral sel. Penurunan kepekatan Na+ dalam sel berfungsi sebagai daya penggerak untuk berfungsinya penukar Na + /H + yang disetempat pada permukaan apikal sel, yang mengeluarkan proton daripada sel ke dalam lumen usus. Proton ini kemudiannya dikembalikan ke sel bersama-sama dengan oligopeptida melalui kotransporter H + -peptide PepT1 (Rajah 8-2).
Aktiviti kotransporter H + -peptida PepT1 dikawal oleh substrat pada tahap transkrip, tetapi data mengenai arah peraturan ini adalah bercanggah. Walaupun kesan rangsangan dipeptida pada tahap PepT1 boleh dihasilkan semula dalam vitro pada kultur sel usus, ada kemungkinan bahawa dalam vivo kesan substrat boleh dimediasi oleh kesan rangsangannya pada hormon gastrousus seperti peptida seperti glukagon.
 Insulin merangsang aktiviti PepT1, tetapi ini berlaku pada tahap pasca translasi, dengan meningkatkan kemasukan PepT1 ke dalam membran plasma. Leptin, yang boleh mencapai sel-sel usus baik melalui peredaran sistemik dan melalui lumen nasi. 8-2.
Insulin merangsang aktiviti PepT1, tetapi ini berlaku pada tahap pasca translasi, dengan meningkatkan kemasukan PepT1 ke dalam membran plasma. Leptin, yang boleh mencapai sel-sel usus baik melalui peredaran sistemik dan melalui lumen nasi. 8-2.
Pengangkutan oligopeptida ke dalam sel mukosa usus
usus selepas rembesan oleh perut, meningkatkan ekspresi PepT1 pada tahap transkrip, dan mengurangkan hormon tiroid.
Buah pinggang, paru-paru, otak, dan beberapa organ dan tisu lain mengekspresikan pengangkut oligopeptida yang berkaitan dengan PepT1, PepT2. Prinsip operasi pengangkut ini adalah serupa dengan PepT1.
PepT2 boleh menggunakan di-, tri- dan tetrapeptida sebagai substrat, sebaik-baiknya dipeptida. Perkaitannya dengan substrat jauh lebih tinggi daripada PepT1. Dalam buah pinggang, PepT2 disetempatkan ke permukaan apikal sel tubular renal, di mana ia mengantara penyerapan semula oligopeptida daripada air kencing. Kecuali untuk kesan perencatan hormon tiroid dan faktor pertumbuhan epidermis pada ekspresi PepT2, peraturan hormon pengangkut ini secara praktikal tidak dikaji. Dwilapisan lipid membran plasma sel tidak telap kepada asid amino. Untuk penyerapan asid amino dalam usus, penyerapan semula daripada air kencing, pengambilan semula pada sinaps, dilepaskan ke dalam aliran darah, dan kemasukan ke dalam sel pengguna, pelbagai jenis pengangkut asid amino digunakan, yang dibahagikan kepada dua kumpulan utama: bebas dan bergantung kepada Na +. Pengangkut asid amino mempamerkan kekhususan yang sangat tinggi untuk kumpulan substrat tertentu.
Amina biogenik, hormon tiroid, dan beberapa ubat juga boleh berfungsi sebagai substrat untuk pengangkut asid amino. Sebilangan besar pengangkut yang bergantung kepada Na+ menjalankan pengangkutan asid amino yang bergantung kepada tenaga merentasi membran plasma, manakala pengangkut bebas Na+ menyediakan penyebaran substrat yang dipermudahkan. Satu contoh kumpulan pertama pengangkut ialah pengangkut asid amino bergandingan proton, PAT1, yang diekspresikan terutamanya pada permukaan apikal sel mukosa usus. Prinsip operasi pengangkut ini adalah serupa dengan pengangkut oligopeptida PepT1, yang diterangkan di atas. Peraturan aktiviti PAT1 boleh dijalankan, khususnya, melalui fosforilasi penukar Na + /H + atau protein yang mengawalnya. Pengangkut SN1 juga memindahkan asid amino akibat pertukaran Na+/H+, tetapi pertukaran ini dijalankan oleh pengangkut itu sendiri dan berlaku dalam arah yang bertentangan dengan yang diterangkan untuk pengangkut PAT1, ditambah dengan penukar Na+/H+ (Rajah 8). -3). Pengangkut SN1, khususnya, memastikan kemasukan glutamin ke dalam hepatosit periportal untuk sintesis urea dan, sebaliknya, eksport glutamin oleh hepatosit pericentral ke dalam aliran darah dan seterusnya ke dalam buah pinggang. Dalam tubul proksimal buah pinggang, ekspresi pengangkut ini secara adaptif meningkat semasa asidosis kronik (fungsi ammoniagenesis untuk perkumuhan proton, lihat di bawah), dan peningkatan ini dipromosikan oleh glucocorticoids. Satu lagi varian pengangkutan asid amino yang bergantung kepada Na + boleh diperhatikan dalam kes pengangkut ATA1, yang menjalankan pengangkutan bersama asid amino dan Na + . Dalam kes ini, proton bertindak sebagai pengawal selia alosterik pengangkut (lihat Rajah 8-3).
Contoh sistem pengangkutan asid amino melalui penyebaran terfasilitasi ialah sistem L Pengangkut kumpulan ini dibina daripada dua subunit: ringan dan berat, dihubungkan oleh ikatan disulfida. Subunit ringan, seperti LAT1, merentangi membran plasma 12 kali. Subunit terglikosilasi berat, seperti 4F2hc, mengandungi hanya satu domain transmembran (Rajah 8-4). Kumpulan pengangkut ini terutamanya memastikan pertukaran antara asid amino yang disetempat di dalam sel dan dalam persekitaran ekstraselular. Kepentingan sistem pengangkutan ini nampaknya adalah untuk memastikan pergerakan transmembran asid amino, yang merupakan substrat yang lemah untuk pengangkut yang bergantung kepada Na +. Oleh itu, pengangkut dimerik rbAT/ disetempat pada permukaan apikal sel-sel tubul proksimal buah pinggang.
 nasi. 8-3. Varian pengangkut asid amino bergantung Na+ (a.a.): a- pengangkut SN1 menjalankan pengangkutan bersama Na+ dan asid amino sebagai pertukaran untuk proton (proton diperlukan untuk orientasi semula SN1 dalam membran). SN1 mengantara import glutamin ke dalam hepatosit periportal daripada aliran darah dan eksport glutamin yang disintesis daripada hepatosit pericentral;
nasi. 8-3. Varian pengangkut asid amino bergantung Na+ (a.a.): a- pengangkut SN1 menjalankan pengangkutan bersama Na+ dan asid amino sebagai pertukaran untuk proton (proton diperlukan untuk orientasi semula SN1 dalam membran). SN1 mengantara import glutamin ke dalam hepatosit periportal daripada aliran darah dan eksport glutamin yang disintesis daripada hepatosit pericentral;
b- pengangkut elektrogenik ATA1 bertindak serupa dengan SN1, tetapi tidak memindahkan proton
 nasi. 8-4. Pengangkut asid amino:
nasi. 8-4. Pengangkut asid amino:
A- pengangkut asid amino dimerik b 0+ dibina daripada rantai berat rbAT (nada ringan) dan rantai ringan b 0+ +AT (nada gelap), yang dihubungkan oleh ikatan disulfida. Dilokalkan pada permukaan apikal sel-sel buah pinggang, usus kecil, dan otak;
b- pengangkut b 0+ menjalankan pertukaran bebas Na+ bagi asid amino neutral dan dibasik dan, bersama-sama dengan pengangkut berkaitan LAT2-4F2hc, dengan kerjasama pengangkut yang bergantung kepada Na+, memastikan penyerapan semula sistin, arginin, lisin, ornithine . Kekurangan transporter disertai dengan cystinuria
b 0,.+ AT memastikan penyerapan semula sistin daripada air kencing primer, yang kemudiannya ditukar kepada sistein dalam sel, yang kemudiannya dirembeskan ke dalam darah melalui membran basolateral sel melalui pengangkut dimerik kedua - 4F2/LAT2. Kerja bertenaga sistem penyerapan semula ini dipastikan oleh pengangkutan asid amino yang bergantung kepada Na+ yang ditukar dengan sistin dan sistein, masing-masing. Kesan rangsangan glukokortikoid pada ekspresi pengangkut jenis ini dalam buah pinggang telah ditunjukkan.
METABOLISME ASID AMINO
Asid amino adalah, dalam satu tangan, bahan binaan untuk biosintesis protein dan sebatian lain yang mengandungi nitrogen, dan di sisi lain, sumber tenaga. Bergantung kepada sama ada asid amino tertentu boleh disintesis dalam badan, asid amino tidak penting dan penting dibezakan.
Untuk biosintesis protein, syarat yang diperlukan adalah untuk mengekalkan keseimbangan antara asid amino dalam sel, sepadan dengan kandungannya dalam protein. Keseimbangan ini sebahagian besarnya dikekalkan disebabkan oleh pertukaran asid amino. Interkonversi termasuk dua jenis tindak balas: transaminasi dan deaminasi oksidatif/aminasi reduktif. Tindak balas yang sama ini digunakan untuk merendahkan asid amino semasa glukoneogenesis.
Tindak balas transaminasi boleh balik, i.e. pemindahan kumpulan amino dari satu substrat ke substrat yang lain dimangkinkan oleh aminotransferases. Satu substrat ialah asid amino X, dengan nama yang dipanggil aminotransferase yang sepadan, atau asid α-keto X yang sepadan." Substrat kedua diwakili oleh pasangan α-ketoglutarat/glutamat. Bergantung pada nisbah kepekatan substrat, tindak balas akan ditujukan kepada pembentukan sama ada asid amino X atau glutamat Apabila pengumpulan glutamat, yang kedua boleh menjadi penderma kumpulan amino untuk asid α-keto Y" dengan pembentukan asid amino Y dalam. tindak balas yang dimangkinkan oleh aminotransferase yang sepadan. Pariti antara asid amino lain boleh dicapai dengan cara yang sama.
Asid amino berlebihan boleh disingkirkan melalui deaminasi oksidatif glutamat di bawah tindakan glutamat dehidrogenase. Tindak balas terbalik aminasi reduktif, sebaliknya, boleh meningkatkan kumpulan asid amino dalam sel
(Rajah 8-5). Rantaian tindak balas yang ditunjukkan dalam rajah juga digunakan dalam proses glukoneogenesis: contohnya, degradasi protein otot yang dirangsang oleh glukokortikoid semasa tekanan disertai dengan kemasukan alanin ke dalam darah, yang diangkut ke hati melalui piruvat.
 nasi. 8-5. Interkonversi asid amino.
nasi. 8-5. Interkonversi asid amino.
Aminotransferases memindahkan kumpulan amino kepada α-ketoglutarat. Glutamat yang terhasil mengalami deaminasi oksidatif. Tindak balas terbalik memastikan sintesis asid amino.
dihantar ke sintesis glukosa. Glukoneogenesis yang disebabkan oleh glukokortikoid juga difasilitasi oleh keupayaan hormon ini yang diketahui untuk merangsang transkripsi gen untuk beberapa aminotransferases.
PERTUKARAN AMMONIA
Glutamin adalah sumber tenaga yang penting, terutamanya untuk sel-sel usus dan sistem imun, pelopor untuk glukoneogenesis, dan pengangkut ammonia. Ia adalah asid amino utama dalam darah. Metabolisme glutamin dijalankan dengan penyertaan enzim sitosolik glutamin sintase dan dua isozim glutaminase mitokondria (Rajah 8-6).
Aktiviti glutaminase hepatik meningkat semasa berpuasa, kencing manis dan kandungan protein yang tinggi dalam makanan. Kesemua keadaan ini dicirikan oleh peningkatan katabolisme asid amino yang memasuki hati, bertujuan sebahagiannya untuk meningkatkan glukoneogenesis dan mengeluarkan nitrogen berlebihan melalui kitaran urea.
 Peningkatan aktiviti enzim berlaku, khususnya, di bawah pengaruh glukagon nasi. 8-6.
Peningkatan aktiviti enzim berlaku, khususnya, di bawah pengaruh glukagon nasi. 8-6.
Interkonversi glutamat dan glutamin
disebabkan oleh induksi transkripsi gen melalui elemen cAMP-responsif (CRE) dan glukokortikoid melalui GKCE (Rajah 8-7).
Dalam asidosis metabolik kronik, aktiviti glutaminase buah pinggang meningkat. Tugas utama enzim ini ialah menghasilkan ammonia untuk mengikat proton dan mengeluarkannya dalam air kencing. Kesannya direalisasikan pada peringkat pasca transkrip kerana penstabilan mRNA enzim. Mekanisme ini melibatkan interaksi unsur responsif pH (pHRE) bagi kawasan 3"-tidak diterjemahkan mRNA (yang merupakan ulangan 8 asas langsung yang diperkaya dalam adenosin dan uridin) dengan zeta-kristalin (lihat Rajah 8-7) .
Di bawah tekanan, aktiviti glutamin sintase dalam otot dan paru-paru meningkat. Kesannya direalisasikan pada peringkat transkripsi. Sebagai contoh, dalam paru-paru, mRNA enzim meningkat 10 kali ganda. Glukokortikoid bertindak ke atas ekspresi enzim melalui GKSE kanonik dalam intron pertama dan tapak separuh ke-3 GKSE di kawasan pengawalseliaan jauh gen.
Di bawah tekanan kronik, aktiviti glutamat dehidrogenase dalam buah pinggang meningkat, menukar glutamat kepada α-ketoglutarat dengan pembebasan ammonia. Pengawalseliaan dijalankan pada peringkat pasca transkripsi dengan menstabilkan mRNA enzim kerana pengikatan empat pHRE yang terletak di rantau 3"-tidak diterjemahkan kepada zethacrystallin, iaitu, serupa dengan peraturan glutaminase buah pinggang.
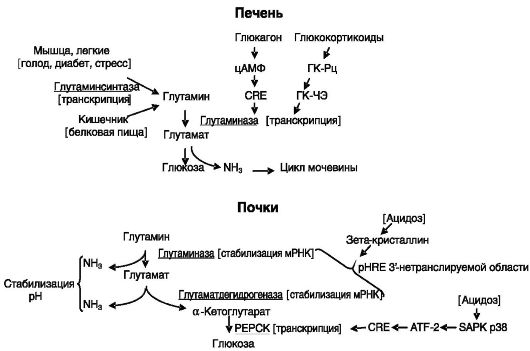 Penggunaan α-ketoglutarat yang terbentuk semasa asidosis dalam buah pinggang berlaku melalui induksi enzim glukoneogenesis. Induksi salah satu daripada mereka, phosphoenolpyruvate carboxykinase (PEPCK), berlaku pada tahap transkrip: penurunan dalam nasi. 8-7.
Penggunaan α-ketoglutarat yang terbentuk semasa asidosis dalam buah pinggang berlaku melalui induksi enzim glukoneogenesis. Induksi salah satu daripada mereka, phosphoenolpyruvate carboxykinase (PEPCK), berlaku pada tahap transkrip: penurunan dalam nasi. 8-7.
pH selular disertai dengan pengaktifan protein kinase p38 yang diaktifkan tekanan (SAPK p38), yang memfosforilasi faktor transkripsi ATF-2, yang berinteraksi dengan elemen responsif cAMP (CRE) gen PEPCK, yang merangsang transkripsi.
KITARAN UREA
Pembentukan urea yang bergantung kepada tenaga dalam hati dalam mamalia adalah laluan utama untuk penggunaan ammonia yang terbentuk daripada asid amino dan sebatian lain yang mengandungi nitrogen. Sintesis urea melibatkan pembentukan karbamoil fosfat daripada karbon dioksida dan ammonia, yang, berinteraksi dengan ornitin, menghasilkan citrulline. Dengan penyertaan kumpulan amino aspartat melalui pembentukan sebatian perantaraan, asid argininosuccinic, arginin disintesis, hidrolisis yang menghasilkan urea dan ornithine asal (Rajah 8-8).
Sintesis karbamoil fosfat boleh dimangkinkan oleh dua enzim: mitokondria carbamoyl fosfat sintase I, ciri hati dan sebahagian usus, dan protein CAD yang dinyatakan secara meluas (carbamoyl phosphate synthase II), yang mempunyai aktiviti sintase karbamoil fosfat.
 nasi. 8-8. Kitaran urea
nasi. 8-8. Kitaran urea
bamoylphosphate synthase, aspartate transcarbamylase dan dihydroorotase, yang memangkinkan 3 daripada 6 tindak balas biosintesis pirimidin.
Pemindahan kumpulan carbamoyl kepada ornithine dimangkin oleh ornithine carbamoyltransferase. Enzim mitokondria diekspresikan terutamanya dalam hati dan mukosa usus. Kekurangan enzim adalah salah satu punca hiperammonemia, disertai dengan muntah, lesu, sawan dan kadang-kadang kematian.
Kekurangan argininosuccinate synthase, enzim yang memangkinkan interaksi citrulline dan aspartate, membawa kepada citrullinemia, disertai dengan serangan muntah dan terencat akal. Pembentukan arginin daripada asid argininosuccinic dimangkinkan oleh liase argininosuccinate. Kekurangan enzim menyebabkan arginine succinicesiduria, disertai dengan keterlambatan dalam perkembangan mental dan fizikal, hati yang diperbesar, kerosakan pada integumen, dan kehilangan kesedaran berkala.
Pembentukan urea daripada arginin dimangkinkan oleh arginase. Enzim diwakili oleh dua isozim (I dan II). Arginase I sitosolik (homotrimer) diekspresikan terutamanya dalam hati, di mana ia menjadi pengantara pembentukan urea. Kekurangan arginase hepatik menyebabkan argininemia, disertai dengan perkembangan tertunda fungsi psikomotor, lumpuh spastik empat anggota badan.
tey.
Ekspresi arginase I, serta mitokondria arginase II (homohexamer) dalam organ dan tisu lain boleh memberikan aspek lain metabolisme sebatian nitrogen (menyediakan ornitin untuk biosintesis glutamat, glutamin, GABA, agmatin, poliamina, kreatin, prolin , TIDAK). Khususnya, arginase mungkin bersaing dengan NO sintase untuk arginin sebagai substrat dan dengan itu mengambil bahagian dalam peraturan proses yang dikawal oleh NO dan cGMP (contohnya, ereksi).
 Enzim kitaran urea dirangsang oleh hormon katabolik (glukokortikoid, glukagon) pada tahap transkripsi. Induksi boleh secara langsung atau tidak langsung melalui rangsangan biosintesis faktor transkripsi C/EBP (Rajah 8-9). nasi. 8-9.
Enzim kitaran urea dirangsang oleh hormon katabolik (glukokortikoid, glukagon) pada tahap transkripsi. Induksi boleh secara langsung atau tidak langsung melalui rangsangan biosintesis faktor transkripsi C/EBP (Rajah 8-9). nasi. 8-9.
Penambah jauh memberikan rangsangan transkripsi gen sintase karbamoil fosfat oleh glukokortikoid dan glukagon (a). Penambah gen arginase-1 memberikan rangsangan oleh glukagon dan (secara tidak langsung, melalui induksi C/EBP) glukokortikoid (b):
C/EBP, CCAAT/enhancer mengikat protein; HNF3 - faktor nuklear hepatosit 3; GRU - unit penderiaan glukokortikoid Adibi S.A.
Peraturan ekspresi pengangkut oligopeptida usus (Pept-1) dalam kesihatan dan penyakit. Am J Physiol Gastrointest Hati Fisiol. 2003;285(5):G779-788. Curthoys N.P., Gstraunthaler G.
Mekanisme peningkatan ekspresi gen buah pinggang semasa asidosis metabolik. Am J Physiol Fisiol Renal. 2001;281(3):F381-390. Desvergne B., Michalik L., Wahli W.
Peraturan transkrip metabolisme. Physiol Rev. 2006;86(2):465-514. Wagner C.A., Lang F., Broer S.
Fungsi dan struktur pengangkut asid amino heterodimerik. Am J Physiol Cell Physiol. 2001;281(4):C1077-1093. Wu G., Jaeger L.A., Bazer F.W., Rhoads J.M.
Kekurangan arginin pada bayi pramatang: mekanisme biokimia dan implikasi pemakanan. J Nutr Biochem. 2004;15(8):442-451.
Bentuk perkumuhan nitrogen protein - dalam bentuk ammonia, urea atau asid urik - berkait rapat dengan keadaan hidup warna dan ketersediaan air (Jadual 10.4). Ammonia adalah sangat toksik walaupun dalam kepekatan yang sangat kecil, jadi ia mesti cepat
Dalam kebanyakan invertebrata akuatik, hasil akhir metabolisme protein ialah ammonia. Oleh kerana keterlarutannya yang mudah dan berat molekul yang rendah, ia meresap dengan sangat cepat. Sebahagian besar daripadanya boleh dikumuhkan melalui mana-mana permukaan yang bersentuhan dengan air, tidak semestinya melalui buah pinggang. Dalam ikan bertulang, kebanyakan nitrogen dikumuhkan dalam bentuk ammonia melalui insang. Dalam ikan mas dan ikan mas, insang merembeskan 6-10 kali lebih banyak nitrogen daripada buah pinggang, dan hanya 10% daripadanya adalah urea; baki 90% dikumuhkan sebagai ammonia (Smith, 1929).
UREA
Urea mudah larut dalam air dan mempunyai ketoksikan yang agak rendah. Sintesis urea dalam haiwan yang lebih tinggi telah dikaji oleh ahli biokimia terkenal Hans Krebs - saintis yang sama yang selepasnya kitaran metabolisme tenaga oksidatif (kitaran asid trikarboksilik, atau kitaran Krebs) dinamakan.
Dalam sintesis urea, ammonia dan karbon dioksida terpeluwap dengan fosfat untuk membentuk karbamoil fosfat, yang kemudiannya digunakan untuk mensintesis sitrulin daripada ornithine, seperti yang ditunjukkan dalam Rajah. 10.13. Selepas ini, satu lagi molekul ammonia ditambah daripada asid aspartik, dan ini membawa kepada pembentukan arginin asid amino. Dengan kehadiran enzim arginase, arginin terurai menjadi urea dan ornithine. Molekul citrulline baru disintesis daripada ornithine, dan keseluruhan kitaran berulang; oleh itu keseluruhan jalan transformasi ini dipanggil kitaran ornithine sintesis urea. Kehadiran arginase dalam haiwan menunjukkan keupayaannya untuk menghasilkan urea dan selalunya menunjukkan bahawa urea adalah perkumuhan nitrogen utamanya. Tetapi ini tidak semestinya berlaku, kerana mungkin arginase hadir walaupun tanpa ketiadaan keseluruhan kitaran.
UREA DALAM VERTEBRATE
Vertebrata yang merembeskan terutamanya urea dan mempunyai enzim kitaran ornithine untuk sintesisnya ditunjukkan dalam Rajah. 10.14. Sebilangan besar urea dirembes oleh ikan bertulang, dan dalam elasmobranch, amfibia dan mamalia ia adalah perkumuhan nitrogen utama. Dalam elasmobranch (jerung dan pari), serta dalam katak pemakan ketam dan coelacanth Latimeria urea dikekalkan dalam badan dan bermain
peranan penting dalam pengawalan diri dan oleh itu merupakan produk metabolik yang berharga. Dalam elasmobranchs, urea ditapis dalam glomerulus, tetapi kerana kepentingannya untuk osmoregulasi, ia tidak boleh hilang dalam air kencing; oleh itu, ia dikembalikan sebagai hasil daripada penyerapan semula aktif dalam tubulus. Dalam amfibia keadaannya berbeza.

Urea ditapis, dan, sebagai tambahan, sejumlah besar ia ditambah kepada air kencing melalui rembesan aktif dalam tubulus. Oleh itu, kedua-dua elasmobranch dan amfibia mempunyai pengangkutan urea tiub aktif, tetapi ia pergi ke arah yang berbeza dalam kumpulan ini. Jelas sekali, mekanisme pengepaman di sini tidak sama secara metabolik, kerana eksperimen dengan beberapa derivatif urea yang berdekatan antara satu sama lain memberikan hasil yang berbeza dalam kedua-dua kumpulan haiwan (Jadual 10.5). Ini adalah contoh terbaik bagaimana fungsi fisiologi yang sama berlaku secara bebas dalam dua kumpulan, tanpa semestinya menggunakan mekanisme yang sama untuk mencapai matlamat yang sama (dalam kes ini, pengangkutan urea aktif).
Dalam katak pemakan ketam, yang juga mengekalkan urea untuk osmoregulasi, penyerapan semula aktif bahan ini dalam tubulus
tidak dijumpai (Schmidt-Nielsen, Lee, 1962). Air kencingnya terbentuk perlahan-lahan, dan tubul renal sangat telap kepada urea. Oleh itu, urea meresap keluar daripada cecair tiub

nasi. 10.14. Pembebasan nitrogen pada pelbagai peringkat filogenesis vertebrata. Garisan" dikelilingi oleh kumpulan haiwan yang masing-masing merembeskan ammonia, urea dan asid urik sebagai najis utama. (B. Schmidt-Nielsen, 3972.)
kembali ke dalam darah dan muncul dalam air kencing dalam kepekatan yang lebih kurang sama seperti dalam darah. Oleh itu, hanya sejumlah kecil yang hilang dalam air kencing.
Jika dalam katak biasa rembesan tiub aktif urea berlaku, maka mengapa katak pemakan ketam tidak menggunakan
Jadual 10.5
Urea diangkut secara aktif oleh tubul renal ikan yu (penyerapan semula aktif) dan katak (rembesan aktif). Tetapi dengan tiga bahan lain yang berkaitan, hasil yang diperoleh dalam kedua-dua spesies haiwan ini adalah berbeza sama sekali. Ini menunjukkan bahawa mekanisme pengangkutan selular dalam buah pinggang mereka adalah berbeza. (B. Schmidt-Nielsen, Rabinovitz, 1964)

pam sedemikian, hanya dengan menukar arahnya ke arah yang bertentangan? Soalan ini tidak mudah untuk dijawab, tetapi nampaknya arah pengangkutan aktif adalah fungsi fisiologi konservatif yang tidak boleh diubah dengan mudah. Seperti yang telah kita lihat, baik di kulit katak dan di buah pinggang mamalia, arah pengangkutan aktif natrium klorida dari luar ke dalam badan dipelihara. Tetapi dalam buah pinggang mamalia, pengangkutan terbalik masuk NaCl dari cecair tiub ke dalam badan digunakan dalam sistem arus balas yang mendarab sedemikian rupa sehingga hasil akhirnya adalah air kencing yang pekat.
Pandangan biasa tentang perkumuhan urea oleh buah pinggang mamalia ialah urea ditapis di dalam glomerulus dan kemudian secara pasif melalui tubulus, walaupun sebahagian daripadanya, disebabkan keresapannya yang tinggi, secara pasif meresap kembali ke dalam darah. Terdapat, bagaimanapun; bukti yang meyakinkan bahawa urea berfungsi sebagai elemen penting dalam sistem arus balas yang mendarab dan bahawa cara perkumuhan urea adalah elemen penting dalam fungsi buah pinggang dalam mamalia.
UREA DAN METAMORFOSIS DALAM AMFIBIAN
Berudu katak dan kodok menghasilkan terutamanya ammonia; haiwan dewasa mengeluarkan urea. Di rumah katak (Rana temporaria), kodok (Bufo bufo) triton (Triturus uulgaris) dan amfibia lain semasa metamorfosis terdapat peralihan yang jelas daripada pembebasan ammonia kepada perkumuhan urea. Walau bagaimanapun, katak cakar Afrika Selatan (Xenopus), yang kekal di dalam air walaupun dalam keadaan dewasa, terus membebaskan ammonia pada peringkat ini (Jadual 10.6).
Peralihan kepada perkumuhan urea semasa metamorfosis dalam amfibia separa darat adalah berkaitan; dengan peningkatan ketara dalam aktiviti semua enzim kitaran ornithine dalam hati (Brown et al., 1959).
Jadual 10.6
Pengeluaran ammonia dalam katak darat Bufo bufo dan dalam amfibia tanpa ekor akuatik sepenuhnya Xenopus laevis. Angka tersebut menunjukkan pembebasan ammonia bebas sebagai peratusan daripada jumlah ammonia dan urea yang dibebaskan pada peringkat pembangunan yang berbeza. (Munro, 1953)

Menariknya, individu amfibia akuatik Xenopus, diekstrak: selama beberapa minggu dari air, urea terkumpul dalam darah dan tisu. Pengumpulan urea boleh didorong dengan meletakkan haiwan dalam larutan NaCl 0.9%. Apabila orang dewasa dijauhkan dari air, tetapi dalam lumut lembap (untuk mengelakkan dehidrasi), kepekatan urea dalam darah meningkat 10-.20 kali dan mencapai hampir 100 mmol/l. Selepas haiwan kembali ke dalam air, lebihan urea dikeluarkan (Balinsky et al, 1961).
Dalam sekumpulan individu Xenopus, yang dalam keadaan semula jadi mengalami kemarau musim panas dalam kelodak berhampiran kolam kering, kepekatan urea juga meningkat sebanyak 15-20 kali ganda. Antara enzim yang terlibat dalam sintesis urea, jumlah sintetase karbamoilfosfat, yang bertanggungjawab untuk peringkat pertama sintesis (lihat Rajah 10.13), meningkat kira-kira enam kali ganda, tetapi aktiviti enzim yang tinggal dalam kitaran tidak berubah. Ada kemungkinan bahawa sintesis carbamoyl fosfat adalah langkah mengehadkan kadar dalam sintesis urea, dan peningkatan dalam enzim ini berkemungkinan mengekalkan ammonia plasma rendah apabila haiwan kehabisan air (Balinsky et al., 1967).
Urea dalam lungfishes
Dalam lungfish Afrika Protopterus Perubahan yang sama berlaku seperti dalam amfibia. Dalam keadaan biasa, apabila ikan seperti itu hidup di dalam air, ia membebaskan banyak ammonia
(dan sejumlah urea), tetapi apabila semasa kemarau ia berada dalam kepompong dalam kelodak kering, maka semua sisa nitrogennya ditukar menjadi urea, yang terkumpul di dalam darah, di mana kepekatannya pada penghujung tiga- tahun tinggal dalam kepompong boleh mencapai 3% ( 500 mmol/l) (Smith, 1959).
Kesemua lima enzim kitaran ornithine ditemui dalam hati lungfish Afrika (Janssens dan Cohen, 1966). Tahap dua enzim yang mengehadkan kadar sintesis urea adalah serupa dalam ikan ini dan dalam berudu katak Rana catsbeia dan jauh lebih rendah daripada paras yang terdapat pada katak dewasa. Ini konsisten dengan fakta bahawa lungfish lebih suka melepaskan ammonia apabila ia berada di dalam air. Walau bagaimanapun, adalah dikira bahawa jumlah enzim kitaran ornithine yang terkandung dalam hati lungfish yang tidak berhibernasi adalah mencukupi untuk memastikan pengumpulan urea benar-benar diperhatikan semasa hibernasi (Forster dan Goldstein, 1966).
Dalam lungfish Australia Neoceratodus kepekatan enzim kitaran ornithine adalah rendah, yang konsisten dengan gaya hidup ikan ini: ia menggunakan paru-paru hanya sebagai organ pernafasan tambahan dan hanya boleh bertahan untuk masa yang singkat di udara (untuk pernafasan lungfishes, lihat Bab 2). Sintesis urea dalam bahagian hati lungfish Australia adalah seratus kali lebih perlahan daripada lungfish Afrika. Ini sekali lagi konsisten dengan gaya hidup akuatik semata-mata mereka yang pertama (Goldstein et al., 1967).
ASID URIK
Pengeluaran asid urik mendominasi dalam serangga, siput darat, kebanyakan reptilia, dan burung. Semua ini biasanya haiwan darat, dan pembentukan asid urik di dalamnya boleh dianggap sebagai penyesuaian berkesan yang menjimatkan air apabila hidup di darat. Oleh kerana asid urik dan garamnya sangat sukar larut dalam air (keterlarutannya adalah kira-kira 6 mg setiap 1 liter air), penyerapan semula air daripada air kencing membawa kepada pemendakan asid urik dan garamnya.
ASID URIC DALAM BURUNG DAN SERANGGA
Bahagian putih separuh pepejal najis burung ialah air kencing dan terdiri terutamanya daripada asid urik; Untuk mengeluarkan najis bernitrogen, burung menghabiskan sangat sedikit air dalam sesetengah serangga, pengurangan kehilangan air melalui air kencing telah berlaku sehingga mereka tidak mengeluarkan asid urik sama sekali, tetapi menyimpannya di bahagian badan yang berlainan, terutamanya dalam
badan gemuk. Oleh itu, bentuk sedemikian tidak memerlukan air sama sekali untuk mengeluarkan produk nitrogen akhir (Kilby, 1963).
Telah dicadangkan bahawa penggunaan asid urik sebagai najis utama memberi kelebihan lain kepada burung. Kerana mereka memerlukan sedikit air untuk menghasilkan air kencing, rembesan asid urik dianggap mengurangkan berat badan burung terbang. Tetapi idea ini tidak meyakinkan, kerana burung yang mempunyai akses kepada air (air tawar dan laut) sering mengeluarkan air kencing cecair dalam kuantiti yang banyak.
TELUR CLEIDOIC
Joseph Needham mencadangkan bahawa perbezaan antara vertebrata yang menghasilkan urea (mamalia dan amfibia) dan yang menghasilkan asid urik (reptilia dan burung) adalah terutamanya disebabkan oleh cara pembiakan. Telur amfibia berkembang di dalam air, manakala embrio mamalia berkembang dalam persekitaran cecair dalam rahim, di mana bahan buangan metabolik memasuki darah ibu. Sebaliknya, perkembangan embrio reptilia dan burung berlaku secara tertutup, yang dipanggil Cleidic telur yang menukar hanya gas dengan persekitaran luaran, dan semua najis kekal di dalam cangkerang. Bekalan air dalam telur cleidic adalah sangat kecil, dan ammonia, sudah tentu, terlalu toksik untuk embrio untuk bertolak ansur dengan kehadirannya dalam kuantiti yang banyak. Jika urea dihasilkan, ia akan kekal di dalam telur dan terkumpul dalam keadaan terlarut. Sementara itu, asid urik boleh memendakan dan dengan itu pada dasarnya dihapuskan; inilah yang berlaku apabila ia disimpan sebagai kristal dalam allantois, yang dengan itu berfungsi sebagai pundi kencing embrio.
ASID URIK DALAM REPTILIA
Cicak dan ular mengeluarkan terutamanya asid urik; banyak penyu mengeluarkan campuran asid urik dan urea, manakala buaya mengeluarkan terutamanya ammonia (Cragg et al., 1961). Ini konsisten dengan idea umum bahawa cara perkumuhan nitrogen berkait rapat dengan jumlah air yang ada di alam sekitar.
Buaya dan buaya mengeluarkan ammonia dalam air kencingnya, di mana kation utama ialah NH4+ dan anion utama ialah HCO 3 - (Coulson et al., 1950; Goulson dan Hernandez, 1955). Ada kemungkinan kehadiran ion ini dalam air kencing membantu air tawar ini
Adalah lebih baik bagi haiwan untuk mengekalkan ion Na + dan C1 -, yang kehilangannya dalam najis, dengan cara itu, juga sangat kecil.
Hampir tidak ada keraguan tentang hubungan rapat antara habitat penyu dan pembebasan nitrogen mereka. Dalam jadual Rajah 10.7 menunjukkan komposisi sampel air kencing daripada lapan spesies penyu yang diperoleh dari Zoo London. Spesies dengan gaya hidup akuatik yang paling ketara menghasilkan sejumlah besar ammonia dan urea dan hanya kesan asid urik; dalam kebanyakan bentuk kediaman darat, lebih separuh daripada nitrogen dikumuhkan dalam bentuk asid urik.
Jadual 10.7
Kadar nitrogen dalam air kencing pelbagai penyu (sebagai peratusan jumlah nitrogen yang dikumuhkan). Bentuk yang paling dikaitkan dengan air menghasilkan hampir tiada asid urik, tetapi bahan ini dominan dalam spesies daratan dari kawasan gersang. Moyle, 1949 )

Terdapat maklumat yang bercanggah tentang sama ada penyu terutamanya mengeluarkan urea atau asid urik. Hakikatnya bukan sahaja spesies berbeza, tetapi juga dalam satu spesies sesetengah individu boleh merembeskan kebanyakannya asid urik, yang lain - kebanyakannya urea, dan yang lain - campuran kedua-dua bahan (Khalil, Haggag, 1955). Malah individu yang sama boleh berpindah dari satu sambungan ke sambungan yang lain dari semasa ke semasa. Beberapa
jumlah asid urik yang dimendakkan dikekalkan dalam kloaka, dan bahagian cecair air kencing dikumuhkan; ini menjadikannya tidak boleh dipercayai untuk menentukan asid urik yang terhasil dengan menganalisis satu atau lebih sampel air kencing: jika kloaka tidak dikosongkan sepenuhnya, bilangan yang sangat rendah boleh diperolehi, dan dengan pemindahan sedemikian, apabila sedimen yang terkumpul selama beberapa lama keluar. , akan ada terlalu banyak asid urik.
Pada penyu Testudo mauritanica peralihan daripada urea kepada asid urik dan belakang nampaknya bergantung secara langsung kepada suhu dan kandungan air dalam badan. Pengeluaran asid urik meningkat apabila keseimbangan cecair tidak menggalakkan, tetapi mekanisme yang mendorong peralihan dalam aktiviti biokimia ini tidak jelas.
Kami telah menyebut dalam Bab 9 bahawa katak Afrika Chiromantis xerampelina kehilangan air melalui kulit dengan sangat perlahan, pada kadar yang sama seperti reptilia. Ia adalah serupa dengan reptilia kerana ia merembeskan terutamanya asid urik, dan bukan urea, seperti yang biasanya menjadi ciri amfibia dewasa. Ini adalah fakta sensasi, kerana ia bercanggah dengan idea yang diterima umum tentang perkumuhan nitrogen dalam amfibia. Ketepatan laporan ini tidak diragui, kerana asid urik ditentukan dalam air kencing Chiromantis dengan kaedah enzimatik khusus untuk bahan ini, dan didapati ia membentuk sehingga 60-75% daripada berat kering air kencing (Loveridge, 1970).
Katak Afrika Selatan Phyllotnedusa sauvagii dalam hal ini ia juga serupa dengan reptilia. Kehilangan air melalui kulit adalah sama dengan magnitud reptilia dengan integumen keringnya, dan air kencing mengandungi sejumlah besar sedimen urat separa pepejal (Shoemaker et al., 1972). Dalam bentuk urat Phyllomedusa 80% daripada jumlah nitrogen dibebaskan, dan peningkatan penggunaan air tidak mengubah keamatan pembentukan urat. Spesies ini terus mengeluarkan terutamanya asid urik walaupun terdapat lebihan air. Apabila katak perlu memulihara air, perkumuhan asid urik (bukan urea) menjadi sangat penting. Dikira bahawa jika hasil perkumuhan katak ini adalah urea, maka untuk membentuk air kencing ia memerlukan kira-kira 60 ml air sehari setiap 1 kg berat badan. Sementara itu, terima kasih kepada fakta bahawa P. sauvagii merembeskan asid urik, ia kehilangan hanya 3.8 ml air sehari setiap 1 kg berat badan dalam air kencing (Shoemaker, McClanahan, 1975).
AMMONIA DAN FUNGSI RENAL
Daripada semua yang telah dinyatakan di atas, nampaknya ammonia dipancarkan terutamanya oleh haiwan akuatik, tetapi ini tidak sepenuhnya benar. Ammonia juga biasanya terdapat dalam air kencing haiwan darat, di mana ia berfungsi untuk mengawal pH air kencing. Jika air kencing menjadi berasid akibat pembebasan bahan buangan berasid, ammonia ditambah untuk meneutralkannya.
Asid berlebihan biasanya terbentuk semasa metabolisme protein, kerana hasil akhir pengoksidaan sistein asid amino yang mengandungi sulfur ialah asid sulfurik. Lebih berasid air kencing, lebih banyak ammonia ditambah. Ammonia, digunakan untuk meneutralkan air kencing berasid, terbentuk di buah pinggang daripada glutamin asid amino. Buah pinggang mengandungi glutaminase, dan ia ada khusus untuk menghasilkan ammonia. Oleh itu, ammonia dalam air kencing mamalia tidak berkaitan secara langsung dengan ammonia yang terbentuk dalam hati semasa deaminasi asid amino, dan dalam pengertian ini ia tidak boleh dianggap sebagai produk akhir normal metabolisme protein.
ASID NUKLEIK DAN PELEPASAN NITROGEN
Asid nukleik mengandungi dua kumpulan sebatian nitrogen: purin (adenine dan guanina) dan pirimidin (sitosin dan timin). Dalam sesetengah haiwan, purin dikumuhkan sebagai asid urik (yang merupakan purin); dalam haiwan lain, struktur purin dipecahkan kepada satu siri sebatian perantaraan atau menjadi ammonia, mana-mana daripadanya boleh dikeluarkan dari badan.
Pecahan metabolik purin dan pembebasan produk akhirnya belum dikaji secara menyeluruh seperti metabolisme protein 13ot. Data yang paling penting diberikan dalam jadual. 10.8. Pada burung, reptilia darat dan serangga, purin dipecahkan kepada asid urik dan yang terakhir dikeluarkan dari badan. Ini adalah haiwan di mana asid urik disintesis daripada nitrogen amina; Jelas sekali, tidak ada gunanya haiwan mensintesis asid urik dan pada masa yang sama mempunyai mekanisme untuk penguraiannya. Oleh itu, seseorang tidak boleh menjangkakan lagi pecahan purin dalam haiwan di mana asid urik adalah produk akhir metabolisme protein.
Antara mamalia, manusia, beruk besar dan Great Dane membentuk kumpulan istimewa: mereka merembeskan asid urik, manakala mamalia lain merembeskan allantoin. Allantoin terbentuk daripada asid urik melalui satu transformasi dengan kehadiran enzim urikase. Manusia dan beruk besar tidak mempunyai enzim ini. Oleh kerana keterlarutannya yang rendah, asid urik kadang-kadang disimpan di dalam tubuh manusia, menyebabkan pembengkakan sendi dan penyakit yang sangat menyakitkan -
Jadual 10.8
Produk akhir nitrogen metabolisme purin dalam haiwan yang berbeza. (Keilin, 1959)

gout Sekiranya manusia mengekalkan enzim uricase, gout tidak akan wujud.
Walaupun Anjing Dalmatian menghasilkan lebih banyak asid urik berbanding anjing lain, ini bukan disebabkan oleh beberapa jenis kecacatan metabolik. Hati setiap anjing mengandungi uricase dan menghasilkan beberapa allantoin. Tetapi Great Dane mempunyai kecacatan buah pinggang yang menghalang penyerapan semula tiub asid urik (yang berlaku pada mamalia lain, termasuk manusia); oleh itu, di Great Dane, asid urik hilang dalam air kencing lebih cepat daripada diproses oleh hati menjadi allantoin (Yu et al., I960). Banyak bukti menunjukkan bahawa asid urik dalam Dalmatian Dane bukan sahaja ditapis dalam glomerulus, tetapi juga dikumuhkan melalui pengangkutan aktif dalam tubulus (Keilin, 1959).
Purin adenine dan guanin mempunyai struktur yang serupa dengan asid urik: ia mengandungi satu cincin enam anggota dan satu cincin lima anggota. Tetapi pirimidin (sitosin dan timin) adalah cincin enam anggota tunggal yang mengandungi dua atom nitrogen. Dalam vertebrata yang lebih tinggi, pirimidin dibelah dengan memecahkan cincin ini untuk menghasilkan satu molekul ammonia dan satu molekul asid β-amino. Yang terakhir kemudiannya dimetabolismekan mengikut skema deaminasi biasa.
Ciri metabolisme asid nukleik yang paling menarik ialah haiwan "lebih tinggi" yang disenaraikan di permulaan jadual. 10.8, sama sekali tidak mempunyai enzim yang diperlukan untuk pemecahan
purin. Di antara haiwan "rendah" kita dapati kerumitan sistem biokimia dan enzimatik yang semakin meningkat yang menguraikan lagi purin, supaya bentuk "terendah" mempunyai radas enzimatik yang paling lengkap.
SEBATIAN NITROGEN LAIN
Dalam labah-labah, perkumuhan utama adalah guanin Nampaknya, ia disintesis daripada nitrogen amina, walaupun keseluruhan laluan pembentukannya tidak diketahui. Sesetengah labah-labah, termasuk tarantula pemakan burung, mengeluarkan lebih daripada 90% daripada jumlah nitrogen mereka dalam bentuk guanin selepas makan (Peschen, 1939). Dalam labah-labah taman biasa Epeira diadema pengenalpastian guanin telah disahkan oleh kaedah enzimatik yang sangat spesifik (Vajropala, 1935).
Guanin juga agak biasa dalam pelbagai haiwan lain. Sebagai contoh, kilauan keperakan sisik ikan adalah disebabkan oleh pemendapan kristal guanin. siput taman Helix membebaskan guanin, tetapi hanya setakat kira-kira 20% daripada jumlah purin yang dikumuhkan, dan baki 80% adalah asid urik. Ada kemungkinan bahawa pecahan ini adalah hasil metabolisme asid nukleik, dan asid urik terbentuk sebagai hasil metabolisme protein.
Asid amino tidak menduduki tempat penting di kalangan produk metabolisme nitrogen, tetapi ia didapati dalam kuantiti yang kecil dalam air kencing banyak haiwan. Nampaknya lebih menguntungkan haiwan itu untuk menyahcemarkan asid amino, mengeluarkan ammonia dengan cara biasa dan menggunakan asid organik yang terhasil dalam metabolisme tenaga. Tetapi kerana asid amino hanya memainkan peranan kecil dalam perkumuhan nitrogen, isu ini tidak akan dibincangkan di sini.
TEORI RECAPTULASI
Secara amnya dipercayai bahawa perkumuhan nitrogen dalam embrio anak ayam yang sedang berkembang berubah-ubah mengikut masa dan melalui beberapa siri puncak: pertama produk utama adalah ammonia, kemudian urea dan akhirnya asid urik. Diandaikan bahawa perkembangan sedemikian reka bentuk semula peringkat evolusi, yang pada burung berakhir dengan pembebasan asid urik. Pengeluaran ammonia dalam embrio anak ayam telah dilaporkan memuncak pada 4 hari, urea pada 9 hari, dan asid urik pada 11 hari selepas permulaan inkubasi (Baldwin, 1949).
Kerja yang lebih baru menunjukkan bahawa perkumuhan nitrogen dalam embrio anak ayam berbeza dengan ketara daripada gambar yang diterangkan sebelum ini (Clark dan Fischer, 1957). Ketiga-tiga produk perkumuhan utama - ammonia, urea dan asid urik - terbentuk dan hadir dari awal perkembangan embrio. Menjelang akhir
Tempoh inkubasi untuk asid urik menjadi lebih lama daripada dua produk lain. Walau bagaimanapun, jumlah urea dan ammonia terus meningkat sepanjang pengeraman, dan pada masa penetasan kedua-dua bahan hadir dalam kuantiti yang lebih kurang sama. Menjelang akhir pengeraman, jumlah nitrogen yang dibebaskan mencapai 40 mg, di mana 23% dibahagikan sama rata antara urea dan ammonia, dan selebihnya adalah asid urik (Rajah 10.15).

Apakah punca percanggahan keputusan yang diperolehi? Data sebelumnya mungkin kurang tepat kerana kaedah analisis yang lebih primitif, tetapi ini tidak mungkin menjelaskan puncak individu yang diperhatikan. Sebab utamanya ialah keputusan dinyatakan dalam kuantiti setiap produk perkumuhan per unit berat embrio. Dan kerana embrio berterusan dan semakin jauh, semakin cepat ia membesar,
kemudian membahagikan jumlah setiap bahan dengan berat embrio menghasilkan puncak buatan.
Malah, ketiga-tiga produk perkumuhan hadir dari awal dan secara beransur-ansur meningkat dalam bilangan sepanjang perkembangan embrio, tetapi selepas hari ke-10 pengeraman jumlah ammonia meningkat sedikit. Urea yang dihasilkan oleh embrio tidak disintesis daripada nitrogen asid amino dalam kitaran ornithine, tetapi hasil daripada tindakan arginase pada arginin (Eakin dan Fisher, 1958). Oleh itu, pembentukan ammonia mahupun sintesis urea dalam embrio anak ayam tidak menyokong idea bahawa ontogeni mekanisme biokimia mengulangi sejarah evolusi perkumuhan nitrogen.
Kami memeriksa pelbagai organ perkumuhan dan menerangkan ciri umum mereka. Organ-organ ini mengeluarkan sisa metabolik, membantu mengekalkan kepekatan garam dan bahan terlarut lain yang betul, dan mengawal kandungan air badan, menjimatkan air dengan berhati-hati apabila badan rendah dan mengeluarkan jumlah berlebihan.
Walau bagaimanapun, bukti yang meyakinkan menunjukkan bahawa ini tidak selalunya benar Sesetengah penyiasat (cth, Costa et al., 1968, 1974) telah melaporkan pembentukan gas nitrogen dalam mamalia yang diberi sejumlah besar protein. Maklumat ini harus mengubah beberapa idea kami tentang metabolisme protein dan produk akhir bernitrogen.
Dalam bahasa Yunani kleisto bermaksud tertutup, daripada kleis bermaksud kunci.
Kedua-dua spesies katak yang diterangkan di sini tinggal di kawasan kering separa gurun. - Lebih kurang. ed.
 Hubungan antara manusia dan alam Hubungan antara manusia dan alam
Hubungan antara manusia dan alam Hubungan antara manusia dan alam Kata majmuk dengan vokal penghubung
Kata majmuk dengan vokal penghubung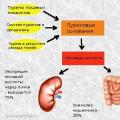 Asid urik dalam darah: norma dan penyelewengan, mengapa ia meningkat, diet untuk mengurangkannya Hasil akhir metabolisme nitrogen adalah
Asid urik dalam darah: norma dan penyelewengan, mengapa ia meningkat, diet untuk mengurangkannya Hasil akhir metabolisme nitrogen adalah