Jadual berkala mendeleev dalam talian. Apakah unsur kimia? Sistem dan ciri unsur kimia
Jadual berkala unsur kimia (jadual berkala)- klasifikasi unsur kimia, mewujudkan pergantungan pelbagai sifat unsur pada caj nukleus atom. Sistem ini adalah ekspresi grafik undang-undang berkala, yang ditubuhkan oleh ahli kimia Rusia D.I. Mendeleev pada tahun 1869. dia versi asal telah dibangunkan oleh D.I. Mendeleev pada 1869-1871 dan menubuhkan pergantungan sifat unsur pada berat atomnya (dalam istilah moden, pada jisim atom). Secara keseluruhan, beberapa ratus pilihan untuk menggambarkan jadual berkala (lengkung analitik, jadual, bentuk geometri dan sebagainya.). Dalam versi moden sistem, diandaikan bahawa elemen dibawa bersama ke dalam jadual dua dimensi, di mana setiap lajur (kumpulan) mentakrifkan fizikal Sifat kimia, dan garisan mewakili tempoh yang agak serupa antara satu sama lain.
Jadual berkala unsur kimia oleh D.I. Mendeleev
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Penemuan yang dibuat oleh ahli kimia Rusia Mendeleev memainkan (setakat ini) paling banyak peranan penting dalam perkembangan sains iaitu dalam perkembangan sains atom-molekul. Penemuan ini memungkinkan untuk mendapatkan idea yang paling mudah difahami dan mudah dipelajari tentang sebatian kimia yang ringkas dan kompleks. Hanya terima kasih kepada jadual yang kami mempunyai konsep tentang unsur-unsur yang kami gunakan dunia moden. Pada abad kedua puluh, peranan ramalan sistem berkala dalam menilai sifat kimia muncul, unsur transuranik, ditunjukkan oleh pencipta jadual.
Dibangunkan pada abad ke-19, jadual berkala Mendeleev untuk kepentingan sains kimia menyediakan sistematisasi siap sedia jenis-jenis atom untuk pembangunan FIZIK pada abad ke-20 (fizik atom dan nukleus atom). Pada awal abad kedua puluh, ahli fizik, melalui penyelidikan mereka mendapati bahawa nombor atom (juga dikenali sebagai nombor atom) juga merupakan ukuran cas elektrik nukleus atom unsur itu. Dan bilangan tempoh (iaitu, siri mendatar) menentukan bilangan kulit elektron atom. Ia juga ternyata bahawa bilangan baris menegak jadual menentukan struktur kuantum kulit luar unsur (oleh itu, unsur-unsur baris yang sama wajib mempunyai sifat kimia yang serupa).
Penemuan saintis Rusia menandakan era baru dalam sejarah sains dunia, penemuan ini bukan sahaja memungkinkan untuk membuat lonjakan besar dalam kimia, tetapi juga tidak ternilai untuk beberapa bidang sains yang lain. Jadual berkala menyediakan sistem maklumat yang koheren tentang unsur-unsur, berdasarkannya, ia menjadi mungkin untuk membuat kesimpulan saintifik, dan juga menjangkakan beberapa penemuan.
Jadual berkalaSalah satu ciri jadual berkala Mendeleev, ialah kumpulan (lajur dalam jadual) mempunyai ungkapan yang lebih ketara bagi arah aliran berkala daripada untuk tempoh atau blok. Pada masa kini, teori mekanik kuantum dan struktur atom menerangkan intipati kumpulan unsur-unsur dengan fakta bahawa mereka mempunyai konfigurasi elektronik yang sama bagi cengkerang valensi, dan sebagai hasilnya, unsur-unsur yang terletak dalam lajur yang sama mempunyai ciri-ciri konfigurasi elektronik yang hampir sama (sama), dengan yang serupa. ciri kimia. Terdapat juga kecenderungan yang jelas untuk perubahan sifat yang stabil apabila jisim atom bertambah. Perlu diingatkan bahawa dalam beberapa kawasan jadual berkala (contohnya, dalam blok D dan F), persamaan mendatar lebih ketara daripada yang menegak.
Jadual berkala mengandungi kumpulan yang diberi nombor siri dari 1 hingga 18 (dari kiri ke kanan), mengikut sistem antarabangsa menamakan kumpulan. DALAM masa dahulu, angka Rom digunakan untuk mengenal pasti kumpulan. Di Amerika, terdapat amalan meletakkan selepas angka Rom, huruf "A" apabila kumpulan itu terletak di blok S dan P, atau huruf "B" untuk kumpulan yang terletak di blok D. Pengecam yang digunakan pada masa itu ialah sama seperti yang terakhir bilangan indeks moden pada zaman kita (contohnya, nama IVB sepadan dengan unsur kumpulan 4 pada zaman kita, dan IVA ialah kumpulan unsur ke-14). DALAM negara Eropah Pada masa itu, sistem serupa digunakan, tetapi di sini, huruf "A" merujuk kepada kumpulan hingga 10, dan huruf "B" - selepas 10 termasuk. Tetapi kumpulan 8,9,10 mempunyai ID VIII, sebagai satu kumpulan tiga kali ganda. Nama kumpulan ini tidak lagi wujud selepas tahun 1988 sistem baru Notasi IUPAC, yang masih digunakan hari ini.
Banyak kumpulan menerima nama tidak sistematik yang bersifat herba (contohnya, "logam tanah beralkali", atau "halogen", dan nama lain yang serupa). Kumpulan 3 hingga 14 tidak menerima nama sedemikian, kerana fakta bahawa mereka kurang serupa antara satu sama lain dan kurang mematuhi corak menegak; mereka biasanya dipanggil sama ada dengan nombor atau dengan nama unsur pertama kumpulan (titanium , kobalt, dsb.).
Unsur kimia yang tergolong dalam kumpulan jadual berkala yang sama menunjukkan arah aliran tertentu dalam keelektronegatifan, jejari atom dan tenaga pengionan. Dalam satu kumpulan, dari atas ke bawah, jejari atom bertambah apabila ia terisi tahap tenaga, elektron valens unsur dikeluarkan daripada nukleus, manakala tenaga pengionan berkurangan dan ikatan dalam atom menjadi lemah, yang memudahkan penyingkiran elektron. Keelektronegatifan juga berkurangan, ini adalah akibat dari fakta bahawa jarak antara nukleus dan elektron valens meningkat. Tetapi terdapat juga pengecualian untuk corak ini, sebagai contoh, keelektronegatifan meningkat, bukannya menurun, dalam kumpulan 11, dalam arah dari atas ke bawah. Terdapat garis dalam jadual berkala yang dipanggil "Tempoh".
Di antara kumpulan, ada yang arah mendatar lebih ketara (tidak seperti kumpulan lain yang nilai yang lebih tinggi mempunyai arah menegak), kumpulan tersebut termasuk blok F, di mana lantanida dan aktinida membentuk dua jujukan mendatar yang penting.
Unsur menunjukkan corak tertentu dalam jejari atom, keelektronegatifan, tenaga pengionan dan tenaga pertalian elektron. Disebabkan fakta bahawa untuk setiap unsur berikutnya bilangan zarah bercas bertambah, dan elektron tertarik kepada nukleus, jejari atom berkurangan dari kiri ke kanan, bersama-sama dengan ini tenaga pengionan meningkat, dan apabila ikatan dalam atom meningkat, kesukaran untuk mengeluarkan elektron meningkat. Logam yang terletak di sebelah kiri jadual dicirikan oleh penunjuk tenaga pertalian elektron yang lebih rendah, dan oleh itu, di sebelah kanan penunjuk tenaga pertalian elektron lebih tinggi untuk bukan logam (tidak mengira gas mulia).
Kawasan yang berbeza dalam jadual berkala Mendeleev, bergantung pada cangkang atom mana elektron terakhir terletak, dan memandangkan kepentingannya kulit elektron, biasanya digambarkan sebagai blok.
Blok S termasuk dua kumpulan pertama unsur (logam alkali dan alkali tanah, hidrogen dan helium).
Blok P termasuk enam kumpulan terakhir, dari 13 hingga 18 (mengikut IUPAC, atau mengikut sistem yang diterima pakai di Amerika - dari IIIA hingga VIIIA), blok ini juga termasuk semua metaloid.
Blok - D, kumpulan 3 hingga 12 (IUPAC, atau IIIB hingga IIB dalam bahasa Amerika), blok ini termasuk semua logam peralihan.
Blok - F, biasanya diletakkan di luar jadual berkala, dan termasuk lantanida dan aktinida.
Eter dalam jadual berkala
Eter dunia adalah bahan SEGALANYA unsur kimia dan ini bermakna - SETIAP bahan adalah jirim benar Mutlak sebagai Esensi pembentuk unsur Sejagat.Eter dunia adalah sumber dan mahkota keseluruhan Jadual Berkala tulen, permulaan dan penghujungnya - alfa dan omega Jadual Berkala Unsur Dmitry Ivanovich Mendeleev.
Dalam falsafah kuno, eter (aithér-Greek), bersama dengan bumi, air, udara dan api, adalah salah satu daripada lima unsur makhluk (menurut Aristotle) - intipati kelima (quinta essentia - Latin), difahami sebagai perkara terbaik yang tersebar luas. DALAM lewat XIX abad, hipotesis eter sejagat (ME) yang memenuhi semua ruang kosmik telah diedarkan secara meluas dalam kalangan saintifik. Ia difahami sebagai cecair tanpa berat dan elastik yang meresap ke semua badan. Ramai yang telah cuba menjelaskan kewujudan eter fenomena fizikal dan harta benda.
Mukadimah.
Mendeleev mempunyai dua penemuan saintifik asas:
1 - Penemuan Hukum Berkala dalam bahan kimia,
2 - Penemuan hubungan antara bahan kimia dan bahan Eter, iaitu: zarah Eter membentuk molekul, nukleus, elektron, dll, tetapi tidak mengambil bahagian dalam tindak balas kimia.
Eter ialah zarah jirim ~ bersaiz 10-100 meter (sebenarnya, ia adalah "bata pertama" jirim).
Data. Eter berada dalam jadual berkala asal. Sel untuk Ether terletak di kumpulan sifar dengan gas lengai dan dalam baris sifar sebagai yang utama faktor pembentuk sistem untuk membina Sistem unsur kimia. Selepas kematian Mendeleev, jadual telah diputarbelitkan dengan mengeluarkan Eter daripadanya dan menghapuskan kumpulan sifar, dengan itu menyembunyikan penemuan asas kepentingan konseptual.
Dalam jadual Eter moden: 1 - tidak kelihatan, 2 - tidak dapat ditebak (kerana ketiadaan kumpulan sifar).
Pemalsuan yang bertujuan menghalang perkembangan kemajuan tamadun.
Bencana buatan manusia (contohnya Chernobyl dan Fukushima) akan dapat dielakkan jika sumber yang mencukupi telah dilaburkan tepat pada masanya dalam pembangunan jadual berkala yang tulen. Penyembunyian pengetahuan konseptual pergi ke peringkat global untuk "menurunkan" tamadun.
Hasilnya. Di sekolah dan universiti mereka mengajar jadual berkala terpotong.
Penilaian keadaan. Jadual berkala tanpa Eter adalah sama seperti manusia tanpa anak - anda boleh hidup, tetapi tidak akan ada perkembangan dan masa depan.
Ringkasan. Jika musuh manusia menyembunyikan ilmu, maka tugas kita ialah mendedahkan ilmu ini.
Kesimpulan. Jadual berkala lama mempunyai lebih sedikit unsur dan lebih berpandangan jauh daripada yang moden.
Kesimpulan. Tahap baru hanya mungkin apabila keadaan maklumat masyarakat berubah.
Pokoknya. Kembali kepada jadual berkala yang sebenar bukan lagi persoalan saintifik, tetapi persoalan politik.

Apa yang utama makna politik Ajaran Einstein? Ia adalah untuk memotong akses manusia kepada sumber yang tidak habis-habis dengan apa-apa cara yang mungkin. sumber semula jadi tenaga yang ditemui oleh kajian sifat-sifat eter dunia. Sekiranya berjaya di jalan ini, oligarki kewangan global akan kehilangan kuasa di dunia ini, terutamanya dalam cahaya retrospektif tahun-tahun itu: Rockefellers memperoleh kekayaan yang tidak dapat dibayangkan, melebihi bajet Amerika Syarikat, mengenai spekulasi minyak, dan kerugian. peranan minyak yang diduduki oleh "emas hitam" di dunia ini - peranan nadi ekonomi global - tidak memberi inspirasi kepada mereka.
Ini tidak memberi inspirasi kepada oligarki lain - raja arang batu dan keluli. Oleh itu, taikun kewangan Morgan serta-merta berhenti membiayai eksperimen Nikola Tesla apabila dia mendekati pemindahan tenaga tanpa wayar dan mengekstrak tenaga "entah dari mana" - daripada eter dunia. Selepas ini, pemiliknya jumlah yang besar tidak menyediakan penyelesaian teknikal yang dipraktikkan bantuan kewangan tiada siapa - solidariti hartawan kewangan adalah seperti pencuri dalam undang-undang dan hidung fenomenal untuk mana bahaya datang. Itulah sebabnya terhadap kemanusiaan dan sabotaj telah dilakukan yang dipanggil " Teori Khas Relativiti."
Salah satu pukulan pertama datang ke meja Dmitry Mendeleev, di mana eter adalah nombor pertama; ia adalah pemikiran tentang eter yang melahirkan wawasan cemerlang Mendeleev - jadual unsur berkalanya.

Bab daripada artikel: V.G. Rodionov. Tempat dan peranan eter dunia dalam jadual sebenar D.I. Mendeleev
6. Argumentum ad rem
Apa yang kini dibentangkan di sekolah dan universiti di bawah tajuk “Jadual Berkala Unsur Kimia D.I. Mendeleev,” adalah satu kepalsuan yang terang-terangan.
Kali terakhir dalam bentuk yang tidak diherotkan meja sebenar Mendeleev diterbitkan pada tahun 1906 di St. Petersburg (buku teks "Asas Kimia", edisi VIII). Dan hanya selepas 96 tahun dilupakan, Jadual Berkala asal bangkit buat kali pertama dari abu terima kasih kepada penerbitan disertasi dalam jurnal ZhRFM Persatuan Fizikal Rusia.
Selepas kematian mengejut D.I. Mendeleev dan kematian rakan-rakan saintifiknya yang setia dalam Persatuan Fiziko-Kimia Rusia, buat pertama kalinya dia mengangkat tangannya ke ciptaan abadi Mendeleev - anak kepada rakan dan rakan sekerja D.I. Mendeleev dalam Persatuan - Boris Nikolaevich Menshutkin. Sudah tentu, Menshutkin tidak bertindak sendirian - dia hanya melaksanakan perintah itu. Lagipun, paradigma baru relativisme memerlukan pengabaian idea eter dunia; dan oleh itu keperluan ini dinaikkan kepada pangkat dogma, dan karya D.I. Mendeleev telah dipalsukan.
Herotan utama Jadual ialah pemindahan "kumpulan sifar" Jadual ke hujungnya, ke kanan, dan pengenalan apa yang dipanggil. "tempoh". Kami menekankan bahawa manipulasi sedemikian (hanya pada pandangan pertama, tidak berbahaya) boleh dijelaskan secara logik hanya sebagai penghapusan sedar pautan metodologi utama dalam penemuan Mendeleev: sistem unsur berkala pada permulaannya, sumber, i.e. di sudut kiri atas Jadual, mesti mempunyai kumpulan sifar dan baris sifar, di mana unsur "X" terletak (menurut Mendeleev - "Newtonium"), - i.e. siaran dunia.
Selain itu, sebagai satu-satunya elemen pembentuk sistem bagi keseluruhan Jadual Unsur Terbitan, elemen "X" ini ialah hujah bagi keseluruhan Jadual Berkala. Pemindahan kumpulan sifar Jadual ke penghujungnya memusnahkan idea prinsip asas keseluruhan sistem unsur ini menurut Mendeleev.
Untuk mengesahkan perkara di atas, kami akan memberikan jawapan kepada D.I. Mendeleev sendiri.
“... Jika analog argon tidak memberikan sebatian sama sekali, maka adalah jelas bahawa adalah mustahil untuk memasukkan mana-mana kumpulan unsur yang diketahui sebelum ini, dan bagi mereka kumpulan sifar khas harus dibuka... Kedudukan ini analog argon dalam kumpulan sifar adalah akibat yang sangat logik untuk memahami undang-undang berkala, dan oleh itu (peletakan dalam kumpulan VIII jelas tidak betul) diterima bukan sahaja oleh saya, tetapi juga oleh Braizner, Piccini dan lain-lain... Sekarang, apabila ia telah menjadi di luar keraguan sedikit pun bahawa sebelum kumpulan I itu, di mana hidrogen harus diletakkan, terdapat kumpulan sifar, yang wakilnya mempunyai berat atom kurang daripada unsur-unsur kumpulan I, nampaknya saya mustahil untuk menafikan kewujudan itu. unsur yang lebih ringan daripada hidrogen.


Daripada jumlah ini, mari kita perhatikan dahulu elemen baris pertama kumpulan pertama. Kami menandakannya dengan "y". Ia jelas akan mempunyai sifat asas gas argon... "Coronium", dengan ketumpatan kira-kira 0.2 berbanding hidrogen; dan ia tidak boleh sama sekali menjadi eter dunia.
Elemen "y" ini, bagaimanapun, adalah perlu untuk mendekati secara mental dengan elemen yang paling penting, dan oleh itu elemen "x" yang paling cepat bergerak, yang, pada pemahaman saya, boleh dianggap sebagai eter. Saya ingin secara tentatif memanggilnya "Newtonium" - sebagai penghormatan kepada Newton yang abadi... Masalah graviti dan masalah semua tenaga (!!! - V. Rodionov) tidak dapat dibayangkan untuk benar-benar diselesaikan tanpa pemahaman sebenar eter sebagai medium dunia yang menghantar tenaga melalui jarak. Pemahaman sebenar tentang eter tidak boleh dicapai dengan mengabaikan kimianya dan tidak mempertimbangkannya unsur unsur; bahan asas kini tidak dapat difikirkan tanpa subordinatnya kepada undang-undang berkala” (“An Attempt at a Chemical Understanding of the World Ether.” 1905, hlm. 27).

"Unsur-unsur ini, mengikut magnitud berat atomnya, mengambil tempat yang tepat di antara halida dan logam alkali, seperti yang ditunjukkan oleh Ramsay pada tahun 1900. Daripada unsur-unsur ini adalah perlu untuk membentuk kumpulan sifar khas, yang pertama kali diiktiraf oleh Errere di Belgium pada tahun 1900. Saya menganggap ia berguna untuk menambah di sini bahawa, secara langsung menilai oleh ketidakupayaan untuk menggabungkan unsur-unsur kumpulan sifar, analog argon harus diletakkan sebelum unsur-unsur kumpulan 1 dan, dalam semangat sistem berkala, mengharapkan berat atom yang lebih rendah untuk mereka daripada untuk logam alkali.
Inilah sebenarnya yang berlaku. Dan jika ya, maka keadaan ini, di satu pihak, berfungsi sebagai pengesahan ketepatan prinsip berkala, dan sebaliknya, jelas menunjukkan hubungan analog argon dengan unsur lain yang diketahui sebelumnya. Hasilnya, adalah mungkin untuk menggunakan prinsip yang dianalisis dengan lebih meluas daripada sebelumnya, dan mengharapkan unsur-unsur siri sifar dengan berat atom jauh lebih rendah daripada hidrogen.
Oleh itu, boleh ditunjukkan bahawa dalam baris pertama, pertama sebelum hidrogen, terdapat unsur kumpulan sifar dengan berat atom 0.4 (mungkin ini koronium Yong), dan dalam baris sifar, dalam kumpulan sifar, terdapat ialah unsur pengehad dengan berat atom yang sangat kecil, tidak mampu interaksi kimia dan oleh itu mempunyai pergerakan separa (gas) yang sangat pantas.
Sifat-sifat ini, mungkin, harus dikaitkan dengan atom-atom eter dunia yang meluas (!!! - V. Rodionov). Saya menyatakan idea ini dalam kata pengantar kepada penerbitan ini dan dalam artikel jurnal Rusia 1902...” (“Asas Kimia.” VIII ed., 1906, hlm. 613 et seq.)
1 , , ,
Daripada komen:
Untuk kimia, jadual unsur berkala moden adalah mencukupi.
Peranan eter boleh berguna dalam tindak balas nuklear, tetapi ini tidak terlalu ketara.
Mengambil kira pengaruh eter adalah paling hampir dengan fenomena pereputan isotop. Walau bagaimanapun, perakaunan ini sangat kompleks dan kehadiran corak tidak diterima oleh semua saintis.
Bukti paling mudah kehadiran eter: Fenomena penghapusan pasangan positron-elektron dan kemunculan pasangan ini dari vakum, serta ketidakmungkinan menangkap elektron dalam keadaan rehat. Juga medan elektromagnet dan analogi lengkap antara foton dalam vakum dan bunyi ombak- fonon dalam kristal.
Eter ialah jirim terbeza, boleh dikatakan, atom dalam keadaan terurai, atau lebih tepat lagi, zarah asas, dari mana atom masa hadapan terbentuk. Oleh itu, ia tidak mempunyai tempat dalam jadual berkala, kerana logik membina sistem ini tidak membayangkan kemasukan struktur bukan kamiran, iaitu atom itu sendiri. Jika tidak, adalah mungkin untuk mencari tempat untuk kuark, di suatu tempat dalam tempoh tolak pertama.
Eter itu sendiri mempunyai struktur manifestasi pelbagai peringkat yang lebih kompleks dalam kewujudan dunia daripada yang diketahui mengenainya sains moden. Sebaik sahaja dia mendedahkan rahsia pertama eter yang sukar difahami ini, maka enjin baharu untuk semua jenis mesin akan dicipta berdasarkan prinsip baharu sepenuhnya.
Malah, Tesla mungkin satu-satunya yang hampir menyelesaikan misteri yang dipanggil eter, tetapi dia sengaja dihalang daripada merealisasikan rancangannya. Macam ni sampai hari ini Genius masih belum lahir yang akan meneruskan kerja pencipta yang hebat dan memberitahu kita semua apa sebenarnya eter misteri itu dan pada alas apa ia boleh diletakkan.
Jika anda mendapati jadual berkala sukar difahami, anda tidak bersendirian! Walaupun sukar untuk memahami prinsipnya, mengetahui cara menggunakannya akan membantu anda belajar Sains semula jadi. Mula-mula, kaji struktur jadual dan maklumat yang boleh anda pelajari daripadanya tentang setiap unsur kimia. Kemudian anda boleh mula mengkaji sifat setiap elemen. Dan akhirnya, menggunakan jadual berkala, anda boleh menentukan bilangan neutron dalam atom unsur kimia tertentu.
Langkah-langkah
Bahagian 1
Struktur jadual- Sebagai contoh, baris pertama jadual mengandungi hidrogen, yang mempunyai nombor atom 1, dan helium, yang mempunyai nombor atom 2. Walau bagaimanapun, ia terletak di tepi bertentangan kerana ia tergolong dalam kumpulan yang berbeza.
-
Ketahui tentang kumpulan yang mengandungi unsur dengan sifat fizikal dan kimia yang serupa. Elemen setiap kumpulan terletak dalam lajur menegak yang sepadan. Mereka biasanya dikenal pasti dengan warna yang sama, yang membantu mengenal pasti unsur-unsur dengan sifat fizikal dan kimia yang serupa dan meramalkan tingkah laku mereka. Semua elemen kumpulan tertentu mempunyai nombor yang sama elektron dalam kulit terluar.
- Hidrogen boleh dikelaskan sebagai logam alkali dan halogen. Dalam beberapa jadual ia ditunjukkan dalam kedua-dua kumpulan.
- Dalam kebanyakan kes, kumpulan diberi nombor dari 1 hingga 18, dan nombor diletakkan di bahagian atas atau bawah jadual. Nombor boleh dinyatakan dalam angka Rom (cth IA) atau Arab (cth 1A atau 1).
- Apabila bergerak di sepanjang lajur dari atas ke bawah, anda dikatakan "menyemak imbas kumpulan".
-
Ketahui mengapa terdapat sel kosong dalam jadual. Unsur disusun bukan sahaja mengikut nombor atomnya, tetapi juga mengikut kumpulan (unsur dalam kumpulan yang sama mempunyai sifat fizikal dan kimia yang serupa). Terima kasih kepada ini, lebih mudah untuk memahami bagaimana elemen tertentu berkelakuan. Walau bagaimanapun, apabila nombor atom bertambah, unsur-unsur yang jatuh ke dalam kumpulan yang sepadan tidak selalu dijumpai, jadi terdapat sel kosong dalam jadual.
- Sebagai contoh, 3 baris pertama mempunyai sel kosong kerana logam peralihan hanya ditemui daripada nombor atom 21.
- Unsur dengan nombor atom 57 hingga 102 dikelaskan sebagai unsur nadir bumi, dan biasanya diletakkan dalam subkumpulannya sendiri di sudut kanan bawah jadual.
-
Setiap baris jadual mewakili noktah. Semua unsur tempoh yang sama mempunyai nombor yang sama orbital atom, di mana elektron terletak dalam atom. Bilangan orbital sepadan dengan nombor tempoh. Jadual mengandungi 7 baris, iaitu 7 noktah.
- Contohnya, atom unsur periode pertama mempunyai satu orbital, dan atom unsur periode ketujuh mempunyai 7 orbital.
- Sebagai peraturan, noktah ditetapkan dengan nombor dari 1 hingga 7 di sebelah kiri jadual.
- Semasa anda bergerak mengikut garisan dari kiri ke kanan, anda dikatakan "mengimbas tempoh".
-
Belajar membezakan antara logam, metaloid dan bukan logam. Anda akan lebih memahami sifat sesuatu elemen jika anda boleh menentukan jenis elemen itu. Untuk kemudahan, dalam kebanyakan jadual logam, metaloid dan bukan logam ditetapkan warna yang berbeza. Logam berada di sebelah kiri dan bukan logam berada di sebelah kanan meja. Metaloid terletak di antara mereka.
Bahagian 2
Penamaan unsur-
Setiap elemen ditetapkan oleh satu atau dua huruf Latin. Sebagai peraturan, simbol elemen ditunjukkan dalam huruf besar di tengah-tengah sel yang sepadan. Simbol ialah nama yang dipendekkan untuk unsur yang sama dalam kebanyakan bahasa. Apabila menjalankan eksperimen dan bekerja dengan persamaan kimia simbol unsur biasa digunakan, jadi ia berguna untuk mengingatinya.
- Biasanya simbol elemen adalah singkatan untuk mereka nama latin, walaupun bagi sesetengah orang, terutamanya baru-baru ini elemen terbuka, mereka berasal daripada nama biasa. Sebagai contoh, helium diwakili oleh simbol He, yang hampir dengan nama biasa dalam kebanyakan bahasa. Pada masa yang sama, besi ditetapkan sebagai Fe, yang merupakan singkatan dari nama Latinnya.
-
Beri perhatian kepada nama penuh elemen jika ia diberikan dalam jadual. Elemen "nama" ini digunakan dalam teks biasa. Contohnya, "helium" dan "karbon" ialah nama unsur. Biasanya, walaupun tidak selalu, nama penuh unsur ditunjukkan di bawah simbol kimianya.
- Kadangkala jadual tidak menunjukkan nama unsur dan hanya memberikan simbol kimianya.
-
Cari nombor atom. Biasanya, nombor atom unsur terletak di bahagian atas sel yang sepadan, di tengah atau di sudut. Ia juga mungkin muncul di bawah simbol atau nama elemen. Unsur mempunyai nombor atom dari 1 hingga 118.
- Nombor atom sentiasa integer.
-
Ingat bahawa nombor atom sepadan dengan bilangan proton dalam atom. Semua atom unsur mengandungi bilangan proton yang sama. Tidak seperti elektron, bilangan proton dalam atom unsur kekal malar. Jika tidak, anda akan mendapat unsur kimia yang berbeza!
-
Jadual berkala, atau jadual berkala unsur kimia, bermula di sebelah kiri bucu atas dan berakhir pada penghujung baris terakhir jadual (sudut kanan bawah). Unsur-unsur dalam jadual disusun dari kiri ke kanan mengikut peningkatan tertib nombor atomnya. Nombor atom menunjukkan bilangan proton yang terkandung dalam satu atom. Selain itu, apabila nombor atom bertambah, jisim atom juga bertambah. Oleh itu, dengan lokasi unsur dalam jadual berkala, jisim atomnya boleh ditentukan.
Seperti yang anda boleh lihat, setiap unsur berikutnya mengandungi satu lagi proton daripada unsur yang mendahuluinya. Ini jelas jika anda lihat nombor atom. Nombor atom bertambah satu apabila anda bergerak dari kiri ke kanan. Oleh kerana elemen disusun dalam kumpulan, beberapa sel jadual dibiarkan kosong.
Terdapat banyak urutan berulang dalam alam semula jadi:
- musim;
- Masa dalam Hari;
- hari dalam seminggu…
Pada pertengahan abad ke-19, D.I. Mendeleev menyedari bahawa sifat kimia unsur juga mempunyai urutan tertentu (mereka mengatakan bahawa idea ini datang kepadanya dalam mimpi). Hasil daripada mimpi indah saintis itu ialah Jadual Berkala Unsur Kimia, di mana D.I. Mendeleev menyusun unsur kimia mengikut urutan peningkatan jisim atom. Dalam jadual moden, unsur kimia disusun mengikut tertib menaik bagi nombor atom unsur (bilangan proton dalam nukleus atom).
Nombor atom ditunjukkan di atas simbol unsur kimia, di bawah simbol adalah jisim atomnya (jumlah proton dan neutron). Sila ambil perhatian bahawa jisim atom bagi sesetengah unsur bukanlah nombor bulat! Ingat isotop! Jisim atom ialah purata wajaran semua isotop unsur yang terdapat di alam semula jadi dalam keadaan semula jadi.

Di bawah jadual adalah lantanida dan aktinida.
Logam, bukan logam, metaloid

Terletak dalam Jadual Berkala di sebelah kiri garis pepenjuru berperingkat yang bermula dengan Boron (B) dan berakhir dengan polonium (Po) (pengecualian adalah germanium (Ge) dan antimoni (Sb). Mudah untuk melihat bahawa logam menduduki paling Jadual berkala. Sifat asas logam: pepejal (kecuali merkuri); bersinar; konduktor elektrik dan haba yang baik; plastik; mudah dibentuk; melepaskan elektron dengan mudah.

Unsur-unsur yang terletak di sebelah kanan pepenjuru berlangkah B-Po dipanggil bukan logam. Sifat bukan logam adalah betul-betul bertentangan dengan sifat logam: pengalir haba dan elektrik yang lemah; rapuh; tidak boleh ditempa; bukan plastik; biasanya menerima elektron.
Metaloid
Antara logam dan bukan logam terdapat semilogam(logamloid). Mereka dicirikan oleh sifat-sifat kedua-dua logam dan bukan logam. Semilogam telah menemui aplikasi utamanya dalam industri dalam pengeluaran semikonduktor, tanpa litar mikro atau mikropemproses moden tunggal tidak dapat dibayangkan.
Tempoh dan kumpulan
Seperti yang dinyatakan di atas, jadual berkala terdiri daripada tujuh tempoh. Dalam setiap tempoh, nombor atom unsur meningkat dari kiri ke kanan.
Sifat unsur berubah secara berurutan dalam tempoh: dengan itu natrium (Na) dan magnesium (Mg), terletak pada permulaan tempoh ketiga, melepaskan elektron (Na memberikan satu elektron: 1s 2 2s 2 2p 6 3s 1 ; Mg memberikan naik dua elektron: 1s 2 2s 2 2p 6 3s 2). Tetapi klorin (Cl), yang terletak pada akhir tempoh, mengambil satu unsur: 1s 2 2s 2 2p 6 3s 2 3p 5.
Dalam kumpulan, sebaliknya, semua unsur mempunyai sifat yang sama. Sebagai contoh, dalam kumpulan IA(1), semua unsur daripada litium (Li) kepada fransium (Fr) menderma satu elektron. Dan semua elemen kumpulan VIIA(17) mengambil satu elemen.
Sesetengah kumpulan sangat penting sehingga mereka telah menerima nama istimewa. Kumpulan ini dibincangkan di bawah.
Kumpulan IA(1). Atom unsur kumpulan ini hanya mempunyai satu elektron dalam lapisan elektron luarnya, jadi mereka mudah melepaskan satu elektron.
Logam alkali yang paling penting ialah natrium (Na) dan kalium (K), kerana ia memainkan peranan penting dalam kehidupan manusia dan merupakan sebahagian daripada garam.
Konfigurasi elektronik:
- Li- 1s 2 2s 1 ;
- Na- 1s 2 2s 2 2p 6 3s 1 ;
- K- 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1
Kumpulan IIA(2). Atom unsur kumpulan ini mempunyai dua elektron dalam lapisan elektron luarnya, yang juga mereka lepaskan semasa tindak balas kimia. Paling elemen penting- kalsium (Ca) adalah asas tulang dan gigi.
Konfigurasi elektronik:
- Jadilah- 1s 2 2s 2 ;
- Mg- 1s 2 2s 2 2p 6 3s 2 ;
- Ca- 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2
Kumpulan VIIA(17). Atom unsur kumpulan ini biasanya menerima satu elektron setiap satu, kerana Terdapat lima elemen pada lapisan elektronik luar dan satu elektron hanya hilang daripada "set lengkap".
Unsur yang paling terkenal dalam kumpulan ini: klorin (Cl) - adalah sebahagian daripada garam dan peluntur; Iodin (I) adalah unsur yang memainkan peranan penting dalam aktiviti kelenjar tiroid manusia.
Konfigurasi Elektronik:
- F- 1s 2 2s 2 2p 5 ;
- Cl- 1s 2 2s 2 2p 6 3s 2 3p 5 ;
- Br- 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5
Kumpulan VIII(18). Atom unsur kumpulan ini mempunyai lapisan elektron luar "lengkap" sepenuhnya. Oleh itu, mereka "tidak" perlu menerima elektron. Dan mereka "tidak mahu" memberikannya. Oleh itu, elemen kumpulan ini sangat "enggan" untuk menyertai tindak balas kimia. Untuk masa yang lama dipercayai bahawa mereka tidak bertindak balas sama sekali (oleh itu nama "inert", iaitu "tidak aktif"). Tetapi ahli kimia Neil Bartlett mendapati bahawa sesetengah gas ini masih boleh bertindak balas dengan unsur lain dalam keadaan tertentu.
Konfigurasi elektronik:
- Ne- 1s 2 2s 2 2p 6 ;
- Ar- 1s 2 2s 2 2p 6 3s 2 3p 6 ;
- Kr- 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6
Unsur valensi dalam kumpulan
Adalah mudah untuk melihat bahawa dalam setiap kumpulan unsur-unsur adalah serupa antara satu sama lain dalam elektron valens mereka (elektron orbital s dan p terletak pada aras tenaga luar).
Logam alkali mempunyai 1 elektron valensi:
- Li- 1s 2 2s 1 ;
- Na- 1s 2 2s 2 2p 6 3s 1 ;
- K- 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1
Logam alkali tanah mempunyai 2 elektron valens:
- Jadilah- 1s 2 2s 2 ;
- Mg- 1s 2 2s 2 2p 6 3s 2 ;
- Ca- 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2
Halogen mempunyai 7 elektron valens:
- F- 1s 2 2s 2 2p 5 ;
- Cl- 1s 2 2s 2 2p 6 3s 2 3p 5 ;
- Br- 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5
Gas lengai mempunyai 8 elektron valensi:
- Ne- 1s 2 2s 2 2p 6 ;
- Ar- 1s 2 2s 2 2p 6 3s 2 3p 6 ;
- Kr- 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6
Untuk maklumat lanjut, lihat artikel Valensi dan Jadual Konfigurasi Elektronik Atom Unsur Kimia mengikut Kala.
Sekarang mari kita beralih perhatian kepada unsur-unsur yang terletak dalam kumpulan dengan simbol DALAM. Mereka terletak di tengah-tengah jadual berkala dan dipanggil logam peralihan.
Ciri tersendiri unsur-unsur ini ialah kehadiran dalam atom elektron yang mengisi d-orbital:
- Sc- 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 ;
- Ti- 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2
Secara berasingan dari meja utama terletak lantanida Dan aktinida- ini adalah apa yang dipanggil logam peralihan dalaman. Dalam atom unsur-unsur ini, elektron mengisi f-orbital:
- Ce- 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 4d 10 5s 2 5p 6 4f 1 5d 1 6s 2 ;
- Th- 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 4d 10 5s 2 5p 6 4f 14 5d 10 6s 2 6p 6 6d 2 7s 2
Semua unsur kimia boleh dicirikan bergantung pada struktur atomnya, serta kedudukannya dalam Jadual berkala DI. Mendeleev. Biasanya, unsur kimia dicirikan mengikut pelan berikut:
- menunjukkan simbol unsur kimia, serta namanya;
- berdasarkan kedudukan unsur dalam Jadual Berkala D.I. Mendeleev menunjukkan ordinalnya, nombor tempoh dan kumpulan (jenis subkumpulan) di mana unsur itu terletak;
- berdasarkan struktur atom, nyatakan cas nukleus, nombor jisim, bilangan elektron, proton dan neutron dalam atom;
- rekodkan konfigurasi elektronik dan nyatakan elektron valens;
- lakarkan formula grafik elektron untuk elektron valens dalam tanah dan keadaan teruja (jika boleh);
- menunjukkan keluarga unsur, serta jenisnya (logam atau bukan logam);
- menunjukkan formula oksida dan hidroksida yang lebih tinggi dengan Penerangan ringkas harta mereka;
- menunjukkan nilai keadaan pengoksidaan minimum dan maksimum bagi unsur kimia.
Ciri-ciri unsur kimia menggunakan vanadium (V) sebagai contoh
Mari kita pertimbangkan ciri-ciri unsur kimia menggunakan vanadium (V) sebagai contoh mengikut pelan yang diterangkan di atas:
1. V – vanadium.
2. Nombor siri– 23. Unsur berada dalam tempoh ke-4, dalam kumpulan V, subkumpulan A (utama).
3. Z=23 (cas nuklear), M=51 (nombor jisim), e=23 (bilangan elektron), p=23 (bilangan proton), n=51-23=28 (bilangan neutron).
4. 23 V 1s 2 2s 2 2p 6 3s 2 3p 6 3d 3 4s 2 – konfigurasi elektronik, elektron valens 3d 3 4s 2.
5. Keadaan tanah
Keadaan teruja

6. unsur-d, logam.
7. Oksida yang lebih tinggi - V 2 O 5 - pameran sifat amfoterik, dengan dominasi berasid:
V 2 O 5 + 2NaOH = 2NaVO 3 + H 2 O
V 2 O 5 + H 2 SO 4 = (VO 2) 2 SO 4 + H 2 O (pH<3)
Vanadium membentuk hidroksida daripada komposisi berikut: V(OH) 2, V(OH) 3, VO(OH) 2. V(OH) 2 dan V(OH) 3 dicirikan oleh sifat asas (1, 2), dan VO(OH) 2 mempunyai sifat amfoterik (3, 4):
V(OH) 2 + H 2 SO 4 = VSO 4 + 2H 2 O (1)
2 V(OH) 3 + 3 H 2 SO 4 = V 2 (SO 4) 3 + 6 H 2 O (2)
VO(OH) 2 + H 2 SO 4 = VOSO 4 + 2 H 2 O (3)
4 VO(OH) 2 + 2KOH = K 2 + 5 H 2 O (4)
8. Keadaan pengoksidaan minimum ialah "+2", maksimum ialah "+5"
Contoh penyelesaian masalah
CONTOH 1
| Senaman | Terangkan unsur kimia fosforus |
| Penyelesaian | 1. P – fosforus. 2. Nombor ordinal – 15. Unsur berada dalam tempoh ke-3, dalam kumpulan V, subkumpulan A (utama). 3. Z=15 (cas nuklear), M=31 (nombor jisim), e=15 (bilangan elektron), p=15 (bilangan proton), n=31-15=16 (bilangan neutron). 4. 15 P 1s 2 2s 2 2p 6 3s 2 3p 3 – konfigurasi elektronik, elektron valens 3s 2 3p 3. 5. Keadaan tanah Keadaan teruja 6. unsur p, bukan logam. 7. Oksida yang lebih tinggi - P 2 O 5 - mempamerkan sifat berasid: P 2 O 5 + 3Na 2 O = 2Na 3 PO 4 Hidroksida yang sepadan dengan oksida yang lebih tinggi - H 3 PO 4, mempamerkan sifat berasid: H 3 PO 4 + 3NaOH = Na 3 PO 4 + 3H 2 O 8. Keadaan pengoksidaan minimum ialah "-3", maksimum ialah "+5" |
CONTOH 2
| Senaman | Terangkan unsur kimia kalium |
| Penyelesaian | 1. K – kalium. 2. Nombor ordinal – 19. Unsur berada dalam tempoh ke-4, dalam kumpulan I, A (utama) subkumpulan. |


 Ringkasan tiga matahari
Ringkasan tiga matahari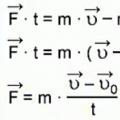 Momentum badan ialah kuantiti fizik vektor
Momentum badan ialah kuantiti fizik vektor Waris Ozhegov menentang Shvedova
Waris Ozhegov menentang Shvedova