Alkaner er eksempler på stoffer. Begrens hydrokarboner
Fra et kjemisk synspunkt er alkaner hydrokarboner, det vil si at den generelle formelen for alkaner bare inkluderer karbon- og hydrogenatomer. I tillegg til at disse forbindelsene ikke inneholder noen funksjonelle grupper, dannes de kun av enkeltbindinger. Slike hydrokarboner kalles mettede.
Typer alkaner
Alle alkaner kan deles inn i to store grupper:
- alifatiske forbindelser. Strukturen deres har form av en lineær kjede, den generelle formelen for alifatiske alkaner er C n H 2n+2, hvor n er antall karbonatomer i kjeden.
- Sykloalkaner. Disse forbindelsene har en syklisk struktur, som forårsaker en betydelig forskjell i deres kjemiske egenskaper fra lineære forbindelser. Spesielt bestemmer strukturformelen til denne typen alkaner likheten mellom egenskapene deres med alkyner, det vil si hydrokarboner med en trippelbinding mellom karbonatomer.
Elektronisk struktur av alifatiske forbindelser
Denne gruppen av alkaner kan ha enten en lineær eller forgrenet hydrokarbonkjede. Deres kjemiske aktivitet er lav sammenlignet med andre organiske forbindelser, siden alle bindinger i molekylet er mettet.
Molekylformelen til alkaner av den alifatiske typen indikerer at deres kjemiske binding har sp 3 hybridisering. Dette betyr at alle de fire kovalente bindingene rundt karbonatomet er helt like når det gjelder deres egenskaper (geometriske og energi). Med denne typen hybridisering har elektronskallene til s- og p-nivåene til karbonatomer samme form som en langstrakt manual.
Mellom karbonatomer er bindingen i kjeden kovalent, og mellom karbon og hydrogen er den delvis polarisert, mens elektrontettheten trekkes til karbon, som til et grunnstoff mer elektronegativt.
Det følger at bare C-C og CH-bindinger eksisterer i molekylene deres. De førstnevnte dannes som et resultat av overlappingen av to elektroniske hybridiserte sp 3-orbitaler med to karbonatomer, og sistnevnte dannes som et resultat av overlappingen av s-orbitalen til hydrogen og sp 3-orbitalen til karbon. C-C-bindingslengden er 1,54 ångstrøm og C-H-bindingslengden er 1,09 ångstrøm.
Geometrien til metanmolekylet
Metan er den enkleste alkanen, som består av bare ett karbonatom og fire hydrogenatomer.
På grunn av energilikheten til de tre 2p- og en 2s-orbitalene, oppnådd som et resultat av sp 3-hybridisering, er alle orbitaler i rommet plassert i samme vinkel i forhold til hverandre. Det er lik 109,47°. Som et resultat av en slik molekylstruktur dannes en likhet med en trekantet likesidet pyramide i rommet.

Enkle alkaner
Den enkleste alkanen er metan, som består av ett karbonatom og fire hydrogenatomer. Etter metan i alkanserien dannes propan, etan og butan av henholdsvis tre, to og fire karbonatomer. Fra og med fem karboner i kjeden, er forbindelser navngitt i henhold til IUPAC-nomenklaturen.
En tabell med formlene til alkaner og deres navn er gitt nedenfor:
Med tap av ett hydrogenatom danner et alkanmolekyl et aktivt radikal, hvis ende endres fra "an" til "yl", for eksempel etan C 2 H 6 - etyl C 2 H 5. Strukturformelen til etanalkan er vist på bildet.

Nomenklatur for organiske forbindelser
Reglene for å bestemme navn på alkaner og forbindelser basert på dem er fastsatt av den internasjonale IUPAC-nomenklaturen. For organiske forbindelser gjelder følgende regler:
- Navnet på en kjemisk forbindelse er basert på navnet på dens lengste kjede av karbonatomer.
- Nummereringen av karbonatomer bør starte fra enden, nærmere som kjedeforgreningen begynner.
- Hvis det er to eller flere karbonkjeder av samme lengde i forbindelsen, så velges den som har færrest radikaler som hovedkjeder, og de har en enklere struktur.
- Hvis det er to eller flere identiske grupper av radikaler i molekylet, brukes de tilsvarende prefiksene i navnet på forbindelsen, som dobler, tredobler, og så videre, navnene på disse radikalene. For eksempel brukes "3,5-dimetyl" i stedet for "3-metyl-5-metyl".
- Alle radikaler er skrevet i alfabetisk rekkefølge i det vanlige navnet på forbindelsen, og prefikser tas ikke i betraktning. Den siste radikalen er skrevet sammen med navnet på selve kjeden.
- Tallene som gjenspeiler antallet radikaler i kjeden er atskilt fra navnene med en bindestrek, og selve tallene er skrevet atskilt med komma.
Overholdelse av reglene i IUPAC-nomenklaturen gjør det enkelt å bestemme molekylformelen til en alkan ved for eksempel at 2,3-dimetylbutan har følgende form.

Fysiske egenskaper
De fysiske egenskapene til alkaner avhenger i stor grad av lengden på karbonkjeden som danner en bestemt forbindelse. Hovedegenskapene er følgende:
- De fire første representantene, i henhold til den generelle formelen for alkaner, er i gassform under normale forhold, det vil si at de er butan, metan, propan og etan. Når det gjelder pentan og heksan, eksisterer de allerede i form av væsker, og med utgangspunkt i syv karbonatomer er alkaner faste stoffer.
- Med en økning i lengden på karbonkjeden øker også tettheten til forbindelsen, så vel som dens første ordens faseovergangstemperaturer, det vil si smelte- og kokepunktene.
- Siden polariteten til den kjemiske bindingen i formelen til stoffet til alkaner er ubetydelig, løses de ikke opp i polare væsker, for eksempel i vann.
- Følgelig kan de brukes som gode løsemidler for forbindelser som ikke-polare fett, oljer og voks.
- Gassovnen til hjemmet bruker en blanding av alkaner rik på det tredje medlemmet av den kjemiske serien - propan.
- Oksygenforbrenning av alkaner frigjør en stor mengde energi i form av varme, så disse forbindelsene brukes som brennbart drivstoff.
Kjemiske egenskaper
På grunn av tilstedeværelsen av stabile bindinger i molekylene til alkaner, er deres reaktivitet sammenlignet med andre organiske forbindelser lav.
Alkaner reagerer praktisk talt ikke med ioniske og polare kjemiske forbindelser. De oppfører seg inert i løsninger av syrer og baser. Alkaner reagerer bare med oksygen og halogener: i det første tilfellet snakker vi om oksidasjonsprosesser, i det andre om substitusjonsprosesser. De viser også noe kjemisk aktivitet i reaksjoner med overgangsmetaller.
I alle disse kjemiske reaksjonene spiller forgrening av karbonkjeden til alkaner, det vil si tilstedeværelsen av radikale grupper i dem, en viktig rolle. Jo flere av dem, jo sterkere er endringen i den ideelle vinkelen mellom bindinger 109,47° i den romlige strukturen til molekylet, noe som fører til dannelse av spenninger inne i det og som et resultat øker den kjemiske aktiviteten til en slik forbindelse.
Reaksjonen av enkle alkaner med oksygen skjer i henhold til følgende skjema: C n H 2n+2 + (1,5n+0,5)O 2 → (n+l)H 2O+ nCO 2 .
Et eksempel på en reaksjon med klor er vist på bildet nedenfor.

Alkanenes fare for naturen og mennesket

Heptan, pentan og heksan er svært brannfarlige væsker og er farlige for både miljøet og menneskers helse fordi de er giftige.
DEFINISJON
Alkaner- mettede (alifatiske) hydrokarboner, hvis sammensetning er uttrykt med formelen C n H 2 n +2.
Alkaner danner en homolog serie, hvor hver kjemisk forbindelse avviker i sammensetning fra den neste og den forrige med samme antall karbon- og hydrogenatomer - CH 2, og stoffene som inngår i den homologe serien kalles homologer. Den homologe serien av alkaner er presentert i tabell 1.
Tabell 1. Homologe serier av alkaner.
I alkanmolekyler skilles primære (dvs. bundet med én binding), sekundære (dvs. bundet med to bindinger), tertiære (dvs. bundet med tre bindinger) og kvartære (dvs. bundet med fire bindinger) karbonatomer.
C 1 H3 - C 2 H 2 - C 1 H 3 (1 - primære, 2 - sekundære karbonatomer)
CH 3 -C 3 H (CH 3) - CH 3 (3-tertiært karbonatom)
CH 3 - C 4 (CH 3) 3 - CH 3 (4-kvartært karbonatom)
Alkaner er preget av strukturell isomerisme (isomerisme av karbonskjelettet). Så pentan har følgende isomerer:
CH3-CH2-CH2-CH2-CH3 (pentan)
CH 3 -CH (CH 3) -CH 2 -CH 3 (2-metylbutan)
CH3-C (CH3)2-CH3 (2,2-dimetylpropan)
For alkaner, starter med heptan, er optisk isomerisme karakteristisk.
Karbonatomer i mettede hydrokarboner er i sp 3 hybridisering. Vinklene mellom bindinger i alkanmolekyler er 109,5.
Kjemiske egenskaper til alkaner
Under normale forhold er alkaner kjemisk inerte - de reagerer ikke med hverken syrer eller alkalier. Dette skyldes den høye styrken til C-C og CH-bindinger. Ikke-polare C-C og CH-bindinger kan bare spaltes homolytisk av aktive frie radikaler. Derfor går alkaner inn i reaksjoner som fortsetter i henhold til mekanismen for radikal substitusjon. I en radikal reaksjon erstattes først og fremst hydrogenatomer ved tertiære, deretter ved sekundære og primære karbonatomer.
Radikale substitusjonsreaksjoner har en kjedekarakter. Hovedstadiene: kjernedannelse (initiering) av kjeden (1) - skjer under påvirkning av UV-stråling og fører til dannelse av frie radikaler, vekst av kjeden (2) - skjer på grunn av løsgjøring av et hydrogenatom fra alkanmolekylet; kjedeavslutning (3) skjer når to identiske eller forskjellige radikaler kolliderer.
X:X → 2X . (1)
R:H+X . → HX+R . (2)
R . + X:X → R:X + X . (2)
R . + R . → R:R (3)
R . + X . → R:X (3)
X . + X . → X:X (3)
Halogenering. Når alkaner interagerer med klor og brom under påvirkning av UV-stråling eller høy temperatur, dannes en blanding av produkter fra mono- til polyhalo-substituerte alkaner:
CH 3 Cl + Cl 2 = CH 2 Cl 2 + HCl (diklormetan)
CH 2 Cl 2 + Cl 2 = CHCl 3 + HCl (triklormetan)
CHCl 3 + Cl 2 = CCl 4 + HCl (tetraklormetan)
Nitrering (Konovalovs reaksjon). Under påvirkning av fortynnet salpetersyre på alkaner ved 140C og lavt trykk oppstår en radikal reaksjon:
CH 3 -CH 3 + HNO 3 \u003d CH 3 -CH 2 -NO 2 (nitroetan) + H 2 O
Sulfoklorering og sulfoksidering. Direkte sulfonering av alkaner er vanskelig og er oftest ledsaget av oksidasjon, noe som resulterer i dannelse av alkansulfonylklorider:
R-H + SO 2 + Cl 2 → R-SO 3 Cl + HCl
Sulfoksidasjonsreaksjonen fortsetter på samme måte, bare i dette tilfellet dannes alkansulfonsyrer:
R-H + SO 2 + ½ O 2 → R-SO 3 H
Sprekker- et radikalt brudd på C-C-bindinger. Oppstår ved oppvarming og i nærvær av katalysatorer. Når høyere alkaner er sprukket, dannes alkener; når metan og etan er sprukket, dannes acetylen:
C 8 H 18 \u003d C 4 H 10 (butan) + C 3 H 8 (propan)
2CH 4 \u003d C 2 H 2 (acetylen) + 3H 2
Oksidasjon. Den milde oksidasjonen av metan med atmosfærisk oksygen kan produsere metanol, mauraldehyd eller maursyre. I luft brenner alkaner til karbondioksid og vann:
C n H 2 n + 2 + (3n + 1) / 2 O 2 \u003d nCO 2 + (n + 1) H 2 O
Fysiske egenskaper til alkaner
Under normale forhold, C 1 -C 4 - gasser, C 5 - C 17 - væsker, starter med C 18 - faste stoffer. Alkaner er praktisk talt uløselige i vann, men svært løselige i ikke-polare løsningsmidler, som benzen. Så, metan CH 4 (myr, gruvegass) er en fargeløs og luktfri gass, svært løselig i etanol, eter, hydrokarboner, men dårlig løselig i vann. Metan brukes som et høykaloridrivstoff i sammensetningen av naturgass, som et råmateriale for produksjon av hydrogen, acetylen, kloroform og andre organiske stoffer i industriell skala.
Propan C 3 H 8 og butan C 4 H 10 er gasser som brukes i hverdagen som ballonggasser på grunn av deres lette flytendegjøring. Propan brukes som drivstoff til biler fordi det er mer miljøvennlig enn bensin. Butan er en råvare for produksjon av 1,3-butadien, som brukes i produksjon av syntetisk gummi.
Oppnå alkaner
Alkaner er hentet fra naturlige kilder - naturgass (80-90% - metan, 2-3% - etan og andre mettede hydrokarboner), kull, torv, tre, olje og fjellvoks.
Tildel laboratorie- og industrielle metoder for å oppnå alkaner. I industrien oppnås alkaner fra bituminøst kull (1) eller ved Fischer-Tropsch-reaksjonen (2):
nC + (n+1)H 2 = C n H 2 n +2 (1)
nCO + (2n+1)H 2 = C n H 2 n +2 + H 2 O (2)
Laboratoriemetoder for å oppnå alkaner inkluderer: hydrogenering av umettede hydrokarboner ved oppvarming og i nærvær av katalysatorer (Ni, Pt, Pd) (1), interaksjon av vann med organometalliske forbindelser (2), elektrolyse av karboksylsyrer (3), dekarboksyleringsreaksjoner (4) og Wurtz (5) og på andre måter.
R 1 -C≡C-R 2 (alkyn) → R 1 -CH \u003d CH-R 2 (alken) → R 1 -CH 2 - CH 2 -R 2 (alkan) (1)
R-Cl + Mg → R-Mg-Cl + H 2 O → R-H (alkan) + Mg(OH)Cl (2)
CH 3 COONa ↔ CH 3 COO - + Na +
2CH 3 COO - → 2CO 2 + C 2 H 6 (etan) (3)
CH 3 COONa + NaOH → CH 4 + Na 2 CO 3 (4)
R1-Cl + 2Na + Cl-R2 → 2NaCl + R1-R2 (5)
Eksempler på problemløsning
EKSEMPEL 1
| Trening | Bestem massen av klor som kreves for klorering i det første trinnet med 11,2 liter metan. |
| Løsning | La oss skrive reaksjonsligningen for det første trinnet av metanklorering (dvs. i halogeneringsreaksjonen erstattes bare ett hydrogenatom, noe som resulterer i dannelsen av et monoklorderivat): CH 4 + Cl 2 \u003d CH 3 Cl + HCl (klormetan) Finn mengden metanstoff: v (CH 4) \u003d V (CH 4) / V m v (CH 4) \u003d 11,2 / 22,4 \u003d 0,5 mol I følge reaksjonsligningen er antall mol klor og antall mol metan lik 1 mol, derfor vil det praktiske antallet mol klor og metan også være det samme og vil være lik: v (Cl 2) \u003d v (CH 4) \u003d 0,5 mol Når du kjenner til mengden klorstoff, kan du finne massen (som er stilt i spørsmålet om problemet). Massen av klor beregnes som produktet av mengden klorstoff og dens molare masse (molekylvekt er 1 mol klor; molekylvekt beregnes ved å bruke tabellen over kjemiske elementer til D.I. Mendeleev). Massen av klor vil være lik: m (Cl 2) \u003d v (Cl 2) × M (Cl 2) m(Cl 2) \u003d 0,5 × 71 \u003d 35,5 g |
| Svar | Massen av klor er 35,5 g |
I. ALKANE (mettede hydrokarboner, parafiner)
Alkaner er alifatiske (asykliske) mettede hydrokarboner der karbonatomer er bundet sammen med enkle (enkelt)bindinger til uforgrenede eller forgrenede kjeder.
Alkaner- navnet på mettede hydrokarboner i henhold til den internasjonale nomenklaturen.
Parafiner- et historisk etablert navn som gjenspeiler egenskapene til disse forbindelsene (fra lat. parrum affinis- har liten tilhørighet, inaktiv).
begrensende, eller rik, er disse hydrokarbonene navngitt i forbindelse med fullstendig metning av karbonkjeden med hydrogenatomer.
De enkleste representantene for alkaner:
Når man sammenligner disse forbindelsene, er det klart at de skiller seg fra hverandre med en gruppe -CH 2 - (metylen). Legger til en annen gruppe til propan -CH 2 -, vi får butan C4H10, deretter alkaner C 5 H 12, C 6 H 14 etc.
Nå kan du utlede den generelle formelen for alkaner. Antall karbonatomer i rekken av alkaner vil bli tatt som n
, da blir antallet hydrogenatomer 2n+2
. Derfor tilsvarer sammensetningen av alkaner den generelle formelen CnH2n+2.
Derfor brukes ofte følgende definisjon:
- Alkaner- hydrokarboner, hvis sammensetning er uttrykt ved den generelle formelen CnH2n+2, Hvor n er antall karbonatomer.
II. Strukturen til alkaner
Kjemisk struktur(rekkefølgen for kobling av atomer i molekyler) av de enkleste alkanene - metan, etan og propan - viser deres strukturelle formler. Fra disse formlene kan det sees at det er to typer kjemiske bindinger i alkaner:
S–S Og S–N.C–C-bindingen er kovalent ikke-polar. CH-bindingen er kovalent, svakt polar, fordi karbon og hydrogen er tett i elektronegativitet (2,5 for karbon og 2,1 for hydrogen). Dannelsen av kovalente bindinger i alkaner på grunn av de vanlige elektronparene av karbon- og hydrogenatomer kan vises ved hjelp av elektroniske formler:
Elektroniske og strukturelle formler reflekterer kjemisk struktur, men gir ingen anelse om romlig struktur av molekyler, som i betydelig grad påvirker egenskapene til stoffet.
Romlig struktur, dvs. det gjensidige arrangementet av atomene til et molekyl i rommet avhenger av retningen til atomorbitalene (AO) til disse atomene. I hydrokarboner spilles hovedrollen av den romlige orienteringen av atomorbitalene til karbon, siden den sfæriske 1s-AO til hydrogenatomet er blottet for en bestemt orientering.
Det romlige arrangementet av karbon-AO-er avhenger i sin tur av typen hybridisering. Det mettede karbonatomet i alkaner er bundet til fire andre atomer. Derfor tilsvarer tilstanden sp 3 hybridisering. I dette tilfellet deltar hver av de fire sp 3 -hybrid karbon AO-ene i aksial (σ-) overlapping med s-AO for hydrogen eller med sp 3 -AO til et annet karbonatom, og danner σ-bindinger С-Н eller С -С.
Fire σ-bindinger av karbon er rettet i rommet i en vinkel på 109 omtrent 28 ", som tilsvarer den minste frastøtingen av elektroner. Derfor har molekylet til den enkleste representanten for alkaner - metan CH 4 - formen av et tetraeder, i midten av hvilket det er et karbonatom, og ved toppunktene - hydrogenatomer:
Bindingsvinkelen H-C-H er 109 o 28". Den romlige strukturen til metan kan vises ved hjelp av volumetriske (skala) og ball-and-stick-modeller.
For opptak er det praktisk å bruke den romlige (stereokjemiske) formelen.
I molekylet til neste homolog - etan C 2 H 6 - to tetraedriske sp 3 karbonatomer danner en mer kompleks romlig struktur:
2. Hvis det i molekyler med samme sammensetning og samme kjemiske struktur er en annen gjensidig ordning av atomer i rommet mulig, så er det romlig isomerisme (stereoisomerisme). I dette tilfellet er ikke bruk av strukturformler nok og man bør bruke molekylære modeller eller spesielle formler - stereokjemisk (romlig) eller projeksjon.
Alkaner, med utgangspunkt i etan H 3 C – CH 3, finnes i forskjellige romlige former ( konformasjoner) forårsaket av intramolekylær rotasjon langs C–C σ-bindingene og viser s.k. rotasjons (konformasjons) isomerisme.
Ulike romlige former av molekylet, som passerer inn i hverandre ved rotasjon rundt C–C σ-bindingene, kalles konformasjoner eller rotasjonsisomerer(konformatorer).
Rotasjonsisomerene til et molekyl er dets energisk ulik tilstand. Deres interkonvertering skjer raskt og konstant som et resultat av termisk bevegelse. Derfor kan ikke rotasjonsisomerer isoleres individuelt, men deres eksistens er bevist ved fysiske metoder. Noen konformasjoner er mer stabile (energetisk gunstige) og molekylet forblir i slike tilstander i lengre tid.
3. I tillegg, hvis det er et karbonatom i molekylet assosiert med 4 forskjellige substituenter, er en annen type romlig isomerisme mulig -
optisk isomeri.For eksempel:
da er eksistensen av to forbindelser med samme strukturformel, men som er forskjellige i romlig struktur, mulig. Molekylene til slike forbindelser forholder seg til hverandre som et objekt og dets speilbilde og er romlige isomerer.
Isomerisme av denne typen kalles optisk, isomerer - optiske isomerer eller optiske antipoder:
Molekyler av optiske isomerer er inkompatible i rommet (som venstre og høyre hender), de mangler et symmetriplan.
Dermed,optiske isomerer romlige isomerer kalles, hvis molekyler forholder seg til hverandre som et objekt og et uforenlig speilbilde.
Optiske isomerer har de samme fysiske og kjemiske egenskapene, men er forskjellige i forholdet til polarisert lys. Slike isomerer har optisk aktivitet (en av dem roterer planet av polarisert lys til venstre, og den andre - til samme vinkel til høyre). Forskjeller i kjemiske egenskaper observeres bare i reaksjoner med optisk aktive reagenser.
Optisk isomerisme er manifestert i organiske stoffer av forskjellige klasser og spiller en svært viktig rolle i kjemien til naturlige forbindelser.
En av de første typene kjemiske forbindelser som ble studert i skolepensum i organisk kjemi er alkaner. De tilhører gruppen av mettede (ellers - alifatiske) hydrokarboner. Molekylene deres inneholder bare enkeltbindinger. Karbonatomer er karakterisert ved sp³-hybridisering.
Homologer er kjemiske stoffer som har felles egenskaper og kjemisk struktur, men som er forskjellige med en eller flere CH2-grupper.
For metan CH4 kan den generelle formelen for alkaner gis: CnH (2n+2), hvor n er antall karbonatomer i forbindelsen.
Her er en tabell over alkaner, der n er i området fra 1 til 10.
Isomerisme av alkaner
Isomerer er de stoffene hvis molekylformel er den samme, men strukturen eller strukturen er forskjellig.
Klassen av alkaner er preget av 2 typer isomerisme: karbonskjelett og optisk isomeri.
La oss gi et eksempel på en strukturell isomer (dvs. et stoff som bare er forskjellig i strukturen til karbonskjelettet) for butan C4H10.
Optiske isomerer kalles slike 2 stoffer, hvis molekyler har en lignende struktur, men ikke kan kombineres i rommet. Fenomenet optisk eller speilisomerisme forekommer i alkaner, og starter med heptan C7H16.
For å gi alkanen det riktige navnet, bruk IUPAC-nomenklaturen. For å gjøre dette, bruk følgende handlingssekvens:

I henhold til planen ovenfor, la oss prøve å gi et navn til den neste alkanen.

 Under normale forhold er uforgrenede alkaner fra CH4 til C4H10 gassformige stoffer, fra C5H12 til C13H28 er de flytende og har en spesifikk lukt, alle påfølgende er faste. Det viser seg at ettersom lengden på karbonkjeden øker, øker koke- og smeltepunktene. Jo mer forgrenet strukturen til en alkan er, desto lavere er temperaturen der den koker og smelter.
Under normale forhold er uforgrenede alkaner fra CH4 til C4H10 gassformige stoffer, fra C5H12 til C13H28 er de flytende og har en spesifikk lukt, alle påfølgende er faste. Det viser seg at ettersom lengden på karbonkjeden øker, øker koke- og smeltepunktene. Jo mer forgrenet strukturen til en alkan er, desto lavere er temperaturen der den koker og smelter.
Gassformige alkaner er fargeløse. Og også alle representanter for denne klassen kan ikke oppløses i vann.
Alkaner som har en aggregeringstilstand av en gass kan brenne, mens flammen enten vil være fargeløs eller ha en lyseblå fargetone.
Kjemiske egenskaper
Under normale forhold er alkaner ganske inaktive. Dette forklares av styrken til σ-bindingene mellom C-C og C-H atomene. Derfor er det nødvendig å sørge for spesielle forhold (for eksempel en ganske høy temperatur eller lys) for å gjøre den kjemiske reaksjonen mulig.
Substitusjonsreaksjoner
Reaksjoner av denne typen inkluderer halogenering og nitrering. Halogenering (reaksjon med Cl2 eller Br2) skjer ved oppvarming eller under påvirkning av lys. Under reaksjonen som fortsetter sekvensielt, dannes haloalkaner.
For eksempel kan du skrive reaksjonen av klorering av etan.
Bromering vil foregå på lignende måte.
Nitrering er en reaksjon med en svak (10%) løsning av HNO3 eller med nitrogenoksid (IV) NO2. Betingelser for å utføre reaksjoner - temperatur 140 °C og trykk.
C3H8 + HNO3 = C3H7NO2 + H2O.
Som et resultat dannes to produkter - vann og en aminosyre.
Nedbrytningsreaksjoner
Dekomponeringsreaksjoner krever alltid høy temperatur. Dette er nødvendig for å bryte bindinger mellom karbon- og hydrogenatomer.
Så, når sprekker temperatur nødvendig mellom 700 og 1000 °C. Under reaksjonen blir -C-C-bindinger ødelagt, en ny alkan og alken dannes:
C8H18 = C4H10 + C4H8
Et unntak er oppsprekking av metan og etan. Som et resultat av disse reaksjonene frigjøres hydrogen og alkynacetylen dannes. Forutsetning er oppvarming til 1500 °C.
C2H4 = C2H2 + H2
Hvis du overskrider temperaturen på 1000 ° C, kan du oppnå pyrolyse med fullstendig brudd på bindinger i forbindelsen:
Under pyrolysen av propyl ble karbon C oppnådd, og hydrogen H2 ble også frigjort.
Dehydrogeneringsreaksjoner
Dehydrogenering (hydrogeneliminering) skjer forskjellig for ulike alkaner. Reaksjonsbetingelsene er en temperatur i området fra 400 til 600 °C, samt tilstedeværelsen av en katalysator, som kan være nikkel eller platina.
Fra en forbindelse med 2 eller 3 C-atomer i karbonskjelettet dannes et alken:
C2H6 = C2H4 + H2.
Hvis det er 4-5 karbonatomer i kjeden til molekylet, vil alkadien og hydrogen bli oppnådd etter dehydrogenering.
C5H12 = C4H8 + 2H2.
Starter med heksan, under reaksjonen, dannes benzen eller dets derivater.
C6H14 = C6H6 + 4H2
Vi bør også nevne omdannelsesreaksjonen utført for metan ved en temperatur på 800 °C og i nærvær av nikkel:
CH4 + H2O = CO + 3H2
For andre alkaner er omdannelsen ukarakteristisk.
Oksidasjon og forbrenning
Hvis en alkan oppvarmet til en temperatur på ikke mer enn 200 ° C interagerer med oksygen i nærvær av en katalysator, vil de oppnådde produktene variere avhengig av andre reaksjonsbetingelser: disse kan være representanter for klassene aldehyder, karboksylsyrer, alkoholer eller ketoner.
Ved fullstendig oksidasjon brenner alkanen til sluttproduktene - vann og CO2:
C9H20 + 14O2 = 9CO2 + 10H2O
Hvis det ikke er nok oksygen under oksidasjon, vil sluttproduktet være kull eller CO i stedet for karbondioksid.
Gjennomføring av isomerisering
Hvis en temperatur på ca. 100-200 grader tilveiebringes, blir en omorganiseringsreaksjon mulig for uforgrenede alkaner. Den andre obligatoriske betingelsen for isomerisering er tilstedeværelsen av en AlCl3-katalysator. I dette tilfellet endres strukturen til molekylene til stoffet og isomeren dannes.
 Betydelige andelen alkaner oppnås ved å skille dem fra naturlige råvarer. Oftest behandles naturgass, hvor hovedkomponenten er metan, eller olje blir utsatt for sprekking og utbedring.
Betydelige andelen alkaner oppnås ved å skille dem fra naturlige råvarer. Oftest behandles naturgass, hvor hovedkomponenten er metan, eller olje blir utsatt for sprekking og utbedring.
Du bør også huske på de kjemiske egenskapene til alkener. I klasse 10 er en av de første laboratoriemetodene som ble studert i kjemitimer hydrogenering av umettede hydrokarboner.
C3H6 + H2 = C3H8
For eksempel, som et resultat av tilsetning av hydrogen til propylen, oppnås et enkelt produkt - propan.
Ved å bruke Wurtz-reaksjonen oppnås alkaner fra monohalogenalkaner, i den strukturelle kjeden som antallet karbonatomer er doblet:
2CH4H9Br + 2Na = C8H18 + 2NaBr.
En annen måte å oppnå er samspillet mellom et salt av en karboksylsyre og et alkali når det oppvarmes:
C2H5COONa + NaOH = Na2CO3 + C2H6.
I tillegg produseres metan noen ganger i en elektrisk lysbue (C + 2H2 = CH4) eller ved å reagere aluminiumkarbid med vann:
Al4C3 + 12H2O = 3CH4 + 4Al(OH)3.
Alkaner er mye brukt i industrien som et lavkost drivstoff. Og de brukes også som råvarer for syntese av andre organiske stoffer. Til dette formål brukes vanligvis metan, som er nødvendig for og syntesegass. Noen andre mettede hydrokarboner brukes for å oppnå syntetiske fettstoffer, og også som base for smøremidler.
For den beste forståelsen av emnet "Alkaner" er det laget mer enn én videoleksjon, som i detalj diskuterer emner som strukturen til materie, isomerer og nomenklatur, og viser også mekanismene for kjemiske reaksjoner.
.
Alkaner - navnet på mettede hydrokarboner i henhold til den internasjonale nomenklaturen. Parafiner er det historisk bevarte navnet på mettede hydrokarboner.
I molekylene til disse forbindelsene er alle valensbindinger av karbon og hydrogen fullstendig mettet. Det er derfor disse hydrokarbonene ikke er i stand til addisjonsreaksjoner. I denne forbindelse kan denne klassen av hydrokarboner defineres som følger:
Hydrokarboner med den generelle formelen C n H 2n+2 som ikke tilsetter hydrogen og andre grunnstoffer kalles mettede hydrokarboner eller alkaner (parafiner).
Den enkleste representanten for mettede hydrokarboner er metan.
Strukturen til metanmolekylet.
Molekylformelen for metan er CH 4 .
Siden hybridisering er involvert s- elektron og tre s- elektron, så kalles denne typen sp 3 - hybridisering.
Valensvinkel: 109
grader.
Metanhomologer.
Det er mange hydrokarboner som ligner på metan, dvs. metanhomologer (gresk "homolog" - lignende). Molekyler inneholder to, tre, fire eller flere karbonatomer. Hvert påfølgende hydrokarbon skiller seg fra det forrige med en gruppe atomer CH 2. For eksempel, hvis du mentalt legger en CH 2-gruppe til et CH 4-metanmolekyl (CH 2-gruppen kalles en homologisk forskjell), oppnås det neste hydrokarbonet i metanserien - etan C 2H 6, etc.
Den homologe rad av metan.
CH 4 - Metan
C2H6 - Etan
C3H8 - Propan
C4H10 - Butan
C5H12 - Pentan
C6H14 - Heksan
C7H16 - Heptan
C9H20 - Nonan
Isomerisme og nomenklatur.
For å sammenstille navnene på mettede forgrenede hydrokarboner, antas det at i alle molekyler er hydrogenatomene erstattet av forskjellige radikaler. For å bestemme navnene på et gitt hydrokarbon, følges en viss rekkefølge:
- Den lengste karbonkjeden er valgt i formelen og symbolene til karbonatomer er nummerert, med start fra slutten av kjeden, som forgreningen er nærmere.
- De navngir radikalene (begynner med det enkleste) og bruker tall for å indikere stedet ved de nummererte karbonatomene. Hvis det samme karbonatomet har to identiske radikaler, gjentas tallet to ganger. Antall identiske radikaler er indikert med tall på gresk ("di" - to, "tre" - tre, "tetra" - fire, etc.)
- Det fulle navnet på dette hydrokarbonet er gitt av antall karbonatomer i den nummererte kjeden.
Å finne i naturen.
Den enkleste representanten for mettede hydrokarboner er metan- dannes i naturen som følge av nedbrytning av rester av plante- og dyreorganismer uten lufttilgang. Dette forklarer utseendet til gassbobler i sumpete vannmasser. Noen ganger frigjøres metan fra kull og hoper seg opp i gruver. Metan utgjør hoveddelen av naturgass ( 80 -97% ). Det finnes også i gasser som frigjøres under oljeproduksjon. Sammensetningen av naturgass og petroleumsgasser inkluderer også etan C 2 H 6 , propan C 3 H 8 , butan C 4 H 10 og noen andre. Gassformige, flytende og faste mettede hydrokarboner finnes i olje.
fysiske egenskaper.
Metan er en fargeløs og luktfri gass, nesten 2 ganger lettere enn luft, lett løselig i vann. Etan, propan, butan under normale forhold er gasser, fra pentan til pentadekan er væsker, og følgende homologer er faste stoffer.
Med en økning i de relative molekylmassene til mettede hydrokarboner øker deres koke- og smeltepunkt naturlig.
 Konvertering av en desimalbrøk til en vanlig brøk og omvendt: en regel, eksempler
Konvertering av en desimalbrøk til en vanlig brøk og omvendt: en regel, eksempler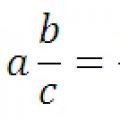 Konvertering av desimaltall til vanlige brøker
Konvertering av desimaltall til vanlige brøker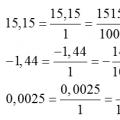 Konvertering av en vanlig brøk til en desimalbrøk og omvendt, regler, eksempler
Konvertering av en vanlig brøk til en desimalbrøk og omvendt, regler, eksempler