dispergerte forbindelser. Disperger systemer: generelle egenskaper og klassifisering
Generell kjemi: lærebok / A. V. Zholnin; utg. V. A. Popkova, A. V. Zholnina. - 2012. - 400 s.: ill.
Kapittel 13. FYSISK KJEMI AV DISPERSIVE SYSTEMER
Kapittel 13. FYSISK KJEMI AV DISPERSIVE SYSTEMER
Livet er et spesielt kolloidalt system... det er et spesielt rike av naturlige vann.
I OG. Vernadsky
13.1 DISPERSIVE SYSTEMER, DERES KLASSIFIKASJONER, EGENSKAPER
Kolloidale løsninger
Det materielle grunnlaget for moderne sivilisasjon og selve eksistensen av mennesket og hele den biologiske verden er assosiert med spredte systemer. En person bor og arbeider i et miljø med spredte systemer. Luft, spesielt luften i arbeidsrom, er et spredt system. Mange matvarer, halvfabrikata og bearbeidingsprodukter er spredte systemer (melk, kjøtt, brød, smør, margarin). Mange medisinske stoffer produseres i form av tynne suspensjoner eller emulsjoner, salver, pastaer eller kremer (protargol, collargol, gelatinol, etc.). Alle levende systemer er spredt. Muskel- og nerveceller, fibre, gener, virus, protoplasma, blod, lymfe, cerebrospinalvæske - alt dette er svært spredte formasjoner. Prosessene som forekommer i dem styres av fysiske og kjemiske lover, som studeres av fysikokjemien til disperse systemer.
Dispergerte systemer er systemer der stoffet er i en tilstand med mer eller mindre høy fragmentering og er jevnt fordelt i miljøet. Vitenskapen om svært spredte systemer kalles kolloidkjemi. Levende stoffer er basert på forbindelser som er i kolloidal tilstand.
Det dispergerte systemet består av et dispersjonsmedium og en dispergert fase. Det er flere klassifiseringer av spredte systemer basert på ulike funksjoner ved spredte systemer.
1. I henhold til aggregeringstilstanden dispersjonsmedium Alle dispergeringssystemer kan reduseres til 3 typer. Dispergerte systemer med gass
dispersjonsmedium - aerosoler(røyk, inneluft, skyer osv.). Disperger systemer med et flytende dispersjonsmedium - lyosoler(skum, emulsjoner - melk, suspensjoner, støv som har kommet inn i luftveiene; blod, lymfe, urin er hydrosoler). Dispergerte systemer med et fast dispersjonsmedium - solidozoli(pimpstein, silikagel, legeringer).
2. Den andre klassifiseringen grupperer dispergerte systemer avhengig av partikkelstørrelsen til den dispergerte fasen. Målet for fragmentering av partikler er enten den tverrgående partikkelstørrelsen - radiusen (r), eller
(radius) av partikler (r) uttrykkes i centimeter, da er dispersjonen D antall partikler som kan pakkes tett langs lengden på en centimeter. Til slutt er det mulig å karakterisere den spesifikke overflaten (∑), enhetene til ∑ er m 2 /g eller m 2 /l. Under bestemt overflate forstå forholdet til overflaten (S) av den dispergerte fasen til sin
avhengighetskoeffisient for den spesifikke overflaten av formen til partiklene. Det spesifikke overflatearealet er direkte proporsjonalt med dispersjon (D) og omvendt proporsjonalt med den tverrgående partikkelstørrelsen (r). Med økende spredning, dvs. med avtagende partikkelstørrelse øker dets spesifikke overflateareal.
De andre klassifiseringsgruppene fordeler systemer avhengig av partikkelstørrelsen til den dispergerte fasen i følgende grupper (tabell 13.1): grove systemer; kolloidale løsninger; sanne løsninger.
Kolloidale systemer kan være gassformige, flytende og faste. Den vanligste og studerte væsken (lyosoler). Kolloide løsninger blir ofte referert til som soler for korte. Avhengig av løsningsmidlets natur - dispersjonsmedium, dvs. vann, alkohol eller eter, lyosoler kalles henholdsvis hydrosoler, alkosoler eller eterosoler. I henhold til intensiteten av interaksjon mellom partiklene i den dispergerte fasen og dispersjonsmediet, er solene delt inn i 2 grupper: lyofil- intensiv interaksjon, som et resultat av hvilket utviklede solvatlag dannes, for eksempel en sol av protoplasma, blod, lymfe, stivelse, protein, etc.; lyofobiske soler- svak interaksjon av partiklene i den dispergerte fasen med partiklene i dispersjonsmediet. Soler av metaller, hydroksyder, praktisk talt alle klassiske kolloidale systemer. IUDer og overflateaktive løsninger er delt inn i separate grupper.
Tabell 13.1. Klassifisering av dispergerte systemer etter partikkelstørrelse og deres egenskaper

Et stort bidrag til teorien om kolloidale løsninger ble gitt av våre innenlandske forskere I.G. Borsjtsjov, P.P. Weimarn, N.P. Peskov, D.I. Mendeleev, B.V. Deryagin, P.A. Gjenbinder osv.
Enhver kolloid løsning er et mikroheterogent, flerfaset, høy- og polydispers system med høy spredningsgrad. Betingelsen for dannelsen av en kolloidal løsning er uoppløseligheten av stoffet i en fase i stoffet til den andre, fordi det bare kan eksistere fysiske grensesnitt mellom slike stoffer. I henhold til styrken av interaksjonen mellom partiklene i den dispergerte fasen, skilles fritt-dispergerte og bundet-dispergerte systemer. Et eksempel på sistnevnte er biologiske membraner.
Fremstillingen av kolloide løsninger utføres ved to metoder: dispergering av store partikler til en kolloidal grad av dispersjon og kondensasjon - dannelsen av forhold under hvilke atomer, molekyler eller ioner kombineres til aggregater av en kolloidal grad av dispersjon.
Metaller, tungtløselige salter i vann, oksider og hydroksyder, og mange ikke-polare organiske stoffer kan danne hydrosoler. Stoffer som løser seg godt i vann, men som er dårlig løselige i ikke-polare forbindelser, er ikke i stand til å danne hydrosoler, men kan danne organosoler.
Som stabilisatorer Det brukes stoffer som hindrer aggregering av kolloidale partikler til større og deres nedbør. Denne effekten er besatt av: et lite overskudd av en av reagensene som substansen i den dispergerte fasen er oppnådd fra, overflateaktive stoffer, inkludert proteiner og polysakkarider.
For å oppnå spredningen som kreves for kolloidale systemer (10 -7 -10 -9 m), gjelder:
Mekanisk knusing ved bruk av kule- og kolloidmøller i nærvær av et flytende dispersjonsmedium og en stabilisator;
Virkningen av ultralyd (for eksempel svovelhydrosol, grafitt, metallhydroksider, etc.);
Peptiseringsmetode, tilsetning av en liten mengde elektrolytt - peptizer;
En av variantene av kondensasjonsmetoden er løsningsmiddelerstatningsmetoden, som resulterer i en reduksjon i løseligheten til stoffet i den dispergerte fasen. Molekyler av et stoff kondenserer til partikler av kolloidal størrelse som et resultat av ødeleggelsen av solvatlagene av molekyler i en ekte løsning og dannelsen av større partikler. I hjertet av kjemi-
Termiske kondenseringsmetoder er kjemiske reaksjoner (oksidasjon, reduksjon, hydrolyse, utveksling) som fører til dannelse av dårlig løselige stoffer i nærvær av visse stabilisatorer.
13.2. MOLEKYLÆR-KINETISKE EGENSKAPER TIL KOLLOIDLØSNINGER. OSMOSE.
OSMOTISK TRYKK
Brownsk bevegelse - dette er den termiske bevegelsen til partikler i kolloidale systemer, som har en molekylær-kinetisk natur. Det er fastslått at bevegelsen av kolloidale partikler er en konsekvens av tilfeldige påvirkninger påført dem av molekyler av et dispersjonsmedium som er i termisk bevegelse. Som et resultat endrer den kolloidale partikkelen ofte retning og hastighet. I 1 s kan en kolloidal partikkel endre retning mer enn 10 20 ganger.
ved diffusjon kalt en spontant pågående prosess for å utjevne konsentrasjonen av kolloidale partikler i en løsning under påvirkning av deres termiske kaotiske bevegelse. Diffusjonsfenomenet er irreversibelt. Diffusjonskoeffisienten er numerisk lik mengden stoff diffundert gjennom en enhetsareal per tidsenhet ved en konsentrasjonsgradient på 1 (dvs. en endring i konsentrasjon på 1 mol/cm 3 i en avstand på 1 cm). A. Einstein (1906) utledet en ligning som relaterer diffusjonskoeffisienten til den absolutte temperaturen, viskositeten og partikkelstørrelsen til den dispergerte fasen:
Hvor T- temperatur, K; r- partikkelradius, m; η - viskositet, Ns/m2; til B- Boltzmanns konstant, 1,38 10 -23; D- diffusjonskoeffisient, m 2 / s.
Diffusjonskoeffisienten er direkte proporsjonal med temperaturen og omvendt proporsjonal med viskositeten til mediet (η) og partikkelradius (r). Årsaken til diffusjon, så vel som Brownsk bevegelse, er den molekylær-kinetiske bevegelsen til partiklene i løsningsmidlet og stoffet. Det er kjent at den kinetiske energien til et molekyl i bevegelse er jo mindre, jo større volum er det (tabell 13.2).
Ved å bruke Einstein-ligningen kan du enkelt bestemme massen til 1 mol av et stoff hvis du vet D, Tη og r. Fra likning (13.1) kan man bestemme r:
Hvor R- universell gasskonstant, 8,3 (J / mol-K); N a Avogadro konstant.
Tabell 13.2. Diffusjonskoeffisient for noen stoffer

I tilfellet når systemet er atskilt fra andre deler av systemet av en skillevegg som er permeabel for en komponent (for eksempel vann) og ugjennomtrengelig for en annen (for eksempel et oppløst stoff), blir diffusjon enveis (osmose). Kraften som forårsaker osmose per enhet av membranoverflaten kalles osmotisk trykk. Rollen til semipermeable skillevegger (membraner) kan utføres av vev fra mennesker, dyr og planter (urinblære, tarmvegger, cellemembraner, etc.). For kolloidale løsninger er det osmotiske trykket mindre enn i sanne løsninger. Diffusjonsprosessen er ledsaget av utseendet av en potensialforskjell som følge av ulik ionemobilitet og dannelsen av en konsentrasjonsgradient (membranpotensial).
Sedimentasjon. Fordelingen av partikler påvirkes ikke bare av diffusjon, men også av gravitasjonsfeltet. Den kinetiske stabiliteten til et kolloidalt system avhenger av virkningen av to motsatt rettede faktorer: tyngdekraften, som partiklene legger seg under, og kraften som partiklene har en tendens til å spre seg i hele volumet og motvirke sedimenteringen.
Optiske egenskaper til kolloidale løsninger. Lysspredning. D. Rayleigh-ligningen. Det er umulig å skille mellom kolloidale og sanne løsninger ved første øyekast. En godt tilberedt sol er en nesten ren gjennomsiktig væske. Dens mikroheterogenitet kan oppdages ved hjelp av spesielle metoder. Hvis en sol som ligger på et ubelyst sted er opplyst med en smal stråle, kan man, sett fra siden, se en lys kjegle, hvis topp er på punktet der strålen kommer inn i det inhomogene rommet. Dette er den såkalte Tyndalls kjegle - en slags uklar glød av kolloider, observert under sidebelysning, kalles Faraday-Tyndall-effekten.
Grunnen til dette fenomenet som er karakteristisk for kolloider er at størrelsen på kolloide partikler er mindre enn halvparten av lysets bølgelengde, mens diffraksjon av lys observeres, som et resultat av spredning, gløder partiklene og blir til en uavhengig lyskilde, og strålen blir synlig.
Teorien om lysspredning ble utviklet av Rayleigh i 1871, som utledet en ligning for sfæriske partikler som relaterer intensiteten til innfallende lys (I 0) til intensiteten av lys spredt av en enhetsvolum av systemet (I p).
Hvor jeg, I0- intensiteten av spredt og innfallende lys, W/m 2 ; k p er Rayleigh-konstanten, en konstant avhengig av brytningsindeksene til stoffene i den dispergerte fasen og dispersjonsmediet, m-3; med v- konsentrasjon av solpartikler, mol/l; λ er bølgelengden til det innfallende lyset, m; r- partikkelradius, m.
13.3. MICELLAR TEORI OM STRUKTUREN AV KOLLOIDPARTIKLER
Miceller danner den dispergerte fasen av solen, og den intermicellære væsken danner et dispersjonsmedium, som inkluderer et løsningsmiddel, elektrolytioner og ikke-elektrolyttmolekyler. En micelle består av et elektrisk nøytralt aggregat og en ionisk partikkel. Massen til en kolloidal partikkel er hovedsakelig konsentrert i aggregatet. Tilslaget kan ha både amorf og krystallinsk struktur. I følge Panet-Fajans-regelen blir ioner irreversibelt adsorbert på aggregatet med dannelse av sterke bindinger med atomene i aggregatet, som er en del av krystallgitteret til aggregatet (eller isomorfe med det). En indikator på dette er uløseligheten til disse forbindelsene. De heter potensielle bestemmende ioner. Som et resultat av selektiv adsorpsjon av ioner eller ionisering av overflatemolekyler, får aggregatet en ladning. Dermed danner de aggregat- og potensialbestemmende ionene kjernen i en micelle og grupperer seg rundt kjerneionene til det motsatte fortegn - motioner. Tilslaget danner sammen med den ionogene delen av micellene et dobbelt elektrisk lag (adsorpsjonslag). Tilslaget sammen med adsorpsjonslaget kalles et granulat. Ladningen til granulen er lik summen av ladningene til motioner og potensialbestemmende ioner. ionogen
en del av micellen består av to lag: adsorpsjon og diffus. Dette fullfører dannelsen av en elektrisk nøytral micelle, som er grunnlaget for en kolloidal løsning. En micelle vises som kolloid-kjemisk formel.
La oss vurdere strukturen til en hydrosolmicelle ved å bruke eksemplet på dannelsen av en kolloidal løsning av bariumsulfat under betingelse av et overskudd av BaCl 2:
Lite løselig bariumsulfat danner et krystallinsk aggregat bestående av m BaSO 4 molekyler. Adsorbert på overflaten av tilslaget n Ba 2+ ioner. Det er 2(n - x) kloridion Cl-. De resterende motionene (2x) er plassert i det diffuse laget:

Strukturen til en micelle av en bariumsulfatsol oppnådd med et overskudd av natriumsulfat er skrevet som:
Fra dataene ovenfor, at tegnet på ladningen til en kolloidal partikkel avhenger av betingelsene for å oppnå en kolloidal løsning.
13.4. ELEKTROKINETISK POTENSIAL
KOLLOIDE Partikler
Zeta-(ζ )-potensiell. Verdien av ladningen til ζ-potensialet bestemmes av ladningen til granulen. Det bestemmes av differansen mellom summen av ladningene til de potensialbestemmende ionene og ladningene til motionene som ligger i adsorpsjonslaget. Den avtar etter hvert som antall motioner i adsorpsjonslaget øker og kan bli lik null hvis ladningen til motionene er lik ladningen til kjernen. Partikkelen vil være i en isoelektrisk tilstand. Størrelsen på ζ-potensialet kan brukes til å bedømme stabiliteten til et dispergert system, dets struktur og elektrokinetiske egenskaper.
ζ-potensialet til forskjellige celler i kroppen varierer. Levende protoplasma er negativt ladet. Ved pH 7,4 er verdien av ζ-potensialet til erytrocytter fra -7 til -22 mV, hos mennesker er den -16,3 mV. Monocytter er omtrent 2 ganger lavere. Det elektrokinetiske potensialet beregnes ved å bestemme hastigheten til partikler i den dispergerte fasen under elektroforese.
Den elektroforetiske mobiliteten til partikler avhenger av en rekke mengder og beregnes ved å bruke Helmholtz-Smoluchowski-ligningen:
Hvor og ef- elektroforetisk mobilitet (elektroforesehastighet), m/s; ε er den relative permittiviteten til løsningen; ε 0 - elektrisk konstant, 8,9 10 -12 A s / W m; Δφ - potensialforskjell fra en ekstern strømkilde, V; ζ - elektrokinetisk potensial, V; η er viskositeten til dispersjonsmediet, N s/m 2 ; l- avstand mellom elektrodene, m; til f- koeffisient, hvis verdi avhenger av formen på den kolloidale partikkelen.
13.5. ELEKTROKINETISKE FENOMEN.
ELEKTROFORESE. ELEKTROFORESE
I MEDISINSK OG BIOLOGISK FORSKNING
Elektrokinetiske fenomener gjenspeiler forholdet som eksisterer mellom bevegelsen til fasene i et spredt system i forhold til hverandre og de elektriske egenskapene til grensesnittet mellom disse fasene. Det er fire typer elektrokinetiske fenomener – elektroforese, elektroosmose, strømningspotensial (strømning) og innsynkningspotensial (sedimentering). Elektrokinetiske fenomener ble oppdaget av F.F. Reiss. I et stykke våt leire senket han et stykke to glassrør, som han helte litt kvartssand i, helte vann til samme nivå og senket elektrodene (fig. 13.1).
Ved å lede en likestrøm fant Reiss at i anoderommet blir vannet over sandlaget grumsete på grunn av opptreden av en suspensjon av leirpartikler, samtidig synker vannstanden i kneet; i katoderøret forblir vannet klart, men nivået stiger. Basert på resultatene av eksperimentet kan vi konkludere med at leirpartikler som beveger seg mot den positive elektroden er negativt ladet, og det tilstøtende vannlaget er positivt ladet, når det beveger seg mot den negative polen.

Ris. 13.1. Elektrokinetiske fenomener med bevegelse av partikler i den dispergerte fasen
i et spredt system
Fenomenet med bevegelse av ladede partikler i den dispergerte fasen i forhold til partiklene i dispersjonsmediet under påvirkning av et elektrisk felt kalles elektroforese. Fenomenet med bevegelse av en væske i forhold til den faste fasen gjennom et porøst fast stoff (membran) kalles elektroosmose. Under betingelsene for det beskrevne eksperimentet ble to elektrokinetiske fenomener observert samtidig - elektroforese og elektroosmose. Bevegelsen av kolloidale partikler i et elektrisk felt er klare bevis på at kolloidale partikler bærer en ladning på overflaten.
En kolloidal partikkel - en micelle kan betraktes som et komplekst ion av enorm størrelse. En kolloidal løsning gjennomgår elektrolyse under påvirkning av likestrøm, kolloidale partikler overføres til anoden eller katoden (avhengig av ladningen til den kolloidale partikkelen). Dermed, elektroforese er elektrolyse av et svært spredt system.
Senere ble 2 fenomener motsatt elektroforese og elektroosmose oppdaget. Dorn oppdaget at når noen partikler legger seg i en væske, for eksempel sand i vann, oppstår en EMF mellom 2 elektroder satt inn på forskjellige punkter i væskekolonnen, kalt sedimentasjonspotensial (Dorn-effekt).
Når en væske tvinges gjennom en porøs skillevegg, på begge sider som det er elektroder, vises også en EMF - strømnings(strøm)potensial.
Den kolloidale partikkelen beveger seg med en hastighet proporsjonal med verdienζ -potensiell. Hvis systemet har en kompleks blanding, er det mulig å studere og separere det ved hjelp av elektroforesemetoden basert på den elektroforetiske mobiliteten til partikler. Dette er mye brukt i biomedisinsk forskning i form av makro- og mikroelektroforese.
Det genererte elektriske feltet får partiklene i den dispergerte fasen til å bevege seg med en hastighet proporsjonal med verdien av ζ-potensialet, som kan observeres ved å flytte grensesnittet mellom testløsningen og bufferen ved hjelp av optiske enheter. Som et resultat blir blandingen delt inn i en rekke fraksjoner. Ved registrering oppnås en kurve med flere topper, høyden på toppen er en kvantitativ indikator på innholdet i hver fraksjon. Denne metoden gjør det mulig å isolere og studere individuelle fraksjoner av blodplasmaproteiner. Elektroforegrammene av blodplasmaet til alle mennesker er normalt de samme. I patologi har de et karakteristisk utseende for hver sykdom. De brukes til å diagnostisere og behandle sykdommer. Elektroforese brukes til å skille aminosyrer, antibiotika, enzymer, antistoffer, etc. Mikroelektroforese består i å bestemme bevegelseshastigheten til partikler under et mikroskop, elektroforese - på papir. Fenomenet elektroforese oppstår under migrering av leukocytter til inflammatoriske foci. Immunelektroforese, diskelektroforese, isotakoforese etc. utvikles og implementeres nå som behandlingsmetoder, som løser mange medisinske og biologiske problemer, både forberedende og analytiske.
13.6. STABILITET PÅ KOLOID-LØSNINGER. SEDIMENTASJON, AGGREGASJON OG KONDENSASJONSSTABILITET AV LYOSOLER. FAKTORER SOM PÅVIRKER BÆREKRAFT
Spørsmålet om stabiliteten til kolloidale systemer er et veldig viktig spørsmål knyttet direkte til deres eksistens. Sedimentasjonsmotstand- motstand av partiklene i det dispergerte systemet til å sette seg under påvirkning av tyngdekraften.
Peskov introduserte begrepet aggregativ og kinetisk stabilitet. Kinetisk stabilitet- evnen til den spredte fasen av det kolloidale systemet til å være i suspendert tilstand, ikke til å sedimentere og motvirke tyngdekreftene. Høyt spredte systemer er kinetisk stabile.
Under aggregativ stabilitet det er nødvendig å forstå evnen til et dispergeringssystem til å opprettholde den opprinnelige spredningsgraden. Dette er kun mulig med en stabilisator. Konsekvensen av brudd på aggregativ stabilitet er kinetisk ustabilitet,
for aggregatene dannet av de innledende partiklene under påvirkning av tyngdekraften skiller seg ut (legger seg eller flyter opp).
Aggregativ og kinetisk stabilitet henger sammen. Jo større den aggregerte stabiliteten til systemet er, desto større er dens kinetiske stabilitet. Stabilitet bestemmes av resultatet av kampen mellom tyngdekraften og Brownsk bevegelse. Dette er et eksempel på manifestasjonen av enhetsloven og kampen for motsetninger. Faktorer som bestemmer stabiliteten til systemene: Brownsk bevegelse, spredning av partikler i den dispergerte fasen, viskositet og ionisk sammensetning av dispersjonsmediet, etc.
Stabilitetsfaktorer for kolloidale løsninger: tilstedeværelsen av en elektrisk ladning av kolloidale partikler. Partikler bærer samme ladning, så når de møtes, frastøter partiklene hverandre; evnen til å løse opp (hydratisere) ionene i det diffuse laget. Jo mer hydrert ionene i det diffuse laget er, jo tykkere er det totale hydreringsskallet, jo mer stabilt er systemet. De elastiske kreftene til solvatlagene har en kileeffekt på spredte partikler og hindrer dem i å nærme seg; adsorpsjonsstrukturerende egenskaper til systemer. Den tredje faktoren er relatert til adsorpsjonsegenskapene til disperse systemer. På den utviklede overflaten av den dispergerte fasen absorberes molekyler av overflateaktive stoffer (overflateaktive stoffer) og makromolekylære forbindelser (HMCs) lett. Store størrelser av molekyler som bærer sine egne solvatiseringslag skaper adsorpsjonssolvatiseringslag med betydelig lengde og tetthet på partikkeloverflaten. Slike systemer er i stabilitet nær lyofile systemer. Alle disse lagene har en viss struktur, de er laget i henhold til P.A. Rebinder strukturell-mekanisk barriere på veien for konvergens av dispergerte partikler.
13.7. ENESTE KOAGULERING. KOAGULERINGSREGLER. KINETIKK FOR KOAGULERING
Soler er termodynamisk ustabile systemer. Partiklene i den dispergerte fasen av solene har en tendens til å redusere den frie overflateenergien ved å redusere den spesifikke overflaten til de kolloidale partiklene, som oppstår når de kombineres. Prosessen med å kombinere kolloidale partikler til større aggregater, og til slutt utfelle dem, kalles koagulasjon.
Koagulasjon er forårsaket av ulike faktorer: mekanisk påvirkning, temperaturendringer (koking og frysing), stråling
ion, fremmedlegemer, spesielt elektrolytter, tid (aldring), konsentrasjon av den dispergerte fasen.
Den mest studerte prosessen er koagulering av soler med elektrolytter. Det er følgende regler for koagulering av soler med elektrolytter.
1. Alle elektrolytter er i stand til å forårsake koagulering av lyofobe soler. Den koagulerende effekten (P) besittes av ioner som har en ladning motsatt ladningen til granulen (potensialbestemmende ioner) og samme fortegn som motioner (Hurdys regel). Koagulering av positivt ladede soler er forårsaket av anioner.
2. Koagulasjonsevnen til ioner (P) avhenger av størrelsen på ladningen deres. Jo høyere ladning av ion, jo høyere koagulerende effekt. (Schulzes regel): PA1 3+ > PCa 2+ > PK + .
Følgelig, for koagulasjonsterskelen, kan vi skrive:
de. jo lavere ioneladning, jo høyere vil konsentrasjonen koagulere.
3. For ioner med samme ladning avhenger koagulasjonsevnen av radius (r) til det solvatiserte ion: jo større radius, desto større koagulasjonseffekt:

4. Hver elektrolytt er karakterisert ved en terskelkonsentrasjon av koagulasjonsprosessen for kolloidoppløsning (koagulasjonsterskel), dvs. den minste konsentrasjonen, uttrykt i millimol, som må tilsettes én liter av en kolloidal løsning for å få den til å koagulere. Koagulasjonsterskelen eller terskelkonsentrasjonen er betegnet C k. Koagulasjonsterskelen er en relativ karakteristikk av solens stabilitet med hensyn til en gitt elektrolytt og er den gjensidige av koagulasjonsevnen:
5. Koagulasjonseffekten til organiske ioner er større enn til uorganiske; koagulering av mange lyofobe soler skjer tidligere,
enn deres isoelektriske tilstand er nådd, hvor eksplisitt koagulering begynner. Denne handlingen kalles kritisk. Verdien er +30 mV.
Koagulasjonsprosessen for hvert dispergert system fortsetter med en viss hastighet. Koagulasjonshastighetens avhengighet av konsentrasjonen av den koagulerende elektrolytten er vist i fig. 13.2.

Ris. 13.2. Koagulasjonshastighetens avhengighet av konsentrasjonen av elektrolytter.
Forklaringer i teksten
Tre regioner og to karakteristiske punkter for A og B er identifisert. Området avgrenset av OA-linjen (langs konsentrasjonsaksen) kalles området for latent koagulasjon. Her er koagulasjonshastigheten nesten null. Dette er sol-stabilitetssonen. Mellom punktene A og B er det et område med langsom koagulering, hvor koagulasjonshastigheten avhenger av elektrolyttkonsentrasjonen. Punkt A tilsvarer den laveste elektrolyttkonsentrasjonen, hvor eksplisitt koagulering begynner (koagulasjonsterskel), og har en kritisk verdi. Dette stadiet kan bedømmes av ytre tegn: en endring i farge, utseendet på turbiditet. Det er en fullstendig ødeleggelse av det kolloidale systemet: frigjøring av stoffet i den dispergerte fasen til et bunnfall, som kalles koagulere. Ved punkt B begynner rask koagulering, dvs. alle kollisjoner av partikler er effektive og avhenger ikke av elektrolyttkonsentrasjonen. Ved punkt B er ζ-potensialet lik 0. Mengden stoff som er nødvendig for koagulering av en kolloid løsning avhenger av om elektrolytten tilsettes umiddelbart eller gradvis, i små porsjoner. Det har blitt observert at i sistnevnte tilfelle må mer substans tilsettes for å frembringe samme koagulasjonsfenomen. Dette fenomenet brukes i medikamentdosering.
Hvis du slår sammen to kolloidale løsninger med motsatt ladning, koagulerer de raskt. Prosessen er av elektrostatisk natur. Den brukes til industri- og avløpsvannbehandling. Ved vannverk tilsettes aluminiumsulfat eller jern(III)klorid til vannet før sandfiltre. Under deres hydrolyse dannes positivt ladede soler av metallhydroksider, som forårsaker koagulering av negativt ladede partikler av mikroflora, jord og organiske urenheter.
Koagulasjonsfenomener spiller en svært viktig rolle i biologiske systemer. Fullblod er en emulsjon. Dannede elementer av blod - en dispergert fase, plasma - et dispersjonsmedium. Plasma er et mer spredt system. Dispergert fase: proteiner, enzymer, hormoner. Blodkoagulasjonssystemet og antikoagulasjonssystemet fungerer. Den første leveres av trombin, som virker på fibrinogen og forårsaker dannelse av fibrinfilamenter (blodpropp). Erytrocytter sedimenterer med en viss hastighet (ESR). Koagulasjonsprosessen sikrer minimalt blodtap og dannelse av blodpropp i sirkulasjonssystemet. I patologi adsorberer erytrocytter store molekyler av gammaglobuliner og fibrinogener, og ESR øker. Den viktigste antikoagulerende evnen til blod er heparin antikoagulant av blod. I klinikker brukes koagulogrammer - et sett med tester for blodkoagulasjon og antikoagulasjon (protrombininnhold, plasma rekalcifiseringstid, heparintoleranse, totalt fibrinogen, etc.), dette er viktig for alvorlig blødning, med dannelse av blodpropp. Blodpropp må tas i betraktning når den konserveres. Ca 2+ -ioner fjernes med natriumnitrat for å felle ut, noe som øker koagulering. Påfør antikoagulant, heparin, dikumarin. Polymerer som brukes til endoproteseerstatning av elementer i det kardiovaskulære systemet må ha antitrombogene eller tromboresistente egenskaper.
13.8. STABILISERING AV KOLLOIDSYSTEMER (BESKYTTELSE AV KOLLOIDLØSNINGER)
Stabilisering av kolloide løsninger med hensyn til elektrolytter ved å lage ytterligere adsorpsjonslag på overflaten av kolloidale partikler med forbedrede strukturelle og mekaniske egenskaper, ved å tilsette en liten mengde av en løsning med høy
komolekulære forbindelser (gelatin, natriumkaseinat, eggalbumin, etc.) ble kalt kolloid beskyttelse. Beskyttede soler er svært motstandsdyktige mot elektrolytter. Den beskyttede solen får alle egenskapene til den adsorberte polymeren. Det dispergerte systemet blir lyofilt og derfor stabilt. Den beskyttende effekten av spiralen eller overflateaktivt middel er preget av et beskyttende nummer. Beskyttelsestallet skal forstås som minimumsmassen av spiral (i milligram) som må tilsettes 10 ml av testsolen for å beskytte den mot koagulering når 1 ml av en 10 % natriumkloridløsning innføres i systemene. Graden av beskyttende virkning av HMS-løsninger avhenger av: naturen til HMS, naturen til den beskyttede solen, graden av dispersjon, pH i mediet og urenheter.
Fenomenet kolloidal beskyttelse i kroppen spiller en svært viktig rolle i en rekke fysiologiske prosesser. Ulike proteiner, polysakkarider, peptider har en beskyttende effekt i kroppen. De adsorberer Ca på kolloidale partikler av slike hydrofobe kroppssystemer som karbonater, kalsiumfosfater, og oversetter dem til en stabil tilstand. Eksempler på beskyttede soler er blod og urin. Hvis du fordamper 1 liter urin, samler det resulterende bunnfallet og deretter prøver å løse det opp i vann, så krever dette 14 liter løsemiddel. Derfor er urin en kolloidal løsning der dispergerte partikler er beskyttet av albuminer, muciner og andre proteiner. Serumproteiner øker løseligheten av kalsiumkarbonat med nesten 5 ganger. Det økte innholdet av kalsiumfosfat i melk skyldes proteinbeskyttelse, som brytes under aldring.
I utviklingen av aterosklerose spiller leucetin-kolesterolbalansen en viktig rolle, i strid med hvilken forholdet mellom kolesterol, fosfolipider og proteiner endres, noe som fører til avsetning av kolesterol på veggene i blodårene, noe som resulterer i aterokalsinose. En stor rolle i beskyttelsen er gitt til komponenter med stor molekylær fett-protein. På den annen side skyldes blodets evne til å holde seg i oppløst tilstand i høye konsentrasjoner av karbon og oksygengasser også av proteiners beskyttende effekt. I dette tilfellet omslutter proteiner gassmikrobobler og beskytter dem mot å feste seg sammen.
Beskyttelse av kolloidale partikler som brukes til fremstilling av legemidler. I kroppen er det ofte nødvendig å introdusere medisinske stoffer i kolloidal tilstand slik at de blir jevnt fordelt i kroppen og absorbert. Så, kolloidale løsninger av sølv, kvikksølv, svovel beskyttet av proteinstoffer, brukt
som medikamenter (protargol, collargol, lysorginon), blir ikke bare ufølsomme for elektrolytter, men kan også fordampes til tørrhet. Den tørre resten etter behandling med vann blir igjen til en sol.
13.9. PEPTISERING
Peptisering - prosess, det motsatte av koagulering, prosessen med overgang av koagulatet til sol. Peptisering skjer når det tilsettes stoffer til bunnfallet (koagulatet) som letter overgangen av bunnfallet til en sol. De kalles pepti lunger. Vanligvis er peptisatorer potensialbestemmende ioner. For eksempel peptiseres et bunnfall av jern(III)hydroksid med jern(III)salter. Men løsningsmidlet (H 2 O) kan også spille rollen som en peptisator. Peptiseringsprosessen skyldes adsorpsjonsfenomener. Peptizeren letter dannelsen av en elektrisk dobbeltlagsstruktur og dannelsen av et zetapotensial.
Derfor skyldes peptiseringsprosessen hovedsakelig adsorpsjon av potensialbestemmende ioner og desorpsjon av motioner, noe som resulterer i en økning i ζ-potensialet til dispergerte partikler og en økning i graden av solvatisering (hydratisering), dannelse av solvatskall rundt partiklene som gir en kileeffekt (adsorpsjonspeptisering).
I tillegg til adsorpsjon er det også oppløsningspeptisering. Denne typen dekker alt når peptiseringsprosessen er assosiert med en kjemisk reaksjon av overflatemolekyler i den dispergerte fasen. Den består av to faser: dannelsen av en peptizer ved kjemisk reaksjon av den innførte elektrolytten til peptizeren med en dispergert partikkel; adsorpsjon av den resulterende peptisatoren på overflaten av den dispergerte fasen, noe som fører til dannelse av miceller og peptisering av bunnfallet. Et typisk eksempel på oppløsningspeptisering er peptisering av metallhydroksider med syrer.
Den maksimale finheten til solene oppnådd ved adsorpsjonspeptisering bestemmes av finhetsgraden til de primære partiklene som danner bunnfallsflakene. Under oppløsningspeptisering kan fragmenteringsgrensen til partikler forlate kolloidområdet og nå den molekylære spredningsgraden. Peptiseringsprosessen er av stor betydning i levende organismer, siden kolloidene av celler og biologiske væsker er konstant utsatt for virkningen av elektrolytter i kroppen.
Virkningen til mange vaskemidler, inkludert vaskemidler, er basert på fenomenet peptisering. Det kolloidale ionet av såpe er en dipol, det adsorberes av smusspartikler, gir dem en ladning og fremmer deres peptisering. Smuss i form av en sol fjernes lett fra overflaten.
13.10. GELER OG GELE. TIKSOTROPI. SYNERESE
Løsninger av spiraler og soler av noen hydrofobe kolloider er i stand til å gjennomgå endringer under visse forhold: tap av fluiditet, geldannelse, geldannelse av løsninger oppstår, og gelé og geler (fra latin "frosset") dannes.
Gelé (gelé)- disse er solide, ikke-flytende, strukturerte systemer som er et resultat av virkningen av molekylære kohesive krefter mellom kolloidale partikler eller makromolekyler av polymerer. Kreftene til intermolekylær interaksjon fører til dannelsen av en romlig nettramme, cellene til romlige masker er fylt med en flytende løsning, som en svamp dynket i væske. Dannelsen av gelé kan representeres som utsalting av spiralen eller det innledende stadiet av koagulering, forekomsten av koagulasjonsstrukturering.
En vandig løsning av gelatin, når blandingen varmes opp til 45 ° C, blir et homogent flytende medium. Når den avkjøles til romtemperatur, øker viskositeten til løsningen, systemet mister fluiditet, geler, konsistensen til den halvfaste massen beholder formen (den kan kuttes med en kniv).
Avhengig av arten av stoffene som danner geléen eller gelen, er det: bygget av harde partikler - skjøre (irreversible); dannet av fleksible makromolekyler - elastisk (reversibel). Sprø de dannes av kolloidale partikler (TiO 2, SiO 2). Tørket er et hardt skum med et stort spesifikt overflateareal. Tørket gelé sveller ikke, tørking forårsaker irreversible endringer.
Elastiske geler dannes av polymerer. Når de tørkes, deformeres de lett, komprimeres, en tørr polymer (pyrogel) oppnås, som beholder elastisiteten. Den er i stand til å svelle i et egnet løsemiddel, prosessen er reversibel og kan gjentas mange ganger.
Svake molekylære bindinger i gelé kan ødelegges mekanisk (ved risting, helling, temperatur). Å bryte bindingen forårsaker ødeleggelse av strukturen, partiklene får evnen
til termisk bevegelse flyter systemet og blir flytende. Etter en tid gjenoppretter strukturen seg spontant. Dette kan gjentas flere titalls ganger. Denne reversible transformasjonen kalles tiksotropi. Denne isotermiske transformasjonen kan representeres av ordningen:
Tixotropi observeres i svake løsninger av gelatin, celleprotoplasma. Reversibiliteten til tiksotropi indikerer at strukturering i de tilsvarende systemene skyldes intermolekylære (van der Waals) krefter - en koagulasjons-tiksotrop struktur.
Geler i kroppen er hjernen, huden, øyeeplet. Kondensasjons-krystalliseringstypen av struktur er preget av en sterkere kjemisk binding. I dette tilfellet brytes reversibiliteten til tiksotropiske endringer (kiselsyregel).
Geléen er en ikke-likevektstilstand i systemet, et visst stadium av den sakte pågående prosessen med faseseparasjon og systemets tilnærming til likevektstilstanden. Prosessen reduseres til den gradvise komprimeringen av gelérammen til en tettere kompakt masse med komprimering av den andre mobile væskefasen, som holdes mekanisk i rammens romlige rutenett. På overflaten av geléen under lagring vises det først separate dråper væske, over tid øker de og smelter sammen til en kontinuerlig masse av væskefasen. Denne spontane prosessen med peeling av gelé kalles synerese. For skjøre geléer er synerese en irreversibel aggregering av partikler, komprimering av hele strukturen. For spiralgelé kan økning av temperaturen stoppe syneresen og returnere geléen til sin opprinnelige posisjon. Separasjon av koagulerte blodpropper, herding av brød, bløtlegging av konfekt er eksempler på synerese. Vevene til unge mennesker er elastiske, inneholder mer vann, elastisiteten går tapt med alderen, mindre vann er synerese.
13.11. SPØRSMÅL OG OPPGAVER FOR EGENSJEKK
FORBEREDT TIL KLASSER OG EKSAMEN
1. Gi begrepet dispergerte systemer, dispergert fase og dispersjonsmedium.
2. Hvordan klassifiseres dispergeringssystemer i henhold til aggregeringstilstanden til den dispergerte fasen og dispersjonsmediet? Gi eksempler på biomedisinsk profil.
3. Hvordan klassifiseres dispergerte systemer etter styrken til intermolekylær interaksjon i dem? Gi eksempler på biomedisinsk profil.
4. Hoveddelen av "kunstig nyre"-apparatet er dialysatoren. Hva er prinsippet for enheten til den enkleste dialysatoren? Hvilke urenheter kan fjernes fra blodet ved dialyse? Hvilke faktorer påvirker dialysehastigheten?
5. På hvilke måter kan en løsning av et lavmolekylært stoff og en kolloidal løsning skilles? Hvilke egenskaper er disse metodene basert på?
6. På hvilke måter kan en sol skilles fra et grovt system? Hvilke egenskaper er disse metodene basert på?
7. Hva er metodene for å få kolloidalt spredte systemer? Hvordan skiller de seg fra hverandre?
8. Hva er trekk ved de molekylær-kinetiske og optiske egenskapene til kolloidalt spredte systemer? Hva skiller dem fra ekte løsninger og grove systemer?
9. Gi begrepet aggregativ, kinetisk og kondensasjonsstabilitet for disperse systemer. Faktorer som bestemmer stabiliteten til systemene.
10. Vis sammenhengen mellom de elektrokinetiske egenskapene til kolloidalt dispergerte systemer.
11. Hvilke elektrokinetiske fenomener observeres under mekanisk blanding av partiklene i den dispergerte fasen: a) i forhold til dispersjonsmediet; b) i forhold til partiklene i den dispergerte fasen?
12. Forklar hvilke av følgende preparater som refererer til kolloide løsninger: a) et preparat av bariumsulfat i vann, brukt som kontrastmiddel i røntgenstudier med en partikkelstørrelse på 10 -7 m; b) et preparat av sølv i vann - collargol, brukt til å behandle purulente sår med en partikkelstørrelse på 10 -9 m.
13. Konseptet med koagulering av soler. Koagulering av lyofile soler. Hva er de ytre tegnene på koagulasjon? Spesifiser mulige koagulasjonsprodukter av soler.
14. Faktorer som forårsaker koagulering av soler. Regler for koagulering av soler med elektrolytter. Kinetikk av koagulasjon. koagulasjonsterskel.
15. Som et resultat av brudd på mikro (Ca 2+) - og makro (C 2 O 4 2-) -element og syre-base homeostase i mage-tarmkanalen, oppstår følgende reaksjon i nyrene:
Hva er ladningen til solen? Hvilke av de angitte ionene vil ha en koagulerende effekt for partiklene til denne solen: K + , Mg 2+ , SO 4 2- , NO 3 - , PO 4 3- , Al 3+ ?
En kalsiumoksalatsol dannes. La oss skrive ned formelen til micellen til solen
(13.3.).

Ladningen av granulen til solen er positiv, noe som betyr at ionene vil ha en koagulerende effekt (k) for partiklene til denne solen: SO 4 2-, PO 4 3-, NO 3 -, etter Hardys regel. Jo høyere ladning det koagulerende ion har, desto sterkere er dets koagulerende effekt (Schulzes regel). I henhold til Schulze-regelen kan disse anionene ordnes i følgende rad: C til P0 4 3-> C til SO 4 2-> C til NO 3 -. Jo lavere ioneladning, jo høyere konsentrasjoner vil forårsake koagulasjon. Koagulasjonsterskelen (p) er en relativ karakteristikk av solens stabilitet i forhold til en gitt elektrolytt og er den gjensidige av
13.12. TESTER
1. Velg feil utsagn:
a) kondensasjonsmetoder for å oppnå kolloidale løsninger inkluderer OVR, hydrolyse, løsningsmiddelerstatning;
b) dispersjonsmetoder for å oppnå kolloidale løsninger inkluderer mekanisk, ultralyd, peptisering;
c) optiske egenskaper til kolloidale systemer inkluderer opalescens, diffraksjon, Tyndall-effekten;
d) de molekylær-kinetiske egenskapene til kolloidale systemer inkluderer Brownsk bevegelse, lysspredning og en endring i fargen på løsningen.
2. Velg feil utsagn:
a) elektroforese er bevegelsen av en dispergert fase i et elektrisk felt i forhold til et stasjonært dispersjonsmedium;
b) elektroosmose er bevegelsen i det elektriske feltet til dispersjonsmediet i forhold til den stasjonære dispergerte fasen;
c) penetrering av væsker som inneholder terapeutiske ioner og molekyler gjennom kapillærsystemet under påvirkning av et elektrisk felt kalles elektrodialyse;
d) elektroforese brukes til å skille proteiner, nukleinsyrer og blodceller.
3. En kolloid løsning som har mistet flyten er:
a) emulsjon;
b) gel;
c) sol;
d) suspensjon.
4. Blodplasma er:
a) sol;
b) gel;
c) sann løsning;
d) emulsjon.
5. Et heterogent system som består av en mikrokrystall av en dispergert fase omgitt av solvatiserte stabilisatorioner kalles:
a) et granulat;
b) kjernen;
c) enheten;
d) micelle.
6. Når en micelle dannes, adsorberes potensialbestemmende ioner i henhold til regelen:
a) Schulze-Hardy;
b) Gjenbinder;
c) Panet Fajanse;
d) Shilova.
7. Et micellegranulat er et aggregat:
a) sammen med adsorpsjonslaget;
b) diffusjonslag;
c) adsorpsjons- og diffusjonslag;
d) potensialbestemmende ioner.
8. Grensesnittpotensialet er potensialet mellom:
a) faste og flytende faser;
b) adsorpsjon og diffuse lag ved glidegrensen;
c) kjerne og motioner;
d) potensialbestemmende ioner og motioner.
9. Evnen til finporøse membraner til å beholde partikler av den dispergerte fasen og fritt passere ioner og molekyler kalles:
I verden rundt oss er rene stoffer ekstremt sjeldne; i utgangspunktet er de fleste stoffene på jorden og i atmosfæren forskjellige blandinger som inneholder mer enn to komponenter. Partikler som varierer i størrelse fra ca. 1 nm (flere molekylstørrelser) til 10 µm kalles fordelt(lat. dispergo - å spre, sprøyte). En rekke systemer (uorganiske, organiske, polymere, proteiner), der minst ett av stoffene er i form av slike partikler, kalles dispergert. fordelt - dette er heterogene systemer som består av to eller flere faser med et høyt utviklet grensesnitt mellom dem eller en blanding bestående av minst to stoffer som er fullstendig eller praktisk talt ikke blandbare med hverandre og som ikke reagerer kjemisk med hverandre. En av fasene, den dispergerte fasen, består av meget fine partikler fordelt i den andre fasen, dispersjonsmediet.
Dispersjonssystem
I henhold til aggregeringstilstanden kan dispergerte partikler være faste, flytende, gassformige og i mange tilfeller ha en kompleks struktur. Dispersjonsmedier kan også være gassformige, flytende og faste. De fleste av de virkelige kroppene i verden rundt oss eksisterer i form av spredte systemer: sjøvann, jord og jord, vev av levende organismer, mange tekniske materialer, matvarer, etc.
Klassifisering av spredte systemer
Til tross for utallige forsøk på å foreslå en enhetlig klassifisering av disse systemene, mangler den fortsatt. Årsaken ligger i det faktum at i enhver klassifisering ikke alle egenskapene til disperse systemer tas som et kriterium, men bare en av dem. Vurder de vanligste klassifiseringene av kolloidale og mikroheterogene systemer.
I ethvert kunnskapsfelt, når man må forholde seg til komplekse objekter og fenomener, for å lette og etablere visse mønstre, er det tilrådelig å klassifisere dem i henhold til et eller annet trekk. Dette gjelder også for feltet disperse systemer; til forskjellige tider ble forskjellige klassifiseringsprinsipper foreslått for dem. I henhold til intensiteten av interaksjon mellom stoffene i dispersjonsmediet og den dispergerte fasen, skilles lyofile og lyofobe kolloider. Andre metoder for klassifisering av disperse systemer er kort skissert nedenfor.
Klassifisering etter tilstedeværelse eller fravær av interaksjonmellom partiklene i den dispergerte fasen. I henhold til denne klassifiseringen er dispergerte systemer delt inn i fritt dispergert og koherent spredt; klassifiseringen gjelder kolloidale løsninger og løsninger av makromolekylære forbindelser.
Svobodnodispersnye-systemer inkluderer typiske kolloidale løsninger, suspensjoner, suspensjoner, forskjellige løsninger av makromolekylære forbindelser, som har flytbarhet, som vanlige væsker og løsninger.
De såkalte strukturerte systemene, der det, som et resultat av samspillet mellom partikler, oppstår et romlig åpent mesh-rammeverk, og systemet som helhet får egenskapen til en halvfast kropp, klassifiseres som forbundet-dispergerte. . For eksempel mister soler av visse stoffer og løsninger av makromolekylære forbindelser med en reduksjon i temperatur eller med en økning i konsentrasjon over en kjent grense, uten å gjennomgå noen ytre endringer, flytbarheten - gelatinisere (gelificere), gå inn i en gel (gelé) stat. Dette inkluderer også konsentrerte pastaer, amorfe utfellinger.
Klassifisering etter spredning. Stoffets fysiske egenskaper avhenger ikke av kroppens størrelse, men ved høy grad av sliping blir de en funksjon av spredning. For eksempel har metallsoler forskjellige farger avhengig av slipegraden. Så kolloidale løsninger av gull med ekstremt høy spredning er lilla, mindre spredt - blå, enda mindre - grønn. Det er grunn til å tro at andre egenskaper til solene til samme stoff endres med sliping: Dette antyder et naturlig kriterium for klassifisering av kolloidale systemer i henhold til spredning, dvs. separasjonen av området til den kolloidale tilstanden (10 -5 - 10 -7 cm) til en rekke smalere intervaller. En slik klassifisering ble en gang foreslått, men den viste seg å være ubrukelig, siden kolloidale systemer nesten alltid er polydisperse; monodisperse er svært sjeldne. I tillegg kan graden av spredning endres over tid, dvs. den avhenger av systemets alder.
Kolloidal kjemi er en vitenskap som studerer metoder for å oppnå, sammensetning, indre struktur, kjemiske og fysiske egenskaper til disperse systemer. Dispergerte systemer er systemer som består av fragmenterte partikler (dispergert fase) fordelt i det omgivende (dispergerte) mediet: gasser, væsker eller faste stoffer. Partikkelstørrelsene til den dispergerte fasen (krystaller, dråper, bobler) varierer i graden av dispergering, hvis verdi er direkte proporsjonal med partikkelstørrelsen. I tillegg er dispergerte partikler også preget av andre egenskaper, som regel av den dispergerte fasen og mediet.
Disperger systemer og deres klassifisering
Alle dispersjonssystemer i henhold til partikkelstørrelsen til dispersjonsfasen kan klassifiseres i molekylær-ionisk (mindre enn én nm), kolloidal (fra én til hundre nm), grov (mer enn hundre nm).
Molekylært spredte systemer. Disse systemene inneholder partikler hvis størrelse ikke overstiger en nm. Denne gruppen inkluderer en rekke ekte løsninger av ikke-elektrolytter: glukose, urea, alkohol, sukrose.
Grove systemer preget av de største partiklene. Disse inkluderer emulsjoner og suspensjoner. Dispergerte systemer der et fast stoff er lokalisert i et flytende dispersjonsmedium (stivelsesløsning, leire) kalles suspensjoner. Emulsjoner er systemer som oppnås ved å blande to væsker, hvor den ene er dispergert i form av dråper i en annen (olje, toluen, benzen i vann eller dråper triacylglyceroler (fett) i melk.
Kolloidale spredningssystemer. Deres størrelse når opp til 100 nm. Slike partikler trenger lett gjennom porene til papirfiltre, men trenger ikke gjennom porene til biologiske membraner til planter og dyr. Siden kolloidale partikler (miceller) har en elektrisk ladning og solvater ioniske skall, på grunn av at de forblir i en suspendert tilstand, kan det hende at de ikke utfelles i tilstrekkelig lang tid. Et slående eksempel er løsninger av gelatin, albumin, gummi arabicum, gull og sølv.
Gjør det mulig å skille mellom homogene og heterogene spredte systemer. I homogene dispergerte systemer males fasepartikler til molekyler, atomer og ioner. Et eksempel på slike dispersjonssystemer kan være en løsning av glukose i vann (molekylært dispersjonssystem) og kjøkkensalt i vann (ionisk dispersjonssystem). De er Størrelsen på molekylene i den dispergerte fasen overstiger ikke en nanometer.
Spredte systemer og løsninger
Av alle de presenterte systemene og løsningene i livet til levende organismer, er kolloidalt spredte systemer av størst betydning. Som du vet, er det kjemiske grunnlaget for eksistensen av en levende organisme utveksling av proteiner i den. I gjennomsnitt er konsentrasjonen av proteiner i kroppen fra 18 til 21%. De fleste proteiner løses opp i vann (konsentrasjonen av dette hos mennesker og dyr er omtrent 65%) og danner kolloidale løsninger.
Det er to grupper kolloidale løsninger: flytende (soler) og gellignende (geler). Alle vitale prosesser som skjer i levende organismer er assosiert med den kolloidale tilstanden til materie. I hver levende celle er biopolymerer (nukleinsyrer, proteiner, glykosaminoglykaner, glykogen) i form av spredte systemer.
Kolloide løsninger er utbredt og inkluderer i slike løsninger olje, tekstiler, plast Mange matprodukter kan tilskrives kolloide løsninger: kefir, melk, etc. De fleste medikamenter (sera, antigener, vaksiner) er kolloidale løsninger. Kolloide løsninger inkluderer også maling.
Heterogen eller heterogen, regnes som et system som består av to eller flere faser. Hver fase har sitt eget grensesnitt, som kan separeres mekanisk.
Et inhomogent system består av en dispergert (intern) fase og et dispersivt (eksternt) medium som omgir partiklene i den dispergerte fasen.
Systemer der væsker er ytre fase kalles inhomogene væskesystemer, og systemer der gasser er ytre fase kalles inhomogene gasssystemer. Heterogene systemer kalles ofte spredte systemer.
Det er følgende typer heterogene systemer: suspensjoner, emulsjoner, skum, støv, røyk, tåke.
Suspensjon er et system som består av en flytende dispersjonsfase og en fast dispersjonsfase (f.eks. sauser med mel, stivet melk, melasse med sukkerkrystaller). Suspensjoner, avhengig av partikkelstørrelsen, er delt inn i grove (partikkelstørrelse mer enn 100 mikron), fin (0,1–100 mikron) og kolloidale (0,1 mikron eller mindre).
Emulsjon- dette er et system som består av en væske og dråper av en annen væske fordelt i den som ikke blandes med den første (for eksempel melk, en blanding av vegetabilsk olje og vann). Under påvirkning av tyngdekraften separeres emulsjonene, men med små dråpestørrelser (mindre enn 0,4–0,5 μm) eller med tilsetning av stabilisatorer blir emulsjonene stabile, ute av stand til å separere over en lang periode.
En økning i konsentrasjonen av den dispergerte fasen kan forårsake dens overgang til den dispergerte fasen, og omvendt. En slik gjensidig overgang kalles faseinversjon Det finnes gassemulsjoner der dispersjonsmediet er en væske, og den dispergerte fasen er en gass.
Skum er et system som består av en flytende dispergert fase og gassbobler fordelt i den (gassdispergert fase) (for eksempel kremer og andre piskede produkter). Skum er nær emulsjoner i sine egenskaper. Emulsjoner og skum er preget av faseinversjon.
Støv, røyk, tåke er aerosoler.
 Aerosoler kalt et dispergert system med et gassformig dispersjonsmedium og en fast eller flytende dispergert fase, som består av partikler fra en kvasimolekylær til en mikroskopisk størrelse, som har egenskapen til å være i suspensjon i mer eller mindre lang tid (f.eks. melstøv dannet under, sikting, transport av mel; sukkerstøv generert ved , etc.). Røyk dannes når fast brensel forbrennes, tåke dannes når damp kondenserer.
Aerosoler kalt et dispergert system med et gassformig dispersjonsmedium og en fast eller flytende dispergert fase, som består av partikler fra en kvasimolekylær til en mikroskopisk størrelse, som har egenskapen til å være i suspensjon i mer eller mindre lang tid (f.eks. melstøv dannet under, sikting, transport av mel; sukkerstøv generert ved , etc.). Røyk dannes når fast brensel forbrennes, tåke dannes når damp kondenserer.
I aerosoler er dispersjonsmediet gass eller luft, mens den dispergerte fasen i støv og røyk er faste stoffer, og i tåke er det flytende. Størrelsen på faste støvpartikler er 3–70 µm, røyk er 0,3–5 µm.
Tåke er et system som består av et gassdispersjonsmedium og væskedråper fordelt i det (væskedispergert fase). Størrelsen på væskedråper dannet som følge av kondens i tåke er 0,3–3 µm. En kvalitativ indikator som karakteriserer jevnheten til aerosolpartikler i størrelse er graden av spredning.
En aerosol kalles monodispers når dens bestanddeler partikler er av samme størrelse, og polydispers når den inneholder partikler av forskjellig størrelse. Monodisperse aerosoler eksisterer praktisk talt ikke i naturen. Bare noen aerosoler nærmer seg monodisperse systemer i partikkelstørrelse (hyfer av sopp, spesielt oppnådde tåker, etc.).
Dispergerte eller heterogene systemer, avhengig av antall dispergerte faser, kan være enkelt- eller multikomponent. For eksempel er et multikomponentsystem melk (det har to spredte faser: fett og protein); sauser (dispergerte faser er mel, fett, etc.).
Både dispersjonsmediet og den dispergerte fasen kan være sammensatt av stoffer i forskjellige aggregeringstilstander. Avhengig av kombinasjonen av tilstander til dispersjonsmediet og den dispergerte fasen, kan åtte typer slike systemer skilles ut
Klassifisering av disperse systemer i henhold til deres aggregeringstilstand
|
Dispersjonsmedium |
Dispergert fase |
Eksempler på noen naturlige og innenlandske spredningssystemer |
|
Væske |
Tåke, assosiert gass med oljedråper, forgasserblanding i bilmotorer (bensindråper i luften) |
|
|
Fast |
Støv i luften, røyk, smog, simums (støv- og sandstormer) |
|
|
Væske |
Sprudlende drikker, badeskum |
|
|
Væske |
Kroppsvæsker (blodplasma, lymfe, fordøyelsessaft), flytende innhold av celler (cytoplasma, karyoplasma) |
|
|
Fast |
Kyss, gelé, lim, elv eller sjøslam suspendert i vann, mørtel |
|
|
Fast |
Snøskorpe med luftbobler i, jord, tekstilstoffer, murstein og keramikk, skumgummi, luftsjokolade, pulver |
|
|
Væske |
Våt jord, medisinske og kosmetiske produkter (salver, mascara, leppestift, etc.) |
|
|
Fast |
Steiner, fargede glass, noen legeringer |
Som en klassifiseringsfunksjon kan man også skille ut et slikt konsept som partikkelstørrelsen til et dispergert system:
- - Grov (> 10 µm): sukker, jord, tåke, regndråper, vulkansk aske, magma, etc.
- - Middels dispergert (0,1-10 mikron): menneskelige røde blodlegemer, E. coli, etc.
dispergert emulsjonssuspensjonsgel
- - Høyt spredt (1-100 nm): influensavirus, røyk, turbiditet i naturlig vann, kunstig oppnådde soler av forskjellige stoffer, vandige løsninger av naturlige polymerer (albumin, gelatin, etc.), etc.
- - Nanoskala (1-10 nm): glykogenmolekyl, fine porer av kull, metallsoler oppnådd i nærvær av organiske molekyler som begrenser veksten av partikler, karbonnanorør, magnetiske nanotråder laget av jern, nikkel, etc.
Grove systemer: emulsjoner, suspensjoner, aerosoler
I henhold til størrelsen på partiklene til stoffet som utgjør den dispergerte fasen, er dispergerte systemer delt inn i grove med partikkelstørrelser på mer enn 100 nm og fint dispergerte med partikkelstørrelser fra 1 til 100 nm. Hvis stoffet er fragmentert til molekyler eller ioner mindre enn 1 nm i størrelse, dannes et homogent system - en løsning. Løsningen er homogen, det er ingen grensesnitt mellom partiklene og mediet, og derfor gjelder den ikke for dispergerte systemer. Grovt dispergerte systemer er delt inn i tre grupper: emulsjoner, suspensjoner og aerosoler.
Emulsjoner er dispergerte systemer med et flytende dispersjonsmedium og en væskedispergert fase.
De kan også deles inn i to grupper: 1) direkte - dråper ikke-polar væske i et polart medium (olje i vann); 2) revers (vann i olje). Endringer i sammensetningen av emulsjoner eller ytre påvirkninger kan føre til transformasjon av en direkte emulsjon til en omvendt og omvendt. Eksempler på de mest kjente naturlige emulsjonene er melk (forward emulsjon) og olje (invers emulsjon). En typisk biologisk emulsjon er fettdråper i lymfen.
Av emulsjonene som er kjent i menneskelig praksis, kan man nevne skjærevæsker, bituminøse materialer, plantevernmiddelpreparater, medisiner og kosmetikk og matvarer. For eksempel, i medisinsk praksis, er fettemulsjoner mye brukt for å gi energi til en sultende eller svekket organisme ved intravenøs infusjon. For å oppnå slike emulsjoner brukes oliven-, bomullsfrø- og soyaoljer. I kjemisk teknologi er emulsjonspolymerisasjon mye brukt som hovedmetode for fremstilling av gummi, polystyren, polyvinylacetat, etc. Suspensjoner er grovt dispergerte systemer med en fast dispergert fase og et flytende dispersjonsmedium.
Vanligvis er partiklene i den dispergerte fasen av suspensjonen så store at de legger seg under påvirkning av tyngdekraften - sediment. Systemer der sedimenteringen går veldig sakte på grunn av den lille forskjellen i tettheten til den dispergerte fasen og dispersjonsmediet kalles også suspensjoner. Praktisk betydningsfulle bygningsoppheng er kalkmaling ("kalkmelk"), emaljemaling, forskjellige bygningsoppheng, for eksempel de som kalles "sementmørtel". Suspensjoner inkluderer også medisiner, for eksempel flytende salver - linimenter. En spesiell gruppe består av grovt dispergerte systemer, hvor konsentrasjonen av den dispergerte fasen er relativt høy sammenlignet med dens lave konsentrasjon i suspensjoner. Slike spredte systemer kalles pastaer. For eksempel dental, kosmetikk, hygienisk osv. kjent for deg fra hverdagen.
Aerosoler er grovt spredte systemer der dispergeringsmediet er luft, og den dispergerte fasen kan være væskedråper (skyer, en regnbue, hårspray eller deodorant frigjort fra en sprayboks) eller faste partikler (støvsky, tornado)
Kolloidale systemer - i dem når størrelsene på kolloidale partikler opp til 100 nm. Slike partikler trenger lett gjennom porene til papirfiltre, men trenger ikke gjennom porene til biologiske membraner til planter og dyr. Siden kolloidale partikler (miceller) har en elektrisk ladning og solvater ioniske skall, på grunn av at de forblir i en suspendert tilstand, kan det hende at de ikke utfelles i tilstrekkelig lang tid. Et slående eksempel på et kolloidalt system er løsninger av gelatin, albumin, gummi arabicum, kolloide løsninger av gull og sølv.
Kolloidale systemer inntar en mellomposisjon mellom grove systemer og sanne løsninger. De er vidt distribuert i naturen. Jord, leire, naturlig vann, mange mineraler, inkludert noen edelstener, er alle kolloidale systemer.
Det er to grupper kolloide løsninger: væske (kolloide løsninger - soler) og gel-lignende (gelé - geler).
De fleste av de biologiske væskene i cellen (den allerede nevnte cytoplasma, kjernesaft - karyoplasma, innholdet i vakuoler) og den levende organismen som helhet er kolloidale løsninger (soler). Alle vitale prosesser som skjer i levende organismer er assosiert med den kolloidale tilstanden til materie. I hver levende celle er biopolymerer (nukleinsyrer, proteiner, glykosaminoglykaner, glykogen) i form av spredte systemer.
Geler er kolloidale systemer der partiklene i den dispergerte fasen danner en romlig struktur.
Geler kan være: mat - marmelade, marshmallow, gelé kjøtt, gelé; biologisk - brusk, sener, hår, muskel- og nervevev, kropper av maneter; kosmetikk - dusjgeler, kremer; medisinske medisiner, salver; mineral - perler, opal, karneol, kalsedon.
Kolloidale systemer er av stor betydning for biologi og medisin. Sammensetningen av enhver levende organisme inkluderer faste, flytende og gassformige stoffer som er i et komplekst forhold til miljøet. Fra et kjemisk synspunkt er organismen som helhet et komplekst sett av mange kolloidale systemer.
Biologiske væsker (blod, plasma, lymfe, cerebrospinalvæske, etc.) er kolloidale systemer der organiske forbindelser som proteiner, kolesterol, glykogen og mange andre er i kolloidal tilstand. Hvorfor gir naturen ham en slik preferanse? Denne funksjonen henger først og fremst sammen med det faktum at stoffet i kolloidal tilstand har et stort grensesnitt mellom fasene, noe som bidrar til en bedre flyt av metabolske reaksjoner.
Eksempler på naturlige og kunstige spredningssystemer. Mineraler og bergarter som naturlige blandinger
Hele naturen rundt oss - organismene til dyr og planter, hydrosfæren og atmosfæren, jordskorpen og tarmene er et komplekst sett av mange forskjellige og mangfoldige grove og kolloidale systemer. Skyene på planeten vår er de samme levende enhetene som all naturen som omgir oss. De er av stor betydning for jorden, siden de er informasjonskanaler. Tross alt består skyer av det kapillære stoffet av vann, og vann er som du vet et veldig godt lager av informasjon. Vannsyklusen i naturen fører til at informasjon om planetens tilstand og humøret til mennesker akkumuleres i atmosfæren, og sammen med skyer beveger seg gjennom hele jordens rom. En fantastisk naturskapning er en sky som gir en person glede, estetisk nytelse og bare et ønske om å noen ganger se på himmelen.
Tåke kan også være et eksempel på et naturlig dispergert system, akkumulering av vann i luften, når de minste kondensasjonsproduktene av vanndamp dannes (ved lufttemperaturer over? 10 ° - de minste vanndråpene, ved? 10 .. ? 15 ° - en blanding av vanndråper og iskrystaller, ved temperaturer under 15 ° - iskrystaller som glitrer i solens stråler eller i lyset fra månen og lyktene). Relativ fuktighet under tåke er vanligvis nær 100 % (minst over 85-90 %). Men i alvorlig frost (? 30 ° og lavere) i bosetninger, på jernbanestasjoner og flyplasser, kan tåke observeres ved enhver relativ luftfuktighet (til og med mindre enn 50%) - på grunn av kondensering av vanndamp som dannes under forbrenning av drivstoff (i motorer, ovner osv.) og slippes ut i atmosfæren gjennom eksosrør og skorsteiner.
Den kontinuerlige varigheten av tåke varierer vanligvis fra flere timer (og noen ganger en halv time eller en time) til flere dager, spesielt i den kalde perioden av året.
Tåke hindrer normal drift av alle typer transport (spesielt luftfart), så tåkeprognoser er av stor nasjonal økonomisk betydning.
Et eksempel på et komplekst dispergert system er melk, hvis hovedkomponenter (ikke medregnet vann) er fett, kasein og melkesukker. Fett er i form av en emulsjon og når melken står, stiger den gradvis til toppen (fløte). Kasein finnes i form av en kolloid løsning og frigjøres ikke spontant, men kan lett utfelles (i form av cottage cheese) når melk surgjøres, for eksempel med eddik. Under naturlige forhold skjer frigjøring av kasein under suring av melk. Til slutt er melkesukker i form av en molekylær løsning og frigjøres bare når vannet fordamper.
Mange gasser, væsker og faste stoffer løses opp i vann. Sukker og bordsalt løses lett opp i vann; karbondioksid, ammoniakk og mange andre stoffer, som kolliderer med vann, går i løsning og mister sin tidligere aggregeringstilstand. Et løst stoff kan skilles fra en løsning på en bestemt måte. Hvis en løsning av bordsalt fordampes, forblir saltet i form av faste krystaller.
Når stoffer løses opp i vann (eller annet løsemiddel), dannes et homogent (homogent) system. En løsning er således et homogent system som består av to eller flere komponenter. Løsninger kan være flytende, faste eller gassformige. Flytende løsninger inkluderer for eksempel en løsning av sukker eller vanlig salt i vann, alkohol i vann og lignende. Faste løsninger av ett metall i et annet inkluderer legeringer: messing er en legering av kobber og sink, bronse er en legering av kobber og tinn og lignende. Et gassformig stoff er luft eller generelt en hvilken som helst blanding av gasser.
 Konvertering av en desimalbrøk til en vanlig brøk og omvendt: en regel, eksempler
Konvertering av en desimalbrøk til en vanlig brøk og omvendt: en regel, eksempler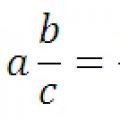 Konvertering av desimaltall til vanlige brøker
Konvertering av desimaltall til vanlige brøker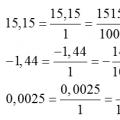 Konvertering av en vanlig brøk til en desimalbrøk og omvendt, regler, eksempler
Konvertering av en vanlig brøk til en desimalbrøk og omvendt, regler, eksempler