Kjemiske egenskaper til arenes. Generell formel og kjennetegn ved arenes
ENRENES
Aromatiske hydrokarboner (arener) – sykliske hydrokarboner, forent av begrepet aromatisitet, som bestemmer vanlige egenskaper i struktur og kjemiske egenskaper.
Klassifikasjon
Basert på antall benzenringer i molekylet deles arener inn i til:
mononukleær
flerkjerne

Nomenklatur og isomeri
Den strukturelle stamfaren til hydrokarboner i benzenserien er benzen C 6 H 6 hvorfra de systematiske navnene på homologer er avledet.
For monosykliske forbindelser beholdes følgende ikke-systematiske (trivielle) navn:

Posisjonen til substituentene er angitt i de minste tallene (nummereringsretningen spiller ingen rolle),
|
|
|
og for di-substituerte forbindelser kan du bruke notasjonen orto, meta, par.
|
|
|
|
Hvis det er tre substituenter i ringen, skal de få de laveste tallene, dvs. raden "1,2,4" har en fordel fremfor "1,3,4".


1,2-dimetyl-4-etylbenzen (riktig navn) 3,4-dimetyl-1-etylbenzen (feil navn)
Isomerismen til monosubstituerte arener skyldes strukturen til karbonskjelettet til substituenten i di- og polysubstituerte benzenhomologer, ytterligere isomerisme er forårsaket av det forskjellige arrangementet av substituenter i kjernen.
Isomerisme av aromatiske hydrokarboner med sammensetningen C 9 H 12:
|
|
|
|
|
Fysiske egenskaper
Koke- og smeltepunktene til arener er høyere enn for alkaner, alkener, alkyner, de er litt polare, uløselige i vann og svært løselige i ikke-polare organiske løsningsmidler. Arenaer er væsker eller faste stoffer som har spesifikke lukter. Benzener og mange kondenserte arener er giftige, noen av dem har kreftfremkallende egenskaper. Mellomprodukter av oksidasjon av kondenserte arener i kroppen er epoksider, som enten selv direkte forårsaker kreft eller er forløpere til kreftfremkallende stoffer.
Får arenaer
Mange aromatiske hydrokarboner er av stor praktisk betydning og produseres i stor industriell skala. En rekke industrielle metoder er basert på prosessering av kull og olje.
Olje består hovedsakelig av alifatiske og alicykliske hydrokarboner for å omdanne alifatiske eller asykliske hydrokarboner til aromatiske, det er utviklet metoder for aromatisering av olje, hvis kjemiske grunnlag ble utviklet av N.D. Zelinsky, B.A. Kazansky.
1. Cyclisering og dehydrogenering:
2. Hydrodesmetylering:

3. Benzenhomologer fremstilles ved alkylering eller acylering etterfulgt av reduksjon av karbonylgruppen.
a) Friedel-Crafts alkylering:

b) Friedel-Crafts acylering:

4. Fremstilling av bifenyl ved Wurtz-Fitting-reaksjonen:
5. Fremstilling av difenylmetan ved Friedel-Crafts-reaksjonen:
Struktur og kjemiske egenskaper.
Aromatiske kriterier:
Basert på teoretiske beregninger og eksperimentelle studier av sykliske konjugerte systemer, ble det funnet at en forbindelse er aromatisk hvis den har:
- Flatt syklisk σ-skjelett;
- Et konjugert lukket π-elektronsystem som dekker alle atomer i ringen og inneholder 4n + 2, hvor n = 0, 1, 2, 3, etc. Denne formuleringen er kjent som Hückels regel.
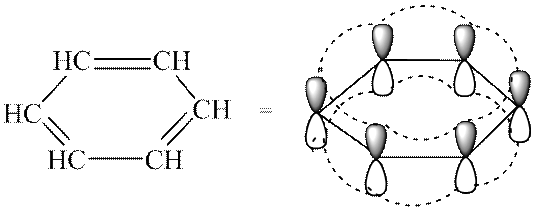
Aromasitetskriterier lar en skille konjugerte aromatiske systemer fra alle andre. Benzen inneholder en sekstett av π elektroner og følger Hückels regel ved n = 1.
Hva gir aromatisitet:
Til tross for den høye graden av umettethet er aromatiske forbindelser motstandsdyktige mot oksidasjonsmidler og temperatur, og de er mer utsatt for å gjennomgå substitusjonsreaksjoner i stedet for addisjonsreaksjoner. Disse forbindelsene har økt termodynamisk stabilitet, noe som sikres av den høye konjugasjonsenergien til det aromatiske ringsystemet (150 kJ/mol), og derfor inngår arener fortrinnsvis i substitusjonsreaksjoner, som et resultat av at de beholder aromatisiteten.
Mekanisme for elektrofile substitusjonsreaksjoner i den aromatiske ringen:
Elektrontettheten til det π-konjugerte systemet til benzenringen er et praktisk mål for angrep av elektrofile reagenser.
Vanligvis genereres elektrofile reagenser under en reaksjon ved bruk av katalysatorer og passende forhold.
E – Y → E δ + – Y δ - → E + + Y - Dannelse av et π-kompleks. Det første angrepet av elektrofilen til π-elektronskyen i ringen fører til koordinering av reagenset med π-systemet og dannelsen av et donor-akseptortype kompleks kaltπ-kompleks.

Aromasystemet er ikke forstyrret: Dannelse av σ-komplekset. Det begrensende stadiet, der elektrofilen danner en kovalent binding med et karbonatom på grunn av to elektroner i π-systemet i ringen, som er ledsaget av overgangen til dette karbonatomet fra sp 2 - V sp 3 -

Stabilisering av σ-komplekset. Det utføres ved abstraksjon av et proton fra σ-komplekset ved hjelp av en base. I dette tilfellet, på grunn av de to elektronene til den brytende kovalente bindingen C–H, gjenopprettes det lukkede π-systemet til ringen, dvs. molekylet går tilbake til aromatisk tilstand:

Effekt av substituenter på reaktivitet og orientering av elektrofil substitusjon
Substituenter på benzenringen forstyrrer fordelingsuniformiteten π- elektronskyen i ringen og derved påvirke ringens reaktivitet.
- Elektrondonerende substituenter (D) øker elektrontettheten til ringen og øker hastigheten på elektrofile substituenter aktiverer.
- Elektrontiltrekkende substituenter (A) reduserer elektrontettheten til ringen og reduserer reaksjonshastigheten, kalt dekontaminering.
Metoder for å skaffe. 1. Fremstilling fra alifatiske hydrokarboner. For å få benzen og dets homologer i industrien bruker de aromatisering mettede hydrokarboner som utgjør olje. Når rettkjedede alkaner bestående av minst seks karbonatomer føres over oppvarmet platina eller kromoksid, skjer dehydrogenering med samtidig ringslutning ( dehydrocyklisering). I dette tilfellet oppnås benzen fra heksan, og toluen oppnås fra heptan.
2. Dehydrogenering av sykloalkaner fører også til aromatiske hydrokarboner; For å gjøre dette føres damper av cykloheksan og dets homologer over oppvarmet platina.

3. Benzen kan fås fra trimerisering av acetylen, hvor acetylen føres over aktivert kull ved 600 °C.

4. Benzenhomologer oppnås fra benzen ved omsetning med alkylhalogenider i nærvær av aluminiumhalogenider (alkyleringsreaksjon, eller Friedel-Crafts-reaksjon).

5. Når fusjon salter av aromatiske syrer med alkali, arener frigjøres i gassform.
Kjemiske egenskaper. Den aromatiske kjernen, som har et mobilt system av n-elektroner, er et praktisk objekt for angrep av elektrofile reagenser. Dette forenkles også av det romlige arrangementet av a-elektronskyen på begge sider av det flate a-skjelettet til molekylet (se fig. 23.1, b).
De mest typiske reaksjonene for arener er de som fortsetter i henhold til mekanismen elektrofil substitusjon, angitt med symbolet S E(fra engelsk, substitusjon, elektrofil).
Mekanisme S E kan representeres som følger:
I det første trinnet blir den elektrofile partikkelen X tiltrukket av n-elektronskyen og danner et n-kompleks med den. To av ringens seks n-elektroner danner da en a-binding mellom X og ett av karbonatomene. I dette tilfellet blir aromatisiteten til systemet forstyrret, siden bare fire a-elektroner gjenstår i ringen, fordelt på fem karbonatomer (a-kompleks). For å opprettholde aromatisiteten sender a-komplekset ut et proton, og to elektroner av CH-bindingen overføres til l-elektronsystemet.
Følgende reaksjoner av aromatiske hydrokarboner fortsetter gjennom mekanismen for elektrofil substitusjon.
1. Halogenering. Benzen og dets homologer reagerer med klor eller brom i nærvær av katalysatorer - vannfri AlCl 3, FeCl 3, AlBr 3.

Denne reaksjonen produserer en blanding av toluen orto- og para-isomerer (se nedenfor). Katalysatorens rolle er å polarisere et nøytralt halogenmolekyl for å danne en elektrofil partikkel fra det.
2. Nitrering. Benzen reagerer veldig sakte med konsentrert salpetersyre selv ved oppvarming. Men når man handler nitrerende blanding(en blanding av konsentrert salpetersyre og svovelsyre), skjer nitreringsreaksjonen ganske lett.
3. Sulfonering. Reaksjonen foregår lett med "rykende" svovelsyre (oleum).
- 4. Friedel-Crafts alkylering- se ovenfor for metoder for å oppnå benzenhomologer.
- 5. Alkylering med alkener. Disse reaksjonene er mye brukt industrielt for å produsere etylbenzen og isopropylbenzen (kumen). Alkylering utføres i nærvær av en A1C13-katalysator. Reaksjonsmekanismen er lik mekanismen til forrige reaksjon.
Alle reaksjonene diskutert ovenfor fortsetter i henhold til mekanismen elektrofil substitusjon SE.
Sammen med substitusjonsreaksjoner kan aromatiske hydrokarboner inngå tilleggsreaksjoner, disse reaksjonene fører imidlertid til ødeleggelse av det aromatiske systemet og krever derfor store mengder energi og forekommer kun under tøffe forhold.
6. Hydrogenering benzen produseres ved oppvarming og høyt trykk i nærvær av metallkatalysatorer (Ni, Pt, Pd). Benzen omdannes til cykloheksan.

Homologer av benzen ved hydrogenering gir cykloheksanderivater.
7. Radikal halogeneringØdeleggelsen av benzen skjer når dampen samvirker med klor kun under påvirkning av hard ultrafiolett stråling. Samtidig benzen legger ved tre klormolekyler og former solid produkt heksaklorcykloheksan (heksakloran) C 6 H 6 C1 6 (hydrogenatomer er ikke angitt i strukturformlene).

8. Oksidasjon med luftoksygen. Når det gjelder motstand mot oksidasjonsmidler, ligner benzen på alkaner - reaksjonen krever tøffe forhold. For eksempel skjer oksidasjon av benzen med atmosfærisk oksygen bare med sterk oppvarming (400 ° C) av dampen i luft i nærvær av en V 2 0 5 katalysator; produkter - en blanding av maleinsyre og dens anhydrid.

Benzenhomologer. De kjemiske egenskapene til benzenhomologer er forskjellige fra de til benzen, som skyldes gjensidig påvirkning av alkylradikalet og benzenringen.
Sidekjedereaksjoner. De kjemiske egenskapene til alkylsubstituenter på benzenringen ligner på alkaner. Hydrogenatomene i dem er erstattet av halogen med en radikal mekanisme (S R). Det er derfor i fravær av en katalysator, ved oppvarming eller UV-bestråling, oppstår en radikal substitusjonsreaksjon i sidekjeden. Påvirkningen av benzenringen på alkylsubstituenter fører imidlertid til at hydrogenet ved karbonatomet som er direkte bundet til benzenringen først erstattes (en -atom karbon).
Substitusjon på benzenringen ved mekanisme S E Kanskje bare i nærvær av en katalysator(A1C1 3 eller FeCl 3). Bytte i ringen skjer kl orto- og para-posisjon til alkylradikalet.

Når kaliumpermanganat og andre sterke oksidasjonsmidler virker på benzenhomologer, oksideres sidekjedene. Uansett hvor kompleks kjeden til substituenten er, blir den ødelagt, med unntak av a-karbonatomet, som oksideres til en karboksylgruppe.
Benzenhomologer med en sidekjede gir benzosyre.

Benzen oppnås fra kulltjære, dannet under koksingen av kull og olje, ved bruk av syntetiske metoder.
1. Fremstilling fra alifatiske hydrokarboner. Når rettkjedede alkaner med minst seks karbonatomer per molekyl føres over oppvarmet platina eller kromoksid, dehydrocyklisering— dannelse av en arene med frigjøring av hydrogen: metode B.A. Kazansky og A.F. Tallerken
2. Dehydrogeneringsykloalkaner (N.D. Zelinsky) Reaksjonen skjer ved å føre damp av cykloheksan og dets homologer over oppvarmet platina ved 3000 0 .
3. Innhenting av benzen trimerisering av acetylen over aktivert karbon ved 600 0(N.D. Zelinsky )
| 3HC?CH | -- 600°C? |
4. Fusjon av salter av aromatiske syrer med alkali eller sodakalk:
5. Kjemiske egenskaper til arenes.
Benzenkjernen er svært slitesterk. De mest typiske reaksjonene for arener er de som fortsetter i henhold til mekanismen elektrofil substitusjon, betegnet med symbolet SE (fra engelsk substitusjon elektrofil).
Kjemiske egenskaper til benzen.
1. Substitusjonsreaksjoner:
Halogenering . Benzen reagerer ikke med klor eller brom under normale forhold. Reaksjonen kan bare skje i nærvær av katalysatorer - vannfri AlCl 3, FeCl 3, AlBr 3. Som et resultat av reaksjonen dannes halogensubstituerte arener:
Katalysatorens rolle er å polarisere et nøytralt halogenmolekyl for å danne en elektrofil partikkel fra det:
Nitrering . Benzen reagerer veldig sakte med konsentrert salpetersyre selv ved oppvarming. Men under handlingen av den såkalte nitrerende blanding (en blanding av konsentrert salpetersyre og svovelsyre) Nitreringsreaksjonen er ganske enkel:
Sulfonering. Reaksjonen foregår lett under påvirkning av "rykende" svovelsyre (oleum):
2. Friedel-Crafts alkylering. Som et resultat av reaksjonen blir en alkylgruppe introdusert i benzenringen for å produsere benzenhomologer. Reaksjonen skjer når benzen utsettes for haloalkaner RСl i nærvær av katalysatorer - aluminiumhalogenider. Katalysatorens rolle reduseres til polariseringen av RСl-molekylet med dannelsen av en elektrofil partikkel:
Avhengig av strukturen til radikalet i haloalkanen, kan forskjellige benzenhomologer oppnås:
Alkylering med alkener. Disse reaksjonene er mye brukt industrielt for å produsere etylbenzen og isopropylbenzen (kumen). Alkylering utføres i nærvær av en AlCl3-katalysator. Reaksjonsmekanismen ligner mekanismen til forrige reaksjon:
Alle reaksjonene diskutert ovenfor fortsetter i henhold til mekanismen elektrofil substitusjon SE. Reaksjoner av tilsetning til arener fører til ødeleggelse av det aromatiske systemet og krever store mengder energi, så de forekommer bare under tøffe forhold.
3. Addisjonsreaksjoner som innebærer å bryte bindinger:
Hydrogenering. Reaksjonen av hydrogentilsetning til arener skjer under oppvarming og høyt trykk i nærvær av metallkatalysatorer (Ni, Pt, Pd). Benzen svinger til cykloheksan, A benzenhomologer - til cykloheksanderivater:
Radikal halogenering. Samspillet mellom benzendamp og klor foregår i henhold til en radikal mekanisme bare under påvirkning av hard ultrafiolett stråling. I dette tilfellet kombineres benzen med tre klormolekyler og former solid produkt - heksaklorcykloheksan (heksakloran) C 6 H 6 Cl 6:
4. Oksidasjon av atmosfærisk oksygen. Når det gjelder motstand mot oksidasjonsmidler, ligner benzen på alkaner. Bare ved sterk oppvarming (400 °C) av benzendamp med atmosfærisk oksygen i nærvær av en V 2 O 5 katalysator, oppnås en blanding av maleinsyre og dens anhydrid:
5. Benzen brenner. (Se eksperiment) Benzenflammer er røykfylte på grunn av det høye karboninnholdet i molekylet.
2 C 6 H 6 + 15 O 2 → 12CO 2 + 6H 2 O
6. Anvendelse av arenaer.
Benzen og dets homologer brukes som kjemiske råvarer for produksjon av legemidler, plast, fargestoffer, aceton, fenol og formaldehydplast. plantevernmidler og mange andre organiske stoffer. Mye brukt som løsemidler. Benzen som tilsetning forbedrer kvaliteten på motordrivstoff. Etylen brukes til å produsere etylalkohol og polyetylen. Det akselererer modningen av frukt (tomater, sitrusfrukter) når små mengder introduseres i luften i drivhusene. Propylen brukes til syntese av glyserin, alkohol og til produksjon av polypropylen, som brukes til produksjon av tau, kabler og emballasjemateriale. Syntetisk gummi er produsert av 1-buten.
Acetylen brukes til autogen sveising av metaller. Polyetylen brukes som emballasjemateriale for fremstilling av poser, leker, husholdningsredskaper (flasker, bøtter, boller, etc.). Aromatiske hydrokarboner er mye brukt i produksjon av fargestoffer, plast, kjemiske legemidler, eksplosiver, syntetiske fibre, motordrivstoff osv. Hovedkilden til aromatiske hydrokarboner er Produktene av kokskull brukes. Fra 1 T Kam.-Ug. harpiks kan frigjøres i gjennomsnitt: 3,5 kg benzen, 1,5 kg toluen, 2 kg naftalen. Produksjonen av A. er av stor betydning. fra fete petroleumshydrokarboner. For noen A.u. Rent syntetiske metoder er av praktisk betydning. Således produseres etylbenzen fra benzen og etylen, hvis dehydrogenering fører til styren.
SELVKONTROLLOPPGAVER:
1. Hvilke forbindelser kalles arenaer?
2. Hva er de karakteristiske fysiske egenskapene?
3. Oppgave. Fra 7,8 g benzen ble det oppnådd 8,61 g nitrobenzen. Bestem utbyttet (i %) av reaksjonsproduktet.
Arenaer(aromatiske hydrokarboner) - forbindelser hvis molekyler inneholder en eller flere benzenringer - sykliske grupper av karbonatomer med en spesifikk natur av bindinger.
Benzen - molekylformel C 6 H 6. Det ble først foreslått av A. Kekule:
Arenastruktur.
Alle 6 karbonatomer er i sp 2-hybridisering. Hvert karbonatom danner 2 σ -bindinger med to nabokarbonatomer og ett hydrogenatom, som er i samme plan. Vinklene er 120°. De. Alle karbonatomer ligger i samme plan og danner en sekskant. Hvert atom har en ikke-hybrid r-boligen der det uparrede elektronet befinner seg. Denne orbitalen er vinkelrett på planet, og derfor π -elektronskyen er "spredt" over alle karbonatomer:

Alle forbindelser er like. Konjugasjonsenergi er mengden energi som må brukes for å ødelegge et aromatisk system.
Dette er det som bestemmer de spesifikke egenskapene til benzen - manifestasjonen av aromatisitet. Dette fenomenet ble oppdaget av Hückel, og kalles Hückels regel.
Arene isomeri.
Arenaer kan deles inn i 2 grupper:
- benzenderivater:

- kondenserte arenaer:

Den generelle formelen for arenes er MEDnH 2 n -6 .
Arener er preget av strukturell isomerisme, som forklares av det gjensidige arrangementet av substituenter i ringen. Hvis det er 2 substituenter i ringen, kan de være i 3 forskjellige posisjoner - orto (o-), meta (m-), para (p-):

Hvis ett proton "tas bort" fra benzen, dannes et radikal - C 6 H 5, som kalles arylradikalet. Protozoer:

Arenes kalles ordet "benzen", som indikerer substituentene i ringen og deres posisjoner:

Fysiske egenskaper ved arenaer.
De første medlemmene i serien er fargeløse væsker med en karakteristisk lukt. De er svært løselige i organiske løsemidler, men uløselige i vann. Benzen er giftig, men har en behagelig lukt. Forårsaker hodepine og svimmelhet innånding av store mengder damp kan føre til bevissthetstap. Irriterer slimhinner og øyne.
Får arenaer.
1. Fra alifatiske hydrokarboner ved å bruke "aromatisering" av mettede hydrokarboner som utgjør oljen. Når det føres over platina eller kromoksid, oppstår dihydrosyklisering:

2. Dehydrogenering av cykloalkaner:

3. Fra acetylen (trimerisering) når det passeres over varmt kull ved 600°C:

4. Friedel-Crafts reaksjon i nærvær av aluminiumklorid:

5. Fusjon av salter av aromatiske syrer med alkali:
Kjemiske egenskaper til arenes.
Arene substitusjonsreaksjoner.
Arene-kjernen har en mobil π - et system som påvirkes av elektrofile reagenser. Arenes er preget av elektrofil substitusjon, som kan representeres som følger:

En elektrofil partikkel blir tiltrukket av π -ringsystem, så dannes det en sterk binding mellom reagenset X og ett av karbonatomene, i hvilket tilfelle ringens enhet blir forstyrret. For å gjenopprette aromatisiteten sendes det ut et proton og 2 elektroner S-N gå inn i π-systemet til ringen.
1. Halogenering skjer i nærvær av katalysatorer - vannfrie klorider og bromider av aluminium og jern:

2. Nitrering av arener. Benzen reagerer veldig sakte med konsentrert salpetersyre ved oppvarming. Men hvis du legger til svovelsyre, fortsetter reaksjonen veldig lett:
3. Sulfonering skjer under påvirkning av 100 % svovelsyre - oleum:
4. Alkylering med alkener. Som et resultat oppstår kjedeforlengelse i nærvær av en katalysator - aluminiumklorid.
Aromatiske hydrokarboner– forbindelser av karbon og hydrogen, hvis molekyl inneholder en benzenring. De viktigste representantene for aromatiske hydrokarboner er benzen og dets homologer - produkter av erstatning av ett eller flere hydrogenatomer i et benzenmolekyl med hydrokarbonrester.
Strukturen til benzenmolekylet
Den første aromatiske forbindelsen, benzen, ble oppdaget i 1825 av M. Faraday. Dens molekylformel ble etablert - C 6 H 6. Hvis vi sammenligner dens sammensetning med sammensetningen av et mettet hydrokarbon som inneholder samme antall karbonatomer - heksan (C 6 H 14), så kan vi se at benzen inneholder åtte færre hydrogenatomer . Som kjent fører utseendet til flere bindinger og sykluser til en reduksjon i antall hydrogenatomer i et hydrokarbonmolekyl. I 1865 foreslo F. Kekule sin strukturformel som cykloheksantrien - 1, 3, 5.

Dermed korresponderer molekylet Kekules formel, inneholder dobbeltbindinger, derfor må benzen være umettet, dvs. det må lett gjennomgå addisjonsreaksjoner: hydrogenering, bromering, hydrering, etc.
Data fra en rekke eksperimenter har imidlertid vist at benzen inngår i tilleggsreaksjoner bare under tøffe forhold (ved høye temperaturer og belysning) og er motstandsdyktig mot oksidasjon. De mest karakteristiske reaksjonene for det er substitusjonsreaksjoner, derfor er benzen nærmere marginale hydrokarboner.
For å prøve å forklare disse avvikene, har mange forskere foreslått ulike alternativer for strukturen til benzen. Strukturen til benzenmolekylet ble til slutt bekreftet ved reaksjonen av dets dannelse fra acetylen. I virkeligheten er karbon-karbonbindingene i benzen ekvivalente, og egenskapene deres ligner ikke på verken enkelt- eller dobbeltbindinger.
For tiden er benzen betegnet enten med Kekule-formelen eller med en sekskant der en sirkel er avbildet.
![]()
Så hva er spesielt med strukturen til benzen? Basert på forskernes data og beregninger ble det konkludert med at alle seks karbonatomene er i en tilstand sp 2 -hybridisering og ligge i samme plan. Uhybridisert s-orbitaler av karbonatomer som utgjør dobbeltbindinger (Kekule formel) er vinkelrett på ringens plan og parallelle med hverandre.
De overlapper hverandre og danner et enkelt π-system. Dermed er systemet med alternerende dobbeltbindinger avbildet i Kekulés formel et syklisk system av konjugerte, overlappende bindinger. Dette systemet består av to toroidale (smultringlignende) områder med elektrontetthet som ligger på hver side av benzenringen. Dermed er det mer logisk å avbilde benzen som en vanlig sekskant med en sirkel i sentrum (π-systemet) enn som cykloheksatrien-1,3,5. 
Den amerikanske forskeren L. Pauling foreslo å representere benzen i form av to grensestrukturer som er forskjellige i fordelingen av elektrontetthet og konstant forvandles til hverandre, dvs. betrakter det som en mellomforbindelse, "gjennomsnitt" av to strukturer.
Bondlengdemålinger bekrefter disse antakelsene. Det ble funnet at alle C-C-bindinger i benzen har samme lengde (0,139 nm). De er litt kortere enn enkelt-C-C-bindinger (0,154 nm) og lengre enn dobbeltbindinger (0,132 nm).
Det er også forbindelser hvis molekyler inneholder flere sykliske strukturer.

Isomerisme og nomenklatur
Benzenhomologer er preget av isomerisme av posisjonen til flere substituenter. Den enkleste homologen av benzen - toluen (metylbenzen) - har ikke slike isomerer; følgende homolog presenteres som fire isomerer:

Grunnlaget for navnet på et aromatisk hydrokarbon med små substituenter er ordet benzen. Atomene i den aromatiske ringen er nummerert fra høyeste til laveste substituent:

I følge den gamle nomenklaturen kalles posisjon 2 og 6 ortoposisjoner, 4 - par-, og 3 og 5 - meta-bestemmelser.
Fysiske egenskaper
Benzen og dets enkleste homologer er under normale forhold svært giftige væsker med en karakteristisk ubehagelig lukt. De løser seg dårlig i vann, men godt i organiske løsemidler.
Kjemiske egenskaper til benzen
Substitusjonsreaksjoner. Aromatiske hydrokarboner gjennomgår substitusjonsreaksjoner.
1. Bromering. Når man reagerer med brom i nærvær av en katalysator, jernbromid (ΙΙΙ), kan et av hydrogenatomene i benzenringen erstattes med et bromatom:

2. Nitrering av benzen og dets homologer. Når et aromatisk hydrokarbon interagerer med salpetersyre i nærvær av svovelsyre (en blanding av svovelsyre og salpetersyre kalles en nitrerende blanding), erstattes hydrogenatomet med en nitrogruppe -NO2:

Ved å redusere nitrobenzenet som dannes i denne reaksjonen, oppnås anilin, et stoff som brukes til å oppnå anilinfargestoffer:

Denne reaksjonen er oppkalt etter den russiske kjemikeren Zinin.
Tilleggsreaksjoner. Aromatiske forbindelser kan også gjennomgå addisjonsreaksjoner til benzenringen. I dette tilfellet dannes cykloheksan eller dets derivater.
1. Hydrogenering. Katalytisk hydrogenering av benzen skjer ved en høyere temperatur enn hydrogenering av alkener:
![]()
2. Klorering. Reaksjonen oppstår når den belyses med ultrafiolett lys og er fri radikal:

Benzenhomologer
Sammensetningen av deres molekyler tilsvarer formelen C n H 2 n-6. De nærmeste homologene til benzen er:
Alle homologer av benzen etter toluen har isomerer. Isomerisme kan assosieres både med antallet og strukturen til substituenten (1, 2), og med posisjonen til substituenten i benzenringen (2, 3, 4). Forbindelser med den generelle formelen C 8 H 10:

I henhold til den gamle nomenklaturen som ble brukt for å indikere den relative plasseringen av to identiske eller forskjellige substituenter på benzenringen, brukes prefiksene orto- (forkortet o-) - substituenter er lokalisert ved nabokarbonatomer, meta-(m-) – gjennom ett karbonatom og par— (n-) – substituenter mot hverandre.
De første medlemmene av den homologe serien av benzen er væsker med en spesifikk lukt. De er lettere enn vann. De er gode løsemidler.
Benzenhomologer reagerer erstatninger ( bromering, nitrering). Toluen oksideres av permanganat ved oppvarming:

Benzenhomologer brukes som løsemidler for å produsere fargestoffer, plantevernmidler, plast og medisiner.




























 Klasselæreres rolle i å forbedre kvaliteten og effektiviteten av pedagogisk arbeid Møte med klasselærere ved begynnelsen av skoleåret
Klasselæreres rolle i å forbedre kvaliteten og effektiviteten av pedagogisk arbeid Møte med klasselærere ved begynnelsen av skoleåret Hvem regnes som skaperen av den cellulære teorien om immunitet?
Hvem regnes som skaperen av den cellulære teorien om immunitet? Presentasjon om emnet "Barn og fuglen" A
Presentasjon om emnet "Barn og fuglen" A