Sluttprodukter av nitrogenmetabolisme. Urinsyre i blodet: normer og avvik, hvorfor det øker, kosthold for å redusere det Sluttproduktet av nitrogenmetabolismen er
Statens utdanningsinstitusjon
Chita State Medical Academy
L.P. Nikitina, A.Ts. Gomboeva, N.S. Kuznetsova
Biokjemi nitrogenmetabolisme under normale og patologiske forhold
Redigert av prof. B.S. Khyshyktueva
L.P. Nikitina
A.Ts. Gomboeva
N.S. Kuznetsova
Denne håndboken er beregnet på studenter ved medisinske universiteter. Den presenterer informasjon om forskjellige nitrogenholdige forbindelser, først og fremst om aminosyrer, nukleotider og deres biopolymerer - proteiner, nukleinsyrer, i et ganske kortfattet, tilgjengelig språk.
|
Liste over forkortelser. . . . . . . . . . . . . . . . . . . . . . . | |||
|
. . . . . . . . . . . . . . . . . . . . . . . | |||
|
Introduksjon. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . | |||
|
. . . . . . . . . . . . . . . . . . . . . . | |||
|
Kapittel 1. Klassifisering og generalitet av roller til nitrogenholdige forbindelser. . | |||
|
Kapittel 2. Metabolisme av aminosyrer. . . . . . . . . . | |||
|
. . . . . . . . . . . . . . . . . . . . . . . . | |||
|
2.1. | |||
|
Hydrolytisk stadium av polypeptidkatabolisme. . . . . . . . . . | |||
|
2.2. | |||
|
Skjebnen til aminosyrer i cellen. . . . . . . | |||
|
. . . . . . . . . . . . . . . . . . . . . . . | |||
|
2.2.1. | |||
|
Alternativer for uspesifikke transformasjoner. . . . . . . . . . . . . . . | |||
|
2.2.1.1. | |||
|
Dekarboksyleringsreaksjoner. . . . . . | |||
|
. . . . . . . . . . . . . . . . . . . | |||
|
2.2.1.2. | |||
|
3.2.2. | |||
|
Betydningen av dinukleotider. . . . . . . . . . . | |||
|
. . . . . . . . . . . . . . . . . . . . | |||
|
3.2.3. | |||
|
Polynukleotider. . . . . . . . . . . . . . . . . . . | |||
|
. . . . . . . . . . . . . . . . . . . | |||
|
3.2.3.1. | |||
|
Typer RNA. . . . . . . . . . . . . . . . . . . . . . . . . | |||
|
. . . . . . . . . . . . . . . . | |||
|
3.2.3.2. | |||
|
DNA-varianter. . . . . . . . . . . . . . . . . . . . . | |||
|
. . . . . . . . . . . . . . . . | |||
|
3.2.3.3. | |||
|
Fysisk-kjemiske og biologiske egenskaper til komplekse nukleotider | |||
|
3.3. | |||
|
Katabolsk fase av utveksling av nukleinstrukturer. . . . . . . . . . | |||
|
3.3.1. | |||
|
Desintegrasjon av nukleoproteiner i mage-tarmkanalen og vev. . . . . . . . . . . . . . . . . | |||
|
3.3.2. | |||
|
Spesifikke veier for nukleosidtransformasjoner. . . . . . . . . | |||
|
3.3.2.1. | |||
|
Sluttproduktet av purinmetabolismen er urinsyre. . . | |||
|
3.3.2.2. | |||
|
Ordning for ødeleggelse av pyrimidinringer. . . . . . . . . . . . . . | |||
|
3.4. | |||
|
Veier for syntese av mononukleotider. . . . . . | |||
|
. . . . . . . . . . . . . . . . . . . . . . | |||
|
3.4.1. | |||
|
Ordbok over genetiske termer. . . . . . . . . . . . | |||
. . . . . . . . . . . . . . . . . . . . . . . .
Liste over forkortelser
ADP – adenosintrifosfat
ALT – alaninaminotransferase
AMP – adenosinmonofosfat
AO – antioksidant
ARZ – antiradikal beskyttelse
AST – aspartataminotransferase
ATP – adenosintrifosfat
HFA – høyere fettsyre
GABA – gamma-aminosmørsyre
HGPRT - hypoxanthine guanine phosphoribosyltransferase
BNP – guanosindifosfat
GMP – guanosinmonofosfat
GNG – glukoneogenese
Fastlege – glyserolfosfatid(er)
HMS – hormonfølsomt element
hRNA – heterogen kjernefysisk ribonukleinsyre
DHAP – dihydroksyacetonfosfat
DOPA – di(hydro)oksyfenylalanin
Mage-tarmkanalen - mage-tarmkanalen
IMP – inosinmonofosfat
iRNA – messenger ribonukleinsyre
CoA – acyleringskoenzym
NAD + – nikotinamid adenindinukleotid
NAD + P – nikotinamid adenindinukleotidfosfat
NTP – nukleosidtrifosfat
OA – oksalacetat
OMP – oritidinmonofosfat
PVA – pyrodruesyre
PPP – pentosefosfatvei
RNDP – ribonukleosid-difosfat
RMNP – ribonukleosidmonofosfat
RNA – ribonukleinsyre
rRNA – ribosomal ribonukleinsyre
RNTP – ribonukleosidtrifosfat
STH – somatotropt hormon
THFA – tetrahydrofolsyre
TDP – tiamindifosfat
TMP – tymidinmonofosfat
tRNA – transport ribonukleinsyre
UMP – uridinmonofosfat
UTP – uridintrifosfat
FAD – flavin adenin dinukleotid
FAPS – fosfoadenosin fosfosulfat
FMN – flavinmononukleotid
PRPP – fosforibosylpyrofosfat
c-AMP – syklisk adenosinmonofosfat
CDP – cytidindifosfat
CMP – cytidinmonofosfat
TCA-syklus – trikarboksylsyresyklus
ETC – elektrontransportkjede
H – histon
SAM – S-adenosylmetionin
Introduksjon
Inkludering av nitrogenatomer som er i stand til å akseptere protoner på grunn av det ensomme elektronparet, dvs. besitter egenskapene til en base, fører til en kvalitativ endring i funksjonene som utføres. Kroppen er ikke i stand til å bruke aminoholdige molekyler som energikilder de tjener andre formål.
Utskillelsessystem av voksne amfibier er representert av et par stammenyrer - mesonephros, som er plassert på sidene av den sakrale delen av ryggraden, men i motsetning til fisk har de ikke en båndlignende form, men er ovale og veldig kompakte. Urinlederen er Wolffian-kanalen (hos menn fungerer den også som vas deferens), som renner inn i cloacaen. I høyere terrestriske former åpner en omfattende blære seg inn i cloaca, hvor urin kommer inn fra cloaca og lagres midlertidig.
Når blæren renner over, tømmer den innholdet i samme cloaca, og derfra skilles urinen ut. Amfibie nyrer fjerner avfallsstoffer fra blodet og opprettholder vann-saltbalansen (likevekt). Antall nefroner i nyren avhenger av hvor nært dyret er knyttet til vann. Hos overveiende akvatiske haleamfibier er det ca 400 - 500 nefroner i begge nyrene, og hos haleløse amfibier - ca 2000. Dette forklares med at akvatiske amfibier skiller ut deler av stoffskiftet gjennom gjellene
og kroppsbelegg ut i det omkringliggende vannet.
Sluttproduktet av nitrogenmetabolisme hos amfibier er urea.
Overflødig vann fjernes gjennom nyrene, som kommer inn i dyrets kropp gjennom huden, mens salter reabsorberes (reabsorberes) fra urinen, slik at de fleste ionene - opptil 99% - går tilbake til blodet.
Gjennom mange tynne sædrør som strekker seg fra testis, passerer reproduktive produkter gjennom den fremre delen av nyren og kommer inn i Wolffian-kanalen, som hos amfibier (så vel som hos bruskfisk) kombinerer funksjonene til urinlederen og vas deferens. Wolffian-kanalene tømmes ut i kloakaen, men kort tid før hver av dem danner en liten forlengelse - sædblæren, der sædceller midlertidig samler seg. I likhet med testiklene og fete kropper blir sædblærene mindre utenfor hekkesesongen.
Amfibier har ikke egne reproduktive kanaler i det mannlige reproduktive systemet.
Det kvinnelige reproduksjonssystemet er dannet av to eggstokker suspendert på mesenteriet, over hvilke det ligger fete kropper (375). Størrelsen på eggstokkene varierer betydelig avhengig av årstid, og øker betydelig i hekkesesongen. Om våren er eggstokkene spesielt store store egg rike på eggeplomme kan sees gjennom den tynne veggen.
Modne egg forlater eggstokken gjennom en ruptur av follikkelmembranen og havner i kroppshulen, hvorfra de deretter kommer inn i eggledertrakten. Hos kvinnelige amfibier er egglederen den sammenkoblede Müller-kanalen, som åpner seg i den ene enden (trakten) inn i kroppshulen, og i den andre inn i cloacaen. I hekkesesongen blir egglederne sterkt langstrakte og veggene deres tykkere.
Mange amfibier er preget av paringsadferd, ofte ledsaget av vokale signaler (hann av noen frosker kan lage ekstremt høye lyder). Dette er nødvendig for å stimulere samtidig frigjøring av reproduktive produkter fra seksuelle partnere. Befruktning kan være intern eller ekstern.
Amfibier er preget av utvikling med metamorfose, med en larve som kommer ut av egget, som i sin organisasjon er mye nærmere fisk enn voksne amfibier. Den har en karakteristisk fiskelignende form, så den beveger seg ved hjelp av kroppens langsgående bøyninger. Åndedrettsorganene tjener først som ytre gjeller, som er utvekster av huden. Lemmer er fraværende i de tidlige stadiene. Hos haleamfibier fungerer de ytre gjellene gjennom hele larveperioden, men de indre utvikler seg ikke.
Under utviklingen av amfibielarver blir dens indre systemer rekonstruert: luftveier, sirkulasjons-, ekskresjons- og fordøyelsesorganer..
Lemmer utvikles gradvis. Metamorfose ender med dannelsen av en miniatyrkopi av det voksne individet hos haleløse dyr, halen reduseres.
Ambystos er preget av neoteny, det vil si at de reproduserer med larver, som i lang tid ble forvekslet med en uavhengig art, og det er derfor de har sitt eget navn - axolotl. En slik larve er større i størrelse enn en voksen. En annen interessant gruppe amfibier er proteaer, som lever permanent i vann og beholder ytre gjeller gjennom hele livet, det vil si at de beholder egenskapene til en larve.
Vi vil snakke om særegenhetene ved metabolismen av purinbaser. Dette betyr ingenting for folk flest. Men hvis du er kjent med ordene "gikt", urolithiasis, insulinresistens, type 2 diabetes, må du vite essensen av purinmetabolisme. Det ser ut til: hva har kirurgi med det å gjøre? Og til tross for at mange spesialister diagnostiserer "gikt" med smerter i leddene og høy urinsyre. I virkeligheten er alt mye mer komplisert. For eksempel kan urinsyregikt oppstå med normale urinsyrenivåer, og omvendt: høy urinsyre kan i noen tilfeller oppstå hos en frisk person.
Menneskekroppen er hovedsakelig sammensatt av fire kjemiske elementer, som utgjør 89% av sammensetningen: C-karbon (50%), O-oksygen (20%), H-hydrogen (10%) og N-nitrogen (8,5% ). Deretter kommer en rekke makroelementer: kalsium, fosfor, kalium, svovel, natrium, klor, etc. Deretter mikroelementer, mengden av disse er veldig liten, men de er livsviktige: mangan, jern, jod, etc.
En levende organisme er et dynamisk system. For å si det enkelt: stoffer kommer hele tiden inn i den (blir en del av kroppen) og fjernes fra den. Hovedkilden til nitrogen for kroppen er proteiner. Protein som tilføres mat i mage-tarmkanalen brytes ned til aminosyrer, som deretter inngår i stoffskiftet. Vel, hvordan fjernes nitrogenholdige stoffer fra kroppen?
I utviklingsprosessen har dyr utviklet visse egenskaper ved nitrogenmetabolisme.
Dessuten vil nøkkelen til å bestemme disse funksjonene være: levekår og tilgang til vann.
Dyr er delt inn i tre grupper som har forskjeller i nitrogenmetabolisme:
Ammoniolytisk. Sluttproduktet av nitrogenmetabolismen er ammoniakk, NH3. Dette inkluderer de fleste akvatiske virvelløse dyr og fisk.
Saken er at ammoniakk er et giftig stoff. Og for å fjerne det trenger du mye, mye væske. Heldigvis er det svært løselig i vann. Med tilgang til land under evolusjonen oppsto det et behov for å endre stoffskiftet. Slik så de ut:
Ureolytisk. Disse dyrene utviklet den såkalte "ureasyklusen." Ammoniakk kombineres med CO2 (karbondioksid). Sluttproduktet dannes - urea. Urea er ikke et så giftig stoff, og det kreves merkbart mindre væske for å fjerne det. Forresten, du og jeg tilhører denne gruppen. Urinsyre dannes også under metabolisme i mye mindre mengder, men brytes ned til lite giftig og svært løselig allantoin. Men... Bortsett fra mennesker og aper. Dette er veldig viktig og vi kommer tilbake til dette.
Urikotelisk. Forfedrene til amfibier med ureolytisk metabolisme måtte tilpasse seg tørre områder. Dette er reptiler og de direkte forfedrene til dinosaurer - fugler. Sluttproduktet deres er urinsyre. Det løser seg veldig dårlig i vann og krever ikke mye vann for å fjerne det fra kroppen. I avføringen til de samme fuglene er mengden urinsyre veldig stor, den skilles ut i en halvfast form. Derfor er fugleskitt (“guano”) hovedårsaken til korrosjon og ødeleggelse av metallstrukturer i broer. . Bilens lakk blir også dårligere – vær forsiktig og vask den med en gang.
Dette er en klassisk sekskantet leverlapp. Generelt er det slik leveren ser ut under et mikroskop. I likhet med Moskva by, er det bare i stedet for Kreml en sentral vene. Og vi vil være interessert i "hus" som ligger tett inntil hverandre. Dette er hepatocytter - nøkkelcellene i leveren.
Det slaviske ordet lever kommer fra ordet "ovn". Faktisk er temperaturen på organet én grad høyere enn kroppstemperaturen. Årsaken til dette er en svært aktiv metabolisme i hepatocytter. Celler er virkelig unike; omtrent 2 tusen kjemiske reaksjoner finner sted i dem.
Leveren er hovedorganet som produserer urinsyre. 95 % av utskilt nitrogen er syntesen av urinsyre som sluttproduktet av kjemiske reaksjoner i leveren. Og bare 5 % er oksidasjonen av purinbaser som kommer utenfra med mat. Derfor er ernæringskorreksjon for hyperurikemi ikke nøkkelen til behandling.
Urinsyremetabolismediagram
 Hvor kommer puriner fra?
Hvor kommer puriner fra?
1. Puriner som kommer fra mat
. Som allerede nevnt, er dette et lite beløp - omtrent 5%. De purinene som finnes i mat (mest av alt, selvfølgelig, i leveren og nyrene, rødt kjøtt).
2. Syntese av purinbaser av kroppen selv
. Det meste av det syntetiseres i leverhepatocytter. Et veldig viktig poeng, det kommer vi tilbake til. Og hva har fruktose med det å gjøre, som anbefales av diabetikere og ikke krever insulin for absorpsjon.
3. Purinbaser, som dannes i kroppen på grunn av vevsnedbrytning: under kreftprosesser, psoriasis
. Hvorfor kan urinsyrenivået øke hos idrettsutøvere? Dette er den tredje veien. Tung fysisk aktivitet fører til økte prosesser med vevsnedbrytning og syntese. Hvis du utførte tungt fysisk arbeid dagen før og du blir testet om morgenen, kan urinsyrenivået være høyere enn gjennomsnittet.  La oss bli kjent: adenin og guanin. Dette er purinbaser. Sammen med tymin og cytosin danner de en DNA-helix. Medisinstudenter liker ikke å stappe på et biokjemikurs :). DNA består som kjent av to kjeder. Motsatt til adenin er alltid tymin, og motsatt av guanin er cytosin. De to DNA-strengene fester seg sammen som de to halvdelene av en glidelås. Mengden av disse stoffene øker med aktiv vevsnedbrytning, slik det for eksempel skjer under kreftprosesser
La oss bli kjent: adenin og guanin. Dette er purinbaser. Sammen med tymin og cytosin danner de en DNA-helix. Medisinstudenter liker ikke å stappe på et biokjemikurs :). DNA består som kjent av to kjeder. Motsatt til adenin er alltid tymin, og motsatt av guanin er cytosin. De to DNA-strengene fester seg sammen som de to halvdelene av en glidelås. Mengden av disse stoffene øker med aktiv vevsnedbrytning, slik det for eksempel skjer under kreftprosesser
Gjennom en rekke påfølgende kjemiske reaksjoner omdannes puriner til urinsyre.

Metabolisme av urinsyre hos mennesker og primater
Jeg planla å gjøre diagrammet så lettfattelig som mulig. La 2. års medisinstudenter undervise :). Men han la igjen navnene på enzymene. Det viktigste poenget er xantinoksidase-enzym
. Det er aktiviteten som avtar under behandlingen allopurinol(mer presist, effektivitet, siden allopurinol konkurrerer med det om reseptoren), noe som reduserer syntesen av urinsyre.
Sjelden oppstår en medfødt sykdom, ledsaget av en genetisk lidelse i syntesen av xantinoksidase, hvor nivået av urinsyre reduseres. I dette tilfellet akkumuleres xanthin og hypoxanthin. Xanthinuria. Det ville virke bra, mindre urinsyre. Imidlertid viste det seg at urinsyre ikke bare er skadelig, men også gunstig...
Samtalen om farene og fordelene med urinsyre bør starte langveis fra. Så, for 17 millioner år siden, under miocen-tiden, opplevde våre forfedre en mutasjon i genet som produserer enzymet urikase. Og vi fikk en "kuttet ned" versjon av purinmetabolismen.
 Hos andre pattedyr omdanner urikase urinsyre til allantoin, som er løselig og lett utskilles fra kroppen. Og disse dyrene har aldri gikt. Det kan være en antagelse om at denne mutasjonen ikke gir noen mening. Men evolusjonen utelukket ikke dette genet: mutasjonen viste seg å være nødvendig.
Hos andre pattedyr omdanner urikase urinsyre til allantoin, som er løselig og lett utskilles fra kroppen. Og disse dyrene har aldri gikt. Det kan være en antagelse om at denne mutasjonen ikke gir noen mening. Men evolusjonen utelukket ikke dette genet: mutasjonen viste seg å være nødvendig.
Moderne forskning har vist at urinsyre er et biprodukt av nedbrytningen av fruktose i leveren og akkumulering av urinsyresalter bidrar til effektiv omdannelse av fruktose til fett. Dermed ble genet for "nøysomhet" fiksert i genomet til våre forfedre. Da måtte genet til for å skape reserver for den sultne perioden. Det ble bevist at den endelige inaktiveringen av urikase falt sammen med global avkjøling av jordens klima. Det var nødvendig å "spise opp" så mye av de subkutane fettreservene som mulig for den kalde perioden og omdanne fruktosen i fruktene til fettreserver. Det gjennomføres nå en rekke eksperimenter med innføring av enzymet urikase i leverceller. Det er mulig at det i fremtiden vil dukke opp medisiner for behandling av gikt basert på urikase-enzymet. Så vår tendens til å bli overvektig ligger i genene våre. Dessverre for de mange menn og kvinner som lider av fedme. Men problemet er ikke bare genetikk. Naturen til det moderne menneskets kosthold har endret seg.
Om skadene og fordelene med urinsyre, samt om ernæring for hyperurikemi
Det er kjent at konstante nivåer av urinsyre kan øke risikoen for flere sykdommer betydelig. Det er imidlertid bevist at periodiske økninger i urinsyrenivåer kan ha en gunstig effekt. Historisk sett var tilgangen til kjøttmat (hovedkilden til puriner) uregelmessig. Hovedmat: ulike røtter, trefrukter. Vel, hvis en primitiv jeger bringer byttedyr, så er det en ferie. Derfor var det å spise kjøttprodukter med jevne mellomrom en vanlig livsstil. Det er byttedyr – vi spiser av hjertens lyst. Det er ingen byttedyr - vi spiser plantemat. Det er nå slått fast at kortvarige, periodiske økninger i urinsyrenivået har en gunstig effekt på nervesystemets utvikling og funksjon. Kanskje det var derfor hjernen begynte å utvikle seg?
Hvordan fjernes denne urinsyren fra kroppen?
To måter: nyrer og lever
Hovedveien er utskillelse gjennom nyrene - 75 %
25 prosent skilles ut av leveren ved hjelp av galle. Urinsyre som kommer inn i tarmens lumen blir ødelagt (takket være våre bakterier i tarmen).
Urinsyre kommer inn i nyrene i form av natriumsalt. Ved acidose (forsuring av urin) kan det dannes mikrolitter i nyrebekkenet. Den samme "sand" og "steiner". Forresten, alkohol reduserer i stor grad utskillelsen av urat i urinen. Dette er grunnen til at det fører til et giktanfall.
Så, hva er konklusjonen som skal trekkes. Metoder for å redusere urinsyre?
1. Prøv å lage 1-2 dager i uken rent vegetarisk
2. Den største mengden puriner finnes i vev av animalsk opprinnelse. Dessuten, i dyreceller med aktiv metabolisme: lever, nyrer - mest av alt.
3. Du bør spise mindre fet mat, siden overflødig mettet fett undertrykker kroppens evne til å behandle urinsyre.
4. Spis mindre fruktose. Urinsyre er et produkt av fruktosemetabolismen. Tidligere ble pasienter med diabetes anbefalt å erstatte glukose med fruktose. Faktisk krever fruktose ikke deltakelse av insulin for absorpsjon. Men fruktose er enda vanskeligere å fordøye. Oppmerksomhet: i sukker er sukrosemolekylet et disakkarid - glukose + fruktose. Så vi spiser mindre sukker.
5. Unngå å drikke alkohol, spesielt øl. Vin i små mengder påvirker ikke urinsyrenivået.
6. Svært intens trening øker urinsyrenivået.
7. Du må drikke mye vann. Dette vil tillate deg å effektivt fjerne urinsyre.
Hvis du har høy urinsyre
Vel, for det første er dette heldigvis ikke alltid en patologi: en kortsiktig økning kan være en variant av normen
Hvis det fortsatt er et problem, må du finne ut på hvilket nivå det er et brudd (den aller første ordningen): forstyrrelser i syntesen av puriner (det samme metabolske syndromet), ernæringsfaktor (vi spiser mye kjøtt, drikker øl), nedsatt nyrefunksjon (nedsatt urinutskillelse syrer) eller samtidige sykdommer ledsaget av vevsdestruksjon.
Lykke til til deg og kompetente leger.
Hvis du finner en skrivefeil i teksten, vennligst gi meg beskjed. Velg et tekststykke og klikk Ctrl+Enter.
Nitrogenholdige forbindelser inkluderer proteiner, peptider, aminosyrer og deres derivater, nukleinsyrer, nukleotider og deres derivater, så vel som nitrogenholdige derivater av sukker. Hoveddelen av fiksert nitrogen står for proteiner, så nitrogenmetabolisme identifiseres ofte med proteinmetabolisme. Selv om aminosyrer som dannes under nedbrytningen av proteiner kan gjenbrukes til proteinbiosyntese (i gjennomsnitt 5 ganger), er en konstant tilførsel av aminosyrer i mat nødvendig for et normalt liv. Konsekvensene av utilstrekkelig inntak av proteinprodukter illustreres av kwashiorkor, en sykdom hos barn på grunn av ernæringsmessig mangel på protein når behovet for karbohydrater og lipider normalt er dekket (fig. 8-1).
Ris. 8-1. Den onde sirkelen til kwashiorkor
Det er generelt akseptert at en voksens minste daglige behov for protein er ca. 100 g. Dette behovet øker med intensiv vekst, restitusjon etter sykdom, graviditet og amming. Nitrogenbalansen (dvs. forholdet mellom nitrogen som forbrukes og utskilles) er en viktig indikator på kroppens tilstand og spesielt vekstprosesser.
Levetiden til proteiner i kroppen varierer fra titalls minutter til flere måneder, i gjennomsnitt 3 uker. Denne perioden kan reduseres av faktorer som stimulerer katabolisme, som glukokortikoider eller proinflammatoriske cytokiner.
PROTEIN FORDØYELSE
Pepsin i magen. Den viktigste mageproteinasen pepsin (en familie av aspartatproteinaser, basert på tilstedeværelsen av to asparaginsyrerester i det aktive senteret) dannes under påvirkning av det sure miljøet i magehulen fra to forløpere - pepsinogener I og II (eller A) og C), utskilt av hovedcellene i magen. Matinntak stimulerer frigjøringen av pepsinogener fra sekretoriske granulat med en parallell økning i syntese de novo. Den stimulerende effekten på utskillelsen av pepsinogener av ulike nervøse og humorale faktorer realiseres først og fremst ved å øke nivået av cAMP (sekretin, vasoaktivt intestinalt peptid (VIP), katekolaminer) eller intracellulært Ca 2+ (kolecystokinin - CCK, gastrin, gastrinfrigjørende peptid - GRP, bombesin, acetylkolin). Somatostatin undertrykker sekresjon. Den kjente ulcerogene effekten av farmakologiske doser av glukokortikoider kan delvis skyldes deres stimulerende effekt på ekspresjonen av pepsinogen C-genet, i den regulatoriske regionen som en funksjonell GKSE finnes. Basale nivåer av glukokortikoider er nødvendige for normale nivåer av pepsinogenekspresjon.
Pankreasproteinaser. Peptidproduktene fra fordøyelsen ved at pepsin kommer inn i tarmen fra magesekken, hydrolyseres videre av flere proteinaser dannet i lumen av duodenum fra inaktive forløpere (zymogener) som kommer fra bukspyttkjertelen. Aktiveringskaskaden initieres av enteropeptidase (eller enterokinase), uttrykt i enterocytter og begerceller i duodenum. Dette enzymet fjerner hemmende fragmenter fra trypsinogenpolypeptider (3 isoformer). Det resulterende trypsin (familie av serinproteinaser) katalyserer videre autoaktivering og aktivering av chymotrypsinogen (familie av serinproteinaser) og prokarboksypeptidase (2 isoformer). Syntesen og sekresjonen av zymogener i bukspyttkjertelen stimuleres adaptivt av proteinmat, antagelig
spesielt med deltakelse av kolecystokinin. Den stimulerende effekten av acetylkolin, insulin, sekretin, bombesin på utskillelsen av zymogener er også vist. Det antas at en av årsakene til utviklingen av pankreatitt kan være intracellulær (dvs. for tidlig) aktivering av zymogener.
TRANSPORT AV OLIGOPEPTIDER OG AMINOSYRER
Oligopeptider. Hoveddelen av produktene av proteinfordøyelse i mage og tarm er representert av di- og tripeptider. Disse oligopeptidene absorberes av cellene i slimhinnen i tynntarmen, hvor de hydrolyseres til aminosyrer under påvirkning av peptidaser. Transporten av oligopeptider over den apikale membranen til tarmceller er energiavhengig og bestemmes av H+-peptid-kotransportøren, PepT1.
Denne transportøren er et glykosylert protein som inneholder 12 transmembrane domener. Det er preget av lav substratspesifisitet (i stand til å transportere 400 forskjellige dipeptider, 8000 tripeptider, en rekke medikamenter som imiterer strukturen til di- og tripeptider, for eksempel β-laktamantibiotika) og lav affinitet for substrater. Energi for transport tilveiebringes av arbeidet med Na + ,K + -ATPase, lokalisert på den basolaterale overflaten av celler. En reduksjon i Na+-konsentrasjonen i cellene tjener som en drivkraft for funksjonen til Na+/H+-veksleren lokalisert på den apikale overflaten av cellene, som fjerner protoner fra cellene inn i tarmens lumen. Disse protonene blir deretter returnert til cellene sammen med oligopeptider gjennom H+-peptid-kotransportøren PepT1 (Figur 8-2).
Aktiviteten til H+-peptid-kotransportøren PepT1 er regulert av substrater på transkripsjonsnivå, men data om retningen til denne reguleringen er motstridende. Selv om den stimulerende effekten av dipeptider på PepT1-nivåer kan reproduseres in vitro på tarmcellekultur, er det mulig at in vivo effekten av substratet kan formidles av dets stimulerende effekt på gastrointestinale hormoner som glukagonlignende peptid.
 Insulin stimulerer PepT1-aktivitet, men dette skjer på post-translasjonelt nivå, ved å øke innsettingen av PepT1 i plasmamembranen. Leptin, som kan nå tarmceller både gjennom den systemiske sirkulasjonen og gjennom lumen Ris. 8-2.
Insulin stimulerer PepT1-aktivitet, men dette skjer på post-translasjonelt nivå, ved å øke innsettingen av PepT1 i plasmamembranen. Leptin, som kan nå tarmceller både gjennom den systemiske sirkulasjonen og gjennom lumen Ris. 8-2.
Transport av oligopeptider inn i tarmslimhinneceller
tarmene etter utskillelse i magen, øker uttrykket av PepT1 på transkripsjonsnivå og reduserer skjoldbruskhormoner.
Nyrene, lungene, hjernen og en rekke andre organer og vev uttrykker den PepT1-relaterte oligopeptidtransportøren, PepT2. Driftsprinsippet til denne transportøren ligner på PepT1.
PepT2 kan bruke di-, tri- og tetrapeptider som substrater, fortrinnsvis dipeptider. Dens affinitet for underlag er betydelig høyere enn for PepT1. I nyren er PepT2 lokalisert til den apikale overflaten av renale tubulære celler, hvor det medierer reabsorpsjon av oligopeptider fra urin. Bortsett fra den hemmende effekten av skjoldbruskkjertelhormoner og epidermal vekstfaktor på uttrykket av PepT2, er den hormonelle reguleringen av denne transportøren praktisk talt ikke studert. Lipid-dobbeltlaget i plasmamembranen til celler er ugjennomtrengelig for aminosyrer. For absorpsjon av aminosyrer i tarmen, reabsorpsjon fra urin, reopptak ved synapsen, frigjøring i blodet og inntreden i forbrukerceller, brukes et bredt spekter av aminosyretransportører, som er delt inn i to hovedgrupper: uavhengige og Na + avhengig. Aminosyretransportører viser svært høy spesifisitet for visse grupper av substrater.
Biogene aminer, skjoldbruskhormoner og en rekke medisiner kan også tjene som substrater for aminosyretransportører. En betydelig andel av Na+-avhengige transportører utfører den energiavhengige transporten av aminosyrer over plasmamembranen, mens Na+-uavhengige transportører gir lettere diffusjon av substrater. Et eksempel på den første gruppen av transportører er den protonkoblede aminosyretransportøren, PAT1, som hovedsakelig uttrykkes på den apikale overflaten av tarmslimhinneceller. Driftsprinsippet til denne transportøren er lik det til oligopeptidtransportøren PepT1, beskrevet ovenfor. Regulering av PAT1-aktivitet kan utføres, spesielt, ved fosforylering av Na+/H+-veksleren eller proteinene som regulerer den. SN1-transportøren overfører også aminosyrer gjennom utveksling av Na+/H+, men denne utvekslingen utføres av transportøren selv og skjer i motsatt retning av den som er beskrevet for PAT1-transportøren, koblet med Na+/H+-veksleren (fig. 8) -3). Spesielt SN1-transportøren sørger for at glutamin kommer inn i periportale hepatocytter for ureasyntese og omvendt eksporten av glutamin fra perisentrale hepatocytter inn i blodet og videre inn i nyrene. I nyrenes proksimale tubuli øker uttrykket av denne transportøren adaptivt under kronisk acidose (funksjonen er ammoniagenese for protonutskillelse, se nedenfor), og denne økningen fremmes av glukokortikoider. En annen variant av Na+-avhengig transport av aminosyrer kan observeres i tilfellet med ATA1-transportøren, som utfører felles transport av aminosyrer og Na+. I dette tilfellet fungerer protoner som allosteriske regulatorer av transportøren (se fig. 8-3).
Et eksempel på et aminosyretransportsystem ved tilrettelagt diffusjon er L-systemet til denne gruppen er bygget av to underenheter: lette og tunge, koblet sammen med en disulfidbinding. Den lette underenheten, som LAT1, spenner over plasmamembranen 12 ganger. Den tunge glykosylerte underenheten, slik som 4F2hc, inneholder kun ett transmembrant domene (fig. 8-4). Denne gruppen av transportører sørger først og fremst for utvekslingen mellom aminosyrer lokalisert i cellen og i det ekstracellulære miljøet. Viktigheten av dette transportsystemet ser ut til å være å sikre transmembranbevegelsen av aminosyrer, som er dårlige substrater for Na+-avhengige transportører. Dermed lokaliserte den dimere transportøren rbAT/ på den apikale overflaten av cellene i de proksimale tubuli i nyrene
 Ris. 8-3. Varianter av Na+-avhengige aminosyretransportører (a.a.): en- SN1-transportøren utfører fellestransporten av Na+ og aminosyrer i bytte mot et proton (protonet er nødvendig for reorientering av SN1 i membranen). SN1 formidler import av glutamin til periportale hepatocytter fra blodet og eksport av syntetisert glutamin fra perisentrale hepatocytter;
Ris. 8-3. Varianter av Na+-avhengige aminosyretransportører (a.a.): en- SN1-transportøren utfører fellestransporten av Na+ og aminosyrer i bytte mot et proton (protonet er nødvendig for reorientering av SN1 i membranen). SN1 formidler import av glutamin til periportale hepatocytter fra blodet og eksport av syntetisert glutamin fra perisentrale hepatocytter;
b- elektrogen transportør ATA1 virker lik SN1, men overfører ikke et proton
 Ris. 8-4. Aminosyretransportører:
Ris. 8-4. Aminosyretransportører:
EN- dimer aminosyretransportør b 0,+ er bygget av en tung kjede rbAT (lys tone) og en lett kjede b 0,+ +AT (mørk tone), koblet sammen med en disulfidbinding. Lokalisert på den apikale overflaten av cellene i nyrene, tynntarmen og hjernen;
b- b 0,+ transportøren utfører Na+-uavhengig utveksling av nøytrale og dibasiske aminosyrer og, sammen med den relaterte transportøren LAT2-4F2hc, i samarbeid med Na+-avhengige transportører, sikrer reabsorpsjon av cystin, arginin, lysin, ornitin . Transportørmangel er ledsaget av cystinuri
b 0,.+ AT sikrer reabsorpsjon av cystin fra primær urin, som videre omdannes i cellene til cystein, som deretter skilles ut i blodet gjennom den basolaterale membranen til cellen gjennom den andre dimere transportøren - 4F2/LAT2. Det energiske arbeidet til dette reabsorpsjonssystemet sikres av den Na+-avhengige transporten av aminosyrer byttet ut med henholdsvis cystin og cystein. Den stimulerende effekten av glukokortikoider på uttrykket av transportører av denne typen i nyrene er vist.
AMINOSYRE METABOLISME
Aminosyrer er på den ene siden et byggemateriale for biosyntese av proteiner og andre nitrogenholdige forbindelser, og på den andre en energikilde. Avhengig av om en bestemt aminosyre kan syntetiseres i kroppen, skilles ikke-essensielle og essensielle aminosyrer.
For proteinbiosyntese er en nødvendig betingelse å opprettholde en balanse mellom aminosyrer i cellen, tilsvarende deres innhold i proteiner. Denne balansen opprettholdes i stor grad på grunn av interkonvertering av aminosyrer. Interkonversjoner inkluderer to typer reaksjoner: transaminering og oksidativ deaminering/reduktiv aminering. De samme reaksjonene brukes til å bryte ned aminosyrer under glukoneogenese.
Reversible transaminasjonsreaksjoner, dvs. overføring av en aminogruppe fra ett substrat til et annet katalyseres av aminotransferaser. Ett substrat er aminosyre X, ved navnet som den tilsvarende aminotransferase kalles, eller den tilsvarende α-ketosyre X." Det andre substratet er representert av α-ketoglutarat/glutamat-paret. Avhengig av forholdet mellom konsentrasjonene av substratene vil reaksjonen være rettet mot dannelsen av enten aminosyre X eller glutamat Ved akkumulering av glutamat kan sistnevnte bli donor av en aminogruppe for α-ketosyren Y" med dannelse av aminosyre Y i. en reaksjon katalysert av den tilsvarende aminotransferase. Paritet mellom andre aminosyrer kan oppnås på samme måte.
Overskudd av aminosyrer kan elimineres ved oksidativ deaminering av glutamat under virkningen av glutamatdehydrogenase. Den omvendte reaksjonen av reduktiv aminering, tvert imot, kan øke mengden av aminosyrer i cellen
(Figur 8-5). Reaksjonskjeden angitt i figuren brukes også i prosessen med glukoneogenese: for eksempel nedbrytningen av muskelprotein stimulert av glukokortikoider under stress er ledsaget av inntreden av alanin i blodet, som transporteres til leveren gjennom pyruvat
 Ris. 8-5. Interomdannelser av aminosyrer.
Ris. 8-5. Interomdannelser av aminosyrer.
Aminotransferaser overfører aminogruppen til α-ketoglutarat. Det resulterende glutamatet gjennomgår oksidativ deaminering. Omvendte reaksjoner sikrer syntesen av aminosyrer.
sendt til glukosesyntese. Glukoneogenese indusert av glukokortikoider lettes også av den kjente evnen til disse hormonene til å stimulere transkripsjonen av gener for en rekke aminotransferaser.
AMMONIKKUTVEKSLING
Glutamin er en viktig energikilde, spesielt for tarmceller og immunsystemet, en forløper for glukoneogenese og en ammoniakktransportør. Det er den dominerende aminosyren i blodet. Glutaminmetabolisme utføres med deltakelse av det cytosoliske enzymet glutaminsyntase og to isozymer av mitokondriell glutaminase (fig. 8-6).
Aktiviteten til hepatisk glutaminase øker under faste, diabetes og høyt proteininnhold i mat. Alle disse tilstandene er preget av økt katabolisme av aminosyrer som kommer inn i leveren, delvis rettet mot å øke glukoneogenesen og fjerne overflødig nitrogen gjennom ureasyklusen.
 En økning i enzymaktivitet oppstår, spesielt under påvirkning av glukagon Ris. 8-6.
En økning i enzymaktivitet oppstår, spesielt under påvirkning av glukagon Ris. 8-6.
Interkonverteringer av glutamat og glutamin
på grunn av induksjon av gentranskripsjon gjennom det cAMP-responsive elementet (CRE) og glukokortikoider gjennom GKCE (fig. 8-7).
Ved kronisk metabolsk acidose øker aktiviteten til nyreglutaminase. Hovedoppgaven til dette enzymet er å generere ammoniakk for å binde protoner og skille dem ut i urinen. Effekten realiseres på post-transkripsjonelt nivå på grunn av stabiliseringen av enzymet mRNA. Mekanismen involverer interaksjonen av det pH-responsive elementet (pHRE) i den 3"-utranslaterte regionen av mRNA (som er en direkte repetisjon av 8 baser anriket på adenosin og uridin) med zeta-krystallin (se fig. 8-7). .
Under stress øker aktiviteten til glutaminsyntase i muskler og lunger. Effekten realiseres på transkripsjonsnivå. For eksempel, i lungene øker enzymets mRNA 10 ganger. Glukokortikoider virker på ekspresjonen av enzymet gjennom det kanoniske GKSE i 1. intron og 3. halvsted av GKSE i det fjerntliggende regulatoriske området av genet.
Under kronisk stress øker aktiviteten til glutamatdehydrogenase i nyrene, og omdanner glutamat til α-ketoglutarat med frigjøring av ammoniakk. Regulering utføres på post-transkripsjonelt nivå ved å stabilisere enzymet mRNA på grunn av bindingen av fire pHRE-er lokalisert i den 3"-utranslaterte regionen til zetakrystallin, dvs. lik reguleringen av nyreglutaminase.
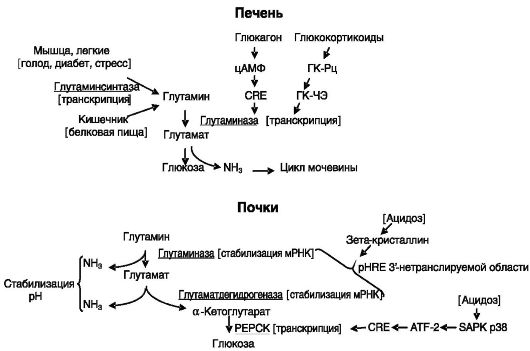 Utnyttelse av α-ketoglutarat dannet under acidose i nyrene skjer gjennom induksjon av glukoneogeneseenzymer. Induksjon av en av dem, fosfoenolpyruvat karboksykinase (PEPCK), skjer på transkripsjonsnivå: en reduksjon i indre Ris. 8-7.
Utnyttelse av α-ketoglutarat dannet under acidose i nyrene skjer gjennom induksjon av glukoneogeneseenzymer. Induksjon av en av dem, fosfoenolpyruvat karboksykinase (PEPCK), skjer på transkripsjonsnivå: en reduksjon i indre Ris. 8-7.
Cellulær pH er ledsaget av aktivering av stressaktivert proteinkinase p38 (SAPK p38), som fosforylerer transkripsjonsfaktoren ATF-2, som interagerer med det cAMP-responsive elementet (CRE) til PEPCK-genet, som stimulerer transkripsjon.
UREASYKLUS
Den energiavhengige dannelsen av urea i leveren hos pattedyr er hovedveien for utnyttelse av ammoniakk dannet fra aminosyrer og andre nitrogenholdige forbindelser. Syntesen av urea involverer dannelsen av karbamoylfosfat fra karbondioksid og ammoniakk, som, i samspill med ornitin, produserer citrullin. Med deltakelse av aminogruppen til aspartat, gjennom dannelsen av en mellomforbindelse, argininoravsyre, syntetiseres arginin, hvis hydrolyse produserer urea og det opprinnelige ornitin (fig. 8-8).
Syntesen av karbamoylfosfat kan katalyseres av to enzymer: mitokondriell karbamoylfosfatsyntase I, karakteristisk for leveren og delvis tarm, og det vidt uttrykte proteinet CAD (karbamoylfosfatsyntase II), som har karbamoylfosfatsyntaseaktivitet.
 Ris. 8-8. Urea syklus
Ris. 8-8. Urea syklus
bamoylfosfatsyntase, aspartat transkarbamylase og dihydroorotase, som katalyserer 3 av de 6 reaksjonene i pyrimidinbiosyntesen.
Overføringen av karbamoylgruppen til ornitin katalyseres av ornitinkarbamoyltransferase. Mitokondrieenzymet uttrykkes hovedsakelig i leveren og tarmslimhinnen. Enzymmangel er en av årsakene til hyperammonemi, ledsaget av oppkast, sløvhet, anfall og noen ganger død.
Mangel på argininosuccinatsyntase, enzymet som katalyserer interaksjonen mellom citrullin og aspartat, fører til citrullinemi, ledsaget av anfall av oppkast og mental retardasjon. Dannelsen av arginin fra argininosuccinsyre katalyseres av argininosuccinatlyase. Enzymmangel forårsaker arginin succinicesiduri, ledsaget av retardasjon i mental og fysisk utvikling, forstørret lever, skade på integumentet og periodisk tap av bevissthet.
Dannelsen av urea fra arginin katalyseres av arginase. Enzymet er representert av to isozymer (I og II). Cytosolisk arginase I (homotrimer) uttrykkes primært i leveren, hvor det medierer dannelsen av urea. Leverarginasemangel forårsaker argininemi, ledsaget av forsinket utvikling av psykomotorisk funksjon, spastisk lammelse av de fire lemmer.
tey.
Uttrykket av arginase I, så vel som mitokondriell arginase II (homoheksamer) i andre organer og vev kan gi andre aspekter av metabolismen av nitrogenholdige forbindelser (tilveiebringer ornitin for biosyntesen av glutamat, glutamin, GABA, agmatin, polyaminer, kreatin, prolin , NEI). Spesielt kan arginase konkurrere med NO-syntase om arginin som et substrat og dermed delta i reguleringen av prosesser kontrollert av NO og cGMP (for eksempel ereksjon).
 Enzymer i ureasyklusen stimuleres av katabolske hormoner (glukokortikoider, glukagon) på transkripsjonsnivå. Induksjon kan være direkte eller indirekte gjennom stimulering av biosyntesen av transkripsjonsfaktoren C/EBP (fig. 8-9). Ris. 8-9.
Enzymer i ureasyklusen stimuleres av katabolske hormoner (glukokortikoider, glukagon) på transkripsjonsnivå. Induksjon kan være direkte eller indirekte gjennom stimulering av biosyntesen av transkripsjonsfaktoren C/EBP (fig. 8-9). Ris. 8-9.
En fjern forsterker gir stimulering av transkripsjon av karbamoylfosfatsyntasegenet av glukokortikoider og glukagon (a). Arginase-1-genforsterkeren gir stimulering av glukagon og (indirekte, gjennom induksjon av C/EBP) glukokortikoider (b):
C/EBP, CCAAT/enhancer-bindende protein; HNF3 - hepatocytt nukleær faktor 3; GRU - glukokortikoid sensorenhet Adibi S.A.
Regulering av ekspresjon av den intestinale oligopeptidtransportøren (Pept-1) i helse og sykdom. Am J Physiol Gastrointest Lever Physiol. 2003;285(5):G779-788. Curthoys N.P., Gstraunthaler G.
Mekanisme for økt renal genuttrykk under metabolsk acidose. Am J Physiol Renal Physiol. 2001;281(3):F381-390. Desvergne B., Michalik L., Wahli W.
Transkripsjonell regulering av metabolisme. Fysiol Rev. 2006;86(2):465-514. Wagner C.A., Lang F., Broer S.
Funksjon og struktur av heterodimere aminosyretransportører. Am J Physiol Cell Physiol. 2001;281(4):C1077-1093. Wu G., Jaeger L.A., Bazer F.W., Rhoads J.M.
Argininmangel hos premature spedbarn: biokjemiske mekanismer og ernæringsmessige implikasjoner. J Nutr Biochem. 2004;15(8):442-451.
Formen for proteinnitrogenutskillelse - i form av ammoniakk, urea eller urinsyre - er nært knyttet til fargens livsbetingelser og tilgjengeligheten av vann (tabell 10.4). Ammoniakk er svært giftig selv i svært små konsentrasjoner, så det må raskt
Hos de fleste virvelløse dyr i vann er sluttproduktet av proteinmetabolismen ammoniakk. På grunn av dens lette løselighet og lave molekylvekt, diffunderer den ekstremt raskt. En betydelig del av det kan skilles ut gjennom alle overflater i kontakt med vann - ikke nødvendigvis gjennom nyrene. Hos benfisk skilles det meste av nitrogen ut i form av ammoniakk gjennom gjellene. Hos karpe og gullfisk skiller gjellene ut 6-10 ganger mer nitrogen enn nyrene, og kun 10 % av det er urea; de resterende 90 % skilles ut som ammoniakk (Smith, 1929).
UREA
Urea er lett løselig i vann og har ganske lav toksisitet. Syntesen av urea i høyerestående dyr ble studert av den berømte biokjemikeren Hans Krebs - den samme forskeren som syklusen med oksidativ energimetabolisme (trikarboksylsyresyklusen eller Krebs-syklusen) ble oppkalt etter.
Ved ureasyntese kondenserer ammoniakk og karbondioksid med fosfat for å danne karbamoylfosfat, som deretter brukes til å syntetisere citrullin fra ornitin, som vist i fig. 10.13. Etter dette tilsettes et annet molekyl ammoniakk fra asparaginsyre, og dette fører til dannelsen av aminosyren arginin. I nærvær av enzymet arginase brytes arginin ned til urea og ornitin. Et nytt citrullinmolekyl syntetiseres fra ornitin, og hele syklusen gjentas; derfor kalles hele denne transformasjonsveien ornitin syklus urea syntese. Tilstedeværelsen av arginase i et dyr indikerer dets evne til å produsere urea og indikerer ofte at urea er dets viktigste nitrogenholdige utskillelse. Men dette er ikke nødvendigvis tilfelle, siden det er mulig for arginase å være tilstede selv i fravær av hele syklusen.
UREA HOS VERTEBRATER
Virveldyr som hovedsakelig utskiller urea og har enzymer fra ornitinsyklusen for syntesen, er vist i fig. 10.14. En viss mengde urea skilles ut av benfisk, og hos elasmobranchs, amfibier og pattedyr er det den viktigste nitrogenholdige utskillelsen. Hos elasmobranchs (haier og rokker), så vel som i den krabbespisende frosken og coelacanth Latimeria urea holdes tilbake i kroppen og spiller
en viktig rolle i selvregulering og er derfor et verdifullt stoffskifteprodukt. Hos elasmobranchs filtreres urea i glomerulus, men på grunn av dets betydning for osmoregulering bør det ikke gå tapt i urinen; derfor returneres det som et resultat av aktiv reabsorpsjon i tubuli. Hos amfibier er situasjonen annerledes.

Urea filtreres, og i tillegg tilsettes en betydelig mengde av det til urinen ved aktiv sekresjon i tubuli. Dermed har både elasmobranchs og amfibier aktiv rørformet transport av urea, men det går i ulike retninger i disse gruppene. Pumpemekanismene her er åpenbart ikke metabolsk identiske, siden forsøk med en rekke ureaderivater som ligger nær hverandre gir ulike resultater i begge dyregruppene (tabell 10.5). Dette er et utmerket eksempel på hvordan den samme fysiologiske funksjonen oppstår uavhengig i to grupper, uten nødvendigvis å bruke de samme mekanismene for å oppnå samme mål (i dette tilfellet aktiv ureatransport).
I den krabbespisende frosken, som også beholder urea for osmoregulering, aktiv reabsorpsjon av dette stoffet i tubuli
ikke funnet (Schmidt-Nielsen, Lee, 1962). Urinen hennes dannes sakte, og nyretubuli er svært permeable for urea. Derfor diffunderer urea ut av den rørformede væsken

Ris. 10.14. Nitrogenfrigjøring på forskjellige stadier av virveldyrfylogenese. Linjer" er omgitt av grupper av dyr som skiller ut henholdsvis ammoniakk, urea og urinsyre som hovedekskrement. (B. Schmidt-Nielsen, 3972.)
tilbake i blodet og vises i urinen i omtrent samme konsentrasjon som i blodet. Dermed går bare små mengder tapt i urinen.
Hvis det oppstår aktiv tubulær sekresjon av urea hos vanlige frosker, hvorfor bruker ikke den krabbespisende frosken
Tabell 10.5
Urea transporteres aktivt av nyretubuli til haien (aktiv reabsorpsjon) og frosk (aktiv sekresjon). Men med tre andre beslektede stoffer er resultatene oppnådd i disse to dyreartene helt forskjellige. Dette antyder at den cellulære transportmekanismen i nyrene deres er annerledes. (B. Schmidt-Nielsen, Rabinovitz, 1964)

en slik pumpe, ganske enkelt ved å endre retningen til motsatt? Dette spørsmålet er ikke lett å svare på, men det ser ut til at retningen for aktiv transport er en konservativ fysiologisk funksjon som ikke lett kan endres. Som vi allerede har sett, både i huden til en frosk og i nyrene til et pattedyr, er retningen for aktiv transport av natriumklorid fra utsiden og inn i kroppen bevart. Men i pattedyrenyren brukes den innovervendte omvendte transporten av NaCl fra rørvæsken inn i kroppen i et multipliserende motstrømssystem på en slik måte at sluttresultatet likevel blir konsentrert urin.
Det vanlige synet på utskillelse av urea fra pattedyrs nyre er at urea filtreres i glomerulus og passerer deretter passivt gjennom tubuli, selv om noe av det, på grunn av sin høye diffusivitet, passivt diffunderer tilbake i blodet. Det er imidlertid; overbevisende bevis på at urea fungerer som et viktig element i det multipliserende motstrømssystemet og at utskillelsesmåten for urea er et essensielt element i nyrefunksjonen hos pattedyr.
UREA OG METAMORFOSE HOS AMFIBIER
Rumpetrollene til frosker og padder produserer hovedsakelig ammoniakk; voksne dyr skiller ut urea. Hos frosken (Rana temporaria), padder (Bufo bufo) triton (Triturus uulgaris) og andre amfibier under metamorfose er det en klar overgang fra frigjøring av ammoniakk til utskillelse av urea. Den sørafrikanske klørfrosken (Xenopus), som forblir i vannet selv i voksen tilstand, fortsetter å frigjøre ammoniakk på dette stadiet (tabell 10.6).
Overgangen til ureautskillelse under metamorfose hos semi-terrestriske amfibier er relatert; med en merkbar økning i aktiviteten til alle enzymer i ornitinsyklusen i leveren (Brown et al., 1959).
Tabell 10.6
Ammoniakkproduksjon i landpadden Bufo bufo og i en fullstendig akvatisk haleløs amfibi Xenopus laevis. Tallene indikerer frigjøring av fri ammoniakk som en prosentandel av den totale mengden ammoniakk og urea som frigjøres på ulike utviklingsstadier. (Munro, 1953)

Interessant nok individer av akvatiske amfibier Xenopus, ekstrahert: i flere uker fra vann akkumuleres urea i blodet og vevet. Ureaakkumulering kan induseres ved å plassere dyr i en 0,9 % NaCl-løsning. Når voksne ble holdt utenfor vann, men i fuktig mose (for å unngå dehydrering), økte konsentrasjonen av urea i blodet 10-,20 ganger og nådde nesten 100 mmol/l. Etter at dyrene kom tilbake til vannet, ble overflødig urea frigjort (Balinsky et al, 1961).
I en gruppe individer Xenopus, som under naturlige forhold opplevde sommertørke i silt nær en uttørket dam, ble også konsentrasjonen av urea økt med 15-20 ganger. Blant enzymene som er involvert i ureasyntese, økte mengden karbamoylfosfatsyntetase, ansvarlig for det første syntesestadiet (se fig. 10.13), omtrent seks ganger, men aktiviteten til de gjenværende enzymene i syklusen endret seg ikke. Det er mulig at karbamoylfosfatsyntese er det hastighetsbegrensende trinnet i ureasyntese, og økninger i dette enzymet vil sannsynligvis holde plasmaammoniakk lav når dyrene er ute av vann (Balinsky et al., 1967).
Urea i lungefisk
I den afrikanske lungefisken Protopterus Absolutt de samme endringene skjer som hos amfibier. Under normale forhold, når en slik fisk lever i vann, frigjør den mye ammoniakk
(og en viss mengde urea), men når den under en tørke befinner seg i en kokong i tørket silt, omdannes alt dets nitrogenholdige avfall til urea, som samler seg i blodet, hvor konsentrasjonen ved slutten av fiskens tre- års opphold i kokongen kan nå 3 % (500 mmol/l) (Smith, 1959).
Alle de fem enzymene i ornitinsyklusen ble funnet i leveren til den afrikanske lungefisken (Janssens og Cohen, 1966). Nivåene av to enzymer som begrenser hastigheten på ureasyntese er like i denne fisken og i froske-rumpetrollen Rana catsbeia og betydelig lavere enn nivåene funnet hos voksne frosker. Dette samsvarer med at lungefisk fortrinnsvis frigjør ammoniakk når den er i vann. Imidlertid ble det beregnet at mengden ornitinsyklusenzymer inneholdt i leveren til lungefisk som ikke er i dvale er tilstrekkelig til å sikre akkumulering av urea som faktisk observeres under dvalemodus (Forster og Goldstein, 1966).
I den australske lungefisken Neoceratodus konsentrasjonene av enzymer i ornitinsyklusen er lave, noe som stemmer overens med livsstilen til denne fisken: den bruker bare lungene som et ekstra åndedrettsorgan og kan bare overleve en kort stund i luften (for lungefisks åndedrett, se kapittel 2). Syntesen av urea i deler av leveren til australsk lungefisk er hundre ganger langsommere enn hos afrikansk lungefisk. Dette er igjen i samsvar med den rent vannlevende livsstilen til den første av dem (Goldstein et al., 1967).
URISYRE
Urinsyreproduksjon dominerer i insekter, landsnegler, de fleste krypdyr og fugler. Alle disse er typisk landdyr, og dannelsen av urinsyre i dem kan betraktes som en effektiv tilpasning som sparer vann når man lever på land. Siden urinsyre og dens salter er svært dårlig løselig i vann (oppløseligheten er ca. 6 mg per 1 liter vann), fører reabsorpsjon av vann fra urin til utfelling av urinsyre og dens salter.
URISYRE I FUGL OG INSEKTER
Den halvfaste hvite delen av fugleskitt er urin og består hovedsakelig av urinsyre; For å skille ut nitrogenholdig ekskrementer bruker fugler svært lite vann hos noen insekter, reduksjonen i vanntapet gjennom urinen har gått så langt at de ikke skiller ut urinsyre i det hele tatt, men avsettes i forskjellige deler av kroppen, hovedsakelig i;
fet kropp. Derfor trenger ikke slike former vann i det hele tatt for å fjerne de endelige nitrogenholdige produktene (Kilby, 1963).
Det har blitt antydet at bruk av urinsyre som hovedekskrement gir en annen fordel for fugler. Fordi de krever lite vann for å produsere urin, antas utskillelsen av urinsyre å redusere kroppsvekten hos flygende fugler. Men denne ideen er ikke overbevisende, siden fugler med tilgang til vann (både ferskvann og marine) ofte skiller ut store mengder flytende urin.
KLEIDOISK EGG
Joseph Needham foreslo at forskjellen mellom de virveldyrene som produserer urea (pattedyr og amfibier) og de som produserer urinsyre (krypdyr og fugler) først og fremst skyldes reproduksjonsmåten. Et amfibieegg utvikler seg i vann, mens et pattedyrembryo utvikler seg i et flytende miljø i livmoren, hvor metabolske avfallsstoffer kommer inn i morens blod. På den annen side skjer den embryonale utviklingen av krypdyr og fugler i en lukket, s.k. Cleidic et egg som bare utveksler gasser med det ytre miljøet, og all ekskrementer forblir inne i skallet. Vanntilførselen i det cleidiske egget er svært liten, og ammoniakk er selvfølgelig for giftig til at embryoet tåler det i store mengder. Hvis urea ble produsert, ville det forbli i egget og akkumuleres i oppløst tilstand. I mellomtiden kan urinsyre utfelles og derved i det vesentlige elimineres; dette er hva som skjer når det avsettes som krystaller i allantois, som dermed fungerer som embryonalblæren.
URISYRE I REPTILER
Øgler og slanger skiller ut primært urinsyre; mange skilpadder skiller ut en blanding av urinsyre og urea, mens krokodiller hovedsakelig skiller ut ammoniakk (Cragg et al., 1961). Dette samsvarer med den generelle ideen om at nitrogenutskillelsesmåten er nært knyttet til mengden tilgjengelig vann i miljøet.
Krokodiller og alligatorer skiller ut ammoniakk i urinen, hvor hovedkationen er NH4+ og hovedanionen er HCO 3 - (Coulson et al., 1950; Goulson og Hernandez, 1955). Det er mulig at tilstedeværelsen av disse ionene i urinen hjelper disse ferskvannene
Det er bedre for dyr å beholde Na + og C1 - ioner, tapet av disse i avføring, forresten, er også veldig lite.
Det kan neppe være noen tvil om den nære sammenhengen mellom habitatet til skilpadder og deres nitrogenutslipp. I tabellen Figur 10.7 viser sammensetningen av urinprøver fra åtte arter av skilpadder hentet fra London Zoo. Arter med den mest uttalte akvatiske livsstilen produserer betydelige mengder ammoniakk og urea og bare spor av urinsyre; i de mest landboende formene skilles mer enn halvparten av nitrogenet ut i form av urinsyre.
Tabell 10.7
Andel nitrogen i urinen til forskjellige skilpadder (som en prosentandel av totalt utskilt nitrogen). Formene som er mest knyttet til vann produserer nesten ingen urinsyre, men dette stoffet er dominerende i landlevende arter fra tørre områder. Moyle, 1949 )

Det er motstridende informasjon om hvorvidt skilpadder primært skiller ut urea eller urinsyre. Faktum er at ikke bare artene er forskjellige, men også innenfor én art kan enkelte individer skille ut overveiende urinsyre, andre – hovedsakelig urea, og atter andre – en blanding av begge stoffene (Khalil, Haggag, 1955). Selv samme individ kan flytte fra en forbindelse til en annen over tid. Noen
mengden utfelt urinsyre holdes tilbake i cloacaen, og den flytende delen av urinen skilles ut; dette gjør det upålitelig å bestemme den resulterende urinsyren ved å analysere en eller flere urinprøver: hvis cloacaen ikke er fullstendig tømt, kan svært lave tall oppnås, og med en slik evakuering, når sedimentet som har samlet seg over en tid kommer ut , vil det være for mye urinsyre.
Ved skilpadden Testudo mauritanica overgangen fra urea til urinsyre og tilbake ser ut til å være direkte avhengig av temperatur og vanninnhold i kroppen. Utskillelsen av urinsyre øker når væskebalansen er ugunstig, men mekanismen som driver denne endringen i biokjemisk aktivitet er uklar.
Vi nevnte allerede i kapittel 9 at den afrikanske frosken Chiromantis xerampelina mister vann gjennom huden veldig sakte, omtrent i samme hastighet som krypdyr. Det ligner på krypdyr ved at det hovedsakelig skiller ut urinsyre, og ikke urea, som vanligvis er karakteristisk for voksne amfibier. Dette er et oppsiktsvekkende faktum, siden det motsier den allment aksepterte ideen om nitrogenutskillelse hos amfibier. Nøyaktigheten av denne rapporten er hevet over tvil, siden urinsyre ble bestemt i urin Chiromantis ved en enzymatisk metode spesifikk for dette stoffet, og det ble funnet at det utgjør opptil 60-75 % av tørrvekten av urin (Loveridge, 1970).
Sørafrikansk frosk Phyllotnedusa sauvagii i denne henseende ligner den også på krypdyr. Tapet av vann gjennom huden er av samme størrelsesorden som for krypdyr med sine tørre integumenter, og urinen inneholder en stor mengde halvfast sediment av urat (Shoemaker et al., 1972). I form av urat Phyllomedusa 80 % av det totale nitrogenet frigjøres, og økt vannforbruk endrer ikke intensiteten av uratdannelse. Denne arten fortsetter å skille ut primært urinsyre selv når det er overflødig vann. Når frosken trenger å spare vann, blir utskillelsen av urinsyre (i stedet for urea) veldig viktig. Det er beregnet at hvis utskillelsesproduktet til denne frosken var urea, ville det trenge omtrent 60 ml vann per dag per 1 kg kroppsvekt for å danne urin. I mellomtiden, takket være det faktum at P. sauvagii skiller ut urinsyre, mister den kun 3,8 ml vann per dag per 1 kg kroppsvekt i urinen (Shoemaker, McClanahan, 1975).
AMMONIKK OG NYREFUNKSJON
Av alt som er sagt ovenfor, kan det se ut til at ammoniakk hovedsakelig slippes ut av vannlevende dyr, men dette er ikke helt sant. Ammoniakk finnes også normalt i urinen til landdyr, der det tjener til å regulere pH i urinen. Hvis urinen blir sur på grunn av frigjøring av sure avfallsstoffer, tilsettes ammoniakk for å nøytralisere den.
Overflødig syre dannes vanligvis under proteinmetabolisme, siden sluttproduktet av oksidasjon av den svovelholdige aminosyren cystein er svovelsyre. Jo surere urinen er, jo mer ammoniakk tilsettes. Ammoniakk, som brukes til å nøytralisere sur urin, dannes i nyrene fra aminosyren glutamin. Nyrene inneholder glutaminase, og den er der spesielt for å produsere ammoniakk. Derfor er ikke ammoniakken i pattedyrurin direkte relatert til ammoniakken som dannes i leveren under deaminering av aminosyrer, og i denne forstand bør den ikke betraktes som et normalt sluttprodukt av proteinmetabolisme.
NUKLEINSYRER OG NITROGEN UTSLIPP
Nukleinsyrer inneholder to grupper nitrogenholdige forbindelser: puriner (adenin og guanin) og pyrimidiner (cytosin og tymin). Hos noen dyr skilles puriner ut som urinsyre (som i seg selv er en purin); hos andre dyr brytes purinstrukturen ned til en serie mellomforbindelser eller til ammoniakk, hvorav hvilken som helst kan skilles ut fra kroppen.
Den metabolske nedbrytningen av puriner og frigjøringen av dets sluttprodukter er ikke studert så grundig som metabolismen av protein 13ot. De viktigste dataene er gitt i tabell. 10.8. Hos fugler, landkrypdyr og insekter brytes puriner ned til urinsyre og sistnevnte skilles ut fra kroppen. Dette er dyrene der urinsyre syntetiseres fra aminnitrogen; Åpenbart ville det være meningsløst for et dyr å syntetisere urinsyre og samtidig ha mekanismer for dens nedbrytning. Derfor kan man ikke forvente ytterligere nedbrytning av puriner hos de dyrene der urinsyre er sluttproduktet av proteinmetabolismen.
Blant pattedyr utgjør mennesker, menneskeaper og Grand Danois en spesiell gruppe: de skiller ut urinsyre, mens andre pattedyr skiller ut allantoin. Allantoin dannes fra urinsyre gjennom en enkelt transformasjon i nærvær av enzymet urikase. Mennesker og menneskeaper har ikke dette enzymet. På grunn av den lave løseligheten blir urinsyre noen ganger avsatt i menneskekroppen, noe som forårsaker hevelse i leddene og en veldig smertefull sykdom -
Tabell 10.8
Nitrogenholdige sluttprodukter av purinmetabolisme hos forskjellige dyr. (Keilin, 1959)

gikt Hvis mennesker beholdt enzymet urikase, ville gikt ikke eksistere.
Selv om dalmatinerhunden produserer mye mer urinsyre enn andre hunder, skyldes dette ikke noen form for metabolsk defekt. Leveren til hver hund inneholder urikase og produserer noe allantoin. Men Grand Danois har en nyrefeil som hindrer tubulær reabsorpsjon av urinsyre (som forekommer hos andre pattedyr, inkludert mennesker); derfor, hos Grand Danois, tapes urinsyre i urinen raskere enn den prosesseres av leveren til allantoin (Yu et al., I960). Mye tyder på at urinsyre hos den dalmatiske dansken ikke bare filtreres i glomerulus, men også skilles ut ved aktiv transport i tubuli (Keilin, 1959).
Purinene adenin og guanin ligner i strukturen på urinsyre: de inneholder en seks-leddet ring og en fem-leddet. Men pyrimidiner (cytosin og tymin) er enkle seksleddede ringer som inneholder to nitrogenatomer. Hos høyere virveldyr spaltes pyrimidiner ved å bryte denne ringen for å produsere ett molekyl ammoniakk og ett molekyl β-aminosyre. Sistnevnte metaboliseres deretter i henhold til det vanlige deamineringsskjemaet.
Det mest slående trekk ved nukleinsyremetabolisme er at de "høyere" dyrene er oppført i begynnelsen av tabellen. 10.8, er fullstendig blottet for enzymer som er nødvendige for nedbrytning
puriner. Blant de "lavere" dyrene finner vi en økende kompleksitet av biokjemiske og enzymatiske systemer som ytterligere bryter ned puriner, slik at de "laveste" formene har det mest komplette enzymapparatet.
ANDRE NITROGENFORBINDELSER
Hos edderkopper er hovedutskillelsen guanin Tilsynelatende er det syntetisert fra aminnitrogen, selv om hele dannelsesveien er ukjent. Noen edderkopper, inkludert fuglespisende taranteller, skiller ut mer enn 90 % av deres totale nitrogen i form av guanin etter å ha spist (Peschen, 1939). I den vanlige hagen edderkopp Epeira diadema identifiseringen av guanin ble bekreftet ved en veldig spesifikk enzymatisk metode (Vajropala, 1935).
Guanin er også ganske vanlig i en rekke andre dyr. For eksempel skyldes den sølvblanke glansen av fiskeskjell avsetningen av guaninkrystaller. hagesnegl Helix frigjør guanin, men bare i en grad av ca. 20 % av den totale mengden puriner som skilles ut, og de resterende 80 % er urinsyre. Det er mulig at denne fraksjonen er et produkt av nukleinsyremetabolisme, og urinsyre dannes som et resultat av proteinmetabolisme.
Aminosyrer inntar ikke en viktig plass blant produktene av nitrogenmetabolisme, men de finnes i små mengder i urinen til mange dyr. Det ser ut til at det er mer lønnsomt for dyret å deaminere aminosyren, skille ut ammoniakk på vanlig måte og bruke den resulterende organiske syren i energimetabolismen. Men siden aminosyrer kun spiller en mindre rolle i nitrogenutskillelsen, vil dette spørsmålet ikke bli diskutert her.
REKAPTULERINGSTEORI
Det ble generelt antatt at nitrogenproduksjonen i det utviklende kyllingembryoet varierte over tid og gikk gjennom en rekke topper: ammoniakk var hovedproduktet først, deretter urea og til slutt urinsyre. Det ble antatt at slik utvikling rekapitulerer stadier av evolusjon, som hos fugler ender med frigjøring av urinsyre. Produksjonen av ammoniakk i kyllingembryoet er rapportert å ha en topp etter 4 dager, urea ved 9 dager og urinsyre 11 dager etter starten av inkubasjonen (Baldwin, 1949).
Nyere arbeid antyder at nitrogenutskillelse i kyllingembryoet skiller seg kraftig fra dette tidligere beskrevne bildet (Clark og Fischer, 1957). Alle de tre hovedekskresjonsproduktene - ammoniakk, urea og urinsyre - dannes og er tilstede helt fra begynnelsen av embryonal utvikling. Mot slutten
Inkubasjonstiden for urinsyre blir mye lengre enn de to andre produktene. Mengden urea og ammoniakk fortsetter imidlertid å øke gjennom hele inkubasjonen, og ved klekkingstid er begge stoffene tilstede i omtrent like store mengder. Ved slutten av inkubasjonen når mengden av frigjort nitrogen 40 mg, hvorav 23 % deles likt mellom urea og ammoniakk, og resten er urinsyre (fig. 10.15).

Hva er årsaken til avviket i de oppnådde resultatene? Tidligere data kan ha vært mindre nøyaktige på grunn av mer primitive analysemetoder, men dette er usannsynlig å forklare de individuelle toppene som er observert. Hovedårsaken er ganske enkelt at resultatene ble uttrykt i mengder av hvert ekskresjonsprodukt per vektenhet av embryoet. Og siden embryoet kontinuerlig og jo lenger det går, jo raskere øker det i størrelse,
å dele mengden av hvert stoff på vekten av embryoet skaper en kunstig topp.
Faktisk er alle tre utskillelsesproduktene tilstede helt fra begynnelsen og øker gradvis i antall gjennom fosterutviklingen, men etter den 10. inkubasjonsdagen øker mengden ammoniakk litt. Urea produsert av embryoet syntetiseres ikke fra aminosyrenitrogen i ornitinsyklusen, men som et resultat av virkningen av arginase på arginin (Eakin og Fisher, 1958). Dermed støtter verken dannelsen av ammoniakk eller syntesen av urea i kyllingembryoet ideen om at ontogenien til biokjemiske mekanismer gjentar den evolusjonære historien til nitrogenutskillelse.
Vi undersøkte ulike utskillelsesorganer og beskrev deres generelle trekk. Disse organene fjerner metabolsk avfall, bidrar til å opprettholde riktige konsentrasjoner av salter og andre oppløste stoffer, og regulerer kroppens vanninnhold, sparer nøye vann når kroppen er lav og fjerner overflødige mengder.
Overbevisende bevis viser imidlertid at dette ikke alltid er sant. Noen forskere (f.eks. Costa et al., 1968, 1974) rapporterer dannelsen av nitrogengass hos pattedyr som mates med store mengder protein. Denne informasjonen bør endre noen av våre ideer om proteinmetabolisme og nitrogenholdige sluttprodukter.
På gresk betyr kleisto lukket, fra kleis betyr nøkkel.
De to froskeartene som er beskrevet her lever i tørre, halvørkenområder. - Ca. utg.
 Forholdet mellom menneske og natur Forholdet mellom menneske og natur
Forholdet mellom menneske og natur Forholdet mellom menneske og natur Sammensatte ord med en forbindelsesvokal
Sammensatte ord med en forbindelsesvokal Urinsyre i blodet: normer og avvik, hvorfor det øker, kosthold for å redusere det Sluttproduktet av nitrogenmetabolismen er
Urinsyre i blodet: normer og avvik, hvorfor det øker, kosthold for å redusere det Sluttproduktet av nitrogenmetabolismen er