Valens av alle kjemikalier. Valens og syrer
Instruksjon
Tabellen er en struktur der de kjemiske elementene er plassert i henhold til deres prinsipper og lover. Det vil si at vi kan si at det er et fleretasjes "hus" der kjemiske elementer "bor", og hver av dem har sin egen leilighet under et visst antall. Horisontalt er det "gulv" - som kan være små og store. Hvis perioden består av to rader (som er angitt på siden ved nummerering), kalles en slik periode en stor. Hvis den bare har én rad, kalles den liten.
Bordet er også delt inn i "innganger" - grupper, hvorav det kun er åtte. Som i enhver inngang ligger leilighetene til venstre og høyre, og her er de kjemiske elementene plassert på samme måte. Bare i denne utførelsesformen er plasseringen ujevn - på den ene siden er det flere elementer og så snakker de om hovedgruppe, på den annen side er det mindre, og dette indikerer at gruppen er sekundær.
Valens er elementenes evne til å danne kjemiske bindinger. Det er en konstant som ikke endres og en variabel som har annen betydning avhengig av hvilket stoff grunnstoffet er i. Når du bestemmer valensen i henhold til det periodiske systemet, er det nødvendig å ta hensyn til følgende egenskaper: gruppenummeret til elementene og dens type (det vil si hoved- eller sidegruppen). Den konstante valensen i dette tilfellet bestemmes av gruppenummeret til hovedundergruppen. For å finne ut verdien av variabel valens (hvis det er en, og vanligvis y), må du trekke tallet på gruppen der elementet er plassert fra 8 (totalt 8 - derav en slik figur).
Eksempel nr. 1. Hvis du ser på elementene i den første gruppen i hovedundergruppen (alkalisk), så kan vi konkludere med at de alle har en valens lik I (Li, Na, K, Rb, Cs, Fr).
Eksempel nr. 2. Grunnstoffer fra den andre gruppen av hovedundergruppen (henholdsvis jordalkaliske metaller) har valens II (Be, Mg, Ca, Sr, Ba, Ra).
Eksempel nr. 3. Hvis vi snakker om ikke-metaller, så er for eksempel P (fosfor) i gruppe V i hovedundergruppen. Herfra vil dens valens være lik V. I tillegg har fosfor en annen valensverdi, og for å bestemme den må du utføre handling 8 - elementnummer. Derfor, 8 - 5 (gruppenummer) \u003d 3. Derfor er den andre valensen av fosfor III.
Eksempel nr. 4. Halogener er inne VII gruppe hovedundergruppe. Derfor vil deres valens være lik VII. Men gitt at disse er ikke-metaller, er det nødvendig å produsere aritmetisk operasjon: 8 - 7 (elementgruppenummer) \u003d 1. Derfor er den andre valensen lik I.
For elementer av sekundære undergrupper (og bare metaller for dem), må valensen huskes, spesielt siden den i de fleste tilfeller er lik I, II, sjeldnere III. Du må også huske valens kjemiske elementer, som har mer enn to verdier.
Relaterte videoer
Merk
Vær forsiktig når du identifiserer metaller og ikke-metaller. For dette er symboler vanligvis gitt i tabellen.
Kilder:
- hvordan man uttaler elementene i det periodiske systemet riktig
- hva er valensen til fosfor? X
Fra skolen eller enda tidligere vet alle at alt rundt, inkludert oss selv, består av deres atomer - de minste og udelelige partiklene. Takket være atomenes evne til å koble seg til hverandre, er mangfoldet i vår verden enorm. Evnen til denne kjemiske atomer element danner bindinger med andre atomer valens element.
Instruksjon
Hvert element i tabellen er tildelt en bestemt serienummer(H - 1, Li - 2, Be - 3, etc.). Dette tallet tilsvarer kjernen (antall protoner i kjernen) og antall elektroner som roterer rundt kjernen. Antall protoner er dermed lik antall elektroner, som betyr at i normale forhold atom elektrisk.
Inndelingen i syv perioder er basert på antallet energinivåer atom. Atomer i den første perioden har et enkelt-nivå elektronskall, det andre - et to-nivå, det tredje - et tre-nivå, etc. Når et nytt energinivå fylles, ny periode.
De første elementene i enhver periode er karakterisert ved at atomer har ett elektron pr ytre nivå, er atomer alkalimetaller. Perioder slutter med atomer edle gasser, med et eksternt energinivå fullstendig fylt med elektroner: i den første perioden har inerte gasser 2 elektroner, i de påfølgende - 8. Det er nettopp på grunn av den lignende strukturen elektronskjell grupper av elementer har lignende fysisk-.
I tabellen D.I. Mendeleev er det 8 hovedundergrupper. Antallet deres skyldes det maksimalt mulige antallet elektroner på energinivået.
Nederst i det periodiske systemet er lantanider og aktinider skilt ut som uavhengige serier.
Ved å bruke tabellen D.I. Mendeleev, man kan observere periodisiteten følgende egenskaper elementer: atomradius, atomvolum; ioniseringspotensial; elektronaffinitetskrefter; elektronegativiteten til atomet; ; fysiske egenskaper potensielle forbindelser.
En tydelig sporet periodisitet i arrangementet av elementer i tabellen D.I. Mendeleev er rasjonelt forklart av den konsistente naturen til fyllingen av energinivåer av elektroner.
Kilder:
- Mendeleev bord
Kunnskapsnivået om strukturen til atomer og molekyler på 1800-tallet tillot ikke å forklare årsaken til at atomer danner et visst antall bindinger med andre partikler. Men ideene til forskere var forut for sin tid, og valens studeres fortsatt som et av kjemiens grunnleggende prinsipper.
Fra historien til konseptet "valens av kjemiske elementer"
Den fremragende engelske kjemikeren på 1800-tallet, Edward Frankland, introduserte begrepet "binding" i vitenskapelig bruk for å beskrive prosessen med interaksjon mellom atomer med hverandre. Forskeren la merke til at noen kjemiske elementer danner forbindelser med samme antall andre atomer. For eksempel fester nitrogen tre hydrogenatomer til ammoniakkmolekylet.
I mai 1852 antok Frankland at det var spesifikt nummer kjemiske bindinger, som et atom kan danne med andre minste materiepartikler. Frankland brukte uttrykket "forbindelseskraft" for å beskrive det som senere skulle bli kalt valens. En britisk kjemiker har bestemt hvor mange kjemiske bindinger som danner atomene til individuelle grunnstoffer kjent i midten av det nittendeårhundrer. Franklands arbeid var et viktig bidrag til moderne strukturkjemi.

Utvikling av synspunkter
Den tyske kjemikeren F.A. Kekule beviste i 1857 at karbon er tetrabasisk. I sin enkleste forbindelse - metan - er det bindinger med 4 hydrogenatomer. Forskeren brukte begrepet "grunnleggende" for å betegne egenskapen til elementer for å feste en strengt definert mengde andre partikler. I Russland ble data om systematisert av A. M. Butlerov (1861). Videre utvikling teorien om kjemisk binding mottatt takket være læren om den periodiske endringen i elementenes egenskaper. Forfatteren er en annen fremragende D. I. Mendeleev. Han beviste at valensen til kjemiske elementer i forbindelser og andre egenskaper skyldes posisjonen de inntar i det periodiske systemet.

Grafisk fremstilling av valens og kjemisk binding
Muligheten for en visuell representasjon av molekyler er en av de utvilsomme fordelene med teorien om valens. De første modellene dukket opp på 1860-tallet, og siden 1864, sirkler med kjemisk tegn innsiden. Mellom symbolene på atomer er en strek indikert og antallet av disse linjene er lik verdien av valensen. I de samme årene ble de første ball-and-stick-modellene laget (se bildet til venstre). I 1866 foreslo Kekule en stereokjemisk tegning av et karbonatom i form av et tetraeder, som han inkluderte i læreboken Organic Chemistry.
Valensen til kjemiske elementer og fremveksten av bindinger ble studert av G. Lewis, som publiserte sine arbeider i 1923 etter de negativt ladede små partikler, som er en del av skallene til atomer. I sin bok brukte Lewis prikker rundt de fire sidene for å representere valenselektroner.
Valens for hydrogen og oksygen
Før opprettelsen ble valensen til kjemiske elementer i forbindelser vanligvis sammenlignet med de atomene den er kjent for. Hydrogen og oksygen ble valgt som standard. Et annet kjemisk grunnstoff tiltrakk seg eller erstattet et visst antall H- og O-atomer.

På denne måten ble egenskaper bestemt i forbindelser med monovalent hydrogen (valensen til det andre elementet er indikert med et romertall):
- HCl - klor (I):
- H20 - oksygen (II);
- NH3 - nitrogen (III);
- CH 4 - karbon (IV).
I oksidene K 2 O, CO, N 2 O 3, SiO 2, SO 3 ble oksygenvalensen til metaller og ikke-metaller bestemt ved å doble antall tilsatte O-atomer. følgende verdier: K (I), C (II), N (III), Si (IV), S (VI).
Hvordan bestemme valensen til kjemiske elementer
Det er regelmessigheter i dannelsen av en kjemisk binding som involverer delte elektronpar:
- Den typiske valensen til hydrogen er I.
- Den vanlige valensen av oksygen er II.
- For ikke-metalliske elementer kan den laveste valensen bestemmes av formel 8 - nummeret på gruppen der de er lokalisert i det periodiske systemet. Det høyeste, om mulig, bestemmes av gruppenummeret.
- For elementer av sideundergrupper er den maksimalt mulige valensen den samme som deres gruppenummer i det periodiske systemet.
Bestemmelsen av valensen til kjemiske elementer i henhold til formelen til forbindelsen utføres ved hjelp av følgende algoritme:
- Skriv over det kjemiske tegnet kjent verdi for ett av elementene. For eksempel, i Mn 2 O 7 er oksygenvalensen II.
- Beregn den totale verdien, for hvilken det er nødvendig å multiplisere valensen med antall atomer av det samme kjemiske elementet i molekylet: 2 * 7 \u003d 14.
- Bestem valensen til det andre elementet som det er ukjent for. Del verdien oppnådd i trinn 2 med antall Mn-atomer i molekylet.
- 14: 2 = 7. i sitt høyeste oksid - VII.
Konstant og variabel valens
Valensverdier for hydrogen og oksygen er forskjellige. For eksempel er svovel i forbindelsen H 2 S toverdig, og i formelen SO 3 er det seksverdig. Karbon danner CO-monoksid og CO 2-dioksid med oksygen. I den første forbindelsen er valensen til C II, og i den andre, IV. Samme verdi i metan CH 4 .

De fleste grunnstoffene viser ikke konstant, men variabel valens, for eksempel fosfor, nitrogen, svovel. Jakten på hovedårsakene til dette fenomenet førte til fremveksten av kjemiske bindingsteorier, ideer om valensskallet til elektroner og molekylære orbitaler. Eksistens ulike verdier den samme egenskapen ble forklart fra synspunktet om strukturen til atomer og molekyler.
Moderne ideer om valens
Alle atomer består av en positiv kjerne omgitt av negativt ladede elektroner. Det ytre skallet som de danner er uferdig. Den ferdige strukturen er den mest stabile, og inneholder 8 elektroner (en oktett). Fremveksten av en kjemisk binding på grunn av vanlige elektronpar fører til en energisk gunstig tilstand av atomer.
Regelen for sammensatt dannelse er å fullføre skallet ved å akseptere elektroner eller donere uparrede, avhengig av hvilken prosess som er lettere. Hvis et atom sørger for dannelsen av en kjemisk binding negative partikler som ikke har et par, danner det like mange bindinger som det har uparrede elektroner. Av moderne ideer, valensen til atomer av kjemiske elementer er evnen til å danne et visst antall kovalente bindinger. For eksempel, i et hydrogensulfidmolekyl H 2 S, får svovel valens II (-), siden hvert atom deltar i dannelsen av to elektronpar. "-"-tegnet indikerer tiltrekningen av et elektronpar til et mer elektronegativt element. For en mindre elektronegativ verdi legges "+" til valensverdien.

Med donor-akseptor-mekanismen involverer prosessen elektronpar ett element og de frie valensorbitalene til et annet.
Valensens avhengighet av atomets struktur
Vurder, ved å bruke eksemplet med karbon og oksygen, hvordan valensen til kjemiske elementer avhenger av strukturen til stoffet. Det periodiske systemet gir en ide om hovedkarakteristikkene til karbonatomet:
- kjemisk tegn - C;
- elementnummer - 6;
- kjerneladning - +6;
- protoner i kjernen - 6;
- elektroner - 6, inkludert 4 eksterne, hvorav 2 danner et par, 2 er uparrede.
Hvis karbonatomet i CO-monoksid danner to bindinger, kommer bare 6 negative partikler til bruk. For å skaffe en oktett er det nødvendig at parene danner 4 eksterne negative partikler. Karbon har valens IV (+) i dioksid og IV (-) i metan.
Serienummeret på oksygen er 8, valensskallet består av seks elektroner, hvorav 2 ikke danner et par og deltar i kjemisk binding og interaksjon med andre atomer. Den typiske valensen for oksygen er II (-).

Valens og oksidasjonstilstand
I mange tilfeller er det mer praktisk å bruke konseptet "oksidasjonstilstand". Dette er navnet gitt til ladningen et atom ville oppnå hvis alle bindingselektronene ble overført til et grunnstoff som har en høyere elektronegativitetsverdi (EO). Oksidasjonstall i enkel sak er lik null. Et "-"-tegn legges til oksidasjonstilstanden til et mer EO-element, et "+"-tegn legges til et mindre elektronegativt. For metaller i hovedundergruppene er for eksempel oksidasjonstilstander og ioneladninger typiske, lik gruppenummeret med et "+"-tegn. I de fleste tilfeller er valensen og oksidasjonstilstanden til atomer i samme forbindelse numerisk de samme. Bare ved interaksjon med flere elektronegative atomer er oksidasjonstilstanden positiv, med elementer der EO er lavere, er den negativ. Begrepet "valens" brukes ofte bare på stoffer med en molekylær struktur.
DEFINISJON
Under valens egenskapen til et atom til et gitt grunnstoff til å feste eller erstatte et visst antall atomer til et annet grunnstoff er underforstått.
Derfor kan valensmålet være antall kjemiske bindinger dannet av et gitt atom med andre atomer. For tiden forstås således valensen til et kjemisk grunnstoff vanligvis som dets evne (i en snevrere forstand, et mål på dets evne) til å danne kjemiske bindinger (fig. 1). I representasjonen av metoden for valensbindinger tilsvarer den numeriske verdien av valens antallet kovalente bindinger som et atom danner.
Ris. 1. Skjematisk dannelse av vann- og ammoniakkmolekyler.
Tabell over valens av kjemiske elementer
Opprinnelig ble valensen til hydrogen tatt som valensenheten. Valensen til et annet element ble i dette tilfellet uttrykt ved antall hydrogenatomer som ett atom av dette elementet fester til seg selv eller erstatter (den såkalte hydrogenvalensen). For eksempel, i forbindelser med sammensetningen HCl, H 2 O, NH 3, CH 4, er hydrogenvalensen til klor en, oksygen - to, nitrogen - tre, karbon - fire.
Da ble det bestemt at det også var mulig å bestemme valensen til det ønskede elementet ved oksygen, hvis valens som regel er lik to. I dette tilfellet beregnes valensen til et kjemisk grunnstoff som det dobbelte av antallet oksygenatomer som ett atom av dette elementet kan feste (den såkalte oksygenvalensen). For eksempel, i forbindelser med sammensetningen N 2 O, CO, SiO 2, SO 3, er valensen for nitrogen oksygen en, karbon - to, silisium - fire, svovel - seks.
Faktisk viste det seg at de fleste kjemiske grunnstoffer har valensverdier i hydrogen og in oksygenforbindelser er forskjellige: for eksempel er valensen til svovel i hydrogen to (H 2 S), og i oksygen - seks (SO 3). I tillegg viser de fleste grunnstoffene forskjellige valenser i forbindelsene. For eksempel danner karbon to oksider: CO-monoksid og CO 2-dioksid. I den første er valensen til karbon II, og i den andre - fire. Det følger av det at det som regel er umulig å karakterisere valensen til et element med et hvilket som helst tall.
Høyere og lavere valens av kjemiske elementer
Verdiene for de høyeste og laveste valensene til et kjemisk element kan bestemmes ved å bruke det periodiske systemet til D.I. Mendeleev. Den høyeste valensen til et grunnstoff faller sammen med tallet på gruppen det er plassert i, og den laveste er forskjellen mellom tallet 8 og gruppetallet. For eksempel er brom lokalisert i gruppe VIIA, som betyr det høyeste valens lik VII, og den laveste - I.
Det er elementer med den såkalte. konstant valens(metaller av IA- og IIA-grupper, aluminium, hydrogen, fluor, oksygen), som i forbindelsene deres viser en enkelt oksidasjonstilstand, som oftest sammenfaller med gruppenummeret til det periodiske systemet til D.I. Mendeleev, hvor de befinner seg).
Elementer som er preget av flere valensverdier (og ikke alltid disse er den høyeste og laveste valensen) kalles variabel valens. For eksempel er svovel preget av valensene II, IV og VI.
For å gjøre det lettere å huske hvor mange og hvilke valenser som er karakteristiske for et bestemt kjemisk element, bruk valenstabellene for kjemiske elementer, som ser slik ut:
Eksempler på problemløsning
EKSEMPEL 1
| Trening | Valens III er typisk for: a) Ca; b) P; c) O; d) Si? |
| Løsning | a) Kalsium er et metall. Den er preget av den eneste mulige valensverdien som samsvarer med gruppenummeret i Periodiske tabell DI. Mendeleev, der den ligger, dvs. valensen av kalsium er II. Svaret er feil. b) Fosfor er et ikke-metall. Refererer til en gruppe kjemiske grunnstoffer med variabel valens: den høyeste bestemmes av gruppenummeret i det periodiske systemet til D.I. Mendeleev, der den ligger, dvs. er lik V, og den laveste er differansen mellom tallet 8 og gruppetallet, dvs. er lik III. Dette er det riktige svaret. |
| Svar | Alternativ (b) |
EKSEMPEL 2
| Trening | Valens III er typisk for: a) Være; b) F; c) Al; d)C? |
| Løsning | For å gi et riktig svar på spørsmålet som stilles, vil vi vurdere hvert av de foreslåtte alternativene separat. a) Beryllium er et metall. Den er karakterisert ved den eneste mulige valensverdien som samsvarer med gruppenummeret i det periodiske systemet til D.I. Mendeleev, der den ligger, dvs. valensen til beryllium er II. Svaret er feil. b) Fluor er et ikke-metall. Den er karakterisert ved den eneste mulige valensverdien lik I. Svaret er feil. c) Aluminium er et metall. Den er karakterisert ved den eneste mulige valensverdien som samsvarer med gruppenummeret i det periodiske systemet til D.I. Mendeleev, der den ligger, dvs. valensen til aluminium er III. Dette er det riktige svaret. |
| Svar | Alternativ (c) |
Valence. Definisjon av valens. Elementer med konstant valens.
Figurativt sett er valens antallet "hender" som et atom klamrer seg til andre atomer med. Naturligvis har atomer ingen "hender"; deres rolle spilles av den såkalte. valenselektroner.
Det kan sies annerledes: valens er evnen til et atom i et gitt grunnstoff til å feste et visst antall andre atomer.
Følgende prinsipper må forstås klart:
Det er elementer med konstant valens (det er relativt få av dem) og elementer med variabel valens (hvorav de fleste).
Elementer med konstant valens må huskes:
De resterende elementene kan ha forskjellig valens.
Den høyeste valensen til et grunnstoff faller i de fleste tilfeller sammen med nummeret til gruppen der elementet befinner seg.
For eksempel er mangan i gruppe VII (sideundergruppe), den høyeste valensen til Mn er syv. Silisium er lokalisert i gruppe IV ( hovedundergruppe), dens høyeste valens er fire.
Det bør imidlertid huskes at den høyeste valensen ikke alltid er den eneste mulige. For eksempel er den høyeste valensen av klor syv (sjekk det ut!), men det er kjent forbindelser der dette elementet viser valenser VI, V, IV, III, II, I.
Det er viktig å huske noen få unntak: den maksimale (og eneste) valensen til fluor er I (og ikke VII), oksygen - II (og ikke VI), nitrogen - IV (nitrogens evne til å vise valens V er en populær myte som finnes selv på noen skoler lærebøker).
Valens og oksidasjonstilstand er ikke identiske begreper.
Disse begrepene er nærme nok, men de bør ikke forveksles! Oksydasjonstilstanden har et tegn (+ eller -), valens - nei; oksidasjonstilstanden til et grunnstoff i et stoff kan være null, valensen er null bare hvis vi har å gjøre med et isolert atom; den numeriske verdien av oksidasjonstilstanden kan IKKE falle sammen med valensen. For eksempel er valensen til nitrogen i N 2 III, og oksidasjonstilstanden = 0. Valensen til karbon i maursyre= IV, og oksidasjonstilstand = +2.
Hvis valensen til ett av elementene i en binær forbindelse er kjent, kan valensen til det andre bli funnet.
Dette gjøres veldig enkelt. Husk den formelle regelen: produktet av antall atomer til det første elementet i et molekyl og dets valens må være lik det samme produktet for det andre elementet.
Eksempel 1. Finn valensene til alle elementene i NH 3-forbindelsen.
Løsning. Vi kjenner valensen til hydrogen - den er konstant og lik I. Vi multipliserer valensen til H med antall hydrogenatomer i ammoniakkmolekylet: 1 3 \u003d 3. Derfor, for nitrogen, er produktet av 1 (antall av N-atomer) ved X (nitrogenvalens) skal også være lik 3. Åpenbart er X = 3. Svar: N(III), H(I).
Eksempel 2. Finn valensene til alle grunnstoffene i Cl 2 O 5-molekylet.
Løsning. Oksygen har en konstant valens (II), i molekylet til dette oksydet er det fem oksygenatomer og to kloratomer. La valensen til klor \u003d X. Vi lager en ligning: 5 2 \u003d 2 X. Åpenbart, X \u003d 5. Svar: Cl (V), O (II).
Eksempel 3. Finn valensen til klor i SCl 2-molekylet, hvis det er kjent at svovelens valens er II.
Løsning. Hvis forfatterne av problemet ikke hadde fortalt oss valensen til svovel, ville det vært umulig å løse det. Både S og Cl er variable valenselementer. Tar i betraktning tilleggsinformasjon, er løsningen bygget i henhold til skjemaet i eksempel 1 og 2. Svar: Cl(I).
Når du kjenner valensen til to elementer, kan du lage en formel for en binær forbindelse.
I eksempel 1 - 3 bestemte vi valensen ved å bruke formelen, la oss nå prøve å gjøre omvendt prosedyre.
Eksempel 4. Skriv formelen for forbindelsen av kalsium og hydrogen.
Løsning. Valensene til kalsium og hydrogen er kjent - henholdsvis II og I. La formelen til den ønskede forbindelsen være Ca x H y. Vi komponerer igjen den velkjente ligningen: 2 x \u003d 1 y. Som en av løsningene på denne ligningen kan vi ta x = 1, y = 2. Svar: CaH 2 .
"Og hvorfor akkurat CaH 2? - spør du. - Tross alt motsier ikke variantene Ca 2 H 4 og Ca 4 H 8 og til og med Ca 10 H 20 vår regel!"
Svaret er enkelt: ta de minste mulige verdiene av x og y. I det gitte eksemplet er disse minimumsverdiene (naturlige!) nøyaktig lik 1 og 2.
"Så, forbindelser som N 2 O 4 eller C 6 H 6 er umulige? - spør du. - Bør disse formlene erstattes med NO 2 og CH?"
Nei, de er mulige. Dessuten er N 2 O 4 og NO 2 fullstendig forskjellige stoffer. Men CH-formelen tilsvarer ikke noe reelt stabilt stoff i det hele tatt (i motsetning til C 6 H 6).
Til tross for alt som er sagt, kan du i de fleste tilfeller bli veiledet av regelen: ta minste verdier indekser.
Eksempel 5. Skriv formelen for forbindelsen av svovel med fluor, hvis det er kjent at valensen til svovel er seks.
Løsning. La den sammensatte formelen være S x F y . Valensen til svovel er gitt (VI), valensen til fluor er konstant (I). Igjen lager vi ligningen: 6 x \u003d 1 y. Det er lett å forstå at de minste mulige verdiene av variablene er 1 og 6. Svar: SF 6 .
Her er faktisk alle hovedpoengene.
Sjekk deg selv nå! Jeg foreslår å gå litt test om emnet "Valence".
En av de viktigste i studien skoletemaer er satsen knyttet til valens. Om det vil bli diskutert i artikkelen.
Valens - hva er det?
Valens i kjemi betyr egenskapen til atomene til et kjemisk grunnstoff til å binde til seg selv atomene til et annet grunnstoff. Oversatt fra latin - styrke. Det uttrykkes i tall. For eksempel vil valensen til hydrogen alltid være lik én. Hvis vi tar formelen vann - H2O, kan den representeres som H - O - H. Ett oksygenatom var i stand til å binde to hydrogenatomer til seg selv. Dette betyr at antall bindinger som oksygen skaper er to. Og valensen til dette elementet vil være lik to.
I sin tur vil hydrogen være toverdig. Atomet kan bare kobles til ett atom i et kjemisk element. I denne saken med oksygen. Mer presist danner atomer, avhengig av elementets valens, par av elektroner. Hvor mange slike par dannes - slik vil valensen være. Den numeriske verdien kalles en indeks. Oksygen har en indeks på 2.
Hvordan bestemme valensen av kjemiske elementer i henhold til tabellen til Dmitry Mendeleev
Når du ser på det periodiske systemet over elementer, kan du se de vertikale radene. De kalles grupper av elementer. Valens avhenger også av gruppen. Elementene i den første gruppen har den første valensen. Den andre er den andre. Tredje - tredje. Og så videre.
Det finnes også elementer med konstant valensindeks. For eksempel hydrogen, halogengruppe, sølv og så videre. De må læres.


Hvordan bestemme valensen til kjemiske elementer med formler?
Noen ganger er det vanskelig å bestemme valensen fra det periodiske systemet. Deretter må du se på den spesifikke kjemiske formelen. Ta oksidet FeO. Her har jern, som oksygen, en valensindeks på to. Men i Fe2O3-oksid er det annerledes. Jern vil være trivalent.


Må alltid huskes forskjellige måter definisjoner av valens og ikke glem dem. Kjenn dens konstante numeriske verdier. Hvilke elementer har dem. Og, selvfølgelig, bruk tabellen over kjemiske elementer. Og også å studere individuelt kjemiske formler. Det er bedre å representere dem i en skjematisk form: H - O - H, for eksempel. Da er sammenhengene synlige. Og antall streker (streker) vil være numerisk verdi valens.
 Konvertering av en desimalbrøk til en vanlig brøk og omvendt: en regel, eksempler
Konvertering av en desimalbrøk til en vanlig brøk og omvendt: en regel, eksempler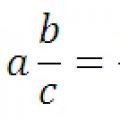 Konvertering av desimaltall til vanlige brøker
Konvertering av desimaltall til vanlige brøker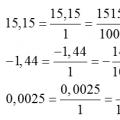 Konvertering av en vanlig brøk til en desimalbrøk og omvendt, regler, eksempler
Konvertering av en vanlig brøk til en desimalbrøk og omvendt, regler, eksempler