Полисахариды. В молекулах нуклеиновых кислот нуклеотиды связаны
Сера - элемент VI группы периодической системы с атомным номером 16. Сера относительно устойчива в свободном состоянии, в обычных условиях находится в виде молекулы S8, имеющей циклическое строение. Природная сера состоит из смеси четырех стабильных изотопов с ат. м. 32, 33, 34 и 36. При образовании химических связей сера может использовать все шесть электронов внешней электронной оболочки (степени окисления серы: 0, 2, 4 и 6).
Сера представляет собой кристаллическую (в виде плотной массы) или аморфную форму (мелкий порошок). По своим химическим свойствам сера является типичным металлоидом и соединяется со многими металлами.
В природе сера встречается как в самородном состоянии, так и в составе сернистых и сернокислых минералов (гипс, серный колчедан, глауберова соль, свинцовый блеск и др.).
Русское название элемента происходит от древне-индийского (санскритского) слова "сира" - светло-желтый. Приставка "тио", часто применяемая к соединениям серы, происходит от греческого названия серы - "тейон" (божественный, небесный), так как сера издавна была символом горючести; огонь же считался достоянием богов, пока Прометей, как гласит миф, не принес его людям.
Сера известна человечеству с древнейших времен. Встречаясь в природе в свободном состоянии, она обращала на себя внимание характерной желтой окраской, а также тем резким запахом, которым сопровождалось ее горение. Считалось также, что запах и голубое пламя, распространяющееся горящей серой, отгоняют демонов.
Сернистый ангидрид - удушливый газ, образующийся при горении серы, еще в древности использовался для отбеливания тканей. При раскопках Помпеи нашли картину, на которой изображен противень с серой и приспособление для подвешивания над ним материи. Издавна употреблялась сера и ее соединения для приготовления косметических средств и для лечения кожных заболеваний. И очень давно ее начали использовать для военных целей. Так, в 670 году защитники Константинополя сожгли арабский флот с помощью "греческого огня". это была смесь селитры, угля и серы. Те же вещества входили в состав черного пороха, применявшегося в Европе в средние века и до конца XIX в.
В водородных и кислородных соединениях сера находится в составе различных анионов, образует многие кислоты и соли. Большинство серосодержащих солей малорастворимы в воде.
Сера образует с кислородом окислы, важнейшими из которых являются сернистый и серный ангидриды. Находясь в одной группе с кислородом, сера обладает сходными окислительно-восстановительными свойствами. С водородом сера образует хорошо растворимый в воде газ - сероводород. Этот газ очень токсичен, за счет его способности прочно связываться с катионами меди в ферментах дыхательной цепи.
Серная кислота, одно из самых важных соединений серы, была открыта, по-видимому, к X в, начиная с XVIII века, ее производят в промышленных масштабах и вскоре она становится важнейшим химическим продуктом, необходимым и в металлургии, и в текстильной промышленности, и в других, самых различных отраслях. В связи с этим начались еще более интенсивные поиски месторождений серы, изучение химических свойств серы и ее соединений и совершенствование методов их извлечения из природного сырья.
Олигосахариды
Моносахариды
- глюкоза
- фруктоза
- галактоза
- манноза
- Дисахариды
- сахароза (обычный сахар)
- мальтоза
- изомальтоза
- лактоза
- лактулоза
- декстрин
- гликоген
- крахмал
- целлюлоза
Белки - главные «труженики» клетки - это природные биополимеры, построенные из остатков 20 аминокислот. В состав макромолекул белков может входить от нескольких десятков до сотен тысяч и даже миллионов аминокислотных остатков, причем свойства белка существенно зависят именно от порядка, в котором располагаются эти остатки друг за другом. По этой причине, очевидно, что число возможных белков практически не ограничено.
Аминокислотами называют органические соединения, в которых карбоксильная (кислотная) группа СООН и аминогруппа NH 2 . присоединены к одному и тому же атому углерода.

Рис.1 Структурная формула аминокислот
Строение такой молекулы описывается структурной формулой (рис.1), где R - радикал, разный для разных аминокислот. Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, в состав аминокислот входят все четыре органогена С, О, Н, N, а в некоторые радикалы может входить сера S.
По способности человека синтезировать аминокислоты из их предшественников они делятся на две группы:
- Незаменимые: Триптофан, Фенилаланин, Лизин, Треонин, Метионин, Лейцин, Изолейцин, Валин, Аргинин, Гистидин;
- Заменимые: Тирозин, Цистеин, Глицин, Аланин, Серин, Глутаминовая кислота͵ Глутамин, Аспарагиновая кислота͵ Аспарагин, Пролин
Незаменимые аминокислоты должны поступать в организм человека с пищей, так как они не синтезируются человеком, хотя некоторые заменимые аминокислоты синтезируются в организме человека в недостаточных количествах и тоже должны поступать с пищей.
Химические формулы 20 стандартных аминокислот:

Структуру белковой молекулы, поддерживаемую ковалентными связями между аминокислотными остатками, называют первичной. Другими словами, первичная структура белка определяется простой последовательностью аминокислотных остатков. Эти остатки могут вполне определенным образом размещаться в пространстве, образуя вторичную структуру. Наиболее характерной вторичной структурой является α-спираль, когда аминокислотные цепочки как бы образуют резьбу винта. Одним из самых удивительных свойств макромолекул является то, что α-спирали с левой и правой «резьбой» встречаются в живой природе с существенно разной вероятностью: макромолекул, «закрученных» вправо, почти нет. Асимметрию биологических веществ относительно зеркального отражения обнаружил в 1848 ᴦ. великий французский ученый Л. Пастер. Впоследствии выяснилось, что эта асимметрия присуща не только макромолекулам (белкам, нуклеиновым кислотам), но и организмам в целом. Как возникла преимущественная спиральность макромолекул и как она в дальнейшем закрепилась в ходе биологической эволюции - эти вопросы до сих пор являются дискуссионными и не имеют однозначного ответа.
Наиболее сложные и тонкие особенности структуры, отличающие один белок от другого, связаны с пространственной организацией белка, которую называют третичной структурой. Фактически речь идет о том, что спиралевидные цепочки аминокислотных остатков свернуты в нечто, напоминающее клубок ниток; В результате довольно длинные цепочки занимают сравнительно небольшой объем в пространстве. Характер свертывания в клубок отнюдь не случаен. Напротив, он однозначно определен для каждого белка. Именно благодаря третичной структуре белок способен выполнять свои уникальные каталитические, ферментативные функции, когда в результате целенаправленного захватывания реагентов осуществляется их синтез в сложные химические соединения, сравнимые по сложности с самим белком. Ни одна из химических реакций, осуществляемых белками, не может происходить обычным образом.
Кроме третичной структуры, белок может иметь четвертичную структуру; когда имеет место структурная связь между двумя или несколькими белками. Фактически речь идет об объединении нескольких «клубков» из полипептидных цепочек.
Нуклеиновые кислоты (от лат. nucleus - ядро) - высокомолекулярные органические фосфорсодержащие соединения, биополимеры. Полимерные формы нуклеиновых кислот называют полинуклеотидами. Цепочки из нуклеотидов соединяются через остаток фосфорной кислоты (фосфодиэфирная связь). Поскольку в нуклеотидах существует только два типа гетероциклических молекул, рибоза и дезоксирибоза, то и имеется лишь два вида нуклеиновых кислот - дезоксирибонуклеиновая (ДНК ) и рибонуклеиновая (РНК ). Нуклеиновые кислоты ДНК и РНК присутствуют в клетках всех живых организмов и выполняют важнейшие функции по хранению, передаче и реализации наследственной информации. Одна из базовых аксиом биологии утверждает, что наследственная информация о структуре и функциях биологического объекта передается из поколения в поколение матричным путем, а носителями этой информации являются нуклеиновые кислоты .
Эти биополимеры на первый взгляд проще, чем белки. «Алфавит» нуклеиновых кислот состоит всего из четырех «букв», в роли которых выступают нуклеотиды - сахара-пентозы, к которым присоединено одно из пяти азотистых оснований: гуанин (Г), аденин (А), цитозин (Ц), тимин (Т) и урацил (У).
 | |||
| Аденин | Гуанин | Тимин | Цитозин |
Рис.2 Структуры оснований, наиболее часто встречающихся в составе ДНК
В рибонуклеиновой кислоте (РНК) сахаром является углевод рибоза (С 5 Н 10 О 5), а в дезоксирибонуклеиновой кислоте (ДНК) - углевод дезоксирибоза (С 5 Н 10 О 4), который отличается от рибозы только тем, что около одного из атомов углерода ОН-группа заменена на атом водорода. Три из указанных азотистых оснований - Г, А и Ц - входят в состав и РНК, и ДНК. Четвертое азотистое основание в этих кислотах разное - Т входит только в ДНК, а У- только в РНК. Связываются звенья нуклеотидов фосфодиэфирными связями остатка фосфорной кислоты Н 3 РО 4 . Относительные молекулярные массы нуклеиновых кислот достигают значений 1500 000-2 000 000 и более. Вторичная структура ДНК была установлена методами рентгеноструктурного анализа в 1953 ᴦ. Р. Франклин, М. Уилкинсом, Дж. Уотсоном и Ф. Криком. Оказалось, что ДНК образуют спирально закрученные нити, причем азотистое основание одной нити ДНК связано водородными связями с определенным основанием другой нити: аденин может быть связан только с тимином, а цитозин - только с гуанином (рис. 3). Такие связи называются комплементарными (дополнительными). Отсюда следует, что порядок расположения оснований в одной нити однозначно определяет порядок в другой нити. Именно с этим связано важнейшее свойство ДНК - способность к самовоспроизведению (репликации). РНК не имеет двойной спиральной структуры и построена как одна из нитей ДНК. Различают рибосомную (рРНК), матричную (мРНК) и транспортную (тРНК). Οʜᴎ отличаются теми ролями, которые играют в клетках.

Рис. 3 Различные формы двойной спирали ДНК
Что же означают последовательности нуклеотидов в нуклеиновых кислотах? Каждые три нуклеотида (их называют триплетами или кодонами) кодируют ту или иную аминокислоту в белке. К примеру, последовательность УЦГ дает сигнал на синтез аминокислоты серин. Сразу возникает вопрос: сколько различных троек можно получить из четырех «букв»? Легко сообразить, что таких троек может быть 4 3 = 64. Но в образовании белков может участвовать всего 20 аминокислотных остатков, значит, некоторые из них можно кодировать разными тройками, что и наблюдается в природе. К примеру, лейцин, серин, аргинин кодируются шестью тройками, пролин, валин и глицин - четырьмя и т. д. Это свойство триплетного генетического кода принято называть вырожденностью или избыточностью. Следует также отметить, что для всех живых организмов кодирование белков происходит одинаково (универсальность кодирования). В то же время последовательности нуклеотидов в ДНК не бывают считаны иначе, как единственным способом (неперекрываемость кодонов).
Ксилоза (древесный сахар) содержится в хлопковой шелухе, кукурузных кочерыжках. Ксилоза входит в состав пентозанов. Соединяясь с фосфором, ксилоза переходит в активные соединения, играющие важную роль во взаимопревращениях сахаров. Арабиноза содержится в хвойных... [читать подробенее]
Закономерности образования и накопления полисахаридов в растениях. Роль в жизни растений Полисахариды составляют 80 % органического вещества планеты, поскольку составляют большую часть сухого вещества растений. В растениях моносахариды и их производные,... [читать подробенее]
Основным резервным полисахаридом в клетках растений является крахмал. Крахмал образуется в растениях при фотосинтезе и откладывается в виде "резервного" углевода в корнях, клубнях и семенах. Например, зерна риса, пшеницы, ржи и других злаков содержат 60-80% крахмала,...
Введение……………………………………………………………………………………………..
Оценка питательности………………………………………………………………………..
Сера………………………………………………………………………………………………………
Аминокислоты белка…………………………………………………………………………
Обогащение рационов серой……………………………………………………………
Влияние серы на пушнину зверей……………………………………………………..
Введение
Создание прочной кормовой базы – это не только увеличение производства и повышение качества кормов разных видов, но прежде всего внедрение высокоэффективных способов и средств их производства, приготовления, способствующих высокой усвояемости животными питательных веществ, содержащихся в кормах и обеспечивающих их рациональное использование.
Кормление влияет на развитие, интенсивность роста, массу тела и воспроизводительные функции животного. Только при полном обеспечении скота и птицы высококачественными кормами можно успешно развивать животноводство. Из всех факторов окружающей среды самое большое влияние на продуктивность оказывает кормление. В структуре себестоимости продукции животноводства доля кормов составляет при производстве молока 50-55%, говядины – 65–70%, свинины – 70–75%.
В современном животноводстве большое внимание уделяется обеспечению сбалансированного питания животных. Применяя научно основанные системы кормления, можно повысить продуктивность животных и эффективно использовать корма. В процессе питания составные вещества воздействуют на организм животного не изолировано друг от друга, а в комплексе. Сбалансированность составных веществ корма в соответствии с потребностями животных – основной показатель этого комплекса.
Оценка питательности
Для животноводства важно не только количество, но, главным образом, качество кормов, т.е. их ценность определяемая содержанием питательных веществ. Полноценными считаются такие рационы и корма, которые содержат все необходимые для организма животного вещества и способны в течение длительного времени обеспечить нормальные отправления всех его физиологических функций.
Под питательностью понимают свойство корма удовлетворять природные потребности животных в пище. Определить питательность корма можно только в процессе его взаимодействия с организмом по физиологическому состоянию животного и изменению его продуктивности. Питательность корма нельзя выразить каким-либо одним показателем. Проведенные ученными исследования роли отдельных питательных веществ в жизнедеятельности организма животного позволили сделать вывод о необходимости всесторонней системы оценки питательности кормов. Эта оценка складывается из следующих данных: химического состава корма и его калорийности; перевариваемость питательных веществ; общей (энергетической) питательности; протеиновой, минеральной и витаминной питательности.
Для оценки питательности кормов необходимо знать их химический состав и основные процессы, происходящие при превращении питательных веществ корма в продукты животноводства. Способ оценки питательности кормов по перевариваемым питательным веществам имеет свои недостатки, поскольку переваривание корма – это усвоение только части питательных веществ корма животного и первый этап обмена веществ между организмом и средой. Не все перевариваемые питательные вещества одинаково используются организмом для жизнедеятельности и образования продукции. Например: пшеничные отруби и зерно ячменя имеют практически одинаковые количество питательных веществ (60–62%), но продуктивное действие отрубей примерно на 25% ниже, чем ячменя. Кроме того, одна часть, считаемая перевариваемой, на самом деле разрушается микроорганизмами с образованием углекислоты, метана и органических кислот, другая часть выводится из организма с жидкостями в виде мочевины и теплоты. Таким образом, для более полной оценки питательности кормов и рационов необходимо знать конечные результаты кормления, т.е. какая часть перевариваемых питательных веществ каждого корма усваивается организмом и превращается в составные части тела животного или в получаемую от животного продукцию. Поэтому наряду с оценкой по перевариваемым питательным веществам используют оценку по общей питательности (калорийности).
Сера
Сера жизненно необходима для организма животного. В организме животных находится главным образом в виде сложных органических соединений- аминокислот белка. В теле животных сера составляет 0,12-0,15 %, Большая часть ее сосредоточена в волосяном покрове, роговом башмаке, коже. Сера так же входит в состав инсулина (гормона поджелудочной железы) и тиамина (витамина В1).
Сравнительно много серы в зерновых злаковых и бобовых кормах, луговом и люцерновом сене, обрате. Все корма, богатые белком, содержат больше серы, чем бедные им.
Потребность в сере овец и скота составляет 0,25-0,4 % сухого вещества кормового рациона. Например, дойной корове серы необходимо 25-50 г в сутки в зависимости от суточного удоя, телятам до 6 мес – 3-10, молодняку – 13-25 в зависимости от живой массы и прироста; овцам: взрослым- 3-9, ягнятам- 2-3 г в сутки. Потребность у овец в сере зависит главным образом от настрига шерсти.
Сера улучшает переваривание целлюлозы и поддерживает биосинтез витаминов группы В. Симптомами недостаточного количества серы в организме являются потеря аппетита, выпадение части волосяного покрова и тусклые глаза. Источником серы могут служить многие корма животного происхождения, например, молоко в различном виде и др.
Свою физиологическую роль в организме она осуществляет через аминокислоты - цистин, метионин, таурин, глутатион, тиамин, в состав которых входит.
Аминокислоты белка
Цистин
Важная аминокислота, содержащая серу. Является мощным антиоксидантом, который печень использует для нейтрализации разрушительных свободных радикалов.
Укрепляет соединительные ткани и усиливает антиокислительные процессы в организме.
Способствует процессам заживления, стимулирует деятельность белых кровяных телец, помогает уменьшить болевые ощущения при воспалениях.
Важная кислота для кожи и волос.
Необходима для защиты от химических токсинов.
Метионин
Одна из незаменимых аминокислот, содержащих серу. Важен для многих функций организма, включая выработку иммунных клеток и функционирование нервной системы. Он является мощным антиоксидантом и важен для сохранения здоровой печени.
Предшественник цистина и креатина.
Может повышать уровень антиоксидантов (глютатиона) и снижать холестерин.
Помогает выводить токсины и восстанавливать ткани печени и почек.
метионин предотвращает заболевания кожи.
полезный в некоторых случаях аллергии, поскольку уменьшает выделение гистамина.
Таурин
Одной из наиболее важных, полезных и безопасных аминокислотных добавок является таурин, широко известный благодаря своему благоприятному воздействию на сердечнососудистую систему. Организм может вырабатывать таурин из цистеина с помощью витамина В6.
Помогает поглощению и уничтожению жиров.
Таурин, который присутствует в органах центральной нервной системы, сетчатке глаза, скелетных мышцах и в сердечной мышце, полезен при лечении сердечно–сосудистых заболеваний и некоторых заболеваний глаз.
Таурин функционирует в электрически активных тканях, таких, как мозг и сердце, и помогает стабилизировать клеточные мембраны.
Существует мнение, что эта аминокислота обладает некоторым антиоксидантным и очистительным действием.
С помощью цинка таурин способствует циркуляции некоторых минералов внутрь и наружу клеток и таким образом участвует в выработке нервных импульсов.
Глутатион
Глутатион не является протеино–строительной аминокислотой, это смесь аминокислотных цепочек.
Глутатион образует ферменты, такие, как глутатион пероксидаза.
Имеет важное значение для жизни и присутствует во всех клетках растений и животных.
Входит в состав питательных формул, а также добавок, которые оказывают на организм очистительное действие, удаляя определенные токсины
Тиамин (В1)
Синонимы: аневрил, аневрин, бевемин, бенерва, берин, бетаксин, бетиамин, битеван, оризанин и др.
Участвует в углеводном обмене, регулирует функции нервной системы, сердечную деятельность. Всасываемость витамина происходит в кишечнике, а в клетках тканей он превращается в кокарбоксилазу.
Защищает мембраны клеток от токсического воздействия продуктов перекисного окисления.
В витамине B1 нуждаются не все домашние животные. У жвачных животных тиамин образуется при помощи некоторых бактерий, обитающих в рубце. Однако, домашние птицы, кролики, свиньи и лошади весьма чувствительны к недостатку этого витамина.
А те животные, которые не получают и не производят самостоятельно витамин B1, часто заболевают полиневритом. При полиневрите, как правило, появляются расстройство координации движений, шаткая походка, сопровождающаяся вращательными движениями и параличами.Тиамин воспроизводится микрофлорой и простейшими в рубце жвачных животных. Хорошо всасывается, но в щелочной среде кишечника разрушается, поэтому его применяют после кормления или парентерально при гипо - и авитаминозах B1, полиневритах разного происхождения, атонии мускулатуры желудка и кишечника, для ускорения роста животных и птиц. Назначают внутрь, подкожно и внутримышечно.
Потребность в витамине B1 в расчете на 1 килограмм корма у цыплят 1 миллиграмм, у свиней 3 миллиграмма. С лечебной целью дают дозы, в 3-8 раз большие. Дозы внутримышечно и подкожно (г): лошадям и крупному рогатому скоту - 0,1-0,3, мелкому рогатому скоту и свиньям - 0,005-0,06, телятам - 0,01-0,06, собакам - 0,001-0,01, курам и гусям - 10-25 мг; цыплятам - 1-2 мг на голову в сутки. Внутрь: цыплятам - 3-4 мг, поросятам - 25-40 мг.
Сера - Входит в состав некоторых аминокислот (цистеин, метионин), витамина В1 и некоторых ферментов. Калий - содержится в клетках в виде + ионов, активизирует жизнедеятельность клетки, активизирует работу ферментов, влияет на ритм сердечной деятельности. Железо - входит в состав гемоглобина и многих ферментов, участвует в дыхании, фотосинтезе. Йод - входит в состав гормонов щитовидной железы, участвует в регуляции обмена веществ. Хлор - участвует в водно-солевом обмене, в передаче нервного импульса, в составе соляной кислоты желудочного сока активизирует фермент пепсин.
Картинка 14 из презентации «Химические вещества клетки» к урокам биологии на тему «Химический состав клетки»Размеры: 960 х 720 пикселей, формат: jpg. Чтобы бесплатно скачать картинку для урока биологии, щёлкните по изображению правой кнопкой мышки и нажмите «Сохранить изображение как...». Для показа картинок на уроке Вы также можете бесплатно скачать презентацию «Химические вещества клетки.ppt» целиком со всеми картинками в zip-архиве. Размер архива - 333 КБ.
Скачать презентациюХимический состав клетки
«Химические вещества клетки» - Неорганические вещества. Функции воды. Транспорт веществ. Соотношение химических соединений в клетке. КАТИОНЫ (+ ионы). Макроэлементы. Содержатся в телах неживой и живой природы. Участвует в химических реакциях. Вода и соли. Гидрофильные хорошо растворимы в воде. Защита организма от перегрева и переохлаждения.
«Строение клетки и её функции» - Функции митохондрий. Митохондрия. Функции: Обеспечивает биосинтез белка (сборку белковой молекулы из аминокислот). Реснички (многочисленные цитоплазматические выросты на мембране). ЦИТОЛОГИЯ (от цито... и...логия) - наука о клетке. Клеточная теория. ген (участок ДНК). Аппарат Гольджи. Жгутики (единичные цитоплазматические выросты на мембране).
«Ядро клетки» - Эндоплазматический ретикулум складчатый. Эукариотической клетки. Днк. 0,25 мкм. Особенности строения. Митохондрии. Плазмиды – маленькие кольцевые ДНК в цитоплазме. Вакуоли. Одноклеточные (бактерии, простейшие). Ядро. Внешняя оболочка. Жгутик. 0,1 мкм. ДНК митохондрий, хлоропластов. Функции ядра в прокариотической клетке выполняют аппарат гольджи.
«Органические вещества клетки» - Органические вещества, входящие в состав клетки. Вывод. РНК: и-РНК, т-РНК, р-РНК. Углеводы состоят из атомов углерода и молекул воды. Каковы функции углеводов и липидов? План. Сделать вывод. Растительные и животные белки. Перечислите функции белков. Закрепление. Органические соединения клетки: белки, жиры, углеводы.
«Строение растительной клетки» - Цели и задачи урока. Жгучие клетки. Результат известен каждому, кто имел дело с крапивой. Клетки пробки мертвы и пропитаны веществами, не пропускающими воду и воздух. Корневые волоски. Домашнее задание. Микроскоп поставили, Препарат - на столик, Объектив направили, Глядь, а лук – из долек! Вакуоли. Л.р.№2 «Пластиды в клетках листа элодеи».
«Биология Строение клетки» - Учебные предметы: биология, физика Участники проекта: учащиеся 10 класса. ОПВ: ПОЧЕМУ МЫ НЕ ПОНИМАЕМ КЛЕТКУ? Выяснить механизмы транспорта веществ через клеточную мембрану. Клеточная мембрана. Тема учебного проекта: Структурная организация клетки. Веб-сайт. Дидактические материалы. Транспорт веществ в клетке.
Всего в теме 15 презентаций
Какая аминокислота ароматическая
B) аспарагиновая кислота
C) цистеин
D) триптофан +
E) гистидин
109. Какая аминокислота гетероциклическая:
A) гистидин +
Какая аминокислота проявляет основные свойства
B) аспарагиновая кислота
D) фенилаланин
111. Укажите цвитеррион аминокислоты:
B) ![]()
C) ![]()
D) ![]() +
+
E) ![]()
112. Какая связь пептидная:
A) ![]()
113. Аминокислота, в молекуле которой нет ассиметрического атома углерода:
A) тирозин
C) глицин +
D) фенилаланин
В состав какой аминокислоты входит сера
A) аргинин
B) триптофан
C) гистидин
D) цистеин +
115. Аминокислота, в молекуле которой нет свободной аминогруппы:
A) пролин +
B) цистеин
C) глутаминовая кислота
D) триптофан
E) фенилаланин
116. Если рН раствора аминокислоты равен значению изоэлектрической точки, тогда:
A) молекула аминокислоты заряжена отрицательно
B) молекула аминокислоты заряжена положительно
C) молекула аминокислоты нейтральна +
D) аминокислота хорошо растворима в воде
E) молекула аминокислоты легко разрушается
117. Если рН раствора аминокислоты равен значению изоэлектрической точки, тогда:
A) молекула аминокислоты в виде биполярного иона +
B) молекула аминокислоты в виде аниона
C) молекула аминокислоты в виде катиона
D) молекула аминокислоты не заряжена
E) молекула аминокислоты разрушается
118. В составе молекулы белка не встречается:
A) креатинфосфат +
B) глутамин
D) гистидин
E) тирозин
119. глицина = 2,4, рК2 глицина = 9,7, изоэлектрическая точка глицина равна:
120. В состав молекулы белка входит:
A) карбоновая кислота
B) D- -аминокислоты
C) D- -аминокислоты
D) L- -аминокислоты
E) L- -аминокислоты +
121. Аминокислота, которая не встречается в составе молекулы белка:
A) триптофан
B) аспарагиновая кислота
D) орнитин +
E) гистидин
122. К заменимым аминокислотам не относится:
C) глутаминовая кислота
D) триптофан +
123. К незаменимым аминокислотам не относится:
B) фенилаланин
D) пролин +
E) треонин
124. К заменимым аминокислотам относится:
B) изолейцин
C) аспарагиновая кислота +
D) метионин
E) триптофан
125. К незаменимым аминокислотам относится:
B) глутаминовая кислота
D) аспарагин
E) цистеин
126. Нингидриновая реакция - качественная реакция на:
A) свободные аминогруппы +
B) свободные карбоксильные группы
C) для определения гидроксильных групп
D) для определения SH-групп
E) для определения ароматических аминокислот
127. Для определения белка в растворе используют:
A) реакцию Селиванова
B) биуретовую реакцию +
C) реакцию Сакагучи
D) нитропруссидную реакцию
E) реакцию Миллона
128. Реакция Миллона используется: для определения:
A) остатков тирозина в молекуле белка +
B) гуанидиновой группы аргинина
C) имидазольной группы гистидина
D) ароматических аминокислот
E) SH-группы цистеина
129. Какая аминокислота дикарбоновая:
A) тирозин
B) глутаминовая кислота +
D) триптофан
130. В составе молекулы гемоглобина:
A) 1 субъединица
B) 3 субъединицы
C) 6 субъединиц
D) 4 субъединицы +
E) 2 субъединицы
131. Сколько субъединиц в молекуле альбумина:
132. Если рН раствора белка выше значения изоэлектрической точки молекулы белка, тогда:
A) молекула белка заряжена отрицательно +
B) молекула белка заряжена положительно
C) молекула белка незаряжена
D) молекула белка денатурирована
E) белок нерастворим
133. К глобулярным белкам не относится:
A) трипсин
B) гемоглобин
C) кератин +
D) альбумин
E) миоглобин
134. К фибриллярным белкам не относится:
A) коллаген
B) инсулин +
C) кератин
E) эластин
135. В состав гликопротеидов входят:
A) фосфаты
B) углеводы +
E) ионы металлов
136. Молекула белка в изоэлектрической точке:
A) заряжена отрицательно
B) заряжена положительно
C) общий заряд равен нулю +
D) денатурирована
E) растворима в растворе
137. Для ферментативной активации аминокислот требуется:
138. В состав гемоглобина входит:
A) марганец
B) молибден
E) железо +
139. Простетическая группа миоглобина - это:
B) молибден
C) ионы магния
D) ионы меди
E) тиаминпирофосфат
140. В формировании третичной структуры молекулы белка участвуют связи:
A) ковалентные связи
B) водородные связи
C) гидрофобные взаимодействия
D) ионные взаимодействия
E) все указанные связи +
141. Белок, у которого имеется четвертичная структура:
A) гемоглобин +
B) рибонуклеаза
C) альбумин
D) миоглобин
E) инсулин
142. Переносчик молекулярного кислорода в организме:
A) амилаза
B) альбумин
C) гемоглобин +
E) коллаген
143. В состав фосфопротеидов входят:
B) фосфаты +
C) углеводы
E) ионы металлов
144. Защитную функцию в организме выполняют:
A) иммуноглобулины +
B) альбумин
C) гистоны
D) фосфатазы
145. Функция, которую белки выполняют в организме:
A) транспортная
B) защитная
C) регуляторная
D) структурная
E) все указанные функции +
146. Липопротеидом является белок, содержащий в своем составе:
B) ионы металлов
C) углеводы
D) липиды +
E) фосфаты
147. Нуклеопротеиды - это:
A) сложные белки, в состав которых входят липиды
B) комплексы нуклеиновых кислот с белками +
C) сложные белки, в состав которых входят углеводы
D) сложные белки, в состав которых входят фосфаты
E) сложные белки, в состав которых входят ионы металлов
148. Для активности пепсина:
A) рН среды должно быть равно рН 1,5-3,0 +
B) среда должна быть нейтральной
C) среда должна быть щелочной
D) в среде должны присутствовать ионы металлов
E) в среде должны присутствовать свободные аминокислоты
149. Белок крови, связывающий жирные кислоты:
A) гемоглобин
B) альбумин +
C) орозомукоид
D) гаптоглобин
E) иммуноглобулин
150. В процессе реакции переаминирования аминокислот образуются:
A) -кетокислоты +
B) альдегиды
D) непредельные углеводороды
E) оксикислоты
151. Буферные свойства аминокислот обусловлены:
A) наличием карбоксильной группы
B) наличием аминогруппы
C) хорошей растворимостью
D) характером радикала
E) присутствием в молекуле одновременно карбоксильной и аминогруппы +
152. Тирозин образуется в печени из:
A) триптофана
B) фенилаланина +
D) гистидина
E) аргинина
153. Аминокислоты используются в организме:
A) для синтеза белков
B) для синтеза гормонов
C) для образования -кетокислот
D) как источник азота для синтеза азотистых соединений неаминоксилотной природы
E) во всех указанных случаях +
154. В цикле мочевины образуется:
B) изолейцин
C) гистидин
D) аргинин +
E) триптофан
155. В организме ферменты:
A) катализируют скорость химической реакции +
B) выполняют структурную функцию
C) запасной фонд химической энергии для анаболических реакций
D) выполняют защитную функцию
E) регулируют осмотическое давление
156. Окислительно-восстановительные реакции катализируют:
A) оксидоредуктазы +
C) гидролазы
D) трансферазы
157. Ферменты, катализирующие перенос атомов и атомных групп:
B) трансферазы +
C) оксидоредуктазы
D) гидролазы
158. Ферменты, катализирующие гидролиз химических связей:
A) оксидоредуктазы
B) трансферазы
D) гидролазы +
159. Ферменты, катализирующие реакции изомеризации:
A) оксидоредуктазы
B) трансферазы
C) изомеразы +
D) гидролазы
160. Ферменты, катализирующие реакции образования новой связи:
A) лигазы +
B) гидролазы
C) трансферазы
D) изомеразы
E) оксидоредуктазы
161. Ферменты, катализирующие реакции негидролитического расщепления и образования двойной связи:
A) гидролазы
B) трансферазы
C) изомеразы
D) оксидоредуктазы
162. К классу гидролаз относятся:
A) эстеразы
B) протеиназы
C) гликозидазы
E) все указанные классы ферментов +
163. К оксидоредуктазам не относятся:
A) лактатдегидрогеназа
B) алкогольдегидрогеназа
C) пероксидаза
D) цитохромоксидаза
E) рибонуклеаза +
164. Апофермент - это:
A) простетическая группа
B) белок, связанный с простетической группой +
C) белковая часть фермента, активная форма которого содержит кофермент
D) органические кофакторы фермента
E) простой белок
165. Никотинамидадениндинуклеотид - кофермент, который переносит:
A) метильные группы
B) алкильные группы
C) ацильные группы
D) аминные группы
E) атомы водорода +
166. К коферментам не относится:
A) флавинмононуклеотид
B) пиридоксальфосфат
C) тироксин +
D) никотинамидадениндинуклеотид
E) тиаминпирофосфат
167. Кофермент, который переносит ацильные группы:
A) никотинамидадениндинуклеотид
B) пиридоксальфосфат
C) флавинмононуклеотид
D) кофермент А +
E) фолиевая кислота
168. К свойствам ферментов не относится:
A) не снижает энергию активации химических реакций +
B) эффективность действия
C) высокая специфичность по отношению к субстрату
D) снижает энергию активации химической реакции
E) специфичность действия относительно типа химической реакции
169. Гидролиз сложных эфиров катализируют:
A) эстеразы +
B) гликозидазы
C) гидролазы
D) протеиназы
E) синтетазы
170. К коферментам относится:
A) тетрагидрофолиевая кислота
B) тиаминпирофосфат
C) флавинадениндинуклеотид
D) липоамид
E) все указанные соединения +
171. Не относится к протеолитическим ферментам:
A) трипсин
B) липаза +
D) эластаза
E) химотрипсин
172. Протеолитические ферменты катализируют:
A) гидролиз пептидной связи +
B) гидролиз гликозидной связи
C) гидролиз сложноэфирной связи
D) гидролиз фосфоэфирной связи
E) гидролиз простой эфирной связи
173. Ферменты - это:
A) биологические катализаторы, ускоряющие химические реакции +
B) основной строительный материал клеточных мембран
C) вещества обеспечивающие детоксикацию организма
D) ингибиторы химических реакций
E) вещества участвующие в передаче сигнальной информации
174. Конкурентные ингибиторы:
A) связываются с субстратами
B) связываются с активным центром фермента +
C) не связываются с фермент-субстратным комплексом
D) не связываются с активным центром фермента, связываются с другим участком фермента
E) связываются с аллостерическим центром фермента необратимо
175. Неконкурентные ингибиторы:
A) подобны по своей структуре субстрату
B) отличаются по своей структуре от субстрата +
C) связываются с активным центром фермента
D) денатурируют фермент
E) связываются с субстратом
176. Протеолитический фермент пепсин:
A) функционирует в желудочном соке при рН 1,5-3,0 +
B) функционирует в желудочном соке при рН 9,0-11,0
C) входит в состав слизистой кишечника
D) функционирует в тонком кишечнике
E) обеспечивает гидролиз триацилглицеридов в жировой ткани
177. Трипсин синтезируется в виде предшественника в:
B) поджелудочной железе +
C) тонком кишечнике
D) жировой ткани
E) слизистой желудка
178. Активность ферментов связана с:
A) температурой среды
B) рН среды
C) присутствием в среде различных химических соединений
D) природой субстрата
E) со всеми указанными условиями +
179. Ферменты ускоряют протекание химических реакций, так как:
A) снижают энергию активации химической реакции +
B) увеличивают энергию активации реакции
C) снижают концентрацию продукта реакции
D) изменяют структуру субстрата
E) изменяют концентрацию исходных веществ
180. В состав нуклеотидов не входит:
A) остаток фосфорной кислоты
B) пиримидиновые основания
C) пуриновые оснвоания
D) дезоксирибоза
E) глюкоза +
181. В состав рибонуклеозидов входит:
B) азотистое основание и рибоза +
E) остаток фосфорной кислоты и рибоза
182. В состав ДНК не входит:
B) урацил +
E) цитозин
183. В состав РНК входит:
A) 2-D-дезоксирибофураноза
B) глюкопираноза
C) D-рибофураноза +
D) фруктофураноза
E) арабиноза
184. Нуклеотидом является:
A) аденозин
C) адениловая кислота +
E) цитозин
185. В состав дезоксирибонуклеотидов входит:
A) остаток фосфорной кислоты и азотистое основание
B) азотистое основание и рибоза
C) азотистое основание и дезоксирибоза
D) остаток фосфорной кислоты и дезоксирибоза
E) остаток фосфорной кислоты, дезоксирибоза и азотистое основание +
186. Азотистое основание, которое не входит в состав РНК:
E) цитозин
187. В составе ДНК содержится:
A) галактопираноза
B) глюкопираноза
C) D-рибофураноза
D) фруктофураноза
E) 2-D-дезоксирибофураноза +
188. Нуклеозидом не является:
A) гуанозин
B) рибозо-5-фосфат +
C) аденозин
E) цитидин
189. Мономерными единицами нуклеиновых кислот являются:
A) нуклеотиды +
B) азотистые основания
C) аминокислоты
D) рибозофосфаты
E) моносахариды
190. В молекулах нуклеиновых кислот нуклеотиды связаны:
A) дисульфидными связями
 Корпускулярные и волновые свойства частиц
Корпускулярные и волновые свойства частиц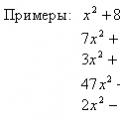 Уравнения онлайн X 5 0 решение
Уравнения онлайн X 5 0 решение Предельные монокарбоновые кислоты
Предельные монокарбоновые кислоты