Katika hali ya kawaida, kalsiamu humenyuka na. Calcium na sifa zake
Calcium
KALCIUM-mimi; m.[kutoka lat. calx (calcis) - chokaa] Kipengele cha kemikali (Ca), chuma-nyeupe chuma ambacho ni sehemu ya chokaa, marumaru, nk.
◁ Calcium, oh, oh. K chumvi.
kalsiamu(lat. Calcium), kipengele cha kemikali cha kundi la II la jedwali la mara kwa mara, ni mali ya metali ya dunia ya alkali. Jina kutoka lat. calx, genitive calcis - chokaa. Metali ya fedha-nyeupe, msongamano 1.54 g/cm 3, t pl 842ºC. Kwa joto la kawaida, hutiwa oksidi kwa urahisi hewani. Kwa suala la kuenea katika ukoko wa dunia, inashika nafasi ya 5 (madini ya calcite, jasi, fluorite, nk). Kama wakala amilifu wa kupunguza, hutumika kupata U, Th, V, Cr, Zn, Be na metali nyingine kutoka kwa misombo yao, ili kuondoa oksidi chuma, shaba, nk. Ni sehemu ya vifaa vya kuzuia msuguano. Misombo ya kalsiamu hutumiwa katika ujenzi (chokaa, saruji), maandalizi ya kalsiamu hutumiwa katika dawa.
KALCIUMCALCIUM (lat. Calcium), Ca (soma "kalsiamu"), kipengele cha kemikali na nambari ya atomiki 20, iko katika kipindi cha nne katika kundi la IIA la mfumo wa mara kwa mara wa vipengele vya Mendeleev; uzito wa atomiki 40.08. Ni mali ya vipengele vya ardhi vya alkali (sentimita. METALI ZA ARDHI YA ALKALINE).
Kalsiamu ya asili ina mchanganyiko wa nuclides (sentimita. NUCLIDE) na idadi kubwa ya 40 (katika mchanganyiko kwa wingi wa 96.94%), 44 (2.09%), 42 (0.667%), 48 (0.187%), 43 (0.135%) na 46 (0.003%). Usanidi wa safu ya 4 ya elektroni ya nje s 2
. Katika karibu misombo yote, hali ya oxidation ya kalsiamu ni +2 (valency II).
Radi ya atomi ya kalsiamu ya neutral ni 0.1974 nm, radius ya Ca 2+ ion ni kutoka 0.114 nm (kwa nambari ya uratibu 6) hadi 0.148 nm (kwa nambari ya uratibu 12). Nishati ya ionization ya mfululizo wa atomi ya kalsiamu ya neutral ni, kwa mtiririko huo, 6.133, 11.872, 50.91, 67.27 na 84.5 eV. Kulingana na mizani ya Pauling, uwezo wa kielektroniki wa kalsiamu ni takriban 1.0. Kwa fomu yake ya bure, kalsiamu ni chuma cha silvery-nyeupe.
Historia ya ugunduzi
Misombo ya kalsiamu hupatikana kila mahali katika asili, hivyo ubinadamu umejulikana nao tangu nyakati za kale. Chokaa kwa muda mrefu imekuwa kutumika katika ujenzi (sentimita. LIME)(wepesi na wa slaked), ambayo kwa muda mrefu imekuwa ikizingatiwa kuwa kitu rahisi, "dunia." Hata hivyo, mwaka wa 1808 mwanasayansi wa Kiingereza G. Davy (sentimita. DAVY Humphrey) imeweza kupata chuma kipya kutoka kwa chokaa. Ili kufanya hivyo, Davy alikabiliwa na electrolysis mchanganyiko wa chokaa iliyotiwa unyevu kidogo na oksidi ya zebaki na kutenga chuma kipya kutoka kwa amalgam iliyoundwa kwenye cathode ya zebaki, ambayo aliiita kalsiamu (kutoka kwa Kilatini calx, jenasi calcis - chokaa). Huko Urusi kwa muda chuma hiki kiliitwa "liming".
Kuwa katika asili
Calcium ni moja ya vipengele vya kawaida duniani. Inachukua 3.38% ya wingi wa ukoko wa dunia (ya 5 kwa wingi baada ya oksijeni, silicon, alumini na chuma). Kutokana na shughuli zake za juu za kemikali, kalsiamu haitokei kwa fomu ya bure katika asili. Kalsiamu nyingi hupatikana katika silicates (sentimita. SILICATES) na aluminosilicates (sentimita. ALUMINIUM SILICATES) miamba mbalimbali (granites (sentimita. GRANITE), miguno (sentimita. GNEISS) Nakadhalika.). Kwa namna ya miamba ya sedimentary, misombo ya kalsiamu inawakilishwa na chaki na mawe ya chokaa, yenye hasa ya calcite ya madini. (sentimita. CALCITE)(CaCO 3). Aina ya fuwele ya calcite - marumaru - ni ya kawaida sana katika asili.
Madini ya kalsiamu kama vile chokaa ni ya kawaida sana (sentimita. LIMESTONE) CaCO3, anhydrite (sentimita. ANHYDRITE) CaSO 4 na jasi (sentimita. GYPSUM) CaSO 4 2H 2 O, fluorite (sentimita. FLUORITE) CaF 2, apatites (sentimita. APATITE) Ca 5 (PO 4) 3 (F,Cl,OH), dolomite (sentimita. DOLOMITE) MgCO 3 ·CaCO 3 . Uwepo wa chumvi za kalsiamu na magnesiamu katika maji ya asili huamua ugumu wake (sentimita. UGUMU WA MAJI). Kiasi kikubwa cha kalsiamu kinapatikana katika viumbe hai. Kwa hiyo, hydroxyapatite Ca 5 (PO 4) 3 (OH), au, kwa kuingia mwingine, 3Ca 3 (PO 4) 2 ·Ca (OH) 2, ni msingi wa tishu za mfupa za wanyama wenye uti wa mgongo, ikiwa ni pamoja na wanadamu; Magamba na magamba ya wanyama wengi wasio na uti wa mgongo, maganda ya mayai, n.k. yametengenezwa kutokana na calcium carbonate CaCO 3.
Risiti
Kalsiamu ya metali hupatikana kwa elektrolisisi ya kuyeyuka inayojumuisha CaCl 2 (75-80%) na KCl au kutoka kwa CaCl 2 na CaF 2, pamoja na kupunguzwa kwa aluminothermic ya CaO katika 1170-1200 °C:
4CaO + 2Al = CaAl 2 O 4 + 3Ca.
Tabia za kimwili na kemikali
Metali ya kalsiamu iko katika marekebisho mawili ya allotropiki (tazama Allotropy (sentimita. ALLOTROPY)) Hadi 443 °C, a-Ca yenye kimiani kilicho katikati ya uso wa ujazo (parameta = 0.558 nm) ni dhabiti; b-Ca yenye kimiani cha ujazo cha aina ya a-Fe (parameta = 0.448 nm) imara zaidi. Kiwango myeyuko wa kalsiamu ni 839 °C, kiwango cha mchemko ni 1484 °C, msongamano ni 1.55 g/cm3.
Shughuli ya kemikali ya kalsiamu ni ya juu, lakini chini kuliko ile ya madini mengine yote ya dunia ya alkali. Humenyuka kwa urahisi na oksijeni, dioksidi kaboni na unyevu hewani, ndiyo sababu uso wa chuma cha kalsiamu kawaida huwa kijivu, kwa hivyo kalsiamu ya maabara kawaida huhifadhiwa, kama metali zingine za alkali, kwenye jar iliyofungwa sana chini ya safu. ya mafuta ya taa.
Katika mfululizo wa uwezo wa kawaida, kalsiamu iko upande wa kushoto wa hidrojeni. Uwezo wa kawaida wa elektrodi wa jozi ya Ca 2+ /Ca 0 ni -2.84 V, ili kalsiamu inajibu kikamilifu ikiwa na maji:
Ca + 2H 2 O = Ca(OH) 2 + H 2.
Kalsiamu humenyuka pamoja na vitu visivyo vya metali amilifu (oksijeni, klorini, bromini) katika hali ya kawaida:
2Ca + O 2 = 2CaO; Ca + Br 2 = CaBr 2.
Inapokanzwa katika hewa au oksijeni, kalsiamu huwaka. Kalsiamu humenyuka pamoja na metali zisizo na kazi kidogo (hidrojeni, boroni, kaboni, silicon, nitrojeni, fosforasi na zingine) inapokanzwa, kwa mfano:
Ca + H 2 = CaH 2 (hidridi ya kalsiamu),
Ca + 6B = CaB 6 (boride ya kalsiamu),
3Ca + N 2 = Ca 3 N 2 (nitridi ya kalsiamu)
Ca + 2C = CaC 2 (calcium carbudi)
3Ca + 2P = Ca 3 P 2 (phosfidi ya kalsiamu), phosfidi za kalsiamu za nyimbo za CaP na CaP 5 pia zinajulikana;
2Ca + Si = Ca 2 Si (silicide ya kalsiamu); silicides za kalsiamu za nyimbo za CaSi, Ca 3 Si 4 na CaSi 2 pia zinajulikana.
Tukio la athari hapo juu, kama sheria, linafuatana na kutolewa kwa kiasi kikubwa cha joto (yaani, athari hizi ni exothermic). Katika misombo yote na zisizo za metali, hali ya oxidation ya kalsiamu ni +2. Mengi ya misombo ya kalsiamu na zisizo za metali hutengana kwa urahisi na maji, kwa mfano:
CaH 2 + 2H 2 O = Ca(OH) 2 + 2H 2,
Ca 3 N 2 + 3H 2 O = 3Ca(OH) 2 + 2NH 3.
Oksidi ya kalsiamu ni kawaida. Katika maabara na teknolojia hupatikana kwa mtengano wa mafuta wa carbonates:
CaCO 3 = CaO + CO 2.
Oksidi ya kalsiamu ya kiufundi CaO inaitwa quicklime.
Humenyuka pamoja na maji kuunda Ca(OH) 2 na kutoa kiwango kikubwa cha joto:
CaO + H 2 O = Ca(OH) 2.
Ca(OH)2 inayopatikana kwa njia hii kwa kawaida huitwa chokaa iliyokatwa au maziwa ya chokaa (sentimita. MAZIWA YA LIME) kutokana na ukweli kwamba umumunyifu wa hidroksidi ya kalsiamu katika maji ni ya chini (0.02 mol / l saa 20 ° C), na inapoongezwa kwa maji, kusimamishwa nyeupe huundwa.
Wakati wa kuingiliana na oksidi za asidi, CaO huunda chumvi, kwa mfano:
CaO + CO 2 = CaCO 3; CaO + SO 3 = CaSO 4.
Ioni ya Ca 2+ haina rangi. Wakati chumvi za kalsiamu zinaongezwa kwenye moto, moto hugeuka kuwa nyekundu ya matofali.
Chumvi za kalsiamu kama vile kloridi ya CaCl 2, bromidi ya CaBr 2, iodidi ya CaI 2 na nitrate ya Ca(NO 3) 2 huyeyushwa sana katika maji. Haiyeyuki katika maji ni floridi CaF 2, carbonate CaCO 3, sulfate CaSO 4, wastani wa orthofosfati Ca 3 (PO 4) 2, oxalate CaC 2 O 4 na baadhi ya wengine.
Ni muhimu kwamba, tofauti na wastani wa kalsiamu carbonate CaCO 3, asidi ya kalsiamu carbonate (bicarbonate) Ca(HCO 3) 2 ni mumunyifu katika maji. Kwa asili, hii inasababisha taratibu zifuatazo. Wakati mvua baridi au maji ya mto, yaliyojaa dioksidi kaboni, hupenya chini ya ardhi na kuanguka kwenye chokaa, kufutwa kwao kunazingatiwa:
CaCO 3 + CO 2 + H 2 O = Ca(HCO 3) 2.
Katika sehemu zile zile ambapo maji yaliyojaa bicarbonate ya kalsiamu huja kwenye uso wa dunia na huwashwa na mionzi ya jua, majibu ya kinyume hutokea:
Ca(HCO 3) 2 = CaCO 3 + CO 2 + H 2 O.
Hii ndio jinsi wingi mkubwa wa vitu huhamishwa katika asili. Kama matokeo, mashimo makubwa yanaweza kuunda chini ya ardhi (tazama Karst (sentimita. KARST (jambo la asili)), na "icicles" za mawe mazuri - stalactites - fomu kwenye mapango (sentimita. STALACTITES (miundo ya madini) na stalagmites (sentimita. STALAGMITES).
Uwepo wa bicarbonate ya kalsiamu iliyoyeyushwa katika maji kwa kiasi kikubwa huamua ugumu wa muda wa maji. (sentimita. UGUMU WA MAJI). Inaitwa ya muda kwa sababu wakati maji yanachemka, bicarbonate hutengana na CaCO 3 huanguka. Jambo hili linaongoza, kwa mfano, kwa ukweli kwamba kiwango huunda kwenye kettle kwa muda.
Matumizi ya kalsiamu na misombo yake
Metali ya kalsiamu hutumiwa kwa uzalishaji wa metallothermic ya urani (sentimita. URANIUM (kipengele cha kemikali), waturiamu (sentimita. THORIUM), titani (sentimita. TITANIUM (kipengele cha kemikali), zirconiamu (sentimita. ZIRCONIUM), cesiamu (sentimita. CESIUM) na rubidium (sentimita. RUBIDIUM).
Misombo ya asili ya kalsiamu hutumiwa sana katika utengenezaji wa vifungashio (saruji (sentimita. CEMENT), jasi (sentimita. GYPSUM), chokaa, nk). Athari ya kumfunga ya chokaa cha slaked inategemea ukweli kwamba baada ya muda, hidroksidi ya kalsiamu humenyuka na dioksidi kaboni katika hewa. Kama matokeo ya mmenyuko unaoendelea, fuwele zenye umbo la sindano za calcite CaCO3 huundwa, ambazo hukua na kuwa mawe ya karibu, matofali na vifaa vingine vya ujenzi na, kama ilivyokuwa, huchomekwa kuwa moja. Crystalline calcium carbonate - marumaru - ni nyenzo bora ya kumaliza. Chaki hutumiwa kwa kupaka nyeupe. Kiasi kikubwa cha chokaa hutumiwa katika utengenezaji wa chuma cha kutupwa, kwani hufanya iwezekanavyo kubadilisha uchafu wa kinzani wa madini ya chuma (kwa mfano, quartz SiO 2) kuwa slags za kuyeyuka kidogo.
Bleach ni nzuri sana kama dawa ya kuua viini. (sentimita. PODA YA KUFUTA)- "bleach" Ca(OCl)Cl - kloridi iliyochanganywa na hipokloridi ya kalsiamu (sentimita. CALCIUM HYPOCHLORITE), na uwezo wa juu wa vioksidishaji.
Sulfate ya kalsiamu pia hutumiwa sana, inapatikana katika mfumo wa kiwanja kisicho na maji na katika mfumo wa hidrati za fuwele - kinachojulikana kama sulfate ya "nusu-aqueous" - alabaster. (sentimita. ALEVIZ FRYAZIN (Milanese)) CaSO 4 ·0.5H 2 O na dihydrate sulfate - gypsum CaSO 4 ·2H 2 O. Gypsum hutumiwa sana katika ujenzi, katika uchongaji, kwa ajili ya utengenezaji wa ukingo wa stucco na bidhaa mbalimbali za kisanii. Plasta pia hutumiwa katika dawa kurekebisha mifupa wakati wa fractures.
Kloridi ya kalsiamu CaCl 2 hutumiwa pamoja na chumvi ya meza ili kupambana na icing ya nyuso za barabara. Fluoridi ya kalsiamu CaF 2 ni nyenzo bora ya macho.
Calcium katika mwili
Calcium ni kipengele cha biogenic (sentimita. VIPENGELE VYA BIOGENIC), daima hupo katika tishu za mimea na wanyama. Sehemu muhimu ya kimetaboliki ya madini ya wanyama na wanadamu na lishe ya madini ya mimea, kalsiamu hufanya kazi mbalimbali katika mwili. Inaundwa na apatite (sentimita. APATITE), pamoja na sulfate na carbonate, kalsiamu huunda sehemu ya madini ya tishu za mfupa. Mwili wa binadamu wenye uzito wa kilo 70 una kuhusu kilo 1 ya kalsiamu. Calcium inashiriki katika utendaji wa njia za ion (sentimita. IONI MICHUZI) kusafirisha vitu kupitia utando wa kibiolojia katika upitishaji wa msukumo wa neva (sentimita. MSHIKAMANO WA NEVA), katika michakato ya kuganda kwa damu (sentimita. KUGANDA KWA DAMU) na mbolea. Calciferols hudhibiti kimetaboliki ya kalsiamu katika mwili (sentimita. CALCIFEROLS)(vitamini D). Ukosefu au ziada ya kalsiamu husababisha magonjwa mbalimbali - rickets (sentimita. RIKETI), kalcinosis (sentimita. CALCINOSIS) nk Kwa hiyo, chakula cha binadamu lazima iwe na misombo ya kalsiamu kwa kiasi kinachohitajika (800-1500 mg ya kalsiamu kwa siku). Maudhui ya kalsiamu ni ya juu katika bidhaa za maziwa (kama vile jibini la jumba, jibini, maziwa), baadhi ya mboga mboga na vyakula vingine. Maandalizi ya kalsiamu hutumiwa sana katika dawa.
Kamusi ya encyclopedic. 2009 .
Visawe:Utangulizi
Mali na matumizi ya kalsiamu
1 Sifa za kimwili
2 Sifa za kemikali
3 Maombi
Kupata kalsiamu
1 Uzalishaji wa electrolytic wa kalsiamu na aloi zake
2 Uzalishaji wa joto
3 Njia ya utupu-mafuta ya kupata kalsiamu
3.1 Njia ya aluminothermic ya kupunguza kalsiamu
3.2 Mbinu ya silicothermic ya kupunguza kalsiamu
Sehemu ya vitendo
Bibliografia
Utangulizi
Kipengele cha kemikali cha kikundi cha II cha mfumo wa upimaji wa Mendeleev, nambari ya atomiki 20, wingi wa atomiki 40.08; fedha-nyeupe mwanga chuma. Kipengele cha asili ni mchanganyiko wa isotopu sita thabiti: 40Ca, 42Ca, 43Ca, 44Ca, 46Ca na 48Ca, ambayo ya kawaida ni 40 Ca (96, 97%).
Ca misombo - chokaa, marumaru, jasi (pamoja na chokaa - bidhaa ya calcination ya chokaa) walikuwa tayari kutumika katika ujenzi katika nyakati za kale. Hadi mwisho wa karne ya 18, wanakemia waliona chokaa kuwa ngumu rahisi. Mnamo mwaka wa 1789, A. Lavoisier alipendekeza kuwa chokaa, magnesia, barite, alumina na silika ni vitu tata. Mnamo mwaka wa 1808, G. Davy, akiweka mchanganyiko wa chokaa chenye mvua na oksidi ya zebaki kwa electrolysis na cathode ya zebaki, alitayarisha Ca amalgam, na kwa kunyunyiza zebaki kutoka humo, alipata chuma kinachoitwa "Calcium" (kutoka Kilatini calx, calcis jinsia - chokaa) .
Uwezo wa kalsiamu kufunga oksijeni na nitrojeni umefanya iwezekane kuitumia kwa ajili ya utakaso wa gesi ajizi na kama getta (Getter ni dutu inayotumiwa kunyonya gesi na kuunda utupu wa kina katika vifaa vya elektroniki.) katika vifaa vya redio vya utupu.
Calcium pia hutumiwa katika madini ya shaba, nikeli, vyuma maalum na shaba; hufunga uchafu unaodhuru wa salfa, fosforasi, na kaboni iliyozidi. Kwa madhumuni sawa, aloi za kalsiamu na silicon, lithiamu, sodiamu, boroni, na alumini hutumiwa.
Katika tasnia, kalsiamu hupatikana kwa njia mbili:
) Kwa kupasha joto mchanganyiko wa briquetted wa CaO na Al poda katika 1200 °C katika utupu wa 0.01 - 0.02 mm. rt. Sanaa.; kutofautishwa na majibu:
CaO + 2Al = 3CaO Al2O3 + 3Ca
Mvuke wa kalsiamu hujilimbikiza kwenye uso wa baridi.
) Kwa electrolysis ya kuyeyuka kwa CaCl2 na KCl na cathode ya kioevu ya shaba-kalsiamu, aloi ya Cu-Ca (65% Ca) huandaliwa, ambayo kalsiamu hutolewa kwa joto la 950 - 1000 ° C katika utupu wa 0.1 - 0.001 mm Hg.
) Mbinu ya kutengeneza kalsiamu kwa kutengana kwa mafuta ya CARBIDE ya kalsiamu CaC2 pia imetengenezwa.
Calcium ni ya kawaida sana katika asili kwa namna ya misombo mbalimbali. Katika ukoko wa dunia inashika nafasi ya tano, ikichukua 3.25%, na mara nyingi hupatikana katika mfumo wa chokaa CaCO. 3, dolomite CaCO 3Mg CO 3, gypsum CaSO 42H 2O, fosforasi Ca 3(P.O. 4)2 na Fluorspar CaF 2, bila kuhesabu sehemu kubwa ya kalsiamu katika utungaji wa miamba ya silicate. Maji ya bahari yana wastani wa 0.04% (wt.) kalsiamu.
Katika kazi hii ya kozi, mali na matumizi ya kalsiamu husomwa, pamoja na nadharia na teknolojia ya njia za utupu-joto kwa ajili ya uzalishaji wake.
. Mali na matumizi ya kalsiamu
.1 Sifa za kimaumbile
Kalsiamu ni chuma-nyeupe-fedha, lakini hufifia inapofunuliwa na hewa kwa sababu ya uundaji wa oksidi kwenye uso wake. Ni chuma cha ductile ngumu zaidi kuliko risasi. Kiini cha kioo ?-Umbo la Ca (imara kwa halijoto ya kawaida) ujazo unaozingatia uso, a = 5.56 Å . Radi ya atomiki 1.97 Å , radii ya ionic Ca 2+, 1,04Å . Uzito 1.54 g/cm 3(20°C). Zaidi ya 464 °C yenye pembe sita ?-fomu. kiwango myeyuko 851 °C, kiwango mchemko 1482 °C; mgawo wa joto wa upanuzi wa mstari 22 · 10 -6 (0-300 °C); conductivity ya mafuta katika 20 °C 125.6 W/(m K) au 0.3 cal/(cm sec °C); uwezo maalum wa joto (0-100 °C) 623.9 J/(kg K) au 0.149 cal/(g °C); upinzani wa umeme kwa 20 °C 4.6 10 -8ohm m au 4.6 10 -6 ohm cm; mgawo wa joto wa upinzani wa umeme ni 4.57 · 10-3 (20 ° C). Modulus ya elasticity 26 Gn / m 2(2600 kgf/mm 2); nguvu ya mvutano 60 MN/m 2(kgf 6 kwa mm 2); kikomo cha elastic 4 MN / m 2(0.4 kgf/mm 2), kutoa nguvu 38 MN/m 2(3.8 kgf/mm 2); urefu wa jamaa 50%; Ugumu wa Brinell 200-300 Mn / m 2(20-30 kgf/mm 2) Calcium ya usafi wa kutosha wa juu ni plastiki, inashinikizwa kwa urahisi, imevingirwa na inayoweza kukatwa.
1.2 Sifa za kemikali
Calcium ni chuma hai. Kwa hivyo, chini ya hali ya kawaida, inaingiliana kwa urahisi na oksijeni ya anga na halojeni:
Ca + O 2= 2 CaO (oksidi ya kalsiamu) (1)
Ca + Br 2= CaBr 2(bromidi ya kalsiamu). (2)
Kalsiamu humenyuka pamoja na hidrojeni, nitrojeni, salfa, fosforasi, kaboni na metali zingine zisizo na metali inapokanzwa:
Ca + H 2= SANA 2(calcium hidridi) (3)
Ca + N 2= Ca 3N 2(nitridi ya kalsiamu) (4)
Ca + S = CaS (sulfidi ya kalsiamu) (5)
Ca + 2 P = Ca 3R 2(calcium fosfidi) (6)
Ca + 2 C = CaC 2 (kalsiamu carbudi) (7)
Kalsiamu humenyuka polepole na maji baridi, lakini kwa nguvu sana na maji ya moto, na kutoa msingi thabiti Ca(OH)2. :
Ca + 2 H 2O = Ca(OH)2 + N 2 (8)
Kwa kuwa ni wakala wa kupunguza nguvu, kalsiamu inaweza kuondoa oksijeni au halojeni kutoka kwa oksidi na halidi za metali ambazo hazifanyi kazi sana, i.e. ina sifa za kupunguza:
Ca + Nb 2O5 = CaO + 2 Nb; (9)
Ca + 2 NbCl 5= 5 CaCl2 + 2 Nb (10)
Kalsiamu humenyuka kwa ukali pamoja na asidi kutoa hidrojeni, humenyuka pamoja na halojeni na hidrojeni kavu kuunda hidridi ya CaH. 2. Wakati kalsiamu inapokanzwa na grafiti, carbudi ya CaC huundwa. 2. Calcium hupatikana kwa electrolysis ya CaCl iliyoyeyuka 2au kupunguzwa kwa aluminothermic katika utupu:
6CaO + 2Al = 3Ca + 3CaO Al2 KUHUSU 3 (11)
Chuma safi hutumiwa kupunguza misombo ya Cs, Rb, Cr, V, Zr, Th, U hadi metali, na kwa deoxidation ya vyuma.
1.3 Maombi
Calcium inazidi kutumika katika tasnia mbalimbali. Hivi karibuni, imepata umuhimu mkubwa kama wakala wa kupunguza katika utayarishaji wa idadi ya metali.
Chuma safi. Uranium hupatikana kwa kupunguza floridi ya uranium na chuma cha kalsiamu. Kalsiamu au hidridi zake zinaweza kutumika kupunguza oksidi za titan, pamoja na oksidi za zirconium, thorium, tantalum, niobium, na metali nyingine adimu.
Calcium ni deoxidizer nzuri na degasser katika uzalishaji wa shaba, nickel, aloi za chromium-nickel, vyuma maalum, nickel na shaba za bati; huondoa sulfuri, fosforasi, na kaboni kutoka kwa metali na aloi.
Kalsiamu huunda misombo ya kinzani na bismuth, kwa hivyo hutumiwa kusafisha risasi kutoka kwa bismuth.
Calcium huongezwa kwa aloi mbalimbali za mwanga. Inasaidia kuboresha uso wa ingot, ukubwa mzuri wa nafaka na kupunguza oxidation.
Aloi za kuzaa zenye kalsiamu hutumiwa sana. Aloi za risasi (0.04% Ca) zinaweza kutumika kutengeneza sheheti za kebo.
Aloi za antifriction za kalsiamu na risasi hutumiwa katika teknolojia. Madini ya kalsiamu hutumiwa sana. Kwa hivyo, chokaa hutumiwa katika utengenezaji wa chokaa, saruji, matofali ya chokaa na moja kwa moja kama nyenzo ya ujenzi, katika madini (flux), katika tasnia ya kemikali kwa utengenezaji wa carbudi ya kalsiamu, soda, caustic soda, bleach, mbolea, katika uzalishaji wa sukari, kioo.
Chaki, marumaru, spar ya Iceland, jasi, fluorite, nk ni ya umuhimu wa vitendo. Kwa sababu ya uwezo wa kumfunga oksijeni na nitrojeni, aloi za kalsiamu au kalsiamu na sodiamu na metali zingine hutumiwa kwa utakaso wa gesi bora na kama kiboreshaji cha vifaa vya redio vya utupu. Calcium pia hutumika kuzalisha hidridi, ambayo ni chanzo cha hidrojeni shambani.
2. Kupata kalsiamu
Kuna njia kadhaa za kupata kalsiamu, hizi ni electrolytic, thermal, vacuum-thermal.
.1 Uzalishaji wa kielektroniki wa kalsiamu na aloi zake
Kiini cha njia ni kwamba cathode hapo awali inagusa elektroliti iliyoyeyuka. Katika hatua ya kuwasiliana, tone la kioevu la chuma linaundwa ambalo linaweka vizuri cathode, ambayo, wakati cathode inapoinuliwa polepole na sawasawa, hutolewa kutoka kwa kuyeyuka pamoja nayo na kuimarisha. Katika kesi hiyo, tone iliyoimarishwa inafunikwa na filamu imara ya electrolyte, kulinda chuma kutoka kwa oxidation na nitriding. Kwa kuendelea na kuinua kwa uangalifu cathode, kalsiamu hutolewa kwenye viboko.
2.2 Uzalishaji wa joto
kalsiamu kemikali electrolytic mafuta
· Mchakato wa kloridi: Teknolojia hiyo inajumuisha kuyeyuka na kupunguza maji ya kloridi ya kalsiamu, risasi inayoyeyuka, kutoa aloi ya risasi-sodiamu mara mbili, kutoa aloi ya ternary risasi-sodiamu-kalsiamu na kuzimua aloi ya ternary kwa risasi baada ya kuondoa chumvi. Mwitikio na kloridi ya kalsiamu huendelea kulingana na equation
CaCl 2 +Na 2Pb 5=2NaCl + PbCa + 2Pb (12)
· Mchakato wa Carbide: Msingi wa kutengeneza aloi ya risasi-kalsiamu ni mmenyuko kati ya carbudi ya kalsiamu na risasi iliyoyeyuka kulingana na equation.
CaC 2+ 3Pb = Pb3 Ca+2C. (13)
2.3 Njia ya utupu-joto kwa kutengeneza kalsiamu
Malighafi kwa njia ya utupu-mafuta
Malighafi ya kupunguzwa kwa mafuta ya oksidi ya kalsiamu ni chokaa, iliyopatikana kwa chokaa cha calcining. Mahitaji makuu ya malighafi ni kama ifuatavyo: chokaa lazima iwe safi iwezekanavyo na iwe na kiwango cha chini cha uchafu unaoweza kupunguzwa na kubadilishwa kuwa chuma pamoja na kalsiamu, hasa metali za alkali na magnesiamu. Chokaa kinapaswa kuchomwa moto hadi carbonate iharibike kabisa, lakini si kabla ya kuchomwa, kwani upunguzaji wa nyenzo za sintered ni chini. Bidhaa iliyochomwa moto lazima ihifadhiwe kutokana na kunyonya kwa unyevu na dioksidi kaboni, kutolewa ambayo wakati wa kurejesha hupunguza utendaji wa mchakato. Teknolojia ya kukamua chokaa na kusindika bidhaa iliyokaushwa ni sawa na usindikaji wa dolomite kwa njia ya silicothermic ya kuzalisha magnesiamu.
.3.1 Njia ya aluminothermic ya kupunguza kalsiamu
Mchoro wa utegemezi wa joto wa mabadiliko katika nishati ya bure ya oxidation ya idadi ya metali (Mchoro 1) inaonyesha kwamba oksidi ya kalsiamu ni mojawapo ya muda mrefu zaidi na vigumu kupunguza oksidi. Haiwezi kupunguzwa na metali nyingine kwa njia ya kawaida - kwa joto la chini na shinikizo la anga. Kinyume chake, kalsiamu yenyewe ni wakala bora wa kupunguza kwa misombo mingine ngumu-kupunguza na wakala wa deoxidizing kwa metali nyingi na aloi. Kupunguza oksidi ya kalsiamu na kaboni kwa ujumla haiwezekani kwa sababu ya malezi ya carbides ya kalsiamu. Walakini, kwa sababu ya ukweli kwamba kalsiamu ina shinikizo la juu la mvuke, oksidi yake inaweza kupunguzwa kwa utupu na alumini, silicon au aloi zao kulingana na majibu.
CaO + Mimi? Ca + MeO (14).
Hadi sasa, ni njia ya aluminothermic tu ya kuzalisha kalsiamu imepata matumizi ya vitendo, kwa kuwa ni rahisi sana kupunguza CaO na alumini kuliko kwa silicon. Kuna maoni tofauti juu ya kemia ya kupunguzwa kwa oksidi ya kalsiamu na alumini. L. Pidgeon na I. Atkinson wanaamini kwamba majibu huendelea na malezi ya monoaluminate ya kalsiamu:
CaO + 2Al = CaO Al 2O3 + 3Ca. (15)
V. A. Pazukhin na A. Ya. Fischer zinaonyesha kuwa mchakato hutokea na malezi ya alumini ya tricalcium:
CaO + 2Al = 3CaO Al 2O 3+ 3Ca. (16)
Kulingana na A.I. Voinitsky, malezi ya majaribio ya pentacalcium ndio ya kwanza katika athari:
CaO + 6Al = 5CaO 3Al 2O3 + 9Ca. (17)
Utafiti wa hivi karibuni wa A. Yu. Taits na A. I. Voinitsky umethibitisha kuwa upunguzaji wa aluminothermic wa kalsiamu hutokea kwa hatua. Hapo awali, kutolewa kwa kalsiamu kunafuatana na uundaji wa 3CaO·AI 2O 3, ambayo kisha humenyuka pamoja na oksidi ya kalsiamu na alumini kuunda 3CaO 3AI 2O 3. Majibu yanaendelea kulingana na mpango ufuatao:
CaO + 6Al = 2 (3CaO Al 2O 3)+ 2CaO + 2Al + 6Ca
(3CaO Al 2O 3) + 2CaO + 2Al = 5CaO 3Al 2O 3+ 3Ca
CaO+ 6A1 = 5CaO 3Al 2O 3+ 9Ca
Kwa kuwa kupunguzwa kwa oksidi hutokea kwa kutolewa kwa kalsiamu ya mvuke, na bidhaa za mmenyuko zilizobaki ziko katika hali ya kufupishwa, ni rahisi kuitenganisha na kuipunguza katika maeneo yaliyopozwa ya tanuru. Hali kuu zinazohitajika kwa upunguzaji wa utupu wa oksidi ya kalsiamu ni joto la juu na shinikizo la chini la mabaki katika mfumo. Chini ni uhusiano kati ya joto na usawa shinikizo la mvuke wa kalsiamu. Nishati ya bure ya mmenyuko (17), iliyohesabiwa kwa halijoto 1124-1728° K imeonyeshwa.
F T = 184820 + 6.95T-12.1 T lg T.
Kwa hivyo utegemezi wa logarithmic wa msawazo wa shinikizo la mvuke wa kalsiamu (mm Hg)
Lg p = 3.59 - 4430\T.
L. Pidgeon na I. Atkinson waliamua kwa majaribio shinikizo la mvuke la usawa wa kalsiamu. Uchambuzi wa kina wa thermodynamic wa mmenyuko wa kupunguzwa kwa oksidi ya kalsiamu na alumini ulifanywa na I. I. Matveenko, ambaye alitoa tegemezi zifuatazo za joto za shinikizo la usawa la mvuke wa kalsiamu:
LGp Ca(1) =8.64 - 12930\T mm Hg.
LGp Ca(2) =8.62 - 11780\T mmHg.
LGp Ca (3 )=8.75 - 12500\T mmHg.
Data iliyohesabiwa na ya majaribio inalinganishwa katika Jedwali. 1.
Jedwali 1 - Athari ya joto juu ya mabadiliko ya usawa wa elasticity ya mvuke ya kalsiamu katika mifumo (1), (2), (3), (3), mm Hg.
Halijoto °СData ya majaribioImekokotwa katika mifumo(1)(2)(3)(3) )1401 1451 1500 1600 17000,791 1016 - - -0,37 0,55 1,2 3,9 11,01,7 3,2 5,6 18,2 492,7 3,5 4,4 6,6 9,50,66 1,4 2,5 8,5 25,7
Kutokana na data iliyotolewa ni wazi kwamba hali zinazofaa zaidi ni za mwingiliano katika mifumo (2) na (3) au (3"). Hii inalingana na uchunguzi, kwa kuwa majaribio ya pentacalcium na aluminiamu ya tricalcium hutawala katika mabaki ya chaji baada ya kupunguzwa kwa oksidi ya kalsiamu na alumini.
Takwimu juu ya usawa wa usawa zinaonyesha kuwa kupunguzwa kwa oksidi ya kalsiamu na alumini inawezekana kwa joto la 1100-1150 ° C. Ili kufikia kiwango cha athari kinachokubalika kivitendo, shinikizo la mabaki katika mfumo wa Ukuaji lazima iwe chini ya usawa P. sawa , yaani usawa wa P lazima uzingatiwe sawa >P ost , na mchakato lazima ufanyike kwa joto la utaratibu wa 1200 °. Utafiti umegundua kuwa kwa joto la 1200-1250 °, matumizi ya juu (hadi 70-75%) na matumizi ya chini maalum ya alumini (kuhusu 0.6-0.65 kg kwa kilo ya kalsiamu) hupatikana.
Kulingana na tafsiri ya hapo juu ya kemia ya mchakato, muundo bora ni malipo iliyoundwa kuunda 5CaO 3Al kwenye mabaki. 2O 3. Ili kuongeza kiwango cha matumizi ya alumini, ni muhimu kutoa ziada ya oksidi ya kalsiamu, lakini sio sana (10-20%), vinginevyo itaathiri vibaya viashiria vingine vya mchakato. Kwa ongezeko la kiwango cha kusaga alumini kutoka kwa chembe za 0.8-0.2 mm hadi minus 0.07 mm (kulingana na V. A. Pazukhin na A. Ya. Fischer), matumizi ya alumini katika mmenyuko huongezeka kutoka 63.7 hadi 78%.
Matumizi ya alumini pia huathiriwa na hali ya briquetting ya malipo. Mchanganyiko wa chokaa na alumini ya unga inapaswa kuunganishwa bila vifunga (ili kuepuka mabadiliko ya gesi katika utupu) kwa shinikizo la kilo 150 / cm3. 2. Kwa shinikizo la chini, matumizi ya alumini hupungua kwa sababu ya kutengwa kwa alumini iliyoyeyuka katika briquettes nyingi za porous, na kwa shinikizo la juu - kutokana na upenyezaji duni wa gesi. Ukamilifu na kasi ya kupona pia hutegemea wiani wa briquettes katika urejesho. Wakati wa kuziweka bila mapengo, wakati upenyezaji wa gesi wa ngome nzima ni mdogo, matumizi ya alumini hupunguzwa sana.
Kielelezo 2 - Mpango wa kupata kalsiamu kwa njia ya utupu-joto.
Teknolojia ya njia ya alumini-joto
Mpango wa kiteknolojia wa utengenezaji wa kalsiamu kwa njia ya aluminothermic umeonyeshwa kwenye Mtini. 2. Chokaa hutumika kama nyenzo ya kuanzia, na poda ya alumini iliyotengenezwa kutoka kwa msingi (bora) au alumini ya upili hutumiwa kama kikali. Alumini inayotumiwa kama wakala wa kupunguza, pamoja na malighafi, haipaswi kuwa na uchafu wa metali tete sana: magnesiamu, zinki, alkali, nk, ambayo inaweza kuyeyuka na kugeuka kuwa condensate. Hii lazima izingatiwe wakati wa kuchagua darasa za alumini iliyorejeshwa.
Kulingana na maelezo ya S. Loomis na P. Staub, nchini Marekani, katika kiwanda cha New England Lime Co. huko Kanani (Connecticut), kalsiamu huzalishwa kwa njia ya aluminothermic. Chokaa cha muundo wa kawaida wafuatayo hutumiwa,%: 97.5 CaO, 0.65 MgO, 0.7 SiO 2, 0.6 Fe 2Oz + AlOz, 0.09 Na 2O+K 2Lo, 0.5 ndio iliyobaki. Bidhaa iliyokaushwa imesagwa kwenye kinu cha Raymond na kitenganishi cha katikati, laini ya kusaga ni (60%) ukiondoa matundu 200. Vumbi la alumini, ambalo ni takataka kutoka kwa utengenezaji wa poda ya alumini, hutumiwa kama wakala wa kupunguza. Chokaa kilichochomwa kutoka kwa mapipa yaliyofungwa na alumini kutoka kwa ngoma hutolewa kwa mizani ya dosing na kisha kwa mchanganyiko. Baada ya kuchanganya, mchanganyiko ni briquetted kwa kutumia njia kavu. Katika mmea uliotajwa, kalsiamu hupunguzwa katika tanuu za retor, ambazo hapo awali zilitumiwa kupata magnesiamu kwa njia ya silicothermic (Mchoro 3). Tanuru huwashwa na gesi ya jenereta. Kila tanuru ina sauti 20 za mlalo zilizotengenezwa kwa chuma kisichostahimili joto kilicho na 28% Cr na 15% Ni.
Kielelezo 3 - Rudisha tanuru kwa uzalishaji wa kalsiamu
Urefu wa kurudi 3 m, kipenyo 254 mm, unene wa ukuta 28 mm. Kupunguza hutokea katika sehemu ya joto ya retor, na condensation hutokea katika mwisho kilichopozwa kinachojitokeza kutoka kwa hotuba. Briquettes huletwa kwenye retort katika mifuko ya karatasi, basi capacitors huingizwa na retor imefungwa. Hewa hutolewa kwa kutumia pampu za utupu za mitambo mwanzoni mwa mzunguko. Kisha pampu za kueneza zimeunganishwa na shinikizo la mabaki hupunguzwa hadi microns 20.
Marudio huwashwa hadi 1200 °. Katika masaa 12. Baada ya kupakia, retorts hufunguliwa na kupakuliwa. Kalsiamu inayosababishwa iko katika mfumo wa silinda ya mashimo ya wingi mnene wa fuwele kubwa zilizowekwa kwenye uso wa sleeve ya chuma. Uchafu kuu katika kalsiamu ni magnesiamu, ambayo hupunguzwa kwanza na hujilimbikizia hasa safu iliyo karibu na sleeve. Kiwango cha wastani cha uchafu ni; 0.5-1% Mg, karibu 0.2% Al, 0.005-0.02% Mn, hadi 0.02% N, uchafu mwingine - Cu, Pb, Zn, Ni, Si, Fe - hutokea katika aina mbalimbali za 0.005-0.04%. A. Yu. Taits na A. I. Voinitsky walitumia tanuru ya utupu ya umeme ya nusu-kiwanda yenye hita za makaa ya mawe ili kuzalisha kalsiamu kwa njia ya aluminiyamu na walipata kiwango cha matumizi ya alumini ya 60%, matumizi maalum ya alumini ya kilo 0.78, matumizi maalum ya malipo ya 4.35 kg, na matumizi maalum ya umeme 14 kW / h kwa kilo 1 ya chuma.
Metali iliyosababishwa, isipokuwa mchanganyiko wa magnesiamu, ilitofautishwa na usafi wa hali ya juu. Kwa wastani, maudhui ya uchafu ndani yake yalikuwa: 0.003-0.004% Fe, 0.005-0.008% Si, 0.04-0.15% Mn, 0.0025-0.004% Cu, 0.006-0.009% N, 0.25% Al.
2.3.2 Mbinu ya kurejesha siliconthermic kalsiamu
Njia ya silicothermic inajaribu sana; wakala wa kupunguza ni ferrosilicon, reagent ambayo ni nafuu zaidi kuliko alumini. Hata hivyo, mchakato wa silicothermic ni vigumu zaidi kutekeleza kuliko ule wa aluminothermic. Kupunguza oksidi ya kalsiamu na silicon huendelea kulingana na equation
CaO + Si = 2CaO SiO2 + 2Ca. (18)
Shinikizo la mvuke wa usawa wa kalsiamu, iliyohesabiwa kutoka kwa maadili ya nishati ya bure, ni:
°С1300140015001600Р, mm Hg. st0.080.150.752.05
Kwa hiyo, katika utupu wa utaratibu wa 0.01 mm Hg. Sanaa. kupunguza oksidi ya kalsiamu inawezekana thermodynamically kwa joto la 1300 °. Katika mazoezi, ili kuhakikisha kasi inayokubalika, mchakato lazima ufanyike kwa joto la 1400-1500 °.
Mwitikio wa kupunguzwa kwa oksidi ya kalsiamu na silicoaluminium, ambamo aloi za alumini na silicon hutumika kama mawakala wa kinakisishaji, ni rahisi kwa kiasi fulani. Majaribio yamethibitisha kuwa upunguzaji na alumini hutawala mwanzoni; na majibu yanaendelea na uundaji wa mwisho wa bCaO 3Al 2Oz kulingana na mpango ulioelezwa hapo juu (Mchoro 1). Kupunguza silicon inakuwa muhimu kwa joto la juu wakati alumini nyingi imejibu; mmenyuko unaendelea na kuundwa kwa 2CaO SiO 2. Kwa muhtasari, mmenyuko wa kupunguza oksidi ya kalsiamu na silicoalumini huonyeshwa na hesabu ifuatayo:
mSi + n Al + (4m +2 ?) CaO = m(2CaO ·SiO 2) + ?n(5CaO Al 2O3 ) + (2m +1, 5n) Ca.
Utafiti wa A. Yu. Taits na A. I. Voinitsky umegundua kuwa oksidi ya kalsiamu imepunguzwa na 75% ya ferrosilicon na mavuno ya chuma ya 50-75% kwa joto la 1400-1450 ° katika utupu wa 0.01-0.03 mm Hg. Sanaa.; silicoaluminium iliyo na 60-30% Si na 32-58% Al (iliyobaki ni chuma, titani, nk), inapunguza oksidi ya kalsiamu na mavuno ya chuma ya takriban 70% kwa joto la 1350-1400 ° katika utupu wa 0.01-0.05 mm Hg. Sanaa. Majaribio ya kipimo cha nusu-kiwanda yamethibitisha uwezekano wa kimsingi wa kutoa kalsiamu kutoka kwa chokaa kwa kutumia ferrosilicon na silicoaluminum. Ugumu kuu wa vifaa ni uteuzi wa kusimama chini ya masharti ya mchakato huu wa bitana.
Wakati wa kutatua tatizo hili, njia inaweza kutekelezwa katika sekta. Mtengano wa CARBIDE ya kalsiamu Kupata chuma cha kalsiamu kwa mtengano wa CARbudi ya kalsiamu
CaC2 = Ca + 2C
inapaswa kuzingatiwa kama njia ya kuahidi. Katika kesi hii, grafiti hupatikana kama bidhaa ya pili. .
ca = 1.35 - 4505\T (1124-1712° K),
lgp ca = 6.62 - 13523\T (1712-2000° K).
Inavyoonekana, carbudi ya kalsiamu ya kibiashara hutengana kwa joto la juu zaidi kuliko ifuatavyo kutoka kwa maneno haya. Waandishi sawa wanaripoti mtengano wa mafuta wa carbudi ya kalsiamu katika vipande vya compact saa 1600-1800 ° katika utupu wa 1 mm Hg. Sanaa. Mavuno ya grafiti yalikuwa 94%, kalsiamu ilipatikana kwa namna ya mipako mnene kwenye jokofu. A. S. Mikulinsky, F. S. Morii, R. Sh. Shklyar kuamua mali ya grafiti iliyopatikana kwa kuoza kwa carbudi ya kalsiamu, mwisho huo ulikuwa moto katika utupu wa 0.3-1 mm Hg. Sanaa. kwa joto la 1630-1750 °. Grafiti inayotokana inatofautiana na grafiti ya Acheson kwa kuwa na nafaka kubwa, conductivity kubwa ya umeme na uzito wa chini wa volumetric.
3. Sehemu ya vitendo
Utoaji wa kila siku wa magnesiamu kutoka kwa electrolyzer kwa sasa ya 100 kA ilikuwa kilo 960 wakati wa kulisha umwagaji na kloridi ya magnesiamu. Voltage kwenye elektroliza ni 0.6 V. Amua:
)Pato la sasa kwenye cathode;
)Kiasi cha klorini kinachozalishwa kwa siku, mradi tu pato la sasa kwenye anode ni sawa na pato la sasa kwenye anode;
)Ujazaji wa kila siku wa MgCl 2ndani ya electrolyzer mradi hasara ya MgCl 2 hutokea hasa kwa sludge na usablimishaji. Kiasi cha sludge ni 0.1 kwa kila t 1 ya Mg iliyo na MgCl 2 katika sublimate 50%. Kiasi cha usablimishaji ni 0.05 t kwa 1 t Mg. Muundo wa kloridi ya magnesiamu ikimwagwa,%: 92 MgCl2 na 8 NaCl.
.Amua pato la sasa kwenye cathode:
m na kadhalika =I ?·k Mg · ?
?=m na kadhalika \I· ?k Mg =960000\100000·0.454·24=0.881 au 88.1%
.Amua kiasi cha Kl iliyopokelewa kwa siku:
x=960000g\24g\mol=40000 mol
Kubadilisha kwa sauti:
x=126785.7 m3
3.a) Pata MgCl safi 2, kuzalisha kilo 960 Mg.
x=95·960\24.3=3753 kg=37.53 t.
b) hasara na sludge. Kutoka kwa muundo wa elektroli za magnesiamu, %: 20-35 MgO, 2-5 Mg, 2-6 Fe, 2-4 SiO 2, 0.8-2 TiO 2, 0.4-1.0 C, 35 MgCl2 .
kilo - 1000 kg
m wow =960 kg - wingi wa sludge kwa siku.
Kwa siku 96 kg ya sludge: 96 · 0.35 (MgCl2 na matope).
c) hasara na sublimates:
kilo - 1000 kg
kilo sublimates: 48 · 0.5=24 kg MgCl 2 na sublimates.
Jumla ya Mg unahitaji kujaza:
33.6+24=3810.6 kg MgCl2 kwa siku
Bibliografia
Misingi ya Metallurgy III
<#"justify">madini ya Al na Mg. Vetyukov M.M., Tsyplokov A.M.
Mafunzo
Je, unahitaji usaidizi wa kusoma mada?
Wataalamu wetu watakushauri au kutoa huduma za mafunzo juu ya mada zinazokuvutia.
Peana maombi yako ikionyesha mada hivi sasa ili kujua juu ya uwezekano wa kupata mashauriano.
Calcium iko katika kipindi kikubwa cha nne, kikundi cha pili, kikundi kikuu, nambari ya serial ya kipengele ni 20. Kwa mujibu wa meza ya mara kwa mara ya Mendeleev, uzito wa atomiki wa kalsiamu ni 40.08. Fomula ya oksidi ya juu zaidi ni CaO. Calcium ina jina la Kilatini kalsiamu, kwa hivyo ishara ya atomi ya kipengele ni Ca.
Tabia za kalsiamu kama dutu rahisi
Katika hali ya kawaida, kalsiamu ni chuma-nyeupe-fedha. Kuwa na shughuli za juu za kemikali, kipengele kina uwezo wa kutengeneza misombo mingi ya madarasa tofauti. Kipengele hiki ni muhimu kwa syntheses ya kiufundi na ya viwanda ya kemikali. Metali imeenea katika ukoko wa dunia: sehemu yake ni karibu 1.5%. Calcium ni ya kundi la madini ya alkali duniani: wakati kufutwa katika maji, hutoa alkali, lakini kwa asili hutokea kwa namna ya madini mengi na. Maji ya bahari yana kalsiamu katika viwango vya juu (400 mg / l).
Sodiamu safiTabia za kalsiamu hutegemea muundo wa kimiani yake ya kioo. Kipengele hiki kina aina mbili: cubic uso-centric na kiasi-centric. Aina ya dhamana katika molekuli ni metali.
Vyanzo vya asili vya kalsiamu:
- apatites;
- alabasta;
- jasi;
- calcite;
- fluorite;
- dolomite.
Mali ya kimwili ya kalsiamu na mbinu za kupata chuma
Chini ya hali ya kawaida, kalsiamu iko katika hali ngumu ya mkusanyiko. Metali huyeyuka kwa 842 °C. Calcium ni kondakta mzuri wa umeme na joto. Inapokanzwa, kwanza hugeuka kuwa kioevu na kisha katika hali ya mvuke na kupoteza mali zake za metali. Ya chuma ni laini sana na inaweza kukatwa kwa kisu. Inachemka kwa 1484 ° C.
Chini ya shinikizo, kalsiamu hupoteza mali zake za metali na conductivity ya umeme. Lakini basi mali ya metali hurejeshwa na mali ya superconductor inaonekana, mara kadhaa ya juu katika utendaji wao kuliko wengine.
Kwa muda mrefu haikuwezekana kupata kalsiamu bila uchafu: kutokana na shughuli zake za juu za kemikali, kipengele hiki haitokei kwa asili katika fomu yake safi. Kipengele hiki kiligunduliwa mwanzoni mwa karne ya 19. Kalsiamu kama chuma iliundwa kwanza na mwanakemia wa Uingereza Humphry Davy. Mwanasayansi aligundua upekee wa mwingiliano wa kuyeyuka kwa madini na chumvi ngumu na mkondo wa umeme. Siku hizi, elektrolisisi ya chumvi ya kalsiamu (mchanganyiko wa kloridi ya kalsiamu na potasiamu, mchanganyiko wa fluoride na kloridi ya kalsiamu) inabakia kuwa njia inayofaa zaidi ya kutengeneza chuma. Kalsiamu pia hutolewa kutoka kwa oksidi yake kwa kutumia aluminothermy, njia ya kawaida katika madini.
Kemikali mali ya kalsiamu
Calcium ni chuma hai ambacho huingia katika mwingiliano mwingi. Katika hali ya kawaida, humenyuka kwa urahisi, na kutengeneza misombo ya binary inayofanana: na oksijeni, halojeni. Bofya ili kujifunza zaidi kuhusu misombo ya kalsiamu. Inapokanzwa, kalsiamu humenyuka na nitrojeni, hidrojeni, kaboni, silicon, boroni, fosforasi, sulfuri na vitu vingine. Katika hewa ya wazi, inaingiliana mara moja na oksijeni na dioksidi kaboni, na kwa hiyo inafunikwa na mipako ya kijivu.
Humenyuka kwa ukali sana pamoja na asidi na wakati mwingine kuwaka. Katika chumvi, kalsiamu inaonyesha mali ya kuvutia. Kwa mfano, stalactites ya pango na stalagmites ni calcium carbonate, hatua kwa hatua hutengenezwa kutoka kwa maji, dioksidi kaboni na bicarbonate kama matokeo ya michakato ndani ya maji ya chini ya ardhi.
Kutokana na shughuli zake za juu katika hali yake ya kawaida, kalsiamu huhifadhiwa katika maabara katika vyombo vya kioo vya giza, vilivyofungwa chini ya safu ya parafini au mafuta ya taa. Mmenyuko wa ubora kwa ioni ya kalsiamu ni kuchorea kwa moto katika rangi tajiri ya matofali-nyekundu.
 Kalsiamu hubadilisha moto kuwa nyekundu
Kalsiamu hubadilisha moto kuwa nyekundu
Chuma katika utungaji wa misombo inaweza kutambuliwa na mvua zisizo na maji za baadhi ya chumvi za kipengele (fluoride, carbonate, sulfate, silicate, phosphate, sulfite).
Mwitikio wa maji na kalsiamu
Calcium huhifadhiwa kwenye mitungi chini ya safu ya kioevu ya kinga. Ili kufanya onyesho la jinsi majibu ya maji na kalsiamu hufanyika, huwezi kuchukua tu chuma na kukata kipande unachotaka kutoka kwake. Ni rahisi zaidi kutumia chuma cha kalsiamu katika maabara kwa namna ya shavings.
Ikiwa hakuna shavings ya chuma na kuna chunks kubwa tu ya kalsiamu kwenye jar, utahitaji pliers au nyundo. Kipande cha kalsiamu kilichomalizika cha ukubwa unaohitajika kinawekwa kwenye chupa au kioo cha maji. Shavings ya kalsiamu huwekwa kwenye bakuli kwenye mfuko wa chachi.
Kalsiamu huzama chini, na kutolewa kwa hidrojeni huanza (kwanza mahali ambapo fracture safi ya chuma iko). Hatua kwa hatua, gesi hutolewa kutoka kwenye uso wa kalsiamu. Mchakato huo unafanana na kuchemsha kwa ukatili, na wakati huo huo precipitate ya hidroksidi ya kalsiamu (chokaa iliyopigwa) huundwa.
 Kuteleza kwa chokaa
Kuteleza kwa chokaa
Kipande cha kalsiamu kinaelea juu, kimenaswa kwenye viputo vya hidrojeni. Baada ya sekunde 30, kalsiamu huyeyuka na maji hubadilika kuwa meupe kama mawingu kwa sababu ya malezi ya kusimamishwa kwa hidroksidi. Ikiwa mmenyuko haufanyiki kwenye beaker, lakini katika tube ya mtihani, unaweza kuchunguza kutolewa kwa joto: tube ya mtihani haraka inakuwa moto. Mwitikio wa kalsiamu na maji hauishii na mlipuko wa kuvutia, lakini mwingiliano wa vitu hivi viwili unaendelea kwa nguvu na unaonekana kuvutia. Uzoefu ni salama.
Ikiwa mfuko na kalsiamu iliyobaki hutolewa kutoka kwa maji na kushikilia hewa, basi baada ya muda fulani, kutokana na mmenyuko unaoendelea, inapokanzwa kwa nguvu itatokea na kalsiamu iliyobaki kwenye chachi ita chemsha. Ikiwa sehemu ya ufumbuzi wa mawingu huchujwa kupitia funnel ndani ya kioo, basi wakati monoksidi kaboni CO₂ inapitishwa kupitia suluhisho, mvua itaunda. Hii haihitaji dioksidi kaboni - unaweza kupiga hewa exhaled ndani ya suluhisho kupitia tube ya kioo.
Nyumbani / Mihadhara Mwaka wa 1 / Kemia ya jumla na ya kikaboni / Swali la 23. Calcium / 2. Sifa za kimwili na kemikali
Tabia za kimwili. Kalsiamu ni chuma-nyeupe inayoweza kuteseka ambayo huyeyuka kwa joto la digrii 850. C na kuchemsha kwa digrii 1482. C. Ni ngumu zaidi kuliko metali za alkali.
Tabia za kemikali. Calcium ni chuma hai. Kwa hivyo, chini ya hali ya kawaida, inaingiliana kwa urahisi na oksijeni ya anga na halojeni:
2 Ca + O2 = 2 CaO (oksidi ya kalsiamu);
Ca + Br2 = CaBr2 (bromidi ya kalsiamu).
Kalsiamu humenyuka pamoja na hidrojeni, nitrojeni, salfa, fosforasi, kaboni na metali zingine zisizo na metali inapokanzwa:
Ca + H2 = CaH2 (hidridi ya kalsiamu);
3 Ca + N2 = Ca3N2 (nitridi ya kalsiamu);
Ca + S = CaS (sulfidi ya kalsiamu);
3 Ca + 2 P = Ca3P2 (fosfidi ya kalsiamu);
Ca + 2 C = CaC2 (calcium carbudi).
Kalsiamu humenyuka polepole na maji baridi, lakini kwa nguvu sana na maji ya moto:
Ca + 2 H2O = Ca(OH)2 + H2.
Kalsiamu inaweza kuondoa oksijeni au halojeni kutoka kwa oksidi na halidi za metali zisizo hai, i.e. ina sifa za kupunguza:
5 Ca + Nb2O5 = CaO + 2 Nb;
- 1. Kuwa katika asili
- 3. Risiti
- 4. Maombi
www.medkurs.ru
Kalsiamu | saraka Dawa za wadudu.ru
Kwa watu wengi, ujuzi kuhusu kalsiamu ni mdogo tu kwa ukweli kwamba kipengele hiki ni muhimu kwa mifupa na meno yenye afya. Ambapo nyingine ni zilizomo, kwa nini inahitajika na jinsi ni muhimu, si kila mtu ana wazo. Hata hivyo, kalsiamu hupatikana katika misombo mingi inayojulikana, ya asili na ya mwanadamu. Chaki na chokaa, stalactites na stalagmites ya mapango, fossils ya kale na saruji, jasi na alabaster, bidhaa za maziwa na madawa ya kupambana na osteoporosis - yote haya na mengi zaidi ni juu ya kalsiamu.
Kipengele hiki kilipatikana kwanza na G. Davy mwaka wa 1808, na mara ya kwanza haikutumiwa kikamilifu. Walakini, chuma hiki sasa ni cha tano kinachozalishwa zaidi ulimwenguni, na hitaji lake linaongezeka mwaka hadi mwaka. Sehemu kuu ya matumizi ya kalsiamu ni utengenezaji wa vifaa vya ujenzi na mchanganyiko. Hata hivyo, ni muhimu kujenga sio nyumba tu, bali pia seli za kuishi. Katika mwili wa binadamu, kalsiamu ni sehemu ya mifupa, hufanya contractions ya misuli iwezekanavyo, inahakikisha kuganda kwa damu, inasimamia shughuli za enzymes kadhaa za utumbo na hufanya kazi zingine nyingi. Sio muhimu sana kwa vitu vingine vilivyo hai: wanyama, mimea, kuvu na hata bakteria. Wakati huo huo, hitaji la kalsiamu ni kubwa sana, ambayo inafanya uwezekano wa kuainisha kama macronutrient.
Calcium, Ca ni kipengele cha kemikali cha kikundi kikuu cha II cha mfumo wa upimaji wa Mendeleev. Nambari ya atomiki - 20. Uzito wa atomiki - 40.08.
Calcium ni chuma cha ardhi cha alkali. Inapokuwa huru, inaweza kutengenezwa, ngumu sana, nyeupe. Kwa msongamano ni mali ya metali nyepesi.
- Uzito - 1.54 g/cm3,
- Kiwango myeyuko - +842 °C,
- Kiwango cha kuchemsha - +1495 ° C.
Calcium imetangaza mali ya metali. Katika misombo yote hali ya oxidation ni +2.
Katika hewa inakuwa kufunikwa na safu ya oksidi, na inapokanzwa huwaka na moto nyekundu, mkali. Humenyuka polepole pamoja na maji baridi, lakini huondoa hidrojeni haraka kutoka kwa maji moto na kutengeneza hidroksidi. Wakati wa kuingiliana na hidrojeni, huunda hidridi. Kwa joto la kawaida humenyuka na nitrojeni, na kutengeneza nitridi. Pia inachanganya kwa urahisi na halojeni na sulfuri, na hupunguza oksidi za chuma inapokanzwa.
Calcium ni mojawapo ya vipengele vingi vya asili. Katika ukoko wa dunia maudhui yake ni 3% ya wingi. Inatokea kwa namna ya amana za chaki, chokaa, na marumaru (aina ya asili ya calcium carbonate CaCO3). Kuna kiasi kikubwa cha amana za jasi (CaSO4 x 2h3O), phosphorite (Ca3 (PO4)2 na silikati mbalimbali zenye kalsiamu.
Maji
. Chumvi za kalsiamu ziko karibu kila wakati katika maji ya asili. Kati ya hizi, jasi tu ni mumunyifu kidogo ndani yake. Wakati maji yana dioksidi kaboni, kalsiamu kabonati huingia kwenye myeyusho katika mfumo wa bicarbonate Ca(HCO3)2.Maji magumu
. Maji ya asili yenye kiasi kikubwa cha chumvi za kalsiamu au magnesiamu huitwa maji ngumu.Maji laini
. Wakati maudhui ya chumvi hizi ni ya chini au haipo, maji huitwa laini.Udongo
. Kama sheria, udongo hutolewa kwa kutosha na kalsiamu. Na, kwa kuwa kalsiamu iko katika wingi mkubwa katika sehemu ya mimea ya mimea, kuondolewa kwake na mavuno sio muhimu.Kupoteza kalsiamu kutoka kwa udongo hutokea kama matokeo ya kuvuja kwake kwa mvua. Utaratibu huu unategemea muundo wa granulometri wa udongo, kiasi cha mvua, aina ya mimea, fomu na vipimo vya mbolea ya chokaa na madini. Kulingana na mambo haya, hasara za kalsiamu kutoka kwa safu ya kilimo huanzia makumi kadhaa hadi 200 - 400 kg / ha au zaidi.
Maudhui ya kalsiamu katika aina tofauti za udongo
Udongo wa podzolic una 0.73% (ya udongo kavu) kalsiamu.
Msitu wa kijivu - 0.90% ya kalsiamu.
Chernozem - 1.44% ya kalsiamu.
Serozem - 6.04% ya kalsiamu.
Katika mmea, kalsiamu hupatikana kwa namna ya phosphates, sulfates, carbonates, na kwa namna ya chumvi ya asidi ya pectic na oxalic. Karibu 65% ya kalsiamu katika mimea inaweza kutolewa kwa maji. Wengine hutibiwa na asidi dhaifu ya asetiki na hidrokloriki. Kalsiamu nyingi hupatikana katika seli za kuzeeka.
Dalili za upungufu wa kalsiamu kulingana na: |
|
Utamaduni | Dalili za upungufu |
Dalili za jumla | Nyeupe ya bud ya apical; Whitening ya majani ya vijana; Ncha za majani zimepinda chini; Kingo za majani hupinda juu; |
Viazi | Majani ya juu huchanua vibaya; Hatua ya kukua ya shina hufa; Kuna mstari mwepesi kwenye kingo za majani, ambayo baadaye huwa giza; Kingo za majani zimekunjwa juu; |
Kabichi nyeupe na cauliflower | Majani ya mimea mchanga yana madoa ya klorotiki (marbling) au kupigwa nyeupe kando ya kingo; Katika mimea ya zamani, majani ya curl na kuchoma huonekana juu yao; Hatua ya kukua hufa |
Sehemu za mwisho za majani hufa Maua huanguka; Madoa meusi yanaonekana kwenye tunda kwenye sehemu ya apical, ambayo huongezeka kadiri tunda linavyokua (tomato blossom end rot) |
|
Vipuli vya apical hufa; Kingo za majani machanga zimejikunja, zina mwonekano chakavu, na hatimaye kufa; Sehemu za juu za shina hufa; Uharibifu wa vidokezo vya mizizi; Kuna matangazo ya hudhurungi kwenye massa ya matunda (mashimo machungu); Ladha ya matunda huharibika; Uuzaji wa matunda hupungua |
Kazi za kalsiamu
Athari za kipengele hiki kwenye mimea ni nyingi na, kama sheria, chanya. Kalsiamu:
- Inaimarisha kimetaboliki;
- Ina jukumu muhimu katika harakati za wanga;
- Huathiri metamorphosis ya vitu vya nitrojeni;
- Kuharakisha matumizi ya protini za hifadhi ya mbegu wakati wa kuota;
- Inachukua jukumu katika mchakato wa photosynthesis;
- mpinzani mkubwa wa cations nyingine, kuzuia kuingia kwao kwa ziada kwenye tishu za mimea;
- Inathiri mali ya physicochemical ya protoplasm (mnato, upenyezaji, nk), na kwa hiyo kozi ya kawaida ya michakato ya biochemical kwenye mmea;
- Misombo ya kalsiamu na vitu vya pectini gundi kuta za seli za kibinafsi pamoja;
- Inathiri shughuli za enzyme.
Ikumbukwe kwamba ushawishi wa misombo ya kalsiamu (chokaa) kwenye shughuli za enzyme huonyeshwa sio tu kwa hatua moja kwa moja, lakini pia kutokana na uboreshaji wa mali ya physico-kemikali ya udongo na utawala wake wa lishe. Kwa kuongezea, kuweka chokaa kwa mchanga huathiri sana michakato ya biosynthesis ya vitamini.
Ukosefu (upungufu) wa kalsiamu katika mimea
Ukosefu wa kalsiamu huathiri hasa maendeleo ya mfumo wa mizizi. Uundaji wa nywele za mizizi kwenye mizizi huacha. Seli za mizizi ya nje zinaharibiwa.
Dalili hii inajidhihirisha na ukosefu wa kalsiamu na ukosefu wa usawa katika suluhisho la virutubishi, ambayo ni, utangulizi wa cations monovalent ya sodiamu, potasiamu na hidrojeni ndani yake.
Aidha, uwepo wa nitrojeni ya nitrati katika suluhisho la udongo huongeza usambazaji wa kalsiamu kwa tishu za mimea, na hupunguza ugavi wa amonia.
Ishara za njaa ya kalsiamu zinatarajiwa wakati maudhui ya kalsiamu ni chini ya 20% ya uwezo wa kubadilishana mawasiliano ya udongo.
Dalili Kwa kuibua, upungufu wa kalsiamu imedhamiriwa na ishara zifuatazo:
- Mizizi ya mimea ina vidokezo vilivyoharibiwa na rangi ya kahawia;
- Sehemu inayokua inaharibika na kufa;
- Maua, ovari na buds huanguka;
- Matunda yanaharibiwa na necrosis;
- Majani yanajulikana kuwa chlorotic;
- Bud ya apical hufa na ukuaji wa shina huacha.
Kabichi, alfalfa, na clover ni nyeti sana kwa uwepo wa kalsiamu. Imeanzishwa kuwa mimea hiyo hiyo pia ina sifa ya kuongezeka kwa unyeti kwa asidi ya udongo.
Sumu ya kalsiamu ya madini husababisha klorosisi ya kati ya mishipa na madoa meupe ya necrotic. Wanaweza kuwa na rangi au kuwa na pete zilizojaa maji. Mimea mingine hujibu kalsiamu ya ziada kwa kukuza rosette ya majani, shina zinazokufa na kuacha majani. Dalili ni sawa kwa kuonekana na upungufu wa chuma na magnesiamu.
Chanzo cha kujaza tena kalsiamu kwenye udongo ni mbolea ya chokaa. Wamegawanywa katika vikundi vitatu:
- Miamba ya calcareous ngumu;
- Miamba ya calcareous laini;
- Taka za viwandani zenye kiwango cha juu cha chokaa.
Kulingana na yaliyomo katika CaO na MgO, miamba ngumu ya calcareous imegawanywa katika:
- chokaa (55-56% CaO na hadi 0.9% MgO);
- chokaa cha dolomitized (42-55% CaO na hadi 9% MgO);
- dolomites (32-30% CaO na 18-20% MgO).
Mawe ya chokaa
- mbolea za msingi za chokaa. Ina 75–100% ya oksidi za Ca na Mg zinazokokotolewa kama CaCO3.Mawe ya chokaa ya Dolomitized
. Ina 79–100% dutu amilifu (a.i.) inayokokotolewa kama CaCO3. Inapendekezwa katika mzunguko wa mazao na viazi, kunde, kitani, mazao ya mizizi, na pia kwenye udongo wenye podzolized.Marl
. Ina hadi 25-15% CaCO3 na uchafu kwa namna ya udongo na mchanga hadi 20-40%. Tenda polepole. Inapendekezwa kwa matumizi kwenye mchanga mwepesi.Chaki
. Ina 90–100% CaCO3. Hatua ni kasi zaidi kuliko ile ya chokaa. Ni mbolea ya chokaa yenye thamani katika umbo la ardhi laini.Chokaa kilichochomwa
(CaO). Maudhui ya CaCO3 ni zaidi ya 70%. Inajulikana kama nyenzo yenye nguvu na inayofanya kazi haraka.Chokaa kilichokatwa
(Ca(OH)2). Maudhui ya CaCO3 - 35% au zaidi. Pia ni mbolea ya chokaa yenye nguvu na inayofanya kazi haraka.Unga wa dolomite
. Maudhui ya CaCO3 na MgCO3 ni kuhusu 100%. Hatua yake ni polepole kuliko ile ya tuffs calcareous. Kawaida hutumiwa ambapo magnesiamu inahitajika.Vitambaa vya Calcareous
. Maudhui ya CaCO3 - 15-96%, uchafu - hadi 25% ya udongo na mchanga, 0.1% P2O5. Hatua ni kasi zaidi kuliko ile ya chokaa.Uchafu wa haja kubwa (kinyesi)
. Inajumuisha CaCO3 na Ca(OH)2. Maudhui ya chokaa ya CaO ni hadi 40%. Nitrojeni pia iko - 0.5% na P2O5 - 1-2%. Hii ni taka kutoka kwa viwanda vya sukari ya beet. Inapendekezwa kwa matumizi sio tu kupunguza asidi ya udongo, lakini pia katika maeneo ya kukua beet kwenye udongo wa chernozem.Vimbunga vya majivu ya shale
. Nyenzo kavu ya vumbi. Maudhui ya dutu ya kazi ni 60-70%. Inahusu taka za viwandani.Vumbi kutoka kwa tanuu na viwanda vya saruji
. Maudhui ya CaCO3 lazima yazidi 60%. Katika mazoezi, hutumiwa katika mashamba yaliyo karibu na mimea ya saruji.Slags za metallurgiska
. Inatumika katika mikoa ya Urals na Siberia. Isiyo ya RISHAI, rahisi kunyunyiza. Lazima iwe na angalau 80% CaCO3 na iwe na unyevu usiozidi 2%. Utungaji wa granulometric ni muhimu: 70% - chini ya 0.25 mm, 90% - chini ya 0.5 mm.Mbolea za kikaboni. Maudhui ya Ca kwa mujibu wa CaCO3 ni 0.32–0.40%.
unga wa fosforasi. Maudhui ya kalsiamu - 22% CaCO3.
Mbolea ya chokaa hutumiwa sio tu kutoa udongo na mimea na kalsiamu. Kusudi kuu la matumizi yao ni kuweka chokaa cha udongo. Hii ni njia ya kurejesha kemikali. Inalenga kupunguza asidi ya ziada ya udongo, kuboresha agrophysical, agrochemical na kibaolojia mali, kusambaza mimea na magnesiamu na kalsiamu, kuhamasisha na immobilizing macroelements na microelements, kujenga mojawapo ya maji-kimwili, kimwili, hali ya hewa kwa maisha ya mimea iliyopandwa.
Ufanisi wa kuweka chokaa cha udongo
Wakati huo huo na kukidhi mahitaji ya mimea kwa kalsiamu kama kipengele cha lishe ya madini, kuweka chokaa husababisha mabadiliko mengi mazuri katika udongo.
Athari za kuweka chokaa kwenye mali ya mchanga fulani
Calcium inakuza mgando wa colloids ya udongo na kuzuia leaching yao. Hii inasababisha ulimaji rahisi na uboreshaji wa hewa.
Kama matokeo ya kuweka chokaa:
- mchanga wa humus huongeza uwezo wao wa kunyonya maji;
- Juu ya udongo nzito wa udongo, mkusanyiko wa udongo na kuunganisha huundwa, ambayo inaboresha upenyezaji wa maji.
Hasa, asidi za kikaboni hazipatikani na H-ions huhamishwa kutoka kwa tata ya kunyonya. Hii inasababisha kuondolewa kwa asidi ya kimetaboliki na kupungua kwa asidi ya hidrolitiki ya udongo. Wakati huo huo, uboreshaji wa muundo wa cationic wa tata ya kunyonya udongo huzingatiwa, ambayo hutokea kutokana na uingizwaji wa ioni za hidrojeni na alumini na cations za kalsiamu na magnesiamu. Hii huongeza kiwango cha kueneza kwa udongo na besi na huongeza uwezo wa kunyonya.
Athari za kuweka chokaa kwenye usambazaji wa nitrojeni kwa mimea
Baada ya kuweka chokaa, mali nzuri ya agrochemical ya udongo na muundo wake inaweza kudumishwa kwa miaka kadhaa. Hii husaidia kuunda hali nzuri kwa ajili ya kuimarisha michakato ya manufaa ya microbiological kwa uhamasishaji wa virutubisho. Shughuli ya amonifiers, nitrifiers, na bakteria ya kurekebisha nitrojeni wanaoishi kwa uhuru katika udongo huongezeka.
Kuweka chokaa husaidia kuongeza kuenea kwa bakteria ya vinundu na kuboresha usambazaji wa nitrojeni kwa mmea mwenyeji. Imeanzishwa kuwa mbolea za bakteria hupoteza ufanisi wao kwenye udongo wa tindikali.
Athari za kuweka chokaa juu ya usambazaji wa vitu vya majivu kwa mimea
Kuweka chokaa husaidia kusambaza mmea na vitu vya majivu, kwani huongeza shughuli za bakteria ambazo hutenganisha misombo ya fosforasi ya kikaboni kwenye udongo na kukuza mpito wa fosfati za chuma na alumini kuwa chumvi za fosforasi za kalsiamu zinazopatikana kwa mimea. Liming ya udongo tindikali huongeza microbiological na biochemical taratibu, ambayo, kwa upande wake, huongeza kiasi cha nitrati, pamoja na aina digestible ya fosforasi na potasiamu.
Athari ya kuweka chokaa kwenye fomu na upatikanaji wa macroelements na microelements
Liming huongeza kiasi cha kalsiamu, na wakati wa kutumia unga wa dolomite - magnesiamu. Wakati huo huo, aina za sumu za manganese na alumini haziyeyuki na hupita kwenye umbo la mvua. Upatikanaji wa vitu kama chuma, shaba, zinki, manganese unapungua. Nitrojeni, salfa, potasiamu, kalsiamu, magnesiamu, fosforasi na molybdenum hupatikana zaidi.
Ushawishi wa kuweka chokaa juu ya hatua ya mbolea ya asidi ya kisaikolojia
Liming huongeza ufanisi wa mbolea ya madini ya physiologically tindikali, hasa amonia na potashi.
Athari nzuri ya mbolea ya physiologically tindikali bila kuongeza ya chokaa hupungua, na baada ya muda inaweza kugeuka hasi. Kwa hiyo, katika maeneo yenye mbolea, mavuno ni kidogo zaidi kuliko katika maeneo yasiyo na mbolea. Mchanganyiko wa kuweka chokaa na matumizi ya mbolea huongeza ufanisi wao kwa 25-50%.
Wakati wa kuweka chokaa, michakato ya enzymatic kwenye udongo imeamilishwa, ambayo rutuba yake inahukumiwa kwa njia isiyo ya moja kwa moja.
Iliyoundwa na: Grigorovskaya P.I.
Ukurasa umeongezwa: 05.12.13 00:40
Sasisho la mwisho: 05/22/14 16:25
Vyanzo vya fasihi:
Glinka N.L. Kemia ya jumla. Kitabu cha maandishi kwa vyuo vikuu. Mchapishaji: Leningrad: Kemia, 1985, ukurasa wa 731
Mineev V.G. Agrochemistry: Kitabu cha maandishi - toleo la 2, lililorekebishwa na kupanuliwa - M.: Nyumba ya Uchapishaji ya Chuo Kikuu cha Jimbo la Moscow, Nyumba ya Uchapishaji ya KolosS, 2004 - 720 p., l. mgonjwa.: mgonjwa. - (Kitabu cha kiada cha chuo kikuu).
Petrov B.A., Seliverstov N.F. Lishe ya madini ya mimea. Mwongozo wa kumbukumbu kwa wanafunzi na bustani. Ekaterinburg, 1998. 79 p.
Encyclopedia kwa watoto. Juzuu 17. Kemia. / Mkuu. mh. V.A. Volodin. - M.: Avanta +, 2000. - 640 p., mgonjwa.
Yagodin B.A., Zhukov Yu.P., Kobzarenko V.I. Agrochemistry / Imehaririwa na B.A. Yagodina - M.: Kolos, 2002 - 584 pp.: mgonjwa (Vitabu vya maandishi na vifaa vya kufundishia kwa wanafunzi wa taasisi za elimu ya juu).
Picha (zilizofanyiwa kazi upya):
20 Ca Calcium, iliyopewa leseni chini ya CC BY
Upungufu wa kalsiamu katika ngano, na CIMMYT, iliyoidhinishwa chini ya CC BY-NC-SA
www.pesticide.ru
Calcium na jukumu lake kwa binadamu - Kemia
Calcium na jukumu lake kwa wanadamu
Utangulizi
Kuwa katika asili
Risiti
Tabia za kimwili
Tabia za kemikali
Utumiaji wa misombo ya kalsiamu
Jukumu la kibaolojia
Hitimisho
Bibliografia
Utangulizi
Kalsiamu ni kipengele cha kikundi kikuu cha kikundi cha pili, kipindi cha nne cha mfumo wa mara kwa mara wa vipengele vya kemikali vya D.I. Mendeleev, na nambari ya atomiki 20. Imeteuliwa na ishara Ca (lat. Calcium). Dutu rahisi ya kalsiamu (Nambari ya CAS: 7440-70-2) ni chuma cha ardhini cha alkali laini na tendaji cha rangi ya fedha-nyeupe.
Licha ya ubiquity wa kipengele namba 20, hata wanakemia hawajaona kalsiamu ya msingi. Lakini chuma hiki, kwa kuonekana na kwa tabia, ni tofauti kabisa na metali za alkali, kuwasiliana na ambayo imejaa hatari ya moto na kuchoma. Inaweza kuhifadhiwa kwa usalama katika hewa, haiwashi kutoka kwa maji. Tabia ya mitambo ya kalsiamu ya msingi haifanyi kuwa "kondoo mweusi" katika familia ya metali: kalsiamu inawazidi wengi wao kwa nguvu na ugumu; inaweza kugeuka kwenye lathe, inayotolewa kwenye waya, kughushi, kushinikizwa.
Na bado, kalsiamu ya msingi haitumiki kamwe kama nyenzo ya kimuundo. Anafanya kazi sana kwa hilo. Kalsiamu humenyuka kwa urahisi pamoja na oksijeni, salfa na halojeni. Hata kwa nitrojeni na hidrojeni, chini ya hali fulani, humenyuka. Mazingira ya oksidi za kaboni, ajizi kwa metali nyingi, ni fujo kwa kalsiamu. Inaungua katika angahewa ya CO na CO2.
Historia na asili ya jina
Jina la kipengele linatokana na Lat. calx (katika kesi ya jeni calcis) -- "chokaa", "jiwe laini". Ilipendekezwa na mwanakemia wa Kiingereza Humphry Davy, ambaye alitenga chuma cha kalsiamu kwa njia ya elektroliti mnamo 1808. Davy aliweka mchanganyiko wa chokaa na oksidi ya zebaki HgO kwenye sahani ya platinamu, ambayo ilitumika kama anodi. Cathode ilikuwa waya ya platinamu iliyoingizwa kwenye zebaki ya kioevu. Kama matokeo ya electrolysis, amalgam ya kalsiamu ilipatikana. Baada ya kusaga zebaki kutoka kwayo, Davy alipata chuma kinachoitwa kalsiamu.
Misombo ya kalsiamu - chokaa, marumaru, jasi (pamoja na chokaa - bidhaa ya kurusha chokaa) imetumika katika ujenzi kwa miaka elfu kadhaa iliyopita. Hadi mwisho wa karne ya 18, wanakemia waliona chokaa kuwa ngumu rahisi. Mnamo mwaka wa 1789, A. Lavoisier alipendekeza kuwa chokaa, magnesia, barite, alumina na silika ni vitu tata.
Kuwa katika asili
Kutokana na shughuli zake za juu za kemikali, kalsiamu haitokei kwa fomu ya bure katika asili.
Kalsiamu huchangia 3.38% ya wingi wa ukoko wa dunia (ya 5 kwa wingi baada ya oksijeni, silicon, alumini na chuma).
Isotopu. Calcium hutokea katika asili kama mchanganyiko wa isotopu sita: 40Ca, 42Ca, 43Ca, 44Ca, 46Ca na 48Ca, kati ya ambayo ya kawaida - 40Ca - ni 96.97%.
Kati ya isotopu sita za asili za kalsiamu, tano ni thabiti. Isotopu ya sita, 48Ca, nzito zaidi kati ya hizo sita na nadra sana (wingi wake wa isotopiki ni 0.187%) hivi majuzi, iligunduliwa hivi karibuni kuwa na uozo wa beta mara mbili na nusu ya maisha ya miaka 5.3 x 1019.
Katika mawe na madini. Zaidi ya kalsiamu ni zilizomo katika silicates na aluminosilicates ya miamba mbalimbali (granites, gneisses, nk), hasa katika feldspar - Ca anorthite.
Kwa namna ya miamba ya sedimentary, misombo ya kalsiamu inawakilishwa na chaki na mawe ya chokaa, yenye hasa ya calcite ya madini (CaCO3). Aina ya fuwele ya calcite - marumaru - ni ya kawaida sana katika asili.
Madini ya kalsiamu kama vile calcite CaCO3, anhydrite CaSO4, alabasta CaSO4 0.5h3O na gypsum CaSO4 2h3O, fluorite CaF2, apatite Ca5(PO4)3(F,Cl,OH), dolomite MgCO3 CaCO3 imeenea sana. Uwepo wa chumvi za kalsiamu na magnesiamu katika maji ya asili huamua ugumu wake.
Kalsiamu, ikihama kwa nguvu kwenye ukoko wa dunia na kujilimbikiza katika mifumo mbalimbali ya kijiokemia, huunda madini 385 (idadi ya nne kwa ukubwa ya madini).
Uhamiaji katika ukoko wa dunia. Katika uhamiaji wa asili wa kalsiamu, jukumu kubwa linachezwa na "usawa wa kaboni", unaohusishwa na athari inayoweza kubadilika ya mwingiliano wa kalsiamu kaboni na maji na dioksidi kaboni na malezi ya bicarbonate mumunyifu:
CaCO3 + h3O + CO2 - Ca (HCO3)2 - Ca2+ + 2HCO3-
(mabadiliko ya usawa kwenda kushoto au kulia kulingana na mkusanyiko wa dioksidi kaboni).
Uhamiaji wa kibiolojia. Katika biosphere, misombo ya kalsiamu hupatikana karibu na tishu zote za wanyama na mimea (tazama pia chini). Kiasi kikubwa cha kalsiamu kinapatikana katika viumbe hai. Kwa hiyo, hydroxyapatite Ca5 (PO4) 3OH, au, katika kuingia nyingine, 3Ca3 (PO4) 2 · Ca (OH) 2, ni msingi wa tishu za mfupa za vertebrates, ikiwa ni pamoja na wanadamu; Maganda na maganda ya wanyama wengi wasio na uti wa mgongo, maganda ya mayai, n.k yanatengenezwa na calcium carbonate CaCO3. Katika tishu hai za binadamu na wanyama kuna 1.4-2% Ca (kwa sehemu ya molekuli); katika mwili wa binadamu wenye uzito wa kilo 70, maudhui ya kalsiamu ni kuhusu kilo 1.7 (hasa katika dutu ya intercellular ya tishu mfupa).
Risiti
Kalsiamu ya metali isiyolipishwa hupatikana kwa elektrolisisi ya kuyeyuka inayojumuisha CaCl2 (75-80%) na KCl au kutoka kwa CaCl2 na CaF2, pamoja na upunguzaji wa aluminiumoxid wa CaO ifikapo 1170-1200 °C:
4CaO + 2Al = CaAl2O4 + 3Ca.
Tabia za kimwili
Metali ya kalsiamu iko katika marekebisho mawili ya allotropiki. Hadi 443 °C, ?-Ca yenye kimiani cha ujazo kilicho katikati ya uso (kigezo a = 0.558 nm) ni dhabiti; uthabiti wa juu zaidi ni ?-Ca na kimiani cha ujazo kilicho katikati ya mwili cha aina ya ?-Fe (kigezo a = 0.448 nm). Mpito wa kawaida wa enthalpy?H0? > ? ni 0.93 kJ/mol.
Tabia za kemikali
Calcium ni chuma cha kawaida cha alkali duniani. Shughuli ya kemikali ya kalsiamu ni ya juu, lakini chini kuliko ile ya madini mengine yote ya dunia ya alkali. Humenyuka kwa urahisi na oksijeni, dioksidi kaboni na unyevu hewani, ndiyo sababu uso wa chuma cha kalsiamu kawaida huwa kijivu, kwa hivyo kalsiamu ya maabara kawaida huhifadhiwa, kama metali zingine za alkali, kwenye jar iliyofungwa sana chini ya safu. mafuta ya taa au mafuta ya taa kioevu.
Katika mfululizo wa uwezo wa kawaida, kalsiamu iko upande wa kushoto wa hidrojeni. Uwezo wa kawaida wa elektrodi wa jozi ya Ca2+/Ca0 ni 2.84 V, hivyo kwamba kalsiamu humenyuka kikamilifu ikiwa na maji, lakini bila kuwasha:
Ca + 2H2O = Ca(OH)2 + H2^ + Q.
Kalsiamu humenyuka pamoja na vitu visivyo vya metali amilifu (oksijeni, klorini, bromini) katika hali ya kawaida:
2Ca + O2 = 2CaO, Ca + Br2 = CaBr2.
Inapokanzwa katika hewa au oksijeni, kalsiamu huwaka. Kalsiamu humenyuka pamoja na metali zisizo na kazi kidogo (hidrojeni, boroni, kaboni, silicon, nitrojeni, fosforasi na zingine) inapokanzwa, kwa mfano:
Ca + H2 = CaH2, Ca + 6B = CaB6,
3Ca + N2 = Ca3N2, Ca + 2C = CaC2,
3Ca + 2P = Ca3P2 (
phosfidi ya kalsiamu), phosfidi za kalsiamu za nyimbo za CaP na CaP5 pia zinajulikana;
2Ca + Si = Ca2Si
(silicide ya kalsiamu), silicides za kalsiamu za nyimbo za CaSi, Ca3Si4 na CaSi2 pia zinajulikana.
Tukio la athari zilizo hapo juu, kama sheria, hufuatana na kutolewa kwa kiasi kikubwa cha joto (yaani, athari hizi ni exothermic). Katika misombo yote na zisizo za metali, hali ya oxidation ya kalsiamu ni +2. Mengi ya misombo ya kalsiamu na zisizo za metali hutengana kwa urahisi na maji, kwa mfano:
CaH2 + 2H2O = Ca(OH)2 + 2H2^,
Ca3N2 + 3H2O = 3Ca(OH)2 + 2Nh4^.
Ioni ya Ca2+ haina rangi. Wakati chumvi ya kalsiamu mumunyifu huongezwa kwenye moto, moto hubadilika kuwa nyekundu ya matofali.
Chumvi za kalsiamu kama vile kloridi ya CaCl2, bromidi ya CaBr2, iodidi ya CaI2 na nitrati ya Ca(NO3)2 huyeyushwa sana katika maji. Haiyeyuki katika maji ni floridi CaF2, carbonate CaCO3, sulfate CaSO4, orthofosfati Ca3(PO4)2, oxalate CaC2O4 na baadhi ya vingine.
Ni muhimu kwamba, tofauti na kalsiamu kabonati CaCO3, asidi ya kalsiamu kabonati (bicarbonate) Ca(HCO3)2 ni mumunyifu katika maji. Kwa asili, hii inasababisha taratibu zifuatazo. Wakati mvua baridi au maji ya mto, yaliyojaa dioksidi kaboni, hupenya chini ya ardhi na kuanguka kwenye chokaa, kufutwa kwao kunazingatiwa:
CaCO3 + CO2 + H2O = Ca(HCO3)2.
Katika sehemu zile zile ambapo maji yaliyojaa bicarbonate ya kalsiamu huja kwenye uso wa dunia na huwashwa na mionzi ya jua, majibu ya kinyume hutokea:
Ca(HCO3)2 = CaCO3 + CO2^ + H2O.
Hii ndio jinsi wingi mkubwa wa vitu huhamishwa katika asili. Kama matokeo, mapengo makubwa yanaweza kuunda chini ya ardhi, na "icicles" za mawe nzuri - stalactites na stalagmites - huunda kwenye mapango.
Uwepo wa bicarbonate ya kalsiamu iliyoyeyushwa katika maji kwa kiasi kikubwa huamua ugumu wa muda wa maji. Inaitwa ya muda kwa sababu wakati maji yanachemka, bicarbonate hutengana na CaCO3 huanguka. Jambo hili linaongoza, kwa mfano, kwa ukweli kwamba kiwango huunda kwenye kettle kwa muda.
Maombi ya chuma cha kalsiamu
Matumizi kuu ya chuma cha kalsiamu ni kama wakala wa kupunguza katika utengenezaji wa metali, haswa nikeli, shaba na chuma cha pua. Kalsiamu na hidridi yake pia hutumika kutengeneza metali ambazo ni ngumu kupunguza kama vile chromium, thoriamu na uranium. Aloi za risasi za kalsiamu hutumiwa katika betri na aloi za kuzaa. Chembechembe za kalsiamu pia hutumiwa kuondoa athari za hewa kutoka kwa vifaa vya utupu.
Metallothermy
Kalsiamu safi ya metali hutumiwa sana katika metallothermy kwa ajili ya uzalishaji wa metali adimu.
Aloi ya aloi
Kalsiamu safi hutumika kutengeneza aloi ya risasi inayotumika kutengenezea sahani za betri na betri za asidi ya risasi zisizo na matengenezo zenye kutokeza kidogo kwa kujitegemea. Pia, kalsiamu ya metali hutumiwa kwa ajili ya uzalishaji wa sungura wa ubora wa kalsiamu BKA.
Mchanganyiko wa nyuklia
Isotopu ya 48Ca ndiyo nyenzo yenye ufanisi zaidi na inayotumiwa sana kwa ajili ya utengenezaji wa vipengele vyenye uzito mkubwa na ugunduzi wa vipengele vipya kwenye jedwali la upimaji. Kwa mfano, katika kesi ya kutumia ions 48Ca kuzalisha vipengele vya superheavy katika accelerators, nuclei ya vipengele hivi huundwa kwa mamia na maelfu ya mara kwa ufanisi zaidi kuliko wakati wa kutumia "projectiles" nyingine (ions).
Utumiaji wa misombo ya kalsiamu
Calcium hidridi. Kwa kupokanzwa kalsiamu katika anga ya hidrojeni, Cah3 (hydride ya kalsiamu) hupatikana, ambayo hutumiwa katika metallurgy (metallothermy) na katika uzalishaji wa hidrojeni katika shamba.
Nyenzo za macho na leza Fluoridi ya kalsiamu (fluorite) hutumika kwa namna ya fuwele moja katika optics (malengo ya angani, lenzi, prismu) na kama nyenzo ya leza. Calcium tungstate (scheelite) katika mfumo wa fuwele moja hutumiwa katika teknolojia ya laser na pia kama scintillator.
Carbudi ya kalsiamu. Carbide ya kalsiamu CaC2 hutumiwa sana kwa ajili ya uzalishaji wa asetilini na kupunguza metali, na pia katika uzalishaji wa cyanamide ya kalsiamu (kwa kupokanzwa carbudi ya kalsiamu katika nitrojeni saa 1200 ° C, mmenyuko ni exothermic, unaofanywa katika tanuu za cyanamide) .
Vyanzo vya kemikali vya sasa. Kalsiamu, pamoja na aloi zake zilizo na alumini na magnesiamu, hutumiwa katika kuhifadhi betri za umeme za mafuta kama anode (kwa mfano, kipengele cha calcium-chromate). Chromate ya kalsiamu hutumiwa katika betri kama vile cathode. Upekee wa betri hizo ni maisha ya rafu ya muda mrefu sana (miongo) katika hali inayofaa, uwezo wa kufanya kazi katika hali yoyote (nafasi, shinikizo la juu), nishati maalum ya juu kwa suala la uzito na kiasi. Hasara: maisha mafupi. Betri kama hizo hutumiwa ambapo inahitajika kuunda nguvu kubwa ya umeme kwa muda mfupi (makombora ya ballistic, vyombo vya anga, nk).
Nyenzo zisizo na moto. Oksidi ya kalsiamu, katika fomu ya bure na kama sehemu ya mchanganyiko wa kauri, hutumiwa katika utengenezaji wa vifaa vya kinzani.
Dawa. Misombo ya kalsiamu hutumiwa sana kama antihistamine.
Kloridi ya kalsiamu
Gluconate ya kalsiamu
Calcium glycerophosphate
Aidha, misombo ya kalsiamu ni pamoja na madawa ya kulevya kwa ajili ya kuzuia osteoporosis, katika complexes ya vitamini kwa wanawake wajawazito na wazee.
Jukumu la kibaolojia
Calcium ni macronutrient ya kawaida katika mwili wa mimea, wanyama na wanadamu. Kwa wanadamu na wanyama wengine wenye uti wa mgongo, wengi wao hupatikana kwenye mifupa na meno kwa namna ya phosphates. Mifupa ya vikundi vingi vya invertebrates (sponges, polyps ya matumbawe, moluska, nk) inajumuisha aina mbalimbali za kalsiamu carbonate (chokaa). Ioni za kalsiamu zinahusika katika michakato ya kuganda kwa damu, na pia katika kuhakikisha shinikizo la osmotic la damu kila wakati. Ioni za kalsiamu pia hutumika kama moja ya wajumbe wa pili wa ulimwengu wote na kudhibiti michakato mbalimbali ya ndani ya seli - contraction ya misuli, exocytosis, ikiwa ni pamoja na usiri wa homoni na neurotransmitters, nk. Mkusanyiko wa kalsiamu katika saitoplazimu ya seli za binadamu ni kuhusu 10?7 mol, katika vimiminika vya seli karibu 10 ?3 mol.
Mahitaji ya kalsiamu hutegemea umri. Kwa watu wazima, ulaji wa kila siku unaohitajika ni kutoka kwa miligramu 800 hadi 1000 (mg), na kwa watoto kutoka 600 hadi 900 mg, ambayo ni muhimu sana kwa watoto kutokana na ukuaji mkubwa wa mifupa. Sehemu kubwa ya kalsiamu inayoingia kwenye mwili wa binadamu na chakula hupatikana katika bidhaa za maziwa; kalsiamu iliyobaki hutoka kwa nyama, samaki, na bidhaa zingine za mmea (haswa kunde). Kunyonya hutokea katika utumbo mkubwa na mdogo na huwezeshwa na mazingira ya tindikali, vitamini D na vitamini C, lactose, na asidi ya mafuta isiyojaa. Jukumu la magnesiamu katika kimetaboliki ya kalsiamu ni muhimu; pamoja na upungufu wake, kalsiamu "huoshwa" kutoka kwa mifupa na kuwekwa kwenye figo (mawe ya figo) na misuli.
Aspirini, asidi oxalic, na derivatives ya estrojeni huingilia unyonyaji wa kalsiamu. Ikiunganishwa na asidi oxalic, kalsiamu huzalisha misombo isiyoweza kuingizwa na maji ambayo ni vipengele vya mawe ya figo.
Kutokana na idadi kubwa ya taratibu zinazohusiana nayo, maudhui ya kalsiamu katika damu yanadhibitiwa kwa usahihi, na kwa lishe sahihi, upungufu haufanyiki. Kutokuwepo kwa muda mrefu kutoka kwa chakula kunaweza kusababisha tumbo, maumivu ya viungo, usingizi, kasoro za ukuaji, na kuvimbiwa. Upungufu wa kina husababisha misuli ya mara kwa mara na osteoporosis. Matumizi mabaya ya kahawa na pombe yanaweza kusababisha upungufu wa kalsiamu, kwani baadhi yake hutolewa kwenye mkojo.
Dozi nyingi za kalsiamu na vitamini D zinaweza kusababisha hypercalcemia, ikifuatiwa na ukokoaji mkali wa mifupa na tishu (haswa huathiri mfumo wa mkojo). Kuzidisha kwa muda mrefu huvuruga utendakazi wa tishu za misuli na neva, huongeza kuganda kwa damu na kupunguza ufyonzwaji wa zinki na seli za mfupa. Kiwango cha juu cha kila siku salama kwa mtu mzima ni miligramu 1500 hadi 1800.
Bidhaa Calcium, mg/100 g
Ufuta 783
Nettle 713
Forest mallow 505
Mmea mkubwa 412
Galinsoga 372
Dagaa katika mafuta 330
Ivy budra 289
Mbwa rose 257
Almond 252
Plantain lanceolist. 248
Hazelnut 226
Mbegu ya Amaranth 214
Majimaji 214
Soya kavu 201
Watoto chini ya miaka 3 - 600 mg.
Watoto kutoka miaka 4 hadi 10 - 800 mg.
Watoto kutoka miaka 10 hadi 13 - 1000 mg.
Vijana kutoka miaka 13 hadi 16 - 1200 mg.
Vijana 16 na zaidi - 1000 mg.
Watu wazima kutoka miaka 25 hadi 50 - kutoka 800 hadi 1200 mg.
Wanawake wajawazito na wanaonyonyesha - kutoka 1500 hadi 2000 mg.
Hitimisho
Calcium ni mojawapo ya vipengele vingi zaidi duniani. Kuna mengi yake katika asili: safu za milima na miamba ya udongo huundwa kutoka kwa chumvi za kalsiamu, hupatikana katika bahari na maji ya mto, na ni sehemu ya viumbe vya mimea na wanyama.
Kalsiamu huwazunguka wakaazi wa jiji mara kwa mara: karibu vifaa vyote kuu vya ujenzi - simiti, glasi, matofali, saruji, chokaa - vina vitu hivi kwa idadi kubwa.
Kwa kawaida, kuwa na mali hizo za kemikali, kalsiamu haiwezi kuwepo katika asili katika hali ya bure. Lakini misombo ya kalsiamu - ya asili na ya bandia - imepata umuhimu mkubwa.
Bibliografia
1. Bodi ya Wahariri: Knunyants I. L. (mhariri mkuu) Kemikali Encyclopedia: katika vitabu 5 - Moscow: Soviet Encyclopedia, 1990. - T. 2. - P. 293. - 671 p.
2. Doronin. N.A. Calcium, Goskhimizdat, 1962. 191 pp. na vielelezo.
3. Dotsenko VA. - Lishe ya matibabu na ya kuzuia. - Swali. lishe, 2001 - N1-p.21-25
4. Bilezikian J. P. Calcium na kimetaboliki ya mfupa // Katika: K. L. Becker, ed.
www.e-ng.ru
Ulimwengu wa Sayansi
Calcium ni kipengele cha chuma cha kikundi kikuu cha II cha kikundi cha 4 cha meza ya mara kwa mara ya vipengele vya kemikali. Ni ya familia ya chuma ya alkali duniani. Ngazi ya nishati ya nje ya atomi ya kalsiamu ina elektroni 2 zilizooanishwa
Ambayo ana uwezo wa kutoa kwa nguvu wakati wa mwingiliano wa kemikali. Hivyo, Calcium ni wakala wa kupunguza na katika misombo yake ina hali ya oxidation ya + 2. Kwa asili, kalsiamu hupatikana tu kwa namna ya chumvi. Sehemu kubwa ya kalsiamu katika ukoko wa dunia ni 3.6%. Madini kuu ya asili ya kalsiamu ni calcite CaCO3 na aina zake - chokaa, chaki, marumaru. Pia kuna viumbe hai (kwa mfano, matumbawe), uti wa mgongo ambao unajumuisha hasa kalsiamu carbonate. Pia madini muhimu ya kalsiamu ni dolomite CaCO3 MgCO3, fluorite CaF2, gypsum CaSO4 2h3O, apatite, feldspar, nk. Calcium ina jukumu muhimu katika maisha ya viumbe hai. Sehemu kubwa ya kalsiamu katika mwili wa binadamu ni 1.4-2%. Ni sehemu ya meno, mifupa, tishu na viungo vingine, inashiriki katika mchakato wa kufungwa kwa damu, na huchochea shughuli za moyo. Ili kutoa mwili kwa kiasi cha kutosha cha kalsiamu, unapaswa dhahiri kutumia maziwa na bidhaa za maziwa, mboga za kijani, na samaki.Dutu rahisi ya kalsiamu ni chuma cha kawaida cha fedha-nyeupe. Ni ngumu sana, plastiki, ina wiani wa 1.54 g/cm3 na kiwango cha kuyeyuka cha 842? C. Kikemia, kalsiamu inafanya kazi sana. Katika hali ya kawaida, inaingiliana kwa urahisi na oksijeni na unyevu hewani, kwa hivyo huhifadhiwa kwenye vyombo vilivyofungwa kwa hermetically. Inapokanzwa hewani, kalsiamu huwaka na kutengeneza oksidi: 2Ca + O2 = 2CaO. Kalsiamu humenyuka pamoja na klorini na bromini inapokanzwa, na florini hata kwenye baridi. Bidhaa za athari hizi ni halidi zinazolingana, kwa mfano: Ca + Cl2 = CaCl2. Kalsiamu inapokanzwa na sulfuri, sulfidi ya kalsiamu huundwa: Ca + S = CaS. Kalsiamu inaweza pia kuguswa na metali nyingine zisizo na metali. Mwingiliano na maji husababisha kuundwa kwa hidroksidi ya kalsiamu mumunyifu kidogo na kutolewa kwa gesi ya hidrojeni :Ca + 2h3O = Ca (OH) 2 + h3. Metali ya kalsiamu hutumiwa sana. Inatumika kama rosette katika utengenezaji wa vyuma na aloi, na kama wakala wa kupunguza kwa utengenezaji wa metali kadhaa za kinzani.
Calcium hupatikana kwa electrolysis ya kloridi ya kalsiamu iliyoyeyuka. Kwa hivyo, kalsiamu ilipatikana kwa mara ya kwanza mnamo 1808 na Humphry Davy.
worldofscience.ru
Kalsiamu ni kipengele cha kikundi kikuu cha kikundi cha pili, kipindi cha nne cha meza ya mara kwa mara ya vipengele vya kemikali, na nambari ya atomiki 20. Imeteuliwa na ishara Ca (lat. Calcium). Dutu rahisi ya kalsiamu (Nambari ya CAS: 7440-70-2) ni chuma cha ardhini cha alkali laini na tendaji cha rangi ya fedha-nyeupe.
Historia na asili ya jina
Jina la kipengele linatokana na Lat. calx (katika kesi ya jeni calcis) - "chokaa", "jiwe laini". Ilipendekezwa na mwanakemia wa Kiingereza Humphry Davy, ambaye alitenga chuma cha kalsiamu kwa njia ya elektroliti mnamo 1808. Davy aliweka mchanganyiko wa chokaa na oksidi ya zebaki HgO kwenye sahani ya platinamu, ambayo ilitumika kama anodi. Cathode ilikuwa waya ya platinamu iliyoingizwa kwenye zebaki ya kioevu. Kama matokeo ya electrolysis, amalgam ya kalsiamu ilipatikana. Baada ya kusaga zebaki kutoka kwayo, Davy alipata chuma kinachoitwa kalsiamu.
Misombo ya kalsiamu - chokaa, marumaru, jasi (pamoja na chokaa - bidhaa ya calcination ya chokaa) imetumika katika ujenzi kwa miaka elfu kadhaa iliyopita. Hadi mwisho wa karne ya 18, wanakemia waliona chokaa kuwa ngumu rahisi. Mnamo mwaka wa 1789, A. Lavoisier alipendekeza kuwa chokaa, magnesia, barite, alumina na silika ni vitu tata.
Risiti
Kalsiamu ya metali isiyolipishwa hupatikana kwa elektrolisisi ya kuyeyuka inayojumuisha CaCl 2 (75-80%) na KCl au CaCl 2 na CaF 2, pamoja na kupunguzwa kwa aluminothermic ya CaO katika 1170-1200 °C:
4CaO + 2Al → CaAl 2 O 4 + 3Ca.
Tabia za kimwili
Metali ya kalsiamu iko katika marekebisho mawili ya allotropiki. Hadi 443 °C, α-Ca yenye kimiani cha ujazo katikati ya uso (kigezo a = 0.558 nm) ni dhabiti; β-Ca yenye kimiani cha ujazo kilicho katikati ya mwili cha aina ya α-Fe (kigezo a = 0.448 nm) ni imara zaidi. Enthalpy ya kawaida ΔH 0 ya mpito wa α → β ni 0.93 kJ/mol.
Kwa ongezeko la polepole la shinikizo, huanza kuonyesha mali ya semiconductor, lakini haina kuwa semiconductor kwa maana kamili ya neno (sio chuma tena). Kwa ongezeko zaidi la shinikizo, inarudi kwenye hali ya metali na huanza kuonyesha mali ya superconducting (joto la superconductivity ni mara sita zaidi kuliko ile ya zebaki, na huzidi vipengele vingine vyote katika conductivity). Tabia ya pekee ya kalsiamu ni sawa kwa njia nyingi za strontium (yaani, sambamba katika meza ya mara kwa mara hubakia).
Tabia za kemikali
Calcium ni chuma cha kawaida cha alkali duniani. Shughuli ya kemikali ya kalsiamu ni ya juu, lakini chini kuliko ile ya madini mengine yote ya dunia ya alkali. Humenyuka kwa urahisi na oksijeni, dioksidi kaboni na unyevu hewani, ndiyo sababu uso wa chuma cha kalsiamu kawaida huwa kijivu, kwa hivyo kalsiamu ya maabara kawaida huhifadhiwa, kama metali zingine za alkali, kwenye jar iliyofungwa sana chini ya safu. mafuta ya taa au mafuta ya taa kioevu.
 Tazama "Jeshi (nambari)" ni nini katika kamusi zingine
Tazama "Jeshi (nambari)" ni nini katika kamusi zingine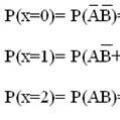 Mifano ya kutatua shida kwenye mada "Vigezo vya nasibu"
Mifano ya kutatua shida kwenye mada "Vigezo vya nasibu" Ninasoma shairi "Frost, Pua Nyekundu" na Nekrasov
Ninasoma shairi "Frost, Pua Nyekundu" na Nekrasov