เส้นผ่านศูนย์กลางของโมเลกุลน้ำ mm. ควานท์
>>ฟิสิกส์: พื้นฐานของทฤษฎีจลนพลศาสตร์ของโมเลกุล ขนาดโมเลกุล
โมเลกุลมีขนาดเล็กมาก แต่ลองดูว่าการประมาณขนาดและมวลนั้นง่ายเพียงใด การสังเกตหนึ่งครั้งและการคำนวณง่ายๆ สองสามข้อก็เพียงพอแล้ว จริงอยู่เรายังต้องหาวิธีการทำเช่นนี้
ทฤษฎีโมเลกุลและจลนพลศาสตร์ของโครงสร้างของสสารมีพื้นฐานมาจากข้อความสามประการ: สสารประกอบด้วยอนุภาค อนุภาคเหล่านี้เคลื่อนที่แบบสุ่ม อนุภาคมีปฏิสัมพันธ์ซึ่งกันและกัน. การยืนยันแต่ละรายการได้รับการพิสูจน์อย่างเข้มงวดโดยการทดลอง
คุณสมบัติและพฤติกรรมของวัตถุทั้งหมดโดยไม่มีข้อยกเว้น ตั้งแต่ ciliates จนถึงดวงดาว ถูกกำหนดโดยการเคลื่อนที่ของอนุภาคที่มีปฏิสัมพันธ์ซึ่งกันและกัน: โมเลกุล อะตอม หรือแม้แต่การก่อตัวที่เล็กกว่า - อนุภาคมูลฐาน
การประมาณขนาดของโมเลกุลเพื่อให้แน่ใจว่ามีโมเลกุลอยู่อย่างสมบูรณ์จำเป็นต้องกำหนดขนาดของโมเลกุล
วิธีที่ง่ายที่สุดในการทำเช่นนี้คือการสังเกตการแพร่กระจายของน้ำมัน เช่น น้ำมันมะกอก บนผิวน้ำ น้ำมันจะไม่ครอบครองพื้นผิวทั้งหมดหากภาชนะมีขนาดใหญ่ ( รูปที่ 8.1). เป็นไปไม่ได้ที่จะทำให้หยดขนาด 1 มม. 3 กระจายออกไปเพื่อให้มีพื้นที่ผิวมากกว่า 0.6 ม. 2 . สามารถสันนิษฐานได้ว่าเมื่อน้ำมันกระจายไปทั่วพื้นที่สูงสุด มันจะก่อตัวเป็นชั้นที่มีความหนาเพียงโมเลกุลเดียว - เป็น "ชั้นโมโนโมเลกุล" ง่ายต่อการกำหนดความหนาของชั้นนี้ และประมาณขนาดของโมเลกุลน้ำมันมะกอก
ปริมาณ วีชั้นน้ำมันเท่ากับผลคูณของพื้นที่ผิวของมัน สเพื่อความหนา งชั้นเช่น V=Sd. ดังนั้นขนาดของโมเลกุลของน้ำมันมะกอกคือ:
ไม่จำเป็นต้องระบุวิธีที่เป็นไปได้ทั้งหมดในการพิสูจน์การมีอยู่ของอะตอมและโมเลกุล เครื่องมือที่ทันสมัยทำให้สามารถมองเห็นภาพของอะตอมและโมเลกุลแต่ละตัวได้ รูปที่ 8.2 แสดงไมโครกราฟของพื้นผิวของซิลิคอนเวเฟอร์ โดยที่การกระแทกคืออะตอมของซิลิคอนแต่ละตัว ภาพดังกล่าวได้รับการเรียนรู้เป็นครั้งแรกในปี พ.ศ. 2524 โดยใช้กล้องจุลทรรศน์แบบใช้แสงธรรมดา ไม่ใช่แบบออปติคัล แต่เป็นกล้องจุลทรรศน์แบบอุโมงค์ที่ซับซ้อน

โมเลกุลรวมทั้งน้ำมันมะกอกมีขนาดใหญ่กว่าอะตอม เส้นผ่านศูนย์กลางของอะตอมใด ๆ มีค่าประมาณ 10 -8 ซม. ขนาดเหล่านี้เล็กมากจนยากที่จะจินตนาการได้ ในกรณีเช่นนี้จะใช้การเปรียบเทียบ
นี่คือหนึ่งในนั้น หากนิ้วกำแน่นเป็นกำปั้นและขยายขนาดเท่าโลก อะตอมที่มีขนาดเท่ากำปั้นก็จะกลายเป็นขนาดเท่ากำปั้น
จำนวนโมเลกุลด้วยขนาดโมเลกุลที่เล็กมาก จำนวนโมเลกุลในร่างกายที่มองด้วยตาเปล่าจึงมีจำนวนมหาศาล ให้เราคำนวณจำนวนโมเลกุลโดยประมาณในหยดน้ำที่มีมวล 1 กรัม และปริมาตรเท่ากับ 1 ซม. 3 .
เส้นผ่านศูนย์กลางของโมเลกุลน้ำอยู่ที่ประมาณ 3 10 -8 ซม. สมมติว่าโมเลกุลของน้ำแต่ละโมเลกุลที่มีการอัดแน่นของโมเลกุลมีปริมาตร (3 10 -8 ซม.) 3 คุณสามารถหาจำนวนโมเลกุลในหยดได้โดยการหาร ปริมาตรหยด (1 ซม. 3) โดยปริมาตรต่อโมเลกุล:
ในการหายใจเข้าแต่ละครั้ง คุณจะจับโมเลกุลจำนวนมากจนถ้าโมเลกุลทั้งหมดกระจายตัวเท่าๆ กันในชั้นบรรยากาศของโลกหลังจากหายใจออก ทุกคนที่อาศัยอยู่ในโลกจะได้รับโมเลกุลสองหรือสามโมเลกุลที่อยู่ในปอดของคุณระหว่างการหายใจเข้า
ขนาดของอะตอมมีขนาดเล็ก: .
บทบัญญัติหลักสามประการของทฤษฎีจลนพลศาสตร์ของโมเลกุลจะถูกกล่าวถึงซ้ำๆ
???
1. ควรใช้การวัดใดเพื่อประเมินขนาดของโมเลกุลน้ำมันมะกอก
2. ถ้าเพิ่มขนาดอะตอมให้ใหญ่ขึ้นจนมีขนาดเท่าเมล็ดงาดำ (0.1 มม.) แล้วเมล็ดพืชจะมีขนาดเท่าใดเมื่อใช้กำลังขยายเท่ากัน
3. ทำรายการหลักฐานการมีอยู่ของโมเลกุลที่คุณรู้จักซึ่งไม่ได้กล่าวถึงในข้อความ
G.Ya.Myakishev, B.B.Bukhovtsev, N.N.Sotsky, ฟิสิกส์เกรด 10
เนื้อหาบทเรียน สรุปบทเรียนสนับสนุนกรอบการนำเสนอบทเรียนวิธีการเร่งเทคโนโลยีแบบโต้ตอบ ฝึกฝน งานและแบบฝึกหัด การประชุมเชิงปฏิบัติการการตรวจสอบตนเอง การฝึกอบรม กรณีศึกษา ภารกิจ คำถาม การบ้าน การสนทนา คำถามเชิงโวหารจากนักเรียน ภาพประกอบ เสียง วิดีโอคลิป และมัลติมีเดียภาพถ่าย รูปภาพกราฟิก ตาราง โครงร่าง อารมณ์ขัน เกร็ดเล็กเกร็ดน้อย เรื่องตลก อุปมาการ์ตูน คำพูด ปริศนาอักษรไขว้ คำคม ส่วนเสริม บทคัดย่อบทความชิปสำหรับสูตรโกงที่อยากรู้อยากเห็น หนังสือเรียนพื้นฐานและอภิธานศัพท์เพิ่มเติมของคำศัพท์อื่นๆ การปรับปรุงตำราและบทเรียนแก้ไขข้อผิดพลาดในหนังสือเรียนอัปเดตชิ้นส่วนในตำราองค์ประกอบของนวัตกรรมในบทเรียนแทนที่ความรู้ที่ล้าสมัยด้วยความรู้ใหม่ สำหรับครูเท่านั้น บทเรียนที่สมบูรณ์แบบแผนปฏิทินสำหรับปี คำแนะนำเกี่ยวกับวิธีการของโปรแกรมการอภิปราย บทเรียนแบบบูรณาการหากคุณมีการแก้ไขหรือคำแนะนำสำหรับบทเรียนนี้
MKT ง่าย!
"ไม่มีอะไรอยู่นอกจากอะตอมและพื้นที่ว่าง..." - Democritus
"ร่างกายใด ๆ สามารถแบ่งได้อย่างไม่มีกำหนด" - อริสโตเติล
บทบัญญัติหลักของทฤษฎีจลนพลศาสตร์ของโมเลกุล (MKT)
วัตถุประสงค์ของ ICB- นี่คือคำอธิบายโครงสร้างและคุณสมบัติของวัตถุขนาดใหญ่และปรากฏการณ์ทางความร้อนที่เกิดขึ้นในพวกมันโดยการเคลื่อนไหวและปฏิสัมพันธ์ของอนุภาคที่ประกอบเป็นร่างกาย
ร่างกายที่มองเห็นด้วยตาเปล่า- สิ่งเหล่านี้เป็นวัตถุขนาดใหญ่ประกอบด้วยโมเลกุลจำนวนมาก
ปรากฏการณ์ทางความร้อน- ปรากฏการณ์ที่เกี่ยวข้องกับร่างกายร้อนและเย็น
ข้อความหลักของ ILC
1. สารประกอบด้วยอนุภาค (โมเลกุลและอะตอม)
2. มีช่องว่างระหว่างอนุภาค
3. อนุภาคเคลื่อนที่แบบสุ่มและต่อเนื่อง
4. อนุภาคมีปฏิสัมพันธ์ซึ่งกันและกัน (ดึงดูดและขับไล่)
การยืนยัน MKT:
1. การทดลอง
- การบดเชิงกลของสาร การละลายของสารในน้ำ การบีบอัดและการขยายตัวของก๊าซ การระเหย; การเปลี่ยนรูปของร่างกาย การแพร่กระจาย; การทดลองของ Brigman: น้ำมันถูกเทลงในภาชนะ ลูกสูบกดน้ำมันจากด้านบน ที่ความดัน 10,000 atm น้ำมันเริ่มซึมผ่านผนังของภาชนะเหล็ก
การแพร่กระจาย; การเคลื่อนที่แบบบราวเนียนของอนุภาคในของเหลวภายใต้การกระทบของโมเลกุล
ความสามารถในการอัดตัวของของแข็งและของเหลวไม่ดี ความพยายามอย่างมากในการทำให้ของแข็งแตกตัว การรวมตัวกันของหยดของเหลว
2. ตรง
- การถ่ายภาพ การกำหนดขนาดอนุภาค
การเคลื่อนที่แบบบราวเนียน
การเคลื่อนที่แบบบราวเนียนคือการเคลื่อนที่ด้วยความร้อนของอนุภาคแขวนลอยในของเหลว (หรือก๊าซ)
การเคลื่อนที่แบบบราวเนียนได้กลายเป็นหลักฐานของการเคลื่อนที่ (ความร้อน) อย่างต่อเนื่องและวุ่นวายของโมเลกุลของสสาร
- ค้นพบโดยนักพฤกษศาสตร์ชาวอังกฤษ อาร์ บราวน์ ในปี พ.ศ. 2370
- คำอธิบายทางทฤษฎีตาม MKT ได้รับโดย A. Einstein ในปี 1905
- ได้รับการยืนยันจากการทดลองโดยนักฟิสิกส์ชาวฝรั่งเศส J. Perrin
มวลและขนาดของโมเลกุล
ขนาดอนุภาค
เส้นผ่านศูนย์กลางของอะตอมใด ๆ ประมาณซม.

จำนวนโมเลกุลในสาร
โดยที่ V คือปริมาตรของสาร Vo คือปริมาตรของหนึ่งโมเลกุล
มวลของหนึ่งโมเลกุล
โดยที่ m คือมวลของสาร
N คือจำนวนโมเลกุลในสาร
หน่วยมวลใน SI: [m]= 1 กก
ในฟิสิกส์อะตอม มวลมักจะวัดเป็นหน่วยมวลอะตอม (a.m.u.)
ตามอัตภาพจะถือเป็น 1 น. :
น้ำหนักโมเลกุลสัมพัทธ์ของสาร
เพื่อความสะดวกในการคำนวณจะมีการแนะนำปริมาณ - น้ำหนักโมเลกุลสัมพัทธ์ของสาร
มวลของโมเลกุลของสารใดๆ เทียบได้กับ 1/12 ของมวลของโมเลกุลคาร์บอน

โดยที่ตัวเศษคือมวลของโมเลกุลและตัวส่วนคือ 1/12 ของมวลของอะตอมของคาร์บอน
ปริมาณนี้ไม่มีมิติ กล่าวคือ ไม่มีหน่วย
มวลอะตอมสัมพัทธ์ของธาตุเคมี

โดยที่ตัวเศษคือมวลของอะตอมและตัวส่วนคือ 1/12 ของมวลของอะตอมของคาร์บอน
ปริมาณไม่มีมิติ กล่าวคือ ไม่มีหน่วย
มวลอะตอมสัมพัทธ์ของธาตุเคมีแต่ละชนิดแสดงไว้ในตารางธาตุ
อีกวิธีหนึ่งในการกำหนดน้ำหนักโมเลกุลสัมพัทธ์ของสาร
มวลโมเลกุลสัมพัทธ์ของสารมีค่าเท่ากับผลรวมของมวลอะตอมสัมพัทธ์ขององค์ประกอบทางเคมีที่ประกอบกันเป็นโมเลกุลของสาร
เรานำมวลอะตอมสัมพัทธ์ของธาตุเคมีใดๆ จากตารางธาตุ!)
ปริมาณของสาร
ปริมาณของสาร (ν) กำหนดจำนวนสัมพัทธ์ของโมเลกุลในร่างกาย
โดยที่ N คือจำนวนโมเลกุลในร่างกาย และ Na คือค่าคงที่ของ Avogadro
หน่วยวัดปริมาณของสารในระบบ SI: [ν] = 1 โมล
1 โมล- นี่คือปริมาณของสารที่มีโมเลกุล (หรืออะตอม) มากเท่ากับจำนวนอะตอมในคาร์บอนที่มีมวล 0.012 กก.
จดจำ!
สารใดๆ 1 โมลมีจำนวนอะตอมหรือโมเลกุลเท่ากัน!
แต่!
ปริมาณสารที่เท่ากันสำหรับสารต่างชนิดกันมีมวลต่างกัน!
ค่าคงที่อาโวกาโดร
จำนวนอะตอมใน 1 โมลของสารใด ๆ เรียกว่าเลขอาโวกาโดรหรือค่าคงที่ของอาโวกาโดร:
มวลโมลาร์
มวลโมลาร์ (M) คือมวลของสารหนึ่งโมล หรือมิฉะนั้น ก็คือมวลของสารหนึ่งโมล
มวลโมเลกุล
- ค่าคงที่ของ Avogadro
หน่วยมวลโมลาร์: [M]=1 กก./โมล
สูตรสำหรับการแก้ปัญหา
สูตรเหล่านี้ได้มาจากการแทนที่สูตรข้างต้น
มวลของสสารใดๆ
การทดลองมากมายแสดงให้เห็นว่า ขนาดโมเลกุลขนาดเล็กมาก. ขนาดเชิงเส้นของโมเลกุลหรืออะตอมสามารถพบได้หลายวิธี ตัวอย่างเช่น ด้วยความช่วยเหลือของกล้องจุลทรรศน์อิเล็กตรอน ภาพถ่ายของโมเลกุลขนาดใหญ่บางส่วนถูกถ่าย และด้วยความช่วยเหลือของเครื่องฉายไอออน (กล้องจุลทรรศน์ไอออน) เราสามารถศึกษาโครงสร้างของผลึกได้เท่านั้น แต่ยังกำหนดระยะห่างระหว่างอะตอมแต่ละอะตอมด้วย ในโมเลกุล
การใช้ความสำเร็จของเทคโนโลยีการทดลองที่ทันสมัยทำให้สามารถกำหนดขนาดเชิงเส้นของอะตอมและโมเลกุลอย่างง่ายซึ่งมีขนาดประมาณ 10-8 ซม. ขนาดเชิงเส้นของอะตอมและโมเลกุลที่ซับซ้อนนั้นใหญ่กว่ามาก ตัวอย่างเช่น ขนาดของโมเลกุลโปรตีนคือ 43*10 -8 ซม.
ในการระบุลักษณะของอะตอม แนวคิดของรัศมีอะตอมถูกนำมาใช้ ซึ่งทำให้สามารถประมาณระยะห่างระหว่างอะตอมในโมเลกุล ของเหลว หรือของแข็งได้โดยประมาณ เนื่องจากอะตอมไม่มีขอบเขตที่ชัดเจนในขนาด นั่นคือ รัศมีอะตอม- นี่คือทรงกลมที่ปิดล้อมส่วนหลักของความหนาแน่นอิเล็กตรอนของอะตอม (อย่างน้อย 90 ... 95%)
ขนาดของโมเลกุลมีขนาดเล็กมากจนสามารถแสดงได้โดยการเปรียบเทียบเท่านั้น ตัวอย่างเช่น โมเลกุลของน้ำมีขนาดเล็กกว่าแอปเปิ้ลลูกใหญ่หลายเท่า แอปเปิ้ลมีขนาดเล็กกว่าลูกโลกกี่เท่า
โมลของสาร
มวลของโมเลกุลและอะตอมแต่ละตัวมีขนาดเล็กมาก ดังนั้นจึงสะดวกกว่าที่จะใช้ค่าสัมพัทธ์มากกว่าค่ามวลสัมบูรณ์ในการคำนวณ
น้ำหนักโมเลกุลสัมพัทธ์(หรือ มวลอะตอมสัมพัทธ์) สาร M r คืออัตราส่วนของมวลของโมเลกุล (หรืออะตอม) ของสารที่กำหนดต่อ 1/12 ของมวลของอะตอมของคาร์บอน
ม r \u003d (ม 0) : (ม 0C / 12)
โดยที่ m 0 คือมวลของโมเลกุล (หรืออะตอม) ของสารที่กำหนด m 0C คือมวลของอะตอมของคาร์บอน
มวลโมเลกุลสัมพัทธ์ (หรืออะตอม) ของสารแสดงว่ามวลของโมเลกุลของสารมากกว่า 1/12 ของมวลของไอโซโทปคาร์บอน C 12 กี่เท่า มวลโมเลกุลสัมพัทธ์ (อะตอม) แสดงเป็นหน่วยมวลอะตอม
หน่วยมวลอะตอมคือ 1/12 ของมวลของไอโซโทปคาร์บอน C 12 การวัดที่แม่นยำแสดงให้เห็นว่าหน่วยมวลอะตอมคือ 1.660 * 10 -27 กก. นั่นคือ
1 สาธุ = 1.660 * 10 -27 กก
มวลโมเลกุลสัมพัทธ์ของสารสามารถคำนวณได้โดยการบวกมวลอะตอมสัมพัทธ์ของธาตุที่ประกอบกันเป็นโมเลกุลของสาร มวลอะตอมสัมพัทธ์ขององค์ประกอบทางเคมีถูกระบุในระบบธาตุเคมีโดย D.I. เมนเดเลเยฟ.
ในระบบธาตุ D.I. มีการระบุ Mendeleev สำหรับแต่ละองค์ประกอบ มวลอะตอมซึ่งวัดเป็นหน่วยมวลอะตอม (amu) ตัวอย่างเช่น มวลอะตอมของแมกนีเซียมคือ 24.305 amu นั่นคือแมกนีเซียมหนักเป็นสองเท่าของคาร์บอน เนื่องจากมวลอะตอมของคาร์บอนเท่ากับ 12 amu (สิ่งนี้เป็นไปตามข้อเท็จจริงที่ว่า 1 amu = 1/12 ของมวลของไอโซโทปของคาร์บอนที่เป็นส่วนประกอบส่วนใหญ่ของอะตอมของคาร์บอน)
ทำไมต้องวัดมวลของโมเลกุลและอะตอมใน amu ถ้ามีหน่วยเป็นกรัมและกิโลกรัม? แน่นอน คุณสามารถใช้หน่วยเหล่านี้ได้ แต่จะไม่สะดวกในการเขียน (ต้องใช้ตัวเลขมากเกินไปเพื่อเขียนมวล) หากต้องการหามวลของธาตุในหน่วยกิโลกรัม ให้นำมวลอะตอมของธาตุนั้นไปคูณด้วย 1 amu มวลอะตอมพบได้ตามตารางธาตุ (เขียนทางด้านขวาของชื่อตัวอักษรของธาตุ) ตัวอย่างเช่น น้ำหนักของอะตอมแมกนีเซียมในหน่วยกิโลกรัมจะเป็น:
m 0Mg = 24.305 * 1 a.e.m. = 24.305 * 1.660 * 10 -27 = 40.3463 * 10 -27 กก.
มวลของโมเลกุลสามารถคำนวณได้โดยการบวกมวลขององค์ประกอบที่ประกอบกันเป็นโมเลกุล ตัวอย่างเช่น มวลของโมเลกุลน้ำ (H 2 O) จะเท่ากับ:
ม. 0H2O \u003d 2 * ม. 0H + ม. 0O \u003d 2 * 1.00794 + 15.9994 \u003d 18.0153 น. = 29.905 * 10 -27 กก
ตุ่นเท่ากับปริมาณของสารในระบบซึ่งมีโมเลกุลมากเท่ากับจำนวนอะตอมในคาร์บอน C 12 0.012 กิโลกรัม นั่นคือถ้าเรามีระบบที่มีสารบางอย่าง และในระบบนี้มีโมเลกุลของสารนี้มากเท่ากับจำนวนอะตอมในคาร์บอน 0.012 กิโลกรัม เราก็สามารถพูดได้ว่าในระบบนี้เรามี 1 โมลของสาร.
ค่าคงที่อาโวกาโดร
ปริมาณของสารν เท่ากับอัตราส่วนของจำนวนโมเลกุลในร่างกายที่กำหนดต่อจำนวนอะตอมในคาร์บอน 0.012 กิโลกรัม นั่นคือจำนวนโมเลกุลใน 1 โมลของสาร
ν = N / N A
โดยที่ N คือจำนวนโมเลกุลในร่างกายที่กำหนด N A คือจำนวนโมเลกุลใน 1 โมลของสารที่ประกอบกันเป็นร่างกาย
N A คือค่าคงที่ของ Avogadro ปริมาณของสารวัดเป็นโมล
ค่าคงที่อาโวกาโดรคือจำนวนโมเลกุลหรืออะตอมในสาร 1 โมล ค่าคงที่นี้ได้รับชื่อเพื่อเป็นเกียรติแก่นักเคมีและนักฟิสิกส์ชาวอิตาลี อาเมเดโอ อาโวกาโดร (1776 – 1856).
สารใดๆ 1 โมลมีจำนวนอนุภาคเท่ากัน
N A \u003d 6.02 * 10 23 โมล -1
มวลโมลาร์คือมวลของสารที่ได้รับในปริมาณหนึ่งโมล:
μ = ม. 0 * ยังไม่มีข้อความ
โดยที่ m 0 คือมวลของโมเลกุล
มวลโมลาร์แสดงเป็นกิโลกรัมต่อโมล (กก./โมล = กก.*โมล -1)
มวลโมลาร์เกี่ยวข้องกับมวลโมเลกุลสัมพัทธ์ตามความสัมพันธ์:
μ \u003d 10 -3 * M r [กก. * โมล -1]
มวลของสารจำนวนใดๆ m เท่ากับผลคูณของมวลของหนึ่งโมเลกุล m 0 โดยจำนวนโมเลกุล:
ม. = ม. 0 N = ม. 0 N A ν = μν
ปริมาณของสารเท่ากับอัตราส่วนของมวลของสารต่อมวลโมลาร์:
ν = ม. / ม
สามารถหามวลของหนึ่งโมเลกุลของสารได้หากทราบมวลโมลาร์และค่าคงที่ Avogadro:
ม. 0 = ม. / N = ม. / νN A = μ / N A
การหามวลของอะตอมและโมเลกุลที่แม่นยำยิ่งขึ้นทำได้โดยใช้แมสสเปกโตรมิเตอร์ ซึ่งเป็นอุปกรณ์ที่ลำแสงของอนุภาคที่มีประจุไฟฟ้าแยกออกจากกันในอวกาศโดยขึ้นอยู่กับมวลประจุของพวกมันโดยใช้สนามไฟฟ้าและสนามแม่เหล็ก
ตัวอย่างเช่น ลองหามวลโมลาร์ของอะตอมแมกนีเซียม ตามที่เราทราบข้างต้น มวลของอะตอมแมกนีเซียมคือ m0Mg = 40.3463 * 10 -27 กก. จากนั้นมวลโมลาร์จะเป็น:
μ \u003d m 0Mg * N A \u003d 40.3463 * 10 -27 * 6.02 * 10 23 \u003d 2.4288 * 10 -2 กก. / โมล
นั่นคือแมกนีเซียม 2.4288 * 10 -2 กิโลกรัม "พอดี" ในหนึ่งโมล หรือประมาณ 24.28 กรัม
อย่างที่คุณเห็น มวลโมลาร์ (หน่วยเป็นกรัม) เกือบจะเท่ากับมวลอะตอมของธาตุที่ระบุในตารางธาตุ ดังนั้น เมื่อพวกเขาระบุมวลอะตอม พวกเขามักจะทำสิ่งนี้:
มวลอะตอมของแมกนีเซียมเท่ากับ 24.305 amu (กรัม/โมล).
สถานศึกษาเทศบาล
“มัธยมศึกษาขั้นพื้นฐาน ครั้งที่ 10”
การกำหนดเส้นผ่านศูนย์กลางของโมเลกุล
งานห้องปฏิบัติการ
ศิลปิน: Masaev Evgeniy
ชั้นประถมศึกษาปีที่ 7 "A"
หัวหน้า: Reznik A.V.
เขต Guryevsky
การแนะนำ
ปีการศึกษานี้ฉันเริ่มเรียนฟิสิกส์ ฉันได้เรียนรู้ว่าร่างกายที่ล้อมรอบเราประกอบด้วยอนุภาคเล็กๆ ซึ่งก็คือโมเลกุล ฉันสงสัยว่าขนาดของโมเลกุลคืออะไร เนื่องจากมีขนาดเล็กมาก โมเลกุลจึงไม่สามารถมองเห็นได้ด้วยตาเปล่าหรือด้วยกล้องจุลทรรศน์ธรรมดา ฉันอ่านเจอว่าโมเลกุลสามารถมองเห็นได้ด้วยกล้องจุลทรรศน์อิเล็กตรอนเท่านั้น นักวิทยาศาสตร์ได้พิสูจน์แล้วว่าโมเลกุลของสารต่างๆ แตกต่างกัน และโมเลกุลของสารชนิดเดียวกันก็เหมือนกัน ฉันต้องการวัดเส้นผ่านศูนย์กลางของโมเลกุลในทางปฏิบัติ แต่น่าเสียดายที่หลักสูตรของโรงเรียนไม่ได้จัดเตรียมไว้สำหรับการศึกษาปัญหาประเภทนี้ และกลายเป็นงานยากที่จะพิจารณาโดยลำพัง และฉันต้องศึกษาวรรณกรรมเกี่ยวกับวิธีการกำหนดเส้นผ่านศูนย์กลางของโมเลกุล
บทฉัน. โมเลกุล
1.1 จากทฤษฎีคำถาม
โมเลกุลในความหมายสมัยใหม่คืออนุภาคที่เล็กที่สุดของสารที่มีคุณสมบัติทางเคมีทั้งหมด โมเลกุลมีความสามารถในการดำรงอยู่อย่างอิสระ มันสามารถประกอบด้วยอะตอมที่เหมือนกันทั้งคู่ ตัวอย่างเช่น ออกซิเจน O 2, โอโซน O 3, ไนโตรเจน N 2, ฟอสฟอรัส P 4, ซัลเฟอร์ S 6 เป็นต้น และจากอะตอมที่แตกต่างกัน ซึ่งรวมถึงโมเลกุลของสารเชิงซ้อนทั้งหมด โมเลกุลที่ง่ายที่สุดประกอบด้วยหนึ่งอะตอม: เหล่านี้คือโมเลกุลของก๊าซเฉื่อย - ฮีเลียม, นีออน, อาร์กอน, คริปทอน, ซีนอน, เรดอน ในสารประกอบโมเลกุลขนาดใหญ่และพอลิเมอร์ แต่ละโมเลกุลสามารถประกอบด้วยอะตอมหลายแสนอะตอม
หลักฐานเชิงทดลองของการมีอยู่ของโมเลกุลได้รับการพิสูจน์อย่างน่าเชื่อถือที่สุดครั้งแรกโดยนักฟิสิกส์ชาวฝรั่งเศส เจ. เพอร์ริน ในปี 1906 เมื่อศึกษาการเคลื่อนที่แบบบราวเนียน ดังที่ Perrin แสดงให้เห็น เป็นผลมาจากการเคลื่อนที่ด้วยความร้อนของโมเลกุล และไม่ใช่อย่างอื่น
สาระสำคัญของโมเลกุลสามารถอธิบายได้จากมุมมองอื่น: โมเลกุลเป็นระบบที่เสถียรซึ่งประกอบด้วยนิวเคลียสของอะตอม (เหมือนกันหรือต่างกัน) และอิเล็กตรอนที่อยู่รอบๆ และคุณสมบัติทางเคมีของโมเลกุลถูกกำหนดโดยอิเล็กตรอนของเปลือกนอก ในอะตอม อะตอมจะรวมกันเป็นโมเลกุลโดยส่วนใหญ่ด้วยพันธะเคมี โดยปกติแล้ว พันธะดังกล่าวจะถูกสร้างขึ้นโดยอิเล็กตรอน 1, 2 หรือ 3 คู่ที่ใช้ร่วมกันโดยอะตอม 2 อะตอม
อะตอมในโมเลกุลเชื่อมต่อกันในลำดับที่แน่นอนและกระจายในอวกาศในลักษณะที่แน่นอน พันธะระหว่างอะตอมมีกำลังต่างกัน ประมาณจากปริมาณพลังงานที่ต้องใช้เพื่อทำลายพันธะระหว่างอะตอม
โมเลกุลมีขนาดและรูปร่างที่แน่นอน มีการกำหนดโดยวิธีการต่างๆ ว่า 1 ซม. 3 ของก๊าซใดๆ ภายใต้สภาวะปกติมีประมาณ 2.7x10 19 โมเลกุล
เพื่อให้เข้าใจว่าจำนวนนี้มากเพียงใด เราสามารถจินตนาการได้ว่าโมเลกุลนั้นเป็น "ก้อนอิฐ" จากนั้นถ้าเรานำจำนวนก้อนอิฐเท่ากับจำนวนโมเลกุลในก๊าซ 1 ซม. 3 ภายใต้สภาวะปกติและวางพื้นผิวของโลกทั้งใบให้แน่น พวกมันก็จะปกคลุมพื้นผิวด้วยชั้นความสูง 120 เมตร ซึ่ง สูงกว่าความสูงของตึก 10 ชั้นเกือบ 4 เท่า โมเลกุลจำนวนมากต่อหน่วยปริมาตรบ่งชี้ว่าโมเลกุลมีขนาดเล็กมาก ตัวอย่างเช่น มวลของโมเลกุลของน้ำคือ m=29.9 x 10 -27 kg ดังนั้นขนาดของโมเลกุลจึงมีขนาดเล็กเช่นกัน เส้นผ่านศูนย์กลางของโมเลกุลถือเป็นระยะทางขั้นต่ำที่แรงผลักยอมให้พวกมันเข้าใกล้กันได้ อย่างไรก็ตาม แนวคิดเรื่องขนาดของโมเลกุลนั้นมีเงื่อนไข เนื่องจากที่ระยะโมเลกุล แนวคิดของฟิสิกส์คลาสสิกมักไม่สมเหตุสมผลเสมอไป ขนาดโมเลกุลเฉลี่ยประมาณ 10-10 ม.
โมเลกุลเป็นระบบที่ประกอบด้วยอิเลคตรอนและนิวเคลียสที่ทำปฏิกิริยากันสามารถอยู่ในสถานะต่างๆ กัน และส่งผ่านจากสถานะหนึ่งไปยังอีกสถานะหนึ่งโดยบังคับ (ภายใต้อิทธิพลของอิทธิพลภายนอก) หรือเกิดขึ้นเอง สำหรับโมเลกุลทั้งหมดประเภทนี้ ชุดของสถานะบางอย่างเป็นลักษณะเฉพาะ ซึ่งสามารถทำหน้าที่ระบุโมเลกุลได้ ในฐานะที่เป็นรูปแบบอิสระโมเลกุลมีคุณสมบัติทางกายภาพที่แน่นอนในแต่ละสถานะคุณสมบัติเหล่านี้จะถูกรักษาไว้ในระดับหนึ่งหรืออีกระดับหนึ่งในระหว่างการเปลี่ยนจากโมเลกุลเป็นสารที่ประกอบด้วยพวกมันและกำหนดคุณสมบัติของสารนี้ ในระหว่างการเปลี่ยนแปลงทางเคมี โมเลกุลของสารหนึ่งจะแลกเปลี่ยนอะตอมกับโมเลกุลของสารอีกชนิดหนึ่ง แตกตัวเป็นโมเลกุลที่มีจำนวนอะตอมน้อยกว่า และยังเข้าสู่ปฏิกิริยาเคมีประเภทอื่นๆ ดังนั้น วิชาเคมีจึงศึกษาสารและการเปลี่ยนแปลงของสารเหล่านี้อย่างใกล้ชิดกับโครงสร้างและสถานะของโมเลกุล
โมเลกุลมักเรียกว่าอนุภาคที่เป็นกลางทางไฟฟ้า ในสสาร ไอออนบวกจะอยู่ร่วมกับประจุลบเสมอ
ตามจำนวนนิวเคลียสของอะตอมที่รวมอยู่ในโมเลกุล ไดอะตอมมิก, ไตรอะตอม ฯลฯ โมเลกุลมีความโดดเด่น ถ้าจำนวนอะตอมในโมเลกุลเกินหนึ่งแสนโมเลกุล เรียกว่า โมเลกุลขนาดใหญ่ ผลรวมของมวลของอะตอมทั้งหมดที่ประกอบกันเป็นโมเลกุลถือเป็นน้ำหนักโมเลกุล ตามน้ำหนักโมเลกุล สารทั้งหมดจะถูกแบ่งตามเงื่อนไขเป็นน้ำหนักโมเลกุลต่ำและสูง
1.2 วิธีการวัดเส้นผ่านศูนย์กลางของโมเลกุล
ในฟิสิกส์ระดับโมเลกุล "ตัวแสดง" หลักคือโมเลกุล ซึ่งเป็นอนุภาคขนาดเล็กที่ไม่สามารถจินตนาการได้ซึ่งประกอบเป็นสสารทั้งหมดในโลก เป็นที่ชัดเจนว่าสำหรับการศึกษาปรากฏการณ์ต่างๆ สิ่งสำคัญคือต้องรู้ว่าพวกมันคืออะไร โมเลกุล โดยเฉพาะอย่างยิ่งขนาดของพวกเขาคืออะไร
เมื่อพูดถึงโมเลกุล พวกเขามักจะนึกถึงลูกบอลที่เล็ก ยืดหยุ่น และแข็ง ดังนั้นการทราบขนาดของโมเลกุลหมายถึงการทราบรัศมีของโมเลกุล
แม้จะมีขนาดเล็กของขนาดโมเลกุล แต่นักฟิสิกส์ก็สามารถพัฒนาได้หลายวิธีในการตรวจสอบพวกมัน Physics 7 พูดถึงพวกเขาสองคน เราใช้ประโยชน์จากคุณสมบัติของของเหลวบางส่วน (น้อยมาก) เพื่อแพร่กระจายในรูปของฟิล์มที่มีความหนาหนึ่งโมเลกุล อีกประการหนึ่ง ขนาดของอนุภาคถูกกำหนดโดยใช้อุปกรณ์ที่ซับซ้อน - เครื่องฉายไอออน
มีการศึกษาโครงสร้างของโมเลกุลด้วยวิธีการทดลองต่างๆ การเลี้ยวเบนของอิเล็กตรอน การเลี้ยวเบนของนิวตรอน และการวิเคราะห์โครงสร้างด้วยรังสีเอกซ์ให้ข้อมูลโดยตรงเกี่ยวกับโครงสร้างของโมเลกุล การเลี้ยวเบนของอิเล็กตรอนเป็นวิธีการที่ตรวจสอบการกระเจิงของอิเล็กตรอนโดยลำแสงของโมเลกุลในเฟสก๊าซ ทำให้สามารถคำนวณค่าพารามิเตอร์ของการกำหนดค่าทางเรขาคณิตสำหรับโมเลกุลที่ค่อนข้างง่ายที่แยกได้ การเลี้ยวเบนของนิวตรอนและการวิเคราะห์โครงสร้างด้วยรังสีเอกซ์จะจำกัดเฉพาะการวิเคราะห์โครงสร้างของโมเลกุลหรือชิ้นส่วนที่ได้รับคำสั่งแต่ละชิ้นในเฟสควบแน่น การศึกษาด้วยรังสีเอกซ์ นอกเหนือจากข้อมูลที่ระบุ ทำให้สามารถรับข้อมูลเชิงปริมาณเกี่ยวกับการกระจายเชิงพื้นที่ของความหนาแน่นของอิเล็กตรอนในโมเลกุล
วิธีการทางสเปกโทรสโกปีขึ้นอยู่กับลักษณะเฉพาะของสเปกตรัมของสารประกอบทางเคมี ซึ่งเกิดจากชุดของสถานะลักษณะเฉพาะของแต่ละโมเลกุลและระดับพลังงานที่สอดคล้องกัน วิธีการเหล่านี้ทำให้สามารถวิเคราะห์สเปกตรัมของสารในเชิงคุณภาพและเชิงปริมาณได้
การดูดกลืนหรือการปล่อยสเปกตรัมในย่านไมโครเวฟของสเปกตรัมทำให้สามารถศึกษาการเปลี่ยนสถานะระหว่างการหมุน ระบุโมเมนต์ความเฉื่อยของโมเลกุล และขึ้นอยู่กับความยาวพันธะ มุมพันธะ และพารามิเตอร์ทางเรขาคณิตอื่นๆ ของโมเลกุล ตามกฎแล้วอินฟราเรดสเปกโทรสโกปีจะตรวจสอบการเปลี่ยนแปลงระหว่างสถานะการสั่น-การหมุนและใช้กันอย่างแพร่หลายเพื่อวัตถุประสงค์ในการวิเคราะห์สเปกตรัม เนื่องจากความถี่การสั่นจำนวนมากของชิ้นส่วนโครงสร้างของโมเลกุลมีลักษณะเฉพาะและเปลี่ยนแปลงเพียงเล็กน้อยเมื่อผ่านจากโมเลกุลหนึ่งไปยังอีกโมเลกุลหนึ่ง ในขณะเดียวกัน อินฟราเรดสเปกโทรสโกปียังทำให้สามารถตัดสินการกำหนดค่าทางเรขาคณิตของสมดุลได้ สเปกตรัมของโมเลกุลในช่วงความถี่แสงและรังสีอัลตราไวโอเลตส่วนใหญ่เกี่ยวข้องกับการเปลี่ยนระหว่างสถานะอิเล็กทรอนิกส์ ผลการวิจัยของพวกเขาคือข้อมูลเกี่ยวกับคุณสมบัติของพื้นผิวที่มีศักยภาพสำหรับสถานะต่างๆ และค่าของค่าคงที่ของโมเลกุลที่กำหนดพื้นผิวที่มีศักยภาพเหล่านี้ ตลอดจนอายุการใช้งานของโมเลกุลในสถานะตื่นเต้นและความน่าจะเป็นของการเปลี่ยนสถานะจากสถานะหนึ่งไปยังอีกสถานะหนึ่ง .
รายละเอียดเกี่ยวกับโครงสร้างทางอิเล็กทรอนิกส์ของโมเลกุล สเปกตรัมอิเล็กตรอนแบบภาพถ่ายและรังสีเอกซ์ รวมถึง Auger spectra ให้ข้อมูลเฉพาะ ซึ่งทำให้สามารถประเมินประเภทความสมมาตรของออร์บิทัลของโมเลกุลและคุณลักษณะของการกระจายความหนาแน่นของอิเล็กตรอนได้ . เลเซอร์สเปกโทรสโกปี (ในช่วงความถี่ต่างๆ) ซึ่งโดดเด่นด้วยการเลือกกระตุ้นที่สูงเป็นพิเศษ ได้เปิดโอกาสมากมายสำหรับการศึกษาแต่ละสถานะของโมเลกุล สเปกโทรสโกปีเลเซอร์แบบพัลซิ่งทำให้สามารถวิเคราะห์โครงสร้างของโมเลกุลอายุสั้นและการเปลี่ยนแปลงของโมเลกุลเป็นสนามแม่เหล็กไฟฟ้าได้
ข้อมูลที่หลากหลายเกี่ยวกับโครงสร้างและคุณสมบัติของโมเลกุลได้มาจากการศึกษาพฤติกรรมของโมเลกุลในสนามไฟฟ้าและสนามแม่เหล็กภายนอก
อย่างไรก็ตาม มีวิธีง่ายๆ แม้ว่าจะไม่ถูกต้องที่สุดในการคำนวณรัศมีของโมเลกุล (หรืออะตอม) ซึ่งขึ้นอยู่กับข้อเท็จจริงที่ว่าโมเลกุลของสารเมื่ออยู่ในสถานะของแข็งหรือของเหลว ถือได้ว่าอยู่ติดกันแน่นขนัด ในกรณีนี้ สำหรับการประมาณคร่าว ๆ เราสามารถสันนิษฐานได้ว่าปริมาณ วีมวลบางส่วน มสารมีค่าเท่ากับผลรวมของปริมาตรของโมเลกุลที่อยู่ในนั้น จากนั้นเราจะได้ปริมาตรของหนึ่งโมเลกุลโดยการหารปริมาตร วีต่อจำนวนโมเลกุล เอ็น.
จำนวนโมเลกุลในมวลสาร มเช่นเดียวกับที่รู้จักกัน
, ที่ไหน ม- มวลโมลาร์ของสาร เอ็น A คือหมายเลขของ Avogadro ดังนั้นปริมาณ วี 0 ของหนึ่งโมเลกุลถูกกำหนดจากความเท่ากันนิพจน์นี้รวมถึงอัตราส่วนของปริมาตรของสารต่อมวล ความสัมพันธ์ที่ตรงกันข้าม
โมเลกุลมีขนาดและรูปร่างต่างๆ เพื่อความชัดเจน เราจะพรรณนาโมเลกุลในรูปของลูกบอล โดยจินตนาการว่ามันถูกปกคลุมด้วยพื้นผิวทรงกลม ซึ่งภายในเป็นเปลือกอิเล็กตรอนของอะตอม (รูปที่ 4, a) ตามแนวคิดสมัยใหม่ โมเลกุลไม่มีเส้นผ่านศูนย์กลางที่กำหนดทางเรขาคณิต ดังนั้นจึงตกลงที่จะใช้ระยะห่างระหว่างจุดศูนย์กลางของโมเลกุลสองตัว (รูปที่ 4b) เป็นเส้นผ่านศูนย์กลาง d ของโมเลกุล ซึ่งใกล้กันมากจนแรงดึงดูดระหว่างกันสมดุลกันโดยแรงผลัก
จากวิชาเคมี "เป็นที่ทราบกันดีว่าหนึ่งกิโลกรัมโมเลกุล (kilomole) ของสารใด ๆ โดยไม่คำนึงถึงสถานะของการรวมตัวนั้นมีจำนวนโมเลกุลเท่ากันเรียกว่า Avogadro number กล่าวคือ N A \u003d 6.02 * 10 26 โมเลกุล
ทีนี้มาประมาณเส้นผ่านศูนย์กลางของโมเลกุลกัน เช่น น้ำ ในการทำเช่นนี้ เราหารปริมาตรของน้ำหนึ่งกิโลโมลด้วยหมายเลข Avogadro น้ำหนึ่งกิโลโมลมีมวล 18 กก.สมมติว่าโมเลกุลของน้ำอยู่ใกล้กันและมีความหนาแน่น 1,000 กก. / ม. 3เราสามารถพูดได้ว่า 1 กมน้ำครอบครองปริมาตร V \u003d 0.018 ม. 3. ปริมาตรต่อโมเลกุลของน้ำ


ใช้โมเลกุลเป็นลูกบอลและใช้สูตรปริมาตรลูกบอล เราคำนวณเส้นผ่านศูนย์กลางโดยประมาณ มิฉะนั้นจะเป็นขนาดเชิงเส้นของโมเลกุลน้ำ:

เส้นผ่านศูนย์กลางของโมเลกุลทองแดง 2.25*10 -10 ม.เส้นผ่านศูนย์กลางของโมเลกุลของก๊าซมีลำดับเดียวกัน ตัวอย่างเช่น เส้นผ่านศูนย์กลางของโมเลกุลไฮโดรเจน 2.47 * 10 -10 ม.คาร์บอนไดออกไซด์ - 3.32*10 -10 ม.โมเลกุลจึงมีเส้นผ่านศูนย์กลางตามลำดับ 10 -10 ม.ตามความยาว 1 ซมสามารถอยู่ใกล้เคียงได้ 100 ล้านโมเลกุล
ลองประมาณมวลของโมเลกุล ตัวอย่างเช่น น้ำตาล (C 12 H 22 O 11) ในการทำเช่นนี้คุณต้องมีน้ำตาลเป็นกิโลโมล (μ = 342.31 กก./กม.)หารด้วยจำนวน Avogadro เช่นจำนวนโมเลกุลใน
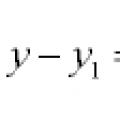 สมการเส้นและเส้นโค้งในระนาบ
สมการเส้นและเส้นโค้งในระนาบ สมการเอกพันธ์ทั่วไป สมการเอกพันธ์ทั่วไปของอันดับสอง
สมการเอกพันธ์ทั่วไป สมการเอกพันธ์ทั่วไปของอันดับสอง ขอบคุณเครื่องหมายจุลภาคเนื่องจากข้อเท็จจริงที่ว่าในพวกเขา
ขอบคุณเครื่องหมายจุลภาคเนื่องจากข้อเท็จจริงที่ว่าในพวกเขา