คุณสมบัติทางเคมีของอารีเนส สูตรทั่วไปและลักษณะเฉพาะของอารีเนส
กเรเนส
อะโรมาติกไฮโดรคาร์บอน (arenes) – ไซคลิกไฮโดรคาร์บอนรวมกันโดยแนวคิดเรื่องอะโรมาติกซิตี้ซึ่งกำหนดลักษณะทั่วไปในโครงสร้างและคุณสมบัติทางเคมี
การจำแนกประเภท
ขึ้นอยู่กับจำนวนวงแหวนของเบนซีนในโมเลกุล อารีนส์จะถูกแบ่งออกเป็นถึง:
โมโนนิวเคลียร์
มัลติคอร์

ระบบการตั้งชื่อและไอโซเมอริซึม
บรรพบุรุษโครงสร้างของไฮโดรคาร์บอนซีรีส์เบนซีนคือ เบนซิน C6H6ซึ่งเป็นที่มาของชื่อที่คล้ายคลึงกันอย่างเป็นระบบ
สำหรับสารประกอบโมโนไซคลิก ชื่อที่ไม่เป็นระบบ (เล็กน้อย) ต่อไปนี้จะยังคงอยู่:

ตำแหน่งขององค์ประกอบทดแทนจะถูกระบุด้วยตัวเลขที่น้อยที่สุด (ทิศทางของการกำหนดหมายเลขไม่สำคัญ)
|
|
|
และสำหรับสารประกอบทดแทนได คุณสามารถใช้สัญลักษณ์ได้ ออร์โธ, เมตาดาต้า, คู่.
|
|
|
|
หากมีตัวสำรอง 3 ตัวในวง ก็ควรได้ตัวเลขต่ำสุดคือ แถว “1,2,4” มีข้อได้เปรียบเหนือ “1,3,4”


1,2-ไดเมทิล-4-เอทิลเบนซีน (ชื่อที่ถูกต้อง) 3,4-ไดเมทิล-1-เอทิลเบนซีน (ชื่อไม่ถูกต้อง)
ไอโซเมอริซึมของเอรีนที่ถูกทดแทนเดี่ยวนั้นเกิดจากโครงสร้างของโครงกระดูกคาร์บอนขององค์ประกอบทดแทน ในได- และโพลิแทนเบนซีนที่คล้ายคลึงกัน จะมีการเพิ่มไอโซเมอร์เพิ่มเติม ซึ่งเกิดจากการจัดเรียงที่แตกต่างกันขององค์ประกอบทดแทนในนิวเคลียส
ไอโซเมอริซึมของอะโรมาติกไฮโดรคาร์บอนที่มีองค์ประกอบ C 9 H 12:
|
|
|
|
|
คุณสมบัติทางกายภาพ
จุดเดือดและจุดหลอมเหลวของเอรีนสูงกว่าอัลเคน อัลคีน อัลคีน โดยมีขั้วเล็กน้อย ไม่ละลายในน้ำ และละลายได้สูงในตัวทำละลายอินทรีย์ที่ไม่มีขั้ว สังเวียนคือของเหลวหรือของแข็งที่มีกลิ่นเฉพาะตัว เบนซีนและอารีนที่ควบแน่นหลายชนิดเป็นพิษ บางส่วนมีคุณสมบัติเป็นสารก่อมะเร็ง ผลิตภัณฑ์ระดับกลางของการเกิดออกซิเดชันของอารีนที่ควบแน่นในร่างกายคืออีพอกไซด์ซึ่งก่อให้เกิดมะเร็งโดยตรงหรือเป็นสารตั้งต้นของสารก่อมะเร็ง
รับสนามกีฬา
อะโรมาติกไฮโดรคาร์บอนหลายชนิดมีความสำคัญในทางปฏิบัติอย่างยิ่งและผลิตขึ้นในระดับอุตสาหกรรมขนาดใหญ่ วิธีการทางอุตสาหกรรมจำนวนหนึ่งขึ้นอยู่กับการแปรรูปถ่านหินและน้ำมัน
น้ำมันประกอบด้วยอะลิฟาติกและอะลิไซคลิกไฮโดรคาร์บอนเป็นส่วนใหญ่ ในการแปลงอะลิฟาติกหรืออะไซคลิกไฮโดรคาร์บอนให้เป็นอะโรมาติกได้มีการพัฒนาวิธีการสำหรับน้ำมันอะโรมาติกซึ่งพื้นฐานทางเคมีได้รับการพัฒนาโดย N.D. เซลินสกี้ ปริญญาตรี คาซานสกี้.
1. วัฏจักรและการดีไฮโดรจีเนชัน:
2. ไฮโดรเดสเมทิลเลชัน:

3. ความคล้ายคลึงกันของเบนซีนถูกเตรียมโดยอัลคิเลชันหรือเอไซเลชัน ตามด้วยรีดักชันของหมู่คาร์บอนิล
ก) อัลคิเลชันของฟรีเดล-คราฟต์:

b) การสังเคราะห์ของ Friedel-Crafts:

4. การเตรียมไบฟีนิลโดยปฏิกิริยา Wurtz-Fitting:
5. การเตรียมไดฟีนิลมีเทนโดยปฏิกิริยาฟรีเดล-คราฟต์:
โครงสร้างและคุณสมบัติทางเคมี
เกณฑ์ความอะโรเมติกส์:
จากการคำนวณทางทฤษฎีและการศึกษาทดลองของระบบคอนจูเกตแบบไซคลิก พบว่าสารประกอบนั้นมีความเป็นอะโรมาติกหากมี:
- วงจรแบน σ-โครงกระดูก;
- ระบบ π-อิเล็กตรอนแบบคอนจูเกตแบบปิด ครอบคลุมอะตอมทั้งหมดของวงแหวนและมี 4n + 2 โดยที่ n = 0, 1, 2, 3 เป็นต้น สูตรนี้เรียกว่ากฎของฮุคเคิล
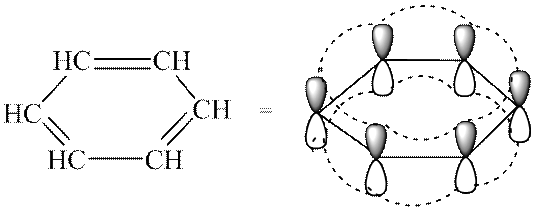
เกณฑ์อะโรมาติกซิตี้ช่วยให้สามารถแยกแยะระบบอะโรมาติกแบบคอนจูเกตจากระบบอื่นๆ ทั้งหมดได้ เบนซีนประกอบด้วยอิเล็กตรอน π จำนวนหนึ่งและอยู่ตามกฎของฮุคเคลที่ n = 1
ความหอมให้อะไร:
แม้จะมีความไม่อิ่มตัวในระดับสูง แต่สารประกอบอะโรมาติกก็สามารถทนต่อสารออกซิไดซ์และอุณหภูมิได้ และมีแนวโน้มที่จะเกิดปฏิกิริยาทดแทนมากกว่าปฏิกิริยาเติม สารประกอบเหล่านี้มีความคงตัวทางอุณหพลศาสตร์เพิ่มขึ้น ซึ่งมั่นใจได้ด้วยพลังงานการคอนจูเกตสูงของระบบวงแหวนอะโรมาติก (150 กิโลจูล/โมล) ดังนั้น สารประกอบเหล่านี้จึงควรเข้าสู่ปฏิกิริยาทดแทน ซึ่งเป็นผลมาจากการที่พวกมันคงความเป็นอะโรมาติกไว้
กลไกของปฏิกิริยาการทดแทนอิเล็กโทรฟิลิกในวงแหวนอะโรมาติก:
ความหนาแน่นของอิเล็กตรอนของระบบคอนจูเกต π ของวงแหวนเบนซีนเป็นเป้าหมายที่สะดวกสำหรับการโจมตีโดยรีเอเจนต์อิเล็กโทรฟิลิก
โดยทั่วไป รีเอเจนต์แบบอิเล็กโตรฟิลิกจะถูกสร้างขึ้นในระหว่างการทำปฏิกิริยาโดยใช้ตัวเร่งปฏิกิริยาและสภาวะที่เหมาะสม
E – Y → E δ + – Y δ - → E + + Y -การก่อตัวของ π-เชิงซ้อน การโจมตีครั้งแรกโดยอิเล็กโทรฟิลของเมฆ π-อิเล็กตรอนของวงแหวน นำไปสู่การประสานกันของรีเอเจนต์กับระบบ π และการก่อตัวของสารเชิงซ้อนประเภทผู้บริจาค-ผู้รับที่เรียกว่าπ-ซับซ้อน

ระบบกลิ่นหอมไม่หยุดชะงัก:การก่อตัวของ σ-เชิงซ้อน ระยะจำกัด ซึ่งอิเล็กโทรฟิลก่อให้เกิดพันธะโควาเลนต์กับอะตอมของคาร์บอนเนื่องจากอิเล็กตรอนสองตัวของระบบ π ของวงแหวน ซึ่งมาพร้อมกับการเปลี่ยนแปลงของอะตอมคาร์บอนนี้จากเอสพี 2 - วีเอสพี 3 -

ความคงตัวของ σ-คอมเพล็กซ์ ดำเนินการโดยนามธรรมของโปรตอนจากคอมเพล็กซ์ σ โดยใช้ฐาน ในกรณีนี้ เนื่องจากอิเล็กตรอนสองตัวของการแตกพันธะโควาเลนต์ C–H ระบบ π แบบปิดของวงแหวนจึงได้รับการฟื้นฟู กล่าวคือ โมเลกุลกลับคืนสู่สถานะอะโรมาติก:

ผลของสารทดแทนต่อปฏิกิริยาและการวางแนวของการทดแทนอิเล็กโทรฟิลิก
สารทดแทนบนวงแหวนเบนซีนขัดขวางการกระจายตัวที่สม่ำเสมอ π- เมฆอิเล็กตรอนของวงแหวนจึงส่งผลต่อปฏิกิริยาของวงแหวน
- องค์ประกอบทดแทนที่บริจาคอิเล็กตรอน (D) จะเพิ่มความหนาแน่นของอิเล็กตรอนของวงแหวนและเพิ่มอัตราการทดแทนด้วยอิเล็กโทรฟิลิก กำลังเปิดใช้งาน
- องค์ประกอบที่ถอนอิเล็กตรอน (A) จะลดความหนาแน่นของอิเล็กตรอนของวงแหวนและลดอัตราการเกิดปฏิกิริยา เรียกว่า การปนเปื้อน
วิธีการได้รับ 1. การเตรียมจากอะลิฟาติกไฮโดรคาร์บอนพวกเขาใช้เพื่อให้ได้มาซึ่งเบนซีนและความคล้ายคลึงกันในอุตสาหกรรม อะโรมาติกไฮโดรคาร์บอนอิ่มตัวที่ประกอบเป็นน้ำมัน เมื่ออัลเคนสายตรงที่ประกอบด้วยอะตอมของคาร์บอนอย่างน้อย 6 อะตอมถูกส่งผ่านไปยังแพลตตินัมหรือโครเมียมออกไซด์ที่ได้รับความร้อน การเกิดดีไฮโดรจีเนชันจะเกิดขึ้นพร้อมกับการปิดวงแหวนพร้อมกัน ( การดีไฮโดรไซไลเซชัน- ในกรณีนี้ เบนซีนได้มาจากเฮกเซน และโทลูอีนได้มาจากเฮปเทน
2. การดีไฮโดรจีเนชันของไซโคลอัลเคนยังนำไปสู่อะโรมาติกไฮโดรคาร์บอน เมื่อต้องการทำเช่นนี้ ไอของไซโคลเฮกเซนและความคล้ายคลึงของมันจะถูกส่งไปยังแพลตตินัมที่ได้รับความร้อน

3.สามารถหาสารเบนซีนได้จาก การตัดแต่งอะเซทิลีนโดยอะเซทิลีนจะถูกส่งผ่านถ่านกัมมันต์ที่อุณหภูมิ 600 °C

4. ความคล้ายคลึงกันของเบนซีนได้มาจากเบนซีนโดยทำปฏิกิริยากับอัลคิลเฮไลด์ต่อหน้าอะลูมิเนียมเฮไลด์ (ปฏิกิริยาอัลคิเลชันหรือปฏิกิริยาฟรีเดล-คราฟต์)

5. เมื่อไหร่ ฟิวชั่นเกลือของกรดอะโรมาติกที่มีอัลคาไล arenes จะถูกปล่อยออกมาในรูปของก๊าซ
คุณสมบัติทางเคมี นิวเคลียสอะโรมาติกซึ่งมีระบบเคลื่อนที่ของอิเล็กตรอนอิเล็กตรอน เป็นวัตถุที่สะดวกสำหรับการโจมตีโดยรีเอเจนต์อิเล็กโทรฟิลิก นอกจากนี้ยังได้รับการอำนวยความสะดวกโดยการจัดเรียงเชิงพื้นที่ของเมฆเออิเล็กตรอนบนทั้งสองด้านของโครงกระดูกแบนของโมเลกุล (ดูรูปที่ 23.1, ข)
ปฏิกิริยาที่พบบ่อยที่สุดสำหรับ arenes คือปฏิกิริยาที่เกิดขึ้นตามกลไก การทดแทนด้วยไฟฟ้าแสดงด้วยสัญลักษณ์ เอส อี(จากภาษาอังกฤษ, การทดแทน, อิเล็กโทรฟิลิก).
กลไก เอส อีสามารถแสดงได้ดังนี้:
ในระยะแรก อนุภาคอิเล็กโทรฟิลิก X จะถูกดึงดูดไปยังเมฆอิเล็กตรอนและก่อตัวเป็นสารเชิงซ้อน n ด้วย อิเล็กตรอน 2 ตัวจากทั้งหมด 6 ตัวของวงแหวนนั้นก่อตัวเป็นพันธะ a ระหว่าง X กับอะตอมของคาร์บอนตัวใดตัวหนึ่ง ในกรณีนี้ ความเป็นอะโรมาติกของระบบจะหยุดชะงัก เนื่องจากมีอิเล็กตรอนเพียงสี่ตัวเท่านั้นที่ยังคงอยู่ในวงแหวน โดยมีการกระจายระหว่างอะตอมของคาร์บอนห้าอะตอม (a-เชิงซ้อน) เพื่อรักษาความเป็นอะโรมาติก เอคอมเพล็กซ์จะปล่อยโปรตอนออกมา และอิเล็กตรอน 2 ตัวของพันธะ C-H จะถูกถ่ายโอนไปยังระบบแอล-อิเล็กตรอน
ปฏิกิริยาต่อไปนี้ของอะโรมาติกไฮโดรคาร์บอนดำเนินการผ่านกลไกของการทดแทนอิเล็กโทรฟิลิก
1. ฮาโลเจนเบนซีนและความคล้ายคลึงกันของมันทำปฏิกิริยากับคลอรีนหรือโบรมีนต่อหน้าตัวเร่งปฏิกิริยา - AlCl 3, FeCl 3, AlBr 3 ที่ไม่มีน้ำ

ปฏิกิริยานี้ทำให้เกิดส่วนผสมจากโทลูอีน ออร์โธ-และพาราไอโซเมอร์ (ดูด้านล่าง) บทบาทของตัวเร่งปฏิกิริยาคือการโพลาไรซ์โมเลกุลฮาโลเจนที่เป็นกลางเพื่อสร้างอนุภาคอิเล็กโทรฟิลิกจากตัวเร่งปฏิกิริยา
2. ไนเตรชันเบนซินทำปฏิกิริยาช้ามากกับกรดไนตริกเข้มข้นแม้ว่าจะถูกความร้อนก็ตาม แต่เมื่อกระทำการ ส่วนผสมไนเตรต(ส่วนผสมของกรดไนตริกและกรดซัลฟิวริกเข้มข้น) ปฏิกิริยาไนเตรตเกิดขึ้นค่อนข้างง่าย
3. ซัลโฟเนชั่น- ปฏิกิริยาเกิดขึ้นได้ง่ายกับกรดซัลฟิวริก "ฟูมิง" (โอเลี่ยม)
- 4. อัลคิเลชันของฟรีเดล-คราฟต์- ดูด้านบนสำหรับวิธีการรับสารที่คล้ายคลึงกันของเบนซีน
- 5. อัลคิเลชันกับอัลคีนปฏิกิริยาเหล่านี้ใช้กันอย่างแพร่หลายในอุตสาหกรรมเพื่อผลิตเอทิลเบนซีนและไอโซโพรพิลเบนซีน (คิวมีน) อัลคิเลชันดำเนินการเมื่อมีตัวเร่งปฏิกิริยา AlC1 3 กลไกการเกิดปฏิกิริยาจะคล้ายกับกลไกของปฏิกิริยาครั้งก่อน
ปฏิกิริยาทั้งหมดที่กล่าวถึงข้างต้นเป็นไปตามกลไก การทดแทนด้วยไฟฟ้า S E .
นอกจากปฏิกิริยาการทดแทนแล้ว อะโรมาติกไฮโดรคาร์บอนยังสามารถเข้าไปได้ ปฏิกิริยาการเติมอย่างไรก็ตามปฏิกิริยาเหล่านี้นำไปสู่การทำลายระบบอะโรมาติกจึงต้องใช้พลังงานจำนวนมากและเกิดขึ้นภายใต้สภาวะที่ไม่เอื้ออำนวยเท่านั้น
6. การเติมไฮโดรเจนเบนซินผลิตโดยการให้ความร้อนและแรงดันสูงโดยมีตัวเร่งปฏิกิริยาโลหะ (Ni, Pt, Pd) เบนซีนจะถูกแปลงเป็นไซโคลเฮกเซน

ความคล้ายคลึงกันของเบนซีนต่อการเกิดไฮโดรจิเนชันทำให้ได้อนุพันธ์ของไซโคลเฮกเซน
7. ฮาโลเจนแบบรุนแรงการทำลายของเบนซีนเกิดขึ้นเมื่อไอของมันทำปฏิกิริยากับคลอรีนภายใต้อิทธิพลของรังสีอัลตราไวโอเลตอย่างหนักเท่านั้น ขณะเดียวกันก็มีน้ำมันเบนซิน แนบคลอรีนสามโมเลกุลและรูปแบบ สินค้าที่เป็นของแข็ง hexachlorocyclohexane (hexachlorane) C 6 H 6 C1 6 (สูตรโครงสร้างไม่ได้ระบุอะตอมไฮโดรเจน)

8. ออกซิเดชันโดยออกซิเจนในอากาศในแง่ของความต้านทานต่อสารออกซิไดซ์เบนซินมีลักษณะคล้ายอัลเคน - ปฏิกิริยาต้องมีสภาวะที่ไม่เอื้ออำนวย ตัวอย่างเช่นการออกซิเดชันของเบนซีนกับออกซิเจนในบรรยากาศเกิดขึ้นเฉพาะเมื่อมีความร้อนสูง (400 ° C) ของไอในอากาศเมื่อมีตัวเร่งปฏิกิริยา V 2 0 5 ผลิตภัณฑ์ - ส่วนผสมของกรดมาลิกและแอนไฮไดรด์

ความคล้ายคลึงกันของเบนซีน คุณสมบัติทางเคมีของเบนซีนคล้ายคลึงกันแตกต่างจากเบนซีนซึ่งเกิดจากการมีอิทธิพลร่วมกันของอัลคิลเรดิคัลและวงแหวนเบนซีน
ปฏิกิริยาลูกโซ่ด้านข้างคุณสมบัติทางเคมีขององค์ประกอบทดแทนอัลคิลบนวงแหวนเบนซีนมีความคล้ายคลึงกับอัลเคน อะตอมไฮโดรเจนในพวกมันจะถูกแทนที่ด้วยฮาโลเจนด้วยกลไกที่รุนแรง (ส อาร์)นั่นเป็นเหตุผล ในกรณีที่ไม่มีตัวเร่งปฏิกิริยา เมื่อได้รับความร้อนหรือการฉายรังสี UV จะเกิดปฏิกิริยาการแทนที่อนุมูลอิสระในห่วงโซ่ด้านข้างอย่างไรก็ตาม อิทธิพลของวงแหวนเบนซีนต่อองค์ประกอบแทนที่อัลคิลนำไปสู่ความจริงที่ว่าไฮโดรเจนที่อะตอมของคาร์บอนที่ถูกพันธะโดยตรงกับวงแหวนเบนซีนนั้นถูกแทนที่ก่อน (a -อะตอมคาร์บอน).
การทดแทนวงแหวนเบนซีนโดยกลไก เอส อีอาจจะ เมื่อมีตัวเร่งปฏิกิริยาเท่านั้น(A1C1 3 หรือ FeCl 3) การเปลี่ยนตัวในวงแหวนเกิดขึ้นที่ ออร์โธ-และพาราตำแหน่งให้กับอัลคิลเรดิคัล

เมื่อโพแทสเซียมเปอร์แมงกาเนตและสารออกซิไดซ์ที่แรงอื่น ๆ ทำปฏิกิริยากับสารเบนซีนที่คล้ายคลึงกัน โซ่ด้านข้างจะถูกออกซิไดซ์ไม่ว่าสายโซ่ขององค์ประกอบทดแทนจะซับซ้อนแค่ไหน มันก็จะถูกทำลาย ยกเว้นอะตอมเอคาร์บอนซึ่งถูกออกซิไดซ์เป็นหมู่คาร์บอกซิล
น้ำมันเบนซินที่คล้ายคลึงกันพร้อมโซ่ด้านเดียวให้ กรดเบนโซอิก

เบนซีนได้มาจากน้ำมันถ่านหินที่เกิดขึ้นระหว่างการโค้กของถ่านหินและน้ำมันโดยใช้วิธีการสังเคราะห์
1. การเตรียมจากอะลิฟาติกไฮโดรคาร์บอนเมื่ออัลเคนสายตรงที่มีคาร์บอนอย่างน้อยหกอะตอมต่อโมเลกุลถูกส่งผ่านไปยังแพลตตินัมหรือโครเมียมออกไซด์ที่ได้รับความร้อน การดีไฮโดรไซไลเซชัน— การก่อตัวของเอรีนโดยการปล่อยไฮโดรเจน: วิธี B.A. Kazansky และ A.F. จาน
2. การดีไฮโดรจีเนชันไซโคลอัลเคน (ND Zelinsky) ปฏิกิริยาเกิดขึ้นโดยการส่งไอของไซโคลเฮกเซนและความคล้ายคลึงของมันไปบนแพลตตินัมที่ได้รับความร้อนที่ 3,000 0 .
3. การได้รับน้ำมันเบนซิน การตัดอะเซทิลีนเหนือถ่านกัมมันต์ที่ 600 0(น.ดี. เซลินสกี้ )
| 3HC?ช | -- 600?ซ? |
4. การรวมเกลือของกรดอะโรมาติกกับอัลคาไลหรือโซดาไลม์:
5. คุณสมบัติทางเคมีของอารีเนส
แกนเบนซินมีความทนทานสูง ปฏิกิริยาที่พบบ่อยที่สุดสำหรับ arenes คือปฏิกิริยาที่เกิดขึ้นตามกลไก การทดแทนด้วยไฟฟ้า แสดงด้วยสัญลักษณ์ S E (จากอิเล็กโทรฟิลิกทดแทนภาษาอังกฤษ)
คุณสมบัติทางเคมีของเบนซีน
1. ปฏิกิริยาการทดแทน:
ฮาโลเจน . เบนซีนไม่ทำปฏิกิริยากับคลอรีนหรือโบรมีนภายใต้สภาวะปกติ ปฏิกิริยาสามารถเกิดขึ้นได้เฉพาะเมื่อมีตัวเร่งปฏิกิริยา - AlCl 3 ปราศจากน้ำ, FeCl 3, AlBr 3 อันเป็นผลมาจากปฏิกิริยาจะเกิด arenes ที่ใช้แทนฮาโลเจน:
บทบาทของตัวเร่งปฏิกิริยาคือการโพลาไรซ์โมเลกุลฮาโลเจนที่เป็นกลางเพื่อสร้างอนุภาคอิเล็กโทรฟิลิกจากนั้น:
ไนเตรชัน . เบนซินทำปฏิกิริยาช้ามากกับกรดไนตริกเข้มข้นแม้ว่าจะถูกความร้อนก็ตาม อย่างไรก็ตามภายใต้การกระทำที่เรียกว่า ส่วนผสมไนเตรต (ส่วนผสมของกรดไนตริกและกรดซัลฟิวริกเข้มข้น) ปฏิกิริยาไนเตรตนั้นค่อนข้างง่าย:
ซัลโฟเนชั่นปฏิกิริยาเกิดขึ้นได้ง่ายภายใต้อิทธิพลของกรดซัลฟิวริก "ควัน" (โอเลี่ยม):
2. อัลคิเลชันของฟรีเดล-คราฟต์. จากผลของปฏิกิริยา หมู่อัลคิลจึงถูกนำเข้าไปในวงแหวนเบนซีนเพื่อผลิตเบนซีนที่คล้ายคลึงกัน ปฏิกิริยาเกิดขึ้นเมื่อเบนซีนสัมผัสกับฮาโลอัลเคนRСlต่อหน้าตัวเร่งปฏิกิริยา - อะลูมิเนียมเฮไลด์ บทบาทของตัวเร่งปฏิกิริยาจะลดลงจนถึงโพลาไรเซชันของโมเลกุลRClด้วยการก่อตัวของอนุภาคอิเล็กโทรฟิลิก:
ขึ้นอยู่กับโครงสร้างของอนุมูลในฮาโลอัลเคน สามารถได้รับความคล้ายคลึงกันของเบนซีนที่แตกต่างกัน:
อัลคิเลชันกับอัลคีนปฏิกิริยาเหล่านี้ใช้กันอย่างแพร่หลายในอุตสาหกรรมเพื่อผลิตเอทิลเบนซีนและไอโซโพรพิลเบนซีน (คิวมีน) อัลคิเลชันดำเนินการโดยมีตัวเร่งปฏิกิริยา AlCl 3 กลไกการเกิดปฏิกิริยาจะคล้ายกับกลไกของปฏิกิริยาก่อนหน้า:
ปฏิกิริยาทั้งหมดที่กล่าวถึงข้างต้นเป็นไปตามกลไก การทดแทนด้วยไฟฟ้า S E . ปฏิกิริยาการเติมเอรีนนำไปสู่การทำลายระบบอะโรมาติกและต้องใช้พลังงานจำนวนมาก ดังนั้นจึงเกิดขึ้นภายใต้สภาวะที่ไม่เอื้ออำนวยเท่านั้น
3. ปฏิกิริยาเติมที่เกี่ยวข้องกับการทำลายพันธะ:
การเติมไฮโดรเจนปฏิกิริยาของการเติมไฮโดรเจนต่อเอรีนเกิดขึ้นภายใต้การให้ความร้อนและแรงดันสูงโดยมีตัวเร่งปฏิกิริยาโลหะ (Ni, Pt, Pd) เบนซินเปลี่ยน ไปจนถึงไซโคลเฮกเซน, ก ความคล้ายคลึงกันของเบนซีน - เป็นอนุพันธ์ของไซโคลเฮกเซน:
ฮาโลเจนแบบรุนแรง. ปฏิกิริยาระหว่างไอน้ำมันเบนซินกับคลอรีนเกิดขึ้นตามกลไกที่รุนแรง ภายใต้อิทธิพลของรังสีอัลตราไวโอเลตอย่างหนักเท่านั้นในกรณีนี้ เบนซินจะรวมกับโมเลกุลและรูปแบบคลอรีนสามโมเลกุล สินค้าที่เป็นของแข็ง -เฮกซาคลอโรไซโคลเฮกเซน (เฮกซะคลอเรน)ค 6 ชั่วโมง 6 คลาส 6:
4. ออกซิเดชันโดยออกซิเจนในบรรยากาศในแง่ของความต้านทานต่อสารออกซิไดซ์ เบนซินมีลักษณะคล้ายอัลเคน เฉพาะเมื่อไอเบนซีนให้ความร้อนสูง (400 °C) พร้อมออกซิเจนในบรรยากาศโดยมีตัวเร่งปฏิกิริยา V 2 O 5 เท่านั้น จะได้ส่วนผสมของกรดมาลิกและแอนไฮไดรด์:
5- เบนซินไหม้. (ดูประสบการณ์) เปลวไฟเบนซินมีควันเนื่องจากมีคาร์บอนสูงในโมเลกุล
2 C 6 H 6 + 15 O 2 → 12CO 2 + 6H 2 O
6- การประยุกต์ใช้สนามกีฬา
เบนซีนและความคล้ายคลึงกันของมันถูกใช้เป็นวัตถุดิบทางเคมีสำหรับการผลิตยา พลาสติก สีย้อม อะซิโตน ฟีนอล และพลาสติกฟอร์มาลดีไฮด์ ยาฆ่าแมลงและสารอินทรีย์อื่นๆ อีกมากมาย ใช้เป็นตัวทำละลายกันอย่างแพร่หลาย เบนซินเป็นสารเติมแต่งช่วยปรับปรุงคุณภาพของน้ำมันเชื้อเพลิงของเครื่องยนต์ เอทิลีนใช้ในการผลิตเอทิลแอลกอฮอล์และโพลีเอทิลีน ช่วยเร่งการสุกของผลไม้ (มะเขือเทศ ผลไม้รสเปรี้ยว) เมื่อนำปริมาณเล็กน้อยเข้าไปในอากาศในเรือนกระจก โพรพิลีนใช้สำหรับการสังเคราะห์กลีเซอรีน แอลกอฮอล์ และสำหรับการผลิตโพรพิลีน ซึ่งใช้ในการผลิตเชือก สายเคเบิล และวัสดุบรรจุภัณฑ์ ยางสังเคราะห์ผลิตจาก 1-บิวทีน
อะเซทิลีนใช้สำหรับการเชื่อมโลหะแบบอัตโนมัติ โพลีเอทิลีนถูกใช้เป็นวัสดุบรรจุภัณฑ์สำหรับการผลิตถุง ของเล่น เครื่องใช้ในบ้าน (ขวด ถัง ชาม ฯลฯ) อะโรมาติกไฮโดรคาร์บอนถูกนำมาใช้กันอย่างแพร่หลายในการผลิตสีย้อม พลาสติก ยาเคมีภัณฑ์ วัตถุระเบิด เส้นใยสังเคราะห์ เชื้อเพลิงรถยนต์ ฯลฯ แหล่งที่มาหลักของอะโรมาติกไฮโดรคาร์บอนคือ ใช้ผลิตภัณฑ์จากถ่านโค้ก ตั้งแต่ 1 ตกม.-อก. เรซินสามารถปล่อยออกมาได้โดยเฉลี่ย: 3.5 กกเบนซิน 1.5 กกโทลูอีน,2 กกแนฟทาลีน การผลิตก.มีความสำคัญอย่างยิ่ง จากไขมันปิโตรเลียมไฮโดรคาร์บอน สำหรับชาวออสเตรเลียบางคน วิธีการสังเคราะห์ล้วนๆ มีความสำคัญในทางปฏิบัติ ดังนั้นเอทิลเบนซีนจึงผลิตจากเบนซีนและเอทิลีนซึ่งการดีไฮโดรจีเนชันจะนำไปสู่สไตรีน
งานควบคุมตนเอง:
1. สารประกอบอะไรที่เรียกว่าอารีน่า?
2. คุณสมบัติทางกายภาพมีลักษณะอย่างไร?
3. งาน.จากเบนซีน 7.8 กรัม จะได้ไนโตรเบนซีน 8.61 กรัม กำหนดผลผลิต (เป็น%) ของผลิตภัณฑ์ที่ทำปฏิกิริยา
อารีน่า(อะโรมาติกไฮโดรคาร์บอน) - สารประกอบที่มีโมเลกุลประกอบด้วยวงแหวนเบนซีนตั้งแต่หนึ่งวงขึ้นไป - กลุ่มไซคลิกของอะตอมคาร์บอนที่มีพันธะเฉพาะ
เบนซีน-สูตรโมเลกุล ค 6 ชั่วโมง 6- เสนอครั้งแรกโดย A. Kekule:
โครงสร้างอารีน่า
มีคาร์บอนอะตอมอยู่ครบ 6 อะตอม เอสพี 2-ไฮบริด อะตอมของคาร์บอนแต่ละอะตอมก่อตัวเป็น 2 σ - พันธะที่มีอะตอมของคาร์บอน 2 อะตอมที่อยู่ใกล้เคียงกันและอะตอมของไฮโดรเจน 1 อะตอมซึ่งอยู่ในระนาบเดียวกัน มุมคือ 120° เหล่านั้น. อะตอมของคาร์บอนทั้งหมดอยู่ในระนาบเดียวกันและก่อตัวเป็นรูปหกเหลี่ยม แต่ละอะตอมมีสารที่ไม่ผสม ร- ถิ่นที่อยู่ซึ่งมีอิเล็กตรอนที่ไม่มีการจับคู่อยู่ วงโคจรนี้ตั้งฉากกับระนาบ ดังนั้น π -เมฆอิเล็กตรอน “กระจาย” ไปทั่วอะตอมของคาร์บอนทั้งหมด:

การเชื่อมต่อทั้งหมดเท่าเทียมกัน พลังงานคอนจูเกตคือปริมาณพลังงานที่ต้องใช้เพื่อทำลายระบบอะโรมาติก
นี่คือสิ่งที่กำหนดคุณสมบัติเฉพาะของเบนซีน - การสำแดงของอะโรมาติก ปรากฏการณ์นี้ถูกค้นพบโดยฮุคเคล และเรียกว่ากฎของฮุคเคล
เอรีน ไอโซเมอริซึม
อารีน่าสามารถแบ่งออกเป็น 2 กลุ่ม:
- อนุพันธ์ของเบนซีน:

- สนามประลองแบบควบแน่น:

สูตรทั่วไปของอารีเนสคือ กับnชม 2 n -6 .
Arenes มีลักษณะพิเศษคือไอโซเมอร์เชิงโครงสร้าง ซึ่งอธิบายได้โดยการจัดเรียงองค์ประกอบแทนที่ในวงแหวนร่วมกัน หากมีองค์ประกอบทดแทน 2 ตัวในวงแหวน พวกเขาสามารถอยู่ใน 3 ตำแหน่งที่แตกต่างกัน - ortho (o-), meta (m-), para (p-):

ถ้าโปรตอนหนึ่งตัวถูก "ดึงออกไป" จากเบนซิน จะเกิดอนุมูลขึ้นมา - ค 6 ชม 5 ซึ่งเรียกว่า อาริล ราดิคัล โปรโตซัว:

Arenes เรียกว่าคำว่า "เบนซิน" ซึ่งบ่งบอกถึงองค์ประกอบทดแทนในสังเวียนและตำแหน่ง:

คุณสมบัติทางกายภาพของสนามกีฬา
สมาชิกชุดแรกเป็นของเหลวไม่มีสีมีกลิ่นเฉพาะตัว ละลายได้ดีในตัวทำละลายอินทรีย์ แต่ไม่ละลายในน้ำ เบนซินเป็นพิษแต่มีกลิ่นหอม ทำให้เกิดอาการปวดศีรษะและเวียนศีรษะ การสูดดมไอในปริมาณมากอาจทำให้หมดสติได้ ระคายเคืองต่อเยื่อเมือกและดวงตา
รับสนามกีฬา
1. จากอะลิฟาติกไฮโดรคาร์บอนโดยใช้ "อะโรมาติเซชัน" ของไฮโดรคาร์บอนอิ่มตัวที่ประกอบเป็นน้ำมัน เมื่อผ่านแพลตตินัมหรือโครเมียมออกไซด์จะเกิดไดไฮโดรไซไลเซชัน:

2. การดีไฮโดรจีเนชันของไซโคลอัลเคน:

3. จากอะเซทิลีน (ไตรเมอร์ไรเซชัน) เมื่อผ่านถ่านหินร้อนที่อุณหภูมิ 600°C:

4. ปฏิกิริยาของฟรีเดล-คราฟต์เมื่อมีอะลูมิเนียมคลอไรด์:

5. การรวมเกลือของกรดอะโรมาติกกับอัลคาไล:
คุณสมบัติทางเคมีของอารีเนส
ปฏิกิริยาการทดแทนเอรีน
แกนกลางมีมือถือ π - ระบบที่ได้รับผลกระทบจากรีเอเจนต์อิเล็กโทรฟิลิก Arenes มีลักษณะเฉพาะด้วยการทดแทนอิเล็กโทรฟิลิก ซึ่งสามารถแสดงได้ดังนี้:

อนุภาคอิเล็กโทรฟิลิกถูกดึงดูด π - ระบบวงแหวน จากนั้นจะเกิดพันธะอันแข็งแกร่งระหว่างรีเอเจนต์ เอ็กซ์และหนึ่งในอะตอมของคาร์บอน ในกรณีนี้ เอกภาพของวงแหวนจะหยุดชะงัก ในการฟื้นฟูความเป็นอะโรมาติก จะต้องปล่อยโปรตอนและอิเล็กตรอน 2 ตัวออกมา ส-เอ็นผ่านเข้าไปในระบบ π ของวงแหวน
1. การฮาโลเจนเกิดขึ้นเมื่อมีตัวเร่งปฏิกิริยา - แอนไฮดรัสคลอไรด์และโบรไมด์ของอลูมิเนียมและเหล็ก:

2. ไนเตรชั่นของเอรีน เบนซีนทำปฏิกิริยาช้ามากกับกรดไนตริกเข้มข้นเมื่อถูกความร้อน แต่ถ้าคุณเติมกรดซัลฟิวริก ปฏิกิริยาจะเกิดขึ้นง่ายมาก:
3. ซัลโฟเนชั่นเกิดขึ้นภายใต้อิทธิพลของกรดซัลฟิวริก 100% - โอเลี่ยม:
4. อัลคิเลชันกับอัลคีน เป็นผลให้เกิดการยืดตัวของโซ่ ปฏิกิริยาเกิดขึ้นเมื่อมีตัวเร่งปฏิกิริยา - อะลูมิเนียมคลอไรด์
อะโรมาติกไฮโดรคาร์บอน– สารประกอบของคาร์บอนและไฮโดรเจนซึ่งมีโมเลกุลประกอบด้วยวงแหวนเบนซีน ตัวแทนที่สำคัญที่สุดของอะโรมาติกไฮโดรคาร์บอนคือเบนซีนและความคล้ายคลึงกัน - ผลิตภัณฑ์ของการแทนที่อะตอมไฮโดรเจนตั้งแต่หนึ่งอะตอมขึ้นไปในโมเลกุลเบนซีนที่มีสารไฮโดรคาร์บอนตกค้าง
โครงสร้างของโมเลกุลเบนซีน
สารประกอบอะโรมาติกชนิดแรกคือ เบนซิน ถูกค้นพบในปี พ.ศ. 2368 โดยเอ็ม. ฟาราเดย์ สร้างสูตรโมเลกุลขึ้น - C 6 H 6 หากเราเปรียบเทียบองค์ประกอบกับองค์ประกอบของไฮโดรคาร์บอนอิ่มตัวที่มีอะตอมคาร์บอนจำนวนเท่ากัน - เฮกเซน (C 6 H 14) เราจะเห็นว่าเบนซีนมีอะตอมไฮโดรเจนน้อยกว่าแปดอะตอม . ดังที่ทราบกันดีว่าการปรากฏตัวของพันธะและวัฏจักรหลายอันทำให้จำนวนอะตอมไฮโดรเจนในโมเลกุลไฮโดรคาร์บอนลดลง ในปี พ.ศ. 2408 F. Kekule ได้เสนอสูตรโครงสร้างเป็นไซโคลเฮกแซนไตรอีน - 1, 3, 5

ดังนั้นโมเลกุลจึงสอดคล้องกัน สูตรเกคูเล่มีพันธะคู่ ดังนั้นเบนซินจะต้องไม่อิ่มตัว กล่าวคือ ต้องเกิดปฏิกิริยาเติมได้ง่าย เช่น ไฮโดรจิเนชัน โบรมีน ไฮเดรชั่น เป็นต้น
อย่างไรก็ตาม ข้อมูลจากการทดลองจำนวนมากแสดงให้เห็นว่าเบนซินจะเกิดปฏิกิริยาการเติมเฉพาะภายใต้สภาวะที่ไม่เอื้ออำนวย (ที่อุณหภูมิและแสงสว่างสูง) และสามารถทนต่อการเกิดออกซิเดชันได้ ปฏิกิริยาที่มีลักษณะเฉพาะมากที่สุดคือปฏิกิริยาทดแทน ดังนั้น เบนซีนจึงมีลักษณะใกล้เคียงกับไฮโดรคาร์บอนส่วนขอบมากขึ้น
นักวิทยาศาสตร์หลายคนพยายามอธิบายความคลาดเคลื่อนเหล่านี้เสนอทางเลือกต่างๆ สำหรับโครงสร้างของเบนซีน ในที่สุดโครงสร้างของโมเลกุลเบนซีนก็ได้รับการยืนยันจากปฏิกิริยาการก่อตัวจากอะเซทิลีน ในความเป็นจริง พันธะคาร์บอน-คาร์บอนในเบนซีนมีความเท่าเทียมกัน และคุณสมบัติของพวกมันไม่เหมือนกับพันธะเดี่ยวหรือพันธะคู่
ในปัจจุบัน เบนซินแสดงด้วยสูตร Kekule หรือเป็นรูปหกเหลี่ยมซึ่งมีวงกลมปรากฏอยู่
![]()
แล้วโครงสร้างของเบนซีนมีความพิเศษอย่างไร? จากข้อมูลและการคำนวณของผู้วิจัย สรุปได้ว่าอะตอมของคาร์บอนทั้ง 6 อะตอมอยู่ในสถานะหนึ่ง เอสพี 2 - การผสมพันธุ์และอยู่ในระนาบเดียวกัน ไม่ผสมพันธุ์ พี- วงโคจรของอะตอมคาร์บอนที่ประกอบเป็นพันธะคู่ (สูตรคีคูเล) ตั้งฉากกับระนาบของวงแหวนและขนานกัน
พวกมันทับซ้อนกันทำให้เกิดระบบ π เดียว ดังนั้น ระบบการสลับพันธะคู่ที่แสดงไว้ในสูตรของ Kekulé จึงเป็นระบบวงจรของพันธะคู่ที่ทับซ้อนกัน ระบบนี้ประกอบด้วยบริเวณวงแหวนวงแหวน (คล้ายโดนัท) สองบริเวณที่มีความหนาแน่นของอิเล็กตรอนซึ่งอยู่ที่ด้านใดด้านหนึ่งของวงแหวนเบนซีน ดังนั้นจึงมีเหตุผลมากกว่าที่จะพรรณนาเบนซีนเป็นรูปหกเหลี่ยมปกติที่มีวงกลมอยู่ตรงกลาง (ระบบ π) มากกว่าในรูปของไซโคลเฮกซาไตรอีน-1,3,5 
นักวิทยาศาสตร์ชาวอเมริกัน L. Pauling เสนอให้เป็นตัวแทนของเบนซีนในรูปแบบของโครงสร้างขอบเขตสองอันที่แตกต่างกันในการกระจายตัวของความหนาแน่นของอิเล็กตรอนและเปลี่ยนรูปเป็นกันและกันอย่างต่อเนื่องนั่นคือ พิจารณาว่าเป็นสารประกอบระดับกลาง "เฉลี่ย" ของโครงสร้างทั้งสอง
การวัดความยาวพันธบัตรยืนยันสมมติฐานเหล่านี้ พบว่าพันธะ C-C ในเบนซีนมีความยาวเท่ากัน (0.139 นาโนเมตร) พวกมันสั้นกว่าพันธะ C-C เดี่ยวเล็กน้อย (0.154 นาโนเมตร) และยาวกว่าพันธะคู่ (0.132 นาโนเมตร) เล็กน้อย
นอกจากนี้ยังมีสารประกอบที่โมเลกุลมีโครงสร้างเป็นวงกลมหลายแบบ

ไอโซเมอริซึมและระบบการตั้งชื่อ
ความคล้ายคลึงกันของเบนซีนมีลักษณะเฉพาะคือ ไอโซเมอริซึมของตำแหน่งขององค์ประกอบย่อยหลายตัว- ความคล้ายคลึงกันที่ง่ายที่สุดของเบนซีน - โทลูอีน (เมทิลเบนซีน) - ไม่มีไอโซเมอร์ดังกล่าว ความคล้ายคลึงต่อไปนี้ถูกนำเสนอเป็นไอโซเมอร์สี่ตัว:

พื้นฐานของชื่ออะโรมาติกไฮโดรคาร์บอนที่มีองค์ประกอบย่อยเล็กน้อยคือคำว่า เบนซิน- อะตอมในวงแหวนอะโรมาติกจะถูกเรียงลำดับจากองค์ประกอบทดแทนสูงสุดไปต่ำสุด:

ตามระบบการตั้งชื่อแบบเก่าจะมีการเรียกตำแหน่งที่ 2 และ 6 orthopositions, 4 - คู่-และ 3 และ 5 - บทบัญญัติเมตา
คุณสมบัติทางกายภาพ
ภายใต้สภาวะปกติ เบนซินและความคล้ายคลึงที่ง่ายที่สุดของมันคือของเหลวที่เป็นพิษมากและมีกลิ่นอันไม่พึงประสงค์ พวกมันละลายในน้ำได้ไม่ดี แต่ละลายได้ดีในตัวทำละลายอินทรีย์
คุณสมบัติทางเคมีของเบนซีน
ปฏิกิริยาการทดแทน- อะโรเมติกไฮโดรคาร์บอนเกิดปฏิกิริยาทดแทน
1. โบรมีน.เมื่อทำปฏิกิริยากับโบรมีนต่อหน้าตัวเร่งปฏิกิริยา ไอรอนโบรไมด์ (ΙΙΙ) อะตอมไฮโดรเจนตัวหนึ่งในวงแหวนเบนซีนจะถูกแทนที่ด้วยอะตอมโบรมีน:

2. การไนเตรตของเบนซีนและความคล้ายคลึงของเบนซีน- เมื่ออะโรมาติกไฮโดรคาร์บอนทำปฏิกิริยากับกรดไนตริกต่อหน้ากรดซัลฟิวริก (ส่วนผสมของกรดซัลฟูริกและกรดไนตริกเรียกว่าส่วนผสมไนเตรต) อะตอมไฮโดรเจนจะถูกแทนที่ด้วยกลุ่มไนโตร -NO2:

โดยการลดไนโตรเบนซีนที่เกิดขึ้นในปฏิกิริยานี้ จะได้สวรรค์ซึ่งเป็นสารที่ใช้เพื่อให้ได้สีย้อมสวรรค์:

ปฏิกิริยานี้ตั้งชื่อตาม Zinin นักเคมีชาวรัสเซีย
ปฏิกิริยาการเติมสารประกอบอะโรเมติกยังสามารถเกิดปฏิกิริยาเติมกับวงแหวนเบนซีนได้ ในกรณีนี้จะเกิดไซโคลเฮกเซนหรืออนุพันธ์ของมัน
1. การเติมไฮโดรเจน- ตัวเร่งปฏิกิริยาไฮโดรจิเนชันของเบนซีนเกิดขึ้นที่อุณหภูมิสูงกว่าการเติมไฮโดรเจนของอัลคีน:
![]()
2. คลอรีนปฏิกิริยาเกิดขึ้นเมื่อถูกส่องสว่างด้วยแสงอัลตราไวโอเลตและเป็นอนุมูลอิสระ:

ความคล้ายคลึงกันของเบนซีน
องค์ประกอบของโมเลกุลสอดคล้องกับสูตร C n H 2 n-6 ความคล้ายคลึงกันของเบนซีนที่ใกล้เคียงที่สุดคือ:
ความคล้ายคลึงกันทั้งหมดของเบนซีนที่ตามหลังโทลูอีนจะมีไอโซเมอร์ ไอโซเมอร์ริซึมสามารถเชื่อมโยงกับทั้งจำนวนและโครงสร้างขององค์ประกอบทดแทน (1, 2) และกับตำแหน่งขององค์ประกอบทดแทนในวงแหวนเบนซีน (2, 3, 4) สารประกอบตามสูตรทั่วไป C 8 H 10:

ตามระบบการตั้งชื่อแบบเก่าที่ใช้ระบุตำแหน่งสัมพัทธ์ขององค์ประกอบทดแทนที่เหมือนกันหรือต่างกันสองตัวบนวงแหวนเบนซีน จะใช้คำนำหน้า ออร์โธ- (ตัวย่อ o-) - องค์ประกอบทดแทนอยู่ที่อะตอมคาร์บอนใกล้เคียง เมตา-(ม-) – ผ่านอะตอมคาร์บอนหนึ่งอะตอมและ คู่— (n-) – สารทดแทนซึ่งกันและกัน
สมาชิกกลุ่มแรกของซีรีส์เบนซีนที่คล้ายคลึงกันคือของเหลวที่มีกลิ่นเฉพาะ พวกมันเบากว่าน้ำ เป็นตัวทำละลายที่ดี
ปฏิกิริยาที่คล้ายคลึงกันของเบนซีน การทดแทน (โบรมีน, ไนเตรชัน) โทลูอีนถูกออกซิไดซ์โดยเปอร์แมงกาเนตเมื่อถูกความร้อน:

สารที่คล้ายคลึงกันของเบนซีนถูกใช้เป็นตัวทำละลายในการผลิตสีย้อม ผลิตภัณฑ์อารักขาพืช พลาสติก และยา




























 บทบาทของครูประจำชั้นในการปรับปรุงคุณภาพและประสิทธิผลของงานการศึกษา การประชุมครูประจำชั้นเมื่อต้นปีการศึกษา
บทบาทของครูประจำชั้นในการปรับปรุงคุณภาพและประสิทธิผลของงานการศึกษา การประชุมครูประจำชั้นเมื่อต้นปีการศึกษา ใครถือเป็นผู้สร้างทฤษฎีภูมิคุ้มกันระดับเซลล์?
ใครถือเป็นผู้สร้างทฤษฎีภูมิคุ้มกันระดับเซลล์? การนำเสนอในหัวข้อ "เด็กกับนก" A
การนำเสนอในหัวข้อ "เด็กกับนก" A