สถาบันกฎหมายและความมั่นคงแห่งชาติ ประสบการณ์การทำงานทั้งหมด
สารทั้งหมดตามความสามารถในการนำกระแสไฟฟ้าในสารละลายหรือในสถานะหลอมเหลวสามารถแบ่งออกเป็นสองกลุ่ม: อิเล็กโทรไลต์และไม่ใช่อิเล็กโทรไลต์
อิเล็กโทรไลต์เป็นสารที่มีสารละลายหรือละลายนำกระแสไฟฟ้า อิเล็กโทรไลต์ ได้แก่ กรด เบส และเกลือ
ไม่ใช่อิเล็กโทรไลต์คือสารที่สารละลายหรือละลายไม่นำกระแสไฟฟ้า ยกตัวอย่างสารอินทรีย์หลายชนิด
ความสามารถของอิเล็กโทรไลต์ (ตัวนำประเภท II) ในการทำกระแสไฟฟ้านั้นแตกต่างโดยพื้นฐานจากค่าการนำไฟฟ้าของโลหะ (ตัวนำประเภทที่ 1): ค่าการนำไฟฟ้าของโลหะเกิดจากการเคลื่อนที่ของอิเล็กตรอนและค่าการนำไฟฟ้าของอิเล็กโทรไลต์สัมพันธ์กับ การเคลื่อนไหวของไอออน
พบว่าในสารละลายของกรด เบส และเกลือ ค่าที่พบจากการทดลองของ p, tcrystal, tboil, pcm นั้นมากกว่าค่าที่คำนวณทางทฤษฎีสำหรับสารละลายเดียวกันโดยพิจารณาจากความเข้มข้นของโมลใน ฉันครั้งหนึ่ง ( ฉัน- สัมประสิทธิ์ไอโซโทนิก) นอกจากนี้จำนวนอนุภาคในสารละลาย NaCl เพิ่มขึ้นเกือบ 2 เท่าและในสารละลาย CaCl2 - 3 เท่า
เพื่ออธิบายลักษณะเฉพาะของพฤติกรรมของอิเล็กโทรไลต์ นักวิทยาศาสตร์ชาวสวีเดน S. Arrhenius ในปี พ.ศ. 2430 ได้เสนอทฤษฎีที่เรียกว่า ทฤษฎีการแยกตัวด้วยไฟฟ้า- สาระสำคัญของทฤษฎีมีดังนี้:
- 1. เมื่ออิเล็กโทรไลต์ละลายในน้ำ จะสลายตัว (แยกตัวออก) ออกเป็นอนุภาคที่มีประจุ (ไอออน) - แคตไอออนที่มีประจุบวก (Na+, K+, Ca2+, H+) และแอนไอออนที่มีประจุลบ (Cl-, SO42-, CO32-, OH-) คุณสมบัติของไอออนแตกต่างอย่างสิ้นเชิงจากอะตอมที่ก่อตัวขึ้น เรียกว่าการสลายตัวของสารที่เป็นกลางเป็นไอออนอันเป็นผลมาจากปฏิกิริยาทางเคมีกับตัวทำละลาย การแยกตัวด้วยไฟฟ้า
- 2. ภายใต้อิทธิพลของกระแสไฟฟ้า ไอออนจะได้รับการเคลื่อนที่ในทิศทาง: แคตไอออนจะเคลื่อนไปทางอิเล็กโทรดที่มีประจุลบ (แคโทด) แอนไอออนจะเคลื่อนไปทางอิเล็กโทรดที่มีประจุบวก (แอโนด)
- 3. การแยกตัวเป็นกระบวนการที่ย้อนกลับได้และสมดุล ซึ่งหมายความว่าควบคู่ไปกับการสลายตัวของโมเลกุลเป็นไอออน (การแยกตัว) มีกระบวนการรวมไอออนเป็นโมเลกุล (การเชื่อมโยง): KA K+ + A-
- 4. ในสารละลาย ไอออนจะอยู่ในสถานะไฮเดรต
ในการหาปริมาณการแยกตัวด้วยไฟฟ้า จะใช้แนวคิดนี้ ระดับการแยกตัวด้วยไฟฟ้า() - อัตราส่วนของจำนวนโมเลกุลที่สลายตัวเป็นไอออนต่อจำนวนโมเลกุลที่ละลายทั้งหมด ระดับของการแยกตัวออกจากกันถูกกำหนดโดยเชิงประจักษ์และแสดงเป็นเศษส่วนหรือเปอร์เซ็นต์ ระดับการแยกตัวด้วยไฟฟ้าขึ้นอยู่กับลักษณะของตัวทำละลายและตัวถูกละลาย อุณหภูมิและความเข้มข้นของสารละลาย:
- 1. ยิ่งตัวทำละลายมีขั้วมากเท่าใด ระดับการแยกตัวของอิเล็กโทรไลต์ก็จะยิ่งสูงขึ้นเท่านั้น
- 2. สารที่มีพันธะขั้วไอออนิกและโควาเลนต์จะเกิดการแยกตัว
- 3. การเพิ่มขึ้นของอุณหภูมิจะทำให้อิเล็กโทรไลต์อ่อนแตกตัวมากขึ้น
- 4. เมื่อความเข้มข้นของอิเล็กโทรไลต์ลดลง (เจือจาง) ระดับของการแยกตัวจะเพิ่มขึ้น
ขึ้นอยู่กับระดับของการแยกตัว อิเล็กโทรไลต์แบบมีเงื่อนไข (ที่ความเข้มข้นของสารละลาย 0.1 M) จะถูกแบ่งออกเป็น:
ขึ้นอยู่กับประเภทของไอออนที่เกิดขึ้นระหว่างการแยกตัว อิเล็กโทรไลต์ทั้งหมดสามารถแบ่งออกเป็นกรด เบส และเกลือได้
กรด- อิเล็กโทรไลต์ที่แยกตัวออกจากกันด้วยการก่อตัวของแคตไอออน H+ เท่านั้นและกากที่เป็นกรด (Cl- - คลอไรด์, NO3- - ไนเตรต, SO42- - ซัลเฟต, HCO3 ไบคาร์บอเนต, CO32 คาร์บอเนต) ตัวอย่างเช่น: HCl H++Cl-, H2SO4 2H++SO42-
การมีอยู่ของไฮโดรเจนไอออนหรือที่เรียกให้เจาะจงกว่าคือไอออน H3O+ ในสารละลายกรดจะเป็นตัวกำหนดคุณสมบัติทั่วไปของกรด (รสเปรี้ยว ผลต่อตัวชี้วัด ปฏิกิริยากับด่าง ปฏิกิริยากับโลหะที่มีการปล่อยไฮโดรเจน ฯลฯ)
ในกรดโพลีบาซิก การแยกตัวจะเกิดขึ้นเป็นขั้นตอน โดยแต่ละขั้นตอนมีลักษณะเฉพาะตามระดับการแยกตัวของมันเอง ดังนั้นกรดออร์โธฟอสฟอริกจึงแยกตัวออกในสามขั้นตอน:
|
ฉันแสดงบนเวที |
H3PO4 เอช+ + H2PO4- |
|
|
เวทีที่สอง |
H2PO4- H+ + HPO42- |
|
|
ระยะที่สาม |
HPO42- H+ + PO43- |
และ 3<2<1, т.е. распад электролита на ионы протекает, в основном, по первой ступени и в растворе ортофосфорной кислоты будут находиться преимущественно ионы Н+ и H2РO4-. Причины этого в том, что ионы водорода значительно сильнее притягиваются к трехзарядному иону РO43- и двухзарядному иону HРO42-, чем к однозарядному H2РO4-. Кроме того, на 2-ой и 3-ей ступенях имеет место смещение равновесия в сторону исходной формы по принципу Ле-Шателье за счет накапливающихся ионов водорода.
เหตุผล- อิเล็กโทรไลต์ที่แยกตัวออกเป็นเพียงไอออนไฮดรอกไซด์ (OH-) เป็นแอนไอออน หลังจากการแยก OH- แล้ว แคตไอออนจะยังคงมีอยู่: Na+, Ca2+, NH4+ ตัวอย่างเช่น: NaOH Na+ + OH-, Ca(OH)2 Ca2+ + 2 OH-
คุณสมบัติทั่วไปของเบส (ความเป็นสบู่เมื่อสัมผัส, ผลต่อตัวบ่งชี้, ปฏิกิริยากับกรด ฯลฯ ) จะถูกกำหนดโดยการมีอยู่ของกลุ่มไฮดรอกโซ OH- ในสารละลายของเบส
เบสโพลีแอซิดมีลักษณะเฉพาะโดยการแยกตัวแบบขั้นตอน:
|
ฉันแสดงบนเวที |
บริติชแอร์เวย์(OH)2 บริติชแอร์เวย์(OH)+ + OH- |
|
เวทีที่สอง |
บา(OH)+ Ba2+ + OH- |
การแยกตัวของแอมโฟเทอริกไฮดรอกไซด์เกิดขึ้นทั้งในรูปแบบเบสและกรด ดังนั้นการแยกตัวของซิงค์ไฮดรอกไซด์สามารถดำเนินการในทิศทางต่อไปนี้ (ในกรณีนี้ ความสมดุลจะเปลี่ยนไปขึ้นอยู่กับสภาพแวดล้อมตามหลักการของเลอชาเตอลิเยร์):
เกลือ- สิ่งเหล่านี้คืออิเล็กโทรไลต์ที่แยกตัวออกเป็นไอออนบวกของโลหะ (หรือกลุ่มที่เข้ามาแทนที่) และไอออนของกรดที่ตกค้าง
เกลือปานกลางแยกตัวออกอย่างสมบูรณ์: CuSO4 Cu2+ + SO42- ต่างจากเกลือทั่วไป เกลือที่เป็นกรดและเกลือพื้นฐานจะแยกตัวออกตามขั้นตอน:
|
ฉันแสดงบนเวที |
NaНСО3 Na+ + НСО3- |
Cu(OH)Cl Cu(OH)+ + Cl- |
|
เวทีที่สอง |
HCO3- H+ + CO32- |
Cu(OH)+ Cu2+ + OH-, |
นอกจากนี้ระดับการแยกตัวของเกลือในขั้นตอนที่สองยังมีน้อยมาก
แลกเปลี่ยนปฏิกิริยาในสารละลายอิเล็กโทรไลต์- นี่คือปฏิกิริยาระหว่างไอออน เงื่อนไขที่จำเป็นสำหรับการเกิดปฏิกิริยาการแลกเปลี่ยนในสารละลายอิเล็กโทรไลต์คือการก่อตัวของสารประกอบหรือสารประกอบที่แยกตัวออกอย่างอ่อนที่ปล่อยออกมาจากสารละลายในรูปของตะกอนหรือก๊าซ
เมื่อเขียนสมการปฏิกิริยาในรูปแบบไอออนิก - โมเลกุล สารประกอบที่แยกตัวออกอย่างอ่อน ก๊าซและละลายได้น้อยจะถูกเขียนในรูปแบบ โมเลกุลและอิเล็กโทรไลต์เข้มข้นที่ละลายน้ำได้ - ในรูปแบบ ไอออนเมื่อเขียนสมการไอออนิก คุณควรปฏิบัติตามตารางความสามารถในการละลายของกรด เบส และเกลือในน้ำ (ภาคผนวก A)
เรามาดูเทคนิคการเขียนสมการไอออนิกโดยใช้ตัวอย่างกัน
ตัวอย่างที่ 1เขียนสมการปฏิกิริยาในรูปแบบไอออนิก-โมเลกุล:
BaCl2 + K2SO4 = BaSO4 + 2KCl
สารละลาย: เกลือเป็นอิเล็กโทรไลต์เข้มข้นและแยกตัวออกเป็นไอออนเกือบทั้งหมด เนื่องจาก BaSO4 เป็นสารประกอบที่ไม่ละลายน้ำในทางปฏิบัติ (ดูตารางในภาคผนวก A) ส่วนหลักของแบเรียมซัลเฟตจะอยู่ในรูปแบบที่ไม่แยกออกจากกัน ดังนั้นเราจะเขียนสารนี้ในรูปของโมเลกุลและเกลือที่เหลือซึ่งละลายได้อยู่ใน รูปแบบของไอออน:
Ba2+ + 2Cl- + 2K+ + SO42- = BaSO4 + 2K+ + 2Cl-
ดังที่เห็นได้จากสมการไอออน-โมเลกุลที่สมบูรณ์ที่ได้ออกมา K+ และ Cl- ไอออนไม่มีปฏิสัมพันธ์กัน ดังนั้น หากไม่รวมพวกมันเข้าด้วยกัน เราจึงได้สมการไอออน-โมเลกุลแบบสั้น:
Ba2+ + SO42- = BaSO4,
ลูกศรบ่งชี้ว่าสารที่เป็นผลเกิดการตกตะกอน
สมการไอออนิกสามารถใช้แทนปฏิกิริยาใดๆ ที่เกิดขึ้นในสารละลายระหว่างอิเล็กโทรไลต์ได้ นอกจากนี้ แก่นแท้ของปฏิกิริยาเคมียังสะท้อนให้เห็นในสมการไอออน-โมเลกุลสั้นๆ จากสมการไอออน-โมเลกุล คุณสามารถเขียนสมการโมเลกุลได้อย่างง่ายดาย
ตัวอย่างที่ 2จับคู่สมการโมเลกุลกับสมการไอออนิก-โมเลกุลต่อไปนี้: 2H+ + S2- = H2S
สารละลาย: ไฮโดรเจนไอออนเกิดขึ้นระหว่างการแยกตัวของกรดแก่ใดๆ เช่น HCl สำหรับไฮโดรเจนไอออนในสมการไอออนิกแบบสั้น คุณต้องเติมคลอรีนไอออนสองตัว ควรเติมแคตไอออน (เช่น 2K+) ลงในซัลไฟด์ไอออนเพื่อสร้างอิเล็กโทรไลต์ที่ละลายน้ำได้และแยกตัวได้ดี จากนั้นจะต้องเขียนไอออนเดียวกันทางด้านขวา จากนั้นสมการไอออน-โมเลกุลและโมเลกุลที่สมบูรณ์จะมีลักษณะดังนี้:
- 2H+ + 2Cl- + 2K+ + S2- = H2S + 2K+ + 2Cl-
- 2 HCl + K2S = H2S + 2 KCl-
คุณเคยสงสัยบ้างไหมว่าเหตุใดวิธีแก้ปัญหาบางอย่างจึงนำไฟฟ้าและบางวิธีก็ไม่นำไฟฟ้า? ตัวอย่างเช่น ทุกคนรู้ดีว่าไม่ควรอาบน้ำขณะเป่าผมให้แห้งจะดีกว่า ท้ายที่สุดแล้วน้ำเป็นตัวนำกระแสไฟฟ้าที่ดีและหากเครื่องเป่าผมที่ใช้งานได้ตกลงไปในน้ำก็ไม่สามารถหลีกเลี่ยงได้ ที่จริงแล้วน้ำไม่ใช่ตัวนำกระแสไฟฟ้าที่ดีนัก มีวิธีแก้ไขที่สามารถนำไฟฟ้าได้ดีกว่ามาก สารดังกล่าวเรียกว่าอิเล็กโทรไลต์ ซึ่งรวมถึงกรด ด่าง และเกลือที่ละลายน้ำได้
อิเล็กโทรไลต์ - พวกเขาเป็นใคร?
คำถามเกิดขึ้น: เหตุใดสารละลายของสารบางชนิดจึงส่งกระแสไฟฟ้าในขณะที่สารบางชนิดไม่ส่งกระแสไฟฟ้า? ทุกอย่างเกี่ยวกับอนุภาคที่มีประจุ - แคตไอออนและแอนไอออน เมื่อละลายในน้ำ อิเล็กโทรไลต์จะแตกตัวเป็นไอออน ซึ่งเมื่อสัมผัสกับกระแสไฟฟ้าจะเคลื่อนที่ไปในทิศทางที่กำหนด แคตไอออนที่มีประจุบวกจะเคลื่อนที่เข้าหาขั้วลบ แคโทด และแอนไอออนที่มีประจุลบจะเคลื่อนที่เข้าหาขั้วบวกซึ่งก็คือแอโนด กระบวนการสลายตัวของสารให้เป็นไอออนเมื่อละลายหรือละลายในน้ำ เรียกอย่างภาคภูมิใจว่าการแยกตัวด้วยไฟฟ้า
คำนี้บัญญัติโดยนักวิทยาศาสตร์ชาวสวีเดน เอส. อาร์เรเนียส เมื่อเขาศึกษาคุณสมบัติของสารละลายในการส่งกระแสไฟฟ้า เมื่อต้องการทำเช่นนี้ เขาได้ลัดวงจรสารบางอย่างโดยใช้สารละลายและตรวจดูว่าหลอดไฟติดหรือไม่ หากหลอดไฟสว่างขึ้น แสดงว่าสารละลายนั้นนำไฟฟ้า ซึ่งนำไปสู่ข้อสรุปว่าสารนี้คืออิเล็กโทรไลต์ หากหลอดไฟยังดับอยู่ แสดงว่าสารละลายไม่นำไฟฟ้า ดังนั้น สารนี้จึงไม่ใช่อิเล็กโทรไลต์ สารที่ไม่ใช่อิเล็กโทรไลต์ ได้แก่ สารละลายน้ำตาล แอลกอฮอล์ และกลูโคส แต่สารละลายของเกลือแกงและกรดซัลฟิวริกนำไฟฟ้าได้ดีดังนั้นจึงเกิดการแยกตัวด้วยไฟฟ้า
ความแตกแยกเกิดขึ้นได้อย่างไร?
ต่อจากนั้นทฤษฎีการแยกตัวด้วยไฟฟ้าได้รับการพัฒนาและเสริมโดยนักวิทยาศาสตร์ชาวรัสเซีย I.A. Kablukov และ V.A. Kistyakovsky ประยุกต์ใช้ทฤษฎีเคมีของการแก้ปัญหาโดย D.I. เมนเดเลเยฟ.
นักวิทยาศาสตร์เหล่านี้พบว่าการแยกตัวของกรด ด่าง และเกลือด้วยไฟฟ้าเกิดขึ้นอันเป็นผลมาจากการให้ความชุ่มชื้นของอิเล็กโทรไลต์ ซึ่งก็คือปฏิกิริยาของมันกับโมเลกุลของน้ำ ไอออน แคตไอออน และแอนไอออนที่เกิดขึ้นจากกระบวนการนี้จะถูกทำให้ชุ่มชื้น ซึ่งก็คือเกี่ยวข้องกับโมเลกุลของน้ำที่ล้อมรอบพวกมันในวงแหวนหนาแน่น คุณสมบัติแตกต่างอย่างมากจากไอออนที่ไม่มีน้ำ
ดังนั้นในสารละลายของสตรอนเซียมไนเตรต Sr(NO3)2 เช่นเดียวกับในสารละลายของซีเซียมไฮดรอกไซด์ CsOH การแยกตัวด้วยไฟฟ้าจึงเกิดขึ้น ตัวอย่างของกระบวนการนี้สามารถแสดงได้ดังนี้:
ซีเนียร์(NO3)2 = ซีอาร์2+ + 2NO3 -,
เหล่านั้น. เมื่อแยกตัวออกจากโมเลกุลของสตรอนเซียมไนเตรตหนึ่งโมเลกุลจะเกิดไอออนบวกสตรอนเทียมหนึ่งอันและแอนไอออนไนเตรต 2 อัน
CsOH = Cs+ + OH-,
เหล่านั้น. การแยกตัวของโมเลกุลซีเซียมไฮดรอกไซด์หนึ่งโมเลกุลจะทำให้เกิดซีเซียมไอออนบวกหนึ่งตัวและไอออนไฮดรอกไซด์หนึ่งตัว
การแยกตัวของกรดด้วยไฟฟ้าก็เกิดขึ้นเช่นเดียวกัน สำหรับกรดไฮโดรไอโอดิก กระบวนการนี้สามารถแสดงได้ด้วยสมการต่อไปนี้:
เหล่านั้น. การแยกตัวของกรดไฮโดรไอโอดิกหนึ่งโมเลกุลจะทำให้เกิดไฮโดรเจนไอออนบวกหนึ่งตัวและไอออนไอโอดีนหนึ่งตัว
กลไกการแยกตัว
การแยกตัวด้วยไฟฟ้าของสารอิเล็กโทรไลต์เกิดขึ้นในหลายขั้นตอน สำหรับสารที่มีพันธะไอออนิก เช่น NaCl, NaOH กระบวนการนี้ประกอบด้วยกระบวนการตามลำดับสามกระบวนการ:
ประการแรก โมเลกุลของน้ำซึ่งมีขั้วตรงข้าม 2 ขั้ว (บวกและลบ) และเป็นตัวแทนของไดโพล จะถูกวางตัวที่ไอออนของคริสตัล พวกมันจะถูกยึดด้วยขั้วบวกกับไอออนลบของคริสตัลและในทางกลับกันด้วยขั้วลบ - กับไอออนบวกของคริสตัล
จากนั้นไอออนของคริสตัลจะถูกทำให้ชุ่มชื้นด้วยไดโพลน้ำ
และหลังจากนั้นเท่านั้น ไอออนไฮเดรตดูเหมือนจะแตกต่างไปในทิศทางที่ต่างกัน และเริ่มเคลื่อนที่แบบสุ่มในสารละลายหรือละลายจนกว่าจะได้รับผลกระทบจากสนามไฟฟ้า
สำหรับสาร เช่น HCl และกรดอื่นๆ กระบวนการแยกตัวจะคล้ายกัน ยกเว้นว่าในระยะเริ่มแรก การเปลี่ยนจากพันธะโควาเลนต์ไปเป็นพันธะไอออนิกเกิดขึ้นเนื่องจากการกระทำของไดโพลน้ำ นี่คือประเด็นหลักของทฤษฎีการแยกตัวของสาร
ปีที่สำเร็จการศึกษาจาก TSU ตั้งชื่อตาม G.R. เดอร์ซาวินา: 2006.
คณะ/สาขาวิชาเฉพาะ:สถาบันนิติศาสตร์/นิติศาสตร์
เมืองที่พำนัก:ตัมบอฟ
ชื่องาน:รองศาสตราจารย์ภาควิชากฎหมายแพ่ง
คำอธิบายของความสำเร็จ:ผู้สมัครสาขานิติศาสตร์
อาชีพ:
ในปี 2549 เธอสำเร็จการศึกษาด้วยเกียรตินิยมจากสถาบันกฎหมายแห่งมหาวิทยาลัยแห่งรัฐ Tambov จี.อาร์. เดอร์ชาวิน.
ตั้งแต่ปีพ. ศ. 2549 ถึง พ.ศ. 2551 มีการดำเนินกิจกรรมภาคปฏิบัติในสาขากฎหมายและการบัญชี ในปี 2009 เธอปกป้องวิทยานิพนธ์ระดับปริญญาเอกของเธอในสาขาพิเศษ 12.00.01 – “ทฤษฎีและประวัติศาสตร์กฎหมายและรัฐ; ประวัติศาสตร์หลักคำสอนเกี่ยวกับกฎหมายและรัฐ”
ตั้งแต่ปี 2551 ถึง 2553 เธอทำงานเป็นอาจารย์ที่สาขา Tambov ของมหาวิทยาลัยมอสโกของกระทรวงกิจการภายในของรัสเซีย
ตั้งแต่ปี 2554 เขาทำงานที่สถาบันกฎหมายของ Tambov State University จี.อาร์. Derzhavin (สถาบันกฎหมายและความมั่นคงแห่งชาติตั้งแต่ปี 2558): ตั้งแต่ปี 2554 - ที่ภาควิชากฎหมายรัฐธรรมนูญการบริหารและการเงินของสถาบันกฎหมายแห่งมหาวิทยาลัยแห่งรัฐ Tambov จี.อาร์. Derzhavin ตั้งแต่ปี 2555 - ที่ภาควิชากฎหมายการเงินและการบริหาร และตั้งแต่ปี 2556 - ที่ภาควิชากฎหมายแพ่ง
เกี่ยวกับการเรียนที่ TSU:
เข้าสู่ปีที่ 1 ของสถาบันนิติศาสตร์ TSU ตั้งชื่อตาม G.R. เดอร์ชาวินในปี 2544 ดูเหมือนจะไม่มีคำถามว่าจะหาการศึกษาระดับอุดมศึกษาได้ที่ไหน ชัดเจน - TSU ตั้งชื่อตาม จี.อาร์. เดอร์ซาวินา ฉันเลือกความพิเศษของฉันตามความต้องการของฉันเอง ฉันเชื่อว่าในทางนิติศาสตร์มีโอกาสที่จะตระหนักถึงศักยภาพสูงสุดของตนเอง เนื่องจากวิชาชีพด้านกฎหมายนั้นมีความเป็นไปได้ในการเลือกสถานที่ทำงานและการเลือกลักษณะเฉพาะของงานมากขึ้น เมื่อเลือกสาขาวิชาพิเศษ ฉันยังยึดตามความคิดเห็นที่แพร่หลายและเป็นที่ยอมรับโดยทั่วไปว่าวิชาชีพทางกฎหมายเป็นที่ต้องการและมีชื่อเสียงมากที่สุด
การเรียนที่สถาบันต้องใช้ความพยายามและความพยายามอย่างมาก แต่ยิ่งฉันเรียนรู้มากเท่าไรก็ยิ่งมีความสนใจในการรับความรู้ใหม่มากขึ้นเท่านั้น ยิ่งมั่นใจว่าการเลือกอาชีพถูกต้องมากขึ้นเท่าใด แรงจูงใจในการปรับปรุงคุณสมบัติของฉันก็จะมากขึ้นเท่านั้น ควรแสดงความขอบคุณเป็นพิเศษต่ออาจารย์ผู้สอน ต้องขอบคุณการทำงานและความปรารถนาที่จะถ่ายทอดความรู้และทักษะให้กับเรา เราจึงมั่นใจเสมอว่าเราได้รับการศึกษาที่มีคุณภาพ ไม่มีข้อสงสัยแม้แต่น้อยว่าไม่มีปัญหาทางวิทยาศาสตร์หรือการปฏิบัติที่สามารถต้านทานความรู้และประสบการณ์ของพวกเขาได้
ปัจจุบันฉันทำงานเป็นครูด้วย งานนี้ทั้งยากและน่าสนใจในเวลาเดียวกัน ขนาดของมันน่าทึ่งมาก: การสัมมนา การบรรยาย โต๊ะกลม การประชุมในระดับต่างๆ การสื่อสารกับผู้คน กับตัวแทนจากโครงสร้างของรัฐ เทศบาล และเอกชนต่างๆ การทำงานในมหาวิทยาลัยช่วยให้คุณมีความรู้สึกเคลื่อนไหวตลอดเวลา
การเลือกอาชีพควรมีสติ และแต่ละคนสามารถรับรู้ได้มากเพียงใดในช่วงปีการศึกษาหนึ่ง ๆ แต่ละคนจะตรวจสอบหลังจากผ่านไประยะหนึ่งหรือหลายทศวรรษต่อมา และนั่นคือสาเหตุว่าทำไมการเลือกอย่างมีสติและถูกต้องสำหรับตัวคุณเองจึงเป็นเรื่องสำคัญมาก งานของทนายความเป็นงานสากล น่าสนใจ น่าตื่นเต้น สามารถเปิดเผยบุคลิกภาพของตนเองได้ ขณะเดียวกันก็มีทางเลือกมากมายในการตระหนักถึงความสามารถและการเติบโตในอาชีพของตน
ซื่อสัตย์และซื่อสัตย์กับเด็กๆ โดยไม่ปิดบังจากพวกเขา สิ่งที่เกิดขึ้นในจิตวิญญาณเป็นเพียงการศึกษาเท่านั้น
แอล.เอ็น. ตอลสตอย
การศึกษาเป็นกระบวนการที่ซับซ้อนหลายแง่มุม โดย A.S. Makarenko เขียนว่า “การศึกษาเป็นกระบวนการทางสังคมในความหมายที่กว้างที่สุด โดยให้ความรู้ทุกอย่าง ทั้งผู้คน สิ่งของ ปรากฏการณ์ แต่ก่อนอื่นและที่สำคัญที่สุดคือ ผู้คน ในจำนวนนี้ ครูต้องมาก่อน”
เกี่ยวกับฉัน
ฉันมีประสบการณ์สอนมา 27 ปี โดย 18 ปีในจำนวนนั้นฉันทำงานในโรงเรียนประจำสำหรับเด็กที่มีความพิการ สำเร็จการศึกษาจากวิทยาลัยการสอนการสุข
ฉันเสียสละตัวเองอย่างไม่เห็นแก่ตัวมาหลายปีแล้ว
สู่ดวงวิญญาณดวงใจของเด็กๆ อย่างไม่หยุดยั้ง
ฉันทำให้ทุกคนอบอุ่นด้วยความรักของฉันอย่างดีที่สุดเท่าที่จะทำได้
และเธอขอความสุขจากพระเจ้าโดยอธิษฐานตอนกลางคืน
ฉันไม่สามารถเป็นแม่ที่แท้จริงสำหรับพวกเขาได้
แต่เขาก็ยังเป็นคนที่รักเสมอ
ยุติธรรม เอาใจใส่ และที่สำคัญที่สุด -
ช่วยให้ฉันใช้ชีวิตในวัยเด็กเมื่อต้องอยู่ไกลบ้าน
ฉันปาดน้ำตาออกจากตาลูกๆ โดยไม่คิดอะไร
พันเข่าของฉัน ถุงเท้าถักนิตติ้ง
เธอร้องเพลงกล่อมเด็กกระซิบอย่างลับๆ
และจิตวิญญาณของฉันก็ถูกฉีกขาดจากความเศร้าโศกอันแสนสาหัส
ยิ้มอย่างเปิดเผยแต่ใจกลับร้องไห้
เธอกดดันฉันให้อยู่กับตัวเองขอร้องการให้อภัย
ว่าฉันอยู่ที่นี่และไม่ใช่แม่ทางสายเลือดของฉัน
ยืนอยู่ข้างลูกสาวตัวน้อยของฉัน
เราโตกันแล้ว กระจายไปทั่วโลกด้วยความหวัง
สร้างความสุขและหาบ้าน...
ฉันอยู่กับลูกคนอื่น และอีกครั้งเหมือนเมื่อก่อน
ฉันพยายามผ่านวัยเด็กด้วยความรัก
หนังสือที่หล่อหลอมโลกภายในของฉัน
Makarenko "บทกวีการสอน", Sukhomlinsky "ฉันมอบหัวใจให้กับเด็ก ๆ ", Ushinsky "เกี่ยวกับการศึกษา"
มุมมองของฉันต่อโลก
“เด็กรู้วิธีที่จะรักคนที่รักเขา - และเขาสามารถถูกเลี้ยงดูมาด้วยความรักเท่านั้น” Felix Dzerzhinsky
ฉันคิดว่า: สิ่งสำคัญคือรูปแบบ
สร้าง, ปั้น, ปั้น,
ฉันคิดว่า: แสดงเส้นทางที่ถูกต้องให้ฉันดู
แก้ไข เยียวยา สอน.
ฉันคิดว่า: ฉีก, ต่อสู้, สับ,
รีบเร่งตราบเท่าที่ความแข็งแกร่งพาคุณไป
แต่ปรากฎว่า - แค่รัก
รักเท่านั้น. แค่นั้นแหละ.
เอส.วี. เบโลวา
ความสำเร็จของฉัน
พ.ศ. 2558 ร่วมสัมมนา “การสนับสนุนรายบุคคลสำหรับนักเรียนที่มีความพิการในกระบวนการศึกษา
จดหมายแสดงความขอบคุณจากผู้อำนวยการโรงเรียนประจำปี 2558 สำหรับความเป็นมืออาชีพและทัศนคติที่ละเอียดอ่อน ความเอาใจใส่และเอาใจใส่นักเรียน
ปี 2559 ขอขอบคุณที่เข้าร่วมโครงการ “สายรุ้ง ในวัยเด็ก”
2017 ประกาศนียบัตรการมีส่วนร่วมอย่างแข็งขันในสัปดาห์ของครู "Broad Maslenitsa"
2017 ได้รับใบรับรองการมีส่วนร่วมในการแข่งขันระดับภูมิภาคครั้งที่ 3 แห่งความเป็นเลิศด้านการสอน "ความเป็นมืออาชีพด้านการสอนในการปฏิบัติงานของระบบการศึกษาสมัยใหม่"
2017 ภายใต้การนำของฉัน นักเรียนได้มีส่วนร่วมในเทศกาลสร้างสรรค์ระดับภูมิภาค "เด็กพิเศษ - ความสามารถพิเศษ"
2017 ร่วมสัมมนาชุด “การสร้างขีดความสามารถเฉพาะทางในการทำงานกับเด็กกำพร้าและเด็กที่ไม่มีผู้ปกครองดูแล ครอบครัวอุปถัมภ์ ครอบครัวที่ประสบปัญหาในการเลี้ยงดูและพัฒนาเด็ก
2018 ประกาศนียบัตรการเข้าร่วมงานเทศกาลระดับภูมิภาค "โรงเรียน ความคิดสร้างสรรค์ ความสำเร็จ"
ปี 2561 ความกตัญญูจากผู้อำนวยการสำหรับการทำงานที่ประสบผลสำเร็จมาหลายปี
2018 เข้าร่วมการประชุมทางวิทยาศาสตร์และการปฏิบัติระหว่างภูมิภาค เรื่อง “การศึกษาของคนพิการ: การขัดเกลาทางสังคมในโลกที่เปลี่ยนแปลง”
2561 ประกาศนียบัตรแห่งชัยชนะ (อันดับที่ 1) ในการแข่งขันระดับภูมิภาคที่จัดขึ้นที่พอร์ทัลการศึกษา All-Russian "การตรัสรู้" ในการเสนอชื่อเพื่อการพัฒนาระเบียบวิธีที่ดีที่สุด
ประกาศนียบัตรผู้ชนะประจำปี 2019 (อันดับที่ 2) ในการแข่งขันระดับภูมิภาคที่จัดขึ้นที่พอร์ทัลการศึกษา All-Russian "การตรัสรู้" ในการเสนอชื่อเข้าชิงโปรแกรมผู้เขียนที่ดีที่สุด
2019 ภายใต้การนำของฉัน นักเรียนได้มีส่วนร่วมในกิจกรรมการแข่งขันระดับภูมิภาคที่จัดขึ้นที่พอร์ทัลการศึกษา All-Russian "การตรัสรู้" ในหมวดมัณฑนศิลป์และประยุกต์ ผลการเข้าร่วม: ผู้ชนะอันดับที่ 1
2019 ภายใต้การนำของฉัน นักเรียนได้มีส่วนร่วมในการแข่งขันสร้างสรรค์ All-Russian "Horizons of Pedagogy" การเสนอชื่อ: "ศิลปะการตกแต่งและประยุกต์" ผลการเข้าร่วม: ผู้ชนะ (อันดับที่ 3)
ผลงานของฉัน
มีศาสตร์แห่งการศึกษาคือการสอน แต่การเลี้ยงดูคนนั้นเป็นศิลปะมากกว่า และไม่มีหนังสือใดที่สามารถสอนศิลปะนี้ได้ งานของครูมีความซับซ้อนและหลากหลาย ผู้ที่รักในอาชีพของตนทำงานด้วยความกระตือรือร้นและแรงบันดาลใจ ความรักที่ครูมีต่ออาชีพที่เขาเลือกนั้นแสดงออกมาเป็นหลักในความรักที่เขามีต่อเด็กๆ และไม่ใช่แค่เพียงไม่กี่คนที่ได้รับเลือกเท่านั้น แต่สำหรับเด็กทุกคนด้วย มีความยืดหยุ่นและยาก คล่องแคล่วและเชื่องช้า ขี้อายและมีชีวิตชีวา อวดดีและสุภาพ ลักษณะเฉพาะของความรักนี้คือการวางแนวการสอนและความระมัดระวัง ความต้องการและความเคารพต่อเด็กสูง ความมีน้ำใจที่สมเหตุสมผลและความรุนแรงต่อพวกเขา “เพื่อที่จะเป็นครูที่แท้จริงของเด็กๆ” V.A. Sukhomlinsky กล่าว “คุณต้องมอบหัวใจให้กับพวกเขา”
เพิ่มใบรับรองให้กับพอร์ตโฟลิโอ







หากต้องการจำกัดผลการค้นหาให้แคบลง คุณสามารถปรับแต่งข้อความค้นหาของคุณโดยการระบุฟิลด์ที่จะค้นหา รายการฟิลด์แสดงไว้ด้านบน ตัวอย่างเช่น:
คุณสามารถค้นหาได้หลายช่องพร้อมกัน:
ตัวดำเนินการเชิงตรรกะ
ตัวดำเนินการเริ่มต้นคือ และ.
ผู้ดำเนินการ และหมายความว่าเอกสารจะต้องตรงกับองค์ประกอบทั้งหมดในกลุ่ม:
การพัฒนางานวิจัย
ผู้ดำเนินการ หรือหมายความว่าเอกสารจะต้องตรงกับค่าใดค่าหนึ่งในกลุ่ม:
ศึกษา หรือการพัฒนา
ผู้ดำเนินการ ไม่ไม่รวมเอกสารที่มีองค์ประกอบนี้:
ศึกษา ไม่การพัฒนา
ประเภทการค้นหา
เมื่อเขียนแบบสอบถาม คุณสามารถระบุวิธีการค้นหาวลีได้ รองรับสี่วิธี: การค้นหาโดยคำนึงถึงสัณฐานวิทยาของบัญชี โดยไม่มีสัณฐานวิทยา การค้นหาคำนำหน้า การค้นหาวลี
ตามค่าเริ่มต้น การค้นหาจะดำเนินการโดยคำนึงถึงสัณฐานวิทยาของบัญชี
หากต้องการค้นหาโดยไม่มีสัณฐานวิทยา เพียงใส่เครื่องหมาย "ดอลลาร์" หน้าคำในวลี:
$ ศึกษา $ การพัฒนา
หากต้องการค้นหาคำนำหน้า คุณต้องใส่เครื่องหมายดอกจันหลังข้อความค้นหา:
ศึกษา *
หากต้องการค้นหาวลี คุณต้องใส่เครื่องหมายคำพูดคู่:
" การวิจัยและพัฒนา "
ค้นหาตามคำพ้องความหมาย
หากต้องการรวมคำพ้องความหมายในผลการค้นหา คุณต้องใส่แฮช " #
" หน้าคำหรือหน้านิพจน์ในวงเล็บ
เมื่อนำไปใช้กับคำเดียวจะพบคำพ้องความหมายได้มากถึงสามคำ
เมื่อนำไปใช้กับนิพจน์ที่อยู่ในวงเล็บ หากพบคำพ้องความหมายจะถูกเพิ่มลงในแต่ละคำ
เข้ากันไม่ได้กับการค้นหาที่ไม่มีสัณฐานวิทยา การค้นหาคำนำหน้า หรือการค้นหาวลี
# ศึกษา
การจัดกลุ่ม
หากต้องการจัดกลุ่มวลีค้นหา คุณต้องใช้วงเล็บปีกกา สิ่งนี้ช่วยให้คุณควบคุมตรรกะบูลีนของคำขอได้
ตัวอย่างเช่น คุณต้องส่งคำขอ: ค้นหาเอกสารที่ผู้เขียนคือ Ivanov หรือ Petrov และชื่อเรื่องมีคำว่า research or development:
ค้นหาคำโดยประมาณ
สำหรับการค้นหาโดยประมาณคุณต้องใส่เครื่องหมายตัวหนอน " ~ " ที่ส่วนท้ายของคำจากวลี ตัวอย่างเช่น:
โบรมีน ~
เมื่อค้นหาจะพบคำเช่น "โบรมีน", "เหล้ารัม", "อุตสาหกรรม" ฯลฯ
คุณสามารถระบุจำนวนการแก้ไขที่เป็นไปได้เพิ่มเติมได้: 0, 1 หรือ 2 ตัวอย่างเช่น:
โบรมีน ~1
ตามค่าเริ่มต้น อนุญาตให้แก้ไขได้ 2 ครั้ง
เกณฑ์ความใกล้ชิด
หากต้องการค้นหาตามเกณฑ์ความใกล้เคียง คุณต้องใส่เครื่องหมายตัวหนอน " ~ " ที่ท้ายวลี เช่น หากต้องการค้นหาเอกสารที่มีคำว่า research and development ภายใน 2 คำ ให้ใช้ข้อความค้นหาต่อไปนี้:
" การพัฒนางานวิจัย "~2
ความเกี่ยวข้องของการแสดงออก
หากต้องการเปลี่ยนความเกี่ยวข้องของนิพจน์แต่ละรายการในการค้นหา ให้ใช้เครื่องหมาย " ^
" ที่ส่วนท้ายของนิพจน์ ตามด้วยระดับความเกี่ยวข้องของนิพจน์นี้สัมพันธ์กับนิพจน์อื่นๆ
ยิ่งระดับสูงเท่าใด นิพจน์ก็จะยิ่งมีความเกี่ยวข้องมากขึ้นเท่านั้น
ตัวอย่างเช่น ในสำนวนนี้ คำว่า "การวิจัย" มีความเกี่ยวข้องมากกว่าคำว่า "การพัฒนา" ถึงสี่เท่า:
ศึกษา ^4 การพัฒนา
ตามค่าเริ่มต้น ระดับคือ 1 ค่าที่ถูกต้องคือจำนวนจริงบวก
ค้นหาภายในช่วงเวลาหนึ่ง
หากต้องการระบุช่วงเวลาที่ควรระบุค่าของฟิลด์คุณควรระบุค่าขอบเขตในวงเล็บโดยคั่นด้วยตัวดำเนินการ ถึง.
จะมีการเรียงลำดับพจนานุกรม
ข้อความค้นหาดังกล่าวจะส่งกลับผลลัพธ์โดยผู้เขียนโดยเริ่มจาก Ivanov และลงท้ายด้วย Petrov แต่ Ivanov และ Petrov จะไม่รวมอยู่ในผลลัพธ์
หากต้องการรวมค่าในช่วง ให้ใช้วงเล็บเหลี่ยม หากต้องการยกเว้นค่า ให้ใช้เครื่องหมายปีกกา
 สมการลอการิทึม
สมการลอการิทึม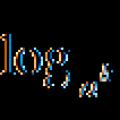 เทคนิคการแก้สมการลอการิทึม
เทคนิคการแก้สมการลอการิทึม การวิเคราะห์ตนเองของครูนักบำบัดการพูด
การวิเคราะห์ตนเองของครูนักบำบัดการพูด