สัญลักษณ์องค์ประกอบทางเคมีของซิลิคอน ซิลิคอนในธรรมชาติ (25.8% ในเปลือกโลก)
- การกำหนด - ศรี (ซิลิคอน);
- ระยะเวลา - III;
- กลุ่ม - 14 (IVa);
- มวลอะตอม - 28.0855;
- เลขอะตอม - 14;
- รัศมีอะตอม = 132 น.;
- รัศมีโควาเลนต์ = 231 น.;
- การกระจายอิเล็กตรอน - 1s 2 2s 2 2p 6 3s 2 3p 2 ;
- อุณหภูมิหลอมละลาย = 1412°C;
- จุดเดือด = 2355°C;
- อิเล็กโทรเนกาติวีตี้ (อ้างอิงจาก Pauling/อ้างอิงจาก Alpred และ Rochow) = 1.90/1.74;
- สถานะออกซิเดชัน: +4, +2, 0, -4;
- ความหนาแน่น (หมายเลข) = 2.33 g/cm3;
- ปริมาตรฟันกราม = 12.1 ซม. 3 /โมล
สารประกอบซิลิกอน:
ซิลิคอนถูกแยกออกครั้งแรกในรูปแบบบริสุทธิ์ในปี พ.ศ. 2354 (J. L. Gay-Lussac และ L. J. Tenard ของฝรั่งเศส) ซิลิกอนธาตุบริสุทธิ์ได้รับมาในปี ค.ศ. 1825 (ชาวสวีเดน เจ. เจ. เบอร์เซลิอุส) องค์ประกอบทางเคมีได้รับชื่อ "ซิลิคอน" (แปลจากภาษากรีกโบราณว่าภูเขา) ในปี พ.ศ. 2377 (นักเคมีชาวรัสเซีย G. I. Hess)
ซิลิคอนเป็นองค์ประกอบทางเคมีที่พบได้ทั่วไป (รองจากออกซิเจน) บนโลก (มีอยู่ในเปลือกโลกประมาณ 28-29% โดยน้ำหนัก) ในธรรมชาติ ซิลิคอนมักมีอยู่ในรูปของซิลิกา (ทราย ควอตซ์ หินเหล็กไฟ เฟลด์สปาร์) เช่นเดียวกับในซิลิเกตและอะลูมิโนซิลิเกต ในรูปแบบบริสุทธิ์ ซิลิคอนนั้นหายากมาก ซิลิเกตธรรมชาติหลายชนิดในรูปแบบบริสุทธิ์เป็นอัญมณี: มรกต, บุษราคัม, อความารี - ทั้งหมดนี้เป็นซิลิคอน ผลึกซิลิคอนบริสุทธิ์ (IV) ออกไซด์เกิดขึ้นในรูปของหินคริสตัลและควอตซ์ ซิลิคอนออกไซด์ซึ่งมีสิ่งสกปรกต่าง ๆ ก่อตัวเป็นหินมีค่าและกึ่งมีค่า - อเมทิสต์, อาเกต, แจสเปอร์

ข้าว. โครงสร้างของอะตอมซิลิคอน
การกำหนดค่าทางอิเล็กทรอนิกส์ของซิลิคอนคือ 1s 2 2s 2 2p 6 3s 2 3p 2 (ดูโครงสร้างอิเล็กทรอนิกส์ของอะตอม) ที่ระดับพลังงานภายนอก ซิลิคอนมีอิเล็กตรอน 4 ตัว โดย 2 ตัวจับคู่กันในระดับย่อย 3s + 2 ตัวไม่จับคู่ใน p-ออร์บิทัล เมื่ออะตอมของซิลิคอนเปลี่ยนไปสู่สถานะตื่นเต้น อิเล็กตรอนหนึ่งตัวจากระดับย่อย s “ออกจาก” คู่ของมันและเคลื่อนไปยังระดับย่อย p ซึ่งมีวงโคจรอิสระหนึ่งวง ดังนั้น ในสภาวะตื่นเต้น โครงสร้างทางอิเล็กทรอนิกส์ของอะตอมซิลิคอนจึงมีรูปแบบดังนี้: 1s 2 2s 2 2p 6 3s 1 3p 3

ข้าว. การเปลี่ยนอะตอมของซิลิคอนไปสู่สถานะตื่นเต้น
ดังนั้น ซิลิคอนในสารประกอบสามารถแสดงวาเลนซีเป็น 4 (บ่อยที่สุด) หรือ 2 (ดูวาเลนซี) ซิลิคอน (เช่นเดียวกับคาร์บอน) ที่ทำปฏิกิริยากับองค์ประกอบอื่น ๆ ก่อให้เกิดพันธะเคมีซึ่งสามารถให้อิเล็กตรอนและยอมรับพวกมันได้ แต่ความสามารถในการรับอิเล็กตรอนในอะตอมของซิลิคอนนั้นเด่นชัดน้อยกว่าในอะตอมของคาร์บอน เนื่องจากมีซิลิคอนขนาดใหญ่กว่า อะตอม.
สถานะออกซิเดชันของซิลิคอน:
- -4 : SiH 4 (ไซเลน), Ca 2 Si, Mg 2 Si (ซิลิเกตโลหะ);
- +4 - เสถียรที่สุด: SiO 2 (ซิลิคอนออกไซด์), H 2 SiO 3 (กรดซิลิก), ซิลิเกตและซิลิคอนเฮไลด์
- 0 : สิ (สารธรรมดา)
ซิลิคอนเป็นสารธรรมดา
ซิลิคอนเป็นสารผลึกสีเทาเข้มที่มีความมันวาวของโลหะ ผลึกซิลิคอนเป็นสารกึ่งตัวนำ
ซิลิคอนก่อรูปการปรับเปลี่ยนแบบ allotropic เพียงครั้งเดียว คล้ายกับเพชร แต่ไม่แข็งแรงเท่า เนื่องจากพันธะ Si-Si ไม่แข็งแรงเท่าในโมเลกุลคาร์บอนของเพชร (ดูเพชร)
ซิลิคอนอสัณฐาน- ผงสีน้ำตาล มีจุดหลอมเหลว 1420°C
ผลึกซิลิคอนได้มาจากซิลิคอนอสัณฐานโดยการตกผลึกซ้ำ ซึ่งแตกต่างจากซิลิคอนอสัณฐานซึ่งเป็นสารเคมีที่ค่อนข้างออกฤทธิ์ ซิลิกอนแบบผลึกมีความเฉื่อยมากกว่าในแง่ของปฏิสัมพันธ์กับสารอื่นๆ
โครงสร้างของโครงตาข่ายคริสตัลของซิลิคอนจะทำซ้ำโครงสร้างของเพชร - แต่ละอะตอมถูกล้อมรอบด้วยอะตอมอีกสี่อะตอมซึ่งอยู่ที่จุดยอดของจัตุรมุข อะตอมถูกยึดเข้าด้วยกันด้วยพันธะโควาเลนต์ซึ่งไม่แข็งแรงเท่ากับพันธะคาร์บอนในเพชร ด้วยเหตุนี้ถึงแม้จะไม่มีก็ตาม พันธะโควาเลนต์บางส่วนในผลึกซิลิกอนแตกออก ส่งผลให้มีการปล่อยอิเล็กตรอนออกมา ทำให้ซิลิคอนมีค่าการนำไฟฟ้าเพียงเล็กน้อย เมื่อซิลิคอนร้อนขึ้น ท่ามกลางแสงหรือเมื่อมีการเติมสิ่งเจือปนลงไป จำนวนพันธะโควาเลนต์ที่แตกออกจะเพิ่มขึ้น ส่งผลให้จำนวนอิเล็กตรอนอิสระเพิ่มขึ้น และดังนั้น ค่าการนำไฟฟ้าของซิลิคอนก็เพิ่มขึ้นด้วย
คุณสมบัติทางเคมีของซิลิคอน
เช่นเดียวกับคาร์บอน ซิลิคอนสามารถเป็นได้ทั้งตัวรีดิวซ์และตัวออกซิไดซ์ ขึ้นอยู่กับว่าสารใดที่ทำปฏิกิริยากับสารนั้น
เลขที่. ซิลิคอนทำปฏิกิริยากับฟลูออรีนเท่านั้น ซึ่งอธิบายได้ด้วยโครงตาข่ายคริสตัลที่ค่อนข้างแข็งแกร่งของซิลิคอน
ซิลิคอนทำปฏิกิริยากับคลอรีนและโบรมีนที่อุณหภูมิเกิน 400°C
ซิลิคอนทำปฏิกิริยากับคาร์บอนและไนโตรเจนที่อุณหภูมิสูงมากเท่านั้น
- ในการทำปฏิกิริยากับอโลหะ ซิลิคอนจะทำหน้าที่ดังนี้ สารรีดิวซ์:
- ภายใต้สภาวะปกติจากอโลหะซิลิคอนจะทำปฏิกิริยากับฟลูออรีนเท่านั้นทำให้เกิดซิลิคอนเฮไลด์:
ศรี + 2F 2 = SiF 4 - ที่อุณหภูมิสูง ซิลิคอนทำปฏิกิริยากับคลอรีน (400°C) ออกซิเจน (600°C) ไนโตรเจน (1,000°C) คาร์บอน (2000°C):
- Si + 2Cl 2 = SiCl 4 - ซิลิคอนเฮไลด์;
- Si + O 2 = SiO 2 - ซิลิคอนออกไซด์;
- 3Si + 2N 2 = Si 3 N 4 - ซิลิคอนไนไตรด์;
- Si + C = SiC - คาร์บอรันดัม (ซิลิคอนคาร์ไบด์)
- ภายใต้สภาวะปกติจากอโลหะซิลิคอนจะทำปฏิกิริยากับฟลูออรีนเท่านั้นทำให้เกิดซิลิคอนเฮไลด์:
- ในการทำปฏิกิริยากับโลหะจะมีซิลิคอนเป็น ตัวออกซิไดซ์(ขึ้นรูป ซาลิไซด์:
ศรี + 2มก. = มก. 2 ศรี - ในการทำปฏิกิริยากับสารละลายเข้มข้นของอัลคาลิส ซิลิคอนจะทำปฏิกิริยากับการปล่อยไฮโดรเจน ทำให้เกิดเกลือที่ละลายน้ำได้ของกรดซิลิซิก เรียกว่า ซิลิเกต:
ศรี + 2NaOH + H 2 O = นา 2 SiO 3 + 2H 2 - ซิลิคอนไม่ทำปฏิกิริยากับกรด (ยกเว้น HF)
การเตรียมและการใช้ซิลิคอน
การได้รับซิลิคอน:
- ในห้องปฏิบัติการ - จากซิลิกา (อลูมิเนียมบำบัด):
3SiO 2 + 4Al = 3Si + 2Al 2 O 3 - ในอุตสาหกรรม - โดยการลดซิลิคอนออกไซด์ด้วยโค้ก (ซิลิคอนบริสุทธิ์ทางเทคนิค) ที่อุณหภูมิสูง:
SiO 2 + 2C = Si + 2CO - ซิลิคอนที่บริสุทธิ์ที่สุดได้มาจากการลดซิลิคอนเตตระคลอไรด์ด้วยไฮโดรเจน (สังกะสี) ที่อุณหภูมิสูง:
SiCl 4 +2H 2 = Si+4HCl
การประยุกต์ใช้ซิลิคอน:
- การผลิตองค์ประกอบรังสีเซมิคอนดักเตอร์
- เป็นสารเติมแต่งทางโลหะวิทยาในการผลิตสารประกอบทนความร้อนและทนกรด
- ในการผลิตโฟโตเซลล์สำหรับแบตเตอรี่พลังงานแสงอาทิตย์
- เป็นวงจรเรียงกระแสไฟ AC
สารประกอบซิลิคอนซึ่งแพร่หลายในโลกมนุษย์รู้จักมาตั้งแต่ยุคหิน การใช้เครื่องมือหินเพื่อแรงงานและการล่าสัตว์ดำเนินไปเป็นเวลาหลายพันปี การใช้สารประกอบซิลิกอนที่เกี่ยวข้องกับการแปรรูป - การผลิตแก้ว - เริ่มต้นประมาณ 3,000 ปีก่อนคริสตกาล จ. (ในอียิปต์โบราณ) สารประกอบซิลิคอนที่เก่าแก่ที่สุดที่รู้จักคือ SiO 2 ออกไซด์ (ซิลิกา) ในศตวรรษที่ 18 ซิลิกาถือเป็นของแข็งธรรมดาและถูกเรียกว่า "โลก" (ตามที่ปรากฏอยู่ในชื่อ) I. Ya. Berzelius เป็นผู้กำหนดความซับซ้อนขององค์ประกอบของซิลิกา เป็นครั้งแรกในปี พ.ศ. 2368 เขาได้รับธาตุซิลิกอนจากซิลิคอนฟลูออไรด์ SiF 4 โดยรีดิวซ์ธาตุหลังด้วยโลหะโพแทสเซียม องค์ประกอบใหม่ได้รับการตั้งชื่อว่า "ซิลิคอน" (จากภาษาละติน silex - หินเหล็กไฟ) ชื่อภาษารัสเซียได้รับการแนะนำโดย G. I. Hess ในปี 1834
การกระจายตัวของซิลิคอนในธรรมชาติซิลิคอนเป็นองค์ประกอบที่มีมากเป็นอันดับสองในเปลือกโลก (รองจากออกซิเจน) ปริมาณเฉลี่ยในเปลือกโลกคือ 29.5% (โดยมวล) ในเปลือกโลก ซิลิคอนมีบทบาทหลักเช่นเดียวกับคาร์บอนในโลกของสัตว์และพืช สำหรับธรณีเคมีของซิลิคอน การเชื่อมต่อที่แข็งแกร่งอย่างยิ่งกับออกซิเจนเป็นสิ่งสำคัญ ประมาณ 12% ของเปลือกโลกคือซิลิกา SiO 2 ในรูปของแร่ควอตซ์และพันธุ์ต่างๆ 75% ของเปลือกโลกประกอบด้วยซิลิเกตและอะลูมิโนซิลิเกตหลายชนิด (เฟลด์สปาร์ ไมคัส แอมฟิโบล ฯลฯ) จำนวนแร่ธาตุทั้งหมดที่มีซิลิกาเกิน 400
ในระหว่างกระบวนการแม็กมาติก ความแตกต่างเล็กน้อยของซิลิคอนเกิดขึ้น: มันสะสมทั้งในแกรนิตอยด์ (32.3%) และในหินอัลตราเบสิก (19%) ที่อุณหภูมิสูงและความดันสูง ความสามารถในการละลายของ SiO 2 จะเพิ่มขึ้น การอพยพของมันด้วยไอน้ำก็เป็นไปได้เช่นกัน ดังนั้นเพกมาไทต์ของหลอดเลือดดำไฮโดรเทอร์มอลจึงมีลักษณะเฉพาะด้วยความเข้มข้นที่สำคัญของควอตซ์ ซึ่งมักเกี่ยวข้องกับองค์ประกอบของแร่ (ทองคำ - ควอตซ์, ควอตซ์ - แคสสิเทอไรต์และหลอดเลือดดำอื่น ๆ )
คุณสมบัติทางกายภาพของซิลิคอนซิลิคอนก่อตัวเป็นผลึกสีเทาเข้มที่มีความแวววาวของโลหะ โดยมีโครงตาข่ายประเภทเพชรลูกบาศก์อยู่ตรงกลางหน้า โดยมีคาบ a = 5.431 Å และความหนาแน่น 2.33 g/cm3 ที่แรงกดดันที่สูงมาก ได้รับการดัดแปลงใหม่ (เห็นได้ชัดว่าเป็นรูปหกเหลี่ยม) โดยมีความหนาแน่น 2.55 กรัม/ซม.3 ซิลิคอนละลายที่ 1,417 °C และเดือดที่ 2,600 °C ความจุความร้อนจำเพาะ (ที่ 20-100 °C) 800 J/(kg · K) หรือ 0.191 cal/(g deg) ค่าการนำความร้อนแม้ตัวอย่างที่บริสุทธิ์ที่สุดจะไม่คงที่และอยู่ในช่วง (25 °C) 84-126 W/(m · K) หรือ 0.20-0.30 cal/(cm·deg) ค่าสัมประสิทธิ์อุณหภูมิของการขยายตัวเชิงเส้นคือ 2.33·10 -6 K -1 หากต่ำกว่า 120 K จะกลายเป็นลบ ซิลิคอนมีความโปร่งใสต่อรังสีอินฟราเรดคลื่นยาว ดัชนีการหักเหของแสง (สำหรับ แล = 6 µm) 3.42; ค่าคงที่ไดอิเล็กทริก 11.7 ซิลิคอนเป็นแม่เหล็ก ความไวต่อแม่เหล็กของอะตอมคือ -0.13-10 -6 ความแข็งของซิลิคอนตาม Mohs 7.0 ตามมาตรฐาน Brinell 2.4 Gn/m2 (240 kgf/mm2) โมดูลัสยืดหยุ่น 109 Gn/m2 (10,890 kgf/mm2) สัมประสิทธิ์การอัด 0.325·10 -6 cm2 /กก. ซิลิคอนเป็นวัสดุที่เปราะ การเสียรูปพลาสติกที่เห็นได้ชัดเจนเริ่มต้นที่อุณหภูมิสูงกว่า 800°C
ซิลิคอนเป็นสารกึ่งตัวนำที่มีประโยชน์หลายอย่าง คุณสมบัติทางไฟฟ้าของซิลิคอนขึ้นอยู่กับสิ่งเจือปนเป็นอย่างมาก ความต้านทานไฟฟ้าเชิงปริมาตรจำเพาะของซิลิคอนที่อุณหภูมิห้องจะอยู่ที่ 2.3·10 3 โอห์ม·ม. (2.3·10 5 โอห์ม·ซม.)
เซมิคอนดักเตอร์ซิลิคอนที่มีค่าการนำไฟฟ้าชนิด p (สารเติมแต่ง B, Al, In หรือ Ga) และชนิด n (สารเติมแต่ง P, Bi, As หรือ Sb) มีความต้านทานต่ำกว่าอย่างเห็นได้ชัด ช่องว่างของแถบความถี่ที่วัดด้วยระบบไฟฟ้าคือ 1.21 eV ที่ 0 K และลดลงเป็น 1.119 eV ที่ 300 K
คุณสมบัติทางเคมีของซิลิคอนตามตำแหน่งของซิลิคอนในตารางธาตุของ Mendeleev อิเล็กตรอน 14 ตัวของอะตอมของซิลิคอนจะถูกกระจายไปทั่วสามเปลือก: ในอิเล็กตรอนตัวแรก (จากนิวเคลียส) 2 ตัวใน 8 ตัวที่สองในสาม (วาเลนซ์) 4; โครงสร้างเปลือกอิเล็กตรอน 1s 2 2s 2 2p 6 3s 2 3p 2 ศักยภาพในการแตกตัวเป็นไอออนตามลำดับ (eV): 8.149; 16.34; 33.46 และ 45.13 รัศมีอะตอม 1.33Å, รัศมีโควาเลนต์ 1.17Å, รัศมีไอออนิก Si 4+ 0.39Å, Si 4- 1.98Å
ในสารประกอบ ซิลิคอน (คล้ายกับคาร์บอน) คือ 4 วาเลนต์ อย่างไรก็ตาม ซิลิกอนซึ่งมีเลขโคออร์ดิเนชั่นเป็น 4 นั้นแตกต่างจากคาร์บอนตรงที่มีเลขโคออร์ดิเนทเป็น 6 ซึ่งอธิบายได้ด้วยอะตอมที่มีปริมาตรมาก (ตัวอย่างของสารประกอบดังกล่าวคือซิลิโคฟลูออไรด์ที่มีหมู่ 2)
พันธะเคมีของอะตอมซิลิคอนกับอะตอมอื่นมักจะดำเนินการผ่านวงโคจร sp 3 แบบไฮบริด แต่ก็เป็นไปได้ที่จะเกี่ยวข้องกับวงโคจร 3 มิติสองในห้า (ว่าง) ของมัน โดยเฉพาะอย่างยิ่งเมื่อซิลิคอนมีพิกัดหกพิกัด ที่มีค่าอิเล็กโตรเนกาติวีตี้ต่ำอยู่ที่ 1.8 (เทียบกับ 2.5 สำหรับคาร์บอน 3.0 สำหรับไนโตรเจน เป็นต้น) ซิลิคอนในสารประกอบที่ไม่ใช่โลหะจะมีประจุบวกทางไฟฟ้า และสารประกอบเหล่านี้มีลักษณะเป็นขั้วในธรรมชาติ พลังงานยึดเกาะสูงของ Si - O กับออกซิเจน เท่ากับ 464 kJ/mol (111 kcal/mol) เป็นตัวกำหนดความเสถียรของสารประกอบออกซิเจน (SiO 2 และซิลิเกต) พลังงานพันธะ Si - Si ต่ำ 176 kJ/mol (42 kcal/mol) ซิลิคอนไม่ได้มีลักษณะเฉพาะจากการก่อตัวของสายโซ่ยาวและพันธะคู่ระหว่างอะตอมของ Si ซึ่งแตกต่างจากคาร์บอน ในอากาศ ซิลิคอนจะคงตัวแม้ในอุณหภูมิที่สูงขึ้นเนื่องจากการก่อตัวของฟิล์มออกไซด์ป้องกัน ในออกซิเจน มันจะออกซิไดซ์เริ่มต้นที่ 400 °C ทำให้เกิดซิลิคอนออกไซด์ (IV) SiO 2 เป็นที่ทราบกันว่าซิลิคอน (II) ออกไซด์ SiO มีความเสถียรที่อุณหภูมิสูงในรูปของก๊าซ จากการทำความเย็นอย่างรวดเร็ว ทำให้ได้ผลิตภัณฑ์ที่เป็นของแข็งซึ่งสลายตัวเป็นส่วนผสมบางๆ ของ Si และ SiO 2 ได้อย่างง่ายดาย ซิลิคอนทนต่อกรดและละลายได้เฉพาะในส่วนผสมของกรดไนตริกและกรดไฮโดรฟลูออริกเท่านั้น ละลายได้ง่ายในสารละลายอัลคาไลร้อนด้วยการปล่อยไฮโดรเจน ซิลิคอนทำปฏิกิริยากับฟลูออรีนที่อุณหภูมิห้องและกับฮาโลเจนอื่นๆ เมื่อถูกความร้อนจนเกิดเป็นสารประกอบที่มีสูตรทั่วไป SiX 4 ไฮโดรเจนไม่ทำปฏิกิริยาโดยตรงกับซิลิคอน และไฮโดรเจนซิลิกา (ไซเลน) ได้มาจากการสลายตัวของซิลิไซด์ (ดูด้านล่าง) ซิลิโคนไฮโดรเจนเป็นที่รู้จักตั้งแต่ SiH 4 ถึง Si 8 H 18 (องค์ประกอบคล้ายกับไฮโดรคาร์บอนอิ่มตัว) ซิลิคอนก่อตัวเป็นไซเลนที่มีออกซิเจน 2 กลุ่ม - ไซลอกเซนและไซลอกซีน ซิลิคอนทำปฏิกิริยากับไนโตรเจนที่อุณหภูมิสูงกว่า 1,000 °C Si3N4 ไนไตรด์ซึ่งไม่ออกซิไดซ์ในอากาศแม้ที่อุณหภูมิ 1200 °C สามารถทนต่อกรด (ยกเว้นกรดไนตริก) และด่าง รวมถึงโลหะหลอมเหลวและตะกรันได้ ซึ่งทำให้เป็นวัสดุที่มีคุณค่าสำหรับอุตสาหกรรมเคมี สำหรับการผลิตวัสดุทนไฟและอื่นๆ สารประกอบซิลิคอนที่มีคาร์บอน (ซิลิคอนคาร์ไบด์ SiC) และโบรอน (SiB 3, SiB 6, SiB 12) มีคุณลักษณะเด่นคือมีความแข็งสูง รวมถึงทนต่อความร้อนและสารเคมี เมื่อถูกความร้อน ซิลิคอนจะทำปฏิกิริยา (เมื่อมีตัวเร่งปฏิกิริยาที่เป็นโลหะ เช่น ทองแดง) กับสารประกอบออร์กาโนคลอรีน (เช่น CH 3 Cl) เพื่อสร้างออร์กาโนฮาโลซิเลน (เช่น Si(CH 3) 3 Cl) ซึ่งใช้สำหรับการสังเคราะห์ ของสารประกอบออร์กาโนซิลิคอนหลายชนิด
ซิลิคอนก่อตัวเป็นสารประกอบที่มีโลหะเกือบทั้งหมด - ซิลิไซด์ (ไม่พบสารประกอบที่มี Bi, Tl, Pb, Hg เท่านั้น) ได้รับซิลิไซด์มากกว่า 250 ชนิดซึ่งองค์ประกอบ (MeSi, MeSi 2, Me 5 Si 3, Me 3 Si, Me 2 Si และอื่น ๆ ) มักจะไม่สอดคล้องกับความจุแบบคลาสสิก ซิลิไซด์เป็นวัสดุทนไฟและแข็ง เฟอร์โรซิลิกอน (สารรีดิวซ์ในการถลุงโลหะผสมพิเศษ ดูเฟอร์โรอัลลอย) และโมลิบดีนัมซิลิไซด์ MoSi 2 (เครื่องทำความร้อนเตาไฟฟ้า ใบพัดกังหันก๊าซ ฯลฯ) มีความสำคัญในทางปฏิบัติมากที่สุด
การได้รับซิลิคอนซิลิคอนที่มีความบริสุทธิ์ทางเทคนิค (95-98%) ได้มาจากอาร์กไฟฟ้าโดยการลดซิลิกา SiO 2 ระหว่างขั้วไฟฟ้ากราไฟท์ ในการพัฒนาเทคโนโลยีเซมิคอนดักเตอร์ได้มีการพัฒนาวิธีการผลิตซิลิคอนบริสุทธิ์และมีความบริสุทธิ์สูง ซึ่งต้องใช้การสังเคราะห์เบื้องต้นของสารประกอบซิลิกอนเริ่มต้นที่บริสุทธิ์ที่สุด ซึ่งซิลิคอนจะถูกสกัดโดยการลดขนาดหรือการสลายตัวด้วยความร้อน
ซิลิคอนเซมิคอนดักเตอร์บริสุทธิ์ได้มาในสองรูปแบบ: โพลีคริสตัลไลน์ (โดยการลด SiCl 4 หรือ SiHCl 3 ด้วยสังกะสีหรือไฮโดรเจน, การสลายตัวด้วยความร้อนของ SiI 4 และ SiH 4) และผลึกเดี่ยว (การละลายของโซนที่ปราศจากเบ้าหลอมและ "ดึง" ผลึกเดี่ยวจาก ซิลิคอนหลอมเหลว - วิธี Czochralski)
การประยุกต์ใช้ซิลิคอนซิลิคอนเจือแบบพิเศษถูกนำมาใช้กันอย่างแพร่หลายเป็นวัสดุสำหรับการผลิตอุปกรณ์เซมิคอนดักเตอร์ (ทรานซิสเตอร์, เทอร์มิสเตอร์, วงจรเรียงกระแสกำลัง, ไทริสเตอร์; โฟโตเซลล์แสงอาทิตย์ที่ใช้ในยานอวกาศ ฯลฯ ) เนื่องจากซิลิคอนมีความโปร่งใสต่อรังสีที่มีความยาวคลื่นตั้งแต่ 1 ถึง 9 ไมครอน จึงถูกนำมาใช้ในเลนส์อินฟราเรด
ซิลิคอนมีการใช้งานที่หลากหลายและขยายตัว ในโลหะวิทยา ซิลิคอนใช้เพื่อกำจัดออกซิเจนที่ละลายในโลหะหลอมเหลว (ดีออกซิเดชัน) ซิลิคอนเป็นส่วนประกอบของโลหะผสมเหล็กและโลหะที่ไม่ใช่เหล็กจำนวนมาก โดยทั่วไปแล้ว ซิลิคอนจะทำให้โลหะผสมมีความต้านทานต่อการกัดกร่อนเพิ่มขึ้น ปรับปรุงคุณสมบัติการหล่อ และเพิ่มความแข็งแรงทางกล อย่างไรก็ตามในระดับที่สูงขึ้น ซิลิคอนอาจทำให้เกิดความเปราะบางได้ ที่สำคัญที่สุดคือโลหะผสมเหล็ก ทองแดง และอลูมิเนียมที่มีซิลิคอน ปริมาณซิลิคอนที่เพิ่มขึ้นจะถูกนำมาใช้ในการสังเคราะห์สารประกอบออร์กาโนซิลิคอนและซิลิไซด์ ซิลิกาและซิลิเกตหลายชนิด (ดินเหนียว เฟลด์สปาร์ ไมกา แป้งโรยตัว ฯลฯ) ได้รับการประมวลผลโดยอุตสาหกรรมแก้ว ซีเมนต์ เซรามิก ไฟฟ้า และอุตสาหกรรมอื่นๆ
ซิลิคอนพบในร่างกายในรูปแบบของสารประกอบต่างๆ ซึ่งส่วนใหญ่เกี่ยวข้องกับการก่อตัวของชิ้นส่วนโครงกระดูกแข็งและเนื้อเยื่อ พืชทะเลบางชนิด (เช่น ไดอะตอม) และสัตว์ (เช่น ฟองน้ำซิลิกา เรดิโอลาเรียน) สามารถสะสมซิลิคอนในปริมาณมากเป็นพิเศษ ทำให้เกิดตะกอนหนาของซิลิคอน (IV) ออกไซด์เมื่อพวกมันตายบนพื้นมหาสมุทร ในทะเลเย็นและทะเลสาบ ตะกอนชีวภาพที่อุดมด้วยซิลิคอนมีอิทธิพลเหนือกว่าในเขตร้อน ทะเล - ตะกอนปูนที่มีปริมาณซิลิคอนต่ำ ในบรรดาพืชบก ธัญพืช ต้นกก ต้นปาล์ม และหางม้าสะสมซิลิคอนจำนวนมาก ในสัตว์มีกระดูกสันหลังปริมาณซิลิคอน (IV) ออกไซด์ในสารเถ้าคือ 0.1-0.5% ซิลิคอนพบได้ในปริมาณมากที่สุดในเนื้อเยื่อเกี่ยวพัน ไต และตับอ่อนที่มีความหนาแน่นสูง อาหารของมนุษย์ในแต่ละวันประกอบด้วยซิลิคอนมากถึง 1 กรัม เมื่อมีฝุ่นซิลิคอน (IV) ออกไซด์ในปริมาณสูงในอากาศ จะเข้าสู่ปอดของมนุษย์และทำให้เกิดโรคซิลิโคซิส
ซิลิคอนในร่างกายซิลิคอนพบในร่างกายในรูปแบบของสารประกอบต่างๆ ซึ่งส่วนใหญ่เกี่ยวข้องกับการก่อตัวของชิ้นส่วนโครงกระดูกแข็งและเนื้อเยื่อ พืชทะเลบางชนิด (เช่น ไดอะตอม) และสัตว์ (เช่น ฟองน้ำซิลิกา เรดิโอลาเรียน) สามารถสะสมซิลิคอนในปริมาณมากเป็นพิเศษ ทำให้เกิดตะกอนหนาของซิลิคอน (IV) ออกไซด์เมื่อพวกมันตายบนพื้นมหาสมุทร ในทะเลเย็นและทะเลสาบ ตะกอนชีวภาพที่อุดมด้วยซิลิคอนมีอิทธิพลเหนือกว่าในเขตร้อน ทะเล - ตะกอนปูนที่มีปริมาณซิลิคอนต่ำ ในบรรดาพืชบก ธัญพืช ต้นกก ต้นปาล์ม และหางม้าสะสมซิลิคอนจำนวนมาก ในสัตว์มีกระดูกสันหลังปริมาณซิลิคอน (IV) ออกไซด์ในสารเถ้าคือ 0.1-0.5% ซิลิคอนพบได้ในปริมาณมากที่สุดในเนื้อเยื่อเกี่ยวพัน ไต และตับอ่อนที่มีความหนาแน่นสูง อาหารของมนุษย์ในแต่ละวันประกอบด้วยซิลิคอนมากถึง 1 กรัม เมื่อมีฝุ่นซิลิคอน (IV) ออกไซด์ในปริมาณสูงในอากาศ จะเข้าสู่ปอดของมนุษย์และทำให้เกิดโรคซิลิโคซิส
ซิลิคอน(lat. silicium), si, องค์ประกอบทางเคมีของกลุ่ม IV ของระบบธาตุของ Mendeleev; เลขอะตอม 14 มวลอะตอม 28.086 ในธรรมชาติ องค์ประกอบดังกล่าวจะแสดงด้วยไอโซโทปเสถียร 3 ไอโซโทป: 28 si (92.27%), 29 si (4.68%) และ 30 si (3.05%)
ภูมิหลังทางประวัติศาสตร์ - สารประกอบ K ซึ่งแพร่หลายบนโลกมนุษย์รู้จักมาตั้งแต่ยุคหิน การใช้เครื่องมือหินเพื่อแรงงานและการล่าสัตว์ดำเนินไปเป็นเวลาหลายพันปี การใช้สารประกอบ K ที่เกี่ยวข้องกับการแปรรูป - การผลิต กระจก -เริ่มประมาณ 3,000 ปีก่อนคริสตกาล จ. (ในอียิปต์โบราณ) สารประกอบที่เก่าแก่ที่สุดที่รู้จักของ K. คือไดออกไซด์ sio 2 (ซิลิกา) ในศตวรรษที่ 18 ซิลิกาถือเป็นวัตถุที่เรียบง่ายและเรียกว่า "โลก" (ซึ่งสะท้อนอยู่ในชื่อของมัน) I. Ya. กำหนดความซับซ้อนขององค์ประกอบของซิลิกา เบอร์เซลิอุสเป็นครั้งแรกในปี พ.ศ. 2368 เขาได้รับธาตุโพแทสเซียมจากซิลิคอนฟลูออไรด์ sif 4 โดยรีดิวซ์ธาตุโพแทสเซียมด้วยโลหะ องค์ประกอบใหม่ได้รับการตั้งชื่อว่า "ซิลิคอน" (จากภาษาละติน silex - หินเหล็กไฟ) ชื่อรัสเซียถูกนำมาใช้โดย G.I. เฮสส์ในปี พ.ศ. 2377
ความชุกในธรรมชาติ - ในแง่ของความชุกในเปลือกโลก ออกซิเจนเป็นองค์ประกอบที่สอง (รองจากออกซิเจน) ปริมาณเฉลี่ยในเปลือกโลกคือ 29.5% (โดยมวล) ในเปลือกโลก คาร์บอนมีบทบาทหลักเช่นเดียวกับคาร์บอนในโลกของสัตว์และพืช สำหรับธรณีเคมีของออกซิเจน การเชื่อมต่อที่แน่นแฟ้นอย่างยิ่งกับออกซิเจนเป็นสิ่งสำคัญ ประมาณ 12% ของเปลือกโลกเป็นซิลิกา sio 2 ในรูปแร่ ควอตซ์และพันธุ์ของมัน 75% ของเปลือกโลกประกอบด้วยสารต่างๆ ซิลิเกตและ อลูมิโนซิลิเกต(เฟลด์สปาร์ ไมคัส แอมฟิโบล ฯลฯ) จำนวนแร่ธาตุทั้งหมดที่มีซิลิกาเกิน 400 .
ในระหว่างกระบวนการแม็กมาติก แคลเซียมจะมีความแตกต่างกันเล็กน้อย โดยสะสมทั้งในแกรนิตอยด์ (32.3%) และในหินอัลตราเบสิก (19%) ที่อุณหภูมิสูงและความดันสูง ความสามารถในการละลายของ sio 2 จะเพิ่มขึ้น การย้ายถิ่นของมันด้วยไอน้ำก็เป็นไปได้เช่นกัน ดังนั้นเพกมาไทต์ของหลอดเลือดดำไฮโดรเทอร์มอลจึงมีลักษณะเฉพาะด้วยความเข้มข้นที่สำคัญของควอตซ์ซึ่งมักเกี่ยวข้องกับองค์ประกอบของแร่ (ทองคำ - ควอตซ์, ควอตซ์ - แคสสิเทอไรต์ ฯลฯ )
คุณสมบัติทางกายภาพและเคมี คาร์บอนก่อตัวเป็นผลึกสีเทาเข้มที่มีความแวววาวของโลหะ โดยมีโครงตาข่ายประเภทเพชรลูกบาศก์อยู่ตรงกลางหน้า โดยมีคาบ a = 5.431 a และความหนาแน่น 2.33 g/cm3 ที่แรงกดดันที่สูงมาก ได้รับการดัดแปลงใหม่ (เห็นได้ชัดว่าเป็นรูปหกเหลี่ยม) โดยมีความหนาแน่น 2.55 กรัม/ซม.3 เคละลายที่ 1417°C เดือดที่ 2600°C ความจุความร้อนจำเพาะ (ที่ 20-100°C) 800 J/ (kg? K) หรือ 0.191 cal/ (g? deg); ค่าการนำความร้อนแม้ตัวอย่างที่บริสุทธิ์ที่สุดจะไม่คงที่และอยู่ในช่วง (25°C) 84-126 W/ (m? K) หรือ 0.20-0.30 cal/ (cm? วินาที? deg) ค่าสัมประสิทธิ์อุณหภูมิของการขยายตัวเชิงเส้น 2.33? 10 -6 เคลวิน -1 ; ต่ำกว่า 120k จะกลายเป็นลบ เคมีความโปร่งใสต่อรังสีอินฟราเรดคลื่นยาว ดัชนีการหักเหของแสง (สำหรับ l =6 µm) 3.42; ค่าคงที่ไดอิเล็กทริก 11.7 เค diamagnetic ความไวต่อแม่เหล็กของอะตอม -0.13? 10 -6. ความแข็ง K. ตาม Mohs 7.0 ตามมาตรฐาน Brinell 2.4 Gn/m2 (240 kgf/mm2) โมดูลัสยืดหยุ่น 109 Gn/m2 (10890 kgf/mm2) สัมประสิทธิ์การอัด 0.325? 10 -6 ซม. 2 /กก. เค. วัสดุเปราะ; การเสียรูปพลาสติกที่เห็นได้ชัดเจนเริ่มต้นที่อุณหภูมิสูงกว่า 800°C
เคเป็นเซมิคอนดักเตอร์ที่กำลังมีการใช้งานเพิ่มมากขึ้น สมบัติทางไฟฟ้าของทองแดงขึ้นอยู่กับสิ่งเจือปนเป็นอย่างมาก ความต้านทานไฟฟ้าเชิงปริมาตรจำเพาะภายในของเซลล์ที่อุณหภูมิห้องจะเท่ากับ 2.3? 10 3 โอห์ม? ม(2,3 ? 10 5 โอห์ม? ซม) .
วงจรสารกึ่งตัวนำที่มีความนำไฟฟ้า ร-type (สารเติมแต่ง B, อัล, ใน หรือ ga) และ n-type (สารเติมแต่ง P, bi, as หรือ sb) มีความต้านทานต่ำกว่ามาก ช่องว่างของแถบตามการวัดทางไฟฟ้าคือ 1.21 evเวลา 0 ถึงและลดลงเหลือ 1.119 evที่ 300 ถึง.
ตามตำแหน่งของวงแหวนในระบบธาตุของ Mendeleev อิเล็กตรอน 14 ตัวของอะตอมของวงแหวนจะถูกกระจายไปทั่วสามเปลือก: ในอิเล็กตรอนตัวแรก (จากนิวเคลียส) 2 ตัวใน 8 ตัวที่สองในสาม (ความจุ) 4; การกำหนดค่าเปลือกอิเล็กตรอน 1s 2 2s 2 2p 6 3s 2 3p 2. ศักยภาพในการแตกตัวเป็นไอออนต่อเนื่อง ( ev): 8.149; 16.34; 33.46 และ 45.13 รัศมีอะตอม 1.33 a, รัศมีโควาเลนต์ 1.17 a, รัศมีไอออนิก si 4+ 0.39 a, si 4- 1.98 a.
ในสารประกอบคาร์บอน (คล้ายกับคาร์บอน) 4-วาเลนทีน อย่างไรก็ตาม ไม่เหมือนกับคาร์บอน ซิลิกาซึ่งมีเลขประสานงานเป็น 4 มีเลขประสานงานเป็น 6 ซึ่งอธิบายได้ด้วยอะตอมที่มีปริมาตรมาก (ตัวอย่างของสารประกอบดังกล่าวคือซิลิโคฟลูออไรด์ที่มีหมู่ 2)
พันธะเคมีของอะตอมคาร์บอนกับอะตอมอื่นมักจะเกิดขึ้นเนื่องจากวงโคจร sp 3 ลูกผสม แต่ก็เป็นไปได้ที่จะเกี่ยวข้องกับสองในห้า (ว่าง) 3 ง-วงโคจร โดยเฉพาะอย่างยิ่งเมื่อ K. มีพิกัดหกตัว เมื่อมีค่าอิเล็กโตรเนกาติวีตี้ต่ำอยู่ที่ 1.8 (เทียบกับ 2.5 สำหรับคาร์บอน 3.0 สำหรับไนโตรเจน เป็นต้น) คาร์บอนจะมีประจุบวกด้วยไฟฟ้าในสารประกอบที่มีอโลหะ และสารประกอบเหล่านี้มีลักษณะเป็นขั้วในธรรมชาติ พลังงานยึดเหนี่ยวสูงกับออกซิเจน si-o เท่ากับ 464 กิโลจูล/โมล(111 กิโลแคลอรี/โมล) , กำหนดความเสถียรของสารประกอบออกซิเจน (sio 2 และซิลิเกต) พลังงานยึดเกาะ Si-si ต่ำ 176 กิโลจูล/โมล (42 กิโลแคลอรี/โมล) ; คาร์บอนไม่ได้มีลักษณะเฉพาะจากการก่อตัวของสายโซ่ยาวและพันธะคู่ระหว่างอะตอมของ Si ซึ่งแตกต่างจากคาร์บอน เนื่องจากการก่อตัวของฟิล์มป้องกันออกไซด์ในอากาศ คาร์บอนจึงมีเสถียรภาพแม้ในอุณหภูมิที่สูงขึ้น ในออกซิเจน มันจะออกซิไดซ์เริ่มต้นที่ 400°C และก่อตัว ซิลิคอนไดออกไซด์ซีโอ 2. เป็นที่ทราบกันว่าไซโอมอนนอกไซด์มีความเสถียรที่อุณหภูมิสูงในรูปของก๊าซ จากการทำความเย็นอย่างกะทันหันทำให้ได้ผลิตภัณฑ์ที่เป็นของแข็งซึ่งสลายตัวเป็นส่วนผสมบาง ๆ ของ si และ sio 2 ได้อย่างง่ายดาย เคทนต่อกรดและละลายได้เฉพาะในส่วนผสมของกรดไนตริกและกรดไฮโดรฟลูออริกเท่านั้น ละลายได้ง่ายในสารละลายอัลคาไลร้อนด้วยการปล่อยไฮโดรเจน เคทำปฏิกิริยากับฟลูออรีนที่อุณหภูมิห้องและกับฮาโลเจนอื่นๆ เมื่อถูกความร้อนจนเกิดเป็นสารประกอบตามสูตรทั่วไป 6 4 . ไฮโดรเจนไม่ทำปฏิกิริยาโดยตรงกับคาร์บอน และ กรดซิลิซิก(ไซเลน) ได้มาจากการสลายตัวของซิลิไซด์ (ดูด้านล่าง) ซิลิโคนไฮโดรเจนเป็นที่รู้จักตั้งแต่ sih 4 ถึง si 8 h 18 (องค์ประกอบคล้ายกับไฮโดรคาร์บอนอิ่มตัว) เคสร้างไซเลนที่มีออกซิเจน 2 กลุ่ม - ไซล็อกเซนและไซลอกซีน K ทำปฏิกิริยากับไนโตรเจนที่อุณหภูมิสูงกว่า 1,000°C สิ่งที่สำคัญที่สุดในทางปฏิบัติคือ si 3 n 4 ไนไตรด์ ซึ่งไม่ออกซิไดซ์ในอากาศแม้ที่อุณหภูมิ 1200°C สามารถทนต่อกรด (ยกเว้นไนตริก) และด่าง เช่นเดียวกับโลหะหลอมเหลวและตะกรัน ซึ่งทำให้เป็นวัสดุที่มีคุณค่าสำหรับ อุตสาหกรรมเคมีเพื่อการผลิตวัสดุทนไฟ ฯลฯ สารประกอบคาร์บอนกับคาร์บอนมีความโดดเด่นด้วยความแข็งสูงตลอดจนความต้านทานความร้อนและสารเคมี ( ซิลิคอนคาร์ไบด์ sic) และโบรอน (sib 3, sib 6, sib 12) เมื่อถูกความร้อน คลอรีนจะทำปฏิกิริยา (เมื่อมีตัวเร่งปฏิกิริยาที่เป็นโลหะ เช่น ทองแดง) กับสารประกอบออร์กาโนคลอรีน (เช่น ch 3 cl) เพื่อสร้างออร์กาโนฮาโลซิเลน [เช่น si (ch 3) 3 ci] ซึ่งใช้สำหรับการสังเคราะห์ มากมาย สารประกอบออร์กาโนซิลิคอน
เคเกิดสารประกอบกับโลหะเกือบทั้งหมด - ซิลิไซด์(ตรวจไม่พบการเชื่อมต่อกับ bi, tl, pb, hg เท่านั้น) ได้รับซิลิไซด์มากกว่า 250 ชนิด ซึ่งองค์ประกอบ (mesi, mesi 2, me 5 si 3, me 3 si, me 2 si, ฯลฯ) มักจะไม่สอดคล้องกับความจุแบบคลาสสิก ซิลิไซด์เป็นวัสดุทนไฟและแข็ง เฟอร์โรซิลิคอนและโมลิบดีนัมซิลิไซด์ mosi 2 มีความสำคัญในทางปฏิบัติมากที่สุด (เครื่องทำความร้อนเตาไฟฟ้า ใบพัดกังหันก๊าซ ฯลฯ)
ใบเสร็จรับเงินและการสมัคร K. ความบริสุทธิ์ทางเทคนิค (95-98%) ได้มาจากส่วนโค้งไฟฟ้าโดยการลดซิลิกา sio 2 ระหว่างขั้วไฟฟ้ากราไฟท์ ในการพัฒนาเทคโนโลยีเซมิคอนดักเตอร์ได้มีการพัฒนาวิธีการเพื่อให้ได้ทองแดงบริสุทธิ์โดยเฉพาะ ซึ่งต้องมีการสังเคราะห์เบื้องต้นของสารประกอบเริ่มต้นที่บริสุทธิ์ที่สุดของทองแดง ซึ่งทองแดงจะถูกสกัดโดยการรีดักชันหรือการสลายตัวด้วยความร้อน
ทองแดงเซมิคอนดักเตอร์บริสุทธิ์ได้มาในสองรูปแบบ: โพลีคริสตัลไลน์ (โดยการลดซิซิ 4 หรือ sihcl 3 ด้วยสังกะสีหรือไฮโดรเจน การสลายตัวด้วยความร้อนของซิล 4 และซิห์ 4) และผลึกเดี่ยว (การหลอมโซนที่ปราศจากเบ้าหลอมและ "ดึง" ผลึกเดี่ยว จากทองแดงหลอมเหลว - วิธี Czochralski)
ทองแดงที่เจือแบบพิเศษถูกนำมาใช้กันอย่างแพร่หลายเป็นวัสดุสำหรับการผลิตอุปกรณ์เซมิคอนดักเตอร์ (ทรานซิสเตอร์, เทอร์มิสเตอร์, วงจรเรียงกระแสกำลัง, ไดโอดควบคุม - ไทริสเตอร์, โฟโตเซลล์แสงอาทิตย์ที่ใช้ในยานอวกาศ ฯลฯ ) เนื่องจาก K. โปร่งใสต่อรังสีที่มีความยาวคลื่นตั้งแต่ 1 ถึง 9 อืมมันถูกใช้ในเลนส์อินฟราเรด .
K. มีขอบเขตการใช้งานที่หลากหลายและขยายตัวอยู่เสมอ ในโลหะวิทยา ออกซิเจนถูกใช้เพื่อกำจัดออกซิเจนที่ละลายในโลหะหลอมเหลว (ดีออกซิเดชัน) เคเป็นส่วนประกอบของโลหะผสมเหล็กและโลหะที่ไม่ใช่เหล็กจำนวนมาก โดยทั่วไปแล้ว คาร์บอนจะทำให้โลหะผสมมีความต้านทานต่อการกัดกร่อนเพิ่มขึ้น ปรับปรุงคุณสมบัติการหล่อ และเพิ่มความแข็งแรงทางกล อย่างไรก็ตามด้วยปริมาณ K. ที่สูงกว่าก็อาจทำให้เกิดความเปราะบางได้ ที่สำคัญที่สุดคือโลหะผสมเหล็ก ทองแดง และอลูมิเนียมที่มีแคลเซียม ปริมาณคาร์บอนที่เพิ่มขึ้นจะถูกนำมาใช้ในการสังเคราะห์สารประกอบออร์กาโนซิลิคอนและซิลิไซด์ ซิลิกาและซิลิเกตหลายชนิด (ดินเหนียว เฟลด์สปาร์ ไมกา แป้งโรยตัว ฯลฯ) ได้รับการประมวลผลโดยอุตสาหกรรมแก้ว ซีเมนต์ เซรามิก ไฟฟ้า และอุตสาหกรรมอื่นๆ
วี.พี. บาร์ซาคอฟสกี้
ซิลิคอนพบในร่างกายในรูปแบบของสารประกอบต่างๆ ซึ่งส่วนใหญ่เกี่ยวข้องกับการก่อตัวของชิ้นส่วนโครงกระดูกแข็งและเนื้อเยื่อ พืชทะเลบางชนิด (เช่น ไดอะตอม) และสัตว์ (เช่น ฟองน้ำซิลิกา เรดิโอลาเรียน) สามารถสะสมซิลิคอนจำนวนมากเป็นพิเศษ กลายเป็นตะกอนหนาของซิลิคอนไดออกไซด์ที่พื้นมหาสมุทรเมื่อพวกมันตาย ในทะเลเย็นและทะเลสาบ ตะกอนชีวภาพที่อุดมไปด้วยโพแทสเซียมมีอิทธิพลเหนือกว่า ในทะเลเขตร้อน ตะกอนปูนที่มีโพแทสเซียมในปริมาณต่ำจะสะสมโพแทสเซียมจำนวนมาก ในสัตว์มีกระดูกสันหลังปริมาณซิลิคอนไดออกไซด์ในสารเถ้าคือ 0.1-0.5% ในปริมาณที่มากที่สุด K. จะพบได้ในเนื้อเยื่อเกี่ยวพันที่หนาแน่น ไต และตับอ่อน อาหารของมนุษย์ในแต่ละวันประกอบด้วยมากถึง 1 ช K. เมื่อมีฝุ่นซิลิคอนไดออกไซด์ในอากาศในปริมาณมาก จะเข้าสู่ปอดของมนุษย์และทำให้เกิดโรค - ซิลิโคซิส
วี.วี. โควาลสกี้
ความหมาย: Berezhnoy A.S. , Silicon และระบบไบนารี่ เค. 1958; Krasyuk B. A. , Gribov A. I. , อุปกรณ์กึ่งตัวนำ - เจอร์เมเนียมและซิลิคอน, M. , 1961; Renyan V.R. เทคโนโลยีของเซมิคอนดักเตอร์ซิลิคอน ทรานส์ จากภาษาอังกฤษ ม. 2512; Sally I.V., Falkevich E.S., การผลิตเซมิคอนดักเตอร์ซิลิคอน, M. , 1970; ซิลิคอนและเจอร์เมเนียม นั่ง. ศิลปะ. เอ็ด. อี. เอส. ฟัลเควิช, ดี. ไอ. เลวินซอน, วี. 1-2, ม., 1969-70; Gladyshevsky E.I. , เคมีคริสตัลของซิลิไซด์และเจอร์ไรด์, M. , 1971; wolf N.f. ข้อมูลเซมิคอนดักเตอร์ซิลิคอน oxf - n. พ.ศ. 2508.
ดาวน์โหลดบทคัดย่อ
ซิลิคอน
ซิลิคอน-ฉัน; ม.[จากภาษากรีก krēmnos - หน้าผา, หิน] องค์ประกอบทางเคมี (Si) ผลึกสีเทาเข้มที่มีความแวววาวของโลหะพบได้ในหินส่วนใหญ่
◁ ซิลิคอนโอ้โอ้ เคเกลือทราย (ดู 2.K.; 1 เครื่องหมาย)
ซิลิคอน(lat. Silicium) องค์ประกอบทางเคมีของกลุ่มที่ 4 ของตารางธาตุ คริสตัลสีเทาเข้มที่มีความแวววาวของโลหะ ความหนาแน่น 2.33 กรัม/ซม.3 ทีกรุณา1415°C. ทนต่ออิทธิพลของสารเคมี คิดเป็น 27.6% ของมวลเปลือกโลก (อันดับที่ 2 ในบรรดาองค์ประกอบ) แร่ธาตุหลักคือซิลิกาและซิลิเกต หนึ่งในวัสดุเซมิคอนดักเตอร์ที่สำคัญที่สุด (ทรานซิสเตอร์ เทอร์มิสเตอร์ โฟโตเซลล์) ส่วนประกอบสำคัญของเหล็กหลายชนิดและโลหะผสมอื่นๆ (เพิ่มความแข็งแรงเชิงกลและความต้านทานการกัดกร่อน ปรับปรุงคุณสมบัติการหล่อ)
ซิลิคอนSILICON (lat. Silicium จาก silex - flint), Si (อ่านว่า "ซิลิเซียม" แต่ปัจจุบันค่อนข้างบ่อยในชื่อ "si") องค์ประกอบทางเคมีที่มีเลขอะตอม 14 มวลอะตอม 28.0855 ชื่อรัสเซียมาจากภาษากรีกเครมนอส - หน้าผาภูเขา
ซิลิคอนธรรมชาติประกอบด้วยส่วนผสมของนิวไคลด์ที่เสถียรสามชนิด (ซม.นิวคลิด)มีเลขมวล 28 (เหนือกว่าในส่วนผสมประกอบด้วย 92.27% โดยมวล), 29 (4.68%) และ 30 (3.05%) การกำหนดค่าชั้นอิเล็กทรอนิกส์ด้านนอกของอะตอมซิลิคอนที่ไม่ได้รับการกระตุ้นที่เป็นกลาง 3 ส 2
ร 2
- ในสารประกอบ มักจะแสดงสถานะออกซิเดชันที่ +4 (วาเลนซ์ IV) และน้อยมาก +3, +2 และ +1 น้อยมาก (วาเลนซี III, II และ I ตามลำดับ) ในตารางธาตุของ Mendeleev ซิลิคอนอยู่ในกลุ่ม IVA (ในกลุ่มคาร์บอน) ในช่วงที่สาม
รัศมีของอะตอมซิลิคอนที่เป็นกลางคือ 0.133 นาโนเมตร
พลังงานไอออไนเซชันตามลำดับของอะตอมซิลิคอนคือ 8.1517, 16.342, 33.46 และ 45.13 eV และความสัมพันธ์ของอิเล็กตรอนคือ 1.22 eV รัศมีของไอออน Si 4+ ที่มีหมายเลขโคออร์ดิเนท 4 (พบมากที่สุดในกรณีของซิลิคอน) คือ 0.040 นาโนเมตร โดยมีหมายเลขโคออร์ดิเนท 6 - 0.054 นาโนเมตร ตามมาตราส่วน Pauling ค่าอิเลคโตรเนกาติวีตี้ของซิลิคอนคือ 1.9 แม้ว่าซิลิคอนมักจะจัดอยู่ในประเภทอโลหะ แต่ในคุณสมบัติหลายประการ ซิลิกอนจะมีตำแหน่งตรงกลางระหว่างโลหะและอโลหะ
ในรูปแบบอิสระ - ผงสีน้ำตาลหรือวัสดุขนาดกะทัดรัดสีเทาอ่อนพร้อมเงาโลหะ
ประวัติความเป็นมาของการค้นพบ (ซม.มนุษย์รู้จักสารประกอบซิลิกอนมาตั้งแต่สมัยโบราณ แต่มนุษย์เริ่มคุ้นเคยกับสารซิลิกอนอย่างง่าย ๆ เมื่อประมาณ 200 ปีที่แล้ว ในความเป็นจริง นักวิจัยกลุ่มแรกที่ได้รับซิลิคอนคือ J. L. Gay-Lussac ชาวฝรั่งเศสเกย์ LUSSAC โจเซฟ หลุยส์) (ซม.และแอล.เจ. เทนาร์ดเทนาร์ หลุยส์ ฌาคส์)
SiF 4 + 4K = Si + 4KF อย่างไรก็ตามนักวิจัยเองก็ไม่ได้ข้อสรุปที่ถูกต้องเกี่ยวกับการได้รับสารธรรมดาชนิดใหม่ เกียรติในการค้นพบองค์ประกอบใหม่เป็นของนักเคมีชาวสวีเดน J. Berzelius (ซม.เบอร์เซเลียส เจนส์ เจค็อบ)ซึ่งยังให้ความร้อนสารประกอบที่มีองค์ประกอบ K 2 SiF 6 ด้วยโลหะโพแทสเซียมเพื่อผลิตซิลิคอน เขาได้ผงอสัณฐานแบบเดียวกับนักเคมีชาวฝรั่งเศส และในปี พ.ศ. 2367 ได้ประกาศสสารธาตุชนิดใหม่ซึ่งเขาเรียกว่า "ซิลิคอน" ผลึกซิลิคอนได้มาในปี พ.ศ. 2397 โดยนักเคมีชาวฝรั่งเศส A. E. Sainte-Clair Deville เท่านั้น (ซม.แซงต์-แคลร์ เดวิลล์ อองรี เอเตียน) .
อยู่ในธรรมชาติ
ในแง่ของความอุดมสมบูรณ์ในเปลือกโลก ซิลิคอนอยู่ในอันดับที่สองในบรรดาองค์ประกอบทั้งหมด (รองจากออกซิเจน) ซิลิคอนคิดเป็น 27.7% ของมวลเปลือกโลก ซิลิคอนเป็นส่วนประกอบของซิลิเกตธรรมชาติหลายร้อยชนิด (ซม.ซิลิเกต)และอลูมิโนซิลิเกต (ซม.อลูมิเนียมซิลิเกต)- ซิลิกาหรือซิลิคอนไดออกไซด์ก็แพร่หลายเช่นกัน (ซม.ซิลิคอนไดออกไซด์) SiO 2 (ทรายแม่น้ำ (ซม.ทราย), ควอตซ์ (ซม.ควอตซ์), หินเหล็กไฟ (ซม.หินเหล็กไฟ)ฯลฯ) คิดเป็นประมาณ 12% ของเปลือกโลก (โดยมวล) ซิลิคอนไม่ได้เกิดขึ้นในรูปแบบอิสระในธรรมชาติ
ใบเสร็จ
ในอุตสาหกรรม ซิลิคอนผลิตขึ้นโดยการลด SiO 2 ที่ละลายด้วยโค้กที่อุณหภูมิประมาณ 1,800°C ในเตาอาร์ค ความบริสุทธิ์ของซิลิคอนที่ได้รับในลักษณะนี้คือประมาณ 99.9% เนื่องจากจำเป็นต้องใช้ซิลิคอนที่มีความบริสุทธิ์สูงกว่าในการใช้งานจริง ซิลิคอนที่ได้จึงถูกคลอรีน สารประกอบขององค์ประกอบ SiCl 4 และ SiCl 3 H เกิดขึ้น คลอไรด์เหล่านี้ได้รับการทำให้บริสุทธิ์เพิ่มเติมด้วยวิธีต่างๆ จากสิ่งสกปรกและในขั้นตอนสุดท้ายจะถูกรีดิวซ์ด้วยไฮโดรเจนบริสุทธิ์ นอกจากนี้ยังเป็นไปได้ที่จะทำให้ซิลิคอนบริสุทธิ์โดยการรับแมกนีเซียมซิลิไซด์ Mg 2 Si ก่อน ถัดไปได้โมโนไซเลน SiH 4 ที่ระเหยได้มาจากแมกนีเซียมซิลิไซด์โดยใช้กรดไฮโดรคลอริกหรือกรดอะซิติก โมโนไซเลนยังถูกทำให้บริสุทธิ์เพิ่มเติมโดยการแก้ไข การดูดซับ และวิธีอื่นๆ จากนั้นจึงสลายตัวเป็นซิลิคอนและไฮโดรเจนที่อุณหภูมิประมาณ 1,000°C ปริมาณสิ่งเจือปนในซิลิคอนที่ได้จากวิธีการเหล่านี้จะลดลงเหลือ 10 -8 -10 -6% โดยน้ำหนัก
คุณสมบัติทางกายภาพและเคมี
ตาข่ายคริสตัลชนิดเพชรลูกบาศก์ศูนย์กลางหน้าซิลิคอน พารามิเตอร์ ก = 0.54307 นาโนเมตร (มีการดัดแปลงโพลีมอร์ฟิกอื่นๆ ของซิลิคอนที่ความดันสูง) แต่เนื่องจากความยาวพันธะระหว่างอะตอม Si-Si ที่ยาวกว่าเมื่อเปรียบเทียบกับความยาวของพันธะ C-C ความแข็งของซิลิคอนจึงน้อยกว่าเพชรอย่างมาก
ความหนาแน่นของซิลิคอนคือ 2.33 กก./ลูกบาศก์เมตร จุดหลอมเหลว 1410°C จุดเดือด 2355°C ซิลิคอนเปราะบาง เมื่อได้รับความร้อนสูงกว่า 800°C เท่านั้นจึงจะกลายเป็นสารพลาสติก สิ่งที่น่าสนใจคือซิลิคอนมีความโปร่งใสจนถึงรังสีอินฟราเรด (IR)
Elemental Silicon เป็นสารกึ่งตัวนำทั่วไป (ซม.เซมิคอนดักเตอร์)- ช่องว่างของแถบความถี่ที่อุณหภูมิห้องคือ 1.09 eV ความเข้มข้นของตัวพากระแสไฟฟ้าในซิลิคอนที่มีค่าการนำไฟฟ้าภายในที่อุณหภูมิห้องคือ 1.5·10 · 16 ม. -3 คุณสมบัติทางไฟฟ้าของผลึกซิลิคอนได้รับอิทธิพลอย่างมากจากสิ่งเจือปนขนาดเล็กที่อยู่ภายใน เพื่อให้ได้ผลึกเดี่ยวของซิลิคอนที่มีค่าการนำไฟฟ้าของรู สารเติมแต่งของธาตุกลุ่มที่ 3 - โบรอน - จะถูกนำมาใช้ในซิลิคอน (ซม. BOR (องค์ประกอบทางเคมี)),อลูมิเนียม (ซม.อลูมิเนียม), แกลเลียม (ซม.แกลเลียม)และอินเดีย (ซม.อินเดียม)ด้วยการนำไฟฟ้า - การเติมองค์ประกอบของกลุ่ม V - ฟอสฟอรัส (ซม.ฟอสฟอรัส), สารหนู (ซม.สารหนู)หรือพลวง (ซม.พลวง)- คุณสมบัติทางไฟฟ้าของซิลิคอนสามารถเปลี่ยนแปลงได้โดยการเปลี่ยนสภาวะการประมวลผลของผลึกเดี่ยว โดยเฉพาะอย่างยิ่งโดยการบำบัดพื้นผิวซิลิกอนด้วยสารเคมีต่างๆ
ในทางเคมี ซิลิคอนจะไม่ใช้งาน ที่อุณหภูมิห้อง มันจะทำปฏิกิริยากับก๊าซฟลูออรีนเท่านั้น ซึ่งส่งผลให้เกิดซิลิคอนเตตราฟลูออไรด์ SiF 4 ที่ระเหยง่าย เมื่อถูกความร้อนจนถึงอุณหภูมิ 400-500°C ซิลิคอนจะทำปฏิกิริยากับออกซิเจนเพื่อสร้างไดออกไซด์ SiO 2 พร้อมกับคลอรีน โบรมีน และไอโอดีน เพื่อสร้างเตตราฮาไลด์ SiHal 4 ที่มีความผันผวนสูงที่สอดคล้องกัน
ซิลิคอนไม่ทำปฏิกิริยาโดยตรงกับไฮโดรเจน สารประกอบของซิลิคอนกับไฮโดรเจนเป็นไซเลน (ซม.ไซลันส์)ด้วยสูตรทั่วไป Si n H 2n+2 - ได้ทางอ้อม Monosilane SiH 4 (มักเรียกว่าไซเลน) จะถูกปล่อยออกมาเมื่อซิลิไซด์ของโลหะทำปฏิกิริยากับสารละลายกรด ตัวอย่างเช่น:
Ca 2 Si + 4HCl = 2CaCl 2 + SiH 4
ไซเลน SiH 4 ที่เกิดขึ้นในปฏิกิริยานี้มีส่วนผสมของไซเลนอื่น ๆ โดยเฉพาะ disilane Si 2 H 6 และ trisilane Si 3 H 8 ซึ่งมีสายโซ่ของอะตอมซิลิคอนเชื่อมต่อกันด้วยพันธะเดี่ยว (-Si-Si-Si -) .
ด้วยไนโตรเจน ซิลิคอนที่อุณหภูมิประมาณ 1,000°C จะเกิดไนไตรด์ Si 3 N 4 โดยมีโบรอน ซึ่งเป็นโบไรด์ที่มีความเสถียรทางความร้อนและทางเคมี SiB 3, SiB 6 และ SiB 12 สารประกอบของซิลิคอนและอะนาล็อกที่ใกล้เคียงที่สุดตามตารางธาตุ - คาร์บอน - ซิลิคอนคาร์ไบด์ SiC (carborundum (ซม.กากเพชร)) มีคุณลักษณะเด่นคือมีความแข็งสูงและมีปฏิกิริยาเคมีต่ำ Carborundum ถูกนำมาใช้กันอย่างแพร่หลายเป็นวัสดุที่มีฤทธิ์กัดกร่อน
เมื่อซิลิคอนถูกให้ความร้อนด้วยโลหะ จะเกิดซิลิไซด์ (ซม.ซิลิไซด์)- ซิลิไซด์สามารถแบ่งออกเป็นสองกลุ่ม: ไอออนิก-โควาเลนต์ (ซิลิไซด์ของโลหะอัลคาไล โลหะอัลคาไลน์เอิร์ท และแมกนีเซียม เช่น Ca 2 Si, Mg 2 Si ฯลฯ) และโลหะที่มีลักษณะคล้ายโลหะ (ซิลิไซด์ของโลหะทรานซิชัน) ซิลิไซด์ของโลหะที่ใช้งานจะสลายตัวภายใต้อิทธิพลของกรด ซิลิไซด์ของโลหะทรานซิชันมีความเสถียรทางเคมีและไม่สลายตัวภายใต้อิทธิพลของกรด ซิลิไซด์คล้ายโลหะมีจุดหลอมเหลวสูง (สูงถึง 2,000°C) ซิลิไซด์ที่มีลักษณะคล้ายโลหะที่เกิดขึ้นบ่อยที่สุดคือองค์ประกอบ MSi, M 3 Si 2, M 2 Si 3, M 5 Si 3 และ MSi 2 ซิลิไซด์คล้ายโลหะมีความเฉื่อยทางเคมีและทนทานต่อออกซิเจนแม้ในอุณหภูมิสูง
ซิลิคอนไดออกไซด์ SiO 2 เป็นออกไซด์ที่เป็นกรดที่ไม่ทำปฏิกิริยากับน้ำ มีอยู่ในรูปของโพลีมอร์ฟหลายชนิด (ควอตซ์ (ซม.ควอตซ์), ไตรไดไมต์, คริสโตบาไลท์, SiO ที่เป็นแก้ว 2) จากการดัดแปลงเหล่านี้ ควอตซ์มีความสำคัญในทางปฏิบัติมากที่สุด ควอตซ์มีคุณสมบัติเพียโซอิเล็กทริก (ซม.วัสดุเพียโซอิเล็กทริก)มีความโปร่งใสต่อรังสีอัลตราไวโอเลต (UV) โดดเด่นด้วยค่าสัมประสิทธิ์การขยายตัวทางความร้อนที่ต่ำมากดังนั้นจานที่ทำจากควอตซ์จึงไม่แตกร้าวภายใต้การเปลี่ยนแปลงของอุณหภูมิสูงถึง 1,000 องศา
ควอตซ์ทนต่อสารเคมีต่อกรด แต่ทำปฏิกิริยากับกรดไฮโดรฟลูออริก:
SiO 2 + 6HF =H 2 + 2H 2 O
และก๊าซไฮโดรเจนฟลูออไรด์ HF:
SiO 2 + 4HF = SiF 4 + 2H 2 O
ปฏิกิริยาทั้งสองนี้ใช้กันอย่างแพร่หลายในการแกะสลักกระจก
เมื่อ SiO 2 หลอมรวมกับอัลคาไลและออกไซด์พื้นฐาน เช่นเดียวกับคาร์บอเนตของโลหะที่ใช้งานอยู่ จะเกิดซิลิเกตขึ้น (ซม.ซิลิเกต)- เกลือของกรดซิลิซิกที่ไม่ละลายน้ำอ่อนมากซึ่งไม่มีองค์ประกอบคงที่ (ซม.กรดซิลิก)สูตรทั่วไป xH 2 O ySiO 2 (บ่อยครั้งในวรรณกรรมที่พวกเขาเขียนไม่ถูกต้องมากไม่เกี่ยวกับกรดซิลิซิก แต่เกี่ยวกับกรดซิลิซิกแม้ว่าในความเป็นจริงพวกเขากำลังพูดถึงสิ่งเดียวกัน) ตัวอย่างเช่น สามารถได้รับโซเดียมออร์โธซิลิเกต:
SiO 2 + 4NaOH = (2Na 2 O) SiO 2 + 2H 2 O,
แคลเซียมเมตาซิลิเกต:
SiO 2 + CaO = CaO SiO 2
หรือผสมแคลเซียมและโซเดียมซิลิเกต:
นา 2 CO 3 + CaCO 3 + 6SiO 2 = นา 2 O CaO 6SiO 2 + 2CO 2
กระจกหน้าต่างทำจากซิลิเกต Na 2 O·CaO·6SiO 2
ควรสังเกตว่าซิลิเกตส่วนใหญ่ไม่มีองค์ประกอบคงที่ ในบรรดาซิลิเกตทั้งหมด มีเพียงโซเดียมและโพแทสเซียมซิลิเกตเท่านั้นที่ละลายในน้ำได้ สารละลายของซิลิเกตเหล่านี้ในน้ำเรียกว่าแก้วที่ละลายน้ำได้ เนื่องจากการไฮโดรไลซิส สารละลายเหล่านี้จึงมีคุณลักษณะพิเศษโดยมีสภาพแวดล้อมที่มีความเป็นด่างสูง ซิลิเกตไฮโดรไลซ์มีลักษณะเฉพาะคือการก่อตัวของสารละลายคอลลอยด์ที่ไม่เป็นความจริง เมื่อสารละลายโซเดียมหรือโพแทสเซียมซิลิเกตกลายเป็นกรด จะเกิดการตกตะกอนของกรดซิลิซิกไฮเดรตสีขาวที่เป็นเจลาติน
องค์ประกอบโครงสร้างหลักของทั้งซิลิคอนไดออกไซด์ที่เป็นของแข็งและซิลิเกตทั้งหมดคือกลุ่มที่อะตอมของซิลิคอน Si ถูกล้อมรอบด้วยจัตุรมุขที่มีอะตอมออกซิเจน 4 อะตอม O ในกรณีนี้ ออกซิเจนแต่ละอะตอมจะเชื่อมต่อกับอะตอมของซิลิคอน 2 อะตอม ชิ้นส่วนสามารถเชื่อมต่อถึงกันได้หลายวิธี ในบรรดาซิลิเกตตามลักษณะของการเชื่อมต่อในชิ้นส่วนพวกมันจะถูกแบ่งออกเป็นเกาะ, โซ่, ริบบิ้น, ชั้น, กรอบและอื่น ๆ
เมื่อ SiO 2 ถูกรีดิวซ์ด้วยซิลิคอนที่อุณหภูมิสูง จะเกิดซิลิคอนมอนอกไซด์ขององค์ประกอบ SiO ขึ้นมา
ซิลิคอนมีลักษณะเฉพาะคือการก่อตัวของสารประกอบออร์กาโนซิลิคอน (ซม.สารประกอบออร์กาโนซิโลน)ซึ่งอะตอมของซิลิคอนเชื่อมต่อกันเป็นสายโซ่ยาวเนื่องจากการเชื่อมอะตอมออกซิเจน -O- และกับแต่ละอะตอมของซิลิคอนนอกเหนือจากอะตอม O สองอะตอมแล้วยังมีอนุมูลอินทรีย์อีกสองตัว R 1 และ R 2 = CH 3, C 2 H 5 ติด C 6 H 5, CH 2 CH 2 CF 3 เป็นต้น
แอปพลิเคชัน
ซิลิคอนถูกใช้เป็นวัสดุเซมิคอนดักเตอร์ ควอตซ์ถูกใช้เป็นเพียโซอิเล็กทริกเป็นวัสดุสำหรับการผลิตเครื่องครัวเคมีทนความร้อน (ควอทซ์) และหลอด UV ซิลิเกตถูกนำมาใช้กันอย่างแพร่หลายเป็นวัสดุก่อสร้าง กระจกหน้าต่างเป็นซิลิเกตอสัณฐาน วัสดุออร์กาโนซิลิคอนมีลักษณะพิเศษคือต้านทานการสึกหรอสูง และมีการใช้กันอย่างแพร่หลายในทางปฏิบัติ เช่น น้ำมันซิลิโคน กาว ยาง และวาร์นิช
บทบาททางชีวภาพ
สำหรับสิ่งมีชีวิตบางชนิด ซิลิคอนเป็นองค์ประกอบทางชีวภาพที่สำคัญ (ซม.องค์ประกอบทางชีวภาพ)- เป็นส่วนหนึ่งของโครงสร้างรองรับในพืชและโครงกระดูกในสัตว์ ซิลิคอนมีความเข้มข้นในปริมาณมากโดยสิ่งมีชีวิตในทะเล - ไดอะตอม (ซม.สาหร่ายไดอะตอม), นักรังสีวิทยา (ซม.เรดิโอลาเรีย),ฟองน้ำ (ซม.ฟองน้ำ)- เนื้อเยื่อของกล้ามเนื้อมนุษย์ประกอบด้วยซิลิคอน (1-2)·10 -2% เนื้อเยื่อกระดูก - 17·10 -4% เลือด - 3.9 มก./ลิตร ซิลิคอนมากถึง 1 กรัมเข้าสู่ร่างกายมนุษย์พร้อมอาหารทุกวัน
สารประกอบซิลิกอนไม่เป็นพิษ แต่การสูดดมอนุภาคที่มีการกระจายตัวสูงของทั้งซิลิเกตและซิลิกอนไดออกไซด์ซึ่งก่อตัวขึ้นเช่นระหว่างการระเบิดเมื่อสกัดหินในเหมืองในระหว่างการทำงานของเครื่องพ่นทราย ฯลฯ อนุภาคขนาดเล็กของ SiO 2 ที่เข้าไปในปอดจะเป็นอันตรายอย่างยิ่ง พวกเขาและคริสตัลที่เกิดขึ้นจะทำลายเนื้อเยื่อปอดและทำให้เกิดอาการเจ็บป่วยร้ายแรง - ซิลิโคซิส (ซม.ซิลิโคซิส)- เพื่อป้องกันไม่ให้ฝุ่นอันตรายนี้เข้าสู่ปอด คุณควรใช้เครื่องช่วยหายใจเพื่อปกป้องระบบทางเดินหายใจของคุณ
พจนานุกรมสารานุกรม. 2009 .
คำพ้องความหมาย:ดูว่า "ซิลิคอน" ในพจนานุกรมอื่นคืออะไร:
- (สัญลักษณ์ Si) องค์ประกอบทางเคมีสีเทาที่แพร่หลายของกลุ่ม IV ของตารางธาตุ อโลหะ มันถูกแยกออกครั้งแรกโดย Jens BERZELIUS ในปี 1824 ซิลิคอนพบได้ในสารประกอบเช่น SILICA (ซิลิคอนไดออกไซด์) หรือใน... ... พจนานุกรมสารานุกรมวิทยาศาสตร์และเทคนิค
ซิลิคอน- ผลิตได้เกือบทั้งหมดโดยการลดความร้อนด้วยคาร์บอนของซิลิกาโดยใช้เตาอาร์คไฟฟ้า เป็นตัวนำความร้อนและไฟฟ้าได้ไม่ดี แข็งกว่าแก้ว มักจะอยู่ในรูปของผงหรือมักเป็นชิ้นที่ไม่มีรูปร่าง... ... คำศัพท์ที่เป็นทางการ
ซิลิคอน- เคมี ธาตุอโลหะ สัญลักษณ์ ศรี (lat. Silicium) ณ. n. 14, เวลา. ม. 28.08; เป็นที่รู้จักกันในชื่อซิลิคอนอสัณฐานและผลึก (ซึ่งสร้างจากคริสตัลชนิดเดียวกับเพชร) ผงสีน้ำตาล Amorphous K. มีโครงสร้างลูกบาศก์กระจายตัวสูง... ... สารานุกรมโพลีเทคนิคขนาดใหญ่
- (ซิลิเซียม), ศรี, องค์ประกอบทางเคมีของกลุ่ม IV ของตารางธาตุ, เลขอะตอม 14, มวลอะตอม 28.0855; อโลหะ จุดหลอมเหลว 1415°C ซิลิคอนเป็นองค์ประกอบที่มีความอุดมสมบูรณ์มากเป็นอันดับสองของโลกรองจากออกซิเจน โดยปริมาณของมันในเปลือกโลกอยู่ที่ 27.6% โดยน้ำหนัก… … สารานุกรมสมัยใหม่
Si (lat. Silicium * a. silicium, ซิลิคอน; n. Silizium; f. silicium; i. siliseo) สารเคมี องค์ประกอบของกลุ่ม IV เป็นระยะ ระบบเมนเดเลเยฟ n. 14, เวลา. ม. 28,086. ไอโซโทปเสถียรที่พบในธรรมชาติมี 3 ไอโซโทป: 28Si (92.27), 29Si (4.68%), 30Si (3 ... สารานุกรมทางธรณีวิทยา
คำนิยาม
ซิลิคอน- องค์ประกอบที่สิบสี่ของตารางธาตุ การกำหนด - Si จากภาษาละติน "ซิลิเซียม" ตั้งอยู่ในช่วงที่ 3 กลุ่ม IVA หมายถึงอโลหะ ประจุนิวเคลียร์คือ 14
ซิลิคอนเป็นหนึ่งในองค์ประกอบที่พบได้บ่อยที่สุดในเปลือกโลก การศึกษาของเราคิดเป็นร้อยละ 27 (น้ำหนัก) ของเปลือกโลกซึ่งมีความอุดมสมบูรณ์เป็นอันดับสองรองจากออกซิเจน ในธรรมชาติ ซิลิคอนพบได้ในสารประกอบเท่านั้น ในรูปของซิลิคอนไดออกไซด์ SiO 2 เรียกว่าซิลิคอนแอนไฮไดรด์หรือซิลิกา ในรูปของเกลือของกรดซิลิก (ซิลิเกต) อลูมิโนซิลิเกตเป็นธรรมชาติที่แพร่หลายมากที่สุดเช่น ซิลิเกตที่มีอลูมิเนียม เหล่านี้รวมถึงเฟลด์สปาร์ ไมคัส ดินขาว ฯลฯ
เช่นเดียวกับคาร์บอนซึ่งเป็นส่วนหนึ่งของสารอินทรีย์ทั้งหมด ซิลิคอนเป็นองค์ประกอบที่สำคัญที่สุดของอาณาจักรพืชและสัตว์
ภายใต้สภาวะปกติ ซิลิคอนจะเป็นสารสีเทาเข้ม (รูปที่ 1) ดูเหมือนโลหะ ทนไฟ - จุดหลอมเหลวอยู่ที่ 1415 o C มีลักษณะมีความแข็งสูง
ข้าว. 1. ซิลิคอน รูปร่าง.
มวลอะตอมและโมเลกุลของซิลิคอน
มวลโมเลกุลสัมพัทธ์ของสาร (M r) คือตัวเลขที่แสดงจำนวนครั้งที่มวลของโมเลกุลที่กำหนดมากกว่า 1/12 ของมวลอะตอมคาร์บอน และมวลอะตอมสัมพัทธ์ของธาตุ (A r) คือ มวลเฉลี่ยของอะตอมขององค์ประกอบทางเคมีมีกี่เท่ามากกว่ามวล 1/12 ของอะตอมคาร์บอน
เนื่องจากซิลิคอนในสถานะอิสระมีอยู่ในรูปของโมเลกุล Si monatomic ค่าของมวลอะตอมและโมเลกุลจึงตรงกัน พวกมันเท่ากับ 28.084.
การดัดแปลงแบบ Allotropy และ Allotropic ของซิลิคอน
ซิลิคอนสามารถมีอยู่ในรูปแบบของการปรับเปลี่ยนแบบ allotropic สองแบบ: คล้ายเพชร (ลูกบาศก์) (เสถียร) และคล้ายกราไฟท์ (ไม่เสถียร) ซิลิคอนคล้ายเพชรอยู่ในสถานะรวมของแข็ง และซิลิคอนคล้ายกราไฟต์อยู่ในสถานะสัณฐาน พวกเขายังแตกต่างกันในลักษณะและกิจกรรมทางเคมี
ผลึกซิลิคอนเป็นสารสีเทาเข้มที่มีความมันวาวของโลหะ และซิลิคอนอสัณฐานเป็นผงสีน้ำตาล การปรับเปลี่ยนครั้งที่สองมีปฏิกิริยามากกว่าครั้งแรก
ไอโซโทปของซิลิคอน
เป็นที่ทราบกันว่าในธรรมชาติซิลิคอนสามารถพบได้ในรูปของไอโซโทปเสถียรสามชนิด ได้แก่ 28 Si, 29 Si และ 30 Si เลขมวลคือ 28, 29 และ 30 ตามลำดับ นิวเคลียสของอะตอมของไอโซโทปซิลิคอน 28 Si ประกอบด้วยโปรตอน 14 ตัวและนิวตรอน 14 ตัว และไอโซโทป 29 Si และ 30 Si มีจำนวนโปรตอนเท่ากัน คือ 15 และ 16 นิวตรอนตามลำดับ
มีไอโซโทปซิลิคอนเทียมที่มีเลขมวลตั้งแต่ 22 ถึง 44 ซึ่งมีอายุยืนยาวที่สุดคือ 32 Si โดยมีครึ่งชีวิต 170 ปี
ซิลิคอนไอออน
ที่ระดับพลังงานภายนอกของอะตอมซิลิคอนจะมีอิเล็กตรอน 4 ตัว ซึ่งได้แก่ เวเลนซ์:
1วินาที 2 2วินาที 2 2จุด 6 3วินาที 2 3p 2 .
อันเป็นผลมาจากปฏิกิริยาทางเคมี ซิลิคอนสามารถให้เวเลนซ์อิเล็กตรอนได้ เช่น เป็นผู้บริจาคและกลายเป็นไอออนที่มีประจุบวก หรือรับอิเล็กตรอนจากอะตอมอื่น เช่น เป็นตัวรับและกลายเป็นไอออนที่มีประจุลบ:
ศรี 0 -4e → ศรี 4+ ;
ศรี 0 +4e → ศรี 4- .
โมเลกุลและอะตอมของซิลิคอน
ในสถานะอิสระ ซิลิคอนมีอยู่ในรูปของโมเลกุล Si ที่มีอะตอมเดี่ยว ต่อไปนี้เป็นคุณสมบัติบางประการที่แสดงถึงอะตอมและโมเลกุลของซิลิคอน:
โลหะผสมซิลิคอน
ซิลิคอนถูกใช้ในโลหะวิทยา ทำหน้าที่เป็นส่วนประกอบของโลหะผสมหลายชนิด สิ่งสำคัญที่สุดคือโลหะผสมที่มีส่วนประกอบของเหล็ก ทองแดง และอลูมิเนียม
ตัวอย่างการแก้ปัญหา
ตัวอย่างที่ 1
| ออกกำลังกาย | ต้องใช้ซิลิกอน (IV) ออกไซด์ที่มีสิ่งเจือปน 0.2 มวลเท่าใดเพื่อให้ได้โซเดียมซิลิเกต 6.1 กรัม |
| สารละลาย | ให้เราเขียนสมการปฏิกิริยาสำหรับการผลิตโซเดียมซิลิเกตจากซิลิคอน (IV) ออกไซด์: SiO 2 + 2NaOH = นา 2 SiO 3 + H 2 O มาหาปริมาณโซเดียมซิลิเกต: n(นา 2 SiO 3) = ม. (นา 2 SiO 3) / M(นา 2 SiO 3); n(นา 2 SiO 3) = 6.1 / 122 = 0.05 โมล ตามสมการปฏิกิริยา n(Na 2 SiO 3) : n(SiO 2) = 1:1 นั่นคือ n(นา 2 SiO 3) = n(SiO 2) = 0.05 โมล มวลของซิลิคอน (IV) ออกไซด์ (ไม่มีสิ่งเจือปน) จะเท่ากับ: M(SiO 2) = Ar(Si) + 2×Ar(O) = 28 + 2×16 = 28 + 32 = 60 กรัม/โมล m บริสุทธิ์ (SiO 2) = n(SiO 2) ×M(SiO 2) = 0.05 × 60 = 3 กรัม จากนั้นมวลของซิลิคอน (IV) ออกไซด์ที่จำเป็นสำหรับปฏิกิริยาจะเท่ากับ: m(SiO 2) =m บริสุทธิ์ (SiO 2)/w สิ่งเจือปน = 3 / 0.2 = 15 กรัม |
| คำตอบ | 15 ก |
ตัวอย่างที่ 2
| ออกกำลังกาย | สามารถรับโซเดียมซิลิเกตได้เป็นจำนวนเท่าใดโดยการหลอมซิลิคอน (IV) ออกไซด์กับโซดา 64.2 กรัม ซึ่งเป็นเศษส่วนมวลของสิ่งเจือปนซึ่งก็คือ 5% |
| สารละลาย | ให้เราเขียนสมการปฏิกิริยาสำหรับการผลิตโซเดียมซิลิเกตโดยการหลอมโซดาและซิลิคอน (IV) ออกไซด์: SiO 2 + Na 2 CO 3 = นา 2 SiO 3 + CO 2 - พิจารณามวลทางทฤษฎีของโซดา (คำนวณโดยใช้สมการปฏิกิริยา): n(นา 2 CO 3) = 1 โมล M(นา 2 CO 3) = 2×Ar(Na) + Ar(C) + 3×Ar(O) = 2×23 + 12 + 3×16 = 106 กรัม/โมล ม.(นา 2 CO 3) = n(นา 2 CO 3) ×M(นา 2 CO 3) = 1 × 106 = 106ก. มาหามวลโซดาที่ใช้งานได้จริง: w บริสุทธิ์ (Na 2 CO 3) = 100% - w สิ่งเจือปน = 100% - 5% = 95% = 0.95 ม. บริสุทธิ์ (นา 2 CO 3) = ม. (นา 2 CO 3) ×w บริสุทธิ์ (นา 2 CO 3); ม. บริสุทธิ์ (นา 2 CO 3) = 64.2 × 0.95 = 61 กรัม ลองคำนวณมวลทางทฤษฎีของโซเดียมซิลิเกต: n(นา 2 SiO 3) = 1 โมล M(นา 2 SiO 3) = 2×Ar(Na) + Ar(Si) + 3×Ar(O) = 2×23 + 28 + 3×16 = 122 กรัม/โมล ม.(นา 2 SiO 3) = n(นา 2 SiO 3) ×M(นา 2 SiO 3) = 1 × 122 = 122 ก. ปล่อยให้มวลในทางปฏิบัติของโซเดียมซิลิเกตเป็น x g เรามาสร้างสัดส่วนกัน: 61 ก. นา 2 CO 3 - x ก. นา 2 SiO 3; 106 ก. นา 2 CO 3 - 122 ก. นา 2 SiO 3 ดังนั้น x จะเท่ากับ: x = 122 × 61/106 = 70.2 ก. ซึ่งหมายความว่ามวลของโซเดียมซิลิเกตที่ปล่อยออกมาคือ 70.2 กรัม |
| คำตอบ | 70.2 ก |
 “ค่ำคืนแห่งปริศนาจากผลงานของ S.
“ค่ำคืนแห่งปริศนาจากผลงานของ S. ในประเด็นของการผ่านการสอบ Unified State ในช่วงต้น การรับรองเบื้องต้นของการสอบ Unified State
ในประเด็นของการผ่านการสอบ Unified State ในช่วงต้น การรับรองเบื้องต้นของการสอบ Unified State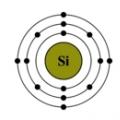 ซิลิคอนในธรรมชาติ (25.8% ในเปลือกโลก)
ซิลิคอนในธรรมชาติ (25.8% ในเปลือกโลก)