ทฤษฎี สมการ และสูตรทางจลน์ศาสตร์โมเลกุลเบื้องต้น บทคัดย่อ: หลักการพื้นฐานของทฤษฎีจลน์ศาสตร์ระดับโมเลกุล
ตามทฤษฎีจลน์ศาสตร์โมเลกุล (MKT) สารทั้งหมดประกอบด้วยอนุภาคขนาดเล็ก - โมเลกุล โมเลกุลมีการเคลื่อนที่อย่างต่อเนื่องและมีปฏิสัมพันธ์ระหว่างกัน
MCT ได้รับการพิสูจน์จากการทดลองจำนวนมากและปรากฏการณ์ทางกายภาพจำนวนมาก ลองพิจารณาบทบัญญัติหลักสามประการของมัน
สารทั้งหมดประกอบด้วยอนุภาค
1) สสารทุกชนิดประกอบด้วยอนุภาคเล็กๆ เช่น โมเลกุล อะตอม ไอออน ฯลฯ ซึ่งแยกจากกันด้วยช่องว่าง
โมเลกุล- อนุภาคเสถียรที่เล็กที่สุดของสารซึ่งยังคงคุณสมบัติทางเคมีพื้นฐานไว้
โมเลกุลที่สร้างสารนี้เหมือนกันทุกประการ สารต่าง ๆ ประกอบด้วยโมเลกุลต่างกัน มีโมเลกุลที่แตกต่างกันจำนวนมากในธรรมชาติ
โมเลกุลประกอบด้วยอนุภาคขนาดเล็กที่เรียกว่าอะตอม
อะตอม- อนุภาคที่เล็กที่สุดขององค์ประกอบทางเคมีที่รักษาคุณสมบัติทางเคมีของมัน
จำนวนอะตอมที่แตกต่างกันนั้นค่อนข้างน้อยและเท่ากับจำนวนองค์ประกอบทางเคมี (116) และไอโซโทปของพวกมัน (ประมาณ 1,500)
อะตอมเป็นเอนทิตีที่ซับซ้อนมาก แต่ MKT แบบคลาสสิกใช้แบบจำลองของอะตอมในรูปของอนุภาคทรงกลมที่เป็นของแข็งและแบ่งแยกไม่ได้
การมีช่องว่างระหว่างโมเลกุลเกิดขึ้นตามมา เช่น จากการทดลองกับการแทนที่ของของเหลวชนิดต่างๆ ปริมาตรของส่วนผสมจะน้อยกว่าผลรวมของปริมาตรของของเหลวผสมเสมอ ปรากฏการณ์ของการซึมผ่าน ความสามารถในการอัด และการละลายของสารยังบ่งชี้ว่าสารเหล่านี้ไม่ต่อเนื่อง แต่ประกอบด้วยอนุภาคแต่ละอนุภาคที่คั่นด้วยช่องว่าง
โดยใช้วิธีการวิจัยสมัยใหม่ (กล้องจุลทรรศน์อิเล็กตรอนและกล้องจุลทรรศน์โพรบ) ทำให้ได้ภาพโมเลกุล
*กฎแห่งอัตราส่วนพหุคูณ
การมีอยู่ของโมเลกุลได้รับการยืนยันอย่างชาญฉลาดตามกฎของอัตราส่วนหลายส่วน อ่านว่า: “เมื่อสารประกอบ (สาร) ที่แตกต่างกันเกิดขึ้นจากธาตุทั้งสอง มวลของธาตุหนึ่งในสารประกอบที่ต่างกันจะสัมพันธ์กันเป็นจำนวนเต็ม กล่าวคือ พวกมันมีหลายอัตราส่วน” ตัวอย่างเช่น ไนโตรเจนและออกซิเจนให้สารประกอบห้าชนิด: N 2 O, N 2 O 2, N 2 O 3, N 2 O 4, N 2 O 5 ในนั้นออกซิเจนจะรวมกับไนโตรเจนในปริมาณเท่ากันในปริมาณหลายอัตราส่วน 1:2:3:4:5 กฎแห่งอัตราส่วนพหุคูณนั้นอธิบายได้ง่าย สารทุกชนิดประกอบด้วยโมเลกุลที่เหมือนกันและมีองค์ประกอบอะตอมที่สอดคล้องกัน เนื่องจากโมเลกุลทั้งหมดของสารที่กำหนดเหมือนกัน อัตราส่วนของปริมาณน้ำหนักของธาตุเชิงเดี่ยวที่ประกอบกันเป็นทั้งร่างกายจึงเหมือนกันกับในแต่ละโมเลกุล ดังนั้นจึงเป็นผลคูณของน้ำหนักอะตอม ซึ่งได้รับการยืนยันแล้ว โดยประสบการณ์
มวลของโมเลกุล
กำหนดมวลของโมเลกุลด้วยวิธีปกติเช่น แน่นอนว่าการชั่งน้ำหนักนั้นเป็นไปไม่ได้ เธอยังเด็กเกินไปสำหรับเรื่องนั้น ปัจจุบันมีหลายวิธีในการกำหนดมวลของโมเลกุล โดยเฉพาะมวลที่คำนวณโดยใช้แมสสเปกโตรกราฟ ม 0 ของอะตอมทั้งหมดในตารางธาตุ
ดังนั้น สำหรับไอโซโทปคาร์บอน \(~^(12)_6C\) ม 0 = 1.995·10 -26 กก. เนื่องจากมวลของอะตอมและโมเลกุลมีขนาดเล็กมาก การคำนวณจึงมักจะใช้ค่ามวลที่ไม่สัมบูรณ์ แต่เป็นค่ามวลสัมพัทธ์ ซึ่งได้มาจากการเปรียบเทียบมวลของอะตอมและโมเลกุลกับหน่วยมวลอะตอม ซึ่งเลือกเป็น \(~\dfrac(1)( 12)\) ส่วนหนึ่งของมวลอะตอมของไอโซโทปคาร์บอน \(~^(12)_6C\):
1 อามู = 1/12 ม 0C = 1.660·10 -27 กก.
โมเลกุลสัมพัทธ์(หรืออะตอม) มวล ม r คือปริมาณที่แสดงจำนวนครั้งที่มวลของโมเลกุล (หรืออะตอม) มากกว่าหน่วยมวลอะตอม:
\(~M_r = \dfrac(m_0)(\dfrac(1)(12) \cdot m_(0C)) . \qquad (1)\)
มวลโมเลกุลสัมพัทธ์ (อะตอม) เป็นปริมาณที่ไม่มีมิติ
มวลอะตอมสัมพัทธ์ขององค์ประกอบทางเคมีทั้งหมดระบุไว้ในตารางธาตุ ดังนั้น สำหรับไฮโดรเจนคือ 1.008 สำหรับฮีเลียมคือ 4.0026 เมื่อทำการคำนวณ มวลอะตอมสัมพัทธ์จะถูกปัดเศษให้เป็นจำนวนเต็มที่ใกล้ที่สุด ตัวอย่างเช่น ไฮโดรเจนมีมากถึง 1 ฮีเลียมมีมากถึง 4
มวลโมเลกุลสัมพัทธ์ของสารที่กำหนดจะเท่ากับผลรวมของมวลอะตอมสัมพัทธ์ขององค์ประกอบที่ประกอบเป็นโมเลกุลของสารที่กำหนด- คำนวณโดยใช้ตารางธาตุและสูตรทางเคมีของสาร
ใช่แล้ว สำหรับน้ำ น้ำ น้ำหนักโมเลกุลสัมพัทธ์คือ มร = 1 2 + 16 = 18
ปริมาณของสาร ค่าคงตัวของอาโวกาโดร
ปริมาณของสสารที่มีอยู่ในร่างกายถูกกำหนดโดยจำนวนโมเลกุล (หรืออะตอม) ในร่างกายนั้น เนื่องจากจำนวนโมเลกุลในร่างกายที่มองเห็นด้วยตาเปล่ามีขนาดใหญ่มาก เพื่อกำหนดปริมาณของสารในร่างกาย จึงเปรียบเทียบจำนวนโมเลกุลในนั้นกับจำนวนอะตอมใน 0.012 กิโลกรัมของไอโซโทปคาร์บอน \(~^(12)_6C \)
ปริมาณของสาร ν - ค่าเท่ากับอัตราส่วนของจำนวนโมเลกุล (อะตอม) เอ็นในร่างกายที่กำหนดตามจำนวนอะตอม เอ็น A ใน 0.012 กิโลกรัมของไอโซโทปคาร์บอน \(~^(12)_6C\):
\(~\nu = \dfrac(N)(N_A) . \qquad (2)\)
ปริมาณของสารมีหน่วย SI คือ โมล 1 โมล- ปริมาณของสารที่มีองค์ประกอบโครงสร้างจำนวนเท่ากัน (อะตอม โมเลกุล ไอออน) เท่ากับจำนวนอะตอมในไอโซโทปคาร์บอน 0.012 กิโลกรัม \(~^(12)_6C\)
เรียกว่าจำนวนอนุภาคในหนึ่งโมลของสาร ค่าคงตัวของอาโวกาโดร.
\(~N_A = \dfrac(0.012)(m_(0C))= \dfrac(0.012)(1.995 \cdot 10^(-26))\) = 6.02·10 23 โมล -1 (3)
ดังนั้น สารใดๆ 1 โมลจะมีจำนวนอนุภาคเท่ากัน เอ็นอนุภาค ตั้งแต่มีมวล ม 0 อนุภาคมีความแตกต่างกันตามสารต่างๆ มวลก็ต่างกันเช่นกัน เอ็น A ของอนุภาคจะแตกต่างกันไปตามสารต่างๆ
มวลของสารที่รับเข้าไปมีปริมาณ 1 โมล เรียกว่า มวลฟันกราม ม:
\(~M = m_0 N_A . \qquad (4)\)
หน่วย SI ของมวลโมลาร์คือ กิโลกรัมต่อโมล (kg/mol)
ระหว่างมวลกราม Μ และน้ำหนักโมเลกุลสัมพัทธ์ ม r มีความสัมพันธ์ดังต่อไปนี้:
\(~M = M_r \cdot 10^(-3) .\)
ดังนั้น มวลโมเลกุลของคาร์บอนไดออกไซด์คือ 44 และมวลโมลาร์คือ 44·10 -3 กิโลกรัม/โมล
ทราบมวลของสารและมวลโมลของมัน มคุณสามารถค้นหาจำนวนโมล (ปริมาณของสาร) ในร่างกาย\[~\nu = \dfrac(m)(M)\]
จากนั้นจากสูตร (2) จำนวนอนุภาคในร่างกาย
\(~N = \nu N_A = \dfrac(m)(M) N_A .\)
เมื่อทราบมวลโมลาร์และค่าคงที่ของอาโวกาโดร คุณสามารถคำนวณมวลของโมเลกุลหนึ่งได้:
\(~m_0 = \dfrac(M)(N_A) = \dfrac(m)(N) .\)
ขนาดโมเลกุล
ขนาดของโมเลกุลเป็นค่าสัมพัทธ์ นี่คือวิธีที่เขาประเมิน ระหว่างโมเลกุลพร้อมกับแรงดึงดูด แรงผลักก็ทำหน้าที่เช่นกัน ดังนั้นโมเลกุลจึงสามารถเข้าใกล้กันในระยะห่างที่กำหนดเท่านั้น ง(รูปที่ 1)
เรียกว่าระยะห่างของการเข้าใกล้สูงสุดระหว่างจุดศูนย์กลางของโมเลกุลทั้งสอง เส้นผ่านศูนย์กลางที่มีประสิทธิภาพโมเลกุล ง(สันนิษฐานว่าโมเลกุลมีรูปร่างเป็นทรงกลม)
ขนาดของโมเลกุลของสารต่าง ๆ นั้นไม่เท่ากัน แต่ทั้งหมดจะอยู่ในลำดับ 10 -10 ม. เช่น เล็กมาก
ดูเพิ่มเติม
- กิโคอิน เอ.เค. มวลและปริมาณของสสาร หรือประมาณ “ความผิดพลาด” ประการหนึ่งของนิวตัน // ควอนตัม - พ.ศ. 2527. - ฉบับที่ 10. - หน้า 26-27
- กิโคอิน เอ.เค. วิธีง่ายๆ ในการกำหนดขนาดของโมเลกุล // ควอนตัม - 2526. - ฉบับที่ 9. - หน้า 29-30
โมเลกุลเคลื่อนที่แบบสุ่ม
2) โมเลกุลมีการเคลื่อนที่แบบสุ่ม (ความร้อน) อย่างต่อเนื่อง
ประเภทของการเคลื่อนที่ด้วยความร้อน (การแปล การสั่น การหมุน) ของโมเลกุลขึ้นอยู่กับลักษณะของอันตรกิริยาและการเปลี่ยนแปลงเมื่อสารเปลี่ยนจากสถานะการรวมตัวหนึ่งไปยังอีกสถานะหนึ่ง ความรุนแรงของการเคลื่อนที่ด้วยความร้อนยังขึ้นอยู่กับอุณหภูมิของร่างกายด้วย
ให้เราแสดงหลักฐานบางประการเกี่ยวกับการเคลื่อนที่แบบสุ่ม (วุ่นวาย) ของโมเลกุล: ก) ความปรารถนาของก๊าซที่จะครอบครองปริมาตรทั้งหมดที่ให้ไว้; ข) การแพร่กระจาย; c) การเคลื่อนที่แบบบราวเนียน
การแพร่กระจาย
การแพร่กระจาย- การแทรกซึมของโมเลกุลของสารที่สัมผัสกันโดยธรรมชาติซึ่งนำไปสู่การปรับความเข้มข้นของสารให้เท่ากันตลอดปริมาตรทั้งหมด ในระหว่างการแพร่กระจาย โมเลกุลของวัตถุที่อยู่ติดกันซึ่งเคลื่อนที่อย่างต่อเนื่องจะเจาะเข้าไปในช่องว่างระหว่างโมเลกุลของกันและกันและมีการกระจายระหว่างกัน
การแพร่กระจายปรากฏอยู่ในร่างกายทั้งหมด - ก๊าซ ของเหลว ของแข็ง แต่มีระดับที่แตกต่างกัน
สามารถตรวจจับการแพร่กระจายของก๊าซได้ เช่น ในกรณีที่เปิดภาชนะที่มีก๊าซมีกลิ่นอยู่ในห้อง หลังจากนั้นสักพักแก๊สจะกระจายไปทั่วห้อง
การแพร่กระจายในของเหลวเกิดขึ้นช้ากว่าในก๊าซมาก ตัวอย่างเช่นหากคุณเทสารละลายคอปเปอร์ซัลเฟตลงในแก้วเป็นครั้งแรกจากนั้นจึงเติมน้ำหนึ่งชั้นอย่างระมัดระวังและทิ้งแก้วไว้ในห้องที่มีอุณหภูมิคงที่จากนั้นหลังจากนั้นไม่นานก็มีขอบเขตที่แหลมคมระหว่างสารละลายคอปเปอร์ซัลเฟต และน้ำจะหายไป และหลังจากนั้นไม่กี่วันของเหลวก็จะผสมกัน
การแพร่กระจายในของแข็งเกิดขึ้นช้ากว่าในของเหลวด้วยซ้ำ (จากหลายชั่วโมงไปจนถึงหลายปี) สามารถสังเกตได้เฉพาะในร่างกายที่ขัดเงาอย่างดีเท่านั้น เมื่อระยะห่างระหว่างพื้นผิวของวัตถุที่ขัดเงานั้นใกล้กับระยะห่างระหว่างโมเลกุล (10 -8 ซม.) ในกรณีนี้ อัตราการแพร่กระจายจะเพิ่มขึ้นตามอุณหภูมิและความดันที่เพิ่มขึ้น
การแพร่กระจายมีบทบาทสำคัญในธรรมชาติและเทคโนโลยี ในธรรมชาติ ต้องขอบคุณการแพร่กระจาย พืชจึงได้รับการบำรุงจากดิน ร่างกายมนุษย์และสัตว์ดูดซับสารอาหารผ่านผนังทางเดินอาหาร ในเทคโนโลยีโดยใช้การแพร่กระจาย เช่น ชั้นผิวของผลิตภัณฑ์โลหะจะอิ่มตัวด้วยคาร์บอน (ซีเมนต์) เป็นต้น
- ชนิดของการแพร่กระจายก็คือ การดูดซึม- การซึมผ่านของของเหลวและสารละลายผ่านพาร์ติชันกึ่งซึมผ่านที่มีรูพรุน
การเคลื่อนไหวแบบบราวเนียน
การเคลื่อนไหวของบราวเนียนถูกค้นพบในปี พ.ศ. 2370 โดยนักพฤกษศาสตร์ชาวอังกฤษ อาร์. บราวน์ การให้เหตุผลทางทฤษฎีจากมุมมองของ MKT ได้รับในปี พ.ศ. 2448 โดย A. Einstein และ M. Smoluchowski
การเคลื่อนไหวแบบบราวเนียน- นี่คือการเคลื่อนที่แบบสุ่มของอนุภาคของแข็งขนาดเล็กที่ "แขวนลอย" ในของเหลว (ก๊าซ)
อนุภาค "แขวนลอย" คืออนุภาคที่มีความหนาแน่นของสารเทียบได้กับความหนาแน่นของตัวกลางที่อนุภาคนั้นตั้งอยู่ อนุภาคดังกล่าวอยู่ในสภาวะสมดุลและอิทธิพลภายนอกเพียงเล็กน้อยทำให้เกิดการเคลื่อนที่
การเคลื่อนที่แบบบราวเนียนมีลักษณะดังนี้:

สาเหตุของการเคลื่อนที่แบบบราวเนียนคือ:
- การเคลื่อนที่อย่างวุ่นวายทางความร้อนของโมเลกุลของตัวกลางซึ่งมีอนุภาคบราวเนียนตั้งอยู่
- ไม่มีการชดเชยที่สมบูรณ์สำหรับผลกระทบของโมเลกุลของตัวกลางในอนุภาคนี้จากด้านต่าง ๆ เนื่องจากการเคลื่อนที่ของโมเลกุลนั้นเป็นแบบสุ่ม
เมื่อโมเลกุลของเหลวที่กำลังเคลื่อนที่ชนกับอนุภาคของแข็งใดๆ พวกมันจะถ่ายโอนการเคลื่อนไหวจำนวนหนึ่งไปยังพวกมัน โดยบังเอิญ โมเลกุลจำนวนมากขึ้นอย่างเห็นได้ชัดจะชนอนุภาคด้านหนึ่งมากกว่าอีกด้านหนึ่ง และอนุภาคจะเริ่มเคลื่อนที่
- หากอนุภาคมีขนาดใหญ่เพียงพอ จำนวนโมเลกุลที่โจมตีมันจากทุกด้านจะมีขนาดใหญ่มาก ผลกระทบของพวกมันจะได้รับการชดเชย ณ เวลาใดก็ตาม และอนุภาคดังกล่าวแทบจะไม่เคลื่อนที่เลย
ดูเพิ่มเติม
- บรอนสไตน์ ส.ส. อะตอมชั่งน้ำหนักอย่างไร // ควอนตัม. - 2513. - ฉบับที่ 2. - หน้า 26-35
อนุภาคมีปฏิสัมพันธ์กัน
3) อนุภาคในสารเชื่อมต่อกันด้วยแรงปฏิสัมพันธ์ของโมเลกุล - แรงดึงดูดและแรงผลัก
ระหว่างโมเลกุลของสาร แรงดึงดูดและแรงผลักจะกระทำพร้อมกัน แรงเหล่านี้ส่วนใหญ่ขึ้นอยู่กับระยะห่างระหว่างโมเลกุล จากการศึกษาเชิงทดลองและเชิงทฤษฎี แรงอันตรกิริยาระหว่างโมเลกุลนั้นมีสัดส่วนผกผัน n- ระดับระยะห่างระหว่างโมเลกุล:
\(~F_r \sim \pm \dfrac(1)(r^n),\)
ที่ไหนสำหรับพลังแห่งแรงดึงดูด n= 7 และสำหรับแรงผลักกัน n= 9 ۞ 15 ดังนั้น แรงผลักจึงเปลี่ยนแปลงมากขึ้นเมื่อระยะห่างเปลี่ยนไป
มีทั้งแรงดึงดูดและแรงผลักเกิดขึ้นระหว่างโมเลกุล มีระยะห่างบ้าง ร 0 ระหว่างโมเลกุล โดยที่แรงผลักจะมีขนาดเท่ากันกับแรงดึงดูด ระยะนี้สอดคล้องกับตำแหน่งสมดุลที่เสถียรของโมเลกุล
เมื่อระยะทางเพิ่มขึ้น รระหว่างโมเลกุล ทั้งแรงดึงดูดและแรงผลักจะลดลง และแรงผลักจะลดลงเร็วขึ้นและมีค่าน้อยกว่าแรงดึงดูด แรงลัพธ์ (แรงดึงดูดและแรงผลัก) มีแนวโน้มที่จะทำให้โมเลกุลเข้าใกล้สถานะดั้งเดิมมากขึ้น แต่เริ่มต้นจากระยะไกล ร m ปฏิสัมพันธ์ของโมเลกุลมีขนาดเล็กมากจนสามารถละเลยได้ ระยะทางที่ยาวที่สุด ร m ซึ่งโมเลกุลยังคงมีปฏิกิริยาโต้ตอบเรียกว่า รัศมีของการกระทำของโมเลกุล (รม. ~ 1.57·10 -9 ม.)
เมื่อระยะทางลดลง รระหว่างโมเลกุล ทั้งแรงดึงดูดและแรงผลักจะเพิ่มขึ้น และแรงผลักจะเพิ่มขึ้นเร็วกว่าและยิ่งใหญ่กว่าแรงดึงดูด แรงลัพธ์ตอนนี้มีแนวโน้มที่จะผลักโมเลกุลออกจากกัน
หลักฐานปฏิสัมพันธ์แรงของโมเลกุล:
ก) การเสียรูปของร่างกายภายใต้อิทธิพลของกำลัง
b) การรักษารูปร่างด้วยวัตถุที่เป็นของแข็ง (แรงดึงดูด)
c) การมีช่องว่างระหว่างโมเลกุล (แรงผลัก)
*กราฟแสดงแรงปฏิสัมพันธ์
ปฏิสัมพันธ์ของโมเลกุลทั้งสองสามารถอธิบายได้โดยใช้กราฟของการฉายภาพผลลัพธ์ เอฟ r แรงดึงดูดและแรงผลักของโมเลกุลจากระยะไกล รระหว่างศูนย์กลางของพวกเขา ลองกำหนดทิศทางของแกนดู รจากโมเลกุล 2 ซึ่งจุดศูนย์กลางตรงกับที่มาของพิกัดซึ่งอยู่ห่างจากจุดนั้น ร 1 ถึงจุดศูนย์กลางของโมเลกุล 2 (รูปที่ 3 ก)
ความแตกต่างในโครงสร้างของก๊าซ ของเหลว และของแข็ง
ในสถานะการรวมตัวของสารที่แตกต่างกัน ระยะห่างระหว่างโมเลกุลจะแตกต่างกัน ดังนั้นความแตกต่างในปฏิกิริยาระหว่างแรงของโมเลกุลและความแตกต่างอย่างมีนัยสำคัญในลักษณะการเคลื่อนที่ของโมเลกุลของก๊าซ ของเหลว และของแข็ง
ใน ก๊าซระยะห่างระหว่างโมเลกุลนั้นมากกว่าขนาดของโมเลกุลหลายเท่า เป็นผลให้แรงอันตรกิริยาระหว่างโมเลกุลของก๊าซมีขนาดเล็กและพลังงานจลน์ของการเคลื่อนที่ด้วยความร้อนของโมเลกุลนั้นเกินกว่าพลังงานศักย์ของอันตรกิริยาของมันมาก แต่ละโมเลกุลเคลื่อนที่อย่างอิสระจากโมเลกุลอื่นด้วยความเร็วมหาศาล (หลายร้อยเมตรต่อวินาที) เปลี่ยนทิศทางและความเร็วเมื่อชนกับโมเลกุลอื่น ความยาวเส้นทางอิสระ λ โมเลกุลของก๊าซขึ้นอยู่กับความดันและอุณหภูมิของก๊าซ ภายใต้สภาวะปกติ λ ~ 10 -7 ม.
ใน ของแข็งพลังแห่งปฏิสัมพันธ์ระหว่างโมเลกุลนั้นยิ่งใหญ่มากจนพลังงานจลน์ของการเคลื่อนที่ของโมเลกุลนั้นน้อยกว่าพลังงานศักย์ของการมีปฏิสัมพันธ์กันมาก โมเลกุลทำการสั่นสะเทือนอย่างต่อเนื่องโดยมีแอมพลิจูดเล็กน้อยรอบตำแหน่งสมดุลคงที่ซึ่งเป็นโหนดของโครงตาข่ายคริสตัล
เวลาที่อนุภาคแกว่งไปมารอบตำแหน่งสมดุลหนึ่งตำแหน่งคือ เวลาแห่ง "ชีวิตที่ตกตะกอน" ของอนุภาค- มีปริมาณของแข็งสูงมาก ดังนั้นของแข็งจึงคงรูปร่างไว้และไม่ไหลภายใต้สภาวะปกติ เวลา "ชีวิตที่ตกลง" ของโมเลกุลขึ้นอยู่กับอุณหภูมิ ใกล้จุดหลอมเหลวจะอยู่ที่ประมาณ 10 –1 – 10 –3 วินาที ที่อุณหภูมิต่ำกว่าอาจเป็นชั่วโมง วัน เดือน
ใน ของเหลวระยะห่างระหว่างโมเลกุลนั้นเล็กกว่าในก๊าซมากและใกล้เคียงกับของแข็งมาก ดังนั้นแรงอันตรกิริยาระหว่างโมเลกุลจึงมีขนาดใหญ่ โมเลกุลของของเหลว เช่น โมเลกุลของของแข็ง จะสั่นสะเทือนรอบตำแหน่งสมดุลที่แน่นอน แต่พลังงานจลน์ของการเคลื่อนที่ของอนุภาคนั้นสมส่วนกับพลังงานศักย์ของอันตรกิริยาของพวกมัน และโมเลกุลมักจะเคลื่อนไปยังตำแหน่งสมดุลใหม่ (เวลา "ชีวิตที่ตกตะกอน" คือ 10–10–10–12 วินาที) สิ่งนี้จะอธิบายความลื่นไหลของของเหลว
ดูเพิ่มเติม
- กิโคอิน เอ.เค. เรื่องสถานะรวมของสสาร // ควอนตัม - พ.ศ. 2527. - ฉบับที่ 9. - หน้า 20-21
วรรณกรรม
Aksenovich L. A. ฟิสิกส์ในโรงเรียนมัธยม: ทฤษฎี การมอบหมายงาน การทดสอบ: หนังสือเรียน เบี้ยเลี้ยงสำหรับสถาบันการศึกษาทั่วไป สิ่งแวดล้อม การศึกษา / L. A. Aksenovich, N. N. Rakina, K. S. Farino; เอ็ด เค.เอส. ฟาริโน. - Mn.: Adukatsiya i vyakhavanne, 2004. - หน้า 119-126.
บางครั้งภายใต้ A.V. เข้าใจความดันบางส่วนของไอน้ำ ในกรณีนี้จะวัดเป็นปาสคาล (Pa)
อุณหภูมิสัมบูรณ์- อุณหภูมิที่วัดได้ในระดับเทอร์โมไดนามิกส์สัมบูรณ์ โดยไม่ขึ้นกับคุณสมบัติของสารเทอร์โมเมตริก นับจากศูนย์สัมบูรณ์ หน่วยที่ ในเอสไอเคลวิน (K)
ศูนย์สัมบูรณ์- จุดเริ่มต้นของอุณหภูมิสัมบูรณ์ ต่ำกว่าอุณหภูมิจุดสามจุดของน้ำ 273.16 K ซึ่งค่าที่ยอมรับคือ 0.01 o C ที่ A.n. การเคลื่อนที่แบบแปลและการหมุนของอะตอมและโมเลกุลหยุดลง แต่พวกมันไม่ได้อยู่นิ่ง แต่อยู่ในสถานะของการสั่นสะเทือน "ศูนย์" จากกฎของอุณหพลศาสตร์เป็นไปตามที่ A.N. ไม่สามารถบรรลุได้ในทางปฏิบัติ
กฎหมายของอาโวกาโดร- หนึ่งในกฎพื้นฐานของก๊าซในอุดมคติ: ปริมาตรที่เท่ากันของก๊าซต่าง ๆ ที่อุณหภูมิและความดันเท่ากันนั้นมีจำนวนโมเลกุลเท่ากัน เปิดดำเนินการในปี พ.ศ. 2354 ในอิตาลี นักฟิสิกส์ A. Avogadro (1776-1856)
อาโวกาโดรคงที่(จำนวน) - จำนวนอนุภาคต่อหน่วยปริมาณของสาร (1 โมล): N A =6.022 10 23 โมล -1 .
สถานะของสสาร- สถานะของสารชนิดเดียวกันที่แตกต่างกันในลักษณะการเคลื่อนที่ด้วยความร้อนของอนุภาค โดยทั่วไปจะมี 3 A.S.V.: แก๊ส ของเหลว และของแข็ง บางครั้งอาจรวมถึงสถานะพลาสมาด้วย สารใน A.S. อยู่ภายใต้เงื่อนไขภายนอกบางอย่าง (อุณหภูมิ ความดัน) การเปลี่ยนแปลงซึ่งนำไปสู่การเปลี่ยนจาก A.S. ไปที่อื่น
กระบวนการอะเดียแบติก (อะเดียแบติก)– แบบจำลองกระบวนการทางอุณหพลศาสตร์ที่ไม่มีการแลกเปลี่ยนความร้อนระหว่างระบบที่พิจารณากับสิ่งแวดล้อม กระบวนการทางอุณหพลศาสตร์ที่แท้จริงถือได้ว่าเป็น A หากเกิดขึ้นในเปลือกฉนวนความร้อนหรือเร็วจนการแลกเปลี่ยนความร้อนไม่มีเวลาเกิดขึ้น
เส้นที่แสดงความสมดุลบนแผนภาพทางอุณหพลศาสตร์ อะเดียแบติกกระบวนการ. สมการก. สำหรับก๊าซในอุดมคตินั้นมีรูปแบบ - เลขชี้กำลังอะเดียแบติกและ กับพีและ กับวีความจุความร้อนที่ความดันและปริมาตรคงที่ตามลำดับ
รัฐอสุรกาย- สถานะของของแข็งที่ไม่มีการจัดเรียงตัวของโมเลกุล ดังนั้นก. สารนี้มีไอโซโทรปิกเช่น มีคุณสมบัติทางกายภาพเหมือนกันทุกทิศทาง และไม่มีจุดหลอมเหลวจำเพาะ
แอนเนรอยด์- บารอมิเตอร์แบบแอนรอยด์ซึ่งเป็นอุปกรณ์สำหรับวัดความดันบรรยากาศส่วนรับซึ่งเป็นกล่องโลหะซึ่งภายในมีการสร้างสุญญากาศอันแรง เมื่อเปลี่ยนตู้เอทีเอ็ม ความดันเปลี่ยนความผิดปกติของกล่องซึ่งด้วยความช่วยเหลือของสปริงและระบบคันโยกที่เกี่ยวข้องทำให้ลูกศรบ่งชี้หมุน
แอนนิโซโทรปี- การพึ่งพาคุณสมบัติทางกายภาพของสารในทิศทาง (ตรงข้ามกับ ไอโซโทรปี- มันสัมพันธ์กับโครงสร้างสั่งการภายในของสื่อ และพบได้ในปรากฏการณ์ของความยืดหยุ่น ความร้อน และการนำไฟฟ้า และการแพร่กระจายของเสียงและแสงในของแข็ง นอกจากนี้ยังสามารถมีอยู่ในอวกาศทางกายภาพเมื่อมีสนามแม่เหล็กไฟฟ้า แรงโน้มถ่วง และสนามอื่นๆ อีกด้วย
ความดันบรรยากาศ- แรงกดดันที่ชั้นบรรยากาศของโลกกระทำต่อวัตถุทั้งหมดในนั้น โดยพิจารณาจากน้ำหนักของเสาอากาศที่วางอยู่ และเป็นปริมาณที่สำคัญที่สุดที่อธิบายสภาวะบรรยากาศของโลก หน่วยโฆษณา ใน SI - Pa, mm Hg ความดันโลหิตปกติ เท่ากับ 760 มม.ปรอท หรือ 1013 hPa.
บารอมิเตอร์- อุปกรณ์สำหรับวัดความดันบรรยากาศ ที่พบมากที่สุดคือเหล็กจัดฟันแบบผิดรูปซึ่งรวมถึงกำไลด้วย - แอนรอยด์(1844, แอล. วิดี). ใน B. เมื่อความดันบรรยากาศเปลี่ยนแปลง เมมเบรนที่หุ้มกล่องที่ใช้สูบอากาศจะโค้งงอ และลูกศรที่เชื่อมต่อกับเมมเบรนผ่านระบบคันโยกจะเบนทิศทาง การกระทำ ของเหลว B. (เช่น ปรอท B. E. Torricelli, 1644) มีพื้นฐานมาจากการปรับสมดุลความดันบรรยากาศกับน้ำหนักของคอลัมน์ของเหลว
คำสั่งซื้อระยะสั้น- การจัดเรียงอะตอมหรือโมเลกุลตามลำดับในระยะใกล้กับระหว่างอะตอม ลักษณะของสารอสัณฐานและของเหลวบางชนิด (พุธ)
กฎหมายบอยล์-มาริออต- หนึ่งในกฎหมาย ก๊าซในอุดมคติ:สำหรับมวลที่กำหนดของก๊าซที่อุณหภูมิคงที่ ผลคูณของความดันและปริมาตรจะเป็นค่าคงที่ สูตร: พีวี=คอนสตรัค- อธิบายกระบวนการไอโซเทอร์มอล
ค่าคงที่ทางกายภาพพื้นฐานค่าหนึ่ง เท่ากับอัตราส่วนของค่าสากล ค่าคงที่ของแก๊ส R ถึง N A.B.p. .รวมอยู่ในความสัมพันธ์ที่สำคัญที่สุดหลายประการของฟิสิกส์เชิงสถิติ: เชื่อมโยง cf พลังงานจลน์ของอนุภาคและอุณหภูมิ เอนโทรปีของระบบกายภาพ และความน่าจะเป็นทางอุณหพลศาสตร์
บราวน์เนียนโมชั่น- การเคลื่อนที่แบบสุ่มของอนุภาคขนาดมหภาคขนาดเล็กที่แขวนลอยอยู่ในของเหลวหรือก๊าซเกิดขึ้นภายใต้อิทธิพลของการเคลื่อนที่ด้วยความร้อนของโมเลกุล การยืนยันด้วยภาพของทฤษฎีจลน์ศาสตร์ของโมเลกุล ค้นพบโดย R. Brown ในปี 1827 อธิบายโดย A. Einstein และ M. Smoluchowski ในปี 1905 ทฤษฎีนี้ได้รับการทดสอบในการทดลองโดย J. Perrin ในปี 1906-11
เครื่องดูดฝุ่น- สถานะของก๊าซที่อยู่ภายในภาชนะที่มีความดันต่ำกว่าบรรยากาศอย่างมีนัยสำคัญ ขึ้นอยู่กับความสัมพันธ์ระหว่างเส้นทางอิสระของอะตอมหรือโมเลกุลและขนาดเชิงเส้นของถัง สุญญากาศสูงพิเศษ สูง ปานกลาง และต่ำมีความโดดเด่น
ความชื้นในอากาศ– ปรากฏการณ์การมีอยู่ของไอน้ำในอากาศ อธิบายโดยปริมาณทางกายภาพ แน่นอนและ ญาติใน . ซึ่งมีการวัด ไฮโกรมิเตอร์
พลังงานภายใน- พลังงานของร่างกายขึ้นอยู่กับสถานะภายในเท่านั้น ประกอบด้วยพลังงานของการเคลื่อนที่แบบสุ่ม (ความร้อน) ของอะตอม โมเลกุล หรืออนุภาคอื่นๆ และพลังงานของการเคลื่อนที่และปฏิกิริยาระหว่างกันภายในอะตอมและระหว่างโมเลกุล (ซม. กฎข้อที่หนึ่งของอุณหพลศาสตร์- ใน MCT จะไม่คำนึงถึงพลังงานของอนุภาคภายในอะตอมและปฏิกิริยาของพวกมัน
กฎข้อที่สองของอุณหพลศาสตร์- หนึ่งในกฎหมายพื้นฐาน อุณหพลศาสตร์ตามที่กระบวนการเป็นระยะเป็นไปไม่ได้ผลลัพธ์เดียวคือประสิทธิภาพการทำงานเทียบเท่ากับปริมาณความร้อนที่ได้รับจากเครื่องทำความร้อน สูตรอื่น: กระบวนการเป็นไปไม่ได้ ผลลัพธ์เดียวคือการถ่ายโอนพลังงานในรูปของความร้อนจากร่างกายที่มีความร้อนน้อยกว่าไปยังร่างกายที่มีความร้อนมากกว่า วี.ซี.ที. เป็นการแสดงออกถึงความปรารถนาของระบบที่ประกอบด้วยอนุภาคที่เคลื่อนที่อย่างโกลาหลจำนวนมากเพื่อเปลี่ยนจากสถานะที่น่าจะเป็นไปได้น้อยกว่าไปเป็นสถานะที่น่าจะเป็นมากขึ้นได้เอง อีกวิธีหนึ่งในการกำหนด V.Z.T: เป็นไปไม่ได้ที่จะสร้างเครื่องจักรการเคลื่อนที่ตลอดกาลประเภทที่สอง
ก๊าซคงที่สากล(R) เป็นหนึ่งในค่าคงที่ทางกายภาพหลักที่รวมอยู่ในสมการสถานะ (ซม.- R=(8.31441±0.00026) J/(โมล K) ความหมายทางกายภาพ: งานของการขยายตัวของก๊าซในอุดมคติหนึ่งโมลในกระบวนการไอโซบาริกโดยมีอุณหภูมิเพิ่มขึ้น 1 เคลวิน
เทอร์โมมิเตอร์แบบแก๊ส- อุปกรณ์สำหรับวัดอุณหภูมิ โดยขึ้นอยู่กับความดันหรือปริมาตรของก๊าซกับอุณหภูมิ
- หนึ่งในกฎหมาย ก๊าซในอุดมคติ: สำหรับมวลที่กำหนดของก๊าซที่ความดันคงที่ อัตราส่วนของปริมาตรต่ออุณหภูมิสัมบูรณ์จะเป็นค่าคงที่ (หรือ: ปริมาตรเป็นสัดส่วนโดยตรงกับอุณหภูมิสัมบูรณ์: โดยที่ α คือสัมประสิทธิ์อุณหภูมิของความดัน) อธิบาย ไอโซบาริกกระบวนการ.
ไฮโกรมิเตอร์– อุปกรณ์วัด แน่นอนหรือ ความชื้นสัมพัทธ์ในอากาศโรงยิมแบ่งออกเป็น เกจวัดน้ำหนัก (เพื่อกำหนดความชื้นสัมพัทธ์), เกจวัดการควบแน่น (เพื่อกำหนดจุดน้ำค้าง), เกจวัดเส้นผม (ความชื้นสัมพัทธ์) และเครื่องวัดไซโครเมทริกหรือไซโครมิเตอร์ (ความชื้นสัมพัทธ์)
องศาเซลเซียสเป็นหน่วยของอุณหภูมิที่ไม่เป็นระบบตาม International Practical Temperature Scale โดยที่ อุณหภูมิ จุดสามจุดน้ำมีอุณหภูมิ 0.01 องศาเซลเซียส และจุดเดือดที่ความดันบรรยากาศปกติคือ 100 องศาเซลเซียส
สั่งซื้อนาน– การจัดเรียงอนุภาค (อะตอมหรือโมเลกุล) ตามลำดับทั่วทั้งปริมาตรของร่างกาย ลักษณะของสารที่เป็นผลึก พ. ปิดรับออเดอร์.
กฎหมายของดาลตัน– หนึ่งในกฎพื้นฐานของก๊าซในอุดมคติ: ความดันของส่วนผสมของก๊าซที่ไม่ทำปฏิกิริยาทางเคมีจะเท่ากับผลรวมของความดันย่อยของก๊าซเหล่านี้
ข้อบกพร่องในคริสตัล– ความไม่สมบูรณ์ของโครงสร้างผลึก การละเมิดการจัดเรียงอนุภาคเป็นระยะอย่างเข้มงวด (อะตอม โมเลกุล ไอออน) ในโหนดของโครงตาข่ายคริสตัล ซึ่งรวมถึงตำแหน่งว่าง (ข้อบกพร่องเฉพาะจุด) ความคลาดเคลื่อน (ข้อบกพร่องเชิงเส้น) ข้อบกพร่องเชิงปริมาตร: รอยแตก รูขุมขน โพรง ฯลฯ มีผลกระทบอย่างมากต่อคุณสมบัติทางกายภาพของคริสตัล
ความคลาดเคลื่อน– ข้อบกพร่องเชิงเส้น ตาข่ายคริสตัลละเมิดการสลับระนาบอะตอมที่ถูกต้อง ในสองมิติจะมีมิติตามลำดับขนาดของอะตอม และในมิติที่สามสามารถทะลุผ่านคริสตัลทั้งหมดได้
การแยกตัวออกจากกัน– กระบวนการสลายตัวของโมเลกุลให้เป็นส่วนที่ง่ายกว่า ได้แก่ อะตอม กลุ่มอะตอม หรือไอออน มันสามารถเกิดขึ้นได้กับอุณหภูมิที่เพิ่มขึ้น (ความร้อน D. ) ในสารละลายอิเล็กโทรไลต์ (อิเล็กโทรไลต์ D. ) และภายใต้อิทธิพลของแสง (โฟโตเคมีคอล D. )
ผลึกเหลว- สถานะของสสารที่พบคุณสมบัติทางโครงสร้างที่อยู่ระหว่างของแข็ง คริสตัลและ ของเหลว.พวกมันถูกสร้างขึ้นในสารที่มีโมเลกุลยาวซึ่งกำหนดทิศทางซึ่งกันและกัน แอนไอโซโทรปีคุณสมบัติทางกายภาพของพวกเขา ใช้ในเทคโนโลยี ชีววิทยา และการแพทย์
เทอร์โมมิเตอร์แบบเหลว– อุปกรณ์วัด อุณหภูมิ,การกระทำนั้นขึ้นอยู่กับการขยายตัวทางความร้อนของของเหลว จ.ที. ขึ้นอยู่กับภูมิภาคของอุณหภูมิ พวกมันจะเต็มไปด้วยปรอท เอทิลแอลกอฮอล์ และของเหลวอื่นๆ
ของเหลว– หนึ่งใน สถานะของการรวมตัวสารที่อยู่ตรงกลางระหว่างของแข็งและก๊าซ เจ..เหมือน. แข็ง,มีกำลังอัดต่ำ มีความหนาแน่นสูง และในเวลาเดียวกัน ชอบ แก๊ส,โดดเด่นด้วยรูปทรงที่แปรผัน (ไหลง่าย) โมเลกุลของเหลว เช่น อนุภาคของของแข็ง ได้รับการสั่นสะเทือนจากความร้อน แต่ตำแหน่งสมดุลของมันจะเปลี่ยนแปลงเป็นครั้งคราว ซึ่งช่วยให้มั่นใจได้ถึงความลื่นไหลของของเหลว
ก๊าซอุดมคติ– แบบจำลองทางจิตของก๊าซซึ่งสามารถละเลยแรงปฏิสัมพันธ์ระหว่างอนุภาคและขนาดของอนุภาคเหล่านี้ได้ เหล่านั้น. อนุภาคถือเป็นจุดวัสดุ และปฏิกิริยาทั้งหมดจะลดลงจนเหลือผลกระทบที่ยืดหยุ่นเต็มที่ ก๊าซหายากที่อุณหภูมิห่างไกลจากอุณหภูมิการควบแน่นจะมีคุณสมบัติใกล้เคียงกันเช่น สมการของรัฐคือ Clapeyron - สมการ Mendeleev.
ไอโซบาร์– เส้นแรงดันคงที่ แสดงสมดุลบนแผนภาพสถานะ กระบวนการไอโซบาริก
กระบวนการไอโซบาร์(ไอโซบาริก) – แบบจำลองทางจิตของกระบวนการทางอุณหพลศาสตร์ที่เกิดขึ้นที่ความดันคงที่ สำหรับก๊าซในอุดมคติจะมีคำอธิบายตามกฎหมาย เกย์-ลุสแซก.
กระบวนการ ISO– กระบวนการทางกายภาพที่เกิดขึ้นที่ความคงตัวของพารามิเตอร์ใดๆ ที่อธิบายสถานะของระบบ (ดู กระบวนการไอโซบาริก, ไอโซเทอร์มอล, ไอโซคอริก).
ไอโซเทอร์ม– เส้นอุณหภูมิคงที่ แสดงสถานะสมดุลบนแผนภาพสถานะ กระบวนการไอโซเทอร์มอล
กระบวนการไอโซเทอร์มอล– แบบจำลองกระบวนการทางอุณหพลศาสตร์ที่เกิดขึ้นที่อุณหภูมิคงที่ ตัวอย่างเช่น การต้มของเหลวที่เป็นเนื้อเดียวกันทางเคมี การละลายผลึกที่เป็นเนื้อเดียวกันทางเคมีที่ความดันภายนอกคงที่ มีการอธิบายไว้สำหรับก๊าซในอุดมคติ กฎหมายบอยล์-แมริออทพ. กระบวนการไอโซบาริก, ไอโซคอริก, อะเดียแบติก
ไอโซโทรปี, ไอโซโทรปี - คุณสมบัติทางกายภาพเหมือนกันทุกทิศทาง มันเกี่ยวข้องกับการขาดโครงสร้างภายในที่เป็นระเบียบของตัวกลางและมีอยู่ในก๊าซ ของเหลว (ยกเว้นผลึกเหลว) และวัตถุอสัณฐาน พ. แอนไอโซโทรปี.
ไอโซโครา- เส้นปริมาตรคงที่ที่แสดงกระบวนการไอโซคอริกสมดุลบนแผนภาพเฟส
กระบวนการไอโซคอริกกระบวนการไอโซคอริกเป็นกระบวนการทางอุณหพลศาสตร์ที่เกิดขึ้นที่ปริมาตรคงที่ของระบบ มีการอธิบายไว้สำหรับก๊าซในอุดมคติ กฎหมายชาร์ลส์.
การระเหย– กระบวนการกลายเป็นไอจากพื้นผิวอิสระของของเหลวที่อุณหภูมิต่ำกว่าจุดเดือด การชลประทานจากพื้นผิวของแข็งเรียกว่าการระเหิด (พ. เดือดนึ่ง).
แคลอรีมิเตอร์- อุปกรณ์สำหรับกำหนดปริมาณแคลอรี่ต่างๆ: ความจุความร้อน ความร้อนจากการเผาไหม้ ความร้อนจากการกลายเป็นไอฯลฯ
เส้นเลือดฝอย– ภาชนะแคบที่มีขนาดหน้าตัดลักษณะเฉพาะน้อยกว่า 1 มิลลิเมตร
ปรากฏการณ์ของเส้นเลือดฝอย- ปรากฏการณ์ที่เกิดจากอิทธิพลของแรงปฏิสัมพันธ์ระหว่างโมเลกุลต่อสมดุลและการเคลื่อนที่ของพื้นผิวอิสระของของเหลว, ส่วนต่อประสานระหว่างของเหลวที่ผสมไม่ได้และขอบเขตของของเหลวกับของแข็ง ตัวอย่างเช่น การขึ้นหรือลงของของเหลวในท่อบางมาก () และในตัวกลางที่มีรูพรุน
คาร์โน ไซเคิล– แบบจำลองทางจิตของกระบวนการวงกลมแบบพลิกกลับได้ซึ่งประกอบด้วยสองกระบวนการ อุณหภูมิคงที่และสอง อะเดียแบติกกระบวนการ ในระหว่างการขยายตัวของอุณหภูมิความร้อน (อุณหภูมิเครื่องทำความร้อน ทีเอ็น) สารทำงาน (ก๊าซในอุดมคติ) จะได้รับปริมาณความร้อน ถามและด้วยการบีบอัดอุณหภูมิคงที่ (อุณหภูมิตู้เย็น ทีเอ็กซ์) - ปริมาณความร้อนถูกลบออก คิวเอ็กซ์- ประสิทธิภาพ ไม่ขึ้นอยู่กับลักษณะของของไหลทำงานและเท่ากับ .
เดือด- กระบวนการระเหยอย่างเข้มข้นไม่เพียง แต่จากพื้นผิวอิสระของของเหลวเท่านั้น แต่ยังตลอดปริมาตรทั้งหมดภายในฟองไอที่เกิดขึ้น อุณหภูมิเคขึ้นอยู่กับลักษณะของของเหลวและความดันภายนอกและอยู่ระหว่าง จุดสามจุดและอุณหภูมิวิกฤติ (ดู ภาวะวิกฤต)
สมการของเมเยอร์- ความสัมพันธ์ที่สร้างความเชื่อมโยงระหว่างความจุความร้อนเชิงโมลของก๊าซอุดมคติที่ความดันคงที่ กับพี และด้วยปริมาตรคงที่ กับวี : ด้วย P = ด้วย V + R - ที่ไหน ร - .
การกระจายแม็กซ์เวลล์- กฎการกระจายความเร็วของโมเลกุลของก๊าซในอุดมคติในสภาวะสมดุลทางอุณหพลศาสตร์
เกจวัดความดัน- อุปกรณ์ตรวจวัด ความดันของเหลวและก๊าซ มี M. สำหรับวัดความดันสัมบูรณ์ วัดจากศูนย์ และ M. สำหรับวัดความดันส่วนเกิน (ความแตกต่างระหว่างความดันสัมบูรณ์และความดันบรรยากาศ) มีปั๊มของเหลว ลูกสูบ เสียรูป และสปริง ขึ้นอยู่กับหลักการทำงาน
วงเดือน- พื้นผิวโค้งของของเหลวในท่อแคบ (คาปิลลารี) หรือระหว่างผนังทึบที่มีระยะห่างกันอย่างใกล้ชิด (ดู)
– ปริมาณทางกายภาพคงที่สำหรับวัสดุที่กำหนด ซึ่งเป็นสัมประสิทธิ์ของสัดส่วนระหว่างความเค้นเชิงกลและความยืดสัมพัทธ์ กฎของฮุค- ม.ยู. อี เท่ากับความเค้นเชิงกลที่เกิดขึ้นในร่างกายที่ผิดรูปเมื่อความยาวเพิ่มขึ้น 2 เท่า หน่วยวัด SI คือปาสคาล
โมเลกุล- อนุภาคเสถียรที่เล็กที่สุดของสาร มีคุณสมบัติทางเคมีทั้งหมด และประกอบด้วยอะตอมที่เหมือนกัน (สารธรรมดา) หรืออะตอมต่าง ๆ (สารเชิงซ้อน) ที่รวมกันด้วยพันธะเคมี พ. อะตอม.
น้ำหนักโมเลกุลคือมวลของโมเลกุลซึ่งแสดงเป็น หน่วยมวลอะตอมพ. มวลฟันกราม
ฟิสิกส์โมเลกุล- สาขาวิชาฟิสิกส์ที่ศึกษาคุณสมบัติทางกายภาพของร่างกาย คุณสมบัติของสถานะรวมของสสาร และกระบวนการของการเปลี่ยนเฟส ขึ้นอยู่กับโครงสร้างโมเลกุลของร่างกาย แรงของปฏิสัมพันธ์ระหว่างโมเลกุล และธรรมชาติของการเคลื่อนที่ด้วยความร้อนของอนุภาค (อะตอม , ไอออน, โมเลกุล) ซม. ฟิสิกส์เชิงสถิติ อุณหพลศาสตร์
มวลฟันกราม- มวลของสารหนึ่งโมล ปริมาณสเกลาร์เท่ากับอัตราส่วนของมวลของร่างกายต่อปริมาณของสาร (จำนวนโมล) ที่บรรจุอยู่ ใน SI มม. เท่ากับ น้ำหนักโมเลกุลสารคูณด้วย 10 -3 และวัดเป็นกิโลกรัมต่อโมล (กก./โมล)
คริสตัลเดี่ยว- เดี่ยว คริสตัลด้วยโครงตาข่ายคริสตัลอันเดียว พวกมันถูกสร้างขึ้นภายใต้สภาพธรรมชาติหรือปลูกเทียมจากการละลาย สารละลาย ไอหรือเฟสของแข็ง พ. โพลีคริสตัล
ไอน้ำอิ่มตัว- ไอน้ำในสมดุลไดนามิกกับเฟสของเหลวหรือของแข็ง สมดุลแบบไดนามิกเป็นที่เข้าใจกันว่าเป็นสถานะที่จำนวนเฉลี่ยของโมเลกุลที่ออกจากของเหลว (ของแข็ง) เท่ากับจำนวนเฉลี่ยของโมเลกุลไอที่กลับสู่ของเหลว (ของแข็ง) ในเวลาเดียวกัน
กระบวนการที่ไม่อาจย้อนกลับได้- กระบวนการที่สามารถเกิดขึ้นเองได้ในทิศทางเดียวเท่านั้น กระบวนการจริงทั้งหมดคือ n.p. และในระบบปิดก็เพิ่มขึ้นตามไปด้วย เอนโทรปีซม. , .
สภาวะปกติ- สภาพทางกายภาพมาตรฐานที่กำหนดโดยความดัน P=101325 Pa (760 mmHg) และอุณหภูมิสัมบูรณ์ T=273.15 K
กระบวนการที่พลิกกลับได้– แบบจำลองของกระบวนการซึ่งกระบวนการย้อนกลับเป็นไปได้ โดยทำซ้ำสถานะขั้นกลางทั้งหมดของกระบวนการภายใต้การพิจารณาตามลำดับ ย้อนกลับได้เท่านั้น กระบวนการสมดุลตัวอย่าง - . พ. -
ความชื้นสัมพัทธ์– ปริมาณทางกายภาพเท่ากับอัตราส่วนความหนาแน่น (ความยืดหยุ่น) ของไอน้ำที่มีอยู่ในอากาศต่อความหนาแน่น (ความยืดหยุ่น) ของไออิ่มตัวที่อุณหภูมิเดียวกัน แสดงเป็นเปอร์เซ็นต์ พ. ความชื้นสัมบูรณ์
ไอน้ำ- สารที่อยู่ในสถานะก๊าซภายใต้สภาวะโดยการบีบอัดทำให้สามารถบรรลุสมดุลกับสารชนิดเดียวกันในสถานะของเหลวหรือของแข็งได้ เช่น ที่อุณหภูมิและความดันต่ำกว่าวิกฤต (ดู ภาวะวิกฤต)ที่ความดันต่ำและอุณหภูมิสูง คุณสมบัติของไอน้ำจะเข้าใกล้คุณสมบัติดังกล่าว ก๊าซในอุดมคติ
พารามิเตอร์สถานะพารามิเตอร์ทางอุณหพลศาสตร์คือปริมาณทางกายภาพที่ทำหน้าที่ในอุณหพลศาสตร์เพื่ออธิบายสถานะของระบบ เช่น ความดัน อุณหภูมิ พลังงานภายใน เอนโทรปี เป็นต้น ป.ล. เชื่อมต่อกัน ดังนั้นสถานะสมดุลของระบบจึงสามารถกำหนดได้อย่างชัดเจนด้วยพารามิเตอร์จำนวนจำกัด (ดู สมการของรัฐ)
การผลิตไอน้ำ– กระบวนการเปลี่ยนสถานะสารจากสถานะของเหลวหรือของแข็งไปเป็นสถานะก๊าซ โดยจะดำเนินต่อไปในปริมาณปิดจนกว่าจะก่อตัว ไอน้ำอิ่มตัว- P มีสองประเภท: การระเหยและ เดือด.
แรงกดดันบางส่วน- ความดันของก๊าซที่รวมอยู่ในส่วนผสมของก๊าซ ซึ่งจะเกิดขึ้นหากครอบครองปริมาตรทั้งหมดของส่วนผสมและอยู่ที่อุณหภูมิของส่วนผสม ซม. .
กฎหมายปาสคาล- กฎหมายพื้นฐาน อุทกสถิต: ความดันที่เกิดจากแรงภายนอกบนพื้นผิวของของเหลวหรือก๊าซจะถูกส่งอย่างเท่าเทียมกันในทุกทิศทาง
กฎข้อที่หนึ่งของอุณหพลศาสตร์- หนึ่งในกฎหมายพื้นฐาน อุณหพลศาสตร์,ซึ่งเป็นกฎการอนุรักษ์พลังงานสำหรับระบบเทอร์โมไดนามิกส์ คือ ปริมาณความร้อน ถามที่สื่อสารกับระบบจะใช้ไปกับการเปลี่ยนแปลงพลังงานภายในของระบบ ∆Uและจบงานตามระบบ มีระบบต่อต้านกองกำลังภายนอก สูตร: Q=∆U+A ระบบ- เกี่ยวกับการใช้ P.z.t. ขึ้นอยู่กับการทำงานของเครื่องยนต์ความร้อน สามารถกำหนดสูตรได้แตกต่างกัน: การเปลี่ยนแปลงพลังงานภายในของระบบ ∆Uเท่ากับผลรวมของปริมาณความร้อนที่ถ่ายโอนไปยังระบบ ถามและการทำงานของแรงภายนอกต่อระบบ ต่อ- สูตร: ∆U=ถาม+ก ภายนอก- ในสูตรข้างต้น ต่อ = - เป็นระบบ.
ละลาย– กระบวนการเปลี่ยนสถานะสารจากสถานะผลึกเป็นสถานะของเหลว เกิดขึ้นกับการดูดซับความร้อนจำนวนหนึ่งที่อุณหภูมิหลอมละลาย ขึ้นอยู่กับลักษณะของสารและความดัน ซม. ความร้อนของการหลอมรวม
พลาสม่า- ก๊าซไอออไนซ์ซึ่งมีความเข้มข้นของประจุบวกและประจุลบเกือบเท่ากัน เกิดขึ้นเมื่อ การปล่อยกระแสไฟฟ้าในก๊าซ เมื่อแก๊สถูกให้ความร้อนจนถึงอุณหภูมิที่เพียงพอสำหรับการแตกตัวเป็นไอออนด้วยความร้อน สสารส่วนใหญ่ในจักรวาลอยู่ในสถานะพลาสมา ได้แก่ ดวงดาว เนบิวลากาแลคซี และสื่อระหว่างดาว
พลาสติก- คุณสมบัติของของแข็งภายใต้อิทธิพลของแรงภายนอกในการเปลี่ยนแปลงรูปร่างและขนาดโดยไม่ยุบตัวและกักเก็บสิ่งตกค้าง (พลาสติก) การเสียรูป ขึ้นอยู่กับชนิดของของเหลวและอุณหภูมิ อาจเปลี่ยนแปลงได้โดยสารลดแรงตึงผิว (เช่น สบู่)
แรงตึงผิว- ปรากฏการณ์ที่แสดงแนวโน้มของของเหลวในการลดพื้นที่ผิวของมัน มีสาเหตุมาจากปฏิสัมพันธ์ระหว่างโมเลกุลและเกิดจากการก่อตัวของชั้นผิวของโมเลกุลซึ่งมีพลังงานมากกว่าพลังงานของโมเลกุลภายในของเหลวที่กำหนดที่อุณหภูมิเดียวกัน
เนื้อหาของบทความ
ทฤษฎีจลนศาสตร์ระดับโมเลกุล– สาขาหนึ่งของฟิสิกส์โมเลกุลที่ศึกษาคุณสมบัติของสสารตามแนวคิดเกี่ยวกับโครงสร้างโมเลกุลและกฎบางอย่างของปฏิสัมพันธ์ระหว่างอะตอม (โมเลกุล) ที่ประกอบเป็นสาร เชื่อกันว่าอนุภาคของสสารมีการเคลื่อนที่แบบสุ่มอย่างต่อเนื่อง และการเคลื่อนไหวนี้ถูกมองว่าเป็นความร้อน
จนกระทั่งถึงศตวรรษที่ 19 พื้นฐานที่ได้รับความนิยมอย่างมากสำหรับหลักคำสอนเรื่องความร้อนคือทฤษฎีแคลอรี่หรือสารของเหลวบางชนิดที่ไหลจากวัตถุหนึ่งไปยังอีกวัตถุหนึ่ง การให้ความร้อนแก่ร่างกายอธิบายได้โดยการเพิ่มขึ้น และการทำให้เย็นลงโดยปริมาณแคลอรี่ที่อยู่ภายในร่างกายลดลง แนวคิดเรื่องอะตอมมาเป็นเวลานานดูเหมือนไม่จำเป็นสำหรับทฤษฎีความร้อน แต่นักวิทยาศาสตร์หลายคนถึงกับเชื่อมโยงความร้อนกับการเคลื่อนที่ของโมเลกุลโดยสัญชาตญาณ โดยเฉพาะอย่างยิ่งคิดว่านักวิทยาศาสตร์ชาวรัสเซีย M.V. Lomonosov เวลาผ่านไปนานมากก่อนที่ทฤษฎีจลน์ศาสตร์ของโมเลกุลจะเอาชนะใจนักวิทยาศาสตร์ได้ในที่สุด และกลายเป็นสมบัติสำคัญของฟิสิกส์
ปรากฏการณ์หลายอย่างในก๊าซ ของเหลว และของแข็งพบคำอธิบายที่ง่ายและน่าเชื่อถือภายใต้กรอบของทฤษฎีจลน์ศาสตร์ของโมเลกุล ดังนั้น ความดันซึ่งกระทำโดยก๊าซบนผนังของภาชนะที่มันถูกปิดอยู่ ถือเป็นผลรวมของการชนกันหลายครั้งของโมเลกุลที่เคลื่อนที่อย่างรวดเร็วกับผนัง ซึ่งเป็นผลมาจากการที่พวกมันถ่ายโอนโมเมนตัมของพวกมันไปที่ผนัง (จำได้ว่าเป็นการเปลี่ยนแปลงของโมเมนตัมต่อหน่วยเวลาซึ่งตามกฎของกลศาสตร์ ทำให้เกิดลักษณะของแรง และแรงต่อหน่วยพื้นผิวผนังคือความดัน) พลังงานจลน์ของการเคลื่อนที่ของอนุภาคซึ่งมีค่าเฉลี่ยมากกว่าจำนวนมหาศาลของพวกมัน เป็นตัวกำหนดสิ่งที่เรียกโดยทั่วไป อุณหภูมิสาร
ต้นกำเนิดของแนวคิดแบบอะตอมมิก ได้แก่ ความคิดที่ว่าร่างกายทั้งหมดในธรรมชาติประกอบด้วยอนุภาคที่เล็กที่สุดซึ่งแบ่งแยกไม่ได้ คือ อะตอม ย้อนกลับไปถึงนักปรัชญาชาวกรีกโบราณ - Leucippus และ Democritus เมื่อกว่าสองพันปีก่อน Democritus เขียนว่า: "... อะตอมมีขนาดและจำนวนนับไม่ถ้วน แต่พวกมันวิ่งไปรอบจักรวาล หมุนวนในลมบ้าหมู และด้วยเหตุนี้ทุกสิ่งที่ซับซ้อนจึงถือกำเนิดขึ้น: ไฟ น้ำ อากาศ ดิน" มีส่วนสนับสนุนอย่างเด็ดขาดต่อการพัฒนาทฤษฎีจลน์ศาสตร์ของโมเลกุลในช่วงครึ่งหลังของศตวรรษที่ 19 ผลงานของนักวิทยาศาสตร์ที่น่าทึ่ง J.C. Maxwell และ L. Boltzmann ผู้ซึ่งวางรากฐานสำหรับการอธิบายคุณสมบัติของสาร (ส่วนใหญ่เป็นก๊าซ) ทางสถิติ (น่าจะเป็น) ซึ่งประกอบด้วยโมเลกุลที่เคลื่อนที่อย่างโกลาหลจำนวนมาก วิธีการทางสถิติได้รับการทำให้เป็นลักษณะทั่วไป (สัมพันธ์กับสถานะของสสารใดๆ) เมื่อต้นศตวรรษที่ 20 ในงานของนักวิทยาศาสตร์ชาวอเมริกัน เจ. กิ๊บส์ ซึ่งถือเป็นหนึ่งในผู้ก่อตั้งกลศาสตร์สถิติหรือฟิสิกส์เชิงสถิติ ในที่สุด ในทศวรรษแรกของศตวรรษที่ 20 นักฟิสิกส์ตระหนักว่าพฤติกรรมของอะตอมและโมเลกุลเป็นไปตามกฎที่ไม่ใช่ของกลศาสตร์คลาสสิก แต่เป็นของกลศาสตร์ควอนตัม สิ่งนี้เป็นแรงผลักดันอันทรงพลังในการพัฒนาฟิสิกส์เชิงสถิติและทำให้สามารถอธิบายปรากฏการณ์ทางกายภาพจำนวนหนึ่งซึ่งก่อนหน้านี้ไม่สามารถอธิบายได้ภายใต้กรอบแนวคิดปกติของกลศาสตร์คลาสสิก
ทฤษฎีจลน์ศาสตร์โมเลกุลของก๊าซ
แต่ละโมเลกุลที่บินเข้าหาผนังเมื่อชนกับมัน จะส่งโมเมนตัมไปที่ผนัง เนื่องจากความเร็วของโมเลกุลระหว่างการชนแบบยืดหยุ่นกับผนังจะแปรผันตามค่า โวลต์ถึง - โวลต์ขนาดของพัลส์ที่ส่งคือ 2 MV- แรงที่กระทำต่อพื้นผิวผนัง D สทันเวลา D ทีถูกกำหนดโดยขนาดของโมเมนตัมทั้งหมดที่ส่งผ่านโดยโมเลกุลทั้งหมดที่ไปถึงผนังในช่วงเวลานี้เช่น เอฟ= 2MV n คดี ส/D ทีที่ไหน คกำหนดโดยนิพจน์ (1) สำหรับค่าความดัน พี = เอฟ/D สในกรณีนี้เราพบว่า: พี = (1/3)นาโนเมตร 2.
เพื่อให้ได้ผลลัพธ์สุดท้าย คุณสามารถละทิ้งสมมติฐานเรื่องความเร็วเท่ากันของโมเลกุลได้โดยการระบุกลุ่มของโมเลกุลที่เป็นอิสระ ซึ่งแต่ละกลุ่มมีความเร็วเท่ากันโดยประมาณ จากนั้นหาความดันเฉลี่ยได้โดยหาค่าเฉลี่ยกำลังสองของความเร็วเหนือกลุ่มโมเลกุลทั้งหมดหรือ
นิพจน์นี้สามารถแสดงในรูปแบบได้เช่นกัน
สะดวกในการให้สูตรนี้มีรูปแบบอื่นโดยการคูณตัวเศษและตัวส่วนใต้เครื่องหมายรากที่สองด้วยเลขอาโวกาโดร
เอ็น เอ= 6.023·10 23.
ที่นี่ ม = เอ็มเอ็น เอ– มวลอะตอมหรือโมเลกุล ค่า R = กิโลเอ็น เอ= 8.318·10 7 erg เรียกว่าค่าคงที่ของแก๊ส
ความเร็วเฉลี่ยของโมเลกุลในก๊าซ แม้ที่อุณหภูมิปานกลาง กลับกลายเป็นว่าสูงมาก ดังนั้น สำหรับโมเลกุลไฮโดรเจน (H2) ที่อุณหภูมิห้อง ( ต= 293K) ความเร็วนี้คือประมาณ 1900 m/s สำหรับโมเลกุลไนโตรเจนในอากาศ - ประมาณ 500 m/s ความเร็วเสียงในอากาศภายใต้สภาวะเดียวกันคือ 340 m/s
เมื่อพิจารณาแล้วว่า n = เอ็น/วี, ที่ไหน วี– ปริมาตรที่ครอบครองโดยก๊าซ เอ็นคือจำนวนโมเลกุลทั้งหมดในปริมาตรนี้ ง่ายต่อการรับผลที่ตามมาจาก (5) ในรูปของกฎก๊าซที่รู้จักกันดี เมื่อต้องการทำเช่นนี้ จำนวนโมเลกุลทั้งหมดจะแสดงเป็น เอ็น = วีเอ็น เอ, ที่ไหน โวลต์คือจำนวนโมลของก๊าซ และสมการ (5) อยู่ในรูป
(8) พีวี = วีอาร์ที,
ซึ่งเรียกว่าสมการคลาเปรอง-เมนเดเลเยฟ
ระบุว่า ต= ความดันก๊าซ const เปลี่ยนแปลงในสัดส่วนผกผันกับปริมาตรที่ก๊าซนั้นครอบครอง (กฎของบอยล์-มาริออต)
ในภาชนะปิดที่มีปริมาตรคงที่ วี= ความดันคงที่เปลี่ยนแปลงเป็นสัดส่วนโดยตรงกับการเปลี่ยนแปลงของอุณหภูมิก๊าซสัมบูรณ์ ต- ถ้าก๊าซอยู่ในสภาวะที่ความดันคงที่ พี= const แต่อุณหภูมิเปลี่ยนแปลง (สามารถบรรลุเงื่อนไขดังกล่าวได้เช่นหากคุณวางก๊าซในกระบอกสูบปิดด้วยลูกสูบที่เคลื่อนที่ได้) ปริมาตรที่ก๊าซครอบครองจะเปลี่ยนตามสัดส่วนการเปลี่ยนแปลงของอุณหภูมิ (กฎของเกย์-ลุสซัก)
ปล่อยให้มีส่วนผสมของก๊าซอยู่ในภาชนะนั่นคือ มีโมเลกุลหลายประเภท ในกรณีนี้ ขนาดของโมเมนตัมที่ถ่ายโอนไปยังผนังโดยโมเลกุลของแต่ละประเภทไม่ได้ขึ้นอยู่กับการมีอยู่ของโมเลกุลประเภทอื่น มันเป็นไปตามนั้น ความดันของส่วนผสมของก๊าซในอุดมคติจะเท่ากับผลรวมของความดันย่อยที่ก๊าซแต่ละชนิดจะสร้างแยกกันหากก๊าซนั้นครอบครองปริมาตรทั้งหมดนี่เป็นกฎแก๊สอีกข้อหนึ่ง - กฎของดาลตันที่มีชื่อเสียง
เส้นทางอิสระระดับโมเลกุล . หนึ่งในคนกลุ่มแรกๆ ที่ย้อนกลับไปในทศวรรษที่ 1850 ให้การประมาณความเร็วความร้อนเฉลี่ยของโมเลกุลของก๊าซต่างๆ อย่างสมเหตุสมผลคือคลอเซียส นักฟิสิกส์ชาวออสเตรีย ค่าความเร็วที่มากผิดปกติที่เขาได้รับทำให้เกิดการคัดค้านทันที หากความเร็วของโมเลกุลสูงมาก กลิ่นของสารที่มีกลิ่นก็ควรจะแพร่กระจายเกือบจะในทันทีจากปลายด้านหนึ่งของห้องปิดไปยังอีกด้านหนึ่ง ในความเป็นจริง การแพร่กระจายของกลิ่นเกิดขึ้นช้ามากและเกิดขึ้นอย่างที่เราทราบกันดีในปัจจุบัน ผ่านกระบวนการที่เรียกว่าการแพร่กระจายของก๊าซ คลอเซียสและคนอื่นๆ ในเวลาต่อมาสามารถให้คำอธิบายที่น่าเชื่อถือสำหรับสิ่งนี้และกระบวนการขนส่งก๊าซอื่นๆ (เช่น การนำความร้อนและความหนืด) โดยใช้แนวคิดของเส้นทางอิสระเฉลี่ย โมเลกุล , เหล่านั้น. ระยะทางเฉลี่ยที่โมเลกุลเคลื่อนที่จากการชนกันครั้งหนึ่ง
แต่ละโมเลกุลในก๊าซจะเกิดการชนกับโมเลกุลอื่นๆ เป็นจำนวนมาก ในช่วงเวลาระหว่างการชนกัน โมเลกุลจะเคลื่อนที่เกือบจะเป็นเส้นตรง โดยประสบกับการเปลี่ยนแปลงความเร็วอย่างรวดเร็วเฉพาะในขณะที่เกิดการชนเท่านั้น โดยธรรมชาติแล้วความยาวของส่วนตรงตามเส้นทางของโมเลกุลอาจแตกต่างกันดังนั้นจึงสมเหตุสมผลที่จะพูดถึงเฉพาะเส้นทางอิสระของโมเลกุลโดยเฉลี่ยเท่านั้น
ในช่วงเวลา D ทีโมเลกุลจะผ่านเส้นทางซิกแซกที่ซับซ้อนเท่ากับ โวลต์ดี ที- วิถีโคจรตามเส้นทางนี้มีความโค้งงอพอๆ กับที่มีการชนกัน อนุญาต ซีหมายถึงจำนวนการชนที่โมเลกุลประสบต่อหน่วยเวลา ดังนั้นเส้นทางอิสระเฉลี่ยจึงเท่ากับอัตราส่วนของความยาวเส้นทาง N 2 เช่น ก» 2.0·10 –10 ม. ตารางที่ 1 แสดงค่า l 0 ในหน่วย µm (1 µm = 10 –6 m) คำนวณโดยใช้สูตร (10) สำหรับก๊าซบางชนิดภายใต้สภาวะปกติ ( พี= 1 เอทีเอ็ม ต=273K) ค่าเหล่านี้มีค่ามากกว่าเส้นผ่านศูนย์กลางภายในของโมเลกุลประมาณ 100–300 เท่า
ฟิสิกส์ถือว่าสสารใดๆ เป็นกลุ่มของอนุภาคเล็กๆ ได้แก่ อะตอม โมเลกุล และไอออน อนุภาคทั้งหมดเหล่านี้มีการเคลื่อนไหวที่วุ่นวายอย่างต่อเนื่องและมีปฏิสัมพันธ์ซึ่งกันและกันผ่านการชนแบบยืดหยุ่น
ทฤษฎีอะตอมเป็นพื้นฐานของทฤษฎีจลน์ศาสตร์ของโมเลกุล
พรรคเดโมแครต
ทฤษฎีจลน์ศาสตร์เชิงโมเลกุลมีต้นกำเนิดในสมัยกรีกโบราณเมื่อประมาณ 2,500 ปีก่อน ถือเป็นรากฐานของมัน สมมติฐานอะตอม , ซึ่งมีผู้เขียนอยู่ ลูซิปปุส นักปรัชญาชาวกรีกโบราณและนักเรียนของเขา นักวิทยาศาสตร์ชาวกรีกโบราณชื่อเดโมคริตุสจากเมืองอับเดรา

ลิวซิปปัส
Leucippus และ Democritus สันนิษฐานว่าวัตถุทั้งหมดประกอบด้วยอนุภาคเล็กๆ ที่แบ่งแยกไม่ได้ที่เรียกว่า อะตอม (จากภาษากรีกἄτομος - แบ่งแยกไม่ได้). และช่องว่างระหว่างอะตอมก็เต็มไปด้วยความว่างเปล่า อะตอมทุกชนิดมีขนาดและรูปร่างและสามารถเคลื่อนที่ได้ ผู้เสนอทฤษฎีนี้ในยุคกลาง ได้แก่ จิออร์ดาโน่ บรูโน่, กาลิเลโอ, ไอแซค เบ็คแมนและนักวิทยาศาสตร์คนอื่นๆ รากฐานของทฤษฎีจลน์ศาสตร์โมเลกุลถูกวางไว้ในงาน "อุทกพลศาสตร์" ซึ่งตีพิมพ์ในปี 1738 ผู้เขียนคือนักฟิสิกส์ ช่างเครื่อง และนักคณิตศาสตร์ชาวสวิส แดเนียล เบอร์นูลลี.
หลักการพื้นฐานของทฤษฎีจลน์ศาสตร์ของโมเลกุล

มิคาอิล วาซิลีวิช โลโมโนซอฟ
สิ่งที่ใกล้เคียงที่สุดกับฟิสิกส์สมัยใหม่คือทฤษฎีโครงสร้างอะตอมของสสารซึ่งได้รับการพัฒนาโดยนักวิทยาศาสตร์ชาวรัสเซียผู้ยิ่งใหญ่ในศตวรรษที่ 18 มิคาอิล วาซิลีวิช โลโมโนซอฟ- เขาแย้งว่าสารทั้งหมดประกอบด้วย โมเลกุลซึ่งเขาเรียกว่า คลังข้อมูล - และคอร์พัสเคิลก็ประกอบด้วย อะตอม - ทฤษฎีของโลโมโนซอฟถูกเรียกว่า กล้ามเนื้อ .
แต่ปรากฏว่าอะตอมกำลังแบ่งตัว ประกอบด้วยนิวเคลียสที่มีประจุบวกและอิเล็กตรอนเชิงลบ แต่โดยทั่วไปแล้วจะมีความเป็นกลางทางไฟฟ้า
วิทยาศาสตร์สมัยใหม่เรียก อะตอม ส่วนที่เล็กที่สุดขององค์ประกอบทางเคมีที่เป็นพาหะของคุณสมบัติพื้นฐานของมัน เชื่อมต่อกันด้วยพันธะระหว่างอะตอม อะตอมจึงก่อตัวเป็นโมเลกุล โมเลกุลสามารถประกอบด้วยอะตอมขององค์ประกอบทางเคมีที่เหมือนกันหรือต่างกันตั้งแต่หนึ่งอะตอมขึ้นไป
ร่างกายทั้งหมดประกอบด้วยอนุภาคจำนวนมาก ได้แก่ อะตอม โมเลกุล และไอออน อนุภาคเหล่านี้เคลื่อนที่อย่างต่อเนื่องและวุ่นวาย การเคลื่อนไหวไม่มีทิศทางใดโดยเฉพาะและเรียกว่า การเคลื่อนไหวทางความร้อน - ในระหว่างการเคลื่อนที่ อนุภาคจะโต้ตอบกันผ่านการชนแบบยืดหยุ่นอย่างยิ่ง
เราไม่สามารถสังเกตโมเลกุลและอะตอมด้วยตาเปล่าได้ แต่เราสามารถเห็นผลการกระทำของพวกเขาได้
การยืนยันบทบัญญัติหลักของทฤษฎีจลน์ศาสตร์โมเลกุลคือ: การแพร่กระจาย , การเคลื่อนไหวแบบบราวเนียน และ เปลี่ยน สถานะรวมของสาร .
การแพร่กระจาย

การแพร่กระจายในของเหลว
ข้อพิสูจน์ประการหนึ่งเกี่ยวกับการเคลื่อนที่อย่างต่อเนื่องของโมเลกุลก็คือปรากฏการณ์นี้ การแพร่กระจาย .
ในกระบวนการเคลื่อนที่ โมเลกุลและอะตอมของสารหนึ่งจะทะลุผ่านระหว่างโมเลกุลและอะตอมของสารอื่นที่สัมผัสกับสารนั้น โมเลกุลและอะตอมของสารตัวที่สองมีพฤติกรรมในลักษณะเดียวกันทุกประการสัมพันธ์กับสิ่งแรก และหลังจากนั้นระยะหนึ่ง โมเลกุลของสารทั้งสองจะกระจายเท่าๆ กันตลอดปริมาตรทั้งหมด
กระบวนการแทรกซึมของโมเลกุลของสารหนึ่งระหว่างโมเลกุลของอีกสารหนึ่งเรียกว่า การแพร่กระจาย - เราพบกับปรากฏการณ์การแพร่กระจายที่บ้านทุกวันเมื่อเราใส่ถุงชาลงในแก้วน้ำเดือด เราสังเกตว่าน้ำเดือดที่ไม่มีสีเปลี่ยนสีได้อย่างไร โดยการโยนผลึกแมงกานีสหลายๆ เม็ดลงในหลอดทดลองที่มีน้ำ คุณจะเห็นว่าน้ำเปลี่ยนเป็นสีชมพู นี่ก็เป็นการแพร่กระจายเช่นกัน
เรียกว่าจำนวนอนุภาคต่อหน่วยปริมาตร ความเข้มข้น สาร ในระหว่างการแพร่กระจาย โมเลกุลจะเคลื่อนที่จากส่วนของสารที่มีความเข้มข้นสูงกว่าไปยังส่วนที่มีความเข้มข้นต่ำกว่า การเคลื่อนที่ของโมเลกุลเรียกว่า การไหลของการแพร่กระจาย - ผลของการแพร่กระจายทำให้ความเข้มข้นในส่วนต่างๆ ของสารเท่ากัน
สามารถสังเกตการแพร่กระจายได้ในก๊าซ ของเหลว และของแข็ง ในก๊าซจะเกิดขึ้นในอัตราที่เร็วกว่าในของเหลว เรารู้ว่ากลิ่นกระจายไปในอากาศได้เร็วแค่ไหน ของเหลวในหลอดทดลองจะเปลี่ยนสีได้ช้ากว่ามากหากหยดหมึกลงไป และถ้าเราใส่ผลึกเกลือแกงที่ด้านล่างของภาชนะที่มีน้ำและไม่คนให้เข้ากัน จะผ่านไปนานกว่าหนึ่งวันก่อนที่สารละลายจะกลายเป็นเนื้อเดียวกัน
การแพร่กระจายยังเกิดขึ้นที่ขอบเขตของการสัมผัสกับโลหะ แต่ความเร็วในกรณีนี้ต่ำมาก หากคุณเคลือบทองแดงด้วยทองคำ ที่อุณหภูมิห้องและความดันบรรยากาศ ทองคำจะแทรกซึมเข้าไปในทองแดงได้เพียงไม่กี่ไมครอนหลังจากผ่านไปไม่กี่พันปี
ตะกั่วจากแท่งโลหะที่อยู่ใต้น้ำหนักของแท่งทองคำจะเจาะเข้าไปได้ลึกเพียง 1 ซม. ใน 5 ปี

การแพร่กระจายในโลหะ
อัตราการแพร่กระจาย
อัตราการแพร่กระจายขึ้นอยู่กับพื้นที่หน้าตัดของการไหล, ความแตกต่างของความเข้มข้นของสาร, ความแตกต่างของอุณหภูมิหรือประจุ ผ่านแท่งที่มีเส้นผ่านศูนย์กลาง 2 ซม. ความร้อนจะแพร่กระจายได้เร็วกว่าแท่งที่มีเส้นผ่านศูนย์กลาง 1 ซม. ถึง 4 เท่า ยิ่งความแตกต่างของอุณหภูมิระหว่างสารสูง อัตราการแพร่กระจายก็จะยิ่งสูงขึ้น ในระหว่างการแพร่กระจายความร้อน ความเร็วจะขึ้นอยู่กับ การนำความร้อน วัสดุ และในกรณีมีประจุไฟฟ้าไหลเข้า-ออก การนำไฟฟ้า .
กฎของฟิค

อดอล์ฟ ฟิค
ในปี ค.ศ. 1855 นักสรีรวิทยาชาวเยอรมัน อดอล์ฟ ยูเกน ฟิค ได้ทำการอธิบายเชิงปริมาณครั้งแรกของกระบวนการแพร่กระจาย:
ที่ไหน เจ - ความหนาแน่น การแพร่กระจายของสสาร
ดี - ค่าสัมประสิทธิ์การแพร่กระจาย
ค - ความเข้มข้นของสาร
ความหนาแน่นฟลักซ์การแพร่ของสารเจ [ซม. -2 วินาที -1 ] เป็นสัดส่วนกับสัมประสิทธิ์การแพร่ดี [ซม. -2 วินาที -1 ] และการไล่ระดับความเข้มข้นที่มีเครื่องหมายตรงกันข้าม
สมการนี้เรียกว่า สมการแรกของฟิค .
เรียกว่าการแพร่กระจายซึ่งเป็นผลมาจากความเข้มข้นของสารที่เท่ากัน การแพร่กระจายแบบไม่คงที่ - ด้วยการแพร่กระจายดังกล่าว การไล่ระดับความเข้มข้นจะเปลี่ยนไปตามเวลา และในกรณีที่ การแพร่กระจายแบบคงที่ การไล่ระดับสีนี้คงที่
การเคลื่อนไหวแบบบราวเนียน

โรเบิร์ต บราวน์
ปรากฏการณ์นี้ถูกค้นพบโดยนักพฤกษศาสตร์ชาวสก็อตแลนด์ โรเบิร์ต บราวน์ ในปี พ.ศ. 2370 โดยศึกษาภายใต้กล้องจุลทรรศน์เมล็ดไซโตพลาสซึมที่แขวนลอยอยู่ในน้ำ ซึ่งแยกได้จากเซลล์ละอองเรณูของพืชในอเมริกาเหนือคลาร์กเกีย ปุลเชลลาเขาให้ความสนใจกับเมล็ดแข็งที่เล็กที่สุด พวกเขาตัวสั่นและเคลื่อนไหวช้าๆ โดยไม่มีเหตุผลที่ชัดเจน หากอุณหภูมิของของเหลวเพิ่มขึ้น ความเร็วของอนุภาคจะเพิ่มขึ้น สิ่งเดียวกันนี้เกิดขึ้นเมื่อขนาดอนุภาคลดลง และหากขนาดเพิ่มขึ้น อุณหภูมิของของเหลวจะลดลงหรือความหนืดเพิ่มขึ้น การเคลื่อนที่ของอนุภาคก็จะช้าลง และการ “เต้น” ของอนุภาคที่น่าทึ่งเหล่านี้สามารถสังเกตได้เป็นเวลานานอย่างไม่มีสิ้นสุด เมื่อตัดสินใจว่าสาเหตุของการเคลื่อนไหวนี้คืออนุภาคยังมีชีวิตอยู่ บราวน์จึงเปลี่ยนเมล็ดข้าวด้วยอนุภาคถ่านหินขนาดเล็ก ผลลัพธ์ก็เหมือนกัน

การเคลื่อนไหวแบบบราวเนียน
หากต้องการทำซ้ำการทดลองของ Brown ก็เพียงพอแล้วที่จะมีกล้องจุลทรรศน์ธรรมดาที่สุด ขนาดโมเลกุลมีขนาดเล็กเกินไป และเป็นไปไม่ได้ที่จะตรวจสอบด้วยอุปกรณ์ดังกล่าว แต่ถ้าเราแต้มน้ำในหลอดทดลองด้วยสีน้ำแล้วมองผ่านกล้องจุลทรรศน์ เราจะเห็นอนุภาคสีเล็กๆ เคลื่อนที่แบบสุ่ม สิ่งเหล่านี้ไม่ใช่โมเลกุล แต่เป็นอนุภาคของสีที่แขวนลอยอยู่ในน้ำ และพวกมันถูกบังคับให้เคลื่อนที่ด้วยโมเลกุลของน้ำที่กระทบพวกมันจากทุกทิศทุกทาง
นี่คือพฤติกรรมของอนุภาคทั้งหมดที่มองเห็นได้ด้วยกล้องจุลทรรศน์ซึ่งแขวนลอยอยู่ในของเหลวหรือก๊าซ เรียกว่าการเคลื่อนที่แบบสุ่มที่เกิดจากการเคลื่อนที่ด้วยความร้อนของโมเลกุลหรืออะตอม การเคลื่อนไหวแบบบราวเนียน - อนุภาคบราวเนียนถูกผลกระทบอย่างต่อเนื่องจากโมเลกุลและอะตอมที่ประกอบเป็นของเหลวและก๊าซ และการเคลื่อนไหวนี้ไม่หยุด
แต่การเคลื่อนที่แบบบราวเนียนอาจมีอนุภาคขนาดเล็กถึง 5 ไมโครเมตร (ไมโครเมตร) หากขนาดใหญ่ขึ้นแสดงว่าไม่สามารถเคลื่อนไหวได้ ยิ่งอนุภาคบราวเนียนมีขนาดเล็กเท่าไรก็ยิ่งเคลื่อนที่ได้เร็วเท่านั้น อนุภาคที่มีขนาดเล็กกว่า 3 ไมครอนจะเคลื่อนที่แบบแปลนไปตามวิถีโคจรที่ซับซ้อนทั้งหมดหรือหมุนไป
บราวน์เองก็ไม่สามารถอธิบายปรากฏการณ์ที่เขาค้นพบได้ และในศตวรรษที่ 19 นักวิทยาศาสตร์เท่านั้นที่ค้นพบคำตอบสำหรับคำถามนี้: การเคลื่อนที่ของอนุภาคบราวเนียนเกิดจากอิทธิพลของการเคลื่อนที่ทางความร้อนของโมเลกุลและอะตอมที่มีต่อพวกมัน
สถานะของสสารสามสถานะ

โมเลกุลและอะตอมที่ประกอบเป็นสสารไม่เพียงแต่เคลื่อนไหวเท่านั้น แต่ยังโต้ตอบซึ่งกันและกัน ดึงดูดหรือผลักกันซึ่งกันและกัน
หากระยะห่างระหว่างโมเลกุลเทียบได้กับขนาดของพวกมัน พวกมันก็จะพบกับแรงดึงดูด ถ้ามันเล็กลง พลังที่น่ารังเกียจก็เริ่มครอบงำ สิ่งนี้จะอธิบายความต้านทานของร่างกายต่อการเสียรูป (การบีบอัดหรือแรงดึง)
ถ้าร่างกายถูกบีบอัด ระยะห่างระหว่างโมเลกุลจะลดลง และแรงผลักจะพยายามทำให้โมเลกุลกลับสู่สถานะเดิม เมื่อยืดเหยียดร่างกายจะผิดรูปไปรบกวนแรงดึงดูดระหว่างโมเลกุล
โมเลกุลมีปฏิสัมพันธ์ไม่เพียงแต่ภายในร่างกายเดียวเท่านั้น จุ่มผ้าลงในของเหลว เราจะเห็นว่ามันเปียก สิ่งนี้อธิบายได้จากข้อเท็จจริงที่ว่าโมเลกุลของเหลวถูกดึงดูดไปยังโมเลกุลของแข็งมากกว่ากัน
สารทางกายภาพแต่ละชนิด ขึ้นอยู่กับอุณหภูมิและความดัน สามารถมีได้ 3 สถานะ: ของแข็งของเหลว หรือ ก๊าซ - พวกเขาถูกเรียกว่า รวม .
ในก๊าซ ระยะห่างระหว่างโมเลกุลมีขนาดใหญ่ ดังนั้นแรงดึงดูดระหว่างพวกมันจึงอ่อนแอมากจนทำให้เกิดความวุ่นวายและเคลื่อนไหวอย่างอิสระในอวกาศ พวกเขาเปลี่ยนทิศทางการเคลื่อนไหวชนกันหรือชนผนังหลอดเลือด
ในของเหลว โมเลกุลตั้งอยู่ใกล้กันมากกว่าในก๊าซ แรงดึงดูดระหว่างพวกมันมีมากกว่า โมเลกุลในพวกมันไม่เคลื่อนที่อย่างอิสระอีกต่อไป แต่แกว่งไปมาอย่างวุ่นวายรอบตำแหน่งสมดุล แต่พวกเขาสามารถกระโดดไปในทิศทางของการกระทำของแรงภายนอกโดยเปลี่ยนสถานที่ซึ่งกันและกัน ผลที่ได้คือการไหลของของไหล
ในของแข็ง แรงปฏิสัมพันธ์ระหว่างโมเลกุลมีความแข็งแรงมากเนื่องจากมีระยะห่างระหว่างกันมาก พวกมันไม่สามารถเอาชนะแรงดึงดูดของโมเลกุลข้างเคียงได้ ดังนั้นพวกมันจึงสามารถทำการเคลื่อนไหวแบบแกว่งไปรอบตำแหน่งสมดุลเท่านั้น
ของแข็งคงปริมาตรและรูปร่างไว้ ของเหลวไม่มีรูปร่าง แต่จะมีรูปร่างเหมือนภาชนะที่อยู่ในปัจจุบันเสมอ แต่ปริมาณของมันยังคงเท่าเดิม ร่างกายที่เป็นก๊าซมีพฤติกรรมแตกต่างออกไป พวกเขาเปลี่ยนทั้งรูปร่างและปริมาตรได้อย่างง่ายดายโดยรับรูปร่างของภาชนะที่พวกมันถูกวางไว้และครอบครองปริมาตรทั้งหมดที่ให้ไว้
อย่างไรก็ตาม ยังมีวัตถุที่มีโครงสร้างเป็นของเหลว มีความลื่นไหลน้อยแต่ยังคงสามารถรักษารูปร่างไว้ได้ กายดังกล่าวเรียกว่า สัณฐาน .
ฟิสิกส์สมัยใหม่ยังระบุสถานะที่สี่ของสสารด้วย - พลาสมา .
คำจำกัดความ 1
ทฤษฎีจลน์ศาสตร์ระดับโมเลกุลเป็นหลักคำสอนเรื่องโครงสร้างและคุณสมบัติของสสารโดยอาศัยแนวคิดเรื่องการมีอยู่ของอะตอมและโมเลกุลซึ่งเป็นอนุภาคที่เล็กที่สุดของสารเคมี
หลักการพื้นฐานของทฤษฎีจลน์ศาสตร์โมเลกุลของโมเลกุล:
- สารทั้งหมดสามารถอยู่ในสถานะของเหลว ของแข็ง และก๊าซได้ พวกมันถูกสร้างขึ้นจากอนุภาคที่ประกอบด้วยอะตอม โมเลกุลเบื้องต้นสามารถมีโครงสร้างที่ซับซ้อนได้นั่นคือสามารถมีอะตอมได้หลายอะตอม โมเลกุลและอะตอมเป็นอนุภาคที่เป็นกลางทางไฟฟ้าซึ่งภายใต้สภาวะบางประการจะได้รับประจุไฟฟ้าเพิ่มเติมและกลายเป็นไอออนบวกหรือลบ
- อะตอมและโมเลกุลเคลื่อนที่อย่างต่อเนื่อง
- อนุภาคที่มีลักษณะแรงทางไฟฟ้ามีปฏิกิริยาต่อกัน
บทบัญญัติหลักของ ICT และตัวอย่างมีการระบุไว้ข้างต้น มีอิทธิพลโน้มถ่วงระหว่างอนุภาคเพียงเล็กน้อย
รูปที่ 3. 1. 1. วิถีการเคลื่อนที่ของอนุภาคบราวเนียน
คำจำกัดความ 2
การเคลื่อนที่ของโมเลกุลและอะตอมแบบบราวเนียนยืนยันการมีอยู่ของหลักการพื้นฐานของทฤษฎีจลน์ศาสตร์ของโมเลกุลและยืนยันการทดลองด้วย การเคลื่อนที่ด้วยความร้อนของอนุภาคนี้เกิดขึ้นกับโมเลกุลที่แขวนลอยอยู่ในของเหลวหรือก๊าซ
การพิสูจน์การทดลองของบทบัญญัติหลักของทฤษฎีจลน์ศาสตร์ของโมเลกุล
ในปี ค.ศ. 1827 อาร์ บราวน์ ค้นพบการเคลื่อนไหวนี้ ซึ่งเกิดจากการกระแทกและการเคลื่อนที่ของโมเลกุลแบบสุ่ม เนื่องจากกระบวนการนี้เกิดขึ้นอย่างวุ่นวาย การปะทะจึงไม่สมดุลกัน ดังนั้นข้อสรุปก็คือ ความเร็วของอนุภาคบราวเนียนไม่สามารถคงที่ได้ มันเปลี่ยนแปลงอยู่ตลอดเวลา และการเคลื่อนที่ของทิศทางจะแสดงในรูปแบบของซิกแซก ดังแสดงในรูปที่ 3 1. 1.
ก. ไอน์สไตน์พูดถึงการเคลื่อนไหวของบราวเนียนในปี 1905 ทฤษฎีของเขาได้รับการยืนยันในการทดลองของ J. Perrin ในปี 1908 - 1911
คำจำกัดความ 3
ข้อพิสูจน์ของทฤษฎีของไอน์สไตน์: ออฟเซ็ตสแควร์< r 2 >อนุภาคบราวเนียนสัมพันธ์กับตำแหน่งเริ่มต้น ซึ่งมีค่าเฉลี่ยเหนืออนุภาคบราวเนียนหลายตัว จะเป็นสัดส่วนกับเวลาสังเกต t
การแสดงออก< r 2 >= D t อธิบายกฎการแพร่ ตามทฤษฎีแล้ว D จะเพิ่มขึ้นอย่างซ้ำซากจำเจเมื่ออุณหภูมิเพิ่มขึ้น การเคลื่อนไหวแบบสุ่มสามารถมองเห็นได้เมื่อมีการแพร่กระจาย
คำจำกัดความที่ 4
การแพร่กระจาย- นี่คือคำจำกัดความของปรากฏการณ์การแทรกซึมของสารที่สัมผัสกันตั้งแต่สองตัวขึ้นไป
กระบวนการนี้เกิดขึ้นอย่างรวดเร็วในก๊าซต่างกัน ด้วยตัวอย่างการแพร่กระจายที่มีความหนาแน่นต่างกัน ทำให้ได้ส่วนผสมที่เป็นเนื้อเดียวกัน เมื่อออกซิเจน O2 และไฮโดรเจน H2 อยู่ในภาชนะเดียวกันกับฉากกั้น เมื่อนำออก ก๊าซจะเริ่มผสมกันจนกลายเป็นส่วนผสมที่เป็นอันตราย กระบวนการนี้เกิดขึ้นได้เมื่อไฮโดรเจนอยู่ด้านบนและออกซิเจนอยู่ด้านล่าง
กระบวนการแทรกซึมยังเกิดขึ้นในของเหลว แต่จะช้ากว่ามาก ถ้าเราละลายของแข็งหรือน้ำตาลในน้ำ เราจะได้สารละลายที่เป็นเนื้อเดียวกัน ซึ่งเป็นตัวอย่างที่ชัดเจนของกระบวนการแพร่ในของเหลว ภายใต้สภาวะจริง การผสมในของเหลวและก๊าซจะถูกบดบังโดยกระบวนการผสมที่รวดเร็ว เช่น เมื่อกระแสการพาความร้อนเกิดขึ้น
การแพร่กระจายของของแข็งมีลักษณะเฉพาะด้วยความเร็วที่ช้า หากทำความสะอาดพื้นผิวของปฏิกิริยาระหว่างโลหะ คุณจะเห็นว่าอะตอมของโลหะอื่นจะปรากฏในแต่ละอะตอมเป็นเวลานาน
คำจำกัดความที่ 5
การแพร่และการเคลื่อนที่แบบบราวเนียนถือเป็นปรากฏการณ์ที่เกี่ยวข้องกัน
เมื่ออนุภาคของสารทั้งสองแทรกซึมกัน การเคลื่อนที่จะเป็นแบบสุ่ม กล่าวคือ สังเกตการเคลื่อนที่ด้วยความร้อนของโมเลกุลอย่างวุ่นวาย
แรงที่กระทำระหว่างสองโมเลกุลขึ้นอยู่กับระยะห่างระหว่างกัน โมเลกุลมีประจุบวกและลบ ในระยะทางไกล แรงดึงดูดระหว่างโมเลกุลจะมีอิทธิพลเหนือ ในระยะทางที่สั้น แรงผลักจะมีอิทธิพลเหนือ
การวาดภาพ 3 . 1 . 2 แสดงการพึ่งพาของแรงที่เกิดขึ้น F และพลังงานศักย์ E p ของปฏิสัมพันธ์ระหว่างโมเลกุลในระยะห่างระหว่างจุดศูนย์กลาง ที่ระยะห่าง r = r 0 แรงอันตรกิริยาจะกลายเป็นศูนย์ ระยะนี้ถือเป็นเส้นผ่านศูนย์กลางของโมเลกุลตามอัตภาพ ที่ r = r 0 พลังงานศักย์ของการโต้ตอบมีน้อยมาก
คำนิยาม 6
หากต้องการย้ายโมเลกุลสองตัวออกจากกันด้วยระยะห่าง r 0 คุณควรสื่อสาร E 0 เรียกว่า พลังงานยึดเหนี่ยวหรือความลึกของหลุมศักย์

รูปที่ 3. 1. 2.พลังของการมีปฏิสัมพันธ์ เอฟและพลังงานศักย์แห่งปฏิสัมพันธ์อีอาร์ สองโมเลกุล เอฟ > 0– แรงผลักไส, เอฟ< 0 – พลังแห่งแรงดึงดูด
เนื่องจากโมเลกุลมีขนาดเล็ก โมเลกุลเชิงซ้อนธรรมดาจึงมีความยาวได้ไม่เกิน 10 - 10 เมตร โมเลกุลเชิงซ้อนมีขนาดใหญ่กว่าหลายร้อยเท่า
คำนิยาม 7
เรียกว่าการเคลื่อนที่แบบสุ่มอย่างวุ่นวายของโมเลกุล การเคลื่อนไหวด้วยความร้อน
เมื่ออุณหภูมิเพิ่มขึ้น พลังงานจลน์ของการเคลื่อนที่ด้วยความร้อนจะเพิ่มขึ้น ที่อุณหภูมิต่ำ ในกรณีส่วนใหญ่พลังงานจลน์เฉลี่ยจะน้อยกว่าความลึกของหลุมศักย์ E 0 . กรณีนี้แสดงให้เห็นว่าโมเลกุลไหลเข้าสู่ของเหลวหรือของแข็งโดยมีระยะห่างเฉลี่ยระหว่างกัน r 0 . หากอุณหภูมิสูงขึ้นพลังงานจลน์เฉลี่ยของโมเลกุลจะเกิน E 0 จากนั้นพวกมันจะแยกออกจากกันและก่อตัวเป็นสารก๊าซ
ในของแข็ง โมเลกุลจะเคลื่อนที่แบบสุ่มไปรอบๆ จุดศูนย์กลางคงที่ ซึ่งก็คือตำแหน่งสมดุล พวกมันสามารถกระจายไปในอวกาศในลักษณะที่ไม่ปกติ (ในวัตถุอสัณฐาน) หรือด้วยการก่อตัวของโครงสร้างปริมาตรตามลำดับ (วัตถุที่เป็นผลึก)
สถานะรวมของสาร
อิสระในการเคลื่อนที่ด้วยความร้อนของโมเลกุลนั้นมองเห็นได้ในของเหลว เนื่องจากพวกมันไม่ได้ผูกติดอยู่กับศูนย์กลาง ซึ่งช่วยให้สามารถเคลื่อนที่ได้ตลอดปริมาตรทั้งหมด สิ่งนี้อธิบายความลื่นไหลของมัน
คำจำกัดความ 8
หากโมเลกุลอยู่ใกล้กันก็จะสามารถสร้างโครงสร้างที่เป็นระเบียบซึ่งมีโมเลกุลหลายตัวได้ ปรากฏการณ์นี้เรียกว่า คำสั่งระยะสั้น สั่งระยะไกลลักษณะของวัตถุที่เป็นผลึก
ระยะห่างระหว่างโมเลกุลในก๊าซนั้นมากกว่ามาก ดังนั้นแรงกระทำจึงมีน้อย และการเคลื่อนที่ของพวกมันดำเนินไปในแนวเส้นตรงเพื่อรอการชนครั้งต่อไป ค่า 10 – 8 เมตร คือ ระยะห่างเฉลี่ยระหว่างโมเลกุลอากาศภายใต้สภาวะปกติ เนื่องจากปฏิกิริยาของแรงมีน้อย ก๊าซจึงขยายตัวและสามารถเติมปริมาตรของถังได้ เมื่อปฏิสัมพันธ์ของพวกเขามีแนวโน้มเป็นศูนย์ พวกเขาพูดถึงก๊าซในอุดมคติ
แบบจำลองจลนศาสตร์ของก๊าซในอุดมคติ
ในหน่วย µt ปริมาณของสารถือเป็นสัดส่วนกับจำนวนอนุภาค
คำนิยาม 9
ตุ่นคือปริมาณของสารที่มีอนุภาค (โมเลกุล) มากเท่ากับอะตอมในคาร์บอน C12 0.012 กิโลกรัม โมเลกุลคาร์บอนประกอบด้วยหนึ่งอะตอม จะได้ว่าสาร 1 โมลมีจำนวนโมเลกุลเท่ากัน เบอร์นี้มีชื่อว่า คงที่ อโวกาโดร N A: N A = 6.02 และ 1,023 โมล – 1
สูตรกำหนดปริมาณของสาร ν เขียนเป็นอัตราส่วน N ของจำนวนอนุภาคต่อค่าคงที่ของ Avogadro N A: ν = N N A
คำนิยาม 10
มวลของสารหนึ่งโมลเรียกว่ามวลโมลาร์ M ซึ่งกำหนดไว้ในรูปแบบสูตร M = N A ċ m 0
การแสดงออกของมวลโมลาร์มีหน่วยเป็นกิโลกรัมต่อโมล (kg/mol)
คำนิยาม 11
หากสารมีอะตอมหนึ่งอะตอม เราก็สามารถพูดถึงมวลอะตอมของอนุภาคได้ หน่วยของอะตอมคือ 1 12 มวลของคาร์บอนไอโซโทป C 12 เรียกว่า หน่วยมวลอะตอมและเขียนเป็น ( ก. em.): 1 ก. em = 1.66 ถึง 10 – 27 กก.
ค่านี้เกิดขึ้นพร้อมกับมวลของโปรตอนและนิวตรอน
คำนิยาม 12
อัตราส่วนของมวลของอะตอมหรือโมเลกุลของสารที่กำหนดต่อ 1 12 มวลของอะตอมคาร์บอนเรียกว่า มวลสัมพัทธ์
หากคุณสังเกตเห็นข้อผิดพลาดในข้อความ โปรดไฮไลต์แล้วกด Ctrl+Enter
 ความสัมพันธ์ระหว่างมนุษย์กับธรรมชาติ ความสัมพันธ์ระหว่างมนุษย์กับธรรมชาติ
ความสัมพันธ์ระหว่างมนุษย์กับธรรมชาติ ความสัมพันธ์ระหว่างมนุษย์กับธรรมชาติ คำประสมที่มีสระเชื่อมกัน
คำประสมที่มีสระเชื่อมกัน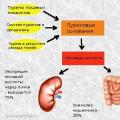 กรดยูริกในเลือด: บรรทัดฐานและการเบี่ยงเบน, เหตุใดจึงเพิ่มขึ้น, อาหารเพื่อลดกรด ผลิตภัณฑ์สุดท้ายของการเผาผลาญไนโตรเจนคือ
กรดยูริกในเลือด: บรรทัดฐานและการเบี่ยงเบน, เหตุใดจึงเพิ่มขึ้น, อาหารเพื่อลดกรด ผลิตภัณฑ์สุดท้ายของการเผาผลาญไนโตรเจนคือ