Восстановитель в ходе реакции принимает электроны. Окислительно-восстановительные реакции
К таковым относят реакции, в которых реагирующие вещества обмениваются электронами, изменяя при этом степени окисления атомов элементов, входящих в состав реагирующих веществ.
Например:
Zn + 2H + → Zn 2+ + H 2 ,
FeS 2 + 8HNO 3 (конц) = Fe(NO 3) 3 + 5NO + 2H 2 SO 4 + 2H 2 O,
Подавляющее большинство химических реакций относятся к окислительно-восстановительным, они играют исключительно важную роль.
Окисление - это процесс отдачи электронов атомом, молекулой или ионом.
Если атом отдает свои электроны, то он приобретает положительный заряд:
Например:
Al - 3e - = Al 3+
H 2 - 2e - = 2H +
При окислении степень окисления повышается.
Если отрицательно заряженный ион (заряд -1), например Cl - , отдает 1 электрон, то он становится нейтральным атомом:
2Cl - - 2e - = Cl 2
Если положительно заряженный ион или атом отдает электроны, то величина его положительного заряда увеличивается соответственно числу отданных электронов:
Fe 2+ - e - = Fe 3+
Восстановление - это процесс присоединения электронов атомом, молекулой или ионом.
Если атом присоединяет электроны, то он превращается в отрицательно заряженный ион:
Например:
Сl 2 + 2е- = 2Сl -
S + 2е - = S 2-
Если положительно заряженный ион принимает электроны, то величина его заряда уменьшается:
Fe 3+ + e- = Fe 2+
или он может перейти в нейтральный атом:
Fe 2+ + 2e- = Fe 0
Окислителем является атом, молекула или ион, принимающий электроны. Восстановителем является атом, молекула или ион, отдающий электроны.
Окислитель в процессе реакции восстанавливается, восстановитель - окисляется.
Окисление всегда сопровождается восстановлением, и наоборот, восстановление всегда связано с окислением, что можно выразить уравнениями:
Восстановитель - е - ↔ Окислитель
Окислитель + е - ↔ Восстановитель
Поэтому окислительно-восстановительные реакции представляют собой единство двух противоположных процессов - окисления и восстановления
Важнейшие восстановители и окислители
|
Восстановители |
Окислители |
Металлы, водород, уголь Оксид углерода(II) CO Сероводород H 2 S, оксид серы(IV) SO 2 , сернистая кислота H 2 SO 3 и ее соли Иодоводородная кислота HI, бромоводородная кислота HBr, соляная кислота HCl Хлорид олова(II) SnCl 2 , сульфат железа(II) FeSO 4 , сульфат марганца(II) MnSO 4 , сульфат хрома(III) Cr 2 (SO 4) 3 Азотистая кислота HNO 2 , аммиак NH 3 , гидразин N 2 H 4 , оксид азота(II) NO Фосфористая кислота H 3 PO 3 Альдегиды, спирты, муравьиная и щавелевая кислоты, глюкоза Катод при электролизе |
Галогены Перманганат калия KMnO 4 , манганат калия K 2 MnO 4 , оксид марганца(IV) MnO 2 Дихромат калия K 2 Cr 2 O 7 , хромат калия K 2 CrO 4 Азотная кислота HNO 3 Кислород O 2 , озон О 3 , пероксид водорода Н 2 О 2 Серная кислота H 2 SO 4 (конц.), селеновая кислота H 2 SeO 4 Оксид меди(II) CuO, оксид серебра(I) Ag 2 O, оксид свинца(IV) PbO 2 Ионы благородных металлов (Ag + , Au 3+ и др.) Хлорид железа(III) FeCl 3 Гипохлориты, хлораты и перхлораты Царская водка, смесь концентрированной азотной и плавиковой кислот Анод при электролизе |
Метод электронного баланса.
Для уравнивания ОВР используют несколько способов, из которых мы пока рассмотрим один - метод электронного баланса.
Напишем уравнение реакции между алюминием и кислородом:
Al + O 2 = Al 2 O 3
Пусть вас не вводит в заблуждение простота этого уравнения. Наша задача - разобраться в методе, который в будущем позволит вам уравнивать гораздо более сложные реакции.
Итак, в чем заключается метод электронного баланса? Баланс - это равенство. Поэтому следует сделать одинаковым количество электронов, которые отдает один элемент и принимает другой элемент в данной реакции. Первоначально это количество выглядит разным, что видно из разных степеней окисления алюминия и кислорода:
Al 0 + O 2 0 = Al 2 +3 O 3 -2
Алюминий отдает электроны (приобретает положительную степень окисления), а кислород - принимает электроны (приобретает отрицательную степень окисления). Чтобы получить степень окисления +3, атом алюминия должен отдать 3 электрона. Молекула кислорода, чтобы превратиться в кислородные атомы со степенью окисления -2, должна принять 4 электрона:
Al 0 - 3e- = Al +3
O 2 0 + 4e- = 2O -2
Чтобы количество отданных и принятых электронов выровнялось, первое уравнение надо умножить на 4, а второе - на 3. Для этого достаточно переместить числа отданных и принятых электронов против верхней и нижней строчки так, как показано на схеме вверху.
Если теперь в уравнении перед восстановителем (Al) мы поставим найденный нами коэффициент 4, а перед окислителем (O 2) - найденный нами коэффициент 3, то количество отданных и принятых электронов выравнивается и становится равным 12. Электронный баланс достигнут. Видно, что перед продуктом реакции Al 2 O 3 необходим коэффициент 2. Теперь уравнение окислительно-восстановительной реакции уравнено:
4Al + 3O 2 = 2Al 2 O 3
Все преимущества метода электронного баланса проявляются в более сложных случаях, чем окисление алюминия кислородом.
Например, известная всем "марганцовка" – марганцевокислый калий KMnO 4 - является сильным окислителем за счет атома Mn в степени окисления +7. Даже анион хлора Cl – отдает ему электрон, превращаясь в атом хлора. Это иногда используют для получения газообразного хлора в лаборатории:
K + Mn +7 O 4 -2 + K + Cl - + H 2 SO 4 = Cl 2 0 + Mn +2 SO 4 + K 2 SO 4 + H 2 O
Составим схему электронного баланса:
Mn +7 + 5e- = Mn +2
2Cl - - 2e- = Cl 2 0
Двойка и пятерка - главные коэффициенты уравнения, благодаря которым удается легко подобрать все другие коэффициенты. Перед Cl 2 следует поставить коэффициент 5 (или 2 × 5 = 10 перед KСl), а перед KMnO 4 - коэффициент 2. Все остальные коэффициенты привязывают к этим двум коэффициентам. Это гораздо легче, чем действовать простым перебором чисел.
2 KMnO 4 + 10KCl + 8H 2 SO 4 = 5 Cl 2 + 2MnSO 4 + 6K 2 SO 4 + 8H 2 O
Чтобы уравнять количество атомов К (12 атомов слева), надо перед K 2 SO 4 в правой части уравнения поставить коэффициент 6. Наконец, чтобы уравнять кислород и водород, достаточно перед H 2 SO 4 и H 2 O поставить коэффициент 8. Мы получили уравнение в окончательном виде.
Метод электронного баланса, как мы видим, не исключает и обыкновенного подбора коэффициентов в уравнениях окислительно-восстановительных реакций, но может заметно облегчить такой подбор.
Составление уравнения реакции меди с раствором нитрата палладия (II) . Запишем формулы исходных и конечных веществ реакции и покажем изменения степеней окисления:
из которых следует, что при восстановителе и окислителе коэффициенты равны 1. Окончательное уравнение реакции:
Cu + Pd(NO 3) 2 = Cu(NO 3) 2 + Pd
Как видно, в суммарном уравнении реакции электроны не фигурируют.
Чтобы проверить правильность составленного уравнения, подсчитываем число атомов каждого элемента в его правой и левой частях. Например, в правой части 6 атомов кислорода, в левой также 6 атомов; палладия 1 и 1; меди тоже 1 и 1. Значит, уравнение составлено правильно.
Переписываем это уравнение в ионной форме:
Cu + Pd 2+ + 2NO 3 - = Cu 2+ + 2NO 3 - + Рd
И после сокращения одинаковых ионов получим
Cu + Pd 2+ = Cu 2+ + Рd
Составление уравнения реакции взаимодействия оксида марганца (IV) с концентрированной соляной кислотой
(с помощью этой реакции в лабораторных условиях получают хлор).
Запишем формулы исходных и конечных веществ реакции:
НCl + МnО 2 → Сl 2 + MnСl 2 + Н 2 О
Покажем изменение степеней окисления атомов до и после реакции:
Эта реакция окислительно-восстановительная, так как изменяются степени окисления атомов хлора и марганца. НCl - восстановитель, MnО 2 - окислитель. Составляем электронные уравнения:

и находим коэффициенты при восстановителе и окислителе. Они соответственно равны 2 и 1. Коэффициент 2 (а не 1) ставится потому, что 2 атома хлора со степенью окисления -1 отдают 2 электрона. Этот коэффициент уже стоит в электронном уравнении:
2НСl + MnO 2 → Сl 2 + MnСl 2 + Н 2 О
Находим коэффициенты для других реагирующих веществ. Из электронных уравнений видно, что на 2 моль HCl приходится 1 моль MnО 2 . Однако, учитывая, что для связывания образующегося двухзарядного иона марганца нужно еще 2 моль кислоты, перед восстановителем следует поставить коэффициент 4. Тогда воды получится 2 моль. Окончательное уравнение имеет вид
4НCl + МnО 2 = Сl 2 + MnСl 2 + 2Н 2 О
Проверку правильности написания уравнения можно ограничить подсчетом числа атомов одного какого-либо элемента, например хлора: в левой части 4 и в правой 2 + 2 = 4.
Поскольку в методе электронного баланса изображаются уравнения реакций в молекулярной форме, то после составления и проверки их следует написать в ионной форме.
Перепишем составленное уравнение в ионной форме:
4Н + + 4Сl - + МnО 2 = Сl 2 + Мn 2 + + 2Сl - + 2Н 2 О
и после сокращения одинаковых ионов в обеих частях уравнения получим
4Н + + 2Сl - + МnО 2 = Сl 2 + Мn 2 + + 2Н 2 О
Составление уравнения реакции взаимодействия сероводорода с подкисленным раствором перманганата калия.
Напишем схему реакции - формулы исходных и полученных веществ:
Н 2 S + КМnO 4 + Н 2 SО 4 → S + МnSО 4 + К 2 SO 4 + Н 2 О
Затем покажем изменение степеней окисления атомов до и после реакции:
Изменяются степени окисления у атомов серы и марганца (Н 2 S - восстановитель, КМnО 4 - окислитель). Составляем электронные уравнения, т.е. изображаем процессы отдачи и присоединения электронов:
И наконец, находим коэффициенты при окислителе и восстановителе, а затем при других реагирующих веществах. Из электронных уравнений видно, что надо взять 5 моль Н 2 S и 2 моль КМnО 4 , тогда получим 5 моль атомов S и 2 моль МnSО 4 . Кроме того, из сопоставления атомов в левой и правой частях уравнения, найдем, что образуется также 1 моль К 2 SО 4 и 8 моль воды. Окончательное уравнение реакции будет иметь вид
5Н 2 S + 2КМnО 4 + ЗН 2 SО 4 = 5S + 2МnSО 4 + К 2 SО 4 + 8Н 2 О
Правильность написания уравнения подтверждается подсчетом атомов одного элемента, например кислорода; в левой части их 2 4 + 3 4 = 20 и в правой части 2 4 + 4 + 8 = 20.
Переписываем уравнение в ионной форме:
5Н 2 S + 2MnO 4 - + 6H + = 5S + 2Мn 2+ + 8Н 2 О
Известно, что правильно написанное уравнение реакции является выражением закона сохранения массы веществ. Поэтому число одних и тех же атомов в исходных веществах и продуктах реакции должно быть одинаковым. Должны сохраняться и заряды. Сумма зарядов исходных веществ всегда должна быть равна сумме зарядов продуктов реакции.
Метод электронно-ионного баланса более универсален по сравнению с методом электронного баланса и имеет неоспоримое преимущество при подборе коэффициентов во многих окислительно-восстановительных реакциях, в частности, с участием органических соединений, в которых даже процедура определения степеней окисления является очень сложной.
Классификация ОВР
Различают три основных типа окислительно-восстановительных реакций:
1) Реакции межмолекулярного окисления-восстановления
(когда окислитель и восстановитель - разные вещества);
2) Реакции диспропорционирования
(когда окислителем и восстановителем может служить одно и то же вещество);
3) Реакции внутримолекулярного окисления-восстановления
(когда одна часть молекулы выступает в роли окислителя, а другая - в роли восстановителя).>
Рассмотрим примеры реакций трех типов.
1. Реакциями межмолекулярного окисления-восстановления являются все уже рассмотренные нами в этом параграфе реакции.
Рассмотрим несколько более сложный случай, когда не весь окислитель может быть израсходован в реакции, поскольку часть его участвует в обычной - не окислительно-восстановительной реакции обмена:
Cu 0 + H + N +5 O 3 -2 = Cu +2 (N +5 O 3 -2) 2 + N +2 O -2 + H 2 O
Часть частиц NO 3 - участвует в реакции в качестве окислителя, давая оксид азота NO, а часть ионов NO 3 - в неизменном виде переходит в соединение меди Cu(NO 3) 2 . Составим электронный баланс:
Cu 0 - 2e- = Cu +2
N +5 + 3e- = N +2
Поставим найденный для меди коэффициент 3 перед Cu и Cu(NO 3) 2 . А вот коэффициент 2 следует поставить только перед NO, потому что весь имеющийся в нем азот участвовал в окислительно-восстановительной реакции. Было бы ошибкой поставить коэффициент 2 перед HNO 3 , потому что это вещество включает в себя и те атомы азота, которые не участвуют в окислении-восстановлении и входят в состав продукта Cu(NO 3) 2 (частицы NO 3 - здесь иногда называют "ионом-наблюдателем").
Остальные коэффициенты подбираются без труда по уже найденным:
3 Cu + 8HNO 3 = 3 Cu(NO 3) 2 + 2 NO + 4H 2 O
2. Реакции диспропорционирования происходят тогда, когда молекулы одного и того же вещества способны окислять и восстанавливать друг друга. Это становится возможным, если вещество содержит в своем составе атомы какого-либо элемента в промежуточной степени окисления.
Следовательно, степень окисления способна как понижаться, так и повышаться. Например:
HN +3 O 2 = HN +5 O 3 + N +2 O + H 2 O
Эту реакцию можно представить как реакцию между HNO 2 и HNO 2 как окислителем и восстановителем и применить метод электронного баланса:
HN +3 O 2 + HN +3 O 2 = HN +5 O3 + N +2 O + H 2 O
N +3 - 2e- = N +5
N +3 + e- = N +2
Получаем уравнение:
2HNO 2 + 1HNO 2 = 1 HNO 3 + 2 NO + H 2 O
Или, складывая вместе моли HNO 2:
3HNO 2 = HNO 3 + 2NO + H 2 O
Реакции внутримолекулярного окисления-восстановления происходят тогда, когда в молекуле соседствуют атомы-окислители и атомы-восстановители. Рассмотрим разложение бертолетовой соли KClO 3 при нагревании:
KCl +5 O 3 -2 = KCl - + O 2 0
Это уравнение также подчиняется требованию электронного баланса:
Cl +5 + 6e- = Cl -
2O -2 - 2e- = O 2 0
Здесь возникает сложность - какой из двух найденных коэффициентов поставить перед KClO 3 - ведь эта молекула содержит и окислитель и восстановитель?
В таких случаях найденные коэффициенты ставятся перед продуктами:
KClO 3 = 2KCl + 3O 2
Теперь ясно, что перед KClO 3 надо поставить коэффициент 2.
2KClO 3 = 2KCl + 3O 2
Внутримолекулярная реакция разложения бертолетовой соли при нагревании используется при получении кислорода в лаборатории.
Метод полуреакций

Как показывает само название, этот метод основан на составлении ионных уравнений для процесса окисления и процесса восстановления с последующим суммированием их в общее уравнение.
В качестве примера составим уравнение той же реакции, которую использовали при объяснении метода электронного баланса.
При пропускании сероводорода Н 2 S через подкисленный раствор перманганата калия КМnО 4 малиновая окраска исчезает и раствор мутнеет.
Опыт показывает, что помутнение раствора происходит в результате образования элементной серы, т.е. протекания процесса:
Н 2 S → S + 2H +
Эта схема уравнена по числу атомов. Для уравнивания по числу зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства:
Н 2 S - 2е - = S + 2H +
Это первая полуреакция - процесс окисления восстановителя Н 2 S.
Обесцвечивание раствора связано с переходом иона MnO 4 - (он имеет малиновую окраску) в ион Mn 2+ (практически бесцветный и лишь при большой концентрации имеет слабо-розовую окраску), что можно выразить схемой
MnO 4 - → Mn 2+
В кислом растворе кислород, входящий в состав ионов МnО 4 , вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так:
MnO 4 - + 8Н + → Мn 2+ + 4Н 2 О
Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные - два положительных (2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов:
MnO 4 - + 8Н + + 5e - = Mn 2+ + 4Н 2 О
Это вторая полуреакция - процесс восстановления окислителя, т.е. перманганат-иона
Для составления общего уравнения реакции надо уравнения полуреакций почленно сложить, предварительно уравняв числа отданных и полученных электронов. В этом случае по правилам нахождения наименьшего кратного определяют соответствующие множители, на которые умножаются уравнения полуреакций. Сокращенно запись проводится так:

И, сократив на 10Н + , окончательно получим
5Н 2 S + 2MnO 4 - + 6H + = 5S + 2Mn 2+ + 8Н 2 О
Проверяем правильность составленного в ионной форме уравнения: число атомов кислорода в левой части 8, в правой 8; число зарядов: в левой части (2-)+(6+) = 4+, в правой 2(2+) = 4+. Уравнение составлено правильно, так как атомы и заряды уравнены.
Методом полуреакций составляется уравнение реакции в ионной форме. Чтобы от него перейти к уравнению в молекулярной форме, поступаем так: в левой части ионного уравнения к каждому аниону подбираем соответствующий катион, а к каждому катиону - анион. Затем те же ионы в таком же числе записываем в правую часть уравнения, после чего ионы объединяем в молекулы:

Таким образом, составление уравнений окислительно-восстановительных реакций с помощью метода полуреакций приводит к тому результату, что и метод электронного баланса.
Сопоставим оба метода. Достоинство ыметода полуреакций по сравнению с методом электронного баланса в том. что в нем применяются не гипотетические ионы, а реально существующие. В самом деле, в растворе нет ионов , а есть ионы .
При методе полуреакций не нужно знать степень окисления атомов.
Написание отдельных ионных уравнений полуреакций необходимо для понимания химических процессов в гальваническом элементе и при электролизе. При этом методе видна роль среды как активного участника всего процесса. Наконец, при использовании метода полуреакций не нужно знать все получающиеся вещества, они появляются в уравнении реакции при выводе его. Поэтому методу полуреакций следует отдать предпочтение и применять его при составлении уравнений всех окислительно-восстановительных реакций, протекающих в водных растворах.
Химические реакции, протекающие с изменением степеней окисления элементов, называются окислительно-восстановительными.
Основные положения теории окисления-восстановления
1. Процесс отдачи электронов атомом или ионом называется окислением:
S 0 - 4e - ® S 4+ (окисление)
Атом или ион, который отдаёт электроны, называется восстановителем (восстановитель): Zn 0 -2e - ® Zn 2+ (окисление).
2. Процесс присоединения электронов атомом или ионом называется восстановлением: S 6+ + 8e - ® S 2- (восстановление).
Атомы или ионы, принимающие электроны, называются окислителями (окислитель): Cl - + e - ® Cl 0 (восстановление).
Окислитель во время реакции восстанавливается, а восстановитель окисляется. Окисление невозможно без одновременно протекающего с ним восстановления и наоборот, восстановление одного вещества невозможно без одновременного окисления другого.
3. В окислительно-восстановительных процессах количество электронов, отданных в процессе окисления, всегда должно быть равно количеству электронов, принятых в процессе восстановления.
Пример:
Cu 2+ O 2- + H 2 0 = Cu 0 + H 2 O 2-
окислитель Cu 2+ +2e - ® Cu 0 восстановление
восстановитель H 2 0 - 2e - ® 2H + окисление
4. Уравнивание количества отданных и принятых электронов производят путём подбора коэффициентов с предварительным составлением уравнения электронного баланса
Пример:
Pb 2+ S 2- + HNO 3 ® S 0 + Pb 2+ (NO 3) 2 + N 2+ O 2- + H 2 O
Восстановитель S 2- - 2e - ® S 0 3 окисление
окислитель N 5+ + 3e - ® N 2+ 2 восстановление
3PbS + 8HNO 3 ® 3S + 3Pb(NO 3) 2 + 2NO + 4H 2 O.
5. При составлении уравнения электронного баланса необходимо исходить из такого количества атомов или ионов сколько их входит в состав молекулы исходного вещества, а иногда в состав молекулы продуктов реакции
Пример:
K 2 Cr 2 6+ O 7 + H 2 SO 4 +KJ - ® J 2 0 + Cr 2 3+ (SO 4) 3 + K 2 SO 4 +H 2 O
Окислитель 2Cr 6+ + 6e - ® 2Cr 3+ 2 1 восстановление
восстановитель 2J - - 2e - ® J 2 0 6 3 окисление
6. Окислительно-восстановительные процессы протекают чаще всего при наличии среды: нейтральной, кислой или щелочной.
Подбор коэффициентов в окислительно-восстановительных реакциях
При подборе коэффициентов надо учитывать основное положение: число электронов, отданных восстановлением, равно числу электронов, полученных окислением.
После выявления окислителя, восстановителя, к соответствующему равенству реакции составляют цифровую схему перехода электронов (уравнение электронного баланса).
Пример 1. Al + Cl 2 ® AlCl 3 , гдеAl – восстановитель, Cl 2 -окислитель.
Схема перехода электронов:
Al 0 - 3e - ® Al +3 3 1 окисление
Cl 0 + e - ® Cl 1 1 3 восстановление
Из данной схемы видно, что на один окисляющийся атом алюминия требуется три атома хлора, воспринимающие эти три электрона (смотри вторую графу). Следовательно, на каждый атом алюминия необходимо три атома хлора или на два атома алюминия три молекулы хлора. Получаем коэффициенты:
2Al + 3Cl 2 = AlCl 3 .
Пример 2. N 3- H 3 + O 0 2 ® N 2+ O 2- +H 2 O, где O 2 - типичный окислитель, а N 3- H 3 играет роль восстановителя.
Составляем схему (электронный баланс):
N 3- - 5e - ® N +2 5 2 4 окисление
O 0 + 2e - ® O -2 2 5 10 восстановление
На 4 атома азота требуется 10 атомов или 5 молекул кислорода. Получаем коэффициенты:
4NH 3 + 5O 2 = 4NO + 6H 2 O.
Особые случаи составления равенств окислительно-восстановительных реакций
1. Если в реакции число электронов, теряемых восстановителем, и число электронов, принимаемых окислителем, является чётными числами, то при нахождении коэффициентов число электронов делят на общий наибольший делитель.
Пример:
H 2 SO 3 + HClO 3 ® H 2 SO 4 +HCl
Восстановитель S +4 - 2е - ® S +6 6 3 окисление
окислительCl +5 + 6e - ® Cl - 2 1 восстановление
Коэффициентами у восстановителя и окислителя будут не 2 и 6, а 1и 3:
3H 2 SO 3 +3HClO 3 =3H 2 SO 4 +HCl.
Если же число электронов, теряемых восстановителем и приобретаемых окислителем, нечетно, а в результате реакции должно получиться чётное число атомов, то коэффициенты удваиваются.
Пример:
KJ - + KMn +7 O 4 + H 2 S +6 O 4 ® J o 2 + K 2 S +6 O 4 + Mn +2 SO 4 + H 2 O
Восстановитель J - -1e - ® J o 5 10 окисление
Коэффициентами у окислителя и восстановителя будут не 1 и 5, а 2 и 10:
10KJ + 2KMnO 4 + 8H 2 SO 4 = 5J 2 + 6K 2 SO 4 + 2MnSO 4 + 8H 2 O.
2. Иногда восстановитель или окислитель расходуется дополнительно на связывание образующихся в результате реакции продуктов.
Пример:
HBr - + KMn +7 O 4 + HBr ®Br 0 2 + KBr - + Mn +2 Br 2 0 + H 2 O
Восстановитель Br - - e - ® Br 0 5 10 окисление
окислитель Mn +7 + 5e - ® Mn +2 1 2 восстановление
В этой реакции десять молекул HBr реагируют как восстановители, а шесть молекул HBr необходимы для связывания получающихся веществ (солеобразование):
10HBr + 2KMnO 4 + 6HBr = 5Br 2 + 2KBr + 2MnBr 2 + 8H 2 O.
3.Окисляются одновременно и положительные и отрицательные ионы молекулы восстановителя.
Пример:
As 2 +3 S 3 -2 + HN +5 O 3 ® H 3 As +5 O 4 + H 2 S +6 O 4 + N +2 O + H 2 O
Здесь ионы As +3 окисляются в ионы As 2 +3 и одновременно ионы S -2 окисляются в ионы S +6 а анионы N +5 восстанавливаются до N +2 .
2Аs +3 - 4e - ® 2Аs +5
восстановители 3S -2 - 24e - ® 3S +6 окисление
окислитель N +5 + 3e - ® N +2 восстановление
В этой реакции на каждые три молекулы As 2 S 3 реагируют 28 молекул HNO 3 . Проверяем правильность составления равенств реакции путём подсчёта атомов водорода и кислорода в правой и левой частях. Таким образом, находим, что в реакцию вступают ещё 4 молекулы воды, которые должны быть приписаны к левой части равенства для окончательной его записи:
3As 2 S 3 + 28HNO 3 + 4H 2 O = 6H 3 AsO 4 + 9H 2 SO 4 + 28NO
2As +3 –4e®2As +5 4
3S -2 –24e®3S + 24
Восстановители 2As +3 + 3S -2 - 28e - ®2As +5 + 3S +6 3 окисление
окислитель N +5 + 3e - ®N +2 28 восстановление
4. Восстановителем и окислителем являются ионы одного и того же элемента, но входящие в состав различных веществ.
Пример:
KJ - + KJ +5 O 3 + H 2 SO 4 ® J 0 2 + K 2 SO 4 + H 2 O
Восстановитель J - - е - ® J 0 5 окисление
окислитель J +5 + 5e - ®J 0 1 восстановление
5KJ + KJO 3 + 3H 2 SO 4 = 3J 2 + 3K 2 SO 4 + 3H 2 O.
5.Восстановителем и окислителем являются ионы одного и того же элемента, входящие в состав одного вещества (самоокисление -самовосстановление).
Пример:
HN +3 O 2 ® HN +5 O 3 + N +2 O + H 2 O
Восстановитель N +3 - 2e - ® N +5 1 окисление
окислитель N +3 + e - ® N +2 2 восстановление
Следовательно, равенство реакции
Окислительно-восстановительные реакции – реакции, протекающие с изменением степени окисления элементов.
Окисление — процесс отдачи электронов атомом
Восстановление — процесс приёма электронов атомом
Восстановитель — элемент, отдающий электроны
Окислитель – элемент, принимающий электроны
Для наглядного, но упрощённого представления о причинах изменения зарядов у элементов обратимся к рисункам:
Атом-это электронейтральная частица. Поэтому число протонов равно числу электронов

Если элемент отдаёт электрон, то его заряд меняется. Он становится положительно заряженным (если принимает, наоборот, отрицательно)

Т.о. на заряд элемента оказывает влияние количество отданных или принятых электронов
I. Составление уравнений окислительно-восставновительных реакций
1. Записываем схему реакции
Na + Cl 2 -> NaCl
2. Расставляем степени окисления элементов:
Na 0 + Cl 2 0 -> Na + Cl —
3. Выписываем элементы, изменившие степень окисления и определяем число отданных/принятых электронов:
Na 0 -1е -> Na +
Cl 2 +2e ->2Cl —
4. Находим наименьшее общее кратное чисел отданных и присоединённых электронов:
Т.о. мы получили необходимые коэффициенты
5. Расставляем коэффициенты:
2Na 0 + Cl 2 0 -> 2Na + Cl —
Окислители — это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается . Окислители при этом восстанавливаются .
Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается . Восстановители при этом окисляются .
Химические вещества можно разделить на типичные окислители , типичные восстановители , и вещества, которые могут проявлять и окислительные, и восстановительные свойства . Некоторые вещества практически не проявляют окислительно-восстановительную активность.
К типичным окислителям относят:
- простые вещества-неметаллы с наиболее сильными окислительными свойствами (фтор F 2 , кислород O 2 , хлор Cl 2);
- ионы металлов или неметаллов с высокими положительными (как правило, высшими) степенями окисления : кислоты (HN +5 O 3 , HCl +7 O 4), соли (KN +5 O 3 , KMn +7 O 4), оксиды (S +6 O 3 , Cr +6 O 3)
- соединения, содержащие некоторые катионы металлов , имеющих высокие степени окисления : Pb 4+ , Fe 3+ , Au 3+ и др.
Типичные восстановители – это, как правило:
- простые вещества-металлы (восстановительные способности металлов определяются рядом электрохимической активности);
- сложные вещества, в составе которых есть атомы или ионы неметаллов с отрицательной (как правило, низшей) степенью окисления : бинарные водородные соединения (H 2 S, HBr), соли бескислородных кислот (K 2 S, NaI);
- некоторые соединения, содержащие катионы с минимальной положительной степенью окисления (Sn 2+ , Fe 2+ , Cr 2+), которые, отдавая электроны, могут повышать свою степень окисления ;
- соединения, содержащие сложные ионы, состоящие из неметаллов с промежуточной положительной степенью окисления (S +4 O 3) 2– , (НР +3 O 3) 2– , в которых элементы могут, отдавая электроны, повышать свою положительную степень окисления .
Большинство остальных веществ может проявлять как окислительные, так и восстановительные свойства .

Типичные окислители и восстановители приведены в таблице.

В лабораторной практике наиболее часто используются следующие окислители :
перманганат калия (KMnO 4);
дихромат калия (K 2 Cr 2 O 7);
азотная кислота (HNO 3);
концентрированная серная кислота (H 2 SO 4);
пероксид водорода (H 2 O 2);
оксиды марганца (IV) и свинца (IV) (MnO 2 , PbO 2);
расплавленный нитрат калия (KNO 3) и расплавы некоторых других нитратов.
К восстановителям , которые применяются в лабораторной практике относятся:
- магний (Mg), алюминий (Al), цинк (Zn) и другие активные металлы;
- водород (Н 2) и углерод (С);
- иодид калия (KI);
- сульфид натрия (Na 2 S) и сероводород (H 2 S);
- сульфит натрия (Na 2 SO 3);
- хлорид олова (SnCl 2).
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции обычно разделяют на четыре типа: межмолекулярные, внутримолекулярные, реакции диспропорционирования (самоокисления-самовосстановления), и реакции контрдиспропорционирования .
Межмолекулярные реакции протекают с изменением степени окисления разных элементов из разных реагентов . При этом образуются разные продукты окисления и восстановления .
2Al 0 + Fe +3 2 O 3 → Al +3 2 O 3 + 2Fe 0 ,
C 0 + 4HN +5 O 3(конц) = C +4 O 2 + 4N +4 O 2 + 2H 2 O.
Внутримолекулярные реакции – это такие реакции, в которых разные элементы из одного реагента переходят в разные продукты, например :
(N -3 H 4) 2 Cr +6 2 O 7 → N 2 0 + Cr +3 2 O 3 + 4 H 2 O,
2 NaN +5 O -2 3 → 2 NaN +3 O 2 + O 0 2 .
Реакции диспропорционирования (самоокисления-самовосстановления) – это такие реакции, в которых окислитель и восстановитель – один и тот же элемент одного реагента, который при этом переходит в разные продукты :
3Br 2 + 6 KOH → 5KBr + KBrO 3 + 3 H 2 O,
Репропорционирование (конпропорционирование, контрдиспропорционирование ) – это реакции, в которых окислитель и восстановитель – это один и тот же элемент , которыйиз разных реагентов переходит в один продукт . Реакция, обратная диспропорционированию.
2H 2 S -2 + S +4 O 2 = 3S + 2H 2 O

Основные правила составления окислительно-восстановительных реакций
Окислительно-восстановительные реакции сопровождаются процессами окисления и восстановления:
Окисление — это процесс отдачи электронов восстановителем.
Восстановление — это процесс присоединения электронов окислителем.
Окислитель восстанавливается , а восстановитель окисляется .
В окислительно-восстановительных реакциях соблюдается электронный баланс : количество электронов, которые отдает восстановитель, равно количеству электронов, которые получает окислитель. Если баланс составлен неверно, составить сложные ОВР у вас не получится.
Используется несколько методов составления окислительно-восстановительных реакций (ОВР): метод электронного баланса, метод электронно-ионного баланса (метод полуреакций) и другие.
Рассмотрим подробно метод электронного баланса .
«Опознать» ОВР довольно легко — достаточно расставить степени окисления во всех соединениях и определить, что атомы меняют степень окисления:
K + 2 S -2 + 2K + Mn +7 O -2 4 = 2K + 2 Mn +6 O -2 4 + S 0
Выписываем отдельно атомы элементов, меняющих степень окисления, в состоянии ДО реакции и ПОСЛЕ реакции.
Степень окисления меняют атомы марганца и серы:
S -2 -2e = S 0
Mn +7 + 1e = Mn +6
Марганец поглощает 1 электрон, сера отдает 2 электрона. При этом необходимо, чтобы соблюдался электронный баланс . Следовательно, необходимо удвоить число атомов марганца, а число атомов серы оставить без изменения. Балансовые коэффициенты указываем и перед реагентами, и перед продуктами!
Схема составления уравнений ОВР методом электронного баланса:

Внимание! В реакции может быть несколько окислителей или восстановителей. Баланс необходимо составить так, чтобы ОБЩЕЕ число отданных и полученных электронов было одинаковым.
Общие закономерности протекания окислительно-восстановительных реакций
Продукты окислительно-восстановительных реакций зачастую зависят от условий проведения процесса . Рассмотрим основные факторы, влияющие на протекание окислительно-восстановительных реакций .
Самый очевидный фактор, определяющий — среда раствора реакции — . Как правило (но не обязательно), вещество, определяющее среду, указано среди реагентов. Возможны такие варианты:
- окислительная активность усиливается в более кислой среде и окислитель восстанавливается глубже (например, перманганат калия, KMnO 4 , где Mn +7 в кислой среде восстанавливается до Mn +2 , а в щелочной — до Mn +6);
- окислительная активность усиливается в более щелочной среде , и окислитель восстанавливается глубже (например, нитрат калия KNO 3 , где N +5 при взаимодействии с восстановителем в щелочной среде восстанавливается до N -3);
- либо окислитель практически не подвержен изменениям среды.

Среда протекания реакции позволяет определить состав и форму существования остальных продуктов ОВР. Основной принцип — продукты образуются такие, которые не взаимодействуют с реагентами!
Обратите внимание! Е сли среда раствора кислая, то среди продуктов реакции не могут присутствовать основания и основные оксиды, т.к. они взаимодействуют с кислотой. И, наоборот, в щелочной среде исключено образование кислоты и кислотного оксида. Это одна из наиболее частых, и наиболее грубых ошибок.
Также на направление протекания ОВР влияет природа реагирующих веществ. Например , при взаимодействии азотной кислоты HNO 3 с восстановителями наблюдается закономерность — чем больше активность восстановителя, тем больше восстановливается азот N +5 .
При увеличении температуры большинство ОВР, как правило, проходят более интенсивно и более глубоко.
В гетерогенных реакциях на состав продуктов зачастую влияет степень измельчения твердого вещества . Например, порошковый цинк с азотной кислотой образует одни продукты, а гранулированный — совершенно другие. Чем больше степень измельчения реагента, тем больше его активность, как правило.
Рассмотрим наиболее типичные лабораторные окислители.
Основные схемы окислительно-восстановительных реакций
Схема восстановления перманганатов
В составе перманганатов есть мощный окислитель — марганец в степени окисления +7. Соли марганца +7 окрашивают раствор в фиолетовый цвет.

Перманганаты, в зависимости от среды реакционного раствора, восстанавливаются по-разному.
В кислой среде восстановление происходит более глубоко, до Mn 2+ . Оксид марганца в степени окисления +2 проявляет основные свойства, поэтому в кислой среде образуется соль. Соли марганца +2 бесцветны . В нейтральном растворе марганец восстанавливается до степени окисления +4 , с образованием амфотерного оксида MnO 2 — коричневого осадка, нерастворимого в кислотах и щелочах. В щелочной среде марганец восстанавливается минимально — до ближайшей степени окисления +6 . Соединения марганца +6 проявляют кислотные свойства, в щелочной среде образуют соли — манганаты . Манганаты придают раствору зеленую окраску .

Рассмотрим взаимодействие перманганата калия KMnO 4 с сульфидом калия в кислой, нейтральной и щелочной средах. В этих реакциях продуктом окисления сульфид-иона является S 0 .
5 K 2 S + 2 KMnO 4 + 8 H 2 SO 4 = 5 S + 2 MnSO 4 + 6 K 2 SO 4 + 8 H 2 O,
3 K 2 S + 2 KMnO 4 + 4 H 2 O = 2 MnO 2 ↓ + 3 S↓ + 8 KOH,
Распространенной ошибкой в этой реакции является указание на взаимодействие серы и щелочи в продуктах реакции. Однако, сера взаимодействует с щелочью в довольно жестких условиях (повышенная температура), что не соответствует условиям этой реакции. При обычных условиях правильно будет указывать именно молекулярную серу и щелочь отдельно, а не продукты их взаимодействия.
K 2 S + 2 KMnO 4 –(KOH)= 2 K 2 MnO 4 + S↓
При составлении этой реакции также возникают трудности. Дело в том, что в данном случае написание молекулы среды (КОН или другая щелочь) в реагентах не требуется для уравнивания реакции. Щелочь принимает участие в реакции, и определяет продукт восстановления перманганата калия, но реагенты и продукты уравниваются и без ее участия. Этот, казалось бы, парадокс легко разрешим, если вспомнить, что химическая реакция — это всего лишь условная запись, которая не указывает на каждый происходящий процесс, а всего лишь является отображением суммы всех процессов. Как определить это самостоятельно? Если действовать по классической схеме — баланс-балансовые коэффициенты-уравнивание металла, то вы увидите, что металлы уравниваются балансовыми коэффициентами, и наличие щелочи в левой части уравнения реакции будет лишним.
Перманганаты окисляют:
- неметаллы с отрицательной степенью окисления до простых веществ (со степенью окисления 0), исключения — фосфор, мышьяк — до +5 ;
- неметаллы с промежуточной степенью окисления до высшей степени окисления;
- активные металлы стабильной положительной степенью окисления металла.
KMnO 4 + неМе (низшая с.о.) = неМе 0 + другие продукты
KMnO 4 + неМе (промежуточная с.о.) = неМе(высшая с.о.) + др. продукты
KMnO 4 + Ме 0 = Ме (стабильная с.о.) + др. продукты
KMnO 4 + P -3 , As -3 = P +5 , As +5 + др. продукты
Схема восстановления хроматов/бихроматов
Особенностью хрома с валентностью VI является то, что он образует 2 типа солей в водных растворах: хроматы и бихроматы, в зависимости от среды раствора. Хроматы активных металлов (например, K 2 CrO 4) — это соли, которые устойчивы в щелочной среде. Дихроматы (бихроматы) активных металлов (например, K 2 Cr 2 O 7) — соли, устойчивые в кислой среде .
Восстанавливаются соединения хрома (VI) до соединений хрома (III) . Соединения хрома Cr +3 — амфотерные, и в зависимости от среды раствора они существуют в растворе в различных формах: в кислой среде в виде солей (амфотерные соединения при взаимодействии с кислотами образуют соли), в нейтральной среде — нерастворимый амфотерный гидроксид хрома (III) Cr(OH) 3 , и в щелочной среде соединения хрома (III) образуют комплексную соль, например, гексагидроксохромат (III) калия K 3 .

Соединения хрома VI окисляют:
- неметаллы в отрицательной степени окисления до простых веществ (со степенью окисления 0), исключения — фосфор, мышьяк – до +5 ;
- неметаллы в промежуточной степени окисления до высшей степени окисления;
- активные металлы из простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
Хромат/бихромат + неМе (отрицательная с.о.) = неМе 0 + другие продукты
Хромат/бихромат + неМе (промежуточная положительная с.о.) = неМе(высшая с.о.) + др. продукты
Хромат/бихромат + Ме 0 = Ме (стабильная с.о.) + др. продукты
Хромат/бихромат + P, As (отрицательная с.о.) = P, As +5 + другие продукты
Разложение нитратов
Соли-нитраты содержат азот в степени окисления +5 — сильный окислитель . Такой азот может окислять кислород (О -2). Это происходит при нагревании нитратов. При этом в большинстве случаев кислород окисляется до степени окисления 0, т.е. до молекулярного кислорода O 2 .
В зависимости от типа металла, образующего соль, при термическом (температурном) разложении нитратов образуются различные продукты: если металл активный (в ряду электрохимической активности находятся до магния ), то азот восстанавливается до степени окисления +3, и при разложении образуется соли-нитриты и молекулярный кислород .
Например :
2NaNO 3 → 2NaNO 2 + O 2 .
Активные металлы в природе встречаются в виде солей (KCl, NaCl).
Если металл в ряду электрохимической активности находится правее магния и левее меди (включая магний и медь) , то при разложении образуется оксид металла в устойчивой степени окисления, оксид азота (IV) (бурый газ) и кислород . Оксид металла образует также при разложении нитрат лития .
Например , разложение нитрата цинка :
2Zn(NO 3) 2 → 2ZnО + 4NO 2 + O 2 .
Металлы средней активности чаще всего в природе встречаются в виде оксидов (Fe 2 O 3 , Al 2 O 3 и др.).
Ионы металлов , расположенных в ряду электрохимической активности правее меди являются сильными окислителями. При разложении нитратов они, как и N +5 , участвуют в окислении кислорода, и восстанавливаются до простых веществ, т.е. образуется металл и выделяются газы — оксид азота (IV) и кислород .
Например , разложение нитрата серебра :
2AgNO 3 → 2Ag + 2NO 2 + O 2 .
Неактивные металлы в природе встречаются в виде простых веществ.
Некоторые исключения!
Разложение нитрата аммония :
В молекуле нитрата аммония есть и окислитель, и восстановитель: азот в степени окисления -3 проявляет только восстановительные свойства, азот в степени окисления +5 — только окислительные.
При нагревании нитрат аммония разлагается . При температуре до 270 о С образуется оксид азота (I) («веселящий газ») и вода:
NH 4 NO 3 → N 2 O + 2H 2 O
Это пример реакции контрдиспропорционирования .
Результирующая степень окиcления азота — среднее арифметическое степени окисления атомов азота в исходной молекуле.
При более высокой температуре оксид азота (I) разлагается на простые вещества — азот и кислород :
2NH 4 NO 3 → 2N 2 + O 2 + 4H 2 O
При разложении нитрита аммония NH 4 NO 2 также происходит контрдиспропорционирование.
Результирующая степень окисления азота также равна среднему арифметическому степеней окисления исходных атомов азота — окислителя N +3 и восстановителя N -3
NH 4 NO 2 → N 2 + 2H 2 O
Термическое разложение нитрата марганца (II) сопровождается окислением металла:
Mn(NO 3) 2 = MnO 2 + 2NO 2
Нитрат железа (II) при низких температурах разлагается до оксида железа (II), при нагревании железо окисляется до степени окисления +3:
2Fe(NO 3) 2 → 2FeO + 4NO 2 + O 2 при 60°C
4Fe(NO 3) 2 → 2Fe 2 O 3 + 8NO 2 + O 2 при >60°C
Нитрат никеля (II)
разлагается до нитрита при нагревании.
Окислительные свойства азотной кислоты
Азотная кислота HNO 3 при взаимодействии с металлами практически никогда не образует водород , в отличие от большинства минеральных кислот.
Это связано с тем, что в составе кислоты есть очень сильный окислитель — азот в степени окисления +5. При взаимодействии с восстановителями — металлами образуются различные продукты восстановления азота.
Азотная кислота + металл = соль металла + продукт восстановления азота + H 2 O
Азотная кислота при восстановлении может переходить в оксид азота (IV) NO 2 (N +4); оксид азота (II) NO (N +2); оксид азота (I) N 2 O («веселящий газ»); молекулярный азот N 2 ; нитрат аммония NH 4 NO 3 . Как правило, образуется смесь продуктов с преобладанием одного из них. Азот восстанавливается при этом до степеней окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты . При этом работает правило: чем меньше концентрация кислоты и выше активность металла, тем больше электронов получает азот, и тем более восстановленные продукты образуются .
Некоторые закономерности позволят верно определять основной продукт восстановления металлами азотной кислоты в реакции:
- при действии очень разбавленной азотной кислоты на металлы образуется, как правило, нитрат аммония NH 4 NO 3 ;
Например , взаимодействие цинка с очень разбавленной азотной кислотой:
4Zn + 10HNO 3 = 4Zn(NO 3) 2 + NH 4 NO 3 + 3H 2 O
- концентрированная азотная кислота на холоде пассивирует некоторые металлы — хром Cr, алюминий Al и железо Fe . При нагревании или разбавлении раствора реакция идет;
пассивация металлов — это перевод поверхности металла в неактивное состояние за счет образования на поверхности металла тонких слоев инертных соединений, в данном случае преимущественно оксидов металлов, которые не реагируют с концентрированной азотной кислотой
- азотная кислота не реагирует с металлами платиновой подгруппы — золотом Au, платиной Pt, и палладием Pd;
- при взаимодействии концентрированной кислоты с неактивными металлами и металлами средней активности азотная кислота восстанавливается до оксида азота (IV) NO 2 ;
Например , окисление меди концентрированной азотной кислотой:
Cu+ 4HNO 3 = Cu(NO 3) 2 + 2NO 2 + 2H 2 O
- при взаимодействии концентрированной азотной кислоты с активными металлами образуется оксид азота (I) N 2 O ;
Например , окисление натрия концентрированной азотной кислотой :
Na+ 10HNO 3 = 8NaNO 3 + N 2 O + 5H 2 O
- при взаимодействии разбавленной азотной кислоты с неактивными металлами (в ряду активности правее водорода) кислота восстанавливается до оксида азота (II) NO ;
- при взаимодействии разбавленной азотной кислоты с металлами средней активности образуется либо оксид азота (II) NO, либо оксид азота N 2 O, либо молекулярный азот N 2 — в зависимости от дополнительных факторов (активность металла, степень измельчения металла, степень разбавления кислоты, температура).
- при взаимодействии разбавленной азотной кислоты с активными металлами образуется молекулярный азот N 2 .
Для приближенного определения продуктов восстановления азотной кислоты при взаимодействии с разными металлами я предлагаю воспользоваться принципом маятника. Основные факторы, смещающие положение маятника: концентрация кислоты и активность металла. Для упрощения используем 3 типа концентраций кислоты: концентрированная (больше 30%), разбавленная (30% или меньше), очень разбавленная (меньше 5%). Металлы по активности разделим на активные (до алюминия), средней активности (от алюминия до водорода) и неактивные (после водорода). Продукты восстановления азотной кислоты располагаем в порядке убывания степени окисления:
NO 2 ; NO; N 2 O; N 2 ; NH 4 NO 3
Чем активнее металл, тем больше мы смещаемся вправо. Чем больше концентрация или меньше степень разбавления кислоты, тем больше мы смещаемся влево.
Например , взаимодействуют концентрированная кислота и неактивный металл медь Cu. Следовательно, смещаемся в крайнее левое положение, образуется оксид азота (IV), нитрат меди и вода.
Взаимодействие металлов с серной кислотой
Разбавленная серная кислота взаимодействует с металлами, как обычная минеральная кислота. Т.е. взаимодействует с металлами, которые расположены в ряду электрохимических напряжений до водорода . Окислителем здесь выступают ионы H + , которые восстанавливаются до молекулярного водорода H 2 . При этом металлы окисляются, как правило, до минимальной степени окисления.
Например :
Fe + H 2 SO 4(разб) = FeSO 4 + H 2
взаимодействует с металлами, стоящими в ряду напряжений как до, так и после водорода.
H 2 SO 4 (конц) + металл = соль металла + продукт восстановления серы (SO 2 , S, H 2 S) + вода
При взаимодействии концентрированной серной кислоты с металлами образуются соль металла (в устойчивой степени окисления), вода и продукт восстановления серы — сернистый газ S +4 O 2 , молекулярная сера S либо сероводород H 2 S -2 , в зависимости от степени концентрации, активности металла, степени его измельчение, температуры и т.д. При взаимодействии концентрированной серной кислоты с металлами молекулярный водород не образуется!
Основные принципы взаимодействия концентрированной серной кислоты с металлами:
1. Концентрированная серная кислота пассивирует алюминий, хром, железо при комнатной температуре, либо на холоду;
2. Концентрированная серная кислота не взаимодействует с золотом, платиной и палладием ;
3. С неактивными металлами концентированная серная кислота восстанавливается до оксида серы (IV).
Например , медь окисляется концентрированной серной кислотой :
Cu 0 + 2H 2 S +6 O 4(конц) = Cu +2 SO 4 + S +4 O 2 + 2H 2 O
4. При взаимодействии с активными металлами и цинком концентрированная серная кислота образует серу S либо сероводород H 2 S 2- (в зависимости от температуры, степени измельчения и активности металла).
Например , взаимодействие концентрированной серной кислоты с цинком :
8Na 0 + 5H 2 S +6 O 4(конц) → 4Na 2 + SO 4 + H 2 S — 2 + 4H 2 O
Пероксид водорода
Пероксид водорода H 2 O 2 содержит кислород в степени окисления -1. Такой кислород может и повышать, и понижать степень окисления. Таким образом, пероксид водорода проявляет и окислительные, и восстановительные свойства.
При взаимодействии с восстановителями пероксид водорода проявляет свойства окислителя, и восстанавливается до степени окисления -2. Как правило, продуктом восстановления пероксида водорода является вода или гидроксид-ион, в зависимости от условий проведения реакции. Например:
S +4 O 2 + H 2 O 2 -1 → H 2 S +6 O 4 -2
При взаимодействии с окислителями перекись окисляется до молекулярного кислорода (степень окисления 0): O 2 . Например :
2KMn +7 O 4 + 5H 2 O 2 -1 + 3H 2 SO 4 → 5O 2 0 + 2Mn +2 SO 4 + K 2 SO 4 + 8H 2 O
Многие вещества обладают особыми свойствами, которые в химии принято называть окислительными или восстановительными.
Одни химические вещества проявляют свойства окислителей, другие - восстановителей, при этом некоторые соединения могут проявлять те и другие свойства одновременно (например – перекись водорода Н 2 О 2).
Что же такое окислитель и восстановитель, окисление и восстановление?
Окислительно-восстановительные свойства вещества связаны с процессом отдачи и приема электронов атомами, ионами или молекулами.
Окислитель - это вещество, которое в ходе реакции принимает электроны, т. е. восстанавливается; восстановитель - отдает электроны, т. е. окисляется. Процессы передачи электронов от одних веществ к другим, обычно называют окислительно-восстановительными реакциями.
Соединения, содержащие атомы элементов с максимальной степенью окисления, могут быть только окислителями за счет этих атомов, т.к. они уже отдали все свои валентные электроны и способны только принимать электроны. Максимальная степень окисления атома элемента равна номеру группы в периодической таблице, к которой относится данный элемент. Соединения, содержащие атомы элементов с минимальной степенью окисления могут служить только восстановителями, поскольку они способны лишь отдавать электроны, потому, что внешний энергетический уровень у таких атомов завершен восемью электронами
 Материк евразия краткое описание для детей Местность евразии
Материк евразия краткое описание для детей Местность евразии Исследовательская работа " Проблемы молодежи" творческая работа учащихся по немецкому языку (9 класс) на тему Топик по немецкому проблемы молодежи
Исследовательская работа " Проблемы молодежи" творческая работа учащихся по немецкому языку (9 класс) на тему Топик по немецкому проблемы молодежи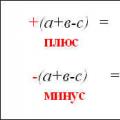 Восприятие учебной информации, психофизиологические особенности Психологические условия развития восприятия учебного материала учащимися
Восприятие учебной информации, психофизиологические особенности Психологические условия развития восприятия учебного материала учащимися