Номенклатура в органической химии. Удивительный мир органических веществ
Еще в середине XIX в. отдельные химики пытались создать такую номенклатуру, которая говорила бы о строении называемых веществ; такую номенклатуру называют рациональной. При этом, например, названия углеводородов производились от названий первого представителя данной группы углеводородов. Так, для ряда метана основой наименования служило название метана. Например, один из изомеров пентана можно назвать диметилэтилметан, т. е. это вещество можно представить как производное метана, у которого два атома водорода замещены метальными группами СН3, а один атом водорода - этильной группой С 2 Н 5 .
Международная номенклатура
Желая создать наиболее рациональную номенклатуру органических соединений, которая была бы принята во всех странах мира, крупнейшие химики - представители химических обществ разных стран - собрались в 1892 г. в Женеве (Швейцария). На этом совещании была выработана систематическая научная номенклатура, которую теперь обычно называют женевской или международной номенклатурой.
Для того чтобы назвать какое-либо соединение по женевской номенклатуре, руководствуются следующими правилами.
Рассматривая структурную формулу соединения, выбирают наиболее длинную цепь атомов углерода и нумеруют атомы, начиная с того конца, к которому ближе стоит заместитель (боковое ответвление).
Соединение рассматривается согласно принципам женевской номенклатуры как производное нормального углеводорода, имеющего такую же, соответствующую перенумерованной цепь.
Место заместителя (ответвления цепи) обозначают цифрой, соответствующей номеру атома углерода, у которого стоит заместитель, затем называют заместитель и, наконец, углеводород, от которого производят все соединение по наиболее длинной перенумерованной цепи.
В тех случаях, когда в цепи имеется несколько ответвлений, положение каждого указывается отдельно соответствующими цифрами, и каждый заместитель называется особо. Если соединение имеет несколько одинаковых заместителей, например две метильные группы, то после двух цифр, обозначающих их места, говорят «диметил» (от греч. ди - «два»); при наличии трех метильных групп говорят «три-метил» и т. д.
После создания женевской номенклатуры неоднократно пытались ее усовершенствовать - дополнить, исправить. Так, в г. Льеже (Бельгия) рассматривались «Льежские правила», которые, однако, не были приняты многими химиками.
В 1957 г., а затем в 1965 г. съездом Международного союза теоретической и прикладной химии International Union of Pure and Applied Chemisty, сокращенно IUPAC (или ИЮПАК), были утверждены правила номенклатуры органических соединений. Эти правила в основном соответствуют женевской номенклатуре, но вносят в нее некоторые поправки. В дальнейшем при изложении Международной номенклатуры различных классов соединений учтены и рекомендации ИЮПАК.
Органические соединения - самый обширный класс химических соединений. Многообразие органических соединений связано с уникальным свойством углерода образовывать цепочки из атомов, что в свою очередь обусловлено высокой стабильностью углерод-углеродной связи. Связь углерод-углерод может быть как одинарной, так и кратной - двойной, тройной. При увеличении кратности углерод-углеродной связи возрастает её энергия, то есть стабильность, а длина уменьшается. Высокая валентность углерода - 4, а также возможность образовывать кратные связи, позволяет образовывать различные структуры.
Основные положения теории химического строения А.М. Бутлерова
- Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения).
- Химическое строение можно устанавливать химическими методами. (В настоящее время используются также современные физические методы).
- Свойства веществ зависят от их химического строения.
- По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы - предвидеть свойства.
- Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга.
Теория Бутлерова явилась научным фундаментом органической химии и способствовала быстрому ее развитию. Опираясь на положения теории, А.М. Бутлеров дал объяснение явлению изомерии, предсказал существование различных изомеров и впервые получил некоторые из них.
Классификация органических соединений
Классификацию органических веществ проводят по разным признакам.
1.По строению углеродной цепи (скелета):
· ациклические
· циклические (карбоциклические, гетероциклические)
- По наличию боковой цепи (радикала)
· неразветвленные,
· разветвленные
2. По степени насыщенности (кратности) углерод-углеродных связей:
· предельные (алканы, циклоалканы);
· непредельные (алкены, арены, алкины, диены и т.д.).
- По наличию функциональных групп:
· углеводороды;
· гетерофункциональные органические соединения (оксикислоты, аминокислоты).
Все классы органических соединений взаимосвязаны. Переход от одних классов соединений к другим осуществляется в основном за счет превращения функциональных групп без изменения углеродного скелета. Соединения каждого класса составляют гомологический ряд.
Номенклатура органических соединений
Для того, чтобы называть органические соединения используют тривиальную, рациональную и систематическую, или международную (IUPAC) номенклатуру.
Тривиальная (исторически сложившаяся) номенклатура в названии соединения обычно указывает на первоисточник его обнаружения или получения (муравьиная кислота, салициловая кислота и т.д.), на какое-либо из характерных свойств. Такая номенклатура не отражает строение вещества и не позволяет составить формулу по его названию.
По рациональной номенклатуре любое органическое соединение данного гомологического ряда называется как производное простейшего.
По международной номенклатуре определяющим фрагментом, лежащим в основе (в корне) названия ациклических соединений, является самая длинная углеродная цепь, а для циклических – цикл.
Названия первых четырех предельных углеводородов тривиальные (исторические названия) - метан, этан, пропан, бутан. Начиная с пятого, названия образованы греческими числительными, соответствующими количеству атомов углерода в молекуле, с добавлением суффикса «-ан», за исключением числа "девять", когда корнем служит латинское числительное "нона".
Номенклатура гомологов ряда насыщенных углеводородов
| ФОРМУЛА | НАЗВАНИЕ | ФОРМУЛА | НАЗВАНИЕ |
| СН 4 | метан | С 6 Н 14 | гексан |
| С 2 Н 6 | этан | С 7 Н 16 | гептан |
| С 3 Н 8 | пропан | С 8 Н 18 | октан |
| С 4 Н 10 | бутан | С 9 Н 20 | нонан |
| С 5 Н 12 | пентан | С 10 Н 22 | декан |
Одновалентные радикалы, образованные из насыщенных неразветвленных предельных углеводородов отнятием водорода от конечного углеродного атома, называют, заменяя суффикс «-ан» в названии углеводорода, суффиксом «-ил».(- СН 3 метил и т.д.)
При составлении названия вещества по его структурной формуле необходимо последовательно выполнить следующие действия:
1. Выбрать главную углеродную цепь (цикл), включающую основную характеристическую группу, и пронумеровать ее с того конца цепи, ближе к которому расположена старшая группа. Если таких возможностей несколько, то нужно учитывать наличие:
а) других характеристических групп (по старшинству);
б) двойной связи;
в) тройной связи;
г) других заместителей (по алфавиту).
2. Составить название из трех частей;
· С помощью приставки (префикса) обозначить заместители (боковые цепи, младшие характеристические группы) и расположить их по алфавиту. Положение заместителя нужно указать цифрой перед приставкой.
· В основе (корне) назвать главную углеродную цепь с учетом ее вида, длины. К названию главной цепи добавить суффикс, обозначающий степень насыщенности связей. Если в молекуле несколько кратных связей, в суффиксе нужно указать их число, а после суффикса - арабскими цифрами их положение в углеродной цепи.
· В окончание включается название старшей характеристической группы с указанием ее положения.
3. Расставить знаки препинания: все цифры отделить от слов дефисом, а друг от друга - запятыми.
Названия характеристических групп (перечислены в порядке убывания старшинства).
Например: назвать соединения по правилам систематической (IUPAC) номенклатуры:


2,4-диметилгептан 4,6-диметилгептен-1
Классы органических соединений
| Углеводороды | Формула класса | Название класса | Представи- тели | Номенклатура | |||||
| Алканы Циклоалканы Алкен Диены Алкины Арены | , , , , , | [-ан] [цикло----ан] [-ен] [-диен] [-ин] Бензол Метилбензол (толуол) Ксилол | |||||||
| Функциональные классы органических веществ | |||||||||
| Формула функцион. группы | Название группы | Формула класса | Название класса | Представи- тели | Номенклатура | ||||
| Карбок- сильная |
R-COOH
| Карбоновые кислоты | HCOOH C COOH | [-овая кислота] | |||||
| Альдегид-ная | COH CHO O | Альдегиды | HCOH CCOH | [-аль] | |||||
| Оксо | R - C – R || о ( CO O | Кетоны | C-C-CH 3 || O | [-он] | |||||
| -OH | Гидрокси | OH O Ar-OH | Спирты Фенолы | C-OH OH OH | [-ол] фенол | ||||
| -NН 2 | Амино | N ( NH ( N | Амины Первичные Вторичные Третичные | C-N ( C) 2 NН ( C) 3 N | -амин | ||||
Контрольные вопросы
1. Предмет биоорганической химии, ее значение для биологии и медицины.
2. Строение и классификация органических соединений по типу углеродной цепи. связям и природе функциональных групп.
3. Номенклатура органических соединений. Заместительная номенклатура ИЮПАК.
а) номенклатурные термины: родоначальная структура, характеристическая группа, заместитель;
б) последовательность составления названия органического соедине-ния по общей схеме.
4. Тривиальная и радикально-функциональная номенклатуры органических соединений.
Типовые задания
1. НАЗВАТЬ СОЕДИНЕНИЯ ПО ПРАВИЛАМ СИСТЕМАТИЧЕСКОЙ (IUPAC) НОМЕНКЛАТУРЫ:


2-оксобутандиол-1,4 4-амино-2-тиопентановая кислота


2-изопропилциклогександиол-1,4 4-гидрокси-2,2-диметилгексадиен-2,5-аль -
2. УСТАНОВИТЕ СООТВЕТСТВИЕ МЕЖДУ НАЗВАНИЕМ СОЕДИНЕНИЯ И КЛАССОМ, К КОТОРОМУ ОНО ПРИНАДЛЕЖИТ
НАЗВАНИЕ СОЕДИНЕНИЯ КЛАСС СОЕДИНЕНИЙ
А) фруктоза 1) арены
Б) 2-метилбутен-1 2) алкены
В) толуол 3) алкадиены
Г) пропин 4) моносахариды
Ну и чтобы завершить знакомство со спиртами, приведу ещё формулу другого известного вещества - холестерина . Далеко не все знают, что он является одноатомным спиртом!
|`/`\\`|<`|w>`\`/|<`/w$color(red)HO$color()>\/`|0/`|/\<`|w>|_q_q_q<-dH>:a_q|0<|dH>`/<`|wH>`\|dH; #a_(A-72)<_(A-120,d+)>-/-/<->`\
Гидроксильную группу в нём я обозначил красным цветом.
Карбоновые кислоты
Любой винодел знает, что вино должно храниться без доступа воздуха. Иначе оно скиснет. Но химики знают причину - если к спирту присоединить ещё один атом кислорода, то получится кислота.Посмотрим на формулы кислот, которые получаются из уже знакомых нам спиртов:
| Вещество | Скелетная формула | Брутто-формула | ||
|---|---|---|---|---|
| Метановая кислота (муравьиная кислота) |
H/C`|O|\OH | HCOOH | O//\OH | |
| Этановая кислота (уксусная кислота) |
H-C-C\O-H; H|#C|H | CH3-COOH | /`|O|\OH | |
| Пропановая кислота (метилуксусная кислота) |
H-C-C-C\O-H; H|#2|H; H|#3|H | CH3-CH2-COOH | \/`|O|\OH | |
| Бутановая кислота (масляная кислота) |
H-C-C-C-C\O-H; H|#2|H; H|#3|H; H|#4|H | CH3-CH2-CH2-COOH | /\/`|O|\OH | |
| Обобщённая формула | {R}-C\O-H | {R}-COOH или {R}-CO2H | {R}/`|O|\OH |
Отличительной особенностью органических кислот является наличие карбоксильной группы (COOH), которая и придаёт таким веществам кислотные свойства.
Все, кто пробовал уксус, знают что он весьма кислый. Причиной этого является наличие в нём уксусной кислоты. Обычно столовый уксус содержит от 3 до 15% уксусной кислоты, а остальное (по большей части) - вода. Употребление в пищу уксусной кислоты в неразбавленном виде представляет опасность для жизни.
Карбоновые кислоты могут иметь несколько карбоксильных групп. В этом случае они называются: двухосновная , трёхосновная и т.д...
В пищевых продуктах содержится немало других органических кислот. Вот только некоторые из них:
Название этих кислот соответствует тем пищевым продуктам, в которых они содержатся.
Кстати, обратите внимание, что здесь встречаются кислоты, имеющие и гидроксильную группу, характерную для спиртов.
Такие вещества называются оксикарбоновыми кислотами
(или оксикислотами).
Внизу под каждой из кислот подписано, уточняющее название той группы органических веществ, к которой она относится.
Радикалы
Радикалы - это ещё одно понятие, которое оказало влияние на химические формулы.
Само слово наверняка всем известно, но в химии радикалы не имеют ничего общего с политиками, бунтовщиками и прочими гражданами с активной позицией.
Здесь это всего лишь фрагменты молекул. И сейчас мы разберёмся, в чём их особенность и познакомимся с новым способом записи химических формул.
Выше по тексту уже несколько раз упоминались обобщённые формулы: спирты - {R}-OH и карбоновые кислоты - {R}-COOH . Напомню, что -OH и -COOH - это функциональные группы. А вот R - это и есть радикал. Не зря он изображается в виде буквы R.
Если выражаться более определённо, то одновалентным радикалом называется часть молекулы, лишённая одного атома водорода. Ну а если отнять два атома водорода, то получится двухвалентный радикал.
Радикалы в химии получили собственные названия.
Некоторые из них получили даже латинские обозначения, похожие на обозначения элементов.
И кроме того, иногда в формулах радикалы могут быть указаны в сокращённом виде, больше напоминающем брутто-формулы.
Всё это демонстрируется в следующей таблице.
| Название | Структурная формула | Обозначение | Краткая формула | Пример спирта | ||
|---|---|---|---|---|---|---|
| Метил | CH3-{} | Me | CH3 | {Me}-OH | CH3OH | |
| Этил | CH3-CH2-{} | Et | C2H5 | {Et}-OH | C2H5OH | |
| Пропил | CH3-CH2-CH2-{} | Pr | C3H7 | {Pr}-OH | C3H7OH | |
| Изопропил | H3C\CH(*`/H3C*)-{} | i-Pr | C3H7 | {i-Pr}-OH | (CH3)2CHOH | |
| Фенил | `/`=`\//-\\-{} | Ph | C6H5 | {Ph}-OH | C6H5OH | |
Думаю, что здесь всё понятно. Хочу только обратить внимание на колонку, где приводятся примеры спиртов.
Некоторые радикалы записываются в виде, напоминающем брутто-формулу, но функциональная группа записывается отдельно.
Например, CH3-CH2-OH
превращается в C2H5OH
.
А для разветвлённых цепочек вроде изопропила применяются конструкции со скобочками.
Существует ещё такое явление, как свободные радикалы . Это радикалы, которые по каким-то причинам отделились от функциональных групп. При этом нарушается одно из тех правил, с которых мы начали изучение формул: число химических связей уже не соответствует валентности одного из атомов. Ну или можно сказать, что одна из связей становится незакрытой с одного конца. Обычно свободные радикалы живут короткое время, ведь молекулы стремятся вернуться в стабильное состояние.
Знакомство с азотом. Амины
Предлагаю познакомиться с ещё одним элементом, который входит в состав многих органических соединений. Это азот
.
Он обозначается латинской буквой N
и имеет валентность, равную трём.
Посмотрим, какие вещества получаются, если к знакомым нам углеводородам присоединить азот:
| Вещество | Развёрнутая структурная формула | Упрощенная структурная формула | Скелетная формула | Брутто-формула |
|---|---|---|---|---|
| Аминометан (метиламин) |
H-C-N\H;H|#C|H | CH3-NH2 | \NH2 | |
| Аминоэтан (этиламин) |
H-C-C-N\H;H|#C|H;H|#3|H | CH3-CH2-NH2 | /\NH2 | |
| Диметиламин | H-C-N<`|H>-C-H; H|#-3|H; H|#2|H | $L(1.3)H/N<_(A80,w+)CH3>\dCH3 | /N<_(y-.5)H>\ | |
| Аминобензол (Анилин) |
H\N|C\\C|C<\H>`//C<|H>`\C<`/H>`||C<`\H>/ | NH2|C\\CH|CH`//C<_(y.5)H>`\HC`||HC/ | NH2|\|`/`\`|/_o | |
| Триэтиламин | $slope(45)H-C-C/N\C-C-H;H|#2|H; H|#3|H; H|#5|H;H|#6|H; #N`|C<`-H><-H>`|C<`-H><-H>`|H | CH3-CH2-N<`|CH2-CH3>-CH2-CH3 | \/N<`|/>\| |
Как Вы уже наверное догадались из названий, все эти вещества объединяются под общим названием амины . Функциональная группа {}-NH2 называется аминогруппой . Вот несколько обобщающих формул аминов:
В общем, никаких особых новшеств здесь нет.
Если эти формулы Вам понятны, то можете смело заниматься дальнейшим изучением органической химии,
используя какой-нибудь учебник или интернет.
Но мне бы хотелось ещё рассказать о формулах в неорганической химии.
Вы убедитесь, как их легко будет понять после изучения строения органических молекул.
Рациональные формулы
Не следует делать вывод о том, что неорганическая химия проще, чем органическая. Конечно, неорганические молекулы обычно выглядят гораздо проще, потому что они не склонны к образованию таких сложных структур, как углеводороды. Но зато приходится изучать более сотни элементов, входящих в состав таблицы Менделеева. А элементы эти имеют склонность объединяться по химическим свойствам, но с многочисленными исключениями.
Так вот, ничего этого я рассказывать не буду. Тема моей статьи - химические формулы.
А с ними как раз всё относительно просто.
Наиболее часто в неорганической химии употребляются рациональные формулы
.
И мы сейчас разберёмся, чем же они отличаются от уже знакомых нам.
Для начала, познакомимся с ещё одним элементом - кальцием. Это тоже весьма распространённый элемент.
Обозначается он Ca
и имеет валентность, равную двум.
Посмотрим, какие соединения он образует с известными нам углеродом, кислородом и водородом.
| Вещество | Структурная формула | Рациональная формула | Брутто-формула |
|---|---|---|---|
| Оксид кальция | Ca=O | CaO | |
| Гидроксид кальция | H-O-Ca-O-H | Ca(OH)2 | |
| Карбонат кальция | $slope(45)Ca`/O\C|O`|/O`\#1 | CaCO3 | |
| Гидрокарбонат кальция | HO/`|O|\O/Ca\O/`|O|\OH | Ca(HCO3)2 | |
| Угольная кислота | H|O\C|O`|/O`|H | H2CO3 |
При первом взгляде можно заметить, что рациональная формула является чем то средним между структурной и брутто-формулой. Но пока что не очень понятно, как они получаются. Чтобы понять смысл этих формул, нужно рассмотреть химические реакции, в которых участвуют вещества.
Кальций в чистом виде - это мягкий белый металл. В природе он не встречается.
Но его вполне возможно купить в магазине химреактивов. Он обычно хранится в специальных баночках без доступа воздуха.
Потому что на воздухе он вступает в реакцию с кислородом. Собственно, поэтому он и не встречается в природе.
Итак, реакция кальция с кислородом:
2Ca + O2 -> 2CaO
Цифра 2 перед формулой вещества означает, что в реакции участвуют 2 молекулы.
Из кальция и кислорода получается оксид кальция.
Это вещество тоже не встречается в природе потому что он вступает в реакцию с водой:
CaO + H2O -> Ca(OH2)
Получается гидроксид кальция. Если присмотреться к его структурной формуле (в предыдущей таблице), то видно,
что она образована одним атомом кальция и двумя гидроксильными группами, с которыми мы уже знакомы.
Таковы законы химии: если гидроксильная группа присоединяется к органическому веществу, получается спирт,
а если к металлу - то гидроксид.
Но и гидроксид кальция не встречается в природе из-за наличия в воздухе углекислого газа. Думаю, что все слыхали про этот газ. Он образуется при дыхании людей и животных, сгорании угля и нефтепродуктов, при пожарах и извержениях вулканов. Поэтому он всегда присутствует в воздухе. Но ещё он довольно хорошо растворяется в воде, образуя угольную кислоту:
CO2 + H2O <=> H2CO3
Знак <=> говорит о том, что реакция может проходить в обе стороны при одинаковых условиях.
Таким образом, гидроксид кальция, растворённый в воде, вступает в реакцию с угольной кислотой и превращается в малорастворимый карбонат кальция:
Ca(OH)2 + H2CO3 -> CaCO3"|v" + 2H2O
Стрелка вниз означает, что в результате реакции вещество выпадает в осадок.
При дальнейшем контакте карбоната кальция с углекислым газом в присутствии воды происходит обратимая
реакция образования кислой соли - гидрокарбоната кальция, который хорошо растворим в воде
CaCO3 + CO2 + H2O <=> Ca(HCO3)2
Этот процесс влияет на жесткость воды. При повышении температуры гидрокарбонат обратно превращается в карбонат. Поэтому в регионах с жесткой водой в чайниках образуется накипь.
Из карбоната кальция в значительной степени состоят мел, известняк, мрамор, туф и многие другие минералы.
Так же он входит в состав кораллов, раковин моллюсков, костей животных и т.д...
Но если карбонат кальция раскалить на очень сильном огне, то он превратится в оксид кальция и углекислый газ.
Этот небольшой рассказ о круговороте кальция в природе должен пояснить, для чего нужны рациональные формулы. Так вот, рациональные формулы записываются так, чтобы были видны функциональные группы. В нашем случае это:
Кроме того, отдельные элементы - Ca, H, O(в оксидах) - тоже являются самостоятельными группами.Ионы
Думаю, что пора знакомиться с ионами. Это слово наверняка всем знакомо. А после изучения функциональных групп, нам ничего не стоит разобраться, что же представляют собой эти ионы.
В общем, природа химических связей обычно заключается в том, что одни элементы отдают электроны, а другие их получают. Электроны - это частицы с отрицательным зарядом. Элемент с полным набором электронов имеет нулевой заряд. Если он отдал электрон, то его заряд становится положительным, а если принял - то отрицатеньным. Например, водород имеет всего один электрон, который он достаточно легко отдаёт, превращаясь в положительный ион. Для этого существует специальная запись в химических формулах:
H2O <=> H^+ + OH^-
Здесь мы видим, что в результате электролитической диссоциации
вода распадается на положительно заряженный
ион водорода и отрицательно заряженную группу OH.
Ион OH^-
называется гидроксид-ион
.
Не следует его путать с гидроксильной группой, которая является не ионом, а частью какой-то молекулы.
Знак + или - в верхнем правом углу демонстрирует заряд иона.
А вот угольная кислота никогда не существует в виде самостоятельного вещества.
Фактически, она является смесью ионов водорода и карбонат-ионов (или гидрокарбонат-ионов):
H2CO3 = H^+ + HCO3^- <=> 2H^+ + CO3^2-
Карбонат-ион имеет заряд 2-. Это означает, что к нему присоединились два электрона.
Отрицательно заряженные ионы называются анионы
. Обычно к ним относятся кислотные остатки.
Положительно заряженные ионы - катионы
. Чаще всего это водород и металлы.
И вот здесь наверное можно полностью понять смысл рациональных формул. В них сначала записывается катион, а за ним - анион. Даже если формула не содержит никаких зарядов.
Вы наверное уже догадываетесь, что ионы можно описывать не только рациональными формулами. Вот скелетная формула гидрокарбонат-аниона:
Здесь заряд указан непосредственно возле атома кислорода, который получил лишний электрон, и поэтому лишился одной чёрточки.
Проще говоря, каждый лишний электрон уменьшает количество химических связей, изображаемых в структурной формуле.
С другой стороны, если у какого-то узла структурной формулы стоит знак +, то у него появляется дополнительная палочка.
Как всегда, подобный факт нужно продемонстрировать на примере.
Но среди знакомых нам веществ не встречается ни одного катиона, который состоял бы из нескольких атомов.
А таким веществом является аммиак . Его водный раствор часто называется нашатырный спирт
и входит в состав любой аптечки.
Аммиак является соединением водорода и азота и имеет рациональную формулу NH3
.
Рассмотрим химическую реакцию, которая происходит при растворении аммиака в воде:
NH3 + H2O <=> NH4^+ + OH^-
То же самое, но с использованием структурных формул:
H|N<`/H>\H + H-O-H <=> H|N^+<_(A75,w+)H><_(A15,d+)H>`/H + O`^-# -H
В правой части мы видим два иона.
Они образовались в результате того, что один атом водорода переместился из молекулы воды в молекулу аммиака.
Но этот атом переместился без своего электрона. Анион нам уже знаком - это гидроксид-ион.
А катион называется аммоний
. Он проявляет свойства, схожие с металлами.
Например, он может объединиться с кислотным остатком.
Вещество, образованное соединением аммония с карбонат-анионом называется карбонат аммония:
(NH4)2CO3
.
Вот уравнение реакции взаимодействия аммония с карбонат-анионом, записанное в виде структурных формул:
2H|N^+<`/H><_(A75,w+)H>_(A15,d+)H + O^-\C|O`|/O^- <=> H|N^+<`/H><_(A75,w+)H>_(A15,d+)H`|0O^-\C|O`|/O^-|0H_(A-15,d-)N^+<_(A105,w+)H><\H>`|H
Но в таком виде уравнение реакции дано в демонстрационных целях. Обычно уравнения используют рациональные формулы:
2NH4^+ + CO3^2- <=> (NH4)2CO3
Система Хилла
Итак, можно считать, что мы уже изучили структурные и рациональные формулы.
Но есть ещё один вопрос, который стоит рассмотреть подробнее.
Чем же всё-таки отличаются брутто-формулы от рациональных?
Мы знаем почему рациональная формула угольной кислоты записывается H2CO3
, а не как-то иначе.
(Сначала идут два катиона водорода, а за ними карбонат-анион).
Но почему брутто-формула записывается CH2O3
?
В принципе, рациональная формула угольной кислоты вполне может считаться истинной формулой,
ведь в ней нет повторяющихся элементов. В отличие от NH4OH
или
Ca(OH)2
.
Но к брутто-формулам очень часто применяется дополнительное правило, определяющее порядок следования элементов.
Правило довольно простое: сначала ставится углерод, затем водород, а дальше остальные элементы в алфавитном порядке.
Вот и выходит CH2O3
- углерод, водород, кислород.
Это называется системой Хилла. Она используется практически во всех химических справочниках. И в этой статье тоже.
Немного о системе easyChem
Вместо заключения мне хотелось бы рассказать о системе easyChem. Она разработана для того, чтобы все те формулы, которые мы тут обсуждали, можно было легко вставить в текст. Собственно, все формулы в этой статье нарисованы при помощи easyChem.
Зачем вообще нужна какая-то система для вывода формул? Всё дело в том, что стандартный способ отображения информации в интернет-браузерах - это язык гипертекстовой разметки (HTML). Он ориентирован на обработку текстовой информации.
Рациональные и брутто-формулы вполне можно изобразить при помощи текста.
Даже некоторые упрощённые структурные формулы тоже могут быть записаны текстом,
например спирт CH3-CH2-OH
.
Хотя для этого пришлось бы в HTML использовать такую запись:
CH3-CH2-OH .
Это конечно создаёт некоторые трудности, но с ними можно смириться. Но как изобразить структурную формулу?
В принципе, можно использовать моноширинный шрифт:
H H | | H-C-C-O-H | | H H Выглядит конечно не очень красиво, но тоже осуществимо.
Настоящая проблема возникает при попытке изобразить бензольные кольца и при использовании скелетных формул.
Здесь не остаётся иного пути, кроме подключения растрового изображения.
Растры хранятся в отдельных файлах. Браузеры могут подключать изображения в формате gif, png или jpeg.
Для создания таких файлов требуется графический редактор. Например, Фотошоп.
Но я более 10 лет знаком с Фотошопом и могу сказать точно, что он очень плохо подходит для изображения химических формул.
Гораздо лучше с этой задачей справляются
молекулярные редакторы .
Но при большом количестве формул, каждая из которых хранится в отдельном файле, довольно легко в них запутаться.
Например, число формул в этой статье равно .
Из них выведены виде графических изображений (остальные при помощи средств HTML).
Система easyChem позволяет хранить все формулы прямо в HTML-документе в текстовом виде. По-моему, это очень удобно.
Кроме того, брутто-формулы в этой статье вычисляются автоматически.
Потому что easyChem работает в два этапа: сначала текстовое описание преобразуется в информационную структуру (граф),
а затем с этой структурой можно выполнять различные действия.
Среди них можно отметить следующие функции: вычисление молекулярной массы, преобразование в брутто-формулу,
проверка на возможность вывода в виде текста, графическая и текстовая отрисовка.
Таким образом, для подготовки этой статьи я пользовался только текстовым редактором. Причём, мне не пришлось думать, какая из формул будет графической, а какая - текстовой.
Вот несколько примеров, раскрывающих секрет подготовки текста статьи:
Описания из левого столбца автоматически превращаются в формулы во втором столбце.
В первой строчке описание рациональной формулы очень похоже на отображаемый результат.
Разница только в том, что числовые коэффициенты выводятся подстрочником.
Во второй строке развёрнутая формула задана в виде трёх отдельных цепочек, разделённых символом;
Я думаю, нетрудно заметить, что текстовое описание во многом напоминает те действия,
которые потребовались бы для изображения формулы карандашом на бумаге.
В третьей строке демонстрируется использование наклонных линий при помощи символов \ и /.
Значок ` (обратный апостроф) означает, что линия проводится справа налево (или снизу вверх).
Здесь есть гораздо более подробная документация по использованию системы easyChem.
На этом разрешите закончить статью и пожелать удачи в изучении химии.
Краткий толковый словарь использованных в статье терминов
Углеводороды Вещества, состоящие из углерода и водорода. Отличаются друг от друга структурой молекул. Структурные формулы схематические изображения молекул, где атомы обозначаются латинскими буквами, а химические связи - чёрточками. Структурные формулы бывают развёрнутыми, упрощёнными и скелетными. Развёрнутые структурные формулы - такие структурные формулы, где каждый атом представлен в виде отдельного узла. Упрощённые структурные формулы - такие структурные формулы, где атомы водорода записаны рядом с тем элементом, с которым они связаны. А если к одному атому крепится больше одного водорода, то количество записывается в виде числа. Так же можно сказать, что в качестве узлов в упрощённых формулах выступают группы. Скелетные формулы - структурные формулы, где атомы углерода изображаются в виде пустых узлов. Число атомов водорода, связанных с каждым атомом углерода равно 4 минус число связей, которые сходятся в узле. Для узлов, образованных не углеродом, применяются правила упрощённых формул. Брутто-формула (она же истинная формула) - список всех химических элементов, которые входят в состав молекулы, с указанием количества атомов в виде числа (если атом один, то единица не пишется) Система Хилла - правило, определяющее порядок следования атомов в брутто-формуле: первым ставится углерод, затем водород, а далее остальные элементы в алфавитном порядке. Это а система используется очень часто. И все брутто-формулы в этой статье записаны по системе Хилла. Функциональные группы Устойчивые сочетания атомов, которые сохраняются в процессе химических реакций. Часто функциональные группы имеют собственные названия, влияют на химические свойства и научное название веществаМОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ
УНИВЕРСИТЕТ ИНЖЕНЕРНОЙ ЭКОЛОГИИ
Москва – 2006 г.
Министерство образования Российской Федерации
МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ИНЖЕНЕРНОЙ ЭКОЛОГИИ
Кафедра «Общая и физическая химия»
НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Методические указания
Под редакцией д.х.н., проф. В.С. Первова
Москва – 2006г.
Допущено редакционно-издательским советом
Составители: Г.Н.Беспалов,Г.С.Исаева,И.В.Ярошенко, Е.Д.Стрельцова
УДК. 5.4.7.1
Номенклатура органических соединений. Методические указания./Сост.:Г.Н.Беспалов, Г.С.Исаева, И.В.Ярошенко, Е.Д.Стрельцова
М.: МГУИЭ, 2006, 28 с., 2 табл.
Методические указания предназначены для студентов, обучающихся по специальностям 1705, 1705.06: 1705.07, 1712.03, изучающих органическую химию. В работе рассматриваются основы системы наименований веществ по рациональной номенклатуре и номенклатуре ИЮПАК. Для проверки усвоения материала предлагаются пятнадцать вариантов заданий.
Рецензенты: кафедра химической технологии плас-тических масс МХТИим. Д.И.Менделеева.
д.х.н., проф., А.Л.Русанов, ИНЭОС РАН.
© Г.Н. Беспалов, Г.С.Исаева,И.В.Ярошенко, Е.Д.Стрельцова
ВВЕДЕНИЕ
Номенклатура – это система наименований веществ. Основное требование, предъявляемое к научной номенклатуре, состоит в том, чтобы она однозначно определяла то или иное химическое соединение, исключая возможность смешения этого соединения с другим, была бы простой и позволяла бы по названию соединения построить его структурную формулу.
Существует несколько различных систем. Одной из первых является тривиальная номенклатура . До сих пор многие органические соединения имеют случайные исторически сложившиеся названия. Одни из них связаны с нахождением в природе, другие с методом получения, третьи – отражают физическое состояние и так далее. Бензол, спирт, метан, гремучая кислота, муравьиная кислота, ацетон, эфир – это тривиальные названия органических веществ. Эти названия не объединены по определённому признаку в стройную систему и не отражают строение молекул органических веществ. Однако, многие природные и синтетические вещества сложной структуры до сих пор имеют тривиальные названия в силу их краткости и выразительности.
Появление теоретических основ органической химии привело к созданию новых систем классификации и, следовательно, новых способов наименования органических соединений, отражающих химическое строение. Это означает, что по названию можно однозначно составить структурные формулу вещества и по структурной формуле дать название вещества. Так появилась рациональная номенклатура и Женевская номенклатура, дальнейшее развитие которой привело к созданию системы ИЮПАК , преложенной Международным союзом чистой прикладной химии, рекомендованной для названия всех органических веществ. Однако в практической деятельности приходится сталкиваться с различными системами названий органических веществ.
Для составления названий органических веществ как по рациональной номенклатуре, так и по системе ИЮПАК необходимо знать названия углеводородных радикалов. Углеводородные радикалы – это частицы, которые получаются при отрыве одного или нескольких атомов водорода от молекулы углеводорода. В молекулах углеводородов следует различать первичные, вторичные, третичные и четвертичные атомы углерода, что определяется числом его связей с соседними углеродными атомами. Первичный имеет одну связь с атомом углерода, вторичный – две связи с атомом или атомами углерода, третичный – три, четверичный – четыре.
При отрыве атома водорода от первичного атома углерода получается первичный радикал (то есть свободная единица валентности имеется у первичного атома углерода), от вторичного – вторичный радикал , от третичного – третичный радикал .
В таблице 1 приведены формулы предельных углеводородов и образованных от них радикалов, а также их названия. Как видно из таблицы, от метана и этана можно образовать лишь по одному радикалу. От пропана, углеводорода с тремя атомами углерода, можно образовать уже два изомерных радикала – пропил и изопропил в зависимости от какого атома углерода (первичного или вторичного) отрывается атом водорода. Начиная с бутана, у углеводородов появляются изомеры . В соответствии с этим увеличивается и число изомерных радикалов: н.бутил, втор. бутил, изобутил, трет. бутил.
Название последующих углеводородов складывается из греческого числительного, соответствующего числу атомов углерода в молекуле и суффикса «ан».
С увеличением числа атомов углерода в углеводороде возрастает количество изомеров, растёт и количество радикалов, которые можно от них образовать.
Специальных названий большинство изомеров не имеет. Однако по рациональной номенклатуре и номенклатуре ИЮПАК можно назвать любое сколь угодно сложное соединение, используя названия простых радикалов.
Таблица 1.
Предельные углеводороды и их радикалы.
|
Углеводород | |||
|
CH 3 -CH 2 -CH 3 |
CH 3 -CH 2 -СН 2 - |
изопропил (втор.пропил) |
|
|
CН 3 - _ СН 2 - СН 2 -СН 3 |
СН 3 -CН 2 -СН 2 -СН 2 - СН 3 -СН 2 -СН |
втор.бутил |
|
|
|
изобу-тан |
СН 3 – СН - СН 2 -
|
изобутил трет.бутил |
В таблице 2. приведены некоторые непредельные и ароматические углеводороды и соответствующие им радикалы Таблица 2. Непредельные и ароматические углеводороды и их радикалы.
|
Углеводороды |
Радикалы |
||
|
СН 2 =СН-СН 3 |
пропилен |
СН 2 =СН-СН 2 - СН=СН-СН 3 СН 2 =С-СН 3 |
пропенил изопропенил |
|
|
ацетилен |
|
ацетиленил или этинил |
|
|
| ||
|
|
|
п(пара)-толилы |
|
РАЦИОНАЛЬНАЯ НОМЕНКЛАТУРА
Рациональная
номенклатура базируется на теории
типов
.
В основе этой системы лежит названия
простейших членов гомологических рядов:
метана
,
если отсутствуют двойные связи, этилена
,
если присутствует одна двойная связь,
и ацетилена
,
если в соединении есть одна тройная
связь. Все
остальные углеводороды рассматриваются
как производные этих простейших
углеводородов, полученные путём замещения
одного или нескольких атомов водорода
на углеводородные
радикалы
.
Для того, чтобы назвать то или иное
соединение нужно перечислить
радикалы-заместители, а затем назвать
соответствующий углеводород. Перечисление
радикалов нужно начать с простейшего
метила, а затем по мере усложнения –
этил, пропил и т.д.. Разветвленные радикалы
считаются более сложными, чем нормальные
с тем же числом атомов углерода. Такое
 соединение можно назвать
метилэтилизопропилметан.
Если в соединении содержится несколько
одинаковых радикалов, то следует указать
сколько этих радикалов содержится в
соединении, используя умножающие
приставки – греческие числительные: 2
– ди, 3 – три, 4 – тетра, поэтому соединение
будет называться триметилэтилметан.
соединение можно назвать
метилэтилизопропилметан.
Если в соединении содержится несколько
одинаковых радикалов, то следует указать
сколько этих радикалов содержится в
соединении, используя умножающие
приставки – греческие числительные: 2
– ди, 3 – три, 4 – тетра, поэтому соединение
будет называться триметилэтилметан.

За центральный атом метана лучше выбирать тот углеродный атом, при котором находится наибольшее число заместителей. В зависимости от того, какой атом углерода выбирается за центральный атом метана, одному и тому же веществу по рациональной номенклатуре можно дать несколько различных названий.
Аналогичным образом называются и соединения с двойной и тройной связями:

Для того, чтобы различить два изомерных соединения можно использовать два способа. В первом соединении радикалы-заместители располагаются у двух разных углеродных атомов, связанных двойной связью, симметрично относительно двойной связи. Во втором соединении оба радикала располагаются у одного и того же углеродного атома, т.е. несимметрично относительно двойной связи.

Поэтому они так и называются: первое – симметрично метилэтилен , а второе - несимметрично метилэтил-этилен. Во втором способе один углеродный атом углерода, соединенный с более простым радикалом обозначается греческой буквой , другой - . При названии таких соединений указывают, при каком углеродном атоме какой находится радикал. Таким образом первое соединение будет называться -метил- -этилэтилен , а второе - -метил- -этилэтилен.
Название углеводородов, молекула которых имеет симметричное строение, т. е. состоит из двух одинаковых радикалов, составляется из названий этих радикалов и приставки ди-

Циклические углеводороды в рациональной номенклатуре рассматриваются как полиметилены и называются по количеству метиленовых групп, входящих в кольцо, причём используются греческие числительные:

Если
в цикле имеются заместители, то они
перечисляются перед названием основного
цикла. Такое

соединение будет называться метилгексаметилен.
Рациональная номенклатура до сих пор используется при наименовании сравнительно простых соединений, особенно, когда хотят подчеркнуть фукциональный тип соединения. Однако наименование сильно разветвлённых углеводородов вызывает затруднения, так как отсутствуют названия сложных радикалов.
НОМЕНКЛАТУРА ИЮПАК
Номенклатура ИЮПАК (IUPAC), предложенная Международным союзом чистой и прикладной химии, даёт возможность назвать любое сколь угодно сложное соединение. Эта номенклатура является развитием и упорядочением Женевской номенклатуры, с которой она имеет много общего.
В этой номенклатуре первые четыре предельных углеводорода нормального строения имеют тривиальные названия: метан, этан, пропан и бутан. Названия последующих нормальных (неразветвлённых) углеводородов образуются от основы греческих числительных с добавлением окончания -ан: С 5 Н 12 - пентан, С 6 Н 14 - гексан, С 7 Н 16 -гептан и т. д. (см. табл.1)
Для названия разветвлённых углеводородов необходимо выбрать самую длинную нормальную цепь . Если в углеводороде можно выделить несколько цепей одинаковой длины, то следует выбрать самую разветвлённую цепь . Название этого углеводорода, соответствующего самой длиной цепи, принимается за основу названия данного углеводорода. Следовательно, углеводород, имеющий строение

будет рассматриваться как производное гептана. Эту самую длинную цепь нумеруют , причём направление нумерации выбирают так, чтобы цифры, указывающие положение боковых цепей, были бы наименьшими. Для каждого бокового заместителя арабской цифрой указывают место расположения его в цепи и дают название. Если в соединении находится несколько одинаковых заместителей, то наряду с указанием места расположения каждого заместителя с помощью умножающих приставок (греческих числительных) ди-, три-, татра- и так далее, указывается их количество. Боковые заместители перечисляют в порядке возрастания их сложности: метил СН 3 – менее сложен, чем этил С 2 Н 5 -, т.е. радикал с меньшим числом атомов углерода менее сложен, чем с большим числом атомов. При одинаковом числе атомов углерода менее сложен тот радикал, у которого основная цепь
длиннее:
втор. бутил
 менее
сложен, чем трет. бутил
менее
сложен, чем трет. бутил

Таким образом, приведённое ранее соединение будет называться 2,2,5-триметил-3-этилгептан.
При наличии в углеводороде кратных связей за главную цепь принимается самая длинная, которая содержат двойную или тройную связь. Если в углеводороде имеется одна двойная связь, то окончание –ан в названии предельного углеводорода, соответствующего в этой цепи, заменяется на окончание – ен и арабской цифрой указывается номер атома углерода, у которого начинается двойная цепь. Так соединение
будет называться гептин-3.
Если в соединении содержатся две двойные или тройные связи, то окончания названий углеводородов должны быть – диен или - диин соответственно с указанием номеров атомов, у которых начинаются кратные связи:
При наличии двойной и тройной связей окончание в названии углеводорода будет –ен-ин с указанием номеров атомов, у которых начинаются соответствующие кратные связи:

В случае разветвлённых непредельных углеводородов главную цепь выбирают таким образом, чтобы положения двойных и ройных связей были обозначены наименьшими номерами.
Названия циклических углеводородов образуют, добавляя к названию предельного углеводорода с тем же числом атомов углерода приставку цикло-

При наличии боковых заместителей указывается их местоположение, количество и название, после чего называется циклический углеводород.

Если в цикле содержатся кратные связи, то это отражается на изменении окончания на -ен при наличии двойной связи или на окончание на –ин при наличии одной тройной связи.

Для простейшего моноциклического ароматического соединения сохраняется тривиальное название – бензол. Кроме того, сохраняются тривиальные названия некоторых замещённых ароматических углеводородов

Моноциклические ароматические углеводороды рассматриваются как производные бензола, полученные путём замещения атомов водорода на углеводородные радикалы. Для того, чтобы назвать то или иное ароматическое соединение следует пронумеровать атомы углерода бензольного кольца, указать положения заместителей в кольце, указать сколько их, назвать эти радикалы, после чего назвать ароматический углеводород. Положения заместителей следует обозначать наименьшими номерами. Таким образом, соединение

будет называться 1,4-диметил-2-этилбензол.
Если в бензольном кольце имеется только два заместителя, то вместо цифр 1,2- , 1,3- и 1,4- можно соответственно использовать обозначения орто (о-), мета (м-) и пара (п-)

Названия
некоторых конденсированных и
полициклических ароматических
углеводородов и порядок нумерации
атомов углерода приводятся далее.


БИБЛИОГРАФИЧЕСКИЙ СПИСОК.
Павлов Б.А., Терентьев А.П.. Курс органической химии. М.-Л.
Домашнее задание 1
Вариант 1,16
а) (CH 3) 2 (CH) 2 (C 2 H 5) 2 ,
б) (CH 3) 2 CCH(CH 3)
а) метилизопропилтрет.бутилметан,
б) метилэтилацетилен.
а) 2,2,3-триметилбутан,
б) 3,4-диметилгексен-3.
Вариант 2,17
1. Напишите в развернутом виде структурные формулы следующих углеводородов и назовите их по рациональной номенклатуре и номенклатуре ИЮПАК. Укажите сколько первичных, вторичных, третичных и четвертичных углеродных атомов в каждом соединении:
а) (CH 3) 3 CCH(CH 3)CH(CH 3)(C 2 H 5)
б) (СН 3)(С 2 Н 5)С 2 (С 2 Н 5) 2 .
2. Напишите структурные формулы следующих соединений
и назовите их по номенклатуре ИЮПАК:
б)
 -метил-
-метил- -этил-
-этил- -втор.бутилэтилен.
-втор.бутилэтилен.
3.Напишите структурные формулы следующих соединений и назовите их по рациональной номенклатуре:
а) 2,2,3,4-тетраметил-3-этилпентан,
б) 2,5-диметилгексин-3.
: Вариант 3,18
1. Напишите а развернутом виде структурные формулы следующих углеводородов и назовите их по рациональной номенклатуре и номенклатуре ИЮПАК. Укажите сколько первичных, вторичных, третичных и четвертичных углеродных атомов в каждом соединении:
а) (CH 3) 3 ССН(С 2 Н 5)СН(СН 3)(С 2 Н 5),
б) (CH 3) 2 CHС 2 СН(CH 3) 2 .
2. Напишите структурные формулы следующих соединений и назовите их по номенклатуре ИЮПАК
а) этилдивтор.бутилметан,
б) изопропилтрет.бутилацетилен.
3. Напишите структурные формулы следующих соединений и назовите их по рациональной номенклатуре:
а) 2,2-диметил-3-этилпентан,
б) 2,2,5,5-тетраметилгексен-3
Вариант 4,19
1. Напишите а развернутом виде структурные формулы следующих углеводородов и назовите их по рациональной номенклатуре и номенклатуре ИЮПАК. Укажите сколько первичных, вторичных, третичных и четвертичных углеродных атомов в каждом соединении:
а) (CH 3) 2 (СН) 4 (СН 3)(С 2 Н 5),
б) (CH 3) 3 С 2 (СН 3)(С 2 Н 5)СН(СН 3) 2 .
а)метилизопропилтрет.бутилметан,
б)сим.втор.бутилтрет.бутилэтилен.
3. Напишите структурные формулы следующих соединений и назовите их по рациональной номенклатуре:
а)2,2,4,4-тетраметил-3-этилпентан,
б) 2,2,5-триметилгексин-3.
Вариант 5,20
1. Напишите в развернутом виде структурные формулы следующих углеводородов и назовите их по рациональной номенклатуре и номенклатуре ИЮПАК. Укажите сколько первичных, вторичных, третичных и четвертичных углеродных атомов в каждом соединении:
а) СН 3 (СН 2) 2 СН(С 2 Н 5)СН(СН 3)(С 2 Н 5),
б) (CH 3) 3 С 4 (СН 3) 3 .
2. Напишите структурные формулы следующих соединений и назовите их по номенклатуре ИЮПАК
а) этилизопропилизобутилметан,
б) -этил-
-этил- -изопропил-
-изопропил- -втор.бутилэтилен.
-втор.бутилэтилен.
3. Напишите структурные формулы следующих соединений и назовите их по рациональной номенклатуре:
а) 2-метил-3,3-диэтилпентан,
б) бутадиен-1,3
Вариант 6, 21
1. Напишите в развернутом виде структурные формулы следующих углеводородов и назовите их по рациональной номенклатуре и номенклатуре ИЮПАК. Укажите сколько первичных, вторичных, третичных и четвертичных углеродных атомов в каждом соединении:
а) (CH 3) 3 С(СН 2) 2 СН(СН 3) 2 ,
б) СН 2 С(СН 3)СНСН 2 .
2. Напишите структурные формулы следующих соединений и назовите их по номенклатуре ИЮПАК
а) метилэтилизопропилтрет.бутилметан,
б)
 ,
, -диметил-
-диметил- -вторбутилэтилен.
-вторбутилэтилен.
Органическая химия – это химия соединений углерода, или, иначе, химия углеводородов и их производных. Какова же классификация и номенклатура органических соединений?
Что такое органические соединения?
По составу органические соединения делятся на классы – углеводороды и функциональные производные углеводородов.
Углеводороды – это органические соединения, в состав которых входят только атомы углерода и водорода (и в основе которых лежит цепь, построенная из углеродных атомов).

Рис. 1. Таблица углеводородов.
Функциональные производные углеводородов имеют одну или несколько функциональных (действующих) групп, которые содержат атомы других элементов (кроме углерода и водорода) и определяют свойства данного класса соединений. В состав функциональных групп входят атомы таких элементов, как кислород, азот, сера. Основные классы органических соединений характеризуются видом функциональных групп.
По форме углеродной цепи органические соединения делятся на соединения нормального и изостроения, а также на соединения с открытой углеродной цепью (ациклические) и с замкнутой углеродной цепью (циклические).
Соединения нормального строения имеют углеродную цепь без разветвлений, а соединения изостроения имеют разветвления в углеродной цепи

Рис. 2. Виды углеродных цепей.
По типу химической связи между атомами углерода органические соединения делятся на насыщенные (предельные) и ненасыщенные (непредельные). Насыщенные содержат только простые углерод-углеродные связи, а ненасыщенные – хотя бы одну кратную связь.
Соединения с открытой цепью – насыщенные и ненасыщенные – называют соединениями жирного ряда., или алифатическими.
Циклические соединения (насыщенные и ненасыщенные) называют алициклическими.
Существуют соединения с особым видом связи, которые называют ароматическими
Номенклатура органических соединений
В настоящее время органические соединения называют согласно правилам Международной систематической номенклатуры. Для распространенных в быту и промышленности соединений, особенно природных, используется тривиальная номенклатура, включающая исторически сложившиеся названия. Для некоторых, особенно монофункциональных, соединений применяется разновидность МСН – радикально-функциональная номенклатура.
Основные принципы составления названия соединения по МСН:
- молекула рассматривается как производное предельного углеводорода;
- в молекуле выбирают самую длинную углеродную цепь, содержащую функциональную группу или кратную связь, если они есть. цепь называют, как соответствующий предельный углеводород;
- главную цепь нумеруют с того его конца, к которому ближе стоит старшая группа в молекуле;
- если в главной цепи есть кратная связь, то в названии предельного углеводорода окончание -ан меняется на соответствующее;
- если в главной цепи есть функциональная группа, то к названию главной цепи прибавляют соответствующее окончание;
- перед названием главной цепи перечисляют названия радикалов, не входящих в главную цепь, но связанных с ней, с добавлением одного локанта на каждый радикал.












 Корпускулярные и волновые свойства частиц
Корпускулярные и волновые свойства частиц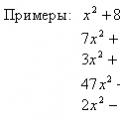 Уравнения онлайн X 5 0 решение
Уравнения онлайн X 5 0 решение Предельные монокарбоновые кислоты
Предельные монокарбоновые кислоты