كيف يتم تحسين خصائص الأكسدة في الجدول الدوري. كيف تتغير خصائص العناصر الكيميائية في المجموعات الفرعية للنظام الدوري لمندليف
(ض) دوري. خلال نفس الفترة مع زيادة ضهناك اتجاه لتقليص حجم الذرات. على سبيل المثال ، في الفترة الثانية ، يكون لنصف القطر الذري القيم التالية:
|
ص ، نانومتر |
0,155 |
0,113 |
0,091 |
0,077 |
0,071 |
0,066 |
0,064 |
يفسر ذلك من خلال زيادة جذب إلكترونات الطبقة الخارجية للنواة مع زيادة شحنة النواة. في المجموعات الفرعية ، من أعلى إلى أسفل ، يزداد نصف القطر الذري ، لأن يزيد عدد طبقات الإلكترون:
|
ص ، نانومتر |
ص ، نانومتر |
||
|
0,155 |
0,071 |
||
|
0,189 |
0,130 |
||
|
0,236 |
0,148 |
||
|
0,248 |
0,161 |
||
|
0,268 |
0,182 |
يؤدي فقدان الذرة للإلكترونات إلى تقليل حجمها الفعال ، وتؤدي إضافة الإلكترونات الزائدة إلى زيادة. لذلك ، فإن نصف قطر الأيون الموجب (الكاتيون) يكون دائمًا أقل ، ويكون نصف قطر الأيون السالب (الأنيون) دائمًا أكبر من نصف قطر الأيونات المقابلة. محايد كهربائياذرة. على سبيل المثال:
|
ص ، نانومتر |
ص ، نانومتر |
||
|
0,236 |
Cl 0 |
0,099 |
|
|
0,133 |
Cl - |
0,181 |
كلما كان نصف قطر الأيون مختلفًا عن نصف قطر الذرة ، زادت شحنة الأيون:
|
كر 0 |
Cr2 + |
Cr3 + |
|
|
ص ، نانومتر |
0,127 |
0,083 |
0,064 |
داخل مجموعة فرعية واحدة ، يزداد نصف قطر أيونات الشحنة نفسها مع زيادة الشحنة النووية:
|
ص ، نانومتر |
ص ، نانومتر |
||
|
لي + |
0,068 |
0,133 |
|
|
نا + |
0,098 |
Cl - |
0,181 |
|
0,133 |
Br - |
0,196 |
|
|
Rb + |
0,149 |
0,220 |
يفسر هذا الانتظام بالزيادة في عدد طبقات الإلكترون والمسافة المتزايدة للإلكترونات الخارجية من النواة.
ب) طاقة التأين وتقارب الإلكترون. في التفاعلات الكيميائية ، لا تخضع نوى الذرات للتغييرات ، بينما يتم إعادة بناء غلاف الإلكترون ، ويمكن للذرات أن تتحول إلى أيونات موجبة وسالبة الشحنة. يمكن قياس هذه القدرة بواسطة طاقة التأين للذرة وتقاربها الإلكتروني.
طاقة التأين (إمكانات التأين) أناهي كمية الطاقة المطلوبة لفصل إلكترون عن ذرة غير مستثارة لتكوين كاتيون:
X- ه→ X +
طاقة يتم قياس التأين بالكيلوجول / مول أو في الكترونفولت 1 فولت = 1.602. 10-19 جول أو 96.485 كيلوجول / مول.(فولت). انفصال الإلكترون الثاني أصعب من الأول لأنه لا ينفصل الإلكترون الثاني عن ذرة محايدة ، بل عن أيون موجب:
X + - ه→ X 2+
لذلك ، احتمال التأين الثاني أنا 2 أكثر من الأول ( أنا 2 >أنا 1). من الواضح أن إزالة كل إلكترون تالٍ سيتطلب طاقة أكثر من إزالة الإلكترون السابق. لوصف خصائص العناصر ، عادة ما تؤخذ في الاعتبار طاقة انفصال الإلكترون الأول.
في المجموعات ، تتناقص إمكانات التأين مع زيادة العدد الذري للعنصر:
|
أنا، فولت |
6,39 |
5,14 |
4,34 |
4,18 |
3,89 |
ويرجع ذلك إلى المسافة الأكبر لإلكترونات التكافؤ من النواة ، وبالتالي ، سهولة فصلها مع زيادة عدد طبقات الإلكترون. يمكن أن تعمل قيمة جهد التأين كمقياس لمعدنية عنصر ما: فكلما قلت إمكانات التأين ، كلما كان من الأسهل إزالة الإلكترون من الذرة ، كلما زادت وضوح الخواص المعدنية.
في فترات من اليسار إلى اليمين ، تزداد شحنة النواة ، ويقل نصف قطر الذرة. لذلك ، تزداد إمكانات التأين تدريجياً ، وتضعف الخصائص المعدنية:
|
أنا، فولت |
5,39 |
9,32 |
8,30 |
11,26 |
14,53 |
13,61 |
17,42 |
21,56 |
كسر الاتجاه التصاعدي أنالوحظ بالنسبة للذرات ذات المستوى الفرعي للطاقة الخارجية المملوء تمامًا ، أو للذرات التي يكون فيها المستوى الفرعي للطاقة الخارجية نصف ممتلئ تمامًا:
يشير هذا إلى زيادة استقرار الطاقة للتكوينات الإلكترونية ذات المستويات الفرعية الكاملة أو نصف المشغولة تمامًا.
تعتمد درجة جذب الإلكترون إلى النواة ، وبالتالي ، إمكانية التأين على عدد من العوامل ، وقبل كل شيء على شحن نووي شحنة النواة تساوي الرقم الترتيبي للعنصر في الجدول الدوري.، على المسافة بين الإلكترون والنواة ، على تأثير غربلة الإلكترونات الأخرى. لذلك ، بالنسبة لجميع الذرات ، باستثناء عناصر الفترة الأولى ، يتم فحص تأثير النواة على إلكترونات الطبقة الخارجية بواسطة إلكترونات الطبقات الداخلية.
مجال نواة الذرة ، الذي يحمل الإلكترونات ، يجذب أيضًا إلكترونًا حرًا إذا كان بالقرب من الذرة. صحيح أن هذا الإلكترون يواجه تنافرًا من إلكترونات الذرة. بالنسبة للعديد من الذرات ، تتجاوز طاقة جذب إلكترون إضافي إلى النواة طاقة تنافره من قذائف الإلكترون. يمكن لهذه الذرات أن تضيف إلكترونًا ، وتشكل أنيونًا ثابتًا منفرداً. طاقة فصل إلكترون من أيون سالب مشحون في العملية X - e → X 0 يسمى تقارب ذرة للإلكترون ( أ) ، يقاس بالكيلوجول / مول أو فولت. عندما يتم توصيل إلكترونين أو أكثر بالذرة ، يسود التنافر على الجذب - دائمًا ما يكون تقارب الذرة لإلكترونين أو أكثر سالبًا. لذلك ، فإن الأيونات السالبة المضاعفة أحادية الذرة (O2 ، S2 ، N 3 ، إلخ) لا يمكن أن توجد في الحالة الحرة.
لا يُعرف تقارب الإلكترون لجميع الذرات. ذرات الهالوجين لها أعلى تقارب للإلكترون.
ب) الكهربية. تميز هذه القيمة قدرة ذرة في جزيء على جذب إلكترونات ملزمة إلى نفسها. كهرسلبيةلا ينبغي الخلط بينه وبين تقارب الإلكترون: المفهوم الأول يشير إلى ذرة في جزيء ، والثاني إلى ذرة معزولة. مطلق كهرسلبية(كيلوجول / مول أو فولت 1 إلكترون فولت = 1.602. 10-19 جول أو 96.485 كيلوجول / مول.) يساوي مجموع طاقة التأين وتقارب الإلكترون: AEO = أنا+أ. في الممارسة العملية ، غالبًا ما يتم استخدام القيمة النسبية كهرسلبية، تساوي نسبة AEO لهذا العنصر إلى AEO لليثيوم (535 كيلو جول / مول):
![]()
أ. كليبنيكوف ، آي إن. Arzhanova، O.A. نابيلكوفا
يتم حساب نصف القطر الذري للعناصر والأيونات على أساس المسافات الداخلية ، والتي لا تعتمد فقط على طبيعة الذرات ، ولكن أيضًا على طبيعة الرابطة الكيميائية بينها وعلى حالة تجميع المادة.
أنصاف أقطار الذرات والأيونات المشحونة بالتساويفي فترة مع زيادة الشحنات ، تنخفض النوى بشكل أساسي (مع استثناءات قليلة) بسبب زيادة قوى جذب كولوم بسبب زيادة العدد ، وبالتالي ، إجمالي شحنة الإلكترونات في قذائف الإلكترون والنواة.
في المجموعات الفرعية ، مع زيادة الشحنة النووية (الانتقال من أعلى إلى أسفل) ، يزداد نصف القطر الذري والأيوني ، كقاعدة عامة ، وهو ما يرتبط بزيادة عدد المستويات الإلكترونية.
طاقة التأين (I) (إمكانات التأين)في الفترة التي تزداد مع زيادة الشحنة النووية ، في المجموعات الفرعية الرئيسية والثالثة تتناقص من أعلى إلى أسفل بسبب ظهور مستوى طاقة جديد. في المجموعات الفرعية المتبقية ، تزداد طاقة التأين مع زيادة الشحنة النووية.
تقارب الإلكترون (E) (يتم إطلاق الطاقة عند توصيل إلكترون إضافي بذرة أو أيون أو جزيء). الحد الأقصى عند ذرات الهالوجين. لا يعتمد تقارب الإلكترون على شحنة النواة الذرية فحسب ، بل يعتمد أيضًا على درجة ملء المستويات الإلكترونية الخارجية.
الكهربية (EO)- خاصية معممة لعنصر ، تعرف بأنها مجموع طاقة التأين وتقارب الإلكترون.
نسبي EC وفقًا لبولينجيتم تعريفه على أنه نسبة EO لعنصر ما إلى EO لذرة الليثيوم. تزداد القدرة الكهربية النسبية في هذه الفترة ، وفي المجموعات الفرعية تتناقص مع زيادة الشحنة النووية.
القوة المؤكسدة للعنصريتغير بنفس طريقة الكهربية ، والقدرة المختزلة بالترتيب العكسي.
كثافة المواد البسيطةفي فترة ما عادة ما يمر من خلال الحد الأقصى للكذب في منتصف الفترة تقريبًا ، ويزداد في المجموعات الفرعية مع زيادة الشحنة النووية.
الخصائص الأساسية للأكاسيد العالية وهيدروكسيدات العناصرفي الفترة التي تضعف فيها بشكل طبيعي ، وهو ما يرتبط بزيادة قوة جذب أيونات الهيدروكسيد إلى الذرة المركزية مع زيادة شحنة نواتها وانخفاض نصف القطر الذري ، وفي مجموعة فرعية ، كقاعدة عامة تزداد لأن نصف القطر الذري للعناصر يزداد.
خصائص الحمضهذه المركبات تتغير في الاتجاه المعاكس.
الخصائص غير المعدنيةفي الفترة ، كقاعدة عامة ، يزدادون من اليسار إلى اليمين ، وفي المجموعة الفرعية يضعفون من أعلى إلى أسفل ، معدن -والعكس صحيح. يمتد الحد بين المعادن وغير المعدنية في الجدول على طول القطر B-At بطريقة تجعل جميع غير المعادن في الجزء الأيمن العلوي من الجدول (الاستثناء هو عناصر d).
يمكن نمذجة آلية تكوين الرابطة الكيميائية بطرق مختلفة.
تؤدي الزيادة في حالة أكسدة عنصر ما وانخفاض نصف قطر أيونه (في هذه الحالة ، انخفاض الشحنة السالبة الفعالة على هذا الأكسجين) إلى زيادة حمضية الأكسيد. هذا يفسر التغيير المنتظم في خصائص الأكاسيد من القاعدية إلى المذبذبة ثم إلى الحمضية.
1) في فترة واحدة ، مع زيادة الرقم التسلسلي ، تزداد الخواص الحمضية للأكاسيد وتزداد قوة الأحماض المقابلة لها.

2) في المجموعات الفرعية الرئيسية للنظام الدوري ، عند الانتقال من عنصر إلى آخر من أعلى إلى أسفل ، لوحظ زيادة في الخصائص الجديدة للأكاسيد:
 3) مع زيادة درجة أكسدة العنصر ، تزداد الخواص الحمضية للأكسيد وتضعف الصفات الأساسية.
3) مع زيادة درجة أكسدة العنصر ، تزداد الخواص الحمضية للأكسيد وتضعف الصفات الأساسية.
الخواص الكيميائية للأكاسيد
أكاسيد أساسية
الأكاسيد الرئيسية هي:
أكاسيد جميع المعادن من المجموعة الفرعية الرئيسية للمجموعة الأولى (الفلزات القلوية Li - Fr)
المجموعة الفرعية الرئيسية للمجموعة الثانية تبدأ بالمغنيسيوم (Mg - Ra)
أكاسيد الفلزات الانتقالية في حالات الأكسدة المنخفضة ، على سبيل المثال MnO ، FeO.
معظم الأكاسيد الأساسية عبارة عن مواد بلورية صلبة ذات طبيعة أيونية ، وفي العقد الشبكية البلورية توجد أيونات معدنية مرتبطة بشدة بأيونات الأكسيد O2- ، وبالتالي ، فإن أكاسيد المعادن النموذجية لها نقاط انصهار وغليان عالية.
نلاحظ سمة مميزة واحدة من الأكاسيد. يؤدي قرب نصف القطر الأيوني للعديد من أيونات المعادن إلى حقيقة أنه في الشبكة البلورية للأكاسيد ، يمكن استبدال أيونات معدن آخر بجزء من أيونات معدن آخر. يؤدي هذا إلى حقيقة أن قانون ثبات التركيب غالبًا لا ينطبق على الأكاسيد ، وقد توجد أكاسيد مختلطة ذات تكوين متغير.
لا تتحلل معظم الأكاسيد الأساسية عند تسخينها ، باستثناء أكاسيد الزئبق والمعادن النبيلة:
2HgO \ u003d 2Hg + O 2
2Ag2O = 4Ag + O2
عند تسخينها ، يمكن أن تتفاعل الأكاسيد القاعدية مع الأكاسيد الحمضية والمذبذبة ، مع الأحماض:
BaO + SiO 2 \ u003d BaSiO 3 ،
MgO + Al 2 O 3 \ u003d Mg (AlO 2) 2 ،
ZnO + H 2 SO 4 \ u003d ZnSO 4 + H 2 O.
تتفاعل أكاسيد الفلزات القلوية والقلوية مع الماء مباشرة:
مثل الأنواع الأخرى من الأكاسيد ، يمكن أن تدخل الأكاسيد الأساسية في تفاعلات الأكسدة والاختزال:
Fe 2 O 3 + 2Al \ u003d Al 2 O 3 + 2Fe
3CuO + 2NH 3 \ u003d 3Cu + N 2 + 3H 2 O
4FeO + O 2 \ u003d 2Fe 2 + O 3
تشكل الأكاسيد الرئيسية لأكثر المعادن نشاطًا (الأرض القلوية والقلوية ، بدءًا من أكسيد الكالسيوم) عند التفاعل مع الماء (تفاعل الماء) هيدروكسيداتها (القواعد) المقابلة لها. على سبيل المثال ، عندما يذوب أكسيد الكالسيوم (الجير الحي) في الماء ، يتشكل هيدروكسيد الكالسيوم - قاعدة قوية:
CaO + H 2 O → Ca (OH) 2
تتفاعل الأكاسيد الأساسية مع الأحماض لتكوين الأملاح المقابلة:
CaO + 2HCl → CaCl 2 + H 2 O
يؤدي تفاعل الأكاسيد القاعدية مع الأكاسيد الحمضية أيضًا إلى تكوين الأملاح:
Na 2 O + CO 2 → Na 2 CO 3
ومع أكاسيد مذبذبة:
Li 2 O + Al 2 O 3 → 2LiAlO 2
أكاسيد حامضية
معظم الأكاسيد غير المعدنية هي أكاسيد حمضية (CO2 ، SO3 ، P4O10). تظهر أيضًا أكاسيد الفلزات الانتقالية في حالات الأكسدة العالية في الغالب خصائص الأكاسيد الحمضية ، على سبيل المثال: CrO3 ، Mn2O7 ، V2O5.
أكاسيد الحمض هي أكاسيده غير المعدنية أو أكاسيد المعادن الانتقالية في حالات الأكسدة العالية ويمكن الحصول عليها بطرق مشابهة لتلك الخاصة بالأكسيدات الأساسية ، على سبيل المثال:
4P + 5O 2 \ u003d 2P 2 + O 5
2ZnS + 3O 2 \ u003d 2ZnO + 2SO 2
K 2 Cr 2 O 7 + H 2 SO 4 \ u003d 2CrO 3 ↓ + K 2 SO 4 + H 2 O
Na 2 SiO 3 + 2HCl = 2NaCl + SiO 2 ↓ + H 2 O
تتفاعل معظم الأكاسيد الحمضية مباشرة مع الماء لتكوين الأحماض:

الأكثر شيوعًا بالنسبة لأكاسيد الحمض هي تفاعلاتها مع الأكاسيد القاعدية والمذبذبة مع القلويات:
P 2 O 5 + Al 2 O 3 \ u003d 2AlPO 4
Ca (OH) 2 + CO 2 \ u003d CaCO 3 ↓ + H 2 O.
ذكر أعلاه أن الأكاسيد الحمضية يمكن أن تدخل في العديد من تفاعلات الأكسدة والاختزال ، على سبيل المثال:
2SO 2 + O 2 2SO 3
SO 2 + 2H 2 S \ u003d 3S + 2H 2 O ،
4CrO 3 + C 2 H 5 OH \ u003d 2Cr 2 O 3 + 2CO 2 + ZN 2 O
تقريبا جميع أكاسيد الحمض ، عند التفاعل مع الماء (الماء) ، تشكل هيدروكسيدات الحمض المقابلة (الأحماض المحتوية على الأكسجين). على سبيل المثال ، عندما يذوب أكسيد الكبريت (VI) في الماء ، يتشكل حمض الكبريتيك:
SO 3 + H 2 O → H 2 SO 4
يمكن الحصول على أكاسيد الحمض من الحمض المقابل:
H 2 SiO 3 → SiO 2 + H 2 O
أكاسيد الأمفوتريك
Amphotericity (من اليونانية Amphoteros - كلاهما) - قدرة المركبات الكيميائية (أكاسيد ، هيدروكسيدات ، أحماض أمينية) على إظهار كل من الخواص الحمضية والخصائص الأساسية ، اعتمادًا على خصائص الكاشف الثاني المتضمن في التفاعل.
تتفاعل أكاسيد الأمفوتريك مع الأحماض القوية لتكوين أملاح هذه الأحماض. هذه التفاعلات هي مظهر من مظاهر الخصائص الرئيسية لأكاسيد مذبذبة ، على سبيل المثال:
ZnO + H 2 SO 4 → ZnSO 4 + H 2 O
تتفاعل أيضًا مع القلويات القوية ، وبالتالي تظهر خصائصها الحمضية ، على سبيل المثال:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O
يمكن أن تتفاعل أكاسيد الأمفوتريك مع القلويات بطريقتين: في المحلول وفي الذوبان.
عندما يتفاعل مع قلوي في الذوبان ، يتشكل ملح متوسط عادي (كما هو موضح في المثال أعلاه).
عند التفاعل مع القلويات في المحلول يتكون ملح معقد.
Al 2 O 3 + 2NaOH + 3H 2 O → 2Na (في هذه الحالة ، يتم تشكيل رباعي هيدروكسي ألومينات الصوديوم)
كل معدن مذبذب له رقم التنسيق الخاص به.
ليكون وزنك هذا هو 4. لـ و Al هي 4 أو 6 ؛ لـ و Cr هو 6 أو (نادرًا جدًا) 4 ؛
عادة لا تذوب الأكاسيد الأمفوتيرية في الماء ولا تتفاعل معها.
أكاسيد الأمفوتريك لها طبيعة مزدوجة: فهي قادرة في نفس الوقت على التفاعلات التي تشمل كلا من الأكاسيد القاعدية والحمضية ، أي تتفاعل مع كل من الأحماض والقلويات:
Al 2 O 3 + 6HCl \ u003d 2AlCl 3 + ZH 2 O ،
آل 2 O 3 + 2NaOH + ZH 2 O \ u003d 2Na [Al (OH) 4].
تشمل أكاسيد الأمفوتريك أكسيد الألومنيوم Al2O3 وأكسيد الكروم (III) Cr2O3 وأكسيد البريليوم BeO وأكسيد الزنك ZnO وأكسيد الحديد (III) Fe2O3 وعدد آخر.
أكسيد مذبذب مثالي هو ماء H2O ، الذي ينفصل ليشكل كميات متساوية من أيونات الهيدروجين (خصائص الحمض) وأيونات الهيدروكسيد (الخصائص الأساسية). تتجلى الخصائص المتذبذبة للماء بوضوح أثناء التحلل المائي للأملاح الذائبة فيه:
Cu 2+ + H 2 O Cu (OH) + + H + ،
CO 3 2- + H 2 O HCO 3- + OH -.
اكتشف ديمتري إيفانوفيتش مينديليف القانون الدوري ، والذي بموجبه تتغير خصائص العناصر والعناصر التي تشكلها بشكل دوري. تم عرض هذا الاكتشاف بيانيا في الجدول الدوري. يوضح الجدول بشكل جيد وواضح كيف تتغير خصائص العناصر خلال الفترة ، وبعد ذلك تتكرر في الفترة التالية.
لحل المهمة رقم 2 في اختبار الحالة الموحدة في الكيمياء ، نحتاج فقط إلى فهم وتذكر خصائص العناصر التي تتغير في أي اتجاهات وكيف.
كل هذا موضح في الشكل أدناه.
من اليسار إلى اليمين ، تزداد القدرة الكهربية ، والخصائص غير المعدنية ، وحالات الأكسدة الأعلى ، وما إلى ذلك. وتنخفض الخواص المعدنية ونصف القطر.
من أعلى إلى أسفل ، والعكس صحيح: تزداد الخواص المعدنية للذرات وأنصاف أقطارها ، بينما تنخفض القدرة الكهربية. أعلى حالة أكسدة ، المقابلة لعدد الإلكترونات في مستوى الطاقة الخارجية ، لا تتغير في هذا الاتجاه.
لنلق نظرة على الأمثلة.
مثال 1في سلسلة العناصر Na → Mg → Al → Si
أ) انخفاض نصف قطر الذرات ؛
ب) يتناقص عدد البروتونات في نوى الذرات.
ج) يزداد عدد طبقات الإلكترون في الذرات ؛
د) تقل درجة أكسدة الذرات ؛
إذا نظرنا إلى الجدول الدوري ، فسنرى أن جميع عناصر هذه السلسلة موجودة في نفس الفترة ويتم سردها بالترتيب الذي تظهر به في الجدول من اليسار إلى اليمين. للإجابة على هذا النوع من الأسئلة ، تحتاج فقط إلى معرفة بعض أنماط التغييرات في الخصائص في الجدول الدوري. لذلك من اليسار إلى اليمين على طول الفترة ، تنخفض الخصائص المعدنية ، وتزداد الخصائص غير المعدنية ، وتزداد القدرة الكهربية ، وتزداد طاقة التأين ، ويقل نصف قطر الذرات. من أعلى إلى أسفل ، تزداد الخواص المعدنية والمختزلة في مجموعة ، وتقل القدرة الكهربية ، وتقل طاقة التأين ، ويزداد نصف قطر الذرات.
إذا كنت منتبهًا ، فقد فهمت بالفعل أنه في هذه الحالة ينخفض نصف القطر الذري. الجواب أ.
مثال 2من أجل زيادة خصائص الأكسدة ، يتم ترتيب العناصر بالترتيب التالي:
أ. F → O → N
B. I → Br → Cl
ب- Cl → S → P
D. F → Cl → Br
كما تعلم ، في الجدول الدوري لمندليف ، تزداد خصائص الأكسدة من اليسار إلى اليمين في فترة ومن أسفل إلى أعلى في مجموعة. يعرض الخيار B فقط عناصر مجموعة واحدة بالترتيب من الأسفل إلى الأعلى. لذلك يناسب ب.
مثال 3يزداد تكافؤ العناصر في الأكسيد الأعلى في السلسلة:
A. Cl → Br → I
B.Cs → K → Li
ب- Cl → S → P
D. Al → C → N
في الأكاسيد العالية ، تظهر العناصر أعلى حالة أكسدة لها ، والتي ستتزامن مع التكافؤ. وتنمو أعلى درجة أكسدة من اليسار إلى اليمين في الجدول. نحن ننظر: في النسختين الأولى والثانية ، نعطي العناصر الموجودة في نفس المجموعات ، حيث أعلى درجة من الأكسدة ، وبالتالي ، لا يتغير التكافؤ في الأكاسيد. Cl → S → P - تقع من اليمين إلى اليسار ، أي على العكس من ذلك ، سينخفض تكافؤهم في أكسيد أعلى. لكن في الصف Al → C → N ، توجد العناصر من اليسار إلى اليمين ، ويزداد التكافؤ في الأكسيد الأعلى فيها. الجواب: G
مثال 4في سلسلة العناصر S → Se → Te
أ) تزداد حموضة مركبات الهيدروجين ؛
ب) تزداد أعلى درجة أكسدة للعناصر ؛
ج) يزداد تكافؤ العناصر في مركبات الهيدروجين ؛
د) يتناقص عدد الإلكترونات في المستوى الخارجي ؛
انظر على الفور إلى موقع هذه العناصر في الجدول الدوري. الكبريت والسيلينيوم والتيلوريوم في نفس المجموعة ، مجموعة فرعية واحدة. مدرج بالترتيب من الأعلى إلى الأسفل. انظر مرة أخرى إلى الرسم البياني أعلاه. من أعلى إلى أسفل في الجدول الدوري ، تزداد الخصائص المعدنية ، وتزداد أنصاف الأقطار ، وتقل القدرة الكهربية ، وطاقة التأين ، والخصائص غير المعدنية ، ولا يتغير عدد الإلكترونات في المستوى الخارجي. تم استبعاد الخيار D على الفور. إذا لم يتغير عدد الإلكترونات الخارجية ، فإن احتمالات التكافؤ وأعلى حالة أكسدة لا تتغير أيضًا ، يتم استبعاد B و C.
يبقى الخيار (أ). نتحقق من الطلب. وفقًا لمخطط Kossel ، تزداد قوة الأحماض الخالية من الأكسجين مع انخفاض حالة الأكسدة للعنصر وزيادة نصف قطر أيونه. حالة الأكسدة لجميع العناصر الثلاثة هي نفسها في مركبات الهيدروجين ، لكن نصف القطر ينمو من أعلى إلى أسفل ، مما يعني أن قوة الأحماض تنمو أيضًا.
الجواب هو أ.
مثال 5من أجل إضعاف الخصائص الرئيسية ، يتم ترتيب الأكاسيد بالترتيب التالي:
A. Na 2 O → K 2 O → Rb 2 O
ب. Na 2 O → MgO → Al 2 O 3
B. BeO → BaO → CaO
SO 3 → P 2 O 5 → SiO 2
تضعف الخصائص الرئيسية للأكاسيد بشكل متزامن مع إضعاف الخصائص المعدنية للعناصر المكونة لها. وخصائص Me تضعف من اليسار إلى اليمين أو من أسفل إلى أعلى. يتم ترتيب Na و Mg و Al من اليسار إلى اليمين. الجواب ب.
أحد أهم قوانين الطبيعة هو القانون الدوري ، الذي اكتشفه مندلييف عام 1869 ، والذي صاغه على النحو التالي: "إن خصائص المواد البسيطة ، وكذلك أشكال وخصائص المركبات ، تعتمد بشكل دوري على المادة الذرية. أوزان العناصر ".
مع تطور كيمياء الكم ، تلقى القانون الدوري تبريرًا نظريًا صارمًا ، ومعه صياغة جديدة: "خصائص المواد البسيطة ، وكذلك أشكال وخصائص مركبات العناصر ، تعتمد بشكل دوري على الحجم من شحنات نوى ذراتهم ".
قبل مندليف ، حاول الكثيرون تنظيم العناصر ، كان ماير (ألمانيا) الأقرب. في عام 1864 ، قدم في كتابه جدولًا تم فيه ترتيب العناصر أيضًا بترتيب تصاعدي لكتلها الذرية ، لكن ماير وضع 27 عنصرًا فقط في هذا الجدول ، وكان أقل من نصفها معروفًا في ذلك الوقت. ميزة Mendeleev هي أنه كان هناك مكان في جدوله ليس فقط لجميع العناصر المعروفة ، ولكن تم ترك مساحات فارغة للعناصر التي لم يتم اكتشافها بعد (ecabor - Sc ، ekaaluminum - Ga ، ekasilicon - Ge).

من وجهة نظر التركيب الإلكتروني للذرة:
فترةقم بتسمية التسلسل الأفقي للعناصر بدءًا من المعدن القلوي وتنتهي بالغاز النبيل بـ نفس القيمة القصوى للعدد الكمي الرئيسي ، مساوية لعدد الفترة.
يتم تحديد عدد العناصر في فترة ما من خلال قدرة المستويات الفرعية.
مجموعةالعناصر عبارة عن مجموعة رأسية من العناصر لها نفس التكوين الإلكتروني وتشابه كيميائي معين. رقم المجموعة (باستثناء المجموعات الفرعية I ، II ، VIII الجانبية) يساوي مجموع إلكترونات التكافؤ.
بالإضافة إلى القسمة على فترات (يحددها عدد الكم الرئيسي) ، هناك تقسيم إلى العائلات، يحددها عدد الكم المداري. إذا تم ملء المستوى الفرعي s في عنصر ، فعندئذٍ s-family أو s-element ؛ المستوى الفرعي - p - عنصر ؛ د- المستوى الفرعي - عنصر د ؛ المستوى الفرعي f - العنصر f.
في شكل الفترة القصيرة من النظام الدوري ، هناك 8 مجموعات ، كل منها مقسمة إلى مجموعات فرعية رئيسية وثانوية. تمتلئ المجموعات الفرعية الرئيسية الأولى والثانية بعناصر s ؛ المجموعات الفرعية الرئيسية III-VIII - عناصر p. د العناصر في مجموعات فرعية جانبية. يتم وضع عناصر f في مجموعات منفصلة.
وهكذا ، يحتل كل عنصر في النظام الدوري للعناصر مكانًا محددًا بدقة ، يتم تمييزه برقم تسلسلي ويرتبط بهيكل غلاف الإلكترون للذرة.
1.2.1. أنماط التغيرات في خصائص العناصر ومركباتها حسب الفترات والمجموعات
أثبتت الدراسات التجريبية اعتماد الخصائص الكيميائية والفيزيائية للعناصر على موقعها في النظام الدوري.
طاقة التأينتسمى الطاقة التي يجب إنفاقها لفصل وإزالة الإلكترون من ذرة أو أيون أو جزيء . يتم التعبير عنها في J أو eV (1eV = 1.6.10 -19 J).
طاقة التأين قياس القدرة التصالحيةذرة. كلما انخفضت قيمة طاقة التأين ، زادت قدرة اختزال الذرة. تفقد الذرات إلكترونًا وتصبح أيونات موجبة الشحنة.
الإلكترون تقاربهي الطاقة المنبعثة عندما يتصل الإلكترون بذرة أو جزيء أو جذري.
تتغير طاقة تقارب الإلكترون للذرات بشكل طبيعي وفقًا لطبيعة الهياكل الإلكترونية لذرات العناصر. فترات من اليسار إلى اليمين زيادة تقارب الإلكترون وخصائص مؤكسدة العناصر.في مجموعات من أعلى إلى أسفل ، يميل تقارب الإلكترون إلى الانخفاض.
الهالوجينات لها أعلى تقارب إلكترون ، لأن من خلال ربط إلكترون واحد بذرة محايدة ، فإنه يكتسب التكوين الإلكتروني الكامل للغاز النبيل.
تسمى الخاصية المميزة لأي من الذرات أسهل في إعطاء أو إضافة إلكترون كهرسلبيةوهو نصف مجموع طاقة التأين وتقارب الإلكترون.
تزداد الكهربية من اليسار إلى اليمين لعناصر كل فترة وتنخفض من أعلى إلى أسفل لعناصر نفس مجموعة PS.
نصف القطر الذري والأيوني
الذرات والأيونات ليس لها حدود محددة بدقة بسبب الطبيعة الموجية للإلكترونات. لذلك ، يتم تحديد نصف القطر الشرطي للذرات والأيونات ، المرتبطة ببعضها البعض بواسطة روابط كيميائية في البلورات.
يتناقص نصف قطر ذرات المعدن في فترات مع زيادة في العدد الترتيبي للعناصر، لأن مع نفس العدد من طبقات الإلكترون ، تزداد شحنة النواة ، وبالتالي تزداد جاذبية الإلكترونات بها.
داخل كل مجموعة من العناصر ، كقاعدة عامة ، يزيد نصف قطر الذرات من أعلى إلى أسفل.، لأن يزداد عدد مستويات الطاقة. كما أن أنصاف أقطار الأيونات تعتمد بشكل دوري على العدد الذري للعنصر.

مثال.كيف تتغير أحجام الذرات خلال فترة ، عند الانتقال من فترة إلى أخرى ، وداخل نفس المجموعة؟ ما العناصر التي لها الحد الأدنى والحد الأقصى لحجم الذرة؟
داخل الفترة (من اليسار إلى اليمين) تقل أحجام الذرات بسبب تزداد شحنة النواة وتنجذب الإلكترونات بقوة أكبر إلى النواة. في المجموعات الفرعية الرئيسية ، تزداد أحجام الذرات بسبب. يزداد عدد طبقات الإلكترون. في المجموعات الفرعية الجانبية ، تكون هذه التغييرات أقل وضوحًا بسبب ضغط d ، وعند الانتقال من الفترة V إلى الفترة VI ، يوجد حتى انخفاض في حجم الذرات بسبب ضغط f.
وفقًا لهذه القواعد ، يكون الحد الأدنى لحجم الذرة هو الهيليوم، والأقصى سيزيوم. لا يحتوي الفرانسيوم على نظائر طويلة العمر (النظير الطبيعي مشع ، بعمر نصف يبلغ 21 دقيقة).
المعادن واللافلزات.إن تقسيم العناصر والمواد البسيطة إلى معادن وغير فلزية مشروط إلى حد ما.
من حيث الخصائص الفيزيائية ، تتميز المعادن بالتوصيل الحراري والكهربائي العالي ، معامل درجة الحرارة السلبية للتوصيل ، اللمعان المعدني المحدد ، المرونة ، الليونة ، إلخ.
حسب الخصائص الكيميائية ، تتميز المعادن بالخصائص الرئيسية للأكاسيد والهيدروكسيدات وخصائص الاختزال.
ترتبط الاختلافات المماثلة في خصائص المواد البسيطة بطبيعة الرابطة الكيميائية أثناء تكوينها. تتكون الرابطة المعدنية في المعادن بنقص إلكترونات التكافؤ ، ورابطة تساهمية في غير المعادن مع وجود عدد كافٍ منها. انطلاقا من ذلك ، من الممكن رسم حدود عمودية بين عناصر المجموعتين IIIA و IV. على اليسار - العناصر التي لديها عجز في إلكترونات التكافؤ ، على اليمين - مع وجود فائض. هذه هي حدود Zintl.
مثال.كيف تختلف المعادن النموذجية عن اللافلزات؟ لماذا وكيف تتغير الخصائص المعدنية بزيادة العدد الترتيبي للعناصر؟
في الجدول الدوري للعناصر ، توجد معادن بشكل أساسي ، وهناك عدد قليل من غير المعادن (22 في المجموع). تشمل المعادن جميع العناصر s. هذا بسبب وجود عدد قليل من إلكترونات التكافؤ (1 أو 2) فيها ، نتيجة لهذا النقص في الإلكترونات ، يتم تكوين رابطة معدنية.
جميع العناصر d و f هي أيضًا معادن. عندما تتشكل الروابط الكيميائية ، تعمل الإلكترونات s لمستوى الطاقة الخارجية وجزء أو كل إلكترونات d للمستوى قبل الأخير كإلكترونات تكافؤ في ذرات العناصر d ، وتشارك الإلكترونات d في تكوين الروابط الكيميائية فقط بعد كل الإلكترونات الخارجية. بالإضافة إلى ذلك ، يساهم تأثير الغربلة للشحنة النووية في سهولة إزالة الإلكترونات s. يتكون من تقليل التأثير على الإلكترون من الشحنة الموجبة للنواة بسبب وجود إلكترونات أخرى بين الإلكترون المعني والنواة (هذه هي d - أو f -electrons).
في العناصر p ، هناك منافسة بين زيادة عدد إلكترونات التكافؤ (الخصائص غير المعدنية) وفحص الشحنة النووية (تم تحسين الخصائص المعدنية). في هذا الصدد ، في العناصر p ، يزداد استقرار حالات الأكسدة السفلية من أعلى إلى أسفل في المجموعة الفرعية.
من اليمين إلى اليسار ، تزداد الخصائص غير المعدنية للذرات على طول الفترة ، بسبب زيادة شحنة النواة الذرية وصعوبة إعطاء الإلكترونات. من أعلى إلى أسفل ، تزداد الخصائص المعدنية في المجموعة الفرعية ، حيث تضعف الرابطة بين الإلكترونات الخارجية والنواة.
تنقسم خواص المركبات إلى حمض-قاعدي وأكسدة. يوضح الجدول الدوري للعناصر هذه الأنماط جيدًا. لنأخذ هذا في الاعتبار في مثال الهيدروكسيدات.
إذا كان للعنصر حالة أكسدة منخفضة (+1 أو +2) ، على سبيل المثال ، Na-O-H ، فإن رابطة Na-O تكون أقل قوة من O-H ويتم كسر الرابطة على طول رابطة أضعف.
Na-O-H Na + + أوه - . المجمع له خصائص أساسية.
إذا كانت حالة أكسدة العنصر كبيرة (من +5 إلى +7) ، فإن رابطة العنصر والأكسجين أقوى من رابطة O-H ويكون للمركب خصائص حمضية. في حامض النيتريك ، تكون حالة أكسدة النيتروجين كبيرة (+5).

ح + + لا 3 -
تظهر المركبات في حالة الأكسدة +3 و +4 خصائص مذبذبة ، أي اعتمادًا على شريك التفاعل ، يمكن أن تظهر الخصائص الحمضية والأساسية. ولكن هناك استثناءات Zn +2 ، Be +2 ، Sn +2 ، Pb +2 ، Ge +2 لها حالة أكسدة +2 ، لكنها مركبات مذبذبة.
حسب الفترةمن اليمين إلى اليسار ، تزداد بالتالي أعلى حالة أكسدة ، تساوي رقم المجموعة زيادة الخواص غير المعدنية والحمضية.
حسب المجموعة الفرعيةمن أعلى إلى أسفل زيادة الخصائص المعدنية والأساسية، لأن يزداد حجم الذرة ويضعف الرابط مع الذرة المجاورة .
وبالتالي ، يسمح لنا النظام الدوري بتحليل موضع المواد البسيطة فيما يتعلق بخصائص خصائصها (المعادن ، غير الفلزية).

يسمح قانون مندليف الدوري بتحديد خصائص المواد البسيطة في المركبات الكيميائية. لأول مرة ، قام مندليف بنفسه بالتنبؤ بالخصائص. قام بحساب خصائص تلك العناصر التي لم يتم اكتشافها بعد.
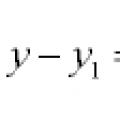 معادلات الخطوط والمنحنيات في المستوى
معادلات الخطوط والمنحنيات في المستوى معادلة متجانسة معممة معادلات متجانسة معممة من الدرجة الثانية
معادلة متجانسة معممة معادلات متجانسة معممة من الدرجة الثانية بفضل الفاصلة يرجع ذلك إلى حقيقة أن في
بفضل الفاصلة يرجع ذلك إلى حقيقة أن في