Kako se označava valencija? Moderne ideje o valenciji
Valence. Određivanje valencije. Elementi sa konstantnom valentnošću.
Slikovito rečeno, valencija je broj "ruka" kojima se atom drži za druge atome. Naravno, atomi nemaju "ruke"; njihovu ulogu igraju tzv. valentnih elektrona.
Možete reći drugačije: Valencija je sposobnost atoma datog elementa da veže određeni broj drugih atoma.
Sljedeći principi moraju biti jasno shvaćeni:
Postoje elementi sa konstantnom valencijom (kojih je relativno malo) i elementi sa promenljivom valencijom (od kojih je većina).
Elementi sa konstantna valencija treba zapamtiti:
Preostali elementi mogu pokazivati različite valencije.
Najveća valencija elementa u većini slučajeva poklapa se s brojem grupe u kojoj se element nalazi.
Na primjer, mangan se nalazi u VII grupa(bočna podgrupa), najveća valencija Mn je sedam. Silicijum se nalazi u grupi IV ( glavna podgrupa), njegova najveća valencija je četiri.
Međutim, treba imati na umu da najveća valencija nije uvijek jedina moguća. Na primjer, najveća valencija hlora je sedam (uvjerite se!), ali su poznata jedinjenja u kojima ovaj element pokazuje valencije VI, V, IV, III, II, I.
Važno je zapamtiti nekoliko izuzeci: maksimalna (i jedina) valencija fluora je I (a ne VII), kiseonika - II (a ne VI), azota - IV (sposobnost azota da pokaže valenciju V je popularan mit koji se nalazi čak i u nekim školama udžbenici).
Valencija i oksidaciono stanje nisu identični koncepti.
Ovi pojmovi su prilično bliski, ali ih ne treba miješati! Oksidacijsko stanje ima predznak (+ ili -), valencija nema; oksidacijsko stanje elementa u supstanciji može biti nula, valencija je nula samo ako imamo posla s izoliranim atomom; numerička vrijednost oksidacijskog stanja ne smije se podudarati s valentnošću. Na primjer, valencija dušika u N 2 je III, a oksidacijsko stanje = 0. Valentnost ugljika u mravlja kiselina= IV, a oksidaciono stanje = +2.
Ako je poznata valencija jednog od elemenata u binarnom spoju, može se pronaći valencija drugog.
Ovo se radi prilično jednostavno. Zapamtite formalno pravilo: proizvod broja atoma prvog elementa u molekuli i njegove valencije mora biti jednak sličnom proizvodu za drugi element.
Primjer 1. Pronađite valencije svih elemenata u jedinjenju NH 3.
Rješenje. Znamo valenciju vodonika - ona je konstantna i jednaka je I. Pomnožimo valenciju H sa brojem atoma vodika u molekuli amonijaka: 1 3 = 3. Dakle, za dušik, proizvod 1 (broj atoma N) sa X (valencija azota) takođe treba da bude jednaka 3. Očigledno, X = 3. Odgovor: N(III), H(I).
Primjer 2. Pronađite valence svih elemenata u molekulu Cl 2 O 5.
Rješenje. Kiseonik ima konstantnu valenciju (II), molekula ovog oksida sadrži pet atoma kiseonika i dva atoma hlora. Neka je valencija hlora = X. Napravimo jednačinu: 5 2 = 2 X. Očigledno, X = 5. Odgovor: Cl(V), O(II).
Primjer 3. Nađite valencu hlora u molekuli SCl 2 ako je poznato da je valenca sumpora II.
Rješenje. Da nam autori problema nisu rekli valenciju sumpora, bilo bi ga nemoguće riješiti. I S i Cl su elementi promjenjive valencije. Uzimajući u obzir Dodatne informacije, rješenje je konstruirano prema šemi primjera 1 i 2. Odgovor: Cl(I).
Poznavajući valencije dva elementa, možete kreirati formulu za binarno jedinjenje.
U primjerima 1 - 3, odredili smo valentnost koristeći formulu sada pokušajmo napraviti obrnuti postupak.
Primjer 4. Napišite formulu za spoj kalcijuma i vodonika.
Rješenje. Poznate su valencije kalcijuma i vodonika - II i I. Neka formula željenog jedinjenja bude Ca x H y. Ponovo sastavljamo dobro poznatu jednačinu: 2 x = 1 y. Kao jedno od rješenja ove jednačine možemo uzeti x = 1, y = 2. Odgovor: CaH 2.
„Zašto baš CaH 2 - pitate se - Uostalom, varijante Ca 2 H 4 i Ca 4 H 8 pa čak i Ca 10 H 20 nisu u suprotnosti sa našim pravilom!
Odgovor je jednostavan: uzmite minimalne moguće vrijednosti x i y. U datom primjeru, ove minimalne (prirodne!) vrijednosti su tačno 1 i 2.
"Dakle, jedinjenja poput N 2 O 4 ili C 6 H 6 su nemoguća?"
Ne, moguće su. Štaviše, N 2 O 4 i NO 2 su u potpunosti različite supstance. Ali formula CH uopće ne odgovara nijednoj stvarnoj stabilnoj tvari (za razliku od C 6 H 6).
Unatoč svemu rečenom, u većini slučajeva možete slijediti pravilo: uzmi najmanjih vrednosti indeksi.
Primjer 5. Napišite formulu za spoj sumpora i fluora ako je poznato da je valencija sumpora šest.
Rješenje. Neka je formula jedinjenja S x F y . Valencija sumpora je data (VI), valenca fluora je konstantna (I). Ponovo formulišemo jednačinu: 6 x = 1 y. Lako je shvatiti da su najmanje moguće vrijednosti varijabli 1 i 6. Odgovor: SF 6.
Ovdje su, zapravo, sve glavne tačke.
Sada se provjeri! Predlažem da prođete kroz kratki test na temu "Valence".
Postoje elementi čija je valencija uvijek konstantna, a njih je vrlo malo. Ali svi ostali elementi pokazuju promjenjivu valenciju.
Više lekcija na sajtu
Jedan atom drugog monovalentnog elementa je u kombinaciji sa jednim atomom monovalentnog elementa(HCl) . Atom dvovalentnog elementa se kombinuje sa dva atoma monovalentnog elementa.(H2O) ili jedan dvovalentni atom(CaO) . To znači da se valencija elementa može predstaviti kao broj koji pokazuje s koliko atoma monovalentnog elementa se atom datog elementa može kombinirati. Osovina elementa je broj veza koje atom formira:
Na – monovalentna (jedna veza)
H – monovalentna (jedna veza)
O – dvovalentni (dvije veze po atomu)
S – heksavalentni (tvori šest veza sa susjednim atomima)
Pravila za određivanje valencije
elemenata u spojevima
1. Osovina vodonik pogrešno za I(jedinica). Zatim, u skladu sa formulom vode H 2 O, dva atoma vodika su vezana za jedan atom kiseonika.
2. Kiseonik u svojim jedinjenjima uvijek pokazuje valenciju II. Prema tome, ugljenik u jedinjenju CO 2 ( ugljen-dioksid) ima valenciju IV.
3. Supreme shaft jednak broj grupe .
4. Najniža valencija jednaka je razlici između broja 8 (broja grupa u tabeli) i broja grupe u kojoj se ovaj element nalazi, tj. 8 — N grupe .
5. Za metale u “A” podgrupama, osovina je jednaka broju grupe.
6. Nemetali općenito pokazuju dvije valencije: višu i nižu.
Slikovito rečeno, osovina je broj „rukova“ kojima se atom drži za druge atome. Naravno, atomi nemaju "ruke"; njihovu ulogu igraju tzv. valentnih elektrona.
Možete reći drugačije: je sposobnost atoma datog elementa da veže određeni broj drugih atoma.
Sljedeći principi moraju biti jasno shvaćeni:
Postoje elementi sa konstantnom valencijom (kojih je relativno malo) i elementi sa promenljivom valencijom (od kojih je većina).
Elementi sa konstantnom valentnošću moraju se zapamtiti.
Valencija je sposobnost atoma da vežu određeni broj drugih atoma za sebe.
Jedan atom drugog monovalentnog elementa je u kombinaciji sa jednim atomom monovalentnog elementa(HCl) . Atom dvovalentnog elementa se kombinuje sa dva atoma monovalentnog elementa.(H2O) ili jedan dvovalentni atom(CaO) . To znači da se valencija elementa može predstaviti kao broj koji pokazuje s koliko atoma monovalentnog elementa se atom datog elementa može kombinirati. Valentnost elementa je broj veza koje atom formira:
N / A – monovalentna (jedna veza)
H – monovalentna (jedna veza)
O - dvovalentna (dvije veze za svaki atom)
S – heksavalentna (tvori šest veza sa susjednim atomima)
Pravila za određivanje valencije
elemenata u spojevima
1. Valence vodonik pogrešno za I(jedinica). Zatim, u skladu sa formulom vode H 2 O, dva atoma vodika su vezana za jedan atom kiseonika.
2. Kiseonik u svojim jedinjenjima uvijek pokazuje valenciju II. Prema tome, ugljenik u spoju CO 2 (ugljični dioksid) ima valenciju IV.
3. Viša valencija jednak broj grupe .
4. Najniža valencija jednaka je razlici između broja 8 (broja grupa u tabeli) i broja grupe u kojoj se ovaj element nalazi, tj. 8 - N grupe .
5. Za metale koji se nalaze u “A” podgrupama, valencija je jednaka broju grupe.
6. Nemetali općenito pokazuju dvije valencije: višu i nižu.
Na primjer: sumpor ima veća valencija VI i najniži (8 – 6), jednak II; fosfor pokazuje valencije V i III.
7. Valencija može biti konstantna ili varijabilna.
Valencija elemenata mora biti poznata da bi se sastavile hemijske formule jedinjenja.
Algoritam za sastavljanje formule jedinjenja fosfor-oksida
|
Sekvenciranje |
Formulisanje fosfor-oksida |
|
1. Napišite simbole elemenata |
R O |
|
2. Odrediti valencije elemenata |
V II |
|
3. Pronađite najmanji zajednički višekratnik brojčanih vrijednosti valencija |
5 2 = 10 |
|
4. Pronađite odnose između atoma elemenata dijeleći pronađeni najmanji višekratnik s odgovarajućim valencijama elemenata |
10: 5 = 2, 10: 2 = 5; P:O=2:5 |
|
5. Napišite indekse za simbole elemenata |
R 2 O 5 |
|
6. Formula jedinjenja (oksida) |
R 2 O 5 |
Zapamtite!
Osobine sastavljanja hemijskih formula jedinjenja.
1) Najniža valenca je prikazana elementom koji se nalazi desno i iznad u tabeli D.I. Mendeljejeva, a najviša je prikazana elementom koji se nalazi lijevo i ispod.
Na primjer, u kombinaciji s kisikom, sumpor pokazuje najveću valenciju VI, a kisik najnižu valenciju II. Dakle, formula za sumporov oksid bi bila SO 3.
U jedinjenju silicijuma sa ugljenikom, prvi pokazuje najveću valenciju IV, a drugi - najnižu IV. Dakle formula
– SiC. Ovo je silicijum karbid, osnova vatrostalnih i abrazivnih materijala.
2) Atom metala je prvi u formuli.
2) U formulama jedinjenja atom nemetala koji pokazuje najnižu valenciju uvijek je na drugom mjestu, a naziv takvog spoja završava na "id".
Na primjer,Sao – kalcijum oksid, NaCl - natrijum hlorida, PbS – olovni sulfid.
Sada možete napisati formule za bilo koje spojeve metala i nemetala.
Tema lekcije: „Valencija. Određivanje valencije po formulama njihovih jedinjenja"
Vrsta lekcije: proučavanje i primarno učvršćivanje novih znanja
Organizacioni oblici: razgovor, individualni zadaci, nezavisni
Ciljevi lekcije:
Didaktički:
Na osnovu znanja učenika ponoviti pojmove „hemijske formule“;
Pomoći učenicima da razviju koncept „valencije“ i sposobnost određivanja valencije atoma elemenata koristeći formule supstanci;
Usmjeriti pažnju učenika na mogućnost integracije predmeta hemije i matematike.
edukativni:
Nastaviti razvijati vještine formulisanja definicija;
Objasniti značenje proučavanih pojmova i objasniti redoslijed radnji pri određivanju valencije pomoću formule tvari;
Promovirati bogaćenje vokabular, razvoj emocija, kreativnih sposobnosti;
Razvijati sposobnost isticanja glavnog, bitnog, upoređivanja, generalizacije, razvijanja dikcije i govora.
edukativni:
Negovati osećaj drugarstva i sposobnost za kolektivni rad;
Povećati stepen estetskog obrazovanja učenika;
Usmjerite učenike na zdrav imidžživot.
Planirani ishodi učenja:
Predmet: znati definiciju pojma „valencija“.
Biti u stanju odrediti valentnost elemenata pomoću formula binarnih jedinjenja. Znati valenciju nekih hemijskih elemenata.
Meta-predmet: razviti sposobnost rada koristeći algoritam za rješavanje obrazovnih i kognitivnih problema.
Lični: formiranje odgovornog odnosa prema učenju, spremnost učenika za samoobrazovanje na osnovu motivacije za učenje.
Glavne vrste studentskih aktivnosti. Odrediti valencu elemenata u binarnim jedinjenjima.
Osnovni koncepti: valencija, konstantna i varijabilna valencija.
Oprema za studente: udžbenik G.E. Rudžitis, F.G. Feldman “Hemija. 8. razred". - M.: Obrazovanje, 2015; na svakoj tabeli “Algoritam za određivanje valencije” (Prilog 2); Handout.
| Tokom nastave | Aktivnosti nastavnika | Aktivnosti učenika |
| 1.Organizacioni momenat | Nastavnik dočekuje učenike, utvrđuje spremnost za nastavu, stvara povoljnu mikroklimu u učionici | Pozdravite nastavnika i pokažite spremnost za lekciju |
| 2.Ažuriranje znanja | Frontalni razgovor sa učenicima na završenoj temi “Hemijska formula”. Vježba 1:Šta piše ovde? Nastavnik demonstrira formule štampane na posebnim listovima papira (Prilog 1). Zadatak 2: individualni rad na karticama (dva učenika rade za tablom). Nakon završetka proračuna provjerite. Kartica br. 1. Izračunaj relativno molekularna težina od ovih supstanci: NaCl, K2O. Kartica br. 2. Izračunajte relativnu molekulsku težinu ovih supstanci: CuO, SO2. | Učenici odgovaraju na pitanja nastavnika, čitaju formule na "hemijskom jeziku" Učenici dobijaju kartice: prva opcija je broj 1, druga opcija je broj 2 i ispunjavaju zadatke. Dva učenika odlaze do table i dalje računaju stražnja strana ploče. Kada završe zadatke, zajedno provjeravaju ispravnost, ako postoje greške, pronalaze načine da ih otklone. |
| 3. Proučavanje novog gradiva | 1. Objašnjenje nastavnika. Formulacija problema. Koncept valencije. Do sada smo koristili gotove formule date u udžbeniku. Hemijske formule se mogu izvesti na osnovu podataka o sastavu supstanci. Ali najčešće se pri sastavljanju hemijskih formula uzimaju u obzir obrasci kojima se elementi povinuju kada se međusobno povezuju. vježba: uporedi kvalitativni i kvantitativni sastav u molekulima: HCl, H2O, NH3, CH4. Šta je zajedničko molekulima? Po čemu se razlikuju jedni od drugih? problem: Zašto različiti atomi sadrže različit broj atoma vodika? zaključak: Atomi imaju različite sposobnosti da zadrže određeni broj drugih atoma u spojevima. Ovo se zove valencija. Riječ "valencija" dolazi iz lat. valentia - snaga. Zapišite definiciju u svoju bilježnicu: Valencija je svojstvo atoma da zadrži određeni broj drugih atoma u spoju. Valencija je označena rimskim brojevima. Valencija atoma vodika se uzima kao jedan, a kisika dva. 1. Zabilježite valenciju poznatog elementa: I 2. naći ukupan broj jedinice valencije poznatog elementa: 3. Ukupan broj valentnih jedinica podijeli se s brojem atoma drugog elementa i sazna se njegova valencija: | Nastavnici slušaju Prisustvo atoma vodonika. HCl - jedan atom hlora drži jedan atom vodonika H2O - jedan atom kiseonika drži dva atoma vodonika NH3 - jedan atom dušika sadrži tri atoma vodika CH4 - jedan atom ugljika sadrži četiri atoma vodika. Oni rješavaju problem, prave pretpostavke i zajedno sa nastavnikom donose zaključak. Zapišite definiciju i poslušajte objašnjenja nastavnika. Koristeći algoritam za određivanje valencije, zapišite formulu u bilježnicu i odredite valenciju elemenata Poslušajte objašnjenja nastavnika |
| 4.Primarna provjera stečenog znanja | Vježba 1: odrediti valenciju elemenata u supstancama. Zadatak u handouts. Vježba 2: U roku od tri minute morate završiti jedan od tri zadatka po vašem izboru. Odaberite samo zadatak koji možete podnijeti. Zadatak je u brošuri. Aplikacioni sloj („4“). Kreativni nivo (“5”). Nastavnik nasumično provjerava sveske učenika i dodjeljuje ocjene za tačno obavljene zadatke. | simulator: učenici u lancu dolaze do ploče i određuju valencije elemenata u predloženim formulama Učenici ispunjavaju predložene zadatke, birajući nivo za koji su, po njihovom mišljenju, sposobni. Analizirajte odgovore zajedno sa nastavnikom |
| 5. Sumiranje lekcije | Razgovor sa studentima: Koji smo problem postavili na početku lekcije? Do kakvog smo zaključka došli? Definišite „valentnost“. Koja je valencija atoma vodika? Kiseonik? Kako odrediti valenciju atoma u spoju? Ocjenjivanje rada učenika u cjelini i pojedinačnih učenika. | Odgovorite na pitanja nastavnika. Analizirajte njihov rad na času. |
| 6.Domaći | § 16, pr. 1, 2, 5, test zadataka | Zapišite zadatak u svoj dnevnik |
| 7. Refleksija | Organizuje izbor učenika adekvatne procene njihovog stava prema času i stanja nakon časa (Prilog 3, štampa za svaki) | Procijenite njihova osjećanja nakon lekcije |
književnost:
Gara N. N. Hemija: nastava u 8. razredu: priručnik za nastavnike / N. N. Gara. - M.: Obrazovanje, 2014.
Ispitivanje i mjerenje materijala. Hemija 8. razred/komp. N.P. Troegubova. - M.: VAKO, 2013.
Rudžitis G.E., Feldman F.G. „Hemija. 8. razred". - M.: Obrazovanje, 2015.
Troegubova N.P. Razvoj zasnovan na lekcijama iz hemije 8.razred. - M.: VAKO, 2014.
Časopis "Biologija" - www.1september.ru - tehnologija učenja orijentisanog na ličnost.
Aneks 1
Šta znači sljedeći unos?
a) 4H; 7Fe; H2; 4H2 b) NaCl; AlBr3; FeS
Dodatak 2
Algoritam za određivanje valencije.
| Algoritam za određivanje valencije | Primjer |
|
| 1. Zapišite formulu supstance. | ||
| 2. Označiti poznatu valenciju elementa | ||
| 3. Pronađite broj valentnih jedinica atoma poznatog elementa tako što ćete pomnožiti valenciju elementa brojem njegovih atoma | 2 |
|
| 4. Podijelite broj valentnih jedinica atoma brojem atoma drugog elementa. Rezultirajući odgovor je željena valencija | 2 | 2 |
| 5. Uradite provjeru, odnosno prebrojite broj valentnih jedinica svakog elementa | I II | I II |
Na času sam radio: aktivno/pasivno
Da li sam: zadovoljan/nezadovoljan svojim radom na času?
Čas mi se činio kratkim/dugačkim
Tokom časa I: nisam umoran/umoran
Moje raspoloženje: postalo je bolje / postalo je gore
Materijal lekcije mi je bio jasan/nerazumljiv, zanimljiv/dosadan.
Handout.
Vježba 1: odrediti valenciju elemenata u supstancama:
SiH4, CrO3, H2S, CO2, CO, SO3, SO2, Fe2O3, FeO, HCl, HBr, Cl2O5, Cl2O7, RN3, K2O, Al2O3, P2O5, NO2, N2O5, Cr2O3, SiO2, B2O3, SiH4, MnO CuO, N2O3.
Vježba 2:
U roku od tri minute morate izvršiti jedan od tri zadatka po vašem izboru. Odaberite samo zadatak koji možete podnijeti.
Reproduktivni nivo (“3”). Odrediti valenciju atoma hemijskih elemenata pomoću formula jedinjenja: NH3, Au2O3, SiH4, CuO.
Aplikacioni sloj („4“). Iz date serije zapišite samo one formule u kojima su atomi metala dvovalentni: MnO, Fe2O3, CrO3, CuO, K2O, CaH2.
Kreativni nivo (“5”). Pronađite obrazac u nizu formula: N2O, NO, N2O3 i stavite valencije iznad svakog elementa.
Jedan hemijski element spajaju ili zamjenjuju određeni broj atoma drugog.
Jedinicom valencije se uzima valencija atoma vodika jednaka 1, odnosno vodonik je jednovalentan. Prema tome, valencija elementa pokazuje na koliko je atoma vodika povezan jedan atom elementa u pitanju. Na primjer, HCl, gdje je hlor jednovalentan; H2O, pri čemu je kiseonik dvovalentan; NH 3, gdje je azot trovalentan.
Tabela elemenata sa konstantnom valentnošću.
Formule supstanci mogu se sastaviti prema valencijama njihovih sastavnih elemenata. I obrnuto, znajući valencije elemenata, možete komponovati od njih hemijska formula.
Algoritam za sastavljanje formula supstanci po valenciji.
1. Zapišite simbole elemenata.
2. Odredite valentnost elemenata uključenih u formulu.
3. Pronađite najmanji zajednički višekratnik brojčanih vrijednosti valencije.
4. Pronađite odnose između atoma elemenata tako što ćete pronađeni najmanji zajednički višekratnik podijeliti odgovarajućim valencijama elemenata.
5. Zapišite indekse elemenata u hemijskoj formuli.
primjer: Hajde da napravimo hemijsku formulu fosfor-oksida.
1. Zapišite simbole:
2. Odredimo valencije:
4. Nađimo odnose između atoma:
5. Zapišite indekse:
Algoritam za određivanje valencije pomoću formula hemijskih elemenata.
1. Zapišite formulu hemijskog jedinjenja.
2. Označiti poznatu valencu elemenata.
3. Pronađite najmanji zajednički višekratnik valencije i indeksa.
4. Pronađite omjer najmanjeg zajedničkog višekratnika i broja atoma drugog elementa. Ovo je željena valencija.
5. Provjerite množenjem valencije i indeksa svakog elementa. Njihovi proizvodi moraju biti jednaki.
primjer: Odredimo valencu vodonik sulfidnih elemenata.
1. Napišimo formulu:
H 2 S
2. Označimo poznatu valenciju:
H 2 S
3. Pronađite najmanji zajednički višekratnik:
H 2 S
4. Pronađite omjer najmanjeg zajedničkog višekratnika i broja atoma sumpora:
H 2 S
5. Uradimo provjeru.
 Korpuskularna i valna svojstva čestica
Korpuskularna i valna svojstva čestica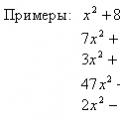 Online jednadžbe X 5 0 rješenje
Online jednadžbe X 5 0 rješenje Zasićene monokarboksilne kiseline
Zasićene monokarboksilne kiseline