Mittemetalliliste elementide minimaalne negatiivne oksüdatsiooniaste. Keemiliste elementide valents
Keemilistes protsessides mängivad peamist rolli aatomid ja molekulid, mille omadused määravad keemiliste reaktsioonide tulemuse. Aatomi üheks oluliseks tunnuseks on oksüdatsiooniarv, mis lihtsustab osakeses elektronide ülekande arvestamise meetodit. Kuidas määrata osakese oksüdatsiooniastet ehk formaalset laengut ja milliseid reegleid selleks teadma peab?
Igasugune keemiline reaktsioon on põhjustatud erinevate ainete aatomite vastasmõjust. Reaktsiooniprotsess ja selle tulemus sõltuvad kõige väiksemate osakeste omadustest.
Mõiste oksüdatsioon (oksüdatsioon) tähendab keemias reaktsiooni, mille käigus aatomite rühm või üks neist kaotab elektrone või saab juurde, omandamise korral nimetatakse reaktsiooni "redutseerimiseks".
Oksüdatsiooniaste on suurus, mida mõõdetakse kvantitatiivselt ja mis iseloomustab reaktsiooni käigus ümberjaotunud elektrone. Need. Oksüdatsiooniprotsessi käigus elektronide hulk aatomis väheneb või suureneb, jagunedes ümber teiste interakteeruvate osakeste vahel ning oksüdatsioonitase näitab täpselt, kuidas need ümber korraldatakse. See kontseptsioon on tihedalt seotud osakeste elektronegatiivsusega – nende võimega meelitada ja tõrjuda vabu ioone.
Oksüdatsioonitaseme määramine sõltub konkreetse aine omadustest ja omadustest, mistõttu arvutusprotseduuri ei saa üheselt nimetada lihtsaks või keeruliseks, kuid selle tulemused aitavad tinglikult fikseerida redoksreaktsioonide protsesse. Tuleb mõista, et saadud arvutustulemus on elektronide ülekande arvestamise tulemus ja sellel puudub füüsiline tähendus ning see ei ole tuuma tegelik laeng.
Oluline on teada! Anorgaanilises keemias kasutatakse elementide oksüdatsiooniastme asemel sageli terminit valents, see pole viga, kuid tuleb meeles pidada, et teine mõiste on universaalsem.
Elektronide liikumise arvutamise mõisted ja reeglid on aluseks keemiliste ainete klassifitseerimisel (nomenklatuuril), nende omaduste kirjeldamisel ja suhtlusvalemite koostamisel. Kuid enamasti kasutatakse seda mõistet redoksreaktsioonide kirjeldamiseks ja nendega töötamiseks.
Oksüdatsiooniastme määramise reeglid
Kuidas oksüdatsiooniastet teada saada? Redoksreaktsioonidega töötades on oluline teada, et osakese formaalne laeng on alati võrdne elektroni väärtusega, väljendatuna arvväärtuses. See omadus tuleneb eeldusest, et sidet moodustavad elektronpaarid on alati täielikult nihkunud negatiivsemate osakeste poole. Tuleb mõista, et me räägime ioonsetest sidemetest ja reaktsiooni korral jagunevad elektronid võrdselt identsete osakeste vahel.
Oksüdatsiooniarvul võib olla nii positiivseid kui ka negatiivseid väärtusi. Asi on selles, et reaktsiooni käigus peab aatom muutuma neutraalseks ja selleks on vaja ioonile kas lisada teatud arv elektrone, kui see on positiivne, või need ära võtta, kui see on negatiivne. Selle mõiste tähistamiseks kirjutatakse valemi kirjutamisel tavaliselt elemendi tähistuse kohale araabia number koos vastava märgiga. Näiteks või jne.
Peaksite teadma, et metallide formaalne laeng on alati positiivne ja enamikul juhtudel saate selle määramiseks kasutada perioodilisustabelit. Näitajate õigeks määramiseks tuleb arvestada mitmete funktsioonidega.

Oksüdatsiooniaste:
Neid omadusi meeles pidades on elementide oksüdatsiooniarvu määramine üsna lihtne, sõltumata keerukusest ja aatomitasemete arvust.
Kasulik video: oksüdatsiooniastme määramine
Mendelejevi perioodilisustabel sisaldab peaaegu kogu keemiliste elementidega töötamiseks vajalikku teavet. Näiteks koolilapsed kasutavad seda ainult keemiliste reaktsioonide kirjeldamiseks. Niisiis, oksüdatsiooninumbri maksimaalsete positiivsete ja negatiivsete väärtuste määramiseks peate kontrollima keemilise elemendi tähistust tabelis:
- Maksimaalne positiivne on selle rühma arv, milles element asub.
- Maksimaalne negatiivne oksüdatsiooniaste on erinevus maksimaalse positiivse piiri ja arvu 8 vahel.
Seega piisab, kui lihtsalt välja selgitada konkreetse elemendi formaalse laengu äärmuslikud piirid. Seda toimingut saab teha perioodilisel tabelil põhinevate arvutuste abil.
Oluline on teada! Ühel elemendil võib korraga olla mitu erinevat oksüdatsioonikiirust.
Oksüdatsioonitaseme määramiseks on kaks peamist meetodit, mille näited on toodud allpool. Esimene neist on meetod, mis nõuab teadmisi ja oskust rakendada keemiaseadusi. Kuidas korraldada selle meetodi abil oksüdatsiooniolekuid?

Oksüdatsiooniastmete määramise reegel
Selleks vajate:
- Tehke kindlaks, kas antud aine on elementaarne ja kas see on väljaspool sidet. Kui jah, siis on selle oksüdatsiooniarv 0, olenemata aine koostisest (üksikud aatomid või mitmetasandilised aatomiühendid).
- Tehke kindlaks, kas kõnealune aine koosneb ioonidest. Kui jah, siis on oksüdatsiooniaste võrdne nende laenguga.
- Kui kõnealune aine on metall, siis vaadake valemis teiste ainete näitajaid ja arvutage aritmeetiliste tehtetega metallinäidud.
- Kui kogu ühendil on üks laeng (sisuliselt on see kõigi esindatud elementide osakeste summa), siis piisab, kui määrata lihtainete näitajad, seejärel lahutada need koguarvust ja saada metalliandmed.
- Kui suhe on neutraalne, peab kogusumma olema null.
Näiteks kaaluge kombineerimist alumiiniumiooniga, mille netolaeng on null. Keemiareeglid kinnitavad tõsiasja, et Cl iooni oksüdatsiooniarv on -1 ja sel juhul on neid ühendis kolm. See tähendab, et Al-ioon peab olema +3, et kogu ühend oleks neutraalne.
See meetod on väga hea, kuna lahuse õigsust saab alati kontrollida, liites kõik oksüdatsioonitasemed kokku.
Teist meetodit saab kasutada keemilisi seadusi tundmata:
- Leidke andmeid osakeste kohta, mille kohta puuduvad ranged reeglid ja nende elektronide täpne arv pole teada (seda saab teha välistamise teel).
- Uurige kõigi teiste osakeste näitajad ja seejärel leidke soovitud osake kogusummast lahutamise teel.
Vaatleme teist meetodit aine Na2SO4 näitel, milles väävliaatomit S ei määrata, on vaid teada, et see erineb nullist.
Et leida, millega kõik oksüdatsiooniastmed on võrdsed:
- Leidke teadaolevaid elemente, pidades silmas traditsioonilisi reegleid ja erandeid.
- Na-ioon = +1 ja iga hapnik = -2.
- Kõigi aatomite peale ühe aatomi oksüdatsiooniastmete saamiseks korrutage iga aine osakeste arv nende elektronidega.
- Na2SO4 sisaldab 2 naatriumi ja 4 hapnikku; korrutades selgub: 2 X +1 = 2 on kõigi naatriumiosakeste oksüdatsiooniarv ja 4 X -2 = -8 - hapnik.
- Lisage saadud tulemused 2+(-8) =-6 – see on ühendi kogulaeng ilma väävliosakeseta.
- Esitage keemiline tähistus võrrandina: teadaolevate andmete summa + tundmatu arv = kogulaeng.
- Na2SO4 on esitatud järgmiselt: -6 + S = 0, S = 0 + 6, S = 6.
Seega, teise meetodi kasutamiseks piisab lihtsate aritmeetikaseaduste tundmisest.

Oksüdatsioonitabel
Töö lihtsustamiseks ja iga keemilise aine oksüdatsiooninäitajate arvutamiseks kasutatakse spetsiaalseid tabeleid, kus kõik andmed registreeritakse.
See näeb välja selline:

Kasulik video: oksüdatsiooniastme määramise õppimine valemite abil
Järeldus
Kemikaalide oksüdatsiooninumbri leidmine on lihtne ülesanne, mis nõuab vaid hoolt ning põhireeglite ja erandite tundmist. Teades erandeid ja kasutades spetsiaalseid tabeleid, ei võta see toiming palju aega.
Selle mõiste defineerimisel eeldatakse tinglikult, et siduvad (valents)elektronid liiguvad elektronegatiivsemate aatomiteni (vt Elektronegatiivsus) ja seetõttu koosnevad ühendid positiivselt ja negatiivselt laetud ioonidest. Oksüdatsiooninumbril võib olla null, negatiivne ja positiivne väärtus, mis asetatakse tavaliselt ülaosas oleva elemendi sümboli kohale.
Nulloksüdatsiooniaste määratakse vabas olekus elementide aatomitele, näiteks: Cu, H2, N2, P4, S6. Need aatomid, mille poole ühendav elektronpilv (elektronipaar) nihkub, on negatiivse oksüdatsiooniastmega. Fluori puhul kõigis selle ühendites on see võrdne -1. Aatomitel, mis loovutavad valentselektrone teistele aatomitele, on positiivne oksüdatsiooniaste. Näiteks leelis- ja leelismuldmetallide puhul on see vastavalt +1 ja +2. Lihtsates ioonides nagu Cl−, S2−, K+, Cu2+, Al3+ on see võrdne iooni laenguga. Enamikus ühendites on vesinikuaatomite oksüdatsiooniaste +1, kuid metallhüdriidides (nende ühendites vesinikuga) - NaH, CaH 2 jt - -1. Hapnikku iseloomustab oksüdatsiooniaste –2, kuid näiteks kombinatsioonis fluoriga OF2 on see +2 ja peroksiidühendites (BaO2 jne) –1. Mõnel juhul võib seda väärtust väljendada murdosana: raua puhul raudoksiidis (II, III) Fe 3 O 4 on see võrdne +8/3.
Aatomite oksüdatsiooniastmete algebraline summa ühendis on null ja kompleksioonis on see iooni laeng. Seda reeglit kasutades arvutame näiteks fosfori oksüdatsiooniastme ortofosforhappes H 3 PO 4. Tähistades seda x-ga ja korrutades vesiniku (+1) ja hapniku (-2) oksüdatsiooniaste nende aatomite arvuga ühendis, saame võrrandi: (+1) 3+x+(-2) 4=0 , kust x=+5 . Samamoodi arvutame kroomi oksüdatsiooniastme Cr 2 O 7 2− ioonis: 2x+(−2) 7=−2; x=+6. Ühendites MnO, Mn 2 O 3, MnO 2, Mn 3 O 4, K 2 MnO 4, KMnO 4 on mangaani oksüdatsiooniaste +2, +3, +4, +8/3, +6, vastavalt +7.
Kõrgeim oksüdatsiooniaste on selle suurim positiivne väärtus. Enamiku elementide puhul on see võrdne perioodilisuse tabeli rühmanumbriga ja on elemendi oluline kvantitatiivne tunnus selle ühendites. Elemendi madalaimat oksüdatsiooniastme väärtust, mis selle ühendites esineb, nimetatakse tavaliselt madalaimaks oksüdatsiooniastmeks; kõik teised on vahepealsed. Seega on väävli kõrgeim oksüdatsiooniaste +6, madalaim -2 ja vaheaste +4.
Elementide oksüdatsiooniastmete muutumine perioodilise süsteemi rühmade kaupa peegeldab nende keemiliste omaduste muutuste perioodilisust aatomarvu suurenemisega.
Elementide oksüdatsiooniastme mõistet kasutatakse ainete klassifitseerimisel, nende omaduste kirjeldamisel, ühendite valemite ja rahvusvaheliste nimetuste koostamisel. Kuid seda kasutatakse eriti laialdaselt redoksreaktsioonide uurimisel. Anorgaanilises keemias kasutatakse sageli mõistet "oksüdatsiooniaste" mõiste "valentsus" asemel (vt.
Keemias viitavad terminid "oksüdatsioon" ja "redutseerimine" reaktsioonidele, mille käigus aatom või aatomite rühm kaotab või omandab vastavalt elektrone. Oksüdatsiooniaste on ühele või mitmele aatomile omistatud arvväärtus, mis iseloomustab ümberjaotatud elektronide arvu ja näitab, kuidas need elektronid reaktsiooni käigus aatomite vahel jagunevad. Selle väärtuse määramine võib olenevalt aatomitest ja nendest koosnevatest molekulidest olla kas lihtne või üsna keeruline protseduur. Lisaks võib mõne elemendi aatomitel olla mitu oksüdatsiooniastet. Õnneks on oksüdatsiooniastme määramiseks olemas lihtsad üheselt mõistetavad reeglid, nende enesekindlaks kasutamiseks piisab keemia ja algebra aluste tundmisest.
Sammud
1. osa
Oksüdatsiooniastme määramine keemiaseaduste järgi- Näiteks Al(s) ja Cl2 oksüdatsiooniaste on 0, kuna mõlemad on keemiliselt sidumata elementaarses olekus.
- Pange tähele, et väävli S8 ehk oktaväävli allotroopset vormi iseloomustab vaatamata selle ebatüüpilisele struktuurile ka oksüdatsiooniaste null.
-
Tehke kindlaks, kas kõnealune aine koosneb ioonidest. Ioonide oksüdatsiooniaste on võrdne nende laenguga. See kehtib nii vabade ioonide kui ka keemiliste ühendite osade kohta.
- Näiteks Cl - iooni oksüdatsiooniaste on -1.
- Keemilises ühendis NaCl oleva Cl-iooni oksüdatsiooniaste on samuti -1. Kuna Na-iooni laeng on definitsiooni järgi +1, järeldame, et Cl-iooni laeng on -1 ja seega on tema oksüdatsiooniaste -1.
-
Pange tähele, et metalliioonidel võib olla mitu oksüdatsiooniastet. Paljude metalliliste elementide aatomeid saab ioniseerida erineval määral. Näiteks metalli, näiteks raua (Fe) ioonide laeng on +2 või +3. Metalliioonide laengut (ja nende oksüdatsiooniastet) saab määrata teiste elementide ioonide laengute järgi, millega metall on keemilise ühendi osa; tekstis on seda laengut tähistatud rooma numbritega: näiteks raua (III) oksüdatsiooniaste on +3.
- Vaatleme näiteks alumiiniumiooni sisaldavat ühendit. AlCl3 ühendi kogulaeng on null. Kuna me teame, et Cl - ioonide laeng on -1 ja ühendis on 3 sellist iooni, siis selleks, et kõnealune aine oleks üldiselt neutraalne, peab Al iooni laeng olema +3. Seega on alumiiniumi oksüdatsiooniaste sel juhul +3.
-
Hapniku oksüdatsiooniaste on -2 (mõnede eranditega). Peaaegu kõigil juhtudel on hapnikuaatomite oksüdatsiooniaste -2. Sellest reeglist on mõned erandid:
- Kui hapnik on elementaarses olekus (O2), on tema oksüdatsiooniaste 0, nagu ka teiste elementaarsete ainete puhul.
- Kui kaasas on hapnik peroksiid, selle oksüdatsiooniaste on -1. Peroksiidid on ühendite rühm, mis sisaldab lihtsat hapnik-hapnik sidet (see tähendab peroksiidi aniooni O 2 -2). Näiteks H 2 O 2 (vesinikperoksiidi) molekuli koostises on hapniku laeng ja oksüdatsiooniaste -1.
- Fluoriga kombineerituna on hapniku oksüdatsiooniaste +2, lugege fluori reeglit allpool.
-
Vesiniku oksüdatsiooniaste on mõne erandiga +1. Nagu hapniku puhul, on ka siin erandeid. Tavaliselt on vesiniku oksüdatsiooniaste +1 (kui see pole elementaarolekus H2). Hüdriidideks nimetatud ühendites on vesiniku oksüdatsiooniaste aga -1.
- Näiteks H2O-s on vesiniku oksüdatsiooniaste +1, kuna hapnikuaatomil on -2 laeng ja üldise neutraalsuse tagamiseks on vaja kahte +1 laengut. Naatriumhüdriidi koostises on aga vesiniku oksüdatsiooniaste juba -1, kuna Na-ioon kannab laengut +1 ja üldise elektrilise neutraalsuse tagamiseks peab vesinikuaatomi laeng (ja seega ka selle oksüdatsiooniaste) olema olema võrdne -1.
-
Fluor Alati selle oksüdatsiooniaste on -1. Nagu juba märgitud, võib mõne elemendi (metalliioonid, hapnikuaatomid peroksiidides jne) oksüdatsiooniaste varieeruda sõltuvalt mitmest tegurist. Fluori oksüdatsiooniaste on aga alati -1. Seda seletatakse asjaoluga, et sellel elemendil on kõrgeim elektronegatiivsus - teisisõnu on fluori aatomid kõige vähem valmis oma elektronidest lahku minema ja tõmbavad kõige aktiivsemalt võõrelektrone. Seega jääb nende tasu muutumatuks.
-
Ühendi oksüdatsiooniastmete summa on võrdne selle laenguga. Kõikide aatomite oksüdatsiooniastmed keemilises ühendis peavad moodustama selle ühendi laengu. Näiteks kui ühend on neutraalne, peab kõigi selle aatomite oksüdatsiooniastmete summa olema null; kui ühend on polüaatomiline ioon, mille laeng on -1, on oksüdatsiooniastmete summa -1 jne.
- See on hea viis kontrollida – kui oksüdatsiooniastmete summa ei võrdu ühendi kogulaenguga, siis oled kuskil vea teinud.
2. osa
Oksüdatsiooniastme määramine ilma keemiaseadusi kasutamata-
Leidke aatomid, millel pole oksüdatsiooniarvude suhtes rangeid reegleid. Mõne elemendi puhul pole oksüdatsiooniastme leidmiseks kindlaid reegleid. Kui aatom ei kuulu ühegi ülalloetletud reegli alla ja te ei tea selle laengut (näiteks on aatom osa kompleksist ja selle laeng pole täpsustatud), saate sellise aatomi oksüdatsiooninumbri määrata järgmiselt. kõrvaldamine. Esmalt määrake ühendi kõigi teiste aatomite laeng ja seejärel arvutage ühendi teadaoleva kogulaengu põhjal antud aatomi oksüdatsiooniaste.
- Näiteks ühendis Na 2 SO 4 on väävliaatomi (S) laeng teadmata – me teame ainult, et see ei ole null, kuna väävel ei ole elementaarses olekus. See ühend on hea näide oksüdatsiooniastme määramise algebralise meetodi illustreerimiseks.
-
Leia ülejäänud elementide oksüdatsiooniastmed ühendis. Määrake ülalkirjeldatud reeglite abil ühendi ülejäänud aatomite oksüdatsiooniastmed. Ärge unustage reeglite erandeid O-, H-aatomite jms puhul.
- Na 2 SO 4 puhul leiame meie reegleid kasutades, et Na-iooni laeng (ja seega ka oksüdatsiooniaste) on +1 ja iga hapnikuaatomi puhul -2.
-
Leia ühendi laengust tundmatu oksüdatsiooniarv. Nüüd on teil kõik andmed soovitud oksüdatsiooniastme hõlpsaks arvutamiseks. Kirjutage üles võrrand, mille vasakul küljel on arvutuste eelmises etapis saadud arvu ja tundmatu oksüdatsiooniastme summa ning paremal pool - ühendi kogulaeng. Teisisõnu, (Teadaolevate oksüdatsiooniastmete summa) + (soovitud oksüdatsiooniaste) = (ühendi laeng).
- Meie puhul näeb Na 2 SO 4 lahus välja järgmine:
- (Teadaolevate oksüdatsiooniastmete summa) + (soovitud oksüdatsiooniaste) = (ühendi laeng)
- -6 + S = 0
- S = 0 + 6
- S = 6. Na 2 SO 4-s on väävel oksüdatsiooniastmes 6 .
- Meie puhul näeb Na 2 SO 4 lahus välja järgmine:
- Ühendites peab kõigi oksüdatsiooniastmete summa võrduma laenguga. Näiteks kui ühend on kaheaatomiline ioon, peab aatomite oksüdatsiooniastmete summa võrduma kogu ioonlaenguga.
- Väga kasulik on osata kasutada perioodilisustabelit ja teada, kus metallilised ja mittemetallilised elemendid selles asuvad.
- Elementaarsel kujul olevate aatomite oksüdatsiooniaste on alati null. Ühe iooni oksüdatsiooniaste on võrdne selle laenguga. Perioodilise tabeli rühma 1A elementide, nagu vesinik, liitium, naatrium, nende elementaarsel kujul on oksüdatsiooniaste +1; 2A rühma metallidel, nagu magneesium ja kaltsium, on nende elementaarsel kujul oksüdatsiooniaste +2. Sõltuvalt keemilise sideme tüübist võib hapnikul ja vesinikul olla 2 erinevat oksüdatsiooniastet.
Tehke kindlaks, kas kõnealune aine on elementaarne. Aatomite oksüdatsiooniaste väljaspool keemilist ühendit on null. See reegel kehtib nii üksikutest vabadest aatomitest moodustunud ainete kui ka nende ainete kohta, mis koosnevad ühe elemendi kahest või mitmeaatomilisest molekulist.
Paljudes kooliõpikutes ja käsiraamatutes õpetatakse valentside põhjal valemeid looma isegi ioonsete sidemetega ühendite jaoks. Valemite koostamise korra lihtsustamiseks on see meie arvates vastuvõetav. Kuid peate mõistma, et see pole ülaltoodud põhjuste tõttu täiesti õige.
Universaalsem mõiste on oksüdatsiooniastme mõiste. Kasutades aatomite oksüdatsiooniastmete väärtusi ja valentsi väärtusi, saate koostada keemilisi valemeid ja kirjutada üles valemiühikud.
Oksüdatsiooni olek- see on osakeses (molekulis, ioonis, radikaalis) oleva aatomi tingimuslik laeng, mis arvutatakse ligikaudselt, et kõik osakeses olevad sidemed on ioonsed.
Enne oksüdatsiooniastmete määramist on vaja võrrelda seotud aatomite elektronegatiivsust. Suurema elektronegatiivsusega aatomil on negatiivne oksüdatsiooniaste ja madalama elektronegatiivsusega aatomil positiivne.
Aatomite elektronegatiivsuse väärtuste objektiivseks võrdlemiseks oksüdatsiooniastmete arvutamisel soovitas IUPAC 2013. aastal kasutada Alleni skaalat.
* Näiteks Alleni skaala järgi on lämmastiku elektronegatiivsus 3,066 ja kloori 2,869.
Illustreerime ülaltoodud määratlust näidetega. Koostame veemolekuli struktuurivalemi.

Kovalentsed polaarsed OH-sidemed on tähistatud sinisega.
Kujutagem ette, et mõlemad sidemed ei ole kovalentsed, vaid ioonsed. Kui need oleksid ioonilised, kanduks üks elektron igalt vesinikuaatomilt üle elektronegatiivsemale hapnikuaatomile. Tähistame need üleminekud siniste nooltega.
*SellesNäiteks on nool eesmärk visuaalselt illustreerida elektronide täielikku ülekannet, mitte illustreerida induktiivset efekti.

On lihtne märgata, et noolte arv näitab ülekantavate elektronide arvu ja nende suund näitab elektronide ülekande suunda.
Hapnikuaatomile on suunatud kaks noolt, mis tähendab, et hapnikuaatomile kantakse üle kaks elektroni: 0 + (-2) = -2. Hapnikuaatomil moodustub laeng -2. See on hapniku oksüdatsiooniaste veemolekulis.
Iga vesinikuaatom kaotab ühe elektroni: 0 - (-1) = +1. See tähendab, et vesinikuaatomite oksüdatsiooniaste on +1.

Oksüdatsiooniastmete summa võrdub alati osakese kogulaenguga.
Näiteks veemolekuli oksüdatsiooniastmete summa on võrdne: +1(2) + (-2) = 0. Molekul on elektriliselt neutraalne osake.
Kui arvutada iooni oksüdatsiooniastmed, on oksüdatsiooniastmete summa vastavalt võrdne selle laenguga.
Oksüdatsiooniastme väärtus on tavaliselt näidatud elemendi sümboli ülemises paremas nurgas. Enamgi veel, tähis kirjutatakse numbri ette. Kui märk tuleb pärast numbrit, siis on see iooni laeng.
Näiteks S -2 on väävliaatom oksüdatsiooniastmes -2, S 2- on väävli anioon laenguga -2.
S +6 O -2 4 2- - aatomite oksüdatsiooniastmete väärtused sulfaatanioonis (iooni laeng on esile tõstetud rohelisega).
Mõelge nüüd juhtumile, kui ühendil on segatud sidemed: Na2SO4. Side sulfaataniooni ja naatriumi katioonide vahel on ioonne, väävli aatomi ja hapnikuaatomite vahelised sidemed sulfaadioonis on kovalentsed polaarsed. Kirjutame üles naatriumsulfaadi graafilise valemi ja näitame nooltega elektronide ülemineku suunda.
*Struktuurivalem näitab kovalentsete sidemete järjekorda osakeses (molekul, ioon, radikaal). Struktuurivalemeid kasutatakse ainult kovalentsete sidemetega osakeste jaoks. Ioonsete sidemetega osakeste puhul pole struktuurivalemi mõistel mingit tähendust. Kui osake sisaldab ioonseid sidemeid, siis kasutatakse graafilist valemit.

Näeme, et tsentraalsest väävliaatomist lahkub kuus elektroni, mis tähendab, et väävli oksüdatsiooniaste on 0 - (-6) = +6.
Terminaalsed hapnikuaatomid võtavad igaüks kaks elektroni, mis tähendab, et nende oksüdatsiooniaste on 0 + (-2) = -2
Silda ühendavad hapnikuaatomid võtavad vastu kaks elektroni ja nende oksüdatsiooniaste on -2.
Oksüdatsiooniastet on võimalik määrata ka struktuur-graafilise valemi abil, kus kovalentsed sidemed on tähistatud kriipsudega ja ioonide laeng.
Selles valemis on sildavatel hapnikuaatomitel juba üksikud negatiivsed laengud ja väävliaatomilt tuleb neile täiendav elektron -1 + (-1) = -2, mis tähendab, et nende oksüdatsiooniaste on -2.
Naatriumioonide oksüdatsiooniaste on võrdne nende laenguga, s.o. +1.

Määrame elementide oksüdatsiooniastmed kaaliumsuperoksiidis (superoksiidis). Selleks loome kaaliumsuperoksiidi graafilise valemi ja näitame noolega elektronide ümberjaotust. O-O side on kovalentne mittepolaarne side, mistõttu see ei näita elektronide ümberjaotumist.
* Superoksiidi anioon on radikaalioon. Ühe hapnikuaatomi formaalne laeng on -1 ja teise, paaritu elektroniga, on 0.

Näeme, et kaaliumi oksüdatsiooniaste on +1. Valemis kaaliumi vastas oleva hapnikuaatomi oksüdatsiooniaste on -1. Teise hapnikuaatomi oksüdatsiooniaste on 0.
Samamoodi saate struktuur-graafilise valemi abil määrata oksüdatsiooniastme.

Ringid näitavad kaaliumiiooni ja ühe hapnikuaatomi formaalseid laenguid. Sel juhul langevad formaalsete laengute väärtused kokku oksüdatsiooniastmete väärtustega.
Kuna superoksiidi aniooni mõlemal hapnikuaatomil on erinevad oksüdatsiooniastmed, saame arvutada aritmeetiline keskmine oksüdatsiooniaste hapnikku.
See on võrdne / 2 = - 1/2 = -0,5.
Aritmeetiliste keskmiste oksüdatsiooniastmete väärtused on tavaliselt näidatud brutovalemites või valemiühikutes, et näidata, et oksüdatsiooniastmete summa on võrdne süsteemi kogulaenguga.
Superoksiidi puhul: +1 + 2(-0,5) = 0

Oksüdatsiooniastmeid on lihtne määrata elektron-punkt valemite abil, milles üksikud elektronpaarid ja kovalentsete sidemete elektronid on tähistatud punktidega.

Hapnik on VIA rühma element, seetõttu on selle aatomil 6 valentselektroni. Kujutagem ette, et veemolekulis on sidemed ioonsed, sel juhul võtaks hapnikuaatom vastu okteti elektrone.
Hapniku oksüdatsiooniaste on vastavalt võrdne: 6 - 8 = -2.
A vesinikuaatomid: 1 - 0 = +1
Oskus määrata oksüdatsiooniastmeid graafiliste valemite abil on selle kontseptsiooni olemuse mõistmiseks hindamatu väärtusega; seda oskust nõutakse ka orgaanilise keemia kursusel. Kui tegemist on anorgaaniliste ainetega, siis on vaja osata määrata oksüdatsiooniastmeid molekulaarvalemeid ja valemiühikuid kasutades.
Selleks peate kõigepealt mõistma, et oksüdatsiooniastmed võivad olla püsivad ja muutlikud. Konstantse oksüdatsiooniastmega elemente tuleb meeles pidada.

Iga keemilist elementi iseloomustavad kõrgemad ja madalamad oksüdatsiooniastmed.
Madalaim oksüdatsiooniaste- see on laeng, mille aatom omandab välisele elektronkihile maksimaalse arvu elektronide vastuvõtmise tulemusena.
Seda silmas pidades madalaimal oksüdatsiooniastmel on negatiivne väärtus, välja arvatud metallid, mille aatomid ei võta kunagi elektrone vastu madala elektronegatiivsuse tõttu. Metallide madalaim oksüdatsiooniaste on 0.
Enamik peamiste alarühmade mittemetalle üritab täita oma välist elektronkihti kuni kaheksa elektroniga, mille järel aatom omandab stabiilse konfiguratsiooni ( okteti reegel). Seetõttu on madalaima oksüdatsiooniastme määramiseks vaja mõista, kui palju valentselektrone puudub aatomil oktetini jõudmiseks.
Näiteks lämmastik on rühma VA element, mis tähendab, et lämmastikuaatomil on viis valentselektroni. Lämmastikuaatomil on oktetist kolm elektroni puudu. See tähendab, et lämmastiku madalaim oksüdatsiooniaste on: 0 + (-3) = -3
Elementide oleku iseloomustamiseks ühendites võeti kasutusele oksüdatsiooniastme mõiste. Oksüdatsiooniaste viitab ühendis oleva aatomi tingimuslikule laengule, mis arvutatakse eeldusel, et ühend koosneb ioonidest. Oksüdatsiooniastet tähistatakse araabia numbriga, mis asetatakse elemendi sümboli ette koos elektronide kadumisele või omandamisele vastava märgiga “+” või “−”. Oksüdatsiooniaste on lihtsalt mugav vorm elektronide ülekande arvestamiseks ja seda ei tohiks pidada molekulis oleva aatomi efektiivseks laenguks (näiteks LiF molekulis on Li ja F efektiivsed laengud +0,89 ja − vastavalt 0,89, samas kui oksüdatsiooniastmed on +1 ja -1), ega ka elemendi valentsina (näiteks ühendites CH 4, CH 3 OH, HCOOH, CO 2 on süsiniku valentsus 4 ja oksüdatsiooniastmed on vastavalt –4, –2, +2, +4).
Valentsi ja oksüdatsiooniastme arvväärtused võivad absoluutväärtuses kokku langeda ainult siis, kui moodustuvad ioonsete sidemetega ühendid. Oksüdatsiooniastme määramisel kasutatakse järgmisi reegleid:
1. Vabas olekus või lihtainete molekulide kujul olevate elementide aatomite oksüdatsiooniaste on võrdne nulliga, näiteks Fe, Cu, H 2, N 2 jne.
2. Üheaatomilise iooni kujul oleva elemendi oksüdatsiooniaste ioonse struktuuriga ühendis on võrdne selle iooni laenguga, näiteks
3. Enamiku ühendite vesiniku oksüdatsiooniaste on +1, välja arvatud metallhüdriidid (NaH, LiH), milles vesiniku oksüdatsiooniaste on −1.
Kõige tavalisem hapniku oksüdatsiooniaste ühendites on –2, välja arvatud peroksiidid (Na 2 O 2, H 2 O 2 - hapniku oksüdatsiooniaste on –1) ja F 2 O (hapniku oksüdatsiooniaste on + 2).
Muutuva oksüdatsiooniastmega elementide puhul saab selle väärtuse välja arvutada, teades ühendi valemit ja võttes arvesse, et molekuli kõigi aatomite oksüdatsiooniastmete summa on null. Keerulises ioonis on see summa võrdne iooni laenguga. Näiteks klooriaatomi oksüdatsiooniaste HClO 4 molekulis, mis arvutatakse molekuli kogulaengu = 0 alusel, x on klooriaatomi oksüdatsiooniaste), on +7. Väävliaatomi oksüdatsiooniaste SO ioonis on +6.
Elemendi redoksomadused sõltuvad selle oksüdatsiooniastmest. Eristatakse sama elemendi aatomeid madalaim , kõrgemale Ja vahepealsed oksüdatsiooniastmed.
Teades elemendi oksüdatsiooniastet ühendis, on võimalik ennustada, kas sellel ühendil on oksüdeerivad või redutseerivad omadused.
Vaatleme näiteks väävel S ja selle ühendeid H 2 S, SO 2 ja SO 3. Seos väävliaatomi elektronstruktuuri ja selle redoks-omaduste vahel nendes ühendites on selgelt toodud tabelis 7.1.
 Mis on sõna morfoloogiline analüüs: näide kõigist kõneosadest
Mis on sõna morfoloogiline analüüs: näide kõigist kõneosadest Millistel nimisõnadel pole sugu?
Millistel nimisõnadel pole sugu?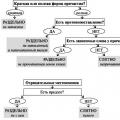 Reeglid mitte lühikeste osalausetega kirjutamiseks
Reeglid mitte lühikeste osalausetega kirjutamiseks