ផ្តល់ការពិពណ៌នាពេញលេញនៃដំណើរការចំហេះគីមីខាងក្រោម។ ចំណាត់ថ្នាក់នៃប្រតិកម្មគីមី
ដំណើរការគីមី-បច្ចេកវិទ្យា និងខ្លឹមសាររបស់វា។
ដំណើរការបច្ចេកវិជ្ជាគីមីគឺជាសំណុំនៃប្រតិបត្តិការដែលធ្វើឱ្យវាអាចទទួលបានផលិតផលគោលដៅពីវត្ថុធាតុដើមដើម។ ប្រតិបត្តិការទាំងអស់នេះគឺជាផ្នែកមួយនៃដំណាក់កាលសំខាន់បីដែលជាលក្ខណៈនៃដំណើរការបច្ចេកវិជ្ជាគីមីស្ទើរតែទាំងអស់។
នៅដំណាក់កាលដំបូង ប្រតិបត្តិការចាំបាច់ដើម្បីរៀបចំសារធាតុចាប់ផ្តើមសម្រាប់ប្រតិកម្មគីមីត្រូវបានអនុវត្ត។ ជាពិសេស សារធាតុ reagents ត្រូវបានផ្ទេរទៅរដ្ឋដែលមានប្រតិកម្មច្រើនបំផុត។ ជាឧទាហរណ៍ វាត្រូវបានគេដឹងថាអត្រានៃប្រតិកម្មគីមីយ៉ាងខ្លាំងអាស្រ័យទៅលើសីតុណ្ហភាព ដូច្នេះសារធាតុប្រតិកម្មត្រូវបានកំដៅជាញឹកញាប់មុនពេលប្រតិកម្មកើតឡើង។ ដើម្បីបង្កើនប្រសិទ្ធភាពនៃដំណើរការ និងកាត់បន្ថយទំហំនៃឧបករណ៍ វត្ថុធាតុដើមឧស្ម័នត្រូវបានបង្ហាប់ទៅសម្ពាធជាក់លាក់មួយ។ ដើម្បីលុបបំបាត់ផលប៉ះពាល់ និងទទួលបានផលិតផលដែលមានគុណភាពខ្ពស់ វត្ថុធាតុដើមត្រូវបានបន្សុតចេញពីភាពមិនបរិសុទ្ធពីបរទេស ដោយប្រើវិធីសាស្រ្តដោយផ្អែកលើភាពខុសគ្នានៃលក្ខណៈសម្បត្តិរូបវន្ត (ការរលាយក្នុងសារធាតុរំលាយផ្សេងៗ ដង់ស៊ីតេ ការកកិត និងសីតុណ្ហភាពគ្រីស្តាល់។ល។)។ នៅពេលបន្សុទ្ធវត្ថុធាតុដើមនិងល្បាយប្រតិកម្មបាតុភូតនៃការផ្ទេរកំដៅនិងម៉ាស់និងដំណើរការ hydromechanical ត្រូវបានគេប្រើយ៉ាងទូលំទូលាយ។ វិធីសាស្ត្រសម្អាតគីមីក៏អាចប្រើបានដែរ ដោយផ្អែកលើប្រតិកម្មគីមី ជាលទ្ធផលនៃសារធាតុមិនបរិសុទ្ធដែលមិនចាំបាច់ត្រូវបានបំប្លែងទៅជាសារធាតុងាយបំបែក។
នៅដំណាក់កាលបន្ទាប់ សារធាតុដែលត្រូវបានរៀបចំយ៉ាងត្រឹមត្រូវត្រូវបានទទួលរងនូវប្រតិកម្មគីមី ដែលអាចមានដំណាក់កាលជាច្រើន។ នៅចន្លោះពេលរវាងដំណាក់កាលទាំងនេះ ជួនកាលចាំបាច់ត្រូវប្រើឡើងវិញនូវកំដៅ និងការផ្ទេរម៉ាស់ និងដំណើរការរាងកាយផ្សេងទៀត។ ឧទាហរណ៍នៅក្នុងការផលិតអាស៊ីតស៊ុលហ្វួរីតស្ពាន់ធ័រឌីអុកស៊ីតត្រូវបានកត់សុីដោយផ្នែកទៅជាទ្រីអុកស៊ីតបន្ទាប់មកល្បាយប្រតិកម្មត្រូវបានធ្វើឱ្យត្រជាក់ស្ពាន់ធ័រ trioxide ត្រូវបានយកចេញពីវាដោយការស្រូបយកហើយម្តងទៀតត្រូវបានបញ្ជូនទៅអុកស៊ីតកម្ម។
ជាលទ្ធផលនៃប្រតិកម្មគីមី ល្បាយនៃផលិតផល (គោលដៅ ផលិតផល អនុផល) និងសារធាតុប្រតិកម្មដែលមិនមានប្រតិកម្មត្រូវបានទទួល។ ប្រតិបត្តិការចុងក្រោយនៃដំណាក់កាលចុងក្រោយត្រូវបានផ្សារភ្ជាប់ជាមួយនឹងការបំបែកនៃល្បាយនេះ ដែលដំណើរការនៃការផ្ទេរ hydromechanical កំដៅ និងម៉ាស់ត្រូវបានប្រើប្រាស់ម្តងទៀត ឧទាហរណ៍៖ ការច្រោះ ការ centrifugation ការកែតម្រូវ ការស្រូបយក ការស្រង់ចេញ។ល។ ផលិតផលប្រតិកម្មត្រូវបានបញ្ជូនទៅ ឃ្លាំងផលិតផលសម្រេច ឬសម្រាប់ដំណើរការបន្ត។ វត្ថុធាតុដើមដែលមិនមានប្រតិកម្មត្រូវបានប្រើប្រាស់ម្តងទៀតក្នុងដំណើរការរៀបចំការកែច្នៃរបស់វា។
នៅគ្រប់ដំណាក់កាលទាំងអស់ និងជាពិសេសនៅដំណាក់កាលចុងក្រោយ ការងើបឡើងវិញនៃសម្ភារៈបន្ទាប់បន្សំ និងធនធានថាមពលក៏ត្រូវបានអនុវត្តផងដែរ។ ស្ទ្រីមនៃសារធាតុឧស្ម័ន និងរាវដែលចូលទៅក្នុងបរិស្ថានត្រូវបានទទួលរងនូវការបន្សុត និងអព្យាក្រឹតភាពនៃសារធាតុមិនបរិសុទ្ធដែលមានគ្រោះថ្នាក់។ សំណល់រឹងត្រូវបានបញ្ជូនសម្រាប់ដំណើរការបន្ថែម ឬដាក់សម្រាប់រក្សាទុកក្នុងលក្ខខណ្ឌសុវត្ថិភាពបរិស្ថាន។
ដូច្នេះ ដំណើរការបច្ចេកវិជ្ជាគីមីទាំងមូល គឺជាប្រព័ន្ធដ៏ស្មុគស្មាញមួយដែលមានដំណើរការអន្តរកម្មបុគ្គល (ធាតុ) និងអន្តរកម្មជាមួយបរិស្ថាន។
ធាតុនៃប្រព័ន្ធគីមី - បច្ចេកវិទ្យាគឺជាដំណើរការដែលបានចុះបញ្ជីខាងលើនៃការផ្ទេរកំដៅនិងម៉ាស់ អ៊ីដ្រូមេកានិក គីមី។ល។ ពួកគេត្រូវបានគេចាត់ទុកថាជាដំណើរការតែមួយនៃបច្ចេកវិទ្យាគីមី។
ប្រព័ន្ធរងសំខាន់នៃដំណើរការបច្ចេកវិជ្ជាគីមីស្មុគស្មាញគឺដំណើរការគីមី។
ដំណើរការគីមី គឺជាប្រតិកម្មគីមីមួយ ឬច្រើន ដែលអមដោយបាតុភូតនៃការផ្ទេរកំដៅ ម៉ាស និងសន្ទុះ មានឥទ្ធិពលលើគ្នាទៅវិញទៅមក និងដំណើរនៃប្រតិកម្មគីមី។
ការវិភាគលើដំណើរការបុគ្គល និងឥទ្ធិពលទៅវិញទៅមក អនុញ្ញាតឱ្យយើងបង្កើតរបបបច្ចេកវិទ្យា។
របបបច្ចេកវិទ្យាគឺជាសំណុំនៃប៉ារ៉ាម៉ែត្របច្ចេកវិទ្យា (សីតុណ្ហភាព សម្ពាធ កំហាប់សារធាតុប្រតិកម្ម។ល។) ដែលកំណត់លក្ខខណ្ឌប្រតិបត្តិការរបស់ឧបករណ៍ ឬប្រព័ន្ធបរិធាន (ដ្យាក្រាមលំហូរដំណើរការ)។
លក្ខខណ្ឌនៃដំណើរការល្អបំផុតគឺជាការរួមបញ្ចូលគ្នានៃប៉ារ៉ាម៉ែត្រមូលដ្ឋាន (សីតុណ្ហភាព សម្ពាធ សមាសភាពនៃល្បាយប្រតិកម្មដំបូង។ វត្ថុធាតុដើម និងថាមពល និងកាត់បន្ថយការខូចខាតដែលអាចកើតមានចំពោះបរិស្ថានបរិស្ថាន។
ដំណើរការឯកតាកើតឡើងនៅក្នុងឧបករណ៍ផ្សេងៗ - រ៉េអាក់ទ័រគីមី ជួរឈរស្រូប និងចម្រោះ ឧបករណ៍ផ្លាស់ប្តូរកំដៅ។ល។ បរិធាននីមួយៗត្រូវបានភ្ជាប់ទៅក្នុងដ្យាក្រាមលំហូរដំណើរការ។
គ្រោងការណ៍បច្ចេកវិទ្យាគឺជាប្រព័ន្ធដែលបង្កើតដោយសមហេតុផលនៃឧបករណ៍នីមួយៗដែលតភ្ជាប់ដោយប្រភេទនៃការតភ្ជាប់ផ្សេងៗ (ដោយផ្ទាល់, បញ្ច្រាស, បន្តបន្ទាប់គ្នា, ប៉ារ៉ាឡែល) ដែលធ្វើឱ្យវាអាចទទួលបានផលិតផលដែលមានគុណភាពដែលបានផ្តល់ឱ្យពីវត្ថុធាតុដើមធម្មជាតិ ឬផលិតផលពាក់កណ្តាលសម្រេច។
គ្រោងការណ៍បច្ចេកវិជ្ជាអាចបើកចំហរឬបិទហើយអាចមានលំហូរឆ្លងកាត់ (ផ្លូវវាង) និងការកែច្នៃឡើងវិញដែលធ្វើឱ្យវាអាចធ្វើទៅបានដើម្បីបង្កើនប្រសិទ្ធភាពនៃប្រព័ន្ធបច្ចេកវិជ្ជាគីមីទាំងមូល។
ការអភិវឌ្ឍន៍និងការសាងសង់គ្រោងការណ៍បច្ចេកវិជ្ជាសមហេតុផលគឺជាកិច្ចការសំខាន់នៃបច្ចេកវិទ្យាគីមី។
ការចាត់ថ្នាក់នៃប្រតិកម្មគីមីដែលស្ថិតនៅក្រោមដំណើរការបច្ចេកវិជ្ជាគីមីឧស្សាហកម្ម
នៅក្នុងគីមីវិទ្យាទំនើប មួយចំនួនធំនៃប្រតិកម្មគីមីផ្សេងគ្នាត្រូវបានគេស្គាល់។ ពួកវាជាច្រើនត្រូវបានអនុវត្តនៅក្នុងរ៉េអាក់ទ័រគីមីឧស្សាហកម្ម ហើយដូច្នេះក្លាយជាវត្ថុនៃការសិក្សាអំពីបច្ចេកវិទ្យាគីមី។
ដើម្បីជួយសម្រួលដល់ការសិក្សាអំពីបាតុភូតដែលមានលក្ខណៈស្រដៀងគ្នា វាជាទម្លាប់ក្នុងវិទ្យាសាស្ត្រដើម្បីចាត់ថ្នាក់ពួកវាទៅតាមលក្ខណៈទូទៅ។ ដោយផ្អែកលើលក្ខណៈអ្វីដែលត្រូវបានគេយកជាមូលដ្ឋានមានប្រភេទជាច្រើននៃការចាត់ថ្នាក់នៃប្រតិកម្មគីមី។
ប្រភេទសំខាន់នៃការចាត់ថ្នាក់គឺការចាត់ថ្នាក់ដោយ យន្តការនៃប្រតិកម្ម។មានប្រតិកម្មសាមញ្ញ (ដំណាក់កាលតែមួយ) និងស្មុគស្មាញ (ច្រើន) ជាពិសេស ប៉ារ៉ាឡែល បន្តបន្ទាប់ និងស៊េរី-ប៉ារ៉ាឡែល។
ប្រតិកម្មដែលទាមទារឱ្យយកឈ្នះឧបសគ្គថាមពលតែមួយ (ដំណាក់កាលមួយ) ត្រូវបានគេហៅថាសាមញ្ញ។
ប្រតិកម្មស្មុគស្មាញរួមមានដំណាក់កាលប៉ារ៉ាឡែល ឬបន្តបន្ទាប់គ្នាជាច្រើន (ប្រតិកម្មសាមញ្ញ)។
ប្រតិកម្មមួយជំហានពិតប្រាកដគឺកម្រណាស់។ ទោះជាយ៉ាងណាក៏ដោយ ប្រតិកម្មស្មុគ្រស្មាញមួយចំនួនដែលឆ្លងកាត់ដំណាក់កាលមធ្យមមួយចំនួនត្រូវបានចាត់ទុកថាសាមញ្ញជាផ្លូវការ។ វាអាចទៅរួចក្នុងករណីដែលផលិតផលប្រតិកម្មកម្រិតមធ្យមមិនត្រូវបានរកឃើញនៅក្រោមលក្ខខណ្ឌនៃបញ្ហាដែលកំពុងពិចារណា។
ចំណាត់ថ្នាក់នៃប្រតិកម្ម ដោយម៉ូលេគុលយកទៅក្នុងគណនីថាតើម៉ូលេគុលប៉ុន្មានត្រូវបានចូលរួមនៅក្នុងប្រតិកម្មបឋមមួយ; មានប្រតិកម្ម mono-, bi- និង trimolecular ។
ទម្រង់នៃសមីការ kinetic (ការពឹងផ្អែកនៃអត្រាប្រតិកម្មលើកំហាប់នៃសារធាតុ reagents) អនុញ្ញាតឱ្យចាត់ថ្នាក់ តាមលំដាប់នៃប្រតិកម្ម។លំដាប់ប្រតិកម្មគឺជាផលបូកនៃនិទស្សន្តនៃការប្រមូលផ្តុំនៃប្រតិកម្មនៅក្នុងសមីការ kinetic ។ មានប្រតិកម្មនៃលំដាប់ទីមួយ ទីពីរ ទីបី និងប្រភាគ។
ប្រតិកម្មគីមីក៏ត្រូវបានសម្គាល់ផងដែរ។ ដោយឥទ្ធិពលកម្ដៅ។នៅពេលដែលប្រតិកម្មខាងក្រៅកើតឡើង អមដោយការបញ្ចេញកំដៅ ( សំណួរ> 0), enthalpy នៃប្រព័ន្ធប្រតិកម្មថយចុះ ( ∆H < 0); при протекании эндотермических реакций, сопровождающихся поглощением теплоты (សំណួរ< 0) មានការកើនឡើងនៃ enthalpy នៃប្រព័ន្ធប្រតិកម្ម ( ∆H> 0).
សម្រាប់ការជ្រើសរើសការរចនានៃរ៉េអាក់ទ័រគីមី និងវិធីសាស្រ្តសម្រាប់គ្រប់គ្រងដំណើរការវាចាំបាច់ណាស់។ សមាសភាពដំណាក់កាលប្រព័ន្ធប្រតិកម្ម។
អាស្រ័យលើចំនួនដំណាក់កាល (មួយ ឬច្រើន) នៃការបង្កើតសារធាតុប្រតិកម្ម និងផលិតផលប្រតិកម្មដំបូង ប្រតិកម្មគីមីត្រូវបានបែងចែកទៅជា homophase និង heterophase ។
ប្រតិកម្មដែលសារធាតុចាប់ផ្តើម អន្តរការីមានស្ថេរភាព និងផលិតផលប្រតិកម្មគឺស្ថិតនៅក្នុងដំណាក់កាលតែមួយត្រូវបានគេហៅថា homophasic ។
ប្រតិកម្មដែលសារធាតុចាប់ផ្តើម អន្តរការីមានស្ថេរភាព និងផលិតផលប្រតិកម្មបង្កើតបានច្រើនជាងមួយដំណាក់កាល ត្រូវបានគេហៅថា heterophasic ។
អាស្រ័យលើ តំបន់លំហូរប្រតិកម្មត្រូវបានបែងចែកជាប្រតិកម្មដូចគ្នានិងតំណពូជ។
គំនិតនៃប្រតិកម្ម "ដូចគ្នា" និង "ខុសគ្នា" មិនស្របគ្នានឹងគំនិតនៃដំណើរការ "homophasic" និង "heterophasic" ទេ។ ភាពដូចគ្នា។ លក្ខណៈ homophasic និង heterophasic នៃដំណើរការអនុញ្ញាតឱ្យយើងវិនិច្ឆ័យសមាសភាពដំណាក់កាលនៃអ្នកចូលរួមក្នុងប្រតិកម្ម។
ក្នុងករណីមានប្រតិកម្មដូចគ្នា ប្រតិកម្ម និងផលិតផលស្ថិតក្នុងដំណាក់កាលដូចគ្នា (រាវ ឬឧស្ម័ន) ហើយប្រតិកម្មដំណើរការក្នុងកម្រិតសំឡេងនៃដំណាក់កាលនេះ។ ឧទាហរណ៍ ការកត់សុីនៃអុកស៊ីដអាសូតជាមួយនឹងអុកស៊ីសែនបរិយាកាសក្នុងការផលិតអាស៊ីតនីទ្រីកគឺជាប្រតិកម្មដំណាក់កាលឧស្ម័ន ហើយប្រតិកម្មអេស្ត្រូហ្វីក (ការផលិតអេស្ត្រូពីអាស៊ីតសរីរាង្គ និងជាតិអាល់កុល) គឺជាដំណាក់កាលរាវ។
នៅពេលដែលមានប្រតិកម្មខុសធម្មតាកើតឡើង យ៉ាងហោចណាស់ប្រតិកម្ម ឬផលិតផលមួយស្ថិតនៅក្នុងស្ថានភាពដំណាក់កាលដែលខុសពីស្ថានភាពដំណាក់កាលនៃអ្នកចូលរួមផ្សេងទៀត ហើយចំណុចប្រទាក់ដំណាក់កាលត្រូវតែយកមកពិចារណានៅពេលវិភាគវា។ ឧទាហរណ៍ អព្យាក្រឹតភាពនៃអាស៊ីតជាមួយអាល់កាឡាំង គឺជាដំណើរការ homophasic ដូចគ្នា។ ការសំយោគកាតាលីករនៃអាម៉ូញាក់គឺជាដំណើរការ homophasic heterogeneous ។ ការកត់សុីនៃអ៊ីដ្រូកាបូនក្នុងដំណាក់កាលរាវដោយឧស្ម័នអុកស៊ីហ្សែនគឺជាដំណើរការ heterophasic ប៉ុន្តែប្រតិកម្មគីមីដែលកើតឡើងគឺដូចគ្នាបេះបិទ។ Slaking នៃ lime CaO + H 2 O Ca (OH) 2 ដែលក្នុងនោះអ្នកចូលរួមទាំងបីនៅក្នុងប្រតិកម្មបង្កើតជាដំណាក់កាលដាច់ដោយឡែក ហើយប្រតិកម្មកើតឡើងនៅចំនុចប្រទាក់រវាងទឹក និងកាល់ស្យូមអុកស៊ីដ គឺជាដំណើរការខុសប្រក្រតី។
អាស្រ័យលើថាតើសារធាតុពិសេស - កាតាលីករ - ត្រូវបានប្រើឬមិនប្រើដើម្បីផ្លាស់ប្តូរអត្រាប្រតិកម្ម ពួកគេត្រូវបានសម្គាល់ កាតាលីករនិង មិនកាតាលីករប្រតិកម្ម និងដំណើរការបច្ចេកវិជ្ជាគីមី។ ភាគច្រើននៃប្រតិកម្មគីមីដែលដំណើរការវិស្វកម្មគីមីឧស្សាហកម្មគឺផ្អែកលើប្រតិកម្មកាតាលីករ។
និងការបែងចែកប្រភេទដែក
- គុណភាព;
- សមាសធាតុគីមី;
- គោលបំណង;
- រចនាសម្ព័ន្ធមីក្រូ;
- កម្លាំង.
គុណភាពដែក
ដោយសមាសធាតុគីមី
ដែកថែបកាបូន ភាពមិនបរិសុទ្ធអចិន្រ្តៃយ៍
តារាង 1.3 ។
ដែកថែបកាបោន
លោហធាតុ ធាតុ សារធាតុបន្ថែមឬ សារធាតុបន្ថែម
ដែកអ៊ីណុក យ៉ាន់ស្ព័រទាប(រហូតដល់ 2.5 wt.%), លោហធាតុ(ពី 2.5 ទៅ 10 wt.%) និង alloyed ខ្ពស់។ "ក្រូម"
ដោយគោលបំណងដែក
រចនាសម្ព័ន្ធ ទាប-(ឬ ពីរបី-)និង កាបូនមធ្យម។
ឧបករណ៍ភ្លេងកាបូនខ្ពស់។
និង (ជាមួយនឹងលក្ខណៈសម្បត្តិពិសេស - ).
និង
និង បង្កើនភាពធន់ទ្រាំកំដៅ ល្បឿនលឿន ដែក
គុណភាពធម្មតា។
ដែកថែបរចនាសម្ព័ន្ធ,
ឧបករណ៍ដែក,
6) បន្ទុក (គ្រាប់បាល់) ក្លាយជា
7) ដែកថែបល្បឿនលឿន(ដែកថែបឧបករណ៍ដែលមានគុណភាពខ្ពស់ដែលមានជាតិដែកខ្ពស់ជាមួយនឹងមាតិកា tungsten ខ្ពស់) ។
8) ស្វ័យប្រវត្តិ, ឧ។សមត្ថភាពម៉ាស៊ីនកើនឡើង (ឬខ្ពស់), ក្លាយជា។
ការវិភាគនៃសមាសភាពនៃក្រុមសម្គាល់ដែកដែលបានបង្កើតជាប្រវត្តិសាស្ត្របង្ហាញថាប្រព័ន្ធសម្គាល់ដែលបានប្រើធ្វើឱ្យវាអាចធ្វើកូដកម្មលក្ខណៈចំណាត់ថ្នាក់ចំនួនប្រាំគឺ: គុណភាព, សមាសភាពគីមី, គោលបំណង, កម្រិតនៃការ deoxidation,និង វិធីសាស្រ្តនៃការទទួលបានចន្លោះ(ស្វ័យប្រវត្តិ ឬក្នុងករណីកម្រ ការបង្កើត) ។ ទំនាក់ទំនងរវាងក្រុមសម្គាល់ និងថ្នាក់ដែកត្រូវបានបង្ហាញដោយផ្នែកខាងក្រោមនៃដ្យាក្រាមប្លុកនៅក្នុងរូបភាពទី 1 ។
ប្រព័ន្ធសម្គាល់ក្រុម ច្បាប់សម្គាល់ និងគំរូនៃថ្នាក់ដែក
| កាបូន | គុណភាពធម្មតា។ | |||||||
| ក្រុមដែក | ការធានាការដឹកជញ្ជូន | ម៉ាក | ||||||
| ក | ដោយសមាសធាតុគីមី | ផ្លូវ0 | ផ្លូវលេខ 1 | ផ្លូវ ២ | ស្ត | ផ្លូវទី 4 | ផ្លូវ ៥ | ផ្លូវលេខ៦ |
| ខ | ដោយលក្ខណៈសម្បត្តិមេកានិច | BSt0 | BSt1 | BSt2 | BStZ | BSt4 | BSt5 | BSt6 |
| IN | ដោយលក្ខណៈសម្បត្តិមេកានិក និងសមាសធាតុគីមី | VSTO | VSt1 | VSt2 | VStZ | VSt4 | VSt5 | VSt6 |
| ការប្រមូលផ្តុំកាបូន, wt ។ % | 0,23 | 0,06-0,12 | 0,09-0,15 | 0,14-0,22 | 0,18-0,27 | 0,28-0,37 | 0,38-0,49 | |
| គុណភាព គុណភាពខ្ពស់ | រចនាសម្ព័ន្ធ | ឧទាហរណ៍នៃម៉ាក | ||||||
| ម៉ាក៖ ចំនួនពីរខ្ទង់នៃ HUNDREDTHS នៃភាគរយនៃកាបូន + សូចនាករនៃកម្រិតនៃការ deoxidation | 05 08kp 10 15 18kp 20A 25ps ZOA 35 40 45 50 55 ... 80 85 កំណត់សម្គាល់៖ 1) អវត្ដមាននៃសូចនាករនៃកម្រិតនៃការ deoxidation មានន័យថា "sp"; 2) "A" នៅចុងបញ្ចប់នៃសញ្ញាបង្ហាញថាដែកមានគុណភាពខ្ពស់ | |||||||
| ឧបករណ៍ | ម៉ាក | |||||||
| ម៉ាក៖ និមិត្តសញ្ញា "U" + លេខ ភាគដប់នៃ PERCENT កាបូន | U7 U7A U8 UVA U9 U9A U10 U10A U12 U12A | |||||||
| DOPED | គុណភាពខ្ពស់ គុណភាពខ្ពស់ គុណភាពខ្ពស់ គុណភាពខ្ពស់ | រចនាសម្ព័ន្ធ | ឧទាហរណ៍នៃម៉ាក | |||||
| ម៉ាក៖ ចំនួនពីរខ្ទង់នៃ HUNDREDTHS នៃកាបូនភាគរយ + និមិត្តសញ្ញាធាតុលោហធាតុ + ចំនួនគត់នៃភាគរយរបស់វា។ | 09G2 10HSND 18G2AFps 20Kh 40G 45KhN 65S2VA 110G13L កំណត់ចំណាំ៖ 1) លេខ “1” មិនត្រូវបានរាប់បញ្ចូលជាសូចនាករនៃកំហាប់ ≤ 1 wt.% នៃធាតុលោហធាតុ។ 2) ថ្នាក់ទី 110G13L គឺជាផ្នែកមួយនៃមួយចំនួនដែលចំនួនរាប់រយភាគរយនៃកាបូនគឺបីខ្ទង់ | |||||||
| ឧបករណ៍ | ឧទាហរណ៍នៃម៉ាក | |||||||
| ម៉ាក៖ ចំនួន TENTHS នៃកាបូនភាគរយ + និមិត្តសញ្ញាធាតុលោហធាតុ+ ចំនួនគត់នៃភាគរយរបស់វា។ | ЗХ2Н2МФ 4ХВ2С 5ХНМ 7X3 9ХВГ X ХВ4 9Х4МЗФ2AGСТ-Ш កំណត់សម្គាល់៖ 1) លេខ "10" មិនត្រូវបានប្រើជាសូចនាករនៃ "ដប់ភាគដប់" នៃម៉ាស់% កាបូន; 2) "-Ш" នៅចុងបញ្ចប់នៃសញ្ញាបង្ហាញថាដែកថែបមានគុណភាពខ្ពស់ជាពិសេសទទួលបានឧទាហរណ៍ដោយវិធីសាស្ត្រ electroslagរលាយ (ប៉ុន្តែមិនត្រឹមតែប៉ុណ្ណោះ) |
ដែកថែបរចនាសម្ព័ន្ធកាបូនដែលមានគុណភាពធម្មតា។
ដែកថែបជាក់លាក់នៃក្រុមសម្គាល់ដែលបានបញ្ជាក់ត្រូវបានកំណត់ដោយប្រើបន្សំអក្សរពីរ "ផ្លូវ"ដែលជាគន្លឹះ (ការបង្កើតប្រព័ន្ធ) នៅក្នុងក្រុមសម្គាល់ដែលកំពុងពិចារណា។ ថ្នាក់ដែកនៃក្រុមនេះអាចសម្គាល់បានភ្លាមៗដោយនិមិត្តសញ្ញានេះ។
និមិត្តសញ្ញា "St" ដោយគ្មានចន្លោះត្រូវបានបន្តដោយលេខដែលចង្អុលបង្ហាញ ចំនួនម៉ាក - ពី «0» មុន "6" ។
ការកើនឡើងនៃលេខថ្នាក់ត្រូវគ្នាទៅនឹងការកើនឡើងនៃមាតិកាកាបូននៅក្នុងដែកថែប ប៉ុន្តែមិនបង្ហាញពីតម្លៃជាក់លាក់របស់វានោះទេ។ ដែនកំណត់ដែលអាចអនុញ្ញាតបាននៃកំហាប់កាបូននៅក្នុងដែកថែបនៃថ្នាក់នីមួយៗត្រូវបានបង្ហាញក្នុងតារាង។ ១.៥. មាតិកាកាបូននៅក្នុង ដែកថែបកាបូនដែលមានគុណភាពធម្មតា។មិនលើសពី 0.5 wt.% ។ ដែកថែបបែបនេះគឺ hypoeutectoid យោងទៅតាមលក្ខណៈវិនិច្ឆ័យរចនាសម្ព័ន្ធហើយដូច្នេះរចនាសម្ព័ន្ធនៅក្នុងគោលបំណង។
លេខត្រូវបានបន្តដោយបន្សំអក្សរមួយក្នុងចំណោមអក្សរបីគឺ "kp", "ps", "sp" - បង្ហាញពីកម្រិតនៃការ deoxidation នៃដែក។
និមិត្តសញ្ញា "St" អាចត្រូវបាននាំមុខដោយអក្សរធំ "A", "B" ឬ "C" ឬប្រហែលជាមិនមាននិមិត្តសញ្ញាណាមួយឡើយ។ តាមរបៀបនេះព័ត៌មានត្រូវបានបញ្ជូនអំពីថាតើដែកនេះជាកម្មសិទ្ធិរបស់អ្វីដែលគេហៅថា "ក្រុមចែកចាយ": A, Bឬ IN, – អាស្រ័យលើសូចនាករដែកស្តង់ដារណាមួយដែលត្រូវបានធានាដោយអ្នកផ្គត់ផ្គង់។
ក្រុមដែក កភ្ជាប់មកជាមួយការធានានៃសមាសធាតុគីមី ឬតម្លៃដែលអាចអនុញ្ញាតបាននៃកំហាប់កាបូន និងភាពមិនបរិសុទ្ធដែលបានបញ្ជាក់ដោយ GOST ។ អក្សរ “A” ច្រើនតែមិនត្រូវបានរាប់បញ្ចូលក្នុងត្រា និងអវត្តមានរបស់វា។ លំនាំដើមមានន័យថាការធានានៃសមាសធាតុគីមី។ អ្នកប្រើប្រាស់ដែក ដោយគ្មានព័ត៌មានអំពីលក្ខណៈសម្បត្តិមេកានិក អាចបង្កើតវាតាមរយៈការព្យាបាលកំដៅសមស្រប ជម្រើសនៃរបៀបដែលទាមទារចំណេះដឹងអំពីសមាសធាតុគីមី។
ក្រុមដែក ខភ្ជាប់មកជាមួយការធានានៃលក្ខណៈសម្បត្តិមេកានិចដែលត្រូវការ។ អ្នកប្រើប្រាស់ដែកអាចកំណត់ការប្រើប្រាស់ដ៏ល្អប្រសើររបស់វានៅក្នុងរចនាសម្ព័ន្ធដោយផ្អែកលើលក្ខណៈដែលស្គាល់នៃលក្ខណៈសម្បត្តិមេកានិក ដោយមិនមានការព្យាបាលកំដៅបឋម។
ក្រុមដែក INភ្ជាប់មកជាមួយការធានាទាំងសមាសធាតុគីមី និងលក្ខណៈសម្បត្តិមេកានិច។ វាត្រូវបានប្រើដោយអ្នកប្រើប្រាស់ជាចម្បងដើម្បីបង្កើតរចនាសម្ព័ន្ធ welded ។ ចំនេះដឹងនៃលក្ខណៈសម្បត្តិមេកានិកធ្វើឱ្យវាអាចទស្សន៍ទាយឥរិយាបថនៃរចនាសម្ព័ន្ធផ្ទុកនៅក្នុងតំបន់ឆ្ងាយពីផ្សារដែក ហើយចំណេះដឹងអំពីសមាសធាតុគីមីធ្វើឱ្យវាអាចទស្សន៍ទាយបាន ហើយប្រសិនបើចាំបាច់ កែតម្រូវលក្ខណៈសម្បត្តិមេកានិកនៃ welds ដោយខ្លួនឯងដោយការព្យាបាលកំដៅ។ .
ឧទាហរណ៍នៃការកត់ត្រាត្រា ដែកថែបកាបូនដែលមានគុណភាពធម្មតា។មើលទៅដូចនេះ៖ VSt3ps, BSt6sp, St1kp .
ដែកថែបដែលមានបាល់
ដែកថែបសម្រាប់សត្វខ្លាឃ្មុំមានសញ្ញាសម្គាល់ផ្ទាល់ខ្លួនរបស់ពួកគេហើយបង្កើតជាក្រុមពិសេសមួយយោងទៅតាមគោលបំណងរបស់ពួកគេ។ រចនាសម្ព័ន្ធ ដែកថែប ទោះបីជានៅក្នុងសមាសភាព និងលក្ខណៈសម្បត្តិ ពួកវានៅជិតដែកឧបករណ៍។ ពាក្យថា "បាល់ទ្រនាប់" កំណត់ផ្នែកតូចចង្អៀតនៃការអនុវត្តរបស់ពួកគេ - សត្វខ្លាឃ្មុំរំកិល (មិនត្រឹមតែសត្វខ្លាឃ្មុំបាល់ប៉ុណ្ណោះទេប៉ុន្តែថែមទាំង roller និងម្ជុល) ។ ដើម្បីសម្គាល់វា អក្សរកាត់ "SHH" ត្រូវបានស្នើឡើង - ក្រូមីញ៉ូមដែលផ្ទុកបាល់, - បន្តដោយលេខ ភាគដប់នៃភាគរយការផ្តោតអារម្មណ៍ជាមធ្យម ក្រូមីញ៉ូម. ក្នុងចំណោមម៉ាកដែលធ្លាប់ស្គាល់យ៉ាងទូលំទូលាយ ShKh6, ShKh9 និង ShKh15 ម៉ាក ShKh15 នៅតែប្រើប្រាស់។ ភាពខុសគ្នារវាងដែកថែបដែលមានគ្រាប់បាល់ និងដែកថែបឧបករណ៍ស្រដៀងគ្នាគឺស្ថិតនៅក្នុងតម្រូវការដ៏តឹងរ៉ឹងសម្រាប់ចំនួននៃការរួមបញ្ចូលមិនមែនលោហធាតុ និងការចែកចាយឯកសណ្ឋាននៃ carbides នៅក្នុង microstructure ។
ការកែលម្អដែកថែប ShKh15 ដោយការណែនាំសារធាតុបន្ថែមយ៉ាន់ស្ព័រ (ស៊ីលីកុន និងម៉ង់ហ្គាណែស) ត្រូវបានឆ្លុះបញ្ចាំងយ៉ាងពិសេសនៅក្នុងការសម្គាល់ - រីករាលដាលដល់ ជាក់លាក់ប្រព័ន្ធនៃច្បាប់ក្រោយៗទៀតសម្រាប់ការកំណត់ធាតុលោហធាតុនៅក្នុងដែកលោហធាតុ៖ ShKh15SG, ShKh20SG ។
ដែកថែបល្បឿនលឿន
ដែកថែបដែលមានល្បឿនលឿនត្រូវបានសម្គាល់ជាពិសេសដោយអក្សរដំបូងនៃអក្ខរក្រមរុស្ស៊ី "P" ដែលត្រូវគ្នាទៅនឹងសំឡេងដំបូងនៅក្នុងពាក្យអង់គ្លេស លឿន - លឿន, លឿន. នេះត្រូវបានបន្តដោយភាគរយចំនួនគត់នៃ tungsten ។ ដូចដែលបានបញ្ជាក់រួចមកហើយ ថ្នាក់ដែកដែលមានល្បឿនលឿនបំផុតពីមុនគឺ P18 ។
ដោយសារតែភាពខ្វះខាត និងការចំណាយខ្ពស់នៃ tungsten មានការផ្លាស់ប្តូរទៅជាដែកថែប tungsten-molybdenum R6M5 ដោយគ្មានអាសូត និង R6AM5 ជាមួយអាសូត។ ស្រដៀងទៅនឹងដែកថែបដែរមានការរួមបញ្ចូលគ្នា (ប្រភេទនៃ "ការបង្កាត់") នៃប្រព័ន្ធសម្គាល់ពីរ។ ការអភិវឌ្ឍន៍ និងការអភិវឌ្ឍនៃដែកថែបល្បឿនលឿនថ្មីជាមួយ cobalt និង vanadium បានពង្រឹងឃ្លាំងអាវុធនៃថ្នាក់ "កូនកាត់": R6AM5F3, R6M4K8, 11R3AM3F2 - ហើយក៏បាននាំឱ្យមានការលេចចេញនូវដែកថែបល្បឿនលឿនដែលមិនមាន tungsten ជាទូទៅដែលត្រូវបានសម្គាល់ទាំងពីរ។ នៅក្នុងប្រព័ន្ធជាក់លាក់មួយ (R0M5F1, R0M2F3) និងតាមរបៀបថ្មីទាំងស្រុង - 9Kh6M3F3AGST-Sh, 9Kh4M3F2AGST-Sh ។
ចំណាត់ថ្នាក់នៃជាតិដែក
ជាតិដែកវណ្ណះគឺជាលោហធាតុដែក និងកាបូនដែលមានច្រើនជាង 2.14 wt.% C ។
ដែកវណ្ណះត្រូវបានចំហុយសម្រាប់កែច្នៃទៅជាដែក (បំប្លែង) ដើម្បីផលិតសារធាតុ ferroalloys ដែលដើរតួជាសារធាតុបន្ថែមលោហធាតុ និងក៏ជាយ៉ាន់ស្ព័រដែលមានបច្ចេកវិទ្យាខ្ពស់សម្រាប់ផលិតដែក (គ្រឹះ)។
កាបូនអាចមាននៅក្នុងដែកវណ្ណះក្នុងទម្រង់ជាដំណាក់កាលកាបូនខ្ពស់ពីរគឺស៊ីម៉ងត៍ (Fe 3 C) និងក្រាហ្វិច ហើយជួនកាលក្នុងពេលដំណាលគ្នាក្នុងទម្រង់ស៊ីម៉ងត៍ និងក្រាហ្វិច។ ដែកវណ្ណះ ដែលក្នុងនោះមានតែស៊ីម៉ងត៍ប៉ុណ្ណោះ ដែលផ្តល់នូវការបាក់ឆ្អឹងភ្លឺចាំង ហើយដូច្នេះត្រូវបានគេហៅថា ស. វត្តមាននៃក្រាហ្វិចផ្តល់ឱ្យជាតិដែកដែលបាក់ឆ្អឹងមានពណ៌ប្រផេះ។ ទោះជាយ៉ាងណាក៏ដោយមិនមែនដែកវណ្ណះទាំងអស់ដែលមានក្រាហ្វិចជាកម្មសិទ្ធិរបស់ថ្នាក់ដែលគេហៅថានោះទេ។ ប្រផេះជាតិដែកបានដេញ រវាងដែកវណ្ណះពណ៌ស និងពណ៌ប្រផេះ មានថ្នាក់មួយ។ ពាក់កណ្តាលចិត្តជាតិដែកបានដេញ
ពាក់កណ្តាលចិត្តដែកវណ្ណះគឺជាដែកវណ្ណះដែលនៅក្នុងរចនាសម្ព័ន្ធដែលទោះបីជាមានក្រាហ្វិចក៏ដោយក៏ស៊ីម៉ងត៍ ledeburite យ៉ាងហោចណាស់ត្រូវបានថែរក្សាដោយផ្នែកហើយដូច្នេះ ledeburite ខ្លួនវាមានវត្តមាន - សមាសធាតុរចនាសម្ព័ន្ធ eutectic ដែលមានទម្រង់ជាក់លាក់។
TO ប្រផេះរួមបញ្ចូលដែកវណ្ណះដែល ledeburite cementite បានបែកបាក់ទាំងស្រុង ហើយក្រោយមកទៀតលែងមាននៅក្នុងរចនាសម្ព័ន្ធទៀតហើយ។ ដែកវណ្ណះពណ៌ប្រផេះមាន ការរួមបញ្ចូលក្រាហ្វិចនិង មូលដ្ឋានដែក. មូលដ្ឋានដែកនេះគឺ pearlitic (eutectoid), ferritic-pearlitic (hypoeutectoid) ឬ ferritic (កាបូនទាប) ។ លំដាប់ដែលបានចង្អុលបង្ហាញនៃប្រភេទនៃមូលដ្ឋានដែកនៃដែកវណ្ណះពណ៌ប្រផេះត្រូវគ្នាទៅនឹងការកើនឡើងនៃការរលាយស៊ីម៉ង់ត៍ដែលជាផ្នែកមួយនៃ perlite ។
ជាតិដែកប្រឆាំងនឹងការកកិត
ឧទាហរណ៍នៃម៉ាក៖ ASF-1, ASF-2, ASF-3 ។
យ៉ាន់ស្ព័រពិសេសធន់នឹងកំដៅ, ធន់នឹងការ corrosionនិង ធន់នឹងកំដៅដែកវណ្ណះ៖
គំរូនៃថ្នាក់នៃដែកវណ្ណះពណ៌ប្រផេះពិសេស
ចំណាត់ថ្នាក់និងការដាក់ស្លាក
លោហធាតុ-សេរ៉ាមិច យ៉ាន់ស្ព័ររឹង
លោហធាតុ-សេរ៉ាមិករឹង គឺជាយ៉ាន់ស្ព័រដែលផលិតដោយលោហធាតុម្សៅ (លោហធាតុ-សេរ៉ាមិច) និងមានផ្ទុកនូវសារធាតុ carbides នៃលោហធាតុ refractory: WC, TiC, TaC ភ្ជាប់ដោយឧបករណ៍ចងដែកផ្លាស្ទិច ដែលភាគច្រើនជា cobalt ។
បច្ចុប្បន្ននេះយ៉ាន់ស្ព័ររឹងនៃក្រុមចំនួន 3 ត្រូវបានផលិតនៅក្នុងប្រទេសរុស្ស៊ី: tungsten, titanium-tungsten និង titanium-tungsten, – មានដូចជាការតភ្ជាប់ cobalt.
ដោយសារតែតម្លៃខ្ពស់នៃ tungsten យ៉ាន់ស្ព័ររឹងត្រូវបានបង្កើតឡើងដែលមិនមានផ្ទុក tungsten carbide ទាល់តែសោះ។ ក្នុងនាមជាដំណាក់កាលរឹងពួកគេមានតែ ទីតានីញ៉ូមកាបូនឬ ទីតានីញ៉ូមកាបូននីទ្រីត- Ti (NC) ។ តួនាទីនៃសរសៃចងប្លាស្ទិចត្រូវបានអនុវត្តដោយ ម៉ាទ្រីសនីកែល-ម៉ូលីបដិនុម. ការចាត់ថ្នាក់នៃយ៉ាន់ស្ព័ររឹងត្រូវបានបង្ហាញនៅក្នុងដ្យាក្រាមប្លុក។
ដោយអនុលោមតាមថ្នាក់ទាំងប្រាំនៃលោហៈធាតុរឹង - សេរ៉ាមិច ច្បាប់សម្គាល់ដែលមានស្រាប់បង្កើតជាក្រុមសម្គាល់ចំនួនប្រាំ។
តង់ស្តែន (ពេលខ្លះគេហៅថា tungsten-cobalt) យ៉ាន់ស្ព័ររឹង
ឧទាហរណ៍: VK3, VK6, VK8, VK10 ។
ទីតានីញ៉ូម តង់ស្តែន (ពេលខ្លះគេហៅថា titanium-tungsten-cobalt) យ៉ាន់ស្ព័ររឹង
ឧទាហរណ៍: T30K4, T15K6, T5K10, T5K12 ។
ទីតានីញ៉ូម តង់ស្ទីន តង់ស្ទីន (ពេលខ្លះគេហៅថា titanium-tantalum-tungsten-cobalt) យ៉ាន់ស្ព័ររឹង
ឧទាហរណ៍: TT7K12, TT8K6, TT10K8, TT20K9។
ជួនកាលនៅចុងបញ្ចប់នៃម៉ាក បន្សំអក្សរ ឬអក្សរត្រូវបានបន្ថែមតាមរយៈសហសញ្ញា ដែលបង្ហាញពីការបែកខ្ញែកនៃភាគល្អិត carbide នៅក្នុងម្សៅ៖
ការចាត់ថ្នាក់នៃលោហធាតុសេរ៉ាមិចរឹង
analogues បរទេសនៃថ្នាក់ក្នុងស្រុកមួយចំនួននៃដែកថែបយ៉ាន់ស្ព័រត្រូវបានផ្តល់ឱ្យក្នុងតារាង 1.1 ។
តារាង 1.1 ។
analogues បរទេសនៃថ្នាក់ក្នុងស្រុកមួយចំនួននៃដែកថែបយ៉ាន់ស្ព័រ
| ប្រទេសរុស្ស៊ី, GOST | អាល្លឺម៉ង់ DIN * | សហរដ្ឋអាមេរិក ASTM* | ជប៉ុន LS * |
| 15X | 15Cr3 | SCr415 | |
| 40X | ៤១ ស៊ី ៤ | អេសស៊ីជី ៤៤០ | |
| 30ХМ | 25CrMo4 | SСМ430,SСМ2 | |
| 12ХГ3А | 14NiCr10** | – | SNC815 |
| 20ХГНМ | 21NiCrMo2 | SNСМ220 | |
| ០៨X១៣ | Х7Сr1З ** | 410 ស | SUS410S |
| 20X13 | Х20Сг13 | SUS420J1 | |
| 12X17 | Х8Сг17 | 430 (51430 ***) | SUS430 |
| 12Х18Н9 | Х12СгNi8 ៩ | SUS302 | |
| ០៨Х១៨Н១០Т | Х10CrNiTi18 ៩ | .321 | SUS321 |
| 10Х13СУ | Х7CrA133** | 405 ** (51405) *** | SUS405** |
| 20Х25Н20С2 | Х15CrNiSi25 ២០ | 30314,314 | SSCS18, SUH310** |
* DIN (Deutsche Industrienorm), ASTM (សង្គមអាមេរិកសម្រាប់សម្ភារៈសាកល្បង), JIS (ស្តង់ដារឧស្សាហកម្មជប៉ុន)។
** ដែក, ស្រដៀងគ្នានៅក្នុងសមាសភាព; *** ស្តង់ដារ SAE
លក្ខណៈពិសេសនៃការចាត់ថ្នាក់
និងការបែងចែកប្រភេទដែក
លក្ខណៈចំណាត់ថ្នាក់ទំនើបនៃដែកថែបរួមមានៈ
- គុណភាព;
- សមាសធាតុគីមី;
- គោលបំណង;
- លក្ខណៈលោហធាតុនៃផលិតកម្ម;
- រចនាសម្ព័ន្ធមីក្រូ;
- វិធីសាស្រ្តប្រពៃណីនៃការពង្រឹង;
- វិធីសាស្រ្តប្រពៃណីនៃការទទួលបានចន្លោះឬផ្នែក;
- កម្លាំង.
ចូរយើងរៀបរាប់ដោយសង្ខេបអំពីពួកវានីមួយៗ។
គុណភាពដែកត្រូវបានកំណត់ជាចម្បងដោយមាតិកានៃសារធាតុមិនបរិសុទ្ធដែលបង្កគ្រោះថ្នាក់ - ស្ពាន់ធ័រ និងផូស្វ័រ - ហើយត្រូវបានកំណត់លក្ខណៈដោយ 4 ប្រភេទ (សូមមើលតារាង 1.2) ។
ដោយសមាសធាតុគីមីដែកថែបត្រូវបានបែងចែកជាធម្មតាទៅជាដែកថែបកាបូន (មិនមានជាតិដែក) និងដែកលោហធាតុ។
ដែកថែបកាបូនមិនមានធាតុយ៉ាន់ស្ព័រដែលបានណែនាំជាពិសេសទេ។ ធាតុដែលមាននៅក្នុងដែកថែបកាបូនក្រៅពីកាបូនគឺស្ថិតក្នុងចំណោមអ្វីដែលគេហៅថា ភាពមិនបរិសុទ្ធអចិន្រ្តៃយ៍. ការប្រមូលផ្តុំរបស់ពួកគេត្រូវតែស្ថិតនៅក្នុងដែនកំណត់ដែលកំណត់ដោយស្តង់ដាររដ្ឋពាក់ព័ន្ធ (GOSTs) ។ នៅក្នុងតារាង 1.3 ។ តម្លៃកំហាប់កម្រិតមធ្យមនៃធាតុមួយចំនួនត្រូវបានផ្តល់ឱ្យ ដែលធ្វើឱ្យវាអាចចាត់ថ្នាក់ធាតុទាំងនេះថាជាសារធាតុមិនបរិសុទ្ធជាជាងធាតុលោហធាតុ។ ដែនកំណត់ជាក់លាក់សម្រាប់មាតិកានៃភាពមិនបរិសុទ្ធនៅក្នុងដែកថែបកាបូនត្រូវបានផ្តល់ដោយស្តង់ដារ GOST ។
តារាង 1.3 ។
កំណត់ការប្រមូលផ្តុំនៃធាតុមួយចំនួនដែលអនុញ្ញាតឱ្យពួកគេចាត់ទុកថាជាសារធាតុមិនស្អាតអចិន្ត្រៃយ៍
ដែកថែបកាបោន
លោហធាតុ ធាតុជួនកាលគេហៅថា alloying សារធាតុបន្ថែមឬ សារធាតុបន្ថែមត្រូវបានណែនាំជាពិសេសទៅក្នុងដែកថែបដើម្បីទទួលបានរចនាសម្ព័ន្ធនិងលក្ខណៈសម្បត្តិដែលត្រូវការ។
ដែកអ៊ីណុកត្រូវបានបែងចែកទៅតាមកំហាប់សរុបនៃធាតុ alloying លើកលែងតែកាបូនចូលទៅក្នុង យ៉ាន់ស្ព័រទាប(រហូតដល់ 2.5 wt.%), លោហធាតុ(ពី 2.5 ទៅ 10 wt.%) និង alloyed ខ្ពស់។(ច្រើនជាង 10 wt.%) ដែលមានជាតិដែកនៅក្រោយយ៉ាងតិច 45 wt.% ។ ជាធម្មតាធាតុលោហធាតុដែលបានណែនាំផ្តល់ឱ្យដែក alloy ឈ្មោះដែលត្រូវគ្នារបស់វា: "ក្រូម"- យ៉ាន់ស្ព័រជាមួយក្រូមីញ៉ូម "ស៊ីលីកុន" - ជាមួយស៊ីលីកុន "ក្រូមស៊ីលីកុន" - ជាមួយក្រូមីញ៉ូមនិងស៊ីលីកុនក្នុងពេលតែមួយ។ល។
លើសពីនេះទៀតយ៉ាន់ស្ព័រដែលមានមូលដ្ឋានលើជាតិដែកក៏ត្រូវបានសម្គាល់ផងដែរនៅពេលដែលសមាសធាតុនៃសម្ភារៈមានជាតិដែកតិចជាង 45% ប៉ុន្តែច្រើនជាងធាតុយ៉ាន់ស្ព័រផ្សេងទៀត។
ដោយគោលបំណងដែកបែងចែកជារចនាសម្ព័ន្ធនិងឧបករណ៍។
រចនាសម្ព័ន្ធដែកថែបដែលប្រើសម្រាប់ផលិតផ្នែកម៉ាស៊ីនផ្សេងៗ យន្តការ និងរចនាសម្ព័ន្ធក្នុងវិស្វកម្មមេកានិច សំណង់ និងការផលិតឧបករណ៍ត្រូវបានពិចារណា។ ពួកវាត្រូវតែមានកម្លាំង និងភាពតឹងណែនចាំបាច់ ហើយប្រសិនបើចាំបាច់ សំណុំនៃលក្ខណៈសម្បត្តិពិសេស (ធន់នឹងសំណឹក ប៉ារ៉ាម៉ាញេទិច ជាដើម)។ ជាធម្មតាដែករចនាសម្ព័ន្ធគឺ ទាប-(ឬ ពីរបី-)និង កាបូនមធ្យម។ភាពរឹងមិនមែនជាលក្ខណៈមេកានិចដែលសម្រេចចិត្តសម្រាប់ពួកគេទេ។
ឧបករណ៍ភ្លេងត្រូវបានគេហៅថាដែកថែបដែលប្រើសម្រាប់កែច្នៃសម្ភារៈដោយការកាត់ ឬចុច ក៏ដូចជាសម្រាប់ផលិតឧបករណ៍វាស់។ ពួកគេត្រូវតែមានភាពរឹងខ្ពស់ ធន់នឹងការពាក់ កម្លាំង និងលក្ខណៈសម្បត្តិជាក់លាក់មួយចំនួនផ្សេងទៀត ឧទាហរណ៍ ធន់នឹងកំដៅ។ លក្ខខណ្ឌចាំបាច់សម្រាប់ការទទួលបានភាពរឹងខ្ពស់គឺជាបរិមាណកាបូនដែលកើនឡើង ដូច្នេះដែកឧបករណ៍ ដោយមានករណីលើកលែងដ៏កម្រគឺតែងតែ កាបូនខ្ពស់។
នៅក្នុងក្រុមនីមួយៗមានការបែងចែកលម្អិតបន្ថែមទៀតទៅតាមគោលបំណង។ រចនាសម្ព័ន្ធដែកត្រូវបានបែងចែកជា សំណង់, វិស្វកម្មនិង ដែកសម្រាប់កម្មវិធីពិសេស(ជាមួយនឹងលក្ខណៈសម្បត្តិពិសេស - ធន់នឹងកំដៅ, ធន់នឹងកំដៅ, ធន់នឹងការ corrosion, មិនម៉ាញេទិក).
ដែកថែបឧបករណ៍ត្រូវបានបែងចែកទៅជា ដែកថែបសម្រាប់ឧបករណ៍កាត់ ដែកស្លាប់និង ដែកសម្រាប់ឧបករណ៍វាស់។
លក្ខណៈសម្បត្តិទូទៅនៃដែកឧបករណ៍គឺភាពរឹងខ្ពស់ ដែលធានាបាននូវភាពធន់ទ្រាំរបស់ឧបករណ៍ចំពោះការខូចទ្រង់ទ្រាយ និងការប៉ះពាល់លើផ្ទៃរបស់វា។ ក្នុងពេលជាមួយគ្នានេះដែកសម្រាប់ឧបករណ៍កាត់គឺស្ថិតនៅក្រោមតម្រូវការជាក់លាក់មួយ - ដើម្បីរក្សាភាពរឹងខ្ពស់នៅសីតុណ្ហភាពកើនឡើង (រហូតដល់ 500...600ºС) ដែលអភិវឌ្ឍនៅគែមកាត់ក្នុងល្បឿនកាត់ខ្ពស់។ សមត្ថភាពជាក់លាក់នៃដែកថែបត្រូវបានគេហៅថារបស់វា។ ធន់ទ្រាំនឹងកំដៅ (ឬធន់ទ្រាំនឹងពណ៌ក្រហម) ។ យោងតាមលក្ខណៈវិនិច្ឆ័យដែលបានបញ្ជាក់ដែកថែបសម្រាប់ឧបករណ៍កាត់ត្រូវបានបែងចែកទៅជា មិនធន់នឹងកំដៅ ធន់នឹងកំដៅពាក់កណ្តាល ធន់នឹងកំដៅនិង បង្កើនភាពធន់ទ្រាំកំដៅ. ក្រុមពីរចុងក្រោយត្រូវបានគេស្គាល់នៅក្នុងបច្ចេកវិទ្យាថាជា ល្បឿនលឿន ដែក
ដែក Die បន្ថែមពីលើភាពរឹងខ្ពស់ ទាមទារភាពតឹងតែងខ្ពស់ ដោយសារឧបករណ៍ Die ដំណើរការក្រោមលក្ខខណ្ឌផ្ទុកឆក់។ លើសពីនេះ ឧបករណ៍សម្រាប់ការបោះត្រាក្តៅ ដែលមានទំនាក់ទំនងជាមួយដែកដែលគេឱ្យឈ្មោះថា អាចឡើងកំដៅកំឡុងពេលប្រតិបត្តិការយូរ។ ដូច្នេះដែកសម្រាប់បោះត្រាក្តៅក៏ត្រូវតែធន់នឹងកំដៅផងដែរ។
ដែកថែបសម្រាប់ឧបករណ៍វាស់ បន្ថែមពីលើភាពធន់នឹងការពាក់ខ្ពស់ ការធានាភាពត្រឹមត្រូវនៃវិមាត្រក្នុងអាយុកាលសេវាកម្មដ៏យូរ ត្រូវតែធានានូវស្ថេរភាពវិមាត្រនៃឧបករណ៍ដោយមិនគិតពីលក្ខខណ្ឌសីតុណ្ហភាពប្រតិបត្តិការ។ នៅក្នុងពាក្យផ្សេងទៀតពួកគេត្រូវតែមានមេគុណតូចបំផុតនៃការពង្រីកកំដៅ។
ចំណាត់ថ្នាក់នៃសារធាតុ inorganic ជាមួយនឹងឧទាហរណ៍នៃសមាសធាតុ
ឥឡូវនេះសូមវិភាគគ្រោងការណ៍ចំណាត់ថ្នាក់ដែលបានបង្ហាញខាងលើដោយលម្អិតបន្ថែមទៀត។
ដូចដែលយើងឃើញជាដំបូង សារធាតុអសរីរាង្គទាំងអស់ត្រូវបានបែងចែកទៅជា សាមញ្ញនិង ស្មុគស្មាញ:
សារធាតុសាមញ្ញ ទាំងនេះគឺជាសារធាតុដែលត្រូវបានបង្កើតឡើងដោយអាតូមនៃធាតុគីមីតែមួយគត់។ ឧទាហរណ៍ សារធាតុសាមញ្ញគឺ អ៊ីដ្រូសែន H2 អុកស៊ីសែន O2 ជាតិដែក Fe កាបូន C ជាដើម។
ក្នុងចំណោមសារធាតុសាមញ្ញមាន លោហធាតុ, មិនមែនលោហធាតុនិង ឧស្ម័នដ៏ថ្លៃថ្នូ៖
លោហធាតុបង្កើតឡើងដោយធាតុគីមីដែលមានទីតាំងនៅខាងក្រោមអង្កត់ទ្រូង boron-astatine ក៏ដូចជាធាតុទាំងអស់ដែលមានទីតាំងនៅក្រុមចំហៀង។
ឧស្ម័នដ៏ថ្លៃថ្នូបង្កើតឡើងដោយធាតុគីមីនៃក្រុម VIIIA ។
មិនមែនលោហធាតុត្រូវបានបង្កើតឡើងរៀងគ្នាដោយធាតុគីមីដែលស្ថិតនៅខាងលើអង្កត់ទ្រូង boron-astatine លើកលែងតែធាតុទាំងអស់នៃក្រុមរងចំហៀង និងឧស្ម័នដ៏ថ្លៃថ្នូដែលស្ថិតនៅក្នុងក្រុម VIIIA៖
ឈ្មោះនៃសារធាតុសាមញ្ញភាគច្រើនត្រូវគ្នានឹងឈ្មោះធាតុគីមីដែលអាតូមដែលពួកវាត្រូវបានបង្កើតឡើង។ ទោះជាយ៉ាងណាក៏ដោយសម្រាប់ធាតុគីមីជាច្រើនបាតុភូតនៃ allotropy គឺរីករាលដាល។ Allotropy គឺជាបាតុភូតនៅពេលដែលធាតុគីមីមួយមានសមត្ថភាពបង្កើតសារធាតុសាមញ្ញមួយចំនួន។ ឧទាហរណ៍នៅក្នុងករណីនៃធាតុគីមីអុកស៊ីសែនអត្ថិភាពនៃសមាសធាតុម៉ូលេគុលដែលមានរូបមន្ត O 2 និង O 3 គឺអាចធ្វើទៅបាន។ សារធាតុទីមួយត្រូវបានគេហៅថាអុកស៊ីហ៊្សែនតាមរបៀបដូចគ្នានឹងធាតុគីមីដែលវាត្រូវបានបង្កើតអាតូមហើយសារធាតុទីពីរ (O 3) ជាធម្មតាត្រូវបានគេហៅថាអូហ្សូន។ សារធាតុកាបូនសាមញ្ញអាចមានន័យថាការកែប្រែ allotropic របស់វា ឧទាហរណ៍ ពេជ្រ ក្រាហ្វិច ឬ ហ្វូលរីន។ ផូស្វ័រសារធាតុសាមញ្ញអាចត្រូវបានគេយល់ថាជាការកែប្រែ allotropic របស់វាដូចជាផូស្វ័រពណ៌ស ផូស្វ័រក្រហម ផូស្វ័រខ្មៅ។
សារធាតុស្មុគស្មាញ
សារធាតុស្មុគស្មាញ គឺជាសារធាតុដែលបង្កើតឡើងដោយអាតូមនៃធាតុគីមីពីរ ឬច្រើន។
ឧទាហរណ៍ សារធាតុស្មុគ្រស្មាញគឺ អាម៉ូញាក់ NH 3 អាស៊ីតស៊ុលហ្វួរិក H 2 SO 4 កំបោរ Ca (OH) 2 និងសារធាតុផ្សេងៗទៀតរាប់មិនអស់។
ក្នុងចំណោមសារធាតុអសរីរាង្គស្មុគ្រស្មាញ មាន 5 ថ្នាក់សំខាន់ៗគឺ អុកស៊ីដ មូលដ្ឋាន អ៊ីដ្រូសែន amphoteric អាស៊ីត និងអំបិល៖
អុកស៊ីដ - សារធាតុស្មុគ្រស្មាញដែលបង្កើតឡើងដោយធាតុគីមីពីរដែលមួយគឺអុកស៊ីសែននៅក្នុងស្ថានភាពអុកស៊ីតកម្ម -2 ។
រូបមន្តទូទៅនៃអុកស៊ីដអាចត្រូវបានសរសេរជា E x O y ដែល E គឺជានិមិត្តសញ្ញានៃធាតុគីមី។
នាមត្រកូលនៃអុកស៊ីដ
ឈ្មោះអុកស៊ីដនៃធាតុគីមីគឺផ្អែកលើគោលការណ៍៖
ឧទាហរណ៍:
Fe 2 O 3 - ជាតិដែក (III) អុកស៊ីដ; CuO - ទង់ដែង (II) អុកស៊ីដ; N 2 O 5 - នីទ្រីកអុកស៊ីដ (V)
ជាញឹកញយ អ្នកអាចរកឃើញព័ត៌មានថា valency នៃធាតុមួយត្រូវបានបង្ហាញក្នុងវង់ក្រចក ប៉ុន្តែនេះមិនមែនជាករណីនោះទេ។ ដូច្នេះ ជាឧទាហរណ៍ ស្ថានភាពអុកស៊ីតកម្មនៃអាសូត N 2 O 5 គឺ +5 ហើយ valence ខុសពីធម្មតាគឺបួន។
ប្រសិនបើធាតុគីមីមានស្ថានភាពអុកស៊ីតកម្មវិជ្ជមានតែមួយនៅក្នុងសមាសធាតុ នោះស្ថានភាពអុកស៊ីតកម្មមិនត្រូវបានចង្អុលបង្ហាញទេ។ ឧទាហរណ៍:
Na 2 O - សូដ្យូមអុកស៊ីដ; H 2 O - អ៊ីដ្រូសែនអុកស៊ីដ; ZnO - អុកស៊ីដស័ង្កសី។
ចំណាត់ថ្នាក់អុកស៊ីដ
អុកស៊ីដ យោងទៅតាមសមត្ថភាពបង្កើតអំបិលនៅពេលធ្វើអន្តរកម្មជាមួយអាស៊ីត ឬមូលដ្ឋានត្រូវបានបែងចែកទៅជា ការបង្កើតអំបិលនិង ការបង្កើតមិនមែនអំបិល.
មានអុកស៊ីដដែលមិនមែនជាអំបិលតិចតួច ពួកវាទាំងអស់ត្រូវបានបង្កើតឡើងដោយ nonmetals នៅក្នុងស្ថានភាពអុកស៊ីតកម្ម +1 និង +2 ។ បញ្ជីនៃអុកស៊ីដមិនបង្កើតអំបិលគួរត្រូវបានចងចាំ: CO, SiO, N 2 O, NO ។
អុកស៊ីដដែលបង្កើតជាអំបិលត្រូវបានបែងចែកទៅជា មូលដ្ឋាន, អាសុីតនិង amphoteric.
អុកស៊ីដមូលដ្ឋានទាំងនេះគឺជាអុកស៊ីដដែលនៅពេលមានប្រតិកម្មជាមួយអាស៊ីត (ឬអុកស៊ីដអាស៊ីត) បង្កើតជាអំបិល។ អុកស៊ីដមូលដ្ឋានរួមមានអុកស៊ីដលោហៈនៅក្នុងស្ថានភាពអុកស៊ីតកម្ម +1 និង +2 លើកលែងតែអុកស៊ីដ BeO, ZnO, SnO, PbO ។
អុកស៊ីដអាស៊ីតទាំងនេះគឺជាអុកស៊ីដដែលនៅពេលដែលមានប្រតិកម្មជាមួយនឹងមូលដ្ឋាន (ឬអុកស៊ីដមូលដ្ឋាន) បង្កើតជាអំបិល។ អុកស៊ីដអាស៊ីតគឺជាអុកស៊ីដស្ទើរតែទាំងអស់នៃមិនមែនលោហធាតុ លើកលែងតែ CO, NO, N 2 O, SiO ដែលមិនបង្កើតជាអំបិល ក៏ដូចជាអុកស៊ីដលោហៈទាំងអស់នៅក្នុងរដ្ឋអុកស៊ីតកម្មខ្ពស់ (+5, +6 និង +7) ។
អុកស៊ីដ amphotericត្រូវបានគេហៅថាអុកស៊ីដដែលអាចមានប្រតិកម្មទាំងអាស៊ីត និងមូលដ្ឋាន ហើយជាលទ្ធផលនៃប្រតិកម្មទាំងនេះបង្កើតជាអំបិល។ អុកស៊ីដបែបនេះបង្ហាញពីធម្មជាតិអាស៊ីត - មូលដ្ឋានពីរ ពោលគឺពួកគេអាចបង្ហាញពីលក្ខណៈសម្បត្តិនៃអុកស៊ីដអាស៊ីត និងមូលដ្ឋាន។ អុកស៊ីដ Amphoteric រួមមានអុកស៊ីដលោហៈនៅក្នុងរដ្ឋអុកស៊ីតកម្ម +3, +4 ក៏ដូចជាអុកស៊ីដ BeO, ZnO, SnO និង PbO ជាករណីលើកលែង។
លោហធាតុមួយចំនួនអាចបង្កើតជាអុកស៊ីដបង្កើតអំបិលទាំងបីប្រភេទ។ ឧទាហរណ៍ ក្រូមីញ៉ូមបង្កើតជាអុកស៊ីដមូលដ្ឋាន CrO អុកស៊ីដ amphoteric Cr 2 O 3 និងអុកស៊ីដអាស៊ីត CrO 3 ។
ដូចដែលអ្នកអាចឃើញលក្ខណៈសម្បត្តិអាស៊ីតមូលដ្ឋាននៃអុកស៊ីដលោហៈដោយផ្ទាល់អាស្រ័យលើកម្រិតនៃការកត់សុីនៃលោហៈនៅក្នុងអុកស៊ីដ: កម្រិតអុកស៊ីតកម្មកាន់តែខ្ពស់លក្ខណៈសម្បត្តិអាស៊ីតកាន់តែច្បាស់។
ហេតុផល
ហេតុផល - សមាសធាតុជាមួយរូបមន្ត Me(OH) x, កន្លែងណា xភាគច្រើនជាញឹកញាប់ស្មើនឹង 1 ឬ 2 ។
ករណីលើកលែង៖ Be(OH) 2, Zn(OH) 2, Sn(OH) 2 និង Pb(OH) 2 មិនមែនជាមូលដ្ឋានទេ ទោះបីជាមានស្ថានភាពអុកស៊ីតកម្មនៃលោហៈ +2 ក៏ដោយ។ សមាសធាតុទាំងនេះគឺជា amphoteric hydroxides ដែលនឹងត្រូវបានពិភាក្សាលម្អិតបន្ថែមទៀតនៅក្នុងជំពូកនេះ។
ចំណាត់ថ្នាក់នៃមូលដ្ឋាន
មូលដ្ឋានត្រូវបានចាត់ថ្នាក់តាមចំនួនក្រុម hydroxyl ក្នុងឯកតារចនាសម្ព័ន្ធមួយ។
មូលដ្ឋានជាមួយក្រុម hydroxo មួយ i.e. ប្រភេទ MeOH ត្រូវបានគេហៅថា មូលដ្ឋាន monoacid,ជាមួយនឹងក្រុមអ៊ីដ្រូហ្សូពីរ, ឧ។ ប្រភេទ Me (OH) 2 រៀងៗខ្លួន ជាតិអាស៊ីតល។
មូលដ្ឋានក៏ត្រូវបានបែងចែកទៅជារលាយ (អាល់កាឡាំង) និងមិនរលាយ។
អាល់កាឡាំងរួមបញ្ចូលទាំងស្រុងនូវអ៊ីដ្រូសែននៃលោហធាតុផែនដីអាល់កាឡាំង និងអាល់កាឡាំង ក៏ដូចជា thallium hydroxide TlOH ។
នាមត្រកូលនៃមូលដ្ឋាន
ឈ្មោះរបស់គ្រឹះគឺផ្អែកលើគោលការណ៍ដូចខាងក្រោមៈ
ឧទាហរណ៍:
Fe (OH) 2 - ជាតិដែក (II) អ៊ីដ្រូសែន,
Cu (OH) 2 - ទង់ដែង (II) អ៊ីដ្រូសែន។
ក្នុងករណីដែលលោហៈនៅក្នុងសារធាតុស្មុគ្រស្មាញមានស្ថានភាពអុកស៊ីតកម្មថេរវាមិនតម្រូវឱ្យចង្អុលបង្ហាញវាទេ។ ឧទាហរណ៍:
NaOH - សូដ្យូមអ៊ីដ្រូសែន;
Ca (OH) 2 - កាល់ស្យូមអ៊ីដ្រូសែន។ល។
អាស៊ីត
អាស៊ីត - សារធាតុស្មុគស្មាញដែលម៉ូលេគុលមានអាតូមអ៊ីដ្រូសែន ដែលអាចជំនួសដោយលោហធាតុ។
រូបមន្តទូទៅនៃអាស៊ីតអាចត្រូវបានសរសេរជា H x A ដែល H គឺជាអាតូមអ៊ីដ្រូសែនដែលអាចជំនួសដោយលោហៈ ហើយ A គឺជាសំណល់អាស៊ីត។
ឧទាហរណ៍ អាស៊ីតរួមមានសមាសធាតុដូចជា H2SO4 HCl HNO3 HNO2 ជាដើម។
ចំណាត់ថ្នាក់អាស៊ីត
យោងតាមចំនួនអាតូមអ៊ីដ្រូសែន ដែលអាចជំនួសដោយលោហៈ អាស៊ីតត្រូវបានបែងចែកជាៈ
- ឱ អាស៊ីតមូលដ្ឋាន៖ HF, HCl, HBr, HI, HNO 3 ;
- ឃ អាស៊ីតមូលដ្ឋាន: H 2 SO 4, H 2 SO 3, H 2 CO 3;
- ធ អាស៊ីត rehobasic៖ H 3 PO 4 , H 3 BO 3 ។
គួរកត់សម្គាល់ថាចំនួនអាតូមអ៊ីដ្រូសែននៅក្នុងករណីនៃអាស៊ីតសរីរាង្គភាគច្រើនមិនឆ្លុះបញ្ចាំងពីមូលដ្ឋានរបស់វា។ ឧទាហរណ៍អាស៊ីតអាសេទិកជាមួយនឹងរូបមន្ត CH 3 COOH ទោះបីជាមានអាតូមអ៊ីដ្រូសែនចំនួន 4 នៅក្នុងម៉ូលេគុលក៏ដោយក៏មិនមែនជា tetra- ប៉ុន្តែ monobasic ។ មូលដ្ឋាននៃអាស៊ីតសរីរាង្គត្រូវបានកំណត់ដោយចំនួនក្រុម carboxyl (-COOH) នៅក្នុងម៉ូលេគុល។
ដូចគ្នានេះផងដែរដោយផ្អែកលើវត្តមានអុកស៊ីសែននៅក្នុងម៉ូលេគុលអាស៊ីតត្រូវបានបែងចែកទៅជាគ្មានអុកស៊ីសែន (HF, HCl, HBr ។ . អាស៊ីតដែលមានអុកស៊ីហ្សែនត្រូវបានគេហៅថាផងដែរ។ អាស៊ីតអុកស៊ីត.
អ្នកអាចអានបន្ថែមអំពីការចាត់ថ្នាក់នៃអាស៊ីត។
នាមត្រកូលនៃអាស៊ីត និងសំណល់អាស៊ីត
បញ្ជីឈ្មោះ និងរូបមន្តនៃអាស៊ីត និងសំណល់អាស៊ីតខាងក្រោមគឺត្រូវតែសិក្សា។
ក្នុងករណីខ្លះ ច្បាប់មួយចំនួនខាងក្រោមអាចធ្វើឱ្យការចងចាំកាន់តែងាយស្រួល។
ដូចដែលអាចមើលឃើញពីតារាងខាងលើ ការបង្កើតឈ្មោះជាប្រព័ន្ធនៃអាស៊ីតគ្មានអុកស៊ីហ្សែន មានដូចខាងក្រោម៖
ឧទាហរណ៍:
HF - អាស៊ីត hydrofluoric;
HCl - អាស៊ីត hydrochloric;
H 2 S គឺជាអាស៊ីតអ៊ីដ្រូស៊ុលហ្វីត។
ឈ្មោះនៃសំណល់អាស៊ីតនៃអាស៊ីតគ្មានអុកស៊ីហ្សែនគឺផ្អែកលើគោលការណ៍៖
ឧទាហរណ៍ Cl - - chloride, Br - - bromide ។
ឈ្មោះនៃអាស៊ីតដែលមានអុកស៊ីហ៊្សែនត្រូវបានទទួលដោយការបន្ថែមបច្ច័យផ្សេងៗ និងការបញ្ចប់ទៅឈ្មោះនៃធាតុបង្កើតអាស៊ីត។ ឧទាហរណ៍ ប្រសិនបើធាតុបង្កើតអាស៊ីតក្នុងអាស៊ីតដែលមានអុកស៊ីហ្សែនមានស្ថានភាពអុកស៊ីតកម្មខ្ពស់បំផុត នោះឈ្មោះអាស៊ីតត្រូវបានបង្កើតដូចតទៅ៖
ឧទាហរណ៍ អាស៊ីតស៊ុលហ្វួរិក H 2 S +6 O 4 អាស៊ីត chromic H 2 Cr +6 O 4 ។
អាស៊ីតដែលមានអុកស៊ីហ៊្សែនទាំងអស់អាចត្រូវបានចាត់ថ្នាក់ជាអាស៊ីតអ៊ីដ្រូអុកស៊ីត ព្រោះវាផ្ទុកក្រុមអ៊ីដ្រូស៊ីល (OH)។ ជាឧទាហរណ៍ នេះអាចត្រូវបានគេមើលឃើញពីរូបមន្តក្រាហ្វិកខាងក្រោមនៃអាស៊ីតដែលមានអុកស៊ីហ្សែនមួយចំនួន៖
ដូច្នេះ អាស៊ីតស៊ុលហ្វួរិច អាចត្រូវបានគេហៅថា ស្ពាន់ធ័រ (VI) អ៊ីដ្រូស៊ីត អាស៊ីតនីទ្រីក - អាសូត (វី) អ៊ីដ្រូស៊ីត អាស៊ីតផូស្វ័រ - ផូស្វ័រ (វី) អ៊ីដ្រូសែន ជាដើម។ ក្នុងករណីនេះ លេខនៅក្នុងតង្កៀបកំណត់កម្រិតនៃការកត់សុីនៃធាតុបង្កើតអាស៊ីត។ កំណែនៃឈ្មោះអាស៊ីតដែលមានអុកស៊ីហ្សែននេះ ហាក់ដូចជាមិនធម្មតាសម្រាប់មនុស្សជាច្រើន ប៉ុន្តែជួនកាលឈ្មោះបែបនេះអាចត្រូវបានរកឃើញនៅក្នុង KIMs ពិតប្រាកដនៃការប្រឡងរដ្ឋបង្រួបបង្រួមក្នុងគីមីវិទ្យា នៅក្នុងភារកិច្ចលើការចាត់ថ្នាក់នៃសារធាតុអសរីរាង្គ។
Amphoteric hydroxides
Amphoteric hydroxides - អ៊ីដ្រូស៊ីតដែកបង្ហាញពីធម្មជាតិពីរ ឧ។ មានសមត្ថភាពបង្ហាញទាំងលក្ខណៈសម្បត្តិនៃអាស៊ីត និងលក្ខណៈសម្បត្តិនៃមូលដ្ឋាន។
អ៊ីដ្រូសែនលោហៈនៅក្នុងរដ្ឋអុកស៊ីតកម្ម +3 និង +4 គឺ amphoteric (ដូចជាអុកស៊ីដ) ។
ផងដែរ ជាករណីលើកលែង អ៊ីដ្រូសែន amphoteric រួមមានសមាសធាតុ Be(OH) 2, Zn(OH) 2, Sn(OH) 2 និង Pb(OH) 2 ទោះបីជាស្ថានភាពអុកស៊ីតកម្មនៃលោហៈនៅក្នុងពួកវា +2 ក៏ដោយ។
សម្រាប់អ៊ីដ្រូសែន amphoteric នៃលោហៈ tri- និង tetravalent អត្ថិភាពនៃទម្រង់ ortho- និង meta-forms គឺអាចធ្វើទៅបាន ដែលខុសគ្នាពីគ្នាទៅវិញទៅមកដោយម៉ូលេគុលទឹកមួយ។ ឧទាហរណ៍ អាលុយមីញ៉ូម(III) អ៊ីដ្រូសែនអាចមាននៅក្នុងទម្រង់អ័រថូ (Al(OH)3) ឬទម្រង់មេតា (AlO(OH)) (មេតាអ៊ីដ្រូសែន)។
ចាប់តាំងពី ដូចដែលបានបញ្ជាក់រួចមកហើយ អ៊ីដ្រូសែន amphoteric បង្ហាញទាំងលក្ខណៈសម្បត្តិនៃអាស៊ីត និងលក្ខណៈសម្បត្តិនៃមូលដ្ឋាន រូបមន្ត និងឈ្មោះរបស់វាក៏អាចត្រូវបានសរសេរខុសគ្នាដែរ៖ ជាមូលដ្ឋាន ឬជាអាស៊ីត។ ឧទាហរណ៍:
អំបិល
អំបិល - ទាំងនេះគឺជាសារធាតុស្មុគ្រស្មាញដែលមាន cations ដែក និង anions នៃសំណល់អាស៊ីត។
ឧទាហរណ៍ អំបិលរួមមានសមាសធាតុដូចជា KCl, Ca(NO 3) 2, NaHCO 3 ជាដើម។
និយមន័យដែលបានបង្ហាញខាងលើពិពណ៌នាអំពីសមាសភាពនៃអំបិលភាគច្រើនទោះជាយ៉ាងណាមានអំបិលដែលមិនស្ថិតនៅក្រោមវា។ ឧទាហរណ៍ ជំនួសឱ្យជាតិដែក អំបិលអាចមានផ្ទុកសារធាតុអាម៉ូញ៉ូម សេអ៊ីត ឬសារធាតុសរីរាង្គរបស់វា។ ទាំងនោះ។ អំបិលរួមមានសមាសធាតុដូចជាឧទាហរណ៍ (NH 4) 2 SO 4 (អាម៉ូញ៉ូមស៊ុលហ្វាត) + Cl - (មេទីលអាម៉ូញ៉ូមក្លរ) ។ល។
ភាពផ្ទុយគ្នាផងដែរចំពោះនិយមន័យនៃអំបិលខាងលើគឺជាថ្នាក់នៃអ្វីដែលគេហៅថា អំបិលស្មុគស្មាញ ដែលនឹងត្រូវបានពិភាក្សានៅចុងបញ្ចប់នៃប្រធានបទនេះ។
ចំណាត់ថ្នាក់នៃអំបិល
ម៉្យាងវិញទៀត អំបិលអាចចាត់ទុកថាជាផលិតផលនៃការជំនួសអ៊ីដ្រូសែនអ៊ីដ្រូសែន H + នៅក្នុងអាស៊ីតជាមួយ cations ផ្សេងទៀត ឬជាផលិតផលនៃការជំនួសអ៊ីយ៉ុងអ៊ីដ្រូសែននៅក្នុងមូលដ្ឋាន (ឬអ៊ីដ្រូសែន amphoteric) ជាមួយ anions ផ្សេងទៀត។
ជាមួយនឹងការជំនួសពេញលេញអ្វីដែលគេហៅថា មធ្យមឬ ធម្មតា។អំបិល។ ឧទាហរណ៍ ជាមួយនឹងការជំនួសពេញលេញនៃអ៊ីដ្រូសែន cations នៅក្នុងអាស៊ីតស៊ុលហ្វួរិកជាមួយនឹង cations សូដ្យូម អំបិលជាមធ្យម (ធម្មតា) Na 2 SO 4 ត្រូវបានបង្កើតឡើង ហើយជាមួយនឹងការជំនួសពេញលេញនៃអ៊ីយ៉ុងអ៊ីដ្រូសែននៅក្នុងមូលដ្ឋាន Ca (OH) 2 ជាមួយនឹងសំណល់អាស៊ីតនៃអ៊ីយ៉ុងនីត្រាត។ អំបិលជាមធ្យម (ធម្មតា) ត្រូវបានបង្កើតឡើង Ca(NO3)2។
អំបិលដែលទទួលបានដោយការជំនួសមិនពេញលេញនៃអ៊ីដ្រូសែន cations នៅក្នុងអាស៊ីត dibasic (ឬច្រើនជាងនេះ) ជាមួយនឹង cations ដែកត្រូវបានគេហៅថាអាស៊ីត។ ដូច្នេះនៅពេលដែល cations អ៊ីដ្រូសែននៅក្នុងអាស៊ីតស៊ុលហ្វួរិកត្រូវបានជំនួសដោយ cations សូដ្យូម នោះអំបិលអាស៊ីត NaHSO 4 ត្រូវបានបង្កើតឡើង។
អំបិលដែលត្រូវបានបង្កើតឡើងដោយការជំនួសអ៊ីយ៉ុងអ៊ីដ្រូអុកស៊ីតមិនពេញលេញនៅក្នុងមូលដ្ឋានអាស៊ីតពីរ (ឬច្រើន) ត្រូវបានគេហៅថាមូលដ្ឋាន។ អូអំបិលខ្លាំង។ ឧទាហរណ៍ ជាមួយនឹងការជំនួសមិនពេញលេញនៃអ៊ីយ៉ុងអ៊ីដ្រូសែននៅក្នុងមូលដ្ឋាន Ca(OH) 2 ជាមួយអ៊ីយ៉ុងនីត្រាត មូលដ្ឋានមួយត្រូវបានបង្កើតឡើង។ អូជម្រះអំបិល Ca(OH)NO3.
អំបិលដែលមានជាតិ cations នៃលោហៈពីរផ្សេងគ្នា និង anions នៃសំណល់អាស៊ីតនៃអាស៊ីតតែមួយត្រូវបានគេហៅថា អំបិលទ្វេដង. ដូច្នេះឧទាហរណ៍អំបិលទ្វេគឺ KNaCO 3, KMgCl 3 ។ល។
ប្រសិនបើអំបិលត្រូវបានបង្កើតឡើងដោយ cations មួយប្រភេទ និងសំណល់អាស៊ីតពីរប្រភេទ អំបិលបែបនេះត្រូវបានគេហៅថាលាយបញ្ចូលគ្នា។ ឧទាហរណ៍ អំបិលចម្រុះគឺជាសមាសធាតុ Ca(OCl)Cl, CuBrCl ជាដើម។
មានអំបិលដែលមិនស្ថិតនៅក្រោមនិយមន័យនៃអំបិលដែលជាផលិតផលនៃការជំនួសអ៊ីដ្រូសែនសេអ៊ីតនៅក្នុងអាស៊ីតជាមួយ cations ដែក ឬផលិតផលនៃការជំនួសអ៊ីយ៉ុងអ៊ីដ្រូសែននៅក្នុងមូលដ្ឋានជាមួយ anions នៃសំណល់អាស៊ីត។ ទាំងនេះគឺជាអំបិលស្មុគស្មាញ។ ឧទាហរណ៍ អំបិលស្មុគស្មាញគឺសូដ្យូម tetrahydroxozincate និង tetrahydroxoaluminate ជាមួយនឹងរូបមន្ត Na 2 និង Na រៀងគ្នា។ អំបិលស្មុគស្មាញច្រើនតែអាចត្រូវបានគេទទួលស្គាល់ក្នុងចំណោមរបស់ផ្សេងទៀតដោយវត្តមាននៃតង្កៀបការ៉េនៅក្នុងរូបមន្ត។ ទោះជាយ៉ាងណាក៏ដោយ អ្នកត្រូវយល់ថា ដើម្បីឱ្យសារធាតុមួយត្រូវបានចាត់ថ្នាក់ជាអំបិល វាត្រូវតែមាន cations មួយចំនួនក្រៅពី (ឬជំនួសឱ្យ) H + ហើយ anions ត្រូវតែមាន anions មួយចំនួនក្រៅពី (ឬជំនួស) OH - . ដូច្នេះ ជាឧទាហរណ៍ សមាសធាតុ H2 មិនមែនជារបស់ថ្នាក់នៃអំបិលស្មុគស្មាញទេ ព្រោះនៅពេលដែលវាផ្តាច់ចេញពី cations មានតែអ៊ីដ្រូសែន cations H + ប៉ុណ្ណោះដែលមានវត្តមាននៅក្នុងដំណោះស្រាយ។ ដោយផ្អែកលើប្រភេទនៃការបំបែកសារធាតុនេះគួរតែត្រូវបានចាត់ថ្នាក់ជាអាស៊ីតស្មុគស្មាញដែលគ្មានអុកស៊ីហ្សែន។ ដូចគ្នានេះដែរសមាសធាតុ OH មិនមែនជារបស់អំបិលទេពីព្រោះ សមាសធាតុនេះមាន cations + និង hydroxide ions OH -, i.e. វាគួរតែត្រូវបានចាត់ទុកថាជាគ្រឹះដ៏ទូលំទូលាយ។
នាមត្រកូលនៃអំបិល
នាមត្រកូលនៃអំបិលមធ្យម និងអាស៊ីត
ឈ្មោះអំបិលមធ្យម និងអាស៊ីតគឺផ្អែកលើគោលការណ៍៖
ប្រសិនបើស្ថានភាពអុកស៊ីតកម្មនៃលោហៈនៅក្នុងសារធាតុស្មុគស្មាញគឺថេរ នោះវាមិនត្រូវបានបង្ហាញទេ។
ឈ្មោះនៃសំណល់អាស៊ីតត្រូវបានផ្តល់ឱ្យខាងលើនៅពេលពិចារណាលើនាមត្រកូលនៃអាស៊ីត។
ឧទាហរណ៍,
Na 2 SO 4 - សូដ្យូមស៊ុលហ្វាត;
NaHSO 4 - សូដ្យូមអ៊ីដ្រូសែនស៊ុលហ្វាត;
CaCO 3 - កាល់ស្យូមកាបូណាត;
Ca (HCO 3) 2 - កាល់ស្យូមប៊ីកាបូណាត។ល។
នាមត្រកូលនៃអំបិលមូលដ្ឋាន
ឈ្មោះអំបិលសំខាន់ៗគឺផ្អែកលើគោលការណ៍៖
ឧទាហរណ៍:
(CuOH) 2 CO 3 - ទង់ដែង (II) hydroxycarbonate;
Fe (OH) 2 NO 3 - ជាតិដែក (III) dihydroxonitrate ។
នាមត្រកូលនៃអំបិលស្មុគស្មាញ
នាមត្រកូលនៃសមាសធាតុស្មុគ្រស្មាញគឺកាន់តែស្មុគស្មាញ ហើយដើម្បីឆ្លងកាត់ការប្រឡងរដ្ឋបង្រួបបង្រួម អ្នកមិនចាំបាច់ដឹងច្រើនអំពីនាមនាមនៃអំបិលស្មុគស្មាញនោះទេ។
អ្នកគួរតែអាចដាក់ឈ្មោះអំបិលស្មុគស្មាញដែលទទួលបានដោយប្រតិកម្មដំណោះស្រាយអាល់កាឡាំងជាមួយនឹងអ៊ីដ្រូសែន amphoteric ។ ឧទាហរណ៍:
*ពណ៌ដូចគ្នានៅក្នុងរូបមន្ត និងឈ្មោះបង្ហាញពីធាតុដែលត្រូវគ្នានៃរូបមន្ត និងឈ្មោះ។
ឈ្មោះអរូបីនៃសារធាតុអសរីរាង្គ
តាមឈ្មោះមិនសូវសំខាន់ យើងមានន័យថាឈ្មោះសារធាតុដែលមិនទាក់ទងគ្នា ឬខ្សោយទៅនឹងសមាសភាព និងរចនាសម្ព័ន្ធរបស់វា។ ឈ្មោះមិនសំខាន់ត្រូវបានកំណត់ជាក្បួន ទាំងដោយហេតុផលប្រវត្តិសាស្ត្រ ឬដោយលក្ខណៈសម្បត្តិរូបវន្ត ឬគីមីនៃសមាសធាតុទាំងនេះ។
បញ្ជីឈ្មោះមិនពិតនៃសារធាតុអសរីរាង្គ ដែលអ្នកត្រូវដឹង៖
| ណា ៣ | គ្រីអូលីត |
| ស៊ីអូ២ | រ៉ែថ្មខៀវ, ស៊ីលីកា |
| FeS ២ | pyrite, pyrite ជាតិដែក |
| CaSO 4 ∙2H 2 O | ហ្គីបស៊ូម |
| CaC2 | កាបូអ៊ីដ្រាតកាល់ស្យូម |
| អាល់ 4 C ៣ | កាបូនអាលុយមីញ៉ូម |
| KOH | ប៉ូតាស្យូម caustic |
| ណាអូ | សូដា caustic, soda caustic |
| H2O2 | hydrogen peroxide |
| CuSO 4 ∙5H 2 O | ស៊ុលទង់ដែង |
| NH4Cl | អាម៉ូញាក់ |
| CaCO3 | ដីស ថ្មម៉ាប ថ្មកំបោរ |
| N2O | ឧស្ម័នសើច |
| លេខ 2 | ឧស្ម័នពណ៌ត្នោត |
| NaHCO3 | ដុតនំ (ផឹក) សូដា |
| Fe3O4 | មាត្រដ្ឋានដែក |
| NH 3 ∙H 2 O (NH 4 OH) | អាម៉ូញាក់ |
| សហ | កាបូនម៉ូណូអុកស៊ីត |
| ឧស្ម័នកាបូនិក | កាបូនឌីអុកស៊ីត |
| ស៊ី.ស៊ី | carborundum (ស៊ីលីកុន carbide) |
| PH ៣ | ផូស្ហ្វីន |
| NH ៣ | អាម៉ូញាក់ |
| KClO3 | អំបិល Bertholet (ប៉ូតាស្យូមក្លរ) |
| (CuOH) 2CO3 | malachite |
| CaO | កំបោររហ័ស |
| Ca(OH) ២ | កំបោរ slaked |
| ដំណោះស្រាយទឹកថ្លានៃ Ca(OH) ២ | ទឹកកំបោរ |
| ការផ្អាកនៃរឹង Ca (OH) 2 នៅក្នុងដំណោះស្រាយ aqueous របស់វា។ | ទឹកដោះគោកំបោរ |
| K2CO3 | ប៉ូតាស្យូម |
| ណា 2 CO 3 | សូដាផេះ |
| Na 2 CO 3 ∙10H 2 O | សូដាគ្រីស្តាល់ |
| MgO | ម៉ាញ៉េស្យូម |
ធាតុគីមីដែលបង្កើតជាធម្មជាតិមានជីវិត និងគ្មានជីវិត គឺស្ថិតក្នុងចលនាថេរ ព្រោះសារធាតុដែលមានធាតុផ្សំទាំងនេះមានការប្រែប្រួលឥតឈប់ឈរ។
ប្រតិកម្មគីមី (ពីប្រតិកម្មឡាតាំង - ការប្រឆាំងភាពធន់) គឺជាការឆ្លើយតបនៃសារធាតុទៅនឹងឥទ្ធិពលនៃសារធាតុផ្សេងទៀតនិងកត្តារាងកាយ (សីតុណ្ហភាពសម្ពាធវិទ្យុសកម្ម។ ល។ ) ។
ទោះជាយ៉ាងណាក៏ដោយ និយមន័យនេះក៏ត្រូវគ្នាទៅនឹងការផ្លាស់ប្តូររូបវន្តដែលកើតឡើងជាមួយនឹងសារធាតុ - ឆ្អិន រលាយ កំណក។ ជាលទ្ធផល ពីសារធាតុដើម សារធាតុថ្មីត្រូវបានបង្កើតឡើង។
ប្រតិកម្មគីមីកើតឡើងជាបន្តបន្ទាប់ទាំងនៅក្នុងខ្លួនរបស់យើង និងនៅក្នុងពិភពលោកជុំវិញខ្លួនយើង។ ប្រតិកម្មរាប់មិនអស់ត្រូវបានចាត់ថ្នាក់តាមលក្ខណៈវិនិច្ឆ័យផ្សេងៗ។ តោះចាំសញ្ញាពីថ្នាក់ទី៨ដែលអ្នកធ្លាប់ស្គាល់រួចមកហើយ។ ដើម្បីធ្វើដូចនេះសូមងាកទៅរកការពិសោធន៍មន្ទីរពិសោធន៍។
ការពិសោធន៍មន្ទីរពិសោធន៍លេខ 3
ការជំនួសដែកសម្រាប់ទង់ដែងនៅក្នុងដំណោះស្រាយនៃទង់ដែង (II) ស៊ុលហ្វាត
ចាក់សូលុយស្យុងស្ពាន់ (II) ស៊ុលហ្វាត 2 មីលីលីត្រចូលទៅក្នុងបំពង់សាកល្បង ហើយដាក់មេដៃ ឬក្រដាស់បិទក្នុងនោះ។ តើអ្នកកំពុងសង្កេតមើលអ្វី? សរសេរសមីការប្រតិកម្មជាទម្រង់ម៉ូលេគុល និងអ៊ីយ៉ុង។ ពិចារណាដំណើរការ redox ។ ដោយផ្អែកលើសមីការម៉ូលេគុល ចាត់ថ្នាក់ប្រតិកម្មនេះទៅជាក្រុមប្រតិកម្មមួយ ឬក្រុមផ្សេងទៀតដោយផ្អែកលើលក្ខណៈដូចខាងក្រោមៈ
ឥឡូវនេះពិនិត្យមើលខ្លួនអ្នក។ CuSO 4 + Fe = FeSO 4 + Cu ។
|
យើងបានមកដល់គោលគំនិតដ៏សំខាន់មួយនៅក្នុងគីមីវិទ្យា - "អត្រានៃប្រតិកម្មគីមី" ។ វាត្រូវបានគេដឹងថាប្រតិកម្មគីមីមួយចំនួនកើតឡើងយ៉ាងឆាប់រហ័ស ខ្លះទៀតក្នុងរយៈពេលដ៏សំខាន់។ នៅពេលដែលសូលុយស្យុងប្រាក់នីត្រាតត្រូវបានបន្ថែមទៅក្នុងសូលុយស្យុងសូដ្យូមក្លរីត ជាតិសូដ្យូមក្លរីតពណ៌សនឹង precipitate ស្ទើរតែភ្លាមៗ៖
AgNO 3 + NaCl = NaNO 3 + AgCl↓ ។
ប្រតិកម្មកើតឡើងក្នុងល្បឿនដ៏ធំសម្បើមដែលអមដោយការផ្ទុះ (រូបភាព 11, 1) ។ ផ្ទុយទៅវិញ stalactites និង stalagmite លូតលាស់យឺតៗនៅក្នុងរូងថ្ម (រូបភាពទី 11, 2) ផលិតផលដែករលួយ (ច្រែះ) (រូបភាព 11, 3) វិមាន និងរូបចម្លាក់ត្រូវបានបំផ្លាញដោយទឹកភ្លៀងអាស៊ីត (រូបភាព 11, 4) ។
អង្ករ។ ដប់មួយ
ប្រតិកម្មគីមីកើតឡើងក្នុងល្បឿនដ៏ធំសម្បើម (1) និងយឺតណាស់ (2-4)
| អត្រានៃប្រតិកម្មគីមី គឺជាការផ្លាស់ប្តូរកំហាប់នៃប្រតិកម្មក្នុងមួយឯកតាពេលវេលា៖ V p = C 1 - C 2 / t ។ |
នៅក្នុងវេនការផ្តោតអារម្មណ៍ត្រូវបានគេយល់ថាជាសមាមាត្រនៃបរិមាណនៃសារធាតុមួយ (ដូចដែលអ្នកបានដឹងហើយថាវាត្រូវបានវាស់ជា moles) ទៅនឹងបរិមាណដែលវាកាន់កាប់ (គិតជាលីត្រ) ។ ពីទីនេះវាមិនពិបាកក្នុងការទាញយកឯកតារង្វាស់សម្រាប់អត្រានៃប្រតិកម្មគីមី - 1 mol / (l s) ។
សាខាពិសេសនៃគីមីវិទ្យាសិក្សាអំពីអត្រានៃប្រតិកម្មគីមីដែលត្រូវបានគេហៅថា kinetics គីមី។
ការដឹងពីច្បាប់របស់វាអនុញ្ញាតឱ្យអ្នកគ្រប់គ្រងប្រតិកម្មគីមី ធ្វើឱ្យវាដំណើរការលឿន ឬយឺត។
តើកត្តាអ្វីខ្លះកំណត់អត្រានៃប្រតិកម្មគីមី?
1. ធម្មជាតិនៃប្រតិកម្ម. ចូរយើងងាកទៅរកការពិសោធន៍។
ការពិសោធន៍មន្ទីរពិសោធន៍លេខ 4
ការពឹងផ្អែកលើអត្រានៃប្រតិកម្មគីមីលើធម្មជាតិនៃប្រតិកម្មដោយប្រើឧទាហរណ៍នៃអន្តរកម្មនៃអាស៊ីតជាមួយលោហធាតុ
| ចាក់ 1-2 មីលីលីត្រនៃអាស៊ីត hydrochloric ចូលទៅក្នុងបំពង់សាកល្បងពីរនិងកន្លែង: នៅក្នុងទី 1 - គ្រាប់ស័ង្កសីមួយនៅក្នុងទីពីរ - ដុំដែកដែលមានទំហំដូចគ្នា។ លក្ខណៈនៃសារធាតុប្រតិកម្មមួយណាដែលប៉ះពាល់ដល់អត្រានៃអន្តរកម្មអាស៊ីតជាមួយលោហៈ? ហេតុអ្វី? សរសេរសមីការប្រតិកម្មជាទម្រង់ម៉ូលេគុល និងអ៊ីយ៉ុង។ ពិចារណាពួកវាពីចំណុចនៃទិដ្ឋភាពនៃការកាត់បន្ថយអុកស៊ីតកម្ម។ បន្ទាប់មកដាក់គ្រាប់ស័ង្កសីដែលដូចគ្នាបេះបិទក្នុងបំពង់សាកល្បងពីរផ្សេងទៀត ហើយបន្ថែមដំណោះស្រាយអាស៊ីតនៃកំហាប់ដូចគ្នាទៅពួកវា៖ នៅក្នុងទី 1 - អាស៊ីតអ៊ីដ្រូក្លរីក ទីពីរ - អាស៊ីតអាសេទិក។ លក្ខណៈនៃសារធាតុប្រតិកម្មមួយណាដែលប៉ះពាល់ដល់អត្រានៃអន្តរកម្មអាស៊ីតជាមួយលោហៈ? ហេតុអ្វី? សរសេរសមីការប្រតិកម្មជាទម្រង់ម៉ូលេគុល និងអ៊ីយ៉ុង។ ពិចារណាពួកវាពីចំណុចនៃទិដ្ឋភាពនៃការកាត់បន្ថយអុកស៊ីតកម្ម។ |
2. ការប្រមូលផ្តុំនៃប្រតិកម្ម. ចូរយើងងាកទៅរកការពិសោធន៍។
ការពិសោធន៍មន្ទីរពិសោធន៍លេខ 5
ការពឹងផ្អែកលើអត្រានៃប្រតិកម្មគីមីលើកំហាប់នៃប្រតិកម្មដោយប្រើឧទាហរណ៍នៃអន្តរកម្មនៃស័ង្កសីជាមួយអាស៊ីត hydrochloric នៃកំហាប់ផ្សេងៗ
វាងាយស្រួលក្នុងការសន្និដ្ឋាន៖ កំហាប់នៃប្រតិកម្មកាន់តែខ្ពស់ អត្រានៃអន្តរកម្មរវាងពួកវាកាន់តែខ្ពស់។
កំហាប់នៃសារធាតុឧស្ម័នសម្រាប់ដំណើរការផលិតភាពដូចគ្នាត្រូវបានកើនឡើងដោយការបង្កើនសម្ពាធ។ ជាឧទាហរណ៍ នេះត្រូវបានធ្វើនៅក្នុងការផលិតអាស៊ីតស៊ុលហ្វួរិក អាម៉ូញាក់ និងជាតិអាល់កុលអេទីល។
កត្តានៃការពឹងផ្អែកនៃអត្រានៃប្រតិកម្មគីមីលើកំហាប់នៃសារធាតុប្រតិកម្មត្រូវបានគេយកមកពិចារណាមិនត្រឹមតែនៅក្នុងផលិតកម្មប៉ុណ្ណោះទេប៉ុន្តែក៏នៅក្នុងផ្នែកផ្សេងទៀតនៃសកម្មភាពរបស់មនុស្សផងដែរឧទាហរណ៍ក្នុងវេជ្ជសាស្ត្រ។ អ្នកជំងឺដែលមានជំងឺសួត ដែលអត្រានៃអន្តរកម្មនៃអេម៉ូក្លូប៊ីនឈាមជាមួយនឹងអុកស៊ីសែនក្នុងខ្យល់មានកម្រិតទាប ដកដង្ហើមបានស្រួលជាងមុន ដោយមានជំនួយពីខ្នើយអុកស៊ីសែន។
3. តំបន់ទំនាក់ទំនងនៃសារធាតុប្រតិកម្ម. ការពិសោធន៍បង្ហាញពីការពឹងផ្អែកនៃអត្រានៃប្រតិកម្មគីមីលើកត្តានេះអាចត្រូវបានអនុវត្តដោយប្រើការពិសោធន៍ខាងក្រោម។
ការពិសោធន៍មន្ទីរពិសោធន៍លេខ 6
អាស្រ័យលើអត្រានៃប្រតិកម្មគីមីលើផ្ទៃទំនាក់ទំនងនៃសារធាតុប្រតិកម្ម
សម្រាប់ប្រតិកម្មចម្រុះ៖ តំបន់ទំនាក់ទំនងធំជាងនៃសារធាតុប្រតិកម្ម អត្រាប្រតិកម្មកាន់តែខ្ពស់។.
អ្នកអាចផ្ទៀងផ្ទាត់វាពីបទពិសោធន៍ផ្ទាល់ខ្លួន។ ដើម្បីពន្លត់ភ្លើង អ្នកដាក់បន្ទះឈើតូចៗនៅក្រោមឈើ ហើយនៅក្រោមពួកវា - ក្រដាសដែលរុះរោយ ដែលភ្លើងឆេះទាំងមូល។ ផ្ទុយទៅវិញការពន្លត់ភ្លើងដោយប្រើទឹកពាក់ព័ន្ធនឹងការកាត់បន្ថយតំបន់នៃការប៉ះវត្ថុដែលឆេះជាមួយនឹងខ្យល់។
នៅក្នុងការផលិតកត្តានេះត្រូវបានយកមកពិចារណាជាពិសេសអ្វីដែលគេហៅថាគ្រែ fluidized ត្រូវបានប្រើ។ ដើម្បីបង្កើនអត្រាប្រតិកម្ម សារធាតុរឹងត្រូវបានកំទេចស្ទើរតែដល់ស្ថានភាពនៃធូលី ហើយបន្ទាប់មកសារធាតុទីពីរដែលជាធម្មតាមានឧស្ម័នត្រូវបានឆ្លងកាត់វាពីខាងក្រោម។ ការឆ្លងកាត់វាតាមរយៈវត្ថុរឹងដែលបែងចែកល្អិតល្អន់បង្កើតឥទ្ធិពលពុះ (ហេតុនេះឈ្មោះនៃវិធីសាស្ត្រ) ។ គ្រែ fluidized ត្រូវបានប្រើឧទាហរណ៍នៅក្នុងការផលិតអាស៊ីតស៊ុលហ្វួរីកនិងផលិតផលប្រេង។
ការពិសោធន៍មន្ទីរពិសោធន៍លេខ 7
ការធ្វើគំរូលើគ្រែដែលមានលំហូរ
4. សីតុណ្ហភាព. ចូរយើងងាកទៅរកការពិសោធន៍។
ការពិសោធន៍មន្ទីរពិសោធន៍លេខ ៨
ការពឹងផ្អែកលើអត្រានៃប្រតិកម្មគីមីលើសីតុណ្ហភាពនៃសារធាតុប្រតិកម្មដោយប្រើឧទាហរណ៍នៃអន្តរកម្មនៃអុកស៊ីដទង់ដែង (II) ជាមួយនឹងដំណោះស្រាយនៃអាស៊ីតស៊ុលហ្វួរីកនៅសីតុណ្ហភាពខុសៗគ្នា។
វាងាយស្រួលក្នុងការសន្និដ្ឋាន៖ សីតុណ្ហភាពកាន់តែខ្ពស់ អត្រាប្រតិកម្មកាន់តែធំ។
ជ័យលាភីរង្វាន់ណូបែលទីមួយ ដែលជាអ្នកគីមីវិទ្យាជនជាតិហូឡង់ J. X. van't Hoff បានបង្កើតច្បាប់៖
នៅក្នុងការផលិត តាមក្បួនដំណើរការគីមីដែលមានសីតុណ្ហភាពខ្ពស់ត្រូវបានប្រើប្រាស់៖ ក្នុងការរលាយដែក និងដែក ការរលាយកញ្ចក់ និងសាប៊ូ ការផលិតក្រដាស និងផលិតផលប្រេង។ល។ (រូបភាព 12)។

អង្ករ។ ១២.
ដំណើរការគីមីដែលមានសីតុណ្ហភាពខ្ពស់: 1 - ដែករលាយ; 2 - កញ្ចក់រលាយ; 3 - ការផលិតផលិតផលប្រេង
កត្តាទីប្រាំដែលល្បឿននៃប្រតិកម្មគីមីអាស្រ័យគឺកាតាលីករ។ អ្នកនឹងជួបគាត់នៅកថាខណ្ឌបន្ទាប់។
ពាក្យនិងគំនិតថ្មី។
- ប្រតិកម្មគីមី និងចំណាត់ថ្នាក់របស់វា។
- សញ្ញានៃការចាត់ថ្នាក់នៃប្រតិកម្មគីមី។
- អត្រានៃប្រតិកម្មគីមី និងកត្តាដែលវាអាស្រ័យ។
ភារកិច្ចសម្រាប់ការងារឯករាជ្យ
- តើប្រតិកម្មគីមីគឺជាអ្វី? តើអ្វីជាខ្លឹមសារនៃដំណើរការគីមី?
- ផ្តល់ការពិពណ៌នាអំពីចំណាត់ថ្នាក់ពេញលេញនៃដំណើរការគីមីខាងក្រោម៖
- ក) ការដុតផូស្វ័រ;
- ខ) អន្តរកម្មនៃដំណោះស្រាយអាស៊ីតស៊ុលហ្វួរិកជាមួយអាលុយមីញ៉ូម;
- គ) ប្រតិកម្មអព្យាក្រឹត;
- ឃ) ការបង្កើត nitric oxide (IV) ពី nitric oxide (II) និងអុកស៊ីសែន។
- ដោយផ្អែកលើបទពិសោធន៍ផ្ទាល់ខ្លួនរបស់អ្នក សូមផ្តល់ឧទាហរណ៍នៃប្រតិកម្មគីមីដែលកើតឡើងក្នុងអត្រាផ្សេងៗគ្នា។
- តើអត្រានៃប្រតិកម្មគីមីគឺជាអ្វី? តើវាអាស្រ័យលើកត្តាអ្វីខ្លះ?
- ផ្តល់ឧទាហរណ៍នៃឥទ្ធិពលនៃកត្តាផ្សេងៗលើដំណើរការគីមីជីវៈ និងឧស្សាហកម្ម។
- ដោយផ្អែកលើបទពិសោធន៍ផ្ទាល់ខ្លួន សូមផ្តល់ឧទាហរណ៍អំពីឥទ្ធិពលនៃកត្តាផ្សេងៗលើប្រតិកម្មគីមីដែលកើតឡើងក្នុងជីវិតប្រចាំថ្ងៃ។
- ហេតុអ្វីបានជាអាហារត្រូវបានរក្សាទុកក្នុងទូទឹកកក?
- ប្រតិកម្មគីមីត្រូវបានចាប់ផ្តើមនៅសីតុណ្ហភាព 100 ° C បន្ទាប់មកកើនឡើងដល់ 150 ° C ។ មេគុណសីតុណ្ហភាពនៃប្រតិកម្មនេះគឺ 2. តើអត្រានៃប្រតិកម្មគីមីនឹងកើនឡើងប៉ុន្មានដង?
ប្រតិកម្មគីមីត្រូវតែសម្គាល់ពីប្រតិកម្មនុយក្លេអ៊ែរ។ ជាលទ្ធផលនៃប្រតិកម្មគីមី ចំនួនអាតូមសរុបនៃធាតុគីមីនីមួយៗ និងសមាសធាតុអ៊ីសូតូបរបស់វាមិនផ្លាស់ប្តូរទេ។ ប្រតិកម្មនុយក្លេអ៊ែរគឺជាបញ្ហាផ្សេងគ្នា - ដំណើរការនៃការបំប្លែងនុយក្លេអ៊ែរអាតូមដែលជាលទ្ធផលនៃអន្តរកម្មរបស់វាជាមួយស្នូលផ្សេងទៀត ឬភាគល្អិតបឋម ឧទាហរណ៍ការបំប្លែងអាលុយមីញ៉ូមទៅជាម៉ាញេស្យូម៖
27 13 Al + 1 1 H = 24 12 Mg + 4 2 He
ការចាត់ថ្នាក់នៃប្រតិកម្មគីមីគឺមានច្រើនមុខ ពោលគឺវាអាចផ្អែកលើលក្ខណៈផ្សេងៗ។ ប៉ុន្តែលក្ខណៈទាំងនេះណាមួយអាចរួមបញ្ចូលប្រតិកម្មរវាងទាំងសារធាតុអសរីរាង្គ និងសារធាតុសរីរាង្គ។
ចូរយើងពិចារណាចំណាត់ថ្នាក់នៃប្រតិកម្មគីមីតាមលក្ខណៈវិនិច្ឆ័យផ្សេងៗ។
I. យោងតាមចំនួននិងសមាសភាពនៃសារធាតុប្រតិកម្ម
ប្រតិកម្មដែលកើតឡើងដោយមិនផ្លាស់ប្តូរសមាសភាពនៃសារធាតុ។
នៅក្នុងគីមីវិទ្យាអសរីរាង្គ ប្រតិកម្មបែបនេះរួមមានដំណើរការនៃការទទួលបានការកែប្រែ allotropic នៃធាតុគីមីមួយ ឧទាហរណ៍៖
C (ក្រាហ្វិច) ↔ C (ពេជ្រ)
S (orhombic) ↔ S (monoclinic)
P (ស) ↔ P (ក្រហម)
Sn (សំណប៉ាហាំងពណ៌ស) ↔ Sn (សំណប៉ាហាំងពណ៌ប្រផេះ)
3O 2 (អុកស៊ីសែន) ↔ 2O 3 (អូហ្សូន)
នៅក្នុងគីមីវិទ្យាសរីរាង្គ ប្រតិកម្មប្រភេទនេះអាចរួមបញ្ចូលប្រតិកម្ម isomerization ដែលកើតឡើងដោយមិនមានការផ្លាស់ប្តូរមិនត្រឹមតែគុណភាពប៉ុណ្ណោះទេ ប៉ុន្តែក៏មានសមាសធាតុបរិមាណនៃម៉ូលេគុលនៃសារធាតុផងដែរ ឧទាហរណ៍៖
1. Isomerization នៃ alkanes ។
ប្រតិកម្ម isomerization នៃ alkanes គឺមានសារៈសំខាន់ជាក់ស្តែងណាស់ ចាប់តាំងពីអ៊ីដ្រូកាបូននៃ isostructure មានសមត្ថភាពបំផ្ទុះទាប។
2. Isomerization នៃ alkenes ។
3. Isomerization នៃ alkynes (ប្រតិកម្មរបស់ A.E. Favorsky) ។
CH 3 - CH 2 - C = - CH ↔ CH 3 - C = - C - CH 3
អេទីលអាសេទីលីន ឌីមេទីល អាសេទីលីន
4. Isomerization នៃ haloalkanes (A. E. Favorsky, 1907) ។
5. Isomerization នៃ ammonium cyanite នៅពេលកំដៅ។

អ៊ុយរ៉េត្រូវបានសំយោគជាលើកដំបូងដោយ F. Wöhler ក្នុងឆ្នាំ 1828 ដោយ isomerizing ammonium cyanate នៅពេលកំដៅ។
ប្រតិកម្មដែលកើតឡើងជាមួយនឹងការផ្លាស់ប្តូរនៅក្នុងសមាសភាពនៃសារធាតុមួយ។
ប្រតិកម្មបែបនេះអាចបែងចែកបានបួនប្រភេទគឺការរួមបញ្ចូលគ្នា ការខូចខាត ការជំនួស និងការផ្លាស់ប្តូរ។
1. ប្រតិកម្មផ្សំគឺជាប្រតិកម្មដែលសារធាតុស្មុគស្មាញមួយត្រូវបានបង្កើតឡើងពីសារធាតុពីរឬច្រើន។
នៅក្នុងគីមីវិទ្យាអសរីរាង្គ ភាពខុសគ្នាទាំងមូលនៃប្រតិកម្មសមាសធាតុអាចត្រូវបានគេពិចារណាឧទាហរណ៍ដោយប្រើឧទាហរណ៍នៃប្រតិកម្មសម្រាប់ការផលិតអាស៊ីតស៊ុលហ្វួរីពីស្ពាន់ធ័រ៖
1. ការរៀបចំស្ពាន់ធ័រអុកស៊ីដ (IV):
S + O 2 = SO - ពីសារធាតុសាមញ្ញពីរ សារធាតុស្មុគស្មាញមួយត្រូវបានបង្កើតឡើង។
2. ការរៀបចំស្ពាន់ធ័រអុកស៊ីដ (VI):
SO 2 + 0 2 → 2SO 3 - សារធាតុស្មុគស្មាញមួយត្រូវបានបង្កើតឡើងពីសារធាតុសាមញ្ញនិងស្មុគស្មាញ។
3. ការរៀបចំអាស៊ីតស៊ុលហ្វួរីក៖
SO 3 + H 2 O = H 2 SO 4 - សារធាតុស្មុគស្មាញមួយត្រូវបានបង្កើតឡើងពីសារធាតុស្មុគស្មាញពីរ។
ឧទាហរណ៍នៃប្រតិកម្មផ្សំដែលសារធាតុស្មុគស្មាញមួយត្រូវបានបង្កើតឡើងពីសារធាតុដំបូងច្រើនជាងពីរ គឺជាដំណាក់កាលចុងក្រោយនៃការផលិតអាស៊ីតនីទ្រីក៖
4NO2 + O2 + 2H2O = 4HNO3
នៅក្នុងគីមីវិទ្យាសរីរាង្គ ប្រតិកម្មផ្សំត្រូវបានគេហៅថា "ប្រតិកម្មបន្ថែម" ។ ភាពខុសគ្នាទាំងមូលនៃប្រតិកម្មបែបនេះអាចត្រូវបានពិចារណាដោយប្រើឧទាហរណ៍នៃប្លុកប្រតិកម្មដែលបង្ហាញពីលក្ខណៈសម្បត្តិនៃសារធាតុមិនឆ្អែត ឧទាហរណ៍ អេទីឡែន៖
1. ប្រតិកម្មអ៊ីដ្រូសែន - ការបន្ថែមអ៊ីដ្រូសែន៖
CH 2 =CH 2 + H 2 → H 3 −CH ៣
អេទីន → អេតាន
2. ប្រតិកម្មជាតិទឹក - ការបន្ថែមទឹក។
3. ប្រតិកម្មវត្ថុធាតុ polymerization ។
2. ប្រតិកម្មរលាយគឺជាប្រតិកម្មដែលសារធាតុថ្មីជាច្រើនត្រូវបានបង្កើតឡើងពីសារធាតុស្មុគស្មាញមួយ។
នៅក្នុងគីមីវិទ្យាអសរីរាង្គ ភាពខុសគ្នាទាំងមូលនៃប្រតិកម្មបែបនេះអាចត្រូវបានពិចារណានៅក្នុងប្លុកនៃប្រតិកម្មសម្រាប់ផលិតអុកស៊ីសែនដោយវិធីសាស្ត្រមន្ទីរពិសោធន៍៖
1. ការរលាយនៃអុកស៊ីដបារត (II) - សារធាតុសាមញ្ញពីរត្រូវបានបង្កើតឡើងពីសារធាតុស្មុគស្មាញមួយ។
2. ការរលាយនៃប៉ូតាស្យូមនីត្រាត - ពីសារធាតុស្មុគស្មាញមួយសាមញ្ញនិងស្មុគស្មាញមួយត្រូវបានបង្កើតឡើង។
3. ការរលាយនៃសារធាតុប៉ូតាស្យូម permanganate - ពីសារធាតុស្មុគស្មាញមួយ សារធាតុស្មុគស្មាញពីរ និងសារធាតុសាមញ្ញមួយត្រូវបានបង្កើតឡើង ពោលគឺសារធាតុថ្មីចំនួនបី។
នៅក្នុងគីមីវិទ្យាសរីរាង្គប្រតិកម្ម decomposition អាចត្រូវបានពិចារណានៅក្នុងប្លុកនៃប្រតិកម្មសម្រាប់ការផលិតអេទីឡែននៅក្នុងមន្ទីរពិសោធន៍និងនៅក្នុងឧស្សាហកម្ម:
1. ប្រតិកម្មនៃការខះជាតិទឹក (ការលុបបំបាត់ទឹក) នៃអេតាណុល៖
C 2 H 5 OH → CH 2 = CH 2 + H 2 O
2. ប្រតិកម្ម dehydrogenation (ការលុបបំបាត់អ៊ីដ្រូសែន) នៃ ethane:
CH 3 -CH 3 → CH 2 = CH 2 + H 2
ឬ CH 3 -CH 3 → 2C + ZN 2
3. ប្រតិកម្មបំបែក Propane (បំបែក)៖
CH 3 -CH 2 -CH 3 → CH 2 =CH 2 + CH 4
3. ប្រតិកម្មជំនួសគឺជាប្រតិកម្មដែលអាតូមនៃសារធាតុសាមញ្ញជំនួសអាតូមនៃធាតុមួយចំនួននៅក្នុងសារធាតុស្មុគស្មាញមួយ។
នៅក្នុងគីមីវិទ្យាអសរីរាង្គឧទាហរណ៍នៃដំណើរការបែបនេះគឺជាប្លុកនៃប្រតិកម្មដែលកំណត់លក្ខណៈនៃលក្ខណៈសម្បត្តិឧទាហរណ៍នៃលោហធាតុ:
1. អន្តរកម្មនៃលោហធាតុផែនដីអាល់កាឡាំង ឬអាល់កាឡាំងជាមួយទឹក៖
2Na + 2H 2 O = 2NaOH + H ២
2. អន្តរកម្មនៃលោហៈជាមួយអាស៊ីតក្នុងដំណោះស្រាយ៖
Zn + 2HCl = ZnСl 2 + H 2
3. អន្តរកម្មនៃលោហៈជាមួយអំបិលក្នុងដំណោះស្រាយ៖
Fe + CuSO 4 = FeSO 4 + Cu
4. Metallothermy:
2Al + Cr 2 O 3 → Al 2 O 3 + 2Сr
ប្រធានបទនៃការសិក្សាគីមីសរីរាង្គមិនមែនជាសារធាតុសាមញ្ញទេ ប៉ុន្តែមានតែសមាសធាតុប៉ុណ្ណោះ។ ដូច្នេះ ជាឧទាហរណ៍នៃប្រតិកម្មជំនួស យើងបង្ហាញលក្ខណៈសម្បត្តិលក្ខណៈភាគច្រើននៃសមាសធាតុឆ្អែត ជាពិសេសមេតាន - សមត្ថភាពនៃអាតូមអ៊ីដ្រូសែនរបស់វាត្រូវបានជំនួសដោយអាតូម halogen ។ ឧទាហរណ៏មួយទៀតគឺ bromination នៃសមាសធាតុក្រអូប (benzene, toluene, aniline) ។
C 6 H 6 + Br 2 → C 6 H 5 Br + HBr
benzene → bromobenzene
ចូរយើងយកចិត្តទុកដាក់លើភាពប្លែកនៃប្រតិកម្មជំនួសនៅក្នុងសារធាតុសរីរាង្គ៖ ជាលទ្ធផលនៃប្រតិកម្មបែបនេះ មិនមែនជាសារធាតុសាមញ្ញ និងស្មុគស្មាញត្រូវបានបង្កើតឡើង ដូចនៅក្នុងគីមីវិទ្យាអសរីរាង្គ ប៉ុន្តែសារធាតុស្មុគស្មាញពីរ។
នៅក្នុងគីមីវិទ្យាសរីរាង្គ ប្រតិកម្មជំនួសក៏រួមបញ្ចូលផងដែរនូវប្រតិកម្មមួយចំនួនរវាងសារធាតុស្មុគស្មាញពីរ ឧទាហរណ៍ nitration នៃ benzene ។ វាគឺជាប្រតិកម្មផ្លាស់ប្តូរជាផ្លូវការ។ ការពិតដែលថានេះគឺជាប្រតិកម្មជំនួសបានច្បាស់លាស់តែនៅពេលពិចារណាយន្តការរបស់វា។
4. ប្រតិកម្មផ្លាស់ប្តូរគឺជាប្រតិកម្មដែលសារធាតុស្មុគស្មាញពីរផ្លាស់ប្តូរសមាសធាតុរបស់វា។
ប្រតិកម្មទាំងនេះកំណត់លក្ខណៈលក្ខណៈសម្បត្តិនៃអេឡិចត្រូលីត ហើយនៅក្នុងដំណោះស្រាយដំណើរការទៅតាមច្បាប់របស់ Berthollet ពោលគឺលុះត្រាតែលទ្ធផលគឺការកកើតនៃ precipitate ឧស្ម័ន ឬសារធាតុ dissociating បន្តិច (ឧទាហរណ៍ H 2 O) ។
នៅក្នុងគីមីវិទ្យាអសរីរាង្គ នេះអាចជាប្លុកនៃប្រតិកម្មដែលកំណត់លក្ខណៈឧទាហរណ៍ លក្ខណៈសម្បត្តិនៃអាល់កាឡាំង៖
1. ប្រតិកម្មអព្យាក្រឹតដែលកើតឡើងជាមួយនឹងការបង្កើតអំបិលនិងទឹក។
2. ប្រតិកម្មរវាងអាល់កាឡាំងនិងអំបិលដែលកើតឡើងជាមួយនឹងការបង្កើតឧស្ម័ន។
3. ប្រតិកម្មរវាងអាល់កាឡាំងនិងអំបិលដែលបណ្តាលឱ្យមានការកកើតទឹកភ្លៀងមួយ:
CuSO 4 + 2KOH = Cu(OH) 2 + K 2 SO 4
ឬក្នុងទម្រង់អ៊ីយ៉ុង៖
Cu 2+ + 2OH − = Cu(OH) ២
នៅក្នុងគីមីវិទ្យាសរីរាង្គ យើងអាចពិចារណាពីប្លុកនៃប្រតិកម្មដែលមានលក្ខណៈជាឧទាហរណ៍ លក្ខណៈសម្បត្តិនៃអាស៊ីតអាសេទិក៖
1. ប្រតិកម្មដែលកើតឡើងជាមួយនឹងការបង្កើតអេឡិចត្រូលីតខ្សោយ - H 2 O:
CH 3 COOH + NaOH → Na(CH3COO) + H 2 O
2. ប្រតិកម្មដែលកើតឡើងជាមួយការបង្កើតឧស្ម័ន៖
2CH 3 COOH + CaCO 3 → 2CH 3 COO + Ca 2+ + CO 2 + H 2 O
3. ប្រតិកម្មដែលកើតឡើងជាមួយនឹងការកកើតនៃទឹកភ្លៀងមួយ:
2CH 3 COOH + K 2 SO 3 → 2K (CH 3 COO) + H 2 SO 3
2CH 3 COOH + SiO → 2CH 3 COO + H 2 SiO 3
II. ដោយការផ្លាស់ប្តូរស្ថានភាពអុកស៊ីតកម្មនៃធាតុគីមីបង្កើតសារធាតុ
ដោយផ្អែកលើលក្ខណៈពិសេសនេះ ប្រតិកម្មខាងក្រោមត្រូវបានសម្គាល់៖
1. ប្រតិកម្មដែលកើតឡើងជាមួយនឹងការផ្លាស់ប្តូរនៅក្នុងស្ថានភាពអុកស៊ីតកម្មនៃធាតុ ឬប្រតិកម្ម redox ។
ទាំងនេះរួមបញ្ចូលប្រតិកម្មជាច្រើន រួមទាំងប្រតិកម្មជំនួសទាំងអស់ ក៏ដូចជាប្រតិកម្មនៃការរួមបញ្ចូលគ្នា និងការរលាយដែលយ៉ាងហោចណាស់សារធាតុសាមញ្ញមួយត្រូវបានពាក់ព័ន្ធ ឧទាហរណ៍៖
1. Mg 0 + H + 2 SO 4 = Mg +2 SO 4 + H 2

2. 2Mg 0 + O 0 2 = Mg +2 O −2

ប្រតិកម្ម redox ស្មុគស្មាញត្រូវបានផ្សំឡើងដោយប្រើវិធីសាស្ត្រតុល្យភាពអេឡិចត្រុង។
2KMn +7 O 4 + 16HCl - = 2KCl - + 2Mn +2 Cl - 2 + 5Cl 0 2 + 8H 2 O

នៅក្នុងគីមីវិទ្យាសរីរាង្គ ឧទាហរណ៍ដ៏គួរឱ្យចាប់អារម្មណ៍មួយនៃប្រតិកម្ម redox គឺជាលក្ខណៈសម្បត្តិរបស់ aldehydes ។
1. ពួកវាត្រូវបានកាត់បន្ថយទៅជាជាតិអាល់កុលដែលត្រូវគ្នា៖


Aldekydes ត្រូវបានកត់សុីទៅជាអាស៊ីតដែលត្រូវគ្នា៖


2. ប្រតិកម្មដែលកើតឡើងដោយមិនផ្លាស់ប្តូរស្ថានភាពអុកស៊ីតកម្មនៃធាតុគីមី។
ទាំងនេះរួមបញ្ចូលជាឧទាហរណ៍ ប្រតិកម្មផ្លាស់ប្តូរអ៊ីយ៉ុងទាំងអស់ ក៏ដូចជាប្រតិកម្មផ្សំជាច្រើន ប្រតិកម្ម decomposition ជាច្រើន ប្រតិកម្ម esterification៖
HCOOH + CHgOH = HCOOCH 3 + H 2 O
III. ដោយឥទ្ធិពលកម្ដៅ
ដោយផ្អែកលើឥទ្ធិពលកម្ដៅ ប្រតិកម្មត្រូវបានបែងចែកទៅជា exothermic និង endothermic ។
1. ប្រតិកម្មខាងក្រៅកើតឡើងជាមួយនឹងការបញ្ចេញថាមពល។
ទាំងនេះរួមបញ្ចូលទាំងប្រតិកម្មផ្សំស្ទើរតែទាំងអស់។ ករណីលើកលែងដ៏កម្រមួយគឺប្រតិកម្ម endothermic នៃការសំយោគនៃ nitric oxide (II) ពីអាសូត និងអុកស៊ីសែន និងប្រតិកម្មនៃឧស្ម័នអ៊ីដ្រូសែនជាមួយអ៊ីយ៉ូតរឹង។
ប្រតិកម្មខាងក្រៅដែលកើតឡើងជាមួយនឹងការបញ្ចេញពន្លឺត្រូវបានចាត់ថ្នាក់ជាប្រតិកម្មចំហេះ។ អ៊ីដ្រូសែននៃអេទីឡែនគឺជាឧទាហរណ៍នៃប្រតិកម្ម exothermic ។ វាដំណើរការនៅសីតុណ្ហភាពបន្ទប់។
2. ប្រតិកម្ម Endothermic កើតឡើងជាមួយនឹងការស្រូបយកថាមពល។
ជាក់ស្តែង, ទាំងនេះនឹងរួមបញ្ចូលស្ទើរតែទាំងអស់ប្រតិកម្ម decomposition, ឧទាហរណ៍:
1. ការបាញ់ថ្មកំបោរ
2. ការបំបែក Butane
បរិមាណថាមពលដែលបញ្ចេញ ឬស្រូបយកជាលទ្ធផលនៃប្រតិកម្មត្រូវបានគេហៅថា ឥទ្ធិពលកម្ដៅនៃប្រតិកម្ម ហើយសមីការនៃប្រតិកម្មគីមីដែលបង្ហាញពីឥទ្ធិពលនេះត្រូវបានគេហៅថាសមីការទែរម៉ូគីមី៖
H 2(g) + C 12(g) = 2HC 1(g) + 92.3 kJ
N 2 (g) + O 2 (g) = 2NO (g) - 90.4 kJ
IV. យោងទៅតាមស្ថានភាពនៃការប្រមូលផ្តុំនៃសារធាតុប្រតិកម្ម (សមាសភាពដំណាក់កាល)
យោងតាមស្ថានភាពនៃការប្រមូលផ្តុំនៃសារធាតុប្រតិកម្ម ពួកគេត្រូវបានសម្គាល់:
1. Heterogeneous reactions - ប្រតិកម្មដែលសារធាតុប្រតិកម្ម និងផលិតផលប្រតិកម្មស្ថិតនៅក្នុងស្ថានភាពផ្សេងគ្នានៃការប្រមូលផ្តុំ (ក្នុងដំណាក់កាលផ្សេងៗគ្នា)។
2. ប្រតិកម្មដូចគ្នា - ប្រតិកម្មដែលសារធាតុប្រតិកម្ម និងផលិតផលប្រតិកម្មស្ថិតនៅក្នុងស្ថានភាពនៃការប្រមូលផ្តុំដូចគ្នា (ក្នុងដំណាក់កាលដូចគ្នា)។
V. ដោយការចូលរួមកាតាលីករ
ដោយផ្អែកលើការចូលរួមរបស់កាតាលីករពួកគេត្រូវបានសម្គាល់:
1. ប្រតិកម្មមិនកាតាលីករកើតឡើងដោយគ្មានការចូលរួមពីកាតាលីករ។
2. ប្រតិកម្មកាតាលីករកើតឡើងដោយមានការចូលរួមពីកាតាលីករ។ ចាប់តាំងពីប្រតិកម្មជីវគីមីទាំងអស់កើតឡើងនៅក្នុងកោសិកានៃសារពាង្គកាយមានជីវិតកើតឡើងដោយមានការចូលរួមពីកាតាលីករជីវសាស្រ្តពិសេសនៃធម្មជាតិប្រូតេអ៊ីន - អង់ស៊ីម ពួកវាទាំងអស់សុទ្ធតែជាកាតាលីករ ឬច្បាស់ជាងនេះទៅទៀត អង់ស៊ីម។ គួរកត់សម្គាល់ថាជាង 70% នៃឧស្សាហកម្មគីមីប្រើកាតាលីករ។
VI. ឆ្ពោះទៅរក
យោងតាមទិសដៅពួកគេត្រូវបានសម្គាល់:
1. ប្រតិកម្មដែលមិនអាចត្រឡប់វិញបានកើតមានឡើងក្រោមលក្ខខណ្ឌដែលបានផ្តល់ឱ្យក្នុងទិសដៅតែមួយប៉ុណ្ណោះ។ ទាំងនេះរួមបញ្ចូលប្រតិកម្មផ្លាស់ប្តូរទាំងអស់ដែលអមដោយការបង្កើតទឹកភ្លៀង ឧស្ម័ន ឬសារធាតុដែលបំបែកបន្តិច (ទឹក) និងប្រតិកម្មចំហេះទាំងអស់។
2. ប្រតិកម្មបញ្ច្រាសក្រោមលក្ខខណ្ឌទាំងនេះកើតឡើងក្នុងពេលដំណាលគ្នាក្នុងទិសដៅផ្ទុយគ្នាពីរ។ ភាគច្រើនលើសលប់នៃប្រតិកម្មបែបនេះគឺ។
នៅក្នុងគីមីវិទ្យាសរីរាង្គ សញ្ញានៃការបញ្ច្រាសត្រូវបានឆ្លុះបញ្ចាំងដោយឈ្មោះ - សទិសន័យនៃដំណើរការ៖
អ៊ីដ្រូសែន - dehydrogenation,
ជាតិទឹក - ខះជាតិទឹក,
វត្ថុធាតុ polymerization - depolymerization ។
ប្រតិកម្មទាំងអស់នៃ esterification (ដំណើរការផ្ទុយ ដូចដែលអ្នកដឹង ត្រូវបានគេហៅថា hydrolysis) និង hydrolysis នៃប្រូតេអ៊ីន esters កាបូអ៊ីដ្រាត និង polynucleotides គឺអាចបញ្ច្រាស់បាន។ ភាពច្រាសមកវិញនៃដំណើរការទាំងនេះបង្កប់នូវទ្រព្យសម្បត្តិដ៏សំខាន់បំផុតនៃសារពាង្គកាយមានជីវិត - ការរំលាយអាហារ។
VII. យោងតាមយន្តការនៃលំហូរពួកគេត្រូវបានសម្គាល់:
1. ប្រតិកម្មរ៉ាឌីកាល់កើតឡើងរវាងរ៉ាឌីកាល់ និងម៉ូលេគុលដែលបង្កើតឡើងកំឡុងពេលប្រតិកម្ម។
ដូចដែលអ្នកបានដឹងរួចមកហើយថា នៅក្នុងប្រតិកម្មទាំងអស់ ចំណងគីមីចាស់ត្រូវបានខូច ហើយចំណងគីមីថ្មីត្រូវបានបង្កើតឡើង។ វិធីសាស្រ្តនៃការបំបែកចំណងនៅក្នុងម៉ូលេគុលនៃសារធាតុចាប់ផ្តើមកំណត់យន្តការ (ផ្លូវ) នៃប្រតិកម្ម។ ប្រសិនបើសារធាតុមួយត្រូវបានបង្កើតឡើងដោយចំណង covalent នោះវាអាចមានវិធីពីរយ៉ាងដើម្បីបំបែកចំណងនេះ៖ hemolytic និង heterolytic ។ ឧទាហរណ៍សម្រាប់ម៉ូលេគុល Cl 2, CH 4 ជាដើម ការបំបែក hemolytic នៃចំណងត្រូវបានដឹង វានឹងនាំទៅដល់ការបង្កើតភាគល្អិតជាមួយនឹងអេឡិចត្រុងដែលមិនផ្គូផ្គង ពោលគឺរ៉ាឌីកាល់សេរី។
រ៉ាឌីកាល់ត្រូវបានបង្កើតឡើងជាញឹកញាប់បំផុតនៅពេលដែលចំណងត្រូវបានបំបែកដែលគូអេឡិចត្រុងដែលបានចែករំលែកត្រូវបានចែករំលែកប្រហែលស្មើគ្នារវាងអាតូម (ចំណងដែលមិនមែនជាប៉ូល) ប៉ុន្តែចំណងប៉ូលជាច្រើនក៏អាចខូចតាមរបៀបស្រដៀងគ្នាដែរ ជាពិសេសនៅពេលដែលប្រតិកម្មកើតឡើងនៅក្នុង ដំណាក់កាលឧស្ម័ន និងក្រោមឥទិ្ធពលនៃពន្លឺ ដូចជាឧទាហរណ៍នៅក្នុងករណីនៃដំណើរការដែលបានពិភាក្សាខាងលើ - អន្តរកម្មនៃ C 12 និង CH 4 - ។ រ៉ាឌីកាល់មានប្រតិកម្មខ្លាំង ព្រោះវាទំនោរទៅបំពេញស្រទាប់អេឡិចត្រុងរបស់ពួកគេ ដោយយកអេឡិចត្រុងពីអាតូម ឬម៉ូលេគុលផ្សេងទៀត។ ជាឧទាហរណ៍ នៅពេលដែលរ៉ាឌីកាល់ក្លរីនប៉ះគ្នាជាមួយម៉ូលេគុលអ៊ីដ្រូសែន វាបណ្តាលឱ្យគូអេឡិចត្រុងរួមគ្នាដែលភ្ជាប់អាតូមអ៊ីដ្រូសែនបំបែក ហើយបង្កើតជាចំណងកូវ៉ាឡេនជាមួយអាតូមអ៊ីដ្រូសែនមួយ។ អាតូមអ៊ីដ្រូសែនទីពីរ ដែលបានក្លាយជារ៉ាឌីកាល់ បង្កើតជាគូអេឡិចត្រុងធម្មតា ជាមួយនឹងអេឡិចត្រុងដែលមិនបានផ្គូផ្គងនៃអាតូមក្លរីន ពីម៉ូលេគុល Cl 2 ដែលដួលរលំ ដែលបណ្តាលឱ្យមានការបង្កើតរ៉ាឌីកាល់ក្លរីន ដែលវាយប្រហារម៉ូលេគុលអ៊ីដ្រូសែនថ្មី ។ល។
ប្រតិកម្មដែលតំណាងឱ្យខ្សែសង្វាក់នៃការផ្លាស់ប្តូរជាបន្តបន្ទាប់ត្រូវបានគេហៅថា ប្រតិកម្មសង្វាក់។ សម្រាប់ការអភិវឌ្ឍន៍ទ្រឹស្តីនៃប្រតិកម្មសង្វាក់ អ្នកគីមីវិទ្យាឆ្នើមពីរនាក់គឺជនរួមជាតិរបស់យើង N. N. Semenov និងជនជាតិអង់គ្លេស S.A. Hinshelwood បានទទួលរង្វាន់ណូបែល។
ប្រតិកម្មជំនួសរវាងក្លរីន និងមេតានដំណើរការស្រដៀងគ្នា៖

ប្រតិកម្មចំហេះភាគច្រើននៃសារធាតុសរីរាង្គ និងអសរីរាង្គ ការសំយោគទឹក អាម៉ូញាក់ វត្ថុធាតុ polymerization នៃអេទីឡែន វីនីលក្លរ ជាដើម ដំណើរការដោយយន្តការរ៉ាឌីកាល់។
2. ប្រតិកម្មអ៊ីយ៉ុងកើតឡើងរវាងអ៊ីយ៉ុងដែលមានស្រាប់ ឬបង្កើតឡើងក្នុងអំឡុងពេលប្រតិកម្ម។
ប្រតិកម្មអ៊ីយ៉ុងធម្មតាគឺជាអន្តរកម្មរវាងអេឡិចត្រូលីតនៅក្នុងដំណោះស្រាយ។ អ៊ីយ៉ុងត្រូវបានបង្កើតឡើងមិនត្រឹមតែក្នុងអំឡុងពេលនៃការបំបែកនៃអេឡិចត្រូលីតនៅក្នុងដំណោះស្រាយប៉ុណ្ណោះទេប៉ុន្តែក៏ស្ថិតនៅក្រោមសកម្មភាពនៃការឆក់អគ្គិសនីកំដៅឬវិទ្យុសកម្មផងដែរ។ ឧទាហរណ៍ γ-rays បំប្លែងម៉ូលេគុលទឹក និងមេតានទៅជាអ៊ីយ៉ុងម៉ូលេគុល។
យោងតាមយន្តការអ៊ីយ៉ុងមួយផ្សេងទៀតប្រតិកម្មនៃការបន្ថែមអ៊ីដ្រូសែន halides អ៊ីដ្រូសែន halogens ទៅ alkenes អុកស៊ីតកម្មនិងការខះជាតិទឹកនៃជាតិអាល់កុលការជំនួសនៃជាតិអាល់កុល hydroxyl ជាមួយ halogen កើតឡើង; ប្រតិកម្មដែលបង្ហាញពីលក្ខណៈសម្បត្តិរបស់ aldehydes និងអាស៊ីត។ ក្នុងករណីនេះអ៊ីយ៉ុងត្រូវបានបង្កើតឡើងដោយការបំបែក heterolytic នៃចំណង covalent ប៉ូល
VIII. យោងទៅតាមប្រភេទនៃថាមពល
ការចាប់ផ្តើមប្រតិកម្មត្រូវបានសម្គាល់:
1. ប្រតិកម្មគីមី។ ពួកវាត្រូវបានផ្តួចផ្តើមដោយថាមពលពន្លឺ។ បន្ថែមពីលើដំណើរការ photochemical នៃការសំយោគ HCl ឬប្រតិកម្មនៃឧស្ម័នមេតានជាមួយនឹងក្លរីនដែលបានពិភាក្សាខាងលើ ទាំងនេះរួមបញ្ចូលការផលិតអូហ្សូននៅក្នុង troposphere ដែលជាការបំពុលបរិយាកាសបន្ទាប់បន្សំ។ តួនាទីចម្បងក្នុងករណីនេះគឺ nitric oxide (IV) ដែលស្ថិតនៅក្រោមឥទ្ធិពលនៃពន្លឺបង្កើតជារ៉ាឌីកាល់អុកស៊ីសែន។ រ៉ាឌីកាល់ទាំងនេះធ្វើអន្តរកម្មជាមួយម៉ូលេគុលអុកស៊ីហ៊្សែន ដែលបណ្តាលឱ្យមានអូហ្សូន។
ការបង្កើតអូហ្សូនកើតឡើង ដរាបណាមានពន្លឺគ្រប់គ្រាន់ ព្រោះថា NO អាចធ្វើអន្តរកម្មជាមួយម៉ូលេគុលអុកស៊ីសែនដើម្បីបង្កើតជា NO 2 ដូចគ្នា។ ការប្រមូលផ្តុំនៃអូហ្សូន និងការបំពុលបរិយាកាសបន្ទាប់បន្សំផ្សេងទៀតអាចនាំឱ្យមានផ្សែងអ័ព្ទគីមី។
ប្រភេទនៃប្រតិកម្មនេះក៏រួមបញ្ចូលផងដែរនូវដំណើរការដ៏សំខាន់បំផុតដែលកើតឡើងនៅក្នុងកោសិការុក្ខជាតិ - រស្មីសំយោគ ឈ្មោះដែលនិយាយសម្រាប់ខ្លួនវាផ្ទាល់។
2. ប្រតិកម្មវិទ្យុសកម្ម។ ពួកវាត្រូវបានផ្តួចផ្តើមដោយវិទ្យុសកម្មថាមពលខ្ពស់ - កាំរស្មី X វិទ្យុសកម្មនុយក្លេអ៊ែរ (γ-rays, a-particles - He 2+ ។ល។) ។ ដោយមានជំនួយពីប្រតិកម្មវិទ្យុសកម្ម ការធ្វើរស្មីសំយោគយ៉ាងលឿនបំផុត វិទ្យុសកម្ម (ការរំលាយវិទ្យុសកម្ម) ត្រូវបានអនុវត្ត។
ឧទាហរណ៍ជំនួសឱ្យការផលិត phenol ពីរដំណាក់កាលពី benzene វាអាចត្រូវបានទទួលបានដោយប្រតិកម្ម benzene ជាមួយទឹកនៅក្រោមឥទ្ធិពលនៃវិទ្យុសកម្ម។ ក្នុងករណីនេះ រ៉ាឌីកាល់ [OH] និង [H] ត្រូវបានបង្កើតឡើងពីម៉ូលេគុលទឹក ដែល benzene ប្រតិកម្មដើម្បីបង្កើត phenol:
C 6 H 6 + 2 [OH] → C 6 H 5 OH + H 2 O
Vulcanization នៃកៅស៊ូអាចត្រូវបានអនុវត្តដោយគ្មានស្ពាន់ធ័រដោយប្រើ radiovulcanization ហើយកៅស៊ូលទ្ធផលនឹងមិនអាក្រក់ជាងកៅស៊ូប្រពៃណីទេ។
3. ប្រតិកម្មគីមី។ ពួកវាត្រូវបានផ្តួចផ្តើមដោយចរន្តអគ្គិសនី។ បន្ថែមពីលើប្រតិកម្មអេឡិចត្រូលីសដែលគេស្គាល់ច្បាស់ យើងក៏នឹងបង្ហាញពីប្រតិកម្មអេឡិចត្រូលីសផងដែរ ឧទាហរណ៍ ប្រតិកម្មសម្រាប់ផលិតកម្មឧស្សាហកម្មនៃសារធាតុអុកស៊ីតកម្មអសរីរាង្គ។
4. ប្រតិកម្មគីមី។ ពួកវាត្រូវបានផ្តួចផ្តើមដោយថាមពលកំដៅ។ ទាំងនេះរួមបញ្ចូលទាំងប្រតិកម្ម endothermic ទាំងអស់ និងប្រតិកម្ម exothermic ជាច្រើន ការចាប់ផ្តើមដែលតម្រូវឱ្យមានការផ្គត់ផ្គង់កំដៅដំបូង ពោលគឺការចាប់ផ្តើមដំណើរការ។
ការចាត់ថ្នាក់នៃប្រតិកម្មគីមីដែលបានពិភាក្សាខាងលើត្រូវបានឆ្លុះបញ្ចាំងនៅក្នុងដ្យាក្រាម។
ការចាត់ថ្នាក់នៃប្រតិកម្មគីមី ដូចជាការចាត់ថ្នាក់ផ្សេងទៀតទាំងអស់គឺមានលក្ខខណ្ឌ។ អ្នកវិទ្យាសាស្ត្របានយល់ព្រមបែងចែកប្រតិកម្មទៅជាប្រភេទមួយចំនួនទៅតាមលក្ខណៈដែលពួកគេកំណត់អត្តសញ្ញាណ។ ប៉ុន្តែការបំប្លែងគីមីភាគច្រើនអាចត្រូវបានចាត់ថ្នាក់ទៅជាប្រភេទផ្សេងៗគ្នា។ ជាឧទាហរណ៍ ចូរយើងកំណត់លក្ខណៈដំណើរការនៃការសំយោគអាម៉ូញាក់។
នេះគឺជាប្រតិកម្មផ្សំ, redox, exothermic, reversible, catalytic, heterogeneous (កាន់តែជាក់លាក់, heterogeneous-catalytic) ដែលកើតឡើងជាមួយនឹងការថយចុះនៃសម្ពាធនៅក្នុងប្រព័ន្ធ។ ដើម្បីគ្រប់គ្រងដំណើរការដោយជោគជ័យ ចាំបាច់ត្រូវគិតគូរពីព័ត៌មានទាំងអស់ដែលបានផ្តល់។ ប្រតិកម្មគីមីជាក់លាក់មួយតែងតែមានលក្ខណៈពហុគុណ និងត្រូវបានកំណត់ដោយលក្ខណៈផ្សេងៗគ្នា។

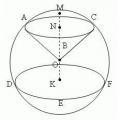 ស្វ៊ែរ បាល់ ផ្នែក និងផ្នែក
ស្វ៊ែរ បាល់ ផ្នែក និងផ្នែក ឯកទេស "គិលានុបដ្ឋាយិកា" (បរិញ្ញាបត្រ)
ឯកទេស "គិលានុបដ្ឋាយិកា" (បរិញ្ញាបត្រ) លក្ខណៈសាមញ្ញបំផុតនៃអាំងតេក្រាល។
លក្ខណៈសាមញ្ញបំផុតនៃអាំងតេក្រាល។