A10. Sifat kimia hidroksida dan asid
bahan diberikan: kalium dikromat, asid sulfurik pekat dan kalium hidroksida, natrium karbonat.
- Terdapat ralat yang serius dalam jawapan Audrey.
Jadi saya akan menulis dengan betul
1.H2SO4+2KOH---gt; K2SO4 + 2H2O
2. K2Cr2O7 + 4H2SO4 ---gt; K2SO4 + Cr2(SO4)3 + 4H2O + 3O2
3. Na2CO3 + H2SO4 ---gt; Na2SO4 + CO2 + H2O
4. Na2CO3 + KOH lt;--gt; K2CO3 + NaOH (lebih banyak kalium logam aktif daripada natrium, oleh itu, tindak balas penggantian berlaku) - Tindak balas antara Na2CO3 dan KOH hanya mungkin dengan lebihan alkali...)
Alkali + garam = bes (baru) + garam (baru). Tetapi! Bahan permulaan mestilah dalam larutan, dan sekurang-kurangnya satu daripada produk tindak balas mesti memendakan atau melarutkan sedikit.
Ia kelihatan seperti ini:
Na2CO3 + 2 KOH = 2 NaOH + K2CO3.Baby Roo betul.
Audrey juga betul. - 1.H2SO4 + 2KOH --gt; K2SO4 + 2H2O
2.K2Cr2O7 + 4 H2SO4 --gt; K2SO4 + Cr2(SO4)3 + 4 H2O + 3O
3. Na2CO3 + H2SO4 --gt; Na2SO4 + CO2 + H2O
4. Na2CO3 + KOH --gt; tiada reaksi - Terdapat kesilapan yang serius dalam jawapan Sage.
Oleh itu, saya akan menulis dengan betul:
4. Na2CO3 + 2 KOH = 2 NaOH + K2CO3.Audrey hanya menulis bahawa tiada tindak balas antara Na2CO3 dan KOH... .
Terdapat tiga kelas dalam alam semula jadi sebatian tak organik: garam, oksida dan hidroksida. Juga, bahan seperti CI2, І2 dan sejenisnya, yang terdiri daripada hanya satu unsur kimia, dibezakan ke dalam kelas yang berasingan.
Pengelasan hidroksida
Ia adalah salah satu daripada tiga kelas sedia ada bagi sebatian tak organik. Mereka dibahagikan kepada asid, bes dan bahan amfoterik. Yang pertama terdiri daripada kation H+ dan anion dalam bentuk residu berasid, contohnya, CI-. Struktur kedua termasuk kation beberapa logam, sebagai contoh, Ca +, serta anion dalam bentuk kumpulan hidroksil DIA-. Yang terakhir ini dicirikan oleh fakta bahawa mereka pada masa yang sama mempunyai sifat kimia yang wujud dalam asid dan bes. Hidroksida tersebut termasuk sebatian aluminium dan besi. Asas seperti yang lain bahan bukan organik, boleh dibahagikan kepada kumpulan bergantung kepada aktiviti kimia mereka. Yang paling kuat dalam hal ini ialah kalium dan natrium hidroksida, yang juga dipanggil alkali. Mereka cepat bertindak balas dengan pelbagai bahan.
Ciri-ciri fizikal
Bahan ini V keadaan biasa(pada suhu bilik dan tekanan rendah) berada dalam pepejal keadaan pengagregatan. Ia kelihatan seperti kristal kecil yang tidak berwarna dan tidak berbau, sangat larut dalam air. Kristal ini sangat higroskopik. Menginap di udara terbuka untuk masa yang lama, mereka kabur dan berubah menjadi penyelesaian, menyerap kelembapan dari atmosfera. Fenomena yang sama diperhatikan dengan natrium hidroksida, hygroscopicity yang lebih tinggi.
Nama lain untuk kalium hidroksida
Dalam ucapan biasa, bahan ini dipanggil potash kaustik, serta potash kaustik dan alkali kalium.
Sifat kimia
Bahan yang dimaksudkan mempunyai semua ciri yang menjadi ciri asas. Sifat alkalinya sangat ketara, seperti natrium hidroksida. Apabila kalium hidroksida dibakar, oksida logam dan air ini dibebaskan. K2O mempunyai warna kuning muda.
Interaksi garam

Garam - bahan yang terdiri daripada kation logam dan anion, diwakili oleh sisa asid. Mereka terbentuk terutamanya oleh interaksi logam aktif dengan asid. Tindak balas penggantian berlaku, di mana, sebagai tambahan kepada garam, hidrogen terbentuk, yang dibebaskan sebagai gas. Apabila bertindak balas dengan bahan kelas ini, garam lain yang mengandungi kalium terbentuk, serta hidroksida logam. Sebagai contoh, apabila bahan ini berinteraksi dengan kuprum klorida, kuprum hidroksida dan kalium klorida terbentuk, yang memendakan. Untuk menjalankan tindak balas seperti ini, adalah perlu untuk mengambil alkali dan kuprum klorida dalam perkadaran sedemikian sehingga dua molekul bahan pertama menyumbang untuk satu saat, iaitu nisbah bahan yang diperolehi adalah seperti berikut: untuk satu molekul cuprum hidroksida, dua kalium klorida. Interaksi sedemikian dipanggil tindak balas pertukaran. Agar mereka dapat dijalankan, adalah perlu untuk mematuhi syarat berikut: salah satu hasil tindak balas mesti sama ada mendakan, atau sejat dalam bentuk gas, atau menjadi air. Logam yang merupakan sebahagian daripada garam sepatutnya kurang reaktif daripada kalium (semuanya kecuali litium).

Tindak balas dengan asid
Semua bes, termasuk kalium hidroksida, dapat berinteraksi dengan asid. Tindak balas yang paling biasa dan kerap digunakan ialah yang melibatkan bahan berkenaan dan asid sulfurik. Dalam kes ini, kalium hidroksida diperlukan dalam jumlah sedemikian sehingga terdapat dua sebatian ini setiap molekul asid. Dalam tindak balas jenis ini, bahan seperti kalium sulfat dan air terbentuk dalam nisbah molar satu hingga dua. Suka proses kimia digunakan secara aktif dalam industri, kerana produk yang dihasilkan digunakan secara meluas di mana-mana.
Apa yang berlaku jika anda menambahnya kepada oksida?
Dalam kes ini, sebenarnya, tindak balas pertukaran juga akan berlaku. Sebagai contoh, jika anda mencampurkan kalium hidroksida dan besi dioksida dalam nisbah molar dua kepada satu, anda boleh mendapatkan ferum hidroksida (II), yang memendakan menjadi mendakan hijau gelap, serta kalium oksida dalam perkadaran sedemikian sehingga satu molekul bahan pertama akan mempunyai satu saat.
Kaedah utama untuk menghasilkan kalium hidroksida
Dalam industri, selalunya ia dilombong oleh elektrolisis larutan kalium klorida. Mendapatkan kalium hidroksida adalah proses di mana, sebagai tambahan kepada bahan yang diekstrak, H 2 dan CI 2 terbentuk.

Kegunaan industri
Pada asasnya, bahan ini digunakan dalam pembuatan sabun dan produk pembersihan lain. Proses ini menggunakan tindak balas sebatian berkenaan dengan beberapa jenis lemak. Natrium hidroksida juga boleh digunakan untuk tujuan yang sama. Juga dipertimbangkan dalam artikel ini, bahan itu digunakan secara meluas dalam industri kimia untuk mendapatkan pelbagai sebatian kalium, terutamanya sulfatnya.

Reaksi di mana ia terbentuk telah dibincangkan oleh kami di atas. Dalam bidang yang sama, ia digunakan sebagai sebatian yang menyerap gas seperti hidrogen sulfida, sulfur dioksida, karbon dioksida. Ia juga bertindak sebagai bahan pengering kerana sifat higroskopiknya yang tinggi. Ia boleh digunakan untuk menentukan tahap kepekatan asid dalam larutan. Selain itu, hidroksida juga digunakan dalam Industri Makanan. Di sini ia digunakan sebagai bahan tambahan makanan E525. Ia bertindak sebagai pengawal selia keasidan. Anda boleh menemuinya dalam komposisi koko, coklat dan produk lain yang serupa. Kalium hidroksida digunakan dalam pemprosesan selulosa, untuk mendapatkan viscose, digunakan dalam bateri alkali, ditambah kepada komposisi detergen pencuci pinggan mangkuk atau membersihkan pelbagai permukaan, untuk merawat kain kapas dan menjadikannya lebih higroskopik.

Sebatian kalium yang diperoleh daripada hidroksida dan kegunaannya
Selalunya, bahan yang dimaksudkan digunakan untuk mengekstrak kalium sulfat, yang digunakan sebagai baja. Mereka memberi makan tumbuhan semasa musim tumbuh. Ia juga digunakan sebagai pengemulsi dalam industri makanan - ia memungkinkan untuk mendapatkan jisim homogen, yang terdiri daripada komponen yang tidak bercampur apabila keadaan biasa. Untuk penunjukannya, penandaan E515 digunakan. Ia juga boleh, seperti kalium hidroksida, bertindak sebagai pengawal selia keasidan. Sulfat sering digunakan sebagai pengganti garam. Di samping itu, bahan ini mendapati aplikasinya dalam farmakologi dalam pengeluaran makanan tambahan, serta dalam pembuatan pewarna. Di samping itu, ia juga digunakan dalam industri kaca.
Kalium hidroksida dan badan manusia
Dalam bentuk penyelesaian pekat, ini sebatian kimia berbahaya kepada organisma hidup. Sentuhan dengan kulit atau membran mukus boleh menyebabkan kecederaan serius. Larutan pekat kalium hidroksida menyebabkan lebih banyak melecur teruk daripada asid. Ia juga mampu melarutkan banyak sebatian organik. Bahan ini tergolong dalam kelas bahaya kedua, iaitu, apabila bekerja dengannya, perlu diperhatikan peraturan khas. Jumlah berlebihan kalium hidroksida dalam badan membawa kepada pembentukan yang baru penyakit kulit atau pemburukan kronik
"Pelajaran asid sulfurik" - Apa sifat umum asid adalah ciri asid sulfurik? Moto pelajaran: Bagaimana asid sulfurik pekat berinteraksi dengan sebatian organik? Hujan asid. Kesan negatif terhadap alam sekitar. "Bagaimanakah asid sulfurik cair berinteraksi dengan logam? Apakah keadaan pengoksidaan yang menjadi ciri atom sulfur?
"Asid sulfurik" - Nikel sulfat. S+6O3 ialah cecair tidak berwarna. Asid anoksik. Interaksi asid dengan sukrosa. asid sulfurik pekat. asid polibes. Asid sulfurik cair mendedahkan segala-galanya sifat ciri asid. Asid sulfurik. Terdapat peraturan ketat mengenai pencampuran asid sulfurik dengan air sejak sekian lama.
"Tembaga logam" - Peranan gangsa sangat hebat. Bahan mudah tembaga ialah logam mulur merah jambu yang cantik. Unsur kimia subkumpulan sampingan kumpulan 1 - Cu (Kuprum). Secara keseluruhan, badan orang biasa (berat badan 70 kg) mengandungi 72 mg tembaga. Peranan utama kuprum dalam tisu tumbuhan dan haiwan adalah penyertaan dalam pemangkinan enzimatik.
"Mendapatkan asid sulfurik" - peringkat II - mendapatkan SO3. Barium klorida ialah reagen berkualiti untuk H2SO4. Kesimpulan. Tujuan pelajaran. Peringkat I - penghasilan sulfur dioksida SO2. H2SO4 conc Produk pengoksidaan. peringkat ke-3. H2SO4 dil. asid sulfurik pekat. Sifat kimia dan pengeluaran asid sulfurik dalam industri. Asid ialah agen pengoksidaan.
"Asid Gred 8" - Apakah jenis asid yang digunakan untuk membuat lukisan pada kaca? Terangkan oksida. Apakah kandungan asid air mineral? Kelas mana bahan kimia adakah kita akan belajar? Apakah asid yang terdapat dalam jus gastrik? Daripada kelas bahan apakah asid boleh diperolehi? Ingat apa yang kita tahu tentang asid dengan contoh.
"Asid sulfurik" - Ia perlu membilas mulut dan tekak dengan larutan soda (20 gram baking soda setiap 1 liter air). Dos maut asid sulfurik apabila diambil secara lisan - 5 miligram. Selepas sangat kuat letusan gunung berapi mungkin berlaku perubahan ketara iklim. Kesan merosakkan asid sulfurik, kaedah perlindungan.
Ciri sifat kimia asas, dan hidroksida amfoterik. Ciri kimia
sifat asid.
1. Kalium hidroksida berinteraksi dengan setiap dua bahan
1) NH 3 dan HCl 2) CO 2 dan CuCl 2 3) H 2 SO 4 dan NaNO 3 4) MgO dan HNO 3
2. Asid hidroklorik cair bertindak balas dengan setiap dua bahan
1) kuprum dan natrium hidroksida
2) magnesium dan perak nitrat
3) besi dan silikon oksida (IV)
4) plumbum dan kalium nitrat
3. Berinteraksi dengan asid hidroklorik
1) NaHCO 3 2) Hg 3) SiO 2 4) S
4. Tindak balas peneutralan berlaku apabila berinteraksi
1) Fe 2 O 3 dan HCl
2) Fe (OH) 3 dan HCl
3) FeCl 3 dan NaNCS
5. Besi hidroksida (II) berinteraksi dengan
1) asid nitrik
2) kalsium oksida
3) kuprum sulfat
4) ammonia
6. Asid sulfurik cair tidak bertindak balas dengan
1) kalsium hidroksida
2) kuprum oksida (II)
4) karbon monoksida (IV)
7. Setiap satu daripada dua bahan bertindak balas dengan kalium hidroksida
1) AlCl 3 dan H 2 S
2) CuO dan Ba (OH) 2
3) CaCO 3 dan NH 3
4) K 2 SO 4 dan AlCl 3
8. Kalsium hidroksida bertindak balas dengan setiap dua bahan
1) HCl dan CO 2
4) BaCl 2 dan NaOH
9. Kalium hidroksida bertindak balas dengan
2) alkali
3) asid
4) asid dan alkali
10. Kalsium hidroksida tidak berinteraksi
1) HCl 2) ZnS 3) CO 2 4) HNO 3
11. Kromium (III) hidroksida bertindak balas dengan setiap dua bahan
1) CO 2 dan HCl
2) SiO 2 dan Cu (OH) 2
4) H 2 SO 4 dan NaOH
12. Tindak balas peneutralan berlaku antara
13 . Setiap satu daripada dua bahan berinteraksi dengan larutan asid sulfurik:
14. Kalsium hidroksida bertindak balas dengan
15. Pekat Asid nitrik biasanya tidak berinteraksi dengan
16. Apabila mengeringkan larutan akueus asid asetik dan kalium hidroksida terbentuk
17. Natrium hidroksida tidak bertindak balas dengan
| 1) | Al(OH)3 | 2) | ZnO | 3) | H2SO4 | 4) | Ba(OH)2 |
18. Asid sulfurik cair bertindak balas dengan setiap dua bahan:
| 1) | Na 2 SiO 3 dan HNO 3 |
| 2) | Fe 2 O 3 dan KNO 3 |
| 3) | Ag dan Cu(OH) 2 |
| 4) | Fe dan Al 2 O 3 |
19. Kedua-dua aluminium hidroksida dan asid hidroklorik boleh berinteraksi dengan
| 1) | CuO | 2) | H2SO4 | 3) | CO2 | 4) | NaOH |
20. Asid hidroklorik tidak berinteraksi dengan salah satu daripada dua bahan:
21. Dengan setiap bahan yang disenaraikan: H 2 S, KOH, Zn
berinteraksi
| 1) | Pb(NO 3) 2 | 2) | ZnSO4 | 3) | Na2CO3 | 4) | HCl |
22. Asid sulfurik cair boleh bertindak balas dengan setiap dua bahan:
23. Setiap satu daripada dua bahan berinteraksi dengan larutan asid sulfurik:
24. Asid nitrik pekat dalam keadaan normal tidak berinteraksi dengan
25. Larutan natrium hidroksida bertindak balas dengan setiap bahan yang ditunjukkan secara berpasangan
26. Natrium hidroksida tidak bertindak balas dengan
| 1) | Al(OH)3 | 2) | ZnO | 3) | H2SO4 | 4) | Ba(OH)2 |
27. Asid sulfurik cair bertindak balas dengan setiap dua bahan:
| 1) | Na 2 SiO 3 dan HNO 3 |
| 2) | Fe 2 O 3 dan KNO 3 |
| 3) | Ag dan Cu(OH) 2 |
| 4) | Fe dan Al 2 O 3 |
28. Kedua-dua aluminium hidroksida dan asid hidroklorik boleh berinteraksi dengan
| 1) | CuO | 2) | H2SO4 | 3) | CO2 | 4) | NaOH |
29. Asid hidroklorik tidak berinteraksi dengan mana-mana dua bahan:
30. Larutan natrium hidroksida tidak berinteraksi dengan
| 1) | CO 2 | 2) | HCl | 3) | SO2 | 4) | MgO |
31. Zink hidroksida berinteraksi dengan setiap dua bahan
2) HNO 3 dan NaCl
3) Mg (OH) 2 dan NaNO 3
4) H 2 S dan Fe (OH) 2
JAWAPAN: 1-2, 2-2, 3-1, 4-2, 5-1, 6-4, 7-1, 8-1, 9-3, 10-2, 11-4, 12-3, 13-2, 14-4, 15-1, 16-3, 17-4, 18-4, 19-4, 20-3, 21-1, 22-4, 23-2, 24-3, 25- 3, 26-4, 27-4, 28-4, 29-3, 30-4, 31-1.
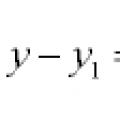 Persamaan garis dan lengkung dalam satah
Persamaan garis dan lengkung dalam satah Persamaan homogen umum Persamaan homogen umum tertib kedua
Persamaan homogen umum Persamaan homogen umum tertib kedua Terima kasih kepada koma Kerana fakta bahawa dalam mereka
Terima kasih kepada koma Kerana fakta bahawa dalam mereka