Sifat fizikokimia minyak dan parameter yang mencirikannya: ketumpatan, kelikatan, kebolehmampatan, pekali isipadu. Kebergantungan mereka pada suhu dan tekanan
Ketumpatan gas
Gas, tidak seperti cecair, dicirikan oleh ketumpatan rendah. Ketumpatan normal gas ialah jisim satu liter gas pada 0°C dan tekanan 1 kgf/cm2. Jisim satu molekul mana-mana gas adalah berkadar dengan ketumpatannya.
Ketumpatan gas, c, berubah mengikut perkadaran tekanan dan diukur dengan nisbah jisim gas m kepada isipadu V yang didudukinya:
Untuk tujuan praktikal, adalah mudah untuk mencirikan pelbagai gas dengan ketumpatannya berbanding udara di bawah keadaan tekanan dan suhu yang sama. Oleh kerana molekul gas yang berbeza mempunyai jisim yang berbeza, ketumpatannya pada tekanan yang sama adalah berkadar dengan jisim molarnya.
Ketumpatan gas dan nisbah ketumpatannya kepada ketumpatan udara:
Undang-undang asas gas
Ciri-ciri gas ialah mereka tidak mempunyai isipadu dan bentuknya sendiri, tetapi mengambil bentuk dan menempati isipadu kapal di mana ia diletakkan. Gas secara seragam mengisi isipadu kapal, cuba mengembang dan menduduki sebanyak mungkin isipadu. Semua gas sangat boleh mampat. Molekul gas nyata mempunyai isipadu dan mempunyai daya tarikan bersama, walaupun kuantiti ini sangat kecil. Pengiraan untuk gas nyata biasanya menggunakan hukum gas untuk gas ideal. Gas ideal ialah gas bersyarat yang molekulnya tidak mempunyai isipadu dan tidak berinteraksi antara satu sama lain kerana ketiadaan daya tarikan, dan dalam perlanggaran di antara mereka tiada daya lain bertindak, kecuali daya hentaman elastik. Gas-gas ini mematuhi undang-undang Boyle - Mariotte, Gay-Lussac, dsb.
Semakin tinggi suhu dan semakin rendah tekanan, semakin hampir kelakuan gas sebenar sepadan dengan gas ideal. Pada tekanan rendah, semua gas boleh dianggap ideal. Pada tekanan kira-kira 100 kg/cm2, sisihan gas nyata daripada hukum gas ideal tidak melebihi 5%. Oleh kerana sisihan gas sebenar daripada undang-undang yang diperoleh untuk gas ideal biasanya boleh diabaikan, undang-undang untuk gas ideal boleh digunakan secara bebas untuk menyelesaikan banyak masalah praktikal.
Undang-undang Boyle -- Mariotte
Pengukuran isipadu gas di bawah pengaruh tekanan luar menunjukkan bahawa terdapat hubungan mudah antara isipadu V dan tekanan P, dinyatakan oleh undang-undang Boyle-Mariotte: tekanan jisim (atau jumlah) gas tertentu pada suhu malar adalah berkadar songsang dengan isipadu gas:
P1: P2 = V1: V2,
di mana Р1 - tekanan gas pada volum V1; Р2 - tekanan gas pada isipadu V2.
Daripada ini berikutan bahawa:
P1 * V1 \u003d P2 * V2 atau P * V \u003d const (pada t \u003d const).
Postulat ini dirumuskan seperti berikut: hasil darab tekanan bagi jisim gas tertentu dan isipadunya adalah malar jika suhu tidak berubah (iaitu, semasa proses isoterma).
Jika, sebagai contoh, kita mengambil 8 liter gas di bawah tekanan P = 0.5 kgf / cm2 dan menukar tekanan pada suhu malar malar, maka data berikut akan diperolehi: pada 1 kgf / cm2, gas akan menduduki isipadu 4 liter, pada 2 kgf / cm2 - 2 liter , pada 4 kgf/cm2 - 1l; pada 8 kgf / cm2 - 0.5 l.
Oleh itu, pada suhu malar, sebarang peningkatan tekanan membawa kepada penurunan dalam isipadu gas, dan penurunan dalam isipadu gas - kepada peningkatan tekanan.
Hubungan antara isipadu gas dan tekanan pada suhu malar digunakan secara meluas untuk pelbagai pengiraan dalam amalan menyelam.
Undang-undang Gay-Lussac dan Charles
Undang-undang Gay-Lussac menyatakan pergantungan isipadu dan tekanan gas pada suhu: pada tekanan malar, isipadu jisim gas tertentu adalah berkadar terus dengan suhu mutlaknya:
di mana T1 dan T2 ialah suhu dalam Kelvin (K), yang sama dengan suhu dalam °C + 273.15; mereka. 0°C? 273 K; 100 ° C - -373 K, dan 0oK \u003d -273.15 ° C.
Oleh itu, sebarang peningkatan suhu membawa kepada peningkatan dalam isipadu, atau, dengan kata lain, perubahan dalam isipadu jisim gas V yang diberikan adalah berkadar terus dengan perubahan suhu t gas pada tekanan malar (iaitu, dalam proses isobarik). Kedudukan ini dinyatakan dengan formula:
di mana V1 ialah isipadu gas pada suhu tertentu; V0 - isipadu awal gas pada 0°С; b - pekali pengembangan isipadu gas.
Apabila gas yang berbeza dipanaskan dengan bilangan darjah yang sama, peningkatan relatif dalam isipadu adalah sama untuk semua gas. Pekali b adalah malar untuk semua gas, nilai kenaikan isipadu, sama dengan 1/273 atau 0.00367 °C-1. Pekali pengembangan isipadu gas ini menunjukkan bahagian isipadu yang diduduki pada 0 ° C, isipadu gas meningkat jika ia dipanaskan sebanyak 1 ° C pada tekanan malar.
Hubungan antara tekanan dan suhu mematuhi corak yang sama, iaitu: perubahan tekanan jisim gas tertentu adalah berkadar terus dengan suhu pada isipadu tetap (iaitu, dalam proses isochoric: dari perkataan Yunani "isos" - sama dan "horema" - kapasiti) , yang dinyatakan oleh formula:
Рt = Р0 (1 + bt),
di mana Pt ialah tekanan gas pada suhu tertentu; P0 -- tekanan gas awal pada 0°C; b - pekali pengembangan isipadu gas.
Hubungan ini telah diwujudkan oleh J. Charles 25 tahun sebelum penerbitan J. L. Gay-Lussac dan sering dipanggil undang-undang Charles. Kebergantungan isipadu pada suhu pada tekanan malar juga pertama kali ditubuhkan oleh Charles.
Apabila suhu gas berkurangan, tekanannya berkurangan, dan pada suhu -273.15 ° C, tekanan mana-mana gas adalah sifar. Suhu ini dipanggil suhu sifar mutlak. Dalam kes ini, pergerakan terma huru-hara molekul berhenti dan jumlah tenaga haba menjadi sama dengan sifar. Kebergantungan di atas, menyatakan undang-undang Charles dan Gay-Lussac, membolehkan menyelesaikan masalah praktikal yang penting dalam penyediaan dan perancangan menyelam bawah air, seperti menentukan tekanan udara dalam silinder dengan perubahan suhu, perubahan yang sepadan dalam rizab udara dan masa yang dihabiskan. pada kedalaman tertentu, dsb. P.
Persamaan keadaan gas ideal
Jika hubungan antara isipadu, tekanan dan suhu disambungkan bersama dan dinyatakan dalam satu persamaan, maka persamaan keadaan gas ideal diperoleh, yang menggabungkan undang-undang Boyle - Mariotte dan Gay-Lussac. Persamaan ini pertama kali diterbitkan oleh B.P. Klaiperon dengan mengubah persamaan yang dicadangkan oleh pendahulunya. Persamaan Claiperon ialah hasil darab tekanan gas dengan jisim dan isipadu tertentu, dibahagikan dengan suhu mutlak, ialah nilai malar, bebas daripada keadaan di mana gas itu berada. Satu cara untuk menulis persamaan ini ialah:
Dalam kes ini, pemalar gas r akan bergantung kepada sifat gas. Jika jisim gas ialah mol (molekul gram), maka pemalar gas R adalah sejagat dan tidak bergantung kepada sifat gas. Untuk jisim gas sama dengan 1 mol, persamaan akan mengambil bentuk berikut:
Nilai tepat R ialah 8.314510 J mol -1 K-1
Jika kita tidak mengambil 1 mol, tetapi sebarang jumlah gas yang mempunyai jisim m, maka keadaan gas ideal boleh dinyatakan oleh persamaan Mendeleev-Claiperon, mudah untuk pengiraan, dalam bentuk yang pertama kali ditulis oleh D.I. Mendeleev. pada tahun 1874:
di mana m ialah jisim gas, g; M ialah jisim molar.
Persamaan keadaan gas ideal boleh digunakan untuk pengiraan dalam amalan menyelam.
Contoh. Tentukan isipadu yang diduduki oleh 2.3 kg hidrogen pada suhu + 10 ° C dan tekanan 125 kgf / cm2
di mana 2300 ialah jisim gas, g; 0.082 - pemalar gas; 283 - suhu T (273+10); 2 - jisim molar hidrogen M. Ia mengikuti daripada persamaan bahawa tekanan yang dikenakan oleh gas pada dinding kapal adalah sama dengan:
Tekanan ini hilang sama ada pada m > 0 (apabila gas hampir hilang), atau pada V> ? (apabila gas mengembang tanpa had), atau pada T > 0 (apabila molekul gas tidak bergerak).
Persamaan Van der Waals
Malah M. V. Lomonosov menegaskan bahawa undang-undang Boyle-Mariotte tidak boleh benar pada tekanan yang sangat tinggi, apabila jarak antara molekul adalah setanding dengan saiz mereka sendiri. Selepas itu, ia telah disahkan sepenuhnya bahawa sisihan daripada kelakuan gas ideal akan menjadi ketara pada tekanan yang sangat tinggi dan suhu yang sangat rendah. Dalam kes ini, persamaan gas ideal akan memberikan hasil yang salah tanpa mengambil kira daya interaksi molekul gas dan isipadu yang didudukinya. Oleh itu, pada tahun 1873, Jan Diederik van der Waals mencadangkan dua pembetulan kepada persamaan ini: untuk tekanan dan untuk isipadu.
undang-undang Avogadro
Avogadro mengemukakan hipotesis yang mana, di bawah keadaan suhu dan tekanan yang sama, semua gas ideal, tanpa mengira sifat kimianya, mengandungi bilangan molekul yang sama setiap unit isipadu. Ia berikutan bahawa jisim isipadu gas yang sama adalah berkadar dengan berat molekulnya.
Berdasarkan undang-undang Avogadro, mengetahui isipadu gas yang dikaji, seseorang boleh menentukan jisimnya dan, sebaliknya, mengetahui isipadunya daripada jisim gas.
Undang-undang dinamik gas
Undang-undang Dalton. Tekanan campuran gas adalah sama dengan jumlah tekanan separa (separa) gas individu yang membentuk campuran, iaitu tekanan yang akan dihasilkan oleh setiap gas secara berasingan jika ia diambil pada suhu yang sama dalam isipadu. daripada campuran itu.
Tekanan gas separa Pr adalah berkadar dengan peratusan C gas yang diberikan dan tekanan mutlak Rabs campuran gas dan ditentukan oleh formula:
Pr \u003d Pa6s C / 100,
di mana Pr ialah tekanan separa gas dalam campuran, kg/cm2; C ialah isipadu kandungan gas dalam campuran, %.
Undang-undang ini boleh digambarkan dengan membandingkan campuran gas dalam isipadu tertutup dengan set pemberat yang berlainan berat diletakkan pada neraca. Jelas sekali, setiap pemberat akan memberi tekanan pada penimbang tanpa mengira kehadiran pemberat lain di atasnya.
 Kesan Suhu dan Tekanan pada Gas Ketumpatan Gas, berbeza dengan cecair yang jatuh, dicirikan oleh kebolehmampatan yang ketara dan nilai pekali pengembangan haba yang tinggi. Kebergantungan ketumpatan gas pada tekanan dan suhu ditentukan oleh persamaan keadaan. Sifat yang paling mudah dimiliki oleh gas yang jarang sehinggakan interaksi antara molekulnya boleh diabaikan. Ini adalah gas ideal (sempurna), yang mana persamaan Mendeleev-Clapeyron adalah sah:
Kesan Suhu dan Tekanan pada Gas Ketumpatan Gas, berbeza dengan cecair yang jatuh, dicirikan oleh kebolehmampatan yang ketara dan nilai pekali pengembangan haba yang tinggi. Kebergantungan ketumpatan gas pada tekanan dan suhu ditentukan oleh persamaan keadaan. Sifat yang paling mudah dimiliki oleh gas yang jarang sehinggakan interaksi antara molekulnya boleh diabaikan. Ini adalah gas ideal (sempurna), yang mana persamaan Mendeleev-Clapeyron adalah sah:
 Pengaruh suhu dan tekanan pada ketumpatan gas р - tekanan mutlak; R - pemalar gas tertentu, berbeza untuk gas yang berbeza, tetapi bebas daripada suhu dan tekanan (untuk udara R = 287 J / (kg K); T - suhu mutlak. Kelakuan gas sebenar dalam keadaan jauh daripada pencairan hanya berbeza sedikit pada tingkah laku gas sempurna, dan bagi mereka dalam julat yang luas adalah mungkin untuk menggunakan persamaan keadaan gas sempurna.
Pengaruh suhu dan tekanan pada ketumpatan gas р - tekanan mutlak; R - pemalar gas tertentu, berbeza untuk gas yang berbeza, tetapi bebas daripada suhu dan tekanan (untuk udara R = 287 J / (kg K); T - suhu mutlak. Kelakuan gas sebenar dalam keadaan jauh daripada pencairan hanya berbeza sedikit pada tingkah laku gas sempurna, dan bagi mereka dalam julat yang luas adalah mungkin untuk menggunakan persamaan keadaan gas sempurna.
 Pengaruh suhu dan tekanan ke atas ketumpatan gas Dalam pengiraan teknikal, ketumpatan gas biasanya dibawa ke keadaan fizikal biasa: T=20°C; p = 101325 Pa. Untuk udara dalam keadaan ini, ρ = 1.2 kg / m 3. Ketumpatan udara dalam keadaan lain ditentukan oleh formula:
Pengaruh suhu dan tekanan ke atas ketumpatan gas Dalam pengiraan teknikal, ketumpatan gas biasanya dibawa ke keadaan fizikal biasa: T=20°C; p = 101325 Pa. Untuk udara dalam keadaan ini, ρ = 1.2 kg / m 3. Ketumpatan udara dalam keadaan lain ditentukan oleh formula:
 Pengaruh suhu dan tekanan ke atas ketumpatan gas Menurut formula ini untuk proses isoterma (T = const): Proses adiabatik ialah proses yang berlaku tanpa pemindahan haba luar. Untuk proses adiabatik, k=cp /cv ialah pemalar adiabatik bagi gas; cp - kapasiti haba, gas pada tekanan malar; cv - sama, pada volum tetap.
Pengaruh suhu dan tekanan ke atas ketumpatan gas Menurut formula ini untuk proses isoterma (T = const): Proses adiabatik ialah proses yang berlaku tanpa pemindahan haba luar. Untuk proses adiabatik, k=cp /cv ialah pemalar adiabatik bagi gas; cp - kapasiti haba, gas pada tekanan malar; cv - sama, pada volum tetap.
 Pengaruh suhu dan tekanan ke atas ketumpatan gas Satu ciri penting yang menentukan pergantungan perubahan ketumpatan dengan perubahan tekanan dalam aliran yang bergerak ialah kelajuan perambatan bunyi a. Dalam medium homogen, kelajuan perambatan bunyi ditentukan daripada ungkapan: Untuk udara a = 330 m/s; untuk karbon dioksida 261 m/s.
Pengaruh suhu dan tekanan ke atas ketumpatan gas Satu ciri penting yang menentukan pergantungan perubahan ketumpatan dengan perubahan tekanan dalam aliran yang bergerak ialah kelajuan perambatan bunyi a. Dalam medium homogen, kelajuan perambatan bunyi ditentukan daripada ungkapan: Untuk udara a = 330 m/s; untuk karbon dioksida 261 m/s.
 Pengaruh suhu dan tekanan ke atas ketumpatan gas Memandangkan isipadu gas sebahagian besarnya bergantung kepada suhu dan tekanan, kesimpulan yang diperolehi dalam kajian cecair yang jatuh boleh dilanjutkan kepada gas hanya jika perubahan tekanan dan suhu tidak ketara dalam fenomena di bawah. pertimbangan. 3 Perbezaan tekanan yang ketara, menyebabkan perubahan ketara dalam ketumpatan gas, boleh berlaku apabila ia bergerak pada kelajuan tinggi. Nisbah antara kelajuan pergerakan dan kelajuan bunyi di dalamnya memungkinkan untuk menilai keperluan untuk mengambil kira kebolehmampatan dalam setiap kes tertentu.
Pengaruh suhu dan tekanan ke atas ketumpatan gas Memandangkan isipadu gas sebahagian besarnya bergantung kepada suhu dan tekanan, kesimpulan yang diperolehi dalam kajian cecair yang jatuh boleh dilanjutkan kepada gas hanya jika perubahan tekanan dan suhu tidak ketara dalam fenomena di bawah. pertimbangan. 3 Perbezaan tekanan yang ketara, menyebabkan perubahan ketara dalam ketumpatan gas, boleh berlaku apabila ia bergerak pada kelajuan tinggi. Nisbah antara kelajuan pergerakan dan kelajuan bunyi di dalamnya memungkinkan untuk menilai keperluan untuk mengambil kira kebolehmampatan dalam setiap kes tertentu.
 Pengaruh suhu dan tekanan pada ketumpatan gas Jika cecair atau gas bergerak, maka untuk menilai kebolehmampatan, mereka tidak menggunakan nilai mutlak kelajuan bunyi, tetapi nombor Mach, sama dengan nisbah halaju aliran kepada kelajuan bunyi. М = ν/а Jika nombor Mach jauh lebih kecil daripada kesatuan, maka cecair atau gas yang jatuh boleh dianggap tidak boleh mampat secara praktikal
Pengaruh suhu dan tekanan pada ketumpatan gas Jika cecair atau gas bergerak, maka untuk menilai kebolehmampatan, mereka tidak menggunakan nilai mutlak kelajuan bunyi, tetapi nombor Mach, sama dengan nisbah halaju aliran kepada kelajuan bunyi. М = ν/а Jika nombor Mach jauh lebih kecil daripada kesatuan, maka cecair atau gas yang jatuh boleh dianggap tidak boleh mampat secara praktikal
 Keseimbangan gas Pada ketinggian kecil lajur gas, ketumpatannya boleh dianggap sama sepanjang ketinggian lajur: maka tekanan yang dicipta oleh lajur ini ditentukan oleh persamaan asas hidrostatik. Apabila lajur udara tinggi, ketumpatannya pada titik yang berbeza tidak lagi sama, jadi persamaan hidrostatik tidak terpakai dalam kes ini.
Keseimbangan gas Pada ketinggian kecil lajur gas, ketumpatannya boleh dianggap sama sepanjang ketinggian lajur: maka tekanan yang dicipta oleh lajur ini ditentukan oleh persamaan asas hidrostatik. Apabila lajur udara tinggi, ketumpatannya pada titik yang berbeza tidak lagi sama, jadi persamaan hidrostatik tidak terpakai dalam kes ini.
 Keseimbangan gas Memandangkan persamaan tekanan pembezaan untuk kes rehat mutlak dan menggantikan nilai ketumpatan ke dalamnya, kita mempunyai Untuk menyepadukan persamaan ini, adalah perlu untuk mengetahui undang-undang perubahan suhu udara berkenaan dengan ketinggian udara. kolum. Ia tidak mungkin untuk menyatakan perubahan suhu dengan fungsi mudah ketinggian atau tekanan, jadi penyelesaian persamaan hanya boleh menjadi anggaran.
Keseimbangan gas Memandangkan persamaan tekanan pembezaan untuk kes rehat mutlak dan menggantikan nilai ketumpatan ke dalamnya, kita mempunyai Untuk menyepadukan persamaan ini, adalah perlu untuk mengetahui undang-undang perubahan suhu udara berkenaan dengan ketinggian udara. kolum. Ia tidak mungkin untuk menyatakan perubahan suhu dengan fungsi mudah ketinggian atau tekanan, jadi penyelesaian persamaan hanya boleh menjadi anggaran.
 Keseimbangan gas Untuk lapisan individu atmosfera, ia boleh diandaikan dengan ketepatan yang mencukupi bahawa perubahan suhu bergantung pada ketinggian (dan untuk lombong - pada kedalaman) berlaku mengikut undang-undang linear: T = T 0 + αz, di mana T dan T 0 ialah suhu udara mutlak, masing-masing, pada ketinggian (kedalaman) z dan di permukaan bumi kecerunan suhu α yang mencirikan perubahan suhu udara dengan peningkatan ketinggian (-α) atau kedalaman (+α) sebanyak 1 m, K / m.
Keseimbangan gas Untuk lapisan individu atmosfera, ia boleh diandaikan dengan ketepatan yang mencukupi bahawa perubahan suhu bergantung pada ketinggian (dan untuk lombong - pada kedalaman) berlaku mengikut undang-undang linear: T = T 0 + αz, di mana T dan T 0 ialah suhu udara mutlak, masing-masing, pada ketinggian (kedalaman) z dan di permukaan bumi kecerunan suhu α yang mencirikan perubahan suhu udara dengan peningkatan ketinggian (-α) atau kedalaman (+α) sebanyak 1 m, K / m.
 Keseimbangan gas Nilai pekali α adalah berbeza di kawasan yang berbeza di sepanjang ketinggian di atmosfera atau di sepanjang kedalaman dalam lombong. Di samping itu, ia juga bergantung kepada keadaan meteorologi, masa dalam setahun, dan faktor lain. Apabila menentukan suhu dalam troposfera (iaitu, sehingga 11000 m), mereka biasanya mengambil α = 0.0065 K/m; untuk lombong dalam, nilai purata α diambil bersamaan dengan 0.004÷ 0.006 K/m basah - 0.01.
Keseimbangan gas Nilai pekali α adalah berbeza di kawasan yang berbeza di sepanjang ketinggian di atmosfera atau di sepanjang kedalaman dalam lombong. Di samping itu, ia juga bergantung kepada keadaan meteorologi, masa dalam setahun, dan faktor lain. Apabila menentukan suhu dalam troposfera (iaitu, sehingga 11000 m), mereka biasanya mengambil α = 0.0065 K/m; untuk lombong dalam, nilai purata α diambil bersamaan dengan 0.004÷ 0.006 K/m basah - 0.01.
 Keseimbangan gas Menggantikan formula perubahan suhu ke dalam persamaan pembezaan tekanan dan mengintegrasikannya, kita memperoleh Persamaan diselesaikan berkenaan dengan H, menggantikan logaritma asli dengan yang perpuluhan, α - nilainya daripada persamaan melalui suhu, R - nilai untuk udara, bersamaan dengan 287 J / (kg K) ; dan gantikan g = 9.81 m/s2.
Keseimbangan gas Menggantikan formula perubahan suhu ke dalam persamaan pembezaan tekanan dan mengintegrasikannya, kita memperoleh Persamaan diselesaikan berkenaan dengan H, menggantikan logaritma asli dengan yang perpuluhan, α - nilainya daripada persamaan melalui suhu, R - nilai untuk udara, bersamaan dengan 287 J / (kg K) ; dan gantikan g = 9.81 m/s2.
 Keseimbangan gas Hasil daripada tindakan ini, formula barometrik H \u003d 29, 3 (T-T 0) (lg p / p 0) / (lg. T 0 / T), serta formula untuk menentukan tekanan, di mana n ditentukan oleh formula
Keseimbangan gas Hasil daripada tindakan ini, formula barometrik H \u003d 29, 3 (T-T 0) (lg p / p 0) / (lg. T 0 / T), serta formula untuk menentukan tekanan, di mana n ditentukan oleh formula
 PERGERAKAN GAS TETAP DALAM PAIP Undang-undang pemuliharaan tenaga dalam bentuk mekanikal untuk unsur panjang dx paip bulat dengan diameter d, dengan syarat perubahan ketinggian geodesik adalah kecil berbanding dengan perubahan tekanan piezometrik, mempunyai proses bentuk. dengan eksponen politropik malar n = const dan mengandaikan bahawa λ= const selepas penyepaduan, undang-undang pengagihan tekanan di sepanjang saluran paip gas diperolehi
PERGERAKAN GAS TETAP DALAM PAIP Undang-undang pemuliharaan tenaga dalam bentuk mekanikal untuk unsur panjang dx paip bulat dengan diameter d, dengan syarat perubahan ketinggian geodesik adalah kecil berbanding dengan perubahan tekanan piezometrik, mempunyai proses bentuk. dengan eksponen politropik malar n = const dan mengandaikan bahawa λ= const selepas penyepaduan, undang-undang pengagihan tekanan di sepanjang saluran paip gas diperolehi
 PERGERAKAN GAS MANTAP DALAM PAIP
PERGERAKAN GAS MANTAP DALAM PAIP
 PERGERAKAN GAS TETAP DALAM PAIP M ω Pada n = 1, formula adalah sah untuk aliran gas isoterma mantap. Pekali rintangan hidraulik λ untuk gas, bergantung pada nombor Reynolds, boleh dikira daripada formula yang digunakan dalam aliran bendalir.
PERGERAKAN GAS TETAP DALAM PAIP M ω Pada n = 1, formula adalah sah untuk aliran gas isoterma mantap. Pekali rintangan hidraulik λ untuk gas, bergantung pada nombor Reynolds, boleh dikira daripada formula yang digunakan dalam aliran bendalir.
 Apabila menggerakkan gas hidrokarbon sebenar untuk proses isoterma, persamaan keadaan digunakan di mana faktor kebolehmampatan z gas hidrokarbon asli ditentukan daripada lengkung eksperimen atau secara analitik daripada persamaan anggaran keadaan.
Apabila menggerakkan gas hidrokarbon sebenar untuk proses isoterma, persamaan keadaan digunakan di mana faktor kebolehmampatan z gas hidrokarbon asli ditentukan daripada lengkung eksperimen atau secara analitik daripada persamaan anggaran keadaan.
 ω
ω
SIFAT FIZIKAL GAS
1. Ketumpatan gas - jisim 1 m 3 gas pada suhu 0 0 dan tekanan 0.1 MPa (760 mm Hg). Ketumpatan gas bergantung kepada tekanan dan suhu. Ketumpatan gas berbeza dalam 0.55 - 1 g / cm 3.
Selalu digunakan ketumpatan relatif melalui udara (nilai tanpa dimensi - nisbah ketumpatan gas kepada ketumpatan udara; dalam keadaan normal, ketumpatan udara ialah 1.293 kg / m 3).
2. Kelikatan gas - geseran dalaman gas yang berlaku semasa pergerakannya. Kelikatan gas adalah sangat rendah 1 . 10 -5 Pa.s. Kelikatan gas yang begitu rendah memastikan pergerakannya yang tinggi melalui retakan dan liang.
3. Keterlarutan gas - salah satu sifat yang paling penting. Keterlarutan gas dalam minyak atau air pada tekanan tidak lebih daripada 5 MPa tertakluk kepada undang-undang Henry, iaitu jumlah gas terlarut adalah berkadar terus dengan tekanan dan pekali keterlarutan.
Pada tekanan yang lebih tinggi, keterlarutan gas sudah ditentukan oleh beberapa penunjuk: suhu, komposisi kimia, kemasinan air bawah tanah, dll. Keterlarutan gas hidrokarbon dalam minyak adalah 10 kali lebih besar daripada dalam air. Gas basah lebih mudah larut dalam minyak daripada gas kering. Minyak yang lebih ringan melarutkan lebih banyak gas daripada minyak berat.
4. Suhu gas kritikal. Bagi setiap gas terdapat suhu di atasnya yang tidak berubah menjadi keadaan cecair, tidak kira berapa tinggi tekanan, i.e. kritikal t(untuk CH 4 t cr = -82.1 0 C). Homolog metana boleh berada dalam keadaan cair (untuk C 2 H 6 t cr \u003d 32.2 0 C, C 3 H 8 t cr = 97.0 0 C).
5. Penyebaran- ini ialah pergerakan gas secara spontan pada tahap molekul ke arah penurunan kepekatan.
6. Faktor isipadu gas pembentukan ialah nisbah isipadu gas dalam keadaan takungan kepada isipadu gas yang sama di bawah keadaan piawai
(T =0 0 dan P=0.1 MPa).
V g \u003d V g pl / V g st
Isipadu gas dalam takungan adalah 100 kali kurang daripada di bawah keadaan standard, kerana gas sangat boleh mampat.
GAS KODENSAT
Bukan sahaja gas boleh larut dalam minyak, tetapi minyak juga boleh larut dalam gas. Ini berlaku dalam keadaan tertentu, iaitu:
1) isipadu gas lebih besar daripada isipadu minyak;
2) tekanan 20-25 MPa;
3) suhu 90-95 0 С.
Di bawah keadaan ini, hidrokarbon cecair mula larut dalam gas. Secara beransur-ansur, campuran sepenuhnya bertukar menjadi gas. Fenomena ini dipanggil penyejatan retrograde. Apabila salah satu keadaan berubah, sebagai contoh, apabila tekanan takungan berkurangan semasa pembangunan, kondensat mula memisahkan daripada campuran ini dalam bentuk hidrokarbon cecair. Komposisinya: C 5, H 12 (pentana) dan ke atas. Fenomena ini dipanggil pemeluwapan retrograde.
Kondensat gas ialah bahagian cecair pengumpulan kondensat gas. Kondensat gas dipanggil minyak ringan, kerana ia tidak mengandungi bahan resin asfalt. Ketumpatan kondensat gas ialah 0.65-0.71 g/cm 3 . Ketumpatan kondensat gas meningkat dengan kedalaman, dan ia juga berubah (biasanya meningkat) semasa pembangunan.
Bezakan antara kondensat mentah dan stabil.
Mentah ialah fasa cecair yang diekstrak ke permukaan, di mana komponen gas dibubarkan. Kondensat mentah diperoleh secara langsung dalam pemisah medan pada tekanan dan suhu pemisahan.
Kondensat gas stabil diperoleh daripada gas mentah dengan penyahgasannya; ia terdiri daripada hidrokarbon cecair (pentana) dan yang lebih tinggi.
GAS HIDRAT
Kebanyakan gas membentuk hidrat kristal dengan air - pepejal. Bahan ini dipanggil gas hidrat dan terbentuk pada suhu rendah, tekanan tinggi dan pada kedalaman cetek. Mereka kelihatan seperti ais atau salji yang longgar. Deposit jenis ini telah ditemui di kawasan permafrost Siberia Barat dan Timur dan di perairan laut utara.
Masalah penggunaan gas hidrat masih belum cukup berkembang. Semua isu pengeluaran gas hidrat dikurangkan kepada mewujudkan keadaan dalam takungan di mana hidrat gas akan terurai menjadi gas dan air.
Untuk ini anda perlukan:
1) pengurangan tekanan dalam takungan;
2) peningkatan suhu;
3) penambahan reagen khas.
Corak dan perubahan sifat minyak dan gas dalam deposit dan deposit
Jadi ia adalah akibat daripada perubahan fizikal dan kimia dalam minyak dan gas yang berlaku di bawah pengaruh air yang menembusi ke dalam deposit dan perubahan dalam tekanan dan suhu takungan. Oleh itu, untuk ramalan yang munasabah tentang perubahan sifat minyak dan gas dalam proses pembangunan, adalah perlu untuk mempunyai idea yang jelas: a) tentang corak perubahan sifat minyak dan gas dari segi jumlah deposit. sebelum permulaan pembangunan; b) mengenai proses interaksi fizikal dan kimia minyak dan gas dengan air yang memasuki takungan (terutama dengan air yang disuntik dengan komposisi yang berbeza daripada air pembentukan); c) tentang arah pergerakan bendalir dalam takungan akibat operasi telaga; d) perubahan dalam tekanan dan suhu takungan semasa tempoh pembangunan deposit. Corak perubahan sifat minyak dan gas mengikut isipadu deposit. Keseragaman lengkap sifat minyak dan gas yang terlarut di dalamnya dalam deposit yang sama adalah fenomena yang agak jarang berlaku. Bagi mendapan minyak, perubahan sifat biasanya agak teratur dan nyata terutamanya dalam peningkatan ketumpatan, termasuk ketumpatan optik, kelikatan, kandungan bahan resin asfalt, parafin dan sulfur apabila kedalaman takungan meningkat, iaitu dari kubah ke sayap dan dari bumbung ke tapak dalam lapisan tebal. Perubahan ketumpatan sebenar dalam kebanyakan deposit biasanya tidak melebihi 0.05-0.07 g/cm3. Walau bagaimanapun, selalunya kecerunan meningkat ketumpatan dan nilai mutlaknya meningkat secara mendadak dalam jarak dekat dengan sentuhan minyak-air. Selalunya, ketumpatan minyak di atas lapisan penebat boleh dikatakan malar. -kir batuan, ketumpatan minyak berkurangan dengan meningkatkan kedalaman, mencapai minimum, dan kemudian meningkat apabila ia menghampiri OWC. Corak yang diterangkan adalah paling tipikal untuk deposit deposit yang tinggi di kawasan berlipat. Sebab utama pembentukannya ialah pembezaan graviti (stratifikasi) minyak mengikut ketumpatan di dalam deposit, serupa dengan stratifikasi gas, minyak dan air di dalam takungan. Perubahan ketara dalam sifat minyak di zon OWC dan di bahagian atas deposit minyak jenis terbuka dikaitkan dengan proses oksidatif.
Bagi takungan kawasan platform dengan aras galas minyak yang rendah dan zon WOC yang luas, stratifikasi graviti adalah lebih lemah dan pengaruh utama ke atas perubahan sifat minyak adalah disebabkan oleh proses oksidatif dalam zon yang di bawah dasar air.
Pada masa yang sama dengan peningkatan ketumpatan minyak, sebagai peraturan, kelikatannya meningkat, kandungan bahan asfalt-resin dan parafin, dan kandungan gas dan tekanan tepu gas terlarut juga berkurangan.
Walaupun aktiviti resapan gas yang tinggi, kebolehubahan komposisi mereka dalam satu takungan adalah jauh daripada fenomena yang jarang berlaku. Ia menunjukkan dirinya paling ketara dalam kandungan komponen berasid - karbon dioksida CO 2 dan terutamanya hidrogen sulfida H 2 S. Dalam pengedaran hidrogen sulfida, pengezonan biasanya diperhatikan, yang dinyatakan dalam perubahan tetap dalam kepekatan hidrogen sulfida ke atas. kawasan. Biasanya tiada perubahan biasa yang jelas dalam kepekatan sepanjang ketinggian deposit.
Deposit kondensat gas tanpa rim minyak dengan tahap kandungan gas yang rendah dan nisbah gas-kondensat yang rendah, sebagai peraturan, mempunyai komposisi gas, komposisi dan hasil kondensat yang agak stabil. Walau bagaimanapun, apabila ketinggian deposit kondensat gas adalah lebih daripada 300 m, proses stratifikasi graviti mula nyata nyata, membawa kepada peningkatan kandungan kondensat ke bawah penurunan pembentukan, terutamanya secara mendadak untuk deposit dengan tinggi. aras galas gas dan rim minyak. Dalam kes ini, kandungan kondensat di kawasan bawah deposit boleh beberapa kali lebih tinggi daripada di gerbang deposit. Khususnya, contoh diketahui apabila nisbah gas kondensat dalam telaga bahagian berhampiran air deposit adalah 180 cm 3 /m 3, dan berhampiran sentuhan gas-minyak - 780 cm 3 /m 3, iaitu, dalam deposit yang sama, kandungan kondensat berubah dalam 4 kali. Turun naik sebanyak 1.5--2 kali adalah perkara biasa bagi kebanyakan medan dengan kandungan gas tahap tinggi dengan saluran keluar kondensat lebih daripada 100 cm 3 /m 3.
Sifat fizikokimia minyak dan parameter yang mencirikannya: ketumpatan, kelikatan, kebolehmampatan, pekali isipadu. Kebergantungan mereka pada suhu dan tekanan
Sifat fizikal minyak takungan adalah sangat berbeza daripada minyak ternyahgas permukaan, yang disebabkan oleh pengaruh suhu, tekanan dan gas terlarut. Perubahan dalam sifat fizikal minyak takungan yang berkaitan dengan keadaan termodinamik kehadirannya di dalam takungan diambil kira apabila mengira rizab minyak dan gas petroleum, apabila mereka bentuk, membangun dan mengendalikan medan minyak.
Ketumpatan minyak dinyahgas berbeza-beza dalam julat yang luas - dari 600 hingga 1000 kg/m 3 dan lebih banyak, dan bergantung terutamanya pada komposisi hidrokarbon dan kandungan bahan asfalt-resin.
Ketumpatan minyak dalam keadaan takungan bergantung kepada jumlah gas terlarut, suhu dan tekanan. Dengan peningkatan tekanan, ketumpatan sedikit meningkat, dan dengan peningkatan dalam dua faktor lain, ia berkurangan. Pengaruh faktor yang terakhir lebih ketara. Ketumpatan minyak tepu dengan nitrogen atau karbon dioksida meningkat sedikit dengan peningkatan tekanan.
Kesan jumlah gas terlarut dan suhu adalah lebih kuat. Oleh itu, ketumpatan gas akibatnya sentiasa kurang daripada ketumpatan minyak ternyahgas di permukaan. Dengan peningkatan tekanan, ketumpatan minyak berkurangan dengan ketara, yang dikaitkan dengan ketepuan minyak dengan gas. Peningkatan tekanan di atas tekanan tepu minyak dengan gas menyumbang kepada beberapa peningkatan dalam ketumpatan minyak.
Ketumpatan air pembentukan, sebagai tambahan kepada tekanan, suhu dan gas terlarut, sangat dipengaruhi oleh kemasinan mereka. Apabila kepekatan garam dalam air pembentukan ialah 643 kg/m 3 ketumpatannya mencapai 1450 kg/m 3 .
Nisbah isipadu. Apabila gas larut dalam cecair, isipadunya bertambah. Nisbah isipadu cecair dengan gas yang terlarut di dalamnya dalam keadaan takungan kepada isipadu cecair yang sama di permukaan selepas penyahgasannya dipanggil pekali isipadu.
b=V PL / V SOV
di mana V PL ialah isipadu minyak dalam keadaan takungan; V POV - isipadu minyak yang sama pada tekanan atmosfera dan t=20°C selepas penyahgas.
Oleh kerana sejumlah besar gas hidrokarbon boleh larut dalam minyak (walaupun 1000 atau lebih m 3 dalam 1 m 3 minyak), bergantung kepada keadaan termodinamik, pekali isipadu minyak boleh mencapai 3.5 atau lebih. Pekali isipadu untuk air pembentukan ialah 0.99-1.06.
Pengurangan dalam isipadu minyak pulih berbanding dengan isipadu minyak dalam takungan, dinyatakan sebagai peratusan, dipanggil "pengecutan"
u=(b-1) / b *100%
Apabila tekanan berkurangan dari takungan awal p 0 kepada tekanan tepu, pekali isipadu berubah sedikit, kerana minyak dengan gas terlarut di dalamnya berkelakuan di kawasan ini sebagai cecair mampat lemah biasa, mengembang sedikit dengan tekanan yang berkurangan. Apabila tekanan berkurangan, gas dibebaskan secara beransur-ansur dari minyak dan faktor isipadu berkurangan. Peningkatan suhu minyak memburukkan keterlarutan gas, yang membawa kepada penurunan pekali isipadu
Kelikatan. Kelikatan adalah salah satu ciri minyak yang paling penting. Kelikatan minyak diambil kira dalam hampir semua pengiraan hidrodinamik yang berkaitan dengan bendalir mengangkat melalui tiub, telaga siram, mengangkut produk telaga melalui paip dalam, memproses zon pembentukan lubang bawah dengan pelbagai kaedah, serta dalam pengiraan yang berkaitan dengan pergerakan minyak dalam takungan.
Kelikatan minyak takungan sangat berbeza daripada kelikatan minyak permukaan, kerana ia mengandungi gas terlarut dalam komposisinya dan berada di bawah keadaan tekanan dan suhu tinggi. Dengan peningkatan jumlah gas dan suhu terlarut, kelikatan minyak berkurangan.
Peningkatan tekanan di bawah tekanan tepu membawa kepada peningkatan dalam GOR dan, akibatnya, kepada penurunan kelikatan. Peningkatan tekanan di atas tekanan tepu untuk minyak takungan membawa kepada peningkatan kelikatan
Dengan peningkatan berat molekul minyak, kelikatannya meningkat. Juga, kelikatan minyak sangat dipengaruhi oleh kandungan parafin dan bahan resin asfalt di dalamnya, sebagai peraturan, ke arah peningkatannya.
Kebolehmampatan minyak. Minyak mempunyai keanjalan, iaitu keupayaan untuk mengubah isipadunya di bawah pengaruh tekanan luaran. Keanjalan cecair diukur dengan pekali kebolehmampatan, yang ditakrifkan sebagai nisbah perubahan isipadu cecair kepada isipadu asalnya dengan perubahan tekanan:
β P =ΔV/(VΔP) , di mana
ΔV ialah perubahan isipadu minyak; V ialah isipadu awal minyak; ΔP - perubahan tekanan
Pekali kebolehmampatan minyak takungan bergantung kepada komposisi, kandungan gas terlarut di dalamnya, suhu dan tekanan mutlak.
Minyak yang dinyahgas mempunyai pekali kebolehmampatan yang agak rendah, dari urutan (4-7) * 10 -10 1/Pa, dan minyak ringan yang mengandungi sejumlah besar gas terlarut dalam komposisinya - sehingga 140 * 10 -10 1 / Pa . Semakin tinggi suhu, semakin tinggi faktor kebolehmampatan.
Ketumpatan.
Ketumpatan biasanya difahami sebagai jisim bahan yang terkandung dalam isipadu unit. Sehubungan itu, dimensi kuantiti ini ialah kg / m 3 atau g / cm 3.
ρ=m/V
Ketumpatan minyak dalam keadaan takungan berkurangan disebabkan oleh gas yang terlarut di dalamnya dan disebabkan oleh peningkatan suhu. Walau bagaimanapun, apabila tekanan jatuh di bawah tekanan tepu, pergantungan ketumpatan minyak adalah tidak monotonik, dan apabila tekanan meningkat melebihi tekanan tepu, minyak mengecut dan ketumpatan sedikit meningkat.
Kelikatan minyak.
Kelikatan mencirikan daya geseran (rintangan dalam) yang berlaku di antara dua lapisan bersebelahan di dalam cecair atau gas per unit permukaan semasa pergerakan bersama mereka.
Kelikatan minyak ditentukan secara eksperimen pada viskometer VVD-U khas. Prinsip operasi viskometer adalah berdasarkan pengukuran masa jatuh bola logam dalam cecair yang disiasat.
Kelikatan minyak ditentukan oleh formula:
μ = t (ρ w - ρ l) k
t – masa jatuh bola, s
ρ w dan ρ w - ketumpatan bola dan cecair, kg / m 3
k ialah pemalar viskometer
Peningkatan suhu menyebabkan penurunan kelikatan minyak (Rajah 2. a). Peningkatan tekanan di bawah tekanan tepu membawa kepada peningkatan dalam GOR dan, akibatnya, kepada penurunan kelikatan. Peningkatan tekanan di atas tekanan tepu untuk minyak takungan membawa kepada peningkatan kelikatan (Rajah 2. b).
Nilai kelikatan minimum berlaku apabila tekanan dalam takungan menjadi sama dengan tekanan tepu takungan.
Kebolehmampatan minyak
Minyak mempunyai keanjalan. Sifat keanjalan minyak dianggarkan oleh faktor kebolehmampatan minyak. Kebolehmampatan minyak difahami sebagai keupayaan cecair untuk menukar isipadunya di bawah tekanan:
β n = (1)
β n - pekali kebolehmampatan minyak, MPa -1-
V n - isipadu awal minyak, m 3
∆V – ukuran isipadu minyak di bawah ukuran tekanan ∆Р
Pekali kebolehmampatan mencirikan perubahan relatif dalam isipadu unit minyak dengan perubahan tekanan per unit. Ia bergantung kepada komposisi minyak takungan, suhu dan tekanan mutlak. Dengan peningkatan suhu, pekali kebolehmampatan meningkat.
Nisbah isipadu
Faktor isipadu difahamkan sebagai nilai yang menunjukkan berapa kali isipadu minyak dalam keadaan takungan melebihi isipadu minyak yang sama selepas pelepasan gas di permukaan.
dalam \u003d V pl / V deg
c - pekali isipadu
V pl dan V deg - isipadu takungan dan minyak nyahgas, m 3
Dengan penurunan tekanan dari takungan awal p 0 kepada tekanan tepu (bahagian ab), pekali isipadu berubah sedikit, kerana minyak dengan gas terlarut di dalamnya berkelakuan di kawasan ini sebagai cecair mampat lemah biasa, mengembang sedikit dengan tekanan yang berkurangan.
Apabila tekanan berkurangan, gas dibebaskan secara beransur-ansur dari minyak dan faktor isipadu berkurangan. Peningkatan suhu minyak memburukkan keterlarutan gas, yang membawa kepada penurunan pekali isipadu.
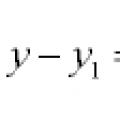 Persamaan garis dan lengkung dalam satah
Persamaan garis dan lengkung dalam satah Persamaan homogen umum Persamaan homogen umum tertib kedua
Persamaan homogen umum Persamaan homogen umum tertib kedua Terima kasih kepada koma Kerana fakta bahawa dalam mereka
Terima kasih kepada koma Kerana fakta bahawa dalam mereka