Vanadium (unsur kimia): sejarah nama, struktur atom, valens. Vanadium - ciri unsur kimia dengan foto; peranan biologinya dalam tubuh manusia; senarai sumber di mana ia terkandung
DEFINISI
Vanadium ialah unsur kedua puluh tiga Jadual Berkala. Jawatan - V dari bahasa Latin "vanadium". Terletak dalam tempoh keempat, kumpulan VB. Merujuk kepada logam. Caj nuklear ialah 23.
Sebatian vanadium diedarkan secara meluas dalam alam semula jadi, tetapi ia sangat tersebar dan tidak membentuk sebarang pengumpulan yang ketara; jumlah kandungan vanadium dalam kerak bumi dianggarkan 0.0015% (jisim).
Vanadium tulen ialah logam keperakan (Rajah 1) logam mudah ditempa dengan ketumpatan 5.96 g / cm 3, lebur pada suhu 1900 o C. Seperti titanium, sifat mekanikal vanadium merosot secara mendadak jika ia mengandungi kekotoran oksigen, nitrogen. , hidrogen.
nasi. 1. Vanadium. Penampilan.
Berat atom dan molekul vanadium
Berat molekul relatif bahan (M r) ialah nombor yang menunjukkan berapa kali jisim molekul tertentu lebih besar daripada 1/12 jisim atom karbon, dan jisim atom relatif unsur (Ar r) ialah berapa kali purata jisim atom bagi unsur kimia lebih besar daripada 1/12 jisim atom karbon.
Oleh kerana dalam keadaan bebas kalsium wujud dalam bentuk molekul monatomik V, nilai jisim atom dan molekulnya adalah sama. Ia bersamaan dengan 50.9962.
Isotop vanadium
Adalah diketahui bahawa dalam alam semula jadi vanadium boleh dalam bentuk satu-satunya isotop stabil 51 V. Nombor jisim ialah 51, nukleus atom mengandungi dua puluh tiga proton dan dua puluh lapan neutron.
Terdapat isotop tiruan vanadium dengan nombor jisim dari 40 hingga 65, di antaranya yang paling stabil ialah 50 V dengan separuh hayat 1.5 × 10 17 tahun, serta lima isotop nuklear.
Ion vanadium
Pada tahap tenaga luar atom vanadium, terdapat lima elektron yang valensi:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 2 4s 2 .
Hasil daripada interaksi kimia, vanadium melepaskan elektron valensnya, i.e. adalah penderma mereka, dan bertukar menjadi ion bercas positif:
V o -2e → V 2+;
V o -3e → V 3+;
V o -4e → V 4+;
V o -5e → V 5+.
Molekul dan atom vanadium
Dalam keadaan bebas, vanadium wujud dalam bentuk molekul monatomik V. Berikut adalah beberapa sifat yang mencirikan atom dan molekul vanadium:
Aloi vanadium
Vanadium digunakan terutamanya sebagai bahan tambahan kepada keluli. Keluli yang mengandungi hanya 0.1 - 0.3% vanadium dicirikan oleh kekuatan tinggi, keanjalan dan ketidakpekaan terhadap hentakan dan hentaman, yang amat penting, contohnya, untuk gandar kereta, yang sentiasa mengalami kejutan. Sebagai peraturan, vanadium dimasukkan ke dalam keluli dalam kombinasi dengan unsur mengaloi lain: kromium, nikel, tungsten, molibdenum.
Contoh penyelesaian masalah
CONTOH 1
DEFINISI
Dalam bentuk bahan mudah vanadium logam refraktori kelabu dengan kekisi padu berpusat badan. Ia terletak dalam tempoh keempat kumpulan V subkumpulan sekunder (B) Jadual Berkala.
Ketumpatan - 6.11 g / cm 3. Takat lebur dan takat didih ialah 1920 o C dan 3400 o C, masing-masing. Sifat fizikokimia vanadium sangat bergantung pada ketulenan logam. Oleh itu, logam tulen boleh ditempa, manakala kehadiran bendasing di dalamnya sangat menjejaskan kemulurannya dan meningkatkan kekerasannya. Di bawah keadaan biasa, ia adalah logam yang tahan kimia.
Valensi vanadium dalam sebatian
Vanadium berada dalam tempoh keempat dalam kumpulan VB Jadual Berkala D.I. Mendeleev. Nombor siri ialah 23. Nukleus atom vanadium mengandungi 23 proton dan 27 neutron (nombor jisim ialah 50). Terdapat empat tahap tenaga dalam atom vanadium, yang mengandungi 23 elektron (Rajah 1).
nasi. 1. Struktur atom vanadium.
Formula elektronik atom vanadium dalam keadaan dasar adalah seperti berikut:
1s 2 2s 2 2hlm 6 3s 2 3hlm 6 3d 3 4s 2 .
Dan gambar rajah tenaga (dibina hanya untuk elektron tahap tenaga luar, yang sebaliknya dipanggil valens):

Kehadiran tiga elektron tidak berpasangan menunjukkan bahawa vanadium dalam sebatiannya boleh mempamerkan valens III (V III 2 O 3, V III F 3, V III Cl 3).
Atom vanadium dapat masuk ke dalam keadaan teruja: elektron subperingkat 4s tidak berpasangan dan salah satu daripadanya menduduki orbital kosong subperingkat 3d:

Kehadiran lima elektron tidak berpasangan menunjukkan bahawa vanadium juga mempamerkan valensi V dalam sebatiannya (V V 2 O 5 , V V F 5).
Adalah diketahui bahawa vanadium mempunyai valensi II(V II O) dan IV (V IV O 2 , V IV Cl 4).
Contoh penyelesaian masalah
CONTOH 1
← Vanadium → Chromium
↓
Nb
(jisim molar)
(elektron pertama)
berpusatkan badan
cerita
Sifat kimia
Secara kimia, vanadium agak lengai. Ia tahan terhadap air laut, larutan cair asid hidroklorik, nitrik dan sulfurik, alkali.
Dengan oksigen, vanadium membentuk beberapa oksida: VO, V 2 O 3, VO 2, V 2 O 5. Jingga V 2 O 5 ialah oksida berasid, VO 2 biru tua adalah amfoterik, selebihnya oksida vanadium adalah asas.
vanadium oksida berikut diketahui:
| Nama | Formula | Ketumpatan | Suhu lebur | Suhu mendidih | Warna |
|---|---|---|---|---|---|
| Vanadium(II) oksida | VO | 5.76 g/cm³ | ~1830 °C | 3100°C | Hitam |
| Vanadium(III) oksida | V 2 O 3 | 4.87 g/cm³ | 1967°C | 3000°C | Hitam |
| Vanadium(IV) oksida | VO2 | 4.65 g/cm³ | 1542°C | 2700°C | biru gelap |
| Vanadium(V) oksida | V 2 O 5 | 3.357 g/cm³ | 670°C | 2030°C | merah kuning |
Vanadium halida dihidrolisiskan. Dengan halogen, vanadium membentuk halida yang agak meruap daripada komposisi VX 2 (X = , , , ), VX 3 , VX 4 (X = , , ), VF 5 dan beberapa oksohalida (VOCl, VOCl 2, VOF 3, dsb.) .
Sebatian vanadium dalam keadaan pengoksidaan +2 dan +3 adalah agen penurunan yang kuat, dalam keadaan pengoksidaan +5 ia menunjukkan sifat agen pengoksidaan. Vinadium karbida VC (t pl =2800 °C), vanadium nitrida VN, vanadium sulfida V 2 S 5, vanadium silicid V 3 Si dan sebatian vanadium lain yang diketahui.
Apabila V 2 O 5 berinteraksi dengan oksida asas, vanadates- garam asid vanadik daripada komposisi berkemungkinan HVO 3 .
Permohonan
80 % [ ] daripada semua vanadium yang dihasilkan digunakan dalam aloi, terutamanya untuk keluli tahan karat dan alat.
Tenaga hidrogen atomVanadium klorida digunakan dalam penguraian termokimia air dalam tenaga nuklear-hidrogen (kitaran vanadium-klorida "General Motors", Amerika Syarikat). Dalam metalurgi, vanadium dilambangkan dengan huruf F.
Dalam penghasilan asid sulfurik Metalurgi
Ia digunakan (terutamanya secara berkesan bersama-sama dengan molibdenum dan nikel) sebagai bahan tambahan mengaloi dalam pengeluaran keluli, dalam pengeluaran bimetal.
Industri automotifVanadium digunakan dalam bahagian yang memerlukan kekuatan yang sangat tinggi, seperti piston enjin kereta. Perindustrian Amerika Henry Ford menyatakan peranan penting vanadium dalam industri automotif. "Jika tidak ada vanadium, tidak akan ada kereta." - kata Ford.
elektronikBahan berasaskan vanadium dan titanium dioksida digunakan dalam penciptaan komputer dan elektronik lain.
Pengeluaran minyakKeluli vanadium digunakan dalam penciptaan platform penggerudian tenggelam untuk menggerudi telaga minyak.
Produk cenderahati
Pengeluaran
Peranan dan kesan biologi
Vanadium dan semua sebatiannya toksik. Sebatian vanadium pentavalen adalah yang paling toksik. Oksida (V)nya sangat beracun (beracun apabila tertelan dan dihidu, menjejaskan sistem pernafasan). Dos maut LD50 vanadium(V) oksida untuk tikus secara lisan ialah 10 mg/kg.
Vanadium dan sebatiannya sangat toksik kepada organisma akuatik (persekitaran).
Telah terbukti bahawa vanadium boleh menghalang sintesis asid lemak dan menghalang pembentukan kolesterol. Vanadium menghalang beberapa sistem enzim [ ], menghalang fosforilasi dan sintesis ATP, mengurangkan tahap koenzim A dan , merangsang aktiviti monoamine oxidase dan fosforilasi oksidatif. Ia juga diketahui bahawa dalam skizofrenia, kandungan vanadium dalam darah meningkat dengan ketara [ ] .
Pengambilan vanadium yang berlebihan dalam badan biasanya dikaitkan dengan faktor persekitaran dan pengeluaran. Di bawah pendedahan akut kepada dos toksik vanadium, pekerja mengalami tindak balas keradangan tempatan pada kulit dan membran mukus mata, saluran pernafasan atas, pengumpulan lendir dalam bronkus dan alveoli. Terdapat juga tindak balas alahan sistemik seperti asma dan ekzema; serta leukopenia dan anemia, yang disertai dengan pelanggaran parameter biokimia utama badan.
Apabila vanadium diberikan kepada haiwan (pada dos 25-50 µg/kg), terencat pertumbuhan, cirit-birit dan peningkatan kematian dicatatkan.
Secara keseluruhan, badan orang biasa (berat badan 70 kg) mengandungi 0.11 mg vanadium. Dos toksik untuk manusia ialah 0.25 mg, dos maut ialah 2-4 mg.
Penerangan dan sifat vanadium
Vanadium pada asalnya ditemui oleh Mexico A.M. Del Rio dalam bijih coklat yang mengandungi plumbum, yang, apabila dipanaskan, memberikan warna kemerahan.
Tetapi unsur itu mendapat pengiktirafan rasmi kemudian, apabila ia ditemui oleh seorang ahli kimia dari Sweden, N.G. Sefstrem, semasa mengkaji bijih besi dari deposit tempatan, dan memberikannya nama Vanadium, konsonan dengan nama Vanadis, yang dipakai oleh orang Yunani kuno dewi kecantikan.
Dari segi rupa, logam itu menyerupai keluli dengan warna kelabu keperakan. Tetapi di situlah persamaan berakhir. Struktur vanadium: kekisi berpusat badan kubik dengan parameter a=3.024A dan z=2. Ketumpatan ialah 6.11 g/cm 3 .
Ia cair pada suhu 1920 o C, dan mula mendidih pada 3400 o C. Tetapi pemanasan di udara terbuka pada suhu melebihi 300 o C mengurangkan sifat plastik logam dan menjadikannya rapuh, sambil meningkatkan kekerasan. Struktur atom logam membantu memahami tingkah laku ini.
unsur vanadium, mempunyai nombor atom 23 dan jisim atom 50.942, ia tergolong dalam kumpulan V tempoh keempat sistem D.. Dan ini bermakna atom vanadium terdiri daripada 23 proton, 23 elektron dan 28 neutron.

Walaupun ia merupakan unsur kumpulan V, valensi vanadium tidak selalu bersamaan dengan 5. Kebetulan ialah 2, 3. 4 dan 5 dengan tanda positif. Nilai valensi yang berbeza dijelaskan dengan cara yang berbeza untuk mengisi cangkang elektron, di mana ia mencapai keadaan stabil.
Adalah diketahui bahawa nilai valensi positif ditentukan oleh bilangan elektron yang disumbangkan oleh atom unsur kimia, dan nilai negatif ditentukan oleh bilangan elektron yang melekat pada tahap tenaga luaran untuk membentuk kestabilannya. Formula elektronik vanadium— 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3 .
Ia boleh dengan mudah menderma dua elektron daripada subperingkat ke-4, manakala keadaan pengoksidaannya adalah disebabkan oleh manifestasi positif 2-valent. Tetapi atom unsur ini mampu menderma 3 lagi elektron dari orbit mendahului subperingkat luar dan menunjukkan keadaan pengoksidaan maksimum +5.
Oksida unsur ini dengan valensi 2 hingga 5 adalah berbeza dalam manifestasi kimianya. Oksida VO dan V 2 O 3 adalah asas, VO 2 adalah amfoterik, dan V 2 O 5 adalah berasid.

Logam tulen dibezakan oleh kemulurannya dan oleh itu diproses dengan baik dengan mengecap, menekan dan menggulung. Pemprosesan dengan mengimpal dan memotong mesti berlaku dalam persekitaran lengai, kerana keplastikan hilang apabila dipanaskan.
Semasa pemprosesan, logam boleh dikatakan tidak tertakluk kepada pengerasan dan boleh menahan beban yang tinggi semasa pengurangan sejuk tanpa penyepuhlindapan perantaraan. Ia tahan terhadap kakisan dan tidak berubah di bawah pengaruh air, termasuk air laut, serta larutan lemah beberapa asid, garam dan alkali.
Deposit dan pengekstrakan vanadium
Unsur kimia vanadium, agak biasa dalam batuan daratan, tetapi tidak berlaku dalam bentuk tulennya, terdapat dalam mineral dalam keadaan tersebar. Pengumpulannya dalam batu sangat jarang berlaku. Ini adalah logam yang jarang ditemui. Bijih dengan kandungan bahan tulen 1% diklasifikasikan sebagai kaya.
Dalam industri, bijih yang mengandungi 0.1% unsur kekurangan sekalipun tidak diabaikan. Dalam kepekatan rendah, ia terdapat dalam lebih daripada empat puluh mineral. Penting untuk industri boleh dipanggil roscoelite, dipanggil vanadium mika, yang mengandungi sehingga 29% V 2 O 5 pentoksida, carnotite (uranium mika) yang mengandungi 20% V 2 O 5, dan vanadinite dengan kandungan 19% V 2 O 5.

Deposit besar bijih yang mengandungi logam terletak di Amerika, Afrika Selatan, Rusia, Finland dan Australia. Terdapat deposit besar di pergunungan Peru, di mana ia diwakili oleh patronit V 2 S 5 yang mengandungi sulfur. Apabila ia dibakar, satu pekat terbentuk yang mengandungi sehingga 30% V 2 O 5.
Mineral itu ditemui di Kyrgyzstan dan Kazakhstan. Padang Kyzylorda yang terkenal adalah antara yang terbesar. Di Rusia, ia dilombong terutamanya di Wilayah Krasnodar (deposit Kerch) dan di Ural (deposit Gusevogorsk titanomagnetite).
Teknologi pengekstrakan logam bergantung pada keperluan untuk ketulenannya dan kawasan penggunaannya. Kaedah utama yang digunakan dalam teknologi pengeluarannya ialah iodida, calcethermal, aluminothermic, karbon terma dalam vakum, klorida.
Teknologi kaedah iodida adalah berdasarkan pemisahan haba iodida. Adalah biasa untuk mendapatkan logam dengan pengurangan V 2 O 5 dengan kaedah terma menggunakan kalsium atau aluminium.
Dalam kes ini, tindak balas berlaku mengikut formula: V 2 O 5 + 5Ca \u003d 2V + 5CaC + 1460 kJ dengan pelepasan haba, yang mencukupi untuk mencairkan V yang terhasil, yang membolehkan ia mengalir dan mengumpul dalam pepejal bentuk. Ketulenan logam yang diperoleh dengan cara ini mencapai 99.5%.
Kaedah moden mengekstrak V ialah pengurangan oksida di bawah keadaan vakum dengan karbon pada suhu dari 1250 ° C hingga 1700 ° C. Kaedah pengekstrakan klorida terdiri daripada pengurangan VCl 3 dengan magnesium cecair.
Penggunaan vanadium
Salah satu aplikasi utama logam yang ditemui sebagai bahan tambahan mengaloi - ferrovanadium untuk meningkatkan kualiti keluli. Penambahan vanadium meningkatkan parameter kekuatan keluli, serta keliatannya, rintangan haus dan ciri-ciri lain.

Dalam kes ini, bahan tambahan melaksanakan fungsi kedua-dua penyahoksida dan komponen pembentuk karbida. Karbida diagihkan sama rata dalam aloi, menghalang pertumbuhan struktur bijirin keluli apabila dipanaskan. Besi tuang aloi vanadium juga meningkatkan kualitinya.
Vanadium digunakan untuk penambahbaikan aloi berasaskan titanium. Terdapat titanium, yang mengandungi sehingga 13% daripada bahan tambahan mengaloi ini. Vanadium juga terdapat dalam aloi niobium, tantalum dan kromium yang digunakan dalam industri penerbangan, serta aluminium, titanium dan bahan lain dalam penerbangan dan roket.
Keunikan elemen itu memungkinkan untuk menggunakannya dalam industri nuklear dalam pengeluaran paip saluran untuk rod bahan api untuk loji kuasa nuklear, kerana, seperti zirkonium, ia mempunyai sifat penangkapan melintang kecil neutron haba, yang penting dalam tindak balas nuklear. Dalam teknologi hidrogen atom, vanadium klorida digunakan untuk interaksi termokimia dengan air.
Vanadium digunakan dalam industri kimia dan pertanian, perubatan, pengeluaran kaca, industri tekstil, pengeluaran cat dan varnis dan pembuatan bateri. Tangan aloi dan perkakas digunakan secara meluas vanadium krom, dibezakan oleh ketahanan mereka.
Salah satu bidang terkini ialah elektronik. Terutama menarik dan menjanjikan adalah bahan berasaskan dioksida. titanium dan vanadium. Disambungkan dengan cara tertentu, mereka mencipta sistem yang mempunyai keupayaan untuk meningkatkan memori dan kelajuan komputer dan peranti elektronik lain dengan ketara.
Harga vanadium
sebagai bahan mentah siap vanadium dilepaskan dalam bentuk rod, bulatan, serta oksida. Dalam pelbagai jenis perusahaan yang terlibat dalam pengeluaran logam refraktori ini, aloi pelbagai gred dibentangkan. Harga sebahagian besarnya bergantung pada tujuan, kesucian logam, kaedah pengeluaran, serta jenis produk.

Sebagai contoh, perusahaan Ekaterinburg NPK "Metalurgi Khas" menjual jongkong pada harga 7 ribu per kg - pada harga 440 hingga 500 ribu satu tan, jongkong jenama VNM-1 pada harga 500 ribu satu tan. Harga juga mungkin berubah bergantung pada keadaan pasaran dan permintaan untuk produk.
Vanadium
VANADIUM-saya; m.[lat. Vanadium dari Nord.] Unsur kimia (V), logam keras kelabu muda yang digunakan untuk membuat gred keluli yang berharga. ● Ia dinamakan sempena dewi kecantikan Norse Vanadis kerana warna garamnya yang cantik.
◁ Vanadium, ke, ke. Bijih ke-V. Keluli ke-V.
vanadium(lat. Vanadium), unsur kimia kumpulan V sistem berkala. Nama itu berasal dari dewi kecantikan Norse Lama Vanadis. Logam keras keluli kelabu. Ketumpatan 6.11 g / cm 3, t pl 1920°C. Tahan air dan banyak asid. Tersebar dalam kerak bumi, selalunya disertai dengan besi (bijih besi merupakan sumber industri vanadium yang penting). Komponen pengaloian keluli struktur dan aloi yang digunakan dalam teknologi penerbangan dan angkasa lepas, pembinaan kapal marin, komponen aloi superkonduktor. Sebatian vanadium digunakan dalam industri tekstil, cat dan varnis, dan kaca.
VANADIUMVANADIUM (lat. Vanadium), V (baca "vanadium"), unsur kimia dengan nombor atom 23, jisim atom 50.9415. Vanadium semulajadi adalah campuran dua nuklida (cm. NUKLID): stabil 51 V (99.76% mengikut jisim) dan radioaktif lemah 52 V (separuh hayat lebih daripada 3.9 10 17 tahun). Konfigurasi dua lapisan elektron luar 3 s 2
hlm 6
d 3
4s 2
. Dalam sistem berkala Mendeleev, ia terletak pada tempoh keempat dalam kumpulan VB. Vanadium membentuk sebatian dalam keadaan pengoksidaan dari +2 hingga +5 (valensi dari II hingga V).
Jejari atom neutral vanadium ialah 0.134 nm, jejari ion V 2+ ialah 0.093 nm, V 3+ ialah 0.078 nm, V 4+ ialah 0.067-0.086 nm, V 5+ ialah 0.050-0.068 nm. Tenaga pengionan berturut-turut bagi atom vanadium ialah 6.74, 14.65, 29.31, 48.6, dan 65.2 eV. Pada skala Pauling, keelektronegatifan vanadium ialah 1.63.
Dalam bentuk bebas - logam perak-kelabu berkilat.
Sejarah penemuan
Vanadium ditemui pada tahun 1801 oleh ahli mineralogi Mexico A. M. del Río sebagai bahan campuran dalam bijih plumbum dari lombong di Zimapan. Del Rio menamakan unsur baru itu erythronium (dari bahasa Yunani erythros, merah) kerana warna merah sebatiannya. Walau bagaimanapun, kemudian dia memutuskan bahawa dia tidak menemui unsur baru, tetapi pelbagai kromium, ditemui empat tahun lebih awal dan masih hampir tidak diterokai. Pada tahun 1830, ahli kimia Jerman F. Wehler mengambil mineral Mexico. (cm. Wehler Friedrich) Bagaimanapun, setelah diracuni oleh hidrogen fluorida, dia menghentikan penyelidikan selama beberapa bulan. Pada tahun yang sama, ahli kimia Sweden N. Sefstrom (cm. SEFSTREM Nils Gabriel) menarik perhatian kepada kehadiran kekotoran dalam bijih besi, di mana, bersama-sama dengan unsur-unsur yang diketahui, beberapa bahan baru ternyata. Hasil analisis di makmal J. Berzelius (cm. BERZELIUS Jens Jacob) telah terbukti bahawa unsur baru telah ditemui. Unsur ini membentuk sebatian dengan pewarnaan yang cantik, maka nama unsur yang dikaitkan dengan nama dewi kecantikan Skandinavia Vanadis. Pada tahun 1831, Wöhler membuktikan identiti erythronium dan vanadium, tetapi unsur itu mengekalkan nama yang diberikan kepadanya oleh Sefstrom dan Berzelius.
Berada di alam semula jadi
Secara semula jadi, vanadium tidak berlaku dalam bentuk bebas, ia tergolong dalam unsur surih. (cm. UNSUR SURIH). Kandungan vanadium dalam kerak bumi ialah 1.6 10 -2% mengikut berat, di dalam air lautan 3.10 -7%. Mineral yang paling penting ialah patronit V(S 2) 2 , vanadinit Pb 5 (VO 4) 3 Cl dan beberapa yang lain. Sumber utama vanadium ialah bijih besi yang mengandungi vanadium sebagai bendasing.
resit
Dalam industri, apabila vanadium diperoleh daripada bijih besi dengan campurannya, pekat pertama disediakan, di mana kandungan vanadium mencapai 8-16%. Selanjutnya, melalui rawatan oksidatif, vanadium dipindahkan ke keadaan pengoksidaan tertinggi +5 dan natrium vanadate NaVO 3 yang mudah larut dalam air diasingkan. Apabila larutan diasidkan dengan asid sulfurik, mendakan terbentuk, yang, selepas pengeringan, mengandungi lebih daripada 90% vanadium.
Pekat utama dikurangkan dalam relau letupan dan pekat vanadium diperoleh, yang kemudiannya digunakan dalam peleburan aloi vanadium dan besi - yang dipanggil ferrovanadium (mengandungi 35 hingga 70% vanadium). Logam vanadium boleh disediakan dengan pengurangan vanadium klorida dengan hidrogen, pengurangan kalsium-terma oksida vanadium (V 2 O 5 atau V 2 O 3), penceraian haba VI 2 dan kaedah lain.
Sifat fizikal dan kimia
Vanadium adalah serupa dalam penampilan keluli, ia agak keras, tetapi pada masa yang sama logam mulur. Takat lebur 1920 ° C, takat didih kira-kira 3400 ° C, ketumpatan 6.11 g / cm 3. Kekisi kristal adalah berpusat badan padu, parameter a=0.3024 nm.
Secara kimia, vanadium agak lengai. Ia tahan terhadap air laut, larutan cair asid hidroklorik, nitrik dan sulfurik, alkali. Vanadium membentuk beberapa oksida dengan oksigen: VO, V 2 O 3 , V 3 O 5 , VO 2 , V 2 O 5 . Jingga V 2 O 5 ialah oksida berasid, VO 2 biru tua adalah amfoterik, selebihnya oksida vanadium adalah asas. Dengan halogen, vanadium membentuk halida daripada komposisi VX 2 (X = F, Cl, Br, I), VX 3, VX 4 (X = F, Cl, Br), VF 5 dan beberapa oksohalida (VOCl, VOCl 2, VOF 3 , dll.).
Sebatian vanadium dalam keadaan pengoksidaan +2 dan +3 adalah agen penurunan yang kuat, dalam keadaan pengoksidaan +5 ia menunjukkan sifat agen pengoksidaan. Vinadium karbida VC (t pl =2800 °C), vanadium nitrida VN, vanadium sulfida V 2 S 5, vanadium silicid V 3 Si dan sebatian vanadium lain yang diketahui.
Apabila V 2 O 5 berinteraksi dengan oksida asas, vanadat terbentuk (cm. VANADATES)- garam asid vanadik daripada komposisi berkemungkinan H 2 .
Permohonan
Vanadium digunakan terutamanya sebagai bahan tambahan mengaloi dalam pengeluaran aloi tahan haus, tahan haba dan tahan kakisan (terutamanya keluli khas), sebagai komponen dalam pengeluaran magnet. Vanadium oksida V 2 O 5 berfungsi sebagai pemangkin yang berkesan, contohnya, dalam pengoksidaan sulfur dioksida SO 2 kepada gas sulfur SO 3 dalam penghasilan asid sulfurik. Sebatian vanadium menemui pelbagai aplikasi dalam pelbagai industri (tekstil, kaca, cat dan varnis, dll.).
Peranan biologi
Vanadium sentiasa terdapat dalam tisu semua organisma dalam jumlah surih. Dalam tumbuhan, kandungannya (0.1-0.2%) adalah jauh lebih tinggi daripada haiwan (1 10 -5 -1 10 -4 %). Sesetengah organisma marin - bryozoans, moluska dan, terutamanya, ascidians - dapat menumpukan vanadium dalam kuantiti yang ketara (dalam ascidians, vanadium ditemui dalam plasma darah atau sel khas - vanadocytes). Nampaknya, vanadium terlibat dalam beberapa proses oksidatif dalam tisu. Tisu otot manusia mengandungi 2 10 - 6% vanadium, tisu tulang - 0.35 10 - 6%, dalam darah - kurang daripada 2 10 - 4% mg / l. Secara keseluruhan, badan orang biasa (berat badan 70 kg) mengandungi 0.11 mg vanadium. Vanadium dan sebatiannya adalah toksik. Dos toksik untuk manusia ialah 0.25 mg, dos maut ialah 2-4 mg. Untuk V 2 O 5 MPC di udara ialah 0.1-0.5 mg / m 3.
Kamus ensiklopedia. 2009 .
sinonim:Lihat apa "vanadium" dalam kamus lain:
- (lat. vanadium). Logam rapuh, putih, ditemui pada tahun 1830 dan dinamakan sempena dewa Scandinavia Vanadium. Kamus perkataan asing termasuk dalam bahasa Rusia. Chudinov A.N., 1910. VANADIUM lat. vanadium, bernama Vanadia, ... ... Kamus perkataan asing bahasa Rusia
- (nilai kimia V, berat atom 51) unsur kimia yang serupa dengan sebatian dengan fosforus dan nitrogen. Sambungan V. agak kerap bertemu, walaupun dalam kuantiti yang kecil, dalam bijih besi dan beberapa tanah liat; dalam pemprosesan bijih besi vanadic, V. bahagian ... ... Ensiklopedia Brockhaus dan Efron
Kamus Vanad sinonim Rusia. vanadium n., bilangan sinonim: 2 vanadium (1) unsur ... kamus sinonim
VANADIUM- VANADIUM, kimia. tanda V, di. V. 51.0, keras, logam berwarna keluli tahan lasak, takat lebur 1715°, sp. berat 5.688. Sambungan V. diedarkan secara meluas dalam alam semula jadi. Sebatian ini adalah racun, kekuatannya tidak lebih rendah daripada arsenik; mereka mempunyai…… Ensiklopedia Perubatan Besar
- (Vanadium), V, unsur kimia kumpulan V sistem berkala, nombor atom 23, jisim atom 50.9415; logam, mp 1920shC. Digunakan untuk mengaloi keluli dan besi tuang, sebagai komponen aloi tahan haba, keras dan tahan kakisan, sebagai ... Ensiklopedia Moden
- (lat. Vanadium) V, unsur kimia kumpulan V sistem berkala, nombor atom 23, jisim atom 50.9415. Nama itu berasal dari dewi kecantikan Norse Lama Vanadis. Logam keras keluli kelabu. Ketumpatan 6.11 g/cm³, mp 1920 .C.… … Kamus Ensiklopedia Besar
- (simbol V), ELEMEN PERALIHAN, ditemui pada tahun 1801. Putih keperakan, boleh ditempa, logam likat. Ditemui dalam bijih besi, plumbum dan uranium, serta dalam arang batu dan minyak. Digunakan dalam aloi keluli untuk meningkatkan kekuatan dan rintangan haba. ... ... Kamus ensiklopedia saintifik dan teknikal Ensiklopedia Fizikal
vanadium- Unsur V kumpulan V Berkala. sistem; di. n. 23, pada. m. 50.942; logam kelabu keluli. V Asli terdiri daripada dua isotop: 51V (99.75%) dan 50V (0.25%). V ditemui pada tahun 1801 oleh Mex. ahli mineralogi A. M. del Rio. Dalam prom. skala V…… Buku Panduan Penterjemah Teknikal
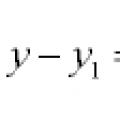 Persamaan garis dan lengkung dalam satah
Persamaan garis dan lengkung dalam satah Persamaan homogen umum Persamaan homogen umum tertib kedua
Persamaan homogen umum Persamaan homogen umum tertib kedua Terima kasih kepada koma Kerana fakta bahawa dalam mereka
Terima kasih kepada koma Kerana fakta bahawa dalam mereka