Nội dung của định luật Dalton là gì? Định luật Dalton cho hỗn hợp khí: ví dụ về giải quyết vấn đề
Một hỗn hợp khí ở trạng thái cân bằng nếu nồng độ của các thành phần và các thông số trạng thái của nó trong toàn bộ thể tích có cùng giá trị. Trong trường hợp này, nhiệt độ của tất cả các khí có trong hỗn hợp là như nhau và bằng nhiệt độ của hỗn hợp T cm.
Ở trạng thái cân bằng, các phân tử của mỗi khí nằm rải rác đều trong toàn bộ thể tích của hỗn hợp, nghĩa là chúng có nồng độ riêng và do đó có áp suất riêng. R Tôi, Pa, được gọi là một phần . Nó được định nghĩa như sau.
Áp suất riêng phần bằng áp suất của một thành phần nhất định, với điều kiện là riêng thành phần đó chiếm toàn bộ thể tích dành cho hỗn hợp ở nhiệt độ hỗn hợp T cmt .
Theo định luật của nhà hóa học và vật lý học người Anh Dalton, được xây dựng vào năm 1801, áp suất của hỗn hợp khí lý tưởng p cmt bằng tổng áp suất riêng phần của các thành phần p Tôi :
Ở đâu N- số lượng thành phần
Biểu thức (2) còn được gọi là định luật áp suất riêng phần.
3.3. Thể tích giảm của một thành phần trong hỗn hợp khí. Định luật Amag
Theo định nghĩa, khối lượng giảm Tôi thành phần thứ của hỗn hợp khí V. Tôi, m3, là thể tích mà thành phần này có thể chiếm, với điều kiện áp suất và nhiệt độ của nó bằng áp suất và nhiệt độ của toàn bộ hỗn hợp khí.
Định luật của nhà vật lý người Pháp Amag, được xây dựng vào khoảng năm 1870, phát biểu: tổng thể tích giảm của tất cả các thành phần trong hỗn hợp bằng thể tích của hỗn hợpV. cmt :
 , m3. (3)
, m3. (3)
3.4. Thành phần hóa học của hỗn hợp khí
Thành phần hóa học của hỗn hợp khí có thể được xác định ba khác nhau cách.
Cho một hỗn hợp khí gồm n thành phần. Hỗn hợp chiếm thể tích V. cm, m3, có khối lượng M cm, kg, áp suất R cm, Pa và nhiệt độ T cm, K. Ngoài ra, số mol của hỗn hợp là N cm, nốt ruồi. Đồng thời, khối lượng của một Tôi thành phần thứ tôi Tôi, kg và số mol của thành phần này ν Tôi, nốt ruồi.
Hiển nhiên là:
 , (4)
, (4)
 . (5)
. (5)
Sử dụng định luật Dalton (2) và định luật Amag (3) cho hỗn hợp đang xét, chúng ta có thể viết:
 , (6)
, (6)
 , (7)
, (7)
Ở đâu R Tôi- áp lực bán phần Tôi thành phần thứ, Pa; V. Tôi- giảm âm lượng Tôi thành phần thứ, m3.
Rõ ràng, thành phần hóa học của hỗn hợp khí có thể được xác định theo khối lượng, mol hoặc phần thể tích của các thành phần của nó:
 , (8)
, (8)
 , (9)
, (9)
 , (10)
, (10)
Ở đâu g Tôi , k Tôi Và r Tôi- Phân số khối lượng, mol và thể tích Tôi thành phần thứ của hỗn hợp tương ứng (giá trị không thứ nguyên).
Hiển nhiên là:
 ,
,
 ,
, . (11)
. (11)
Thông thường trong thực tế, thành phần hóa học của hỗn hợp không được xác định theo phân số Tôi thành phần thứ đó và tỷ lệ phần trăm của nó.
Ví dụ, trong kỹ thuật sưởi ấm, người ta gần như chấp nhận rằng không khí khô bao gồm 79% thể tích nitơ và 21% thể tích oxy.
Phần trăm Tôi Thành phần thứ trong hỗn hợp được tính bằng cách nhân phần của nó với 100.
Ví dụ với không khí khô chúng ta sẽ có:
 ,
,
 . (12)
. (12)
Ở đâu  Và
Và  - phần thể tích của nitơ và oxy trong không khí khô; N 2 và O 2 – chỉ định phần trăm thể tích của nitơ và oxy,% (thể tích).
- phần thể tích của nitơ và oxy trong không khí khô; N 2 và O 2 – chỉ định phần trăm thể tích của nitơ và oxy,% (thể tích).
Ghi chú:
1)Các phần mol của một hỗn hợp lý tưởng bằng số lượng các phần thể tích:k Tôi = r Tôi . Hãy chứng minh điều đó.
Sử dụng định nghĩa về phần khối lượng(10)và định luật Amag (3) chúng ta có thể viết:
 ,
(13)
,
(13)
Ở đâuV. Tôi - giảm âm lượngTôithành phần thứ, m 3
;
ν
Tôi - số molTôithành phần thứ, mol;
 - thể tích của một molTôithành phần thứ ở áp suất hỗn hợp p cmt và nhiệt độ hỗn hợp T cmt , tôi 3
/mol.
- thể tích của một molTôithành phần thứ ở áp suất hỗn hợp p cmt và nhiệt độ hỗn hợp T cmt , tôi 3
/mol.
Từ định luật Avogadro (xem đoạn 2.3 của phụ lục này), suy ra rằng ở cùng nhiệt độ và áp suất, một mol của bất kỳ chất khí nào (thành phần hỗn hợp) đều chiếm cùng một thể tích. Đặc biệt, tại T. cmt và P cmt nó sẽ có khối lượngV. 1 , tôi 3 .
Điều này cho phép chúng ta viết đẳng thức:
 .
(14)
.
(14)
Thay thế(14)V.(13)chúng tôi nhận được những gì chúng tôi cần:
 .
(15)
.
(15)
2)Tỷ lệ thể tích của các thành phần của hỗn hợp khí có thể được tính bằng cách biết áp suất riêng phần của chúng. Hãy thể hiện nó.
Hãy xem xétTôi-thành phần thứ của hỗn hợp khí lý tưởng ở hai trạng thái khác nhau: khi nó đạt áp suất riêng phần p Tôi ; khi nó chiếm thể tích đã giảmV. Tôi .
Phương trình trạng thái của khí lý tưởng có giá trị đối với bất kỳ trạng thái nào của nó, đặc biệt là đối với hai trạng thái nêu trên.
Theo điều này và có tính đến định nghĩa về khối lượng cụ thể, chúng ta có thể viết:
 ,
(16)
,
(16)
 ,
(17)
,
(17)
Ở đâuR Tôi - hằng số khíTôithành phần thứ của hỗn hợp, J/(kg K).
Sau khi chia cả hai phần(16)Và(17)với nhau, chúng tôi nhận được yêu cầu:
 .
(18)
.
(18)
Từ(18)có thể thấy rằng áp suất riêng phần của các thành phần của hỗn hợp có thể được tính từ thành phần hóa học của nó, với áp suất tổng đã biết của hỗn hợp p cmt :
 .
(19)
.
(19)
Xây dựng luật
Định luật về áp suất tổng cộng của hỗn hợp khí
Định luật về độ hòa tan của các thành phần hỗn hợp khí
Ở nhiệt độ không đổi, độ hòa tan trong một chất lỏng nhất định của từng thành phần của hỗn hợp khí nằm phía trên chất lỏng tỷ lệ thuận với áp suất riêng phần của chúng.
Giới hạn áp dụng
Cả hai định luật Dalton đều được thỏa mãn nghiêm ngặt đối với khí lý tưởng. Đối với khí thực, các định luật này có thể áp dụng được với điều kiện là độ hòa tan của chúng thấp và tính chất của chúng gần giống với khí lý tưởng.
Lịch sử khám phá
Định luật cộng áp suất riêng phần được xây dựng vào năm 1801. Đồng thời, sự biện minh đúng đắn về mặt lý thuyết, dựa trên lý thuyết động học phân tử, đã được đưa ra muộn hơn nhiều.
Ghi chú
Quỹ Wikimedia. 2010.
Xem "Định luật Dalton" là gì trong các từ điển khác:
LUẬT DALTON- (Dalton Dalton): định luật thứ nhất, tổng áp suất của hỗn hợp các khí lý tưởng không tương tác hóa học với nhau bằng tổng của các khí riêng lẻ (xem) tạo nên hỗn hợp, tức là áp suất mà mỗi khí sẽ tạo ra trong ... ... Bách khoa toàn thư bách khoa lớn
định luật Dalton- được phát hiện bởi nhà vật lý và hóa học người Anh J. Dalton (1766 1844) vào năm 1801 và 1803. 1) áp suất của hỗn hợp khí lý tưởng không tương tác hóa học bằng tổng áp suất riêng phần. Hãy áp dụng cho khí thực ở nhiệt độ và áp suất... ... Các khái niệm của khoa học tự nhiên hiện đại. Bảng chú giải các thuật ngữ cơ bản
Các định luật cơ bản của hóa học có thể được chia thành định tính và định lượng. Nội dung 1 Định luật định tính 1.1 I. Định luật pha Gibbs ... Wikipedia
LUẬT DALTON- (chính xác hơn là Dalton, Dalton). 1. Định luật đa tỉ lệ do D. phát hiện ra là các nguyên tố có trong một chất hóa học. các kết nối theo tỷ lệ luôn là bội số của các số nguyên tố nhất định. Vì vậy, nếu họ có nước, thì đối với một phần trọng lượng hydro... ... Bách khoa toàn thư y học lớn
ĐỊNH LUẬT DALTON: 1) áp suất của một hỗn hợp khí không tương tác hóa học với nhau bằng tổng áp suất riêng phần của chúng; 2) độ hòa tan của một thành phần của hỗn hợp khí trong một chất lỏng nhất định ở nhiệt độ không đổi là tỉ lệ thuận với một phần.... Từ điển bách khoa lớn
1) áp suất của hỗn hợp khí lý tưởng không tương tác hóa học bằng tổng áp suất riêng phần. Có thể áp dụng gần đúng cho các khí thực ở nhiệt độ p và áp suất xa mức tới hạn. 2) Ở mức không đổi tốc độ hòa tan trong một chất lỏng nhất định... ... Bách khoa toàn thư vật lý
1) áp suất của hỗn hợp khí lý tưởng không tương tác hóa học bằng tổng áp suất riêng phần. Có thể áp dụng gần đúng cho các khí thực ở nhiệt độ và áp suất xa mức tới hạn. 2) Ở mức không đổi độ hòa tan ở nhiệt độ trong một ... Bách khoa toàn thư vật lý
ĐỊNH LUẬT DALTON: 1) áp suất của một hỗn hợp khí không tương tác hóa học với nhau bằng tổng áp suất riêng phần của chúng; 2) độ hòa tan của một thành phần của hỗn hợp khí trong một chất lỏng nhất định ở nhiệt độ không đổi tỷ lệ thuận với thành phần... ... từ điển bách khoa
Mô tả các quá trình xảy ra trong hệ cân bằng “dung dịch lỏng-hơi” dưới tác dụng của nhiệt độ hoặc áp suất. Nội dung 1 Định luật thứ nhất của Konovalov 2 Định luật thứ hai của Konovalov ... Wikipedia
Bài viết hoặc phần này cần sửa đổi. Hãy cải thiện bài viết theo đúng quy định về viết bài. Toàn bộ ... Wikipedia
Vào cuối thế kỷ 18 và nửa đầu thế kỷ 19, các nhà khoa học từ nhiều quốc gia khác nhau đã tích cực nghiên cứu hành vi của chất khí, chất lỏng và chất rắn trong các điều kiện bên ngoài khác nhau, dựa trên nghiên cứu của họ về ý tưởng về cấu trúc nguyên tử và phân tử của vật chất. Một trong những nhà khoa học này là Luật của Anh về hỗn hợp khí, hiện mang tên ông, sẽ được thảo luận trong bài viết này.
Điều kiện đặc biệt
Trước khi xây dựng định luật Dalton cho hỗn hợp khí, cần hiểu một trong các khái niệm. Điều này rất quan trọng vì luật này chỉ có giá trị đối với một chất như vậy. Chúng ta đang nói về một loại khí lý tưởng. Nó là gì?
Khí lý tưởng là khí thỏa mãn các yêu cầu sau:
- kích thước của các phân tử và nguyên tử trong đó nhỏ đến mức chúng có thể được coi là các điểm vật chất có thể tích bằng không;
- phân tử và nguyên tử không tương tác với nhau.
Như vậy, khí lý tưởng là tập hợp các điểm vật chất chuyển động ngẫu nhiên. Tốc độ chuyển động và khối lượng của chúng xác định duy nhất nhiệt độ của toàn bộ hỗn hợp. Áp suất mà chất thử tác dụng lên thành bình phụ thuộc vào các thông số vĩ mô như nhiệt độ, thể tích của bình và số lượng phân tử.
Đối với mô hình khí như vậy, đẳng thức là hợp lệ:
Nó được gọi và kết hợp áp suất (P), nhiệt độ (T), thể tích (V) và lượng chất tính bằng mol (n). Giá trị của R là hệ số tỷ lệ, bằng 8,314 J/(K*mol).
Điều đáng ngạc nhiên về công thức này là nó không bao gồm một tham số nào phụ thuộc vào bản chất hóa học của các phân tử và nguyên tử.
Áp lực bán phần
Định luật Dalton cho hỗn hợp khí lý tưởng đòi hỏi kiến thức về một thông số vĩ mô nữa - áp suất riêng phần.
Giả sử có một hỗn hợp gồm 2 thành phần, ví dụ H 2 và He. Hỗn hợp này nằm trong một bình có thể tích cụ thể và tạo ra một áp suất nhất định lên thành bình. Vì các phân tử hydro và nguyên tử heli không tương tác với nhau nên đối với bất kỳ phép tính nào về đặc tính vĩ mô, cả hai thành phần đều có thể được coi là độc lập với nhau.
Áp suất riêng phần của một thành phần là áp suất mà nó tạo ra độc lập với các thành phần khác của hỗn hợp, chiếm thể tích cung cấp cho nó. Trong ví dụ đang xem xét, chúng ta có thể nói về áp suất riêng phần của H 2 và các đặc tính tương tự của He. Giá trị này được biểu thị bằng pascal và được ký hiệu cho thành phần thứ i là Pi.
Hỗn hợp khí và định luật Dalton

John Dalton, nghiên cứu các chất dễ bay hơi khác nhau, bao gồm cả hơi nước, ở nhiệt độ và áp suất khác nhau, đã đưa ra kết luận sau: áp suất của hỗn hợp hoàn toàn bất kỳ chất tương tự nào theo bất kỳ tỷ lệ nào đều bằng tổng áp suất riêng phần của tất cả các thành phần của nó. Công thức này được gọi là định luật Dalton về áp suất của hỗn hợp khí và được viết như sau:
Ở đây P tot là tổng áp suất của hỗn hợp.
Định luật khá đơn giản này chỉ đúng với hỗn hợp khí lý tưởng, các thành phần của chúng không phản ứng hóa học với nhau.
Một công thức khác của định luật Dalton

Định luật Dalton đối với hỗn hợp khí có thể được biểu thị không chỉ dưới dạng áp suất riêng phần mà còn dưới dạng phần mol của từng thành phần. Ta thu được công thức tương ứng.
Vì mỗi thành phần hoạt động độc lập với các thành phần khác trong hỗn hợp khí nên phương trình trạng thái có thể được viết cho nó:
Phương trình này đúng cho từng thành phần thứ i, vì đối với tất cả chúng, nhiệt độ T và thể tích V đều như nhau. Giá trị n i là số mol chất i trong hỗn hợp.
Bây giờ chúng ta biểu thị áp suất riêng phần và chia cho áp suất tổng của toàn bộ hỗn hợp, khi đó chúng ta nhận được:
P i /P tot = n i *R*T / V / (n *R*T/V) = n i /n
Ở đây n là tổng lượng chất có trong toàn bộ hỗn hợp. Nó có thể thu được bằng cách tính tổng tất cả n i . Tỉ số n i/n được gọi là phần mol của thành phần i trong hỗn hợp. Nó thường được ký hiệu bằng ký hiệu x i. Về phân số mol, định luật Dalton được viết như sau:
Thường được biểu diễn dưới dạng phần trăm nguyên tử của các thành phần trong hỗn hợp. Ví dụ, 21% O 2 trong không khí có nghĩa là phần mol của nó là 0,21, nghĩa là cứ một phần năm phân tử không khí là oxy.
Vận dụng định luật để giải quyết vấn đề

Được biết, hỗn hợp khí gồm oxy và nitơ chịu áp suất 5 atm trong một hình trụ. Biết rằng nó chứa 10 mol nitơ và 3 mol oxy, cần xác định áp suất riêng phần của mỗi chất.
Để trả lời câu hỏi của bài toán, trước tiên chúng ta hãy tìm tổng lượng chất:
n = n N2 + n O2 = 10 + 3 = 13 mol
x N2 = n N2 /n = 10/13 = 0,7692
x O2 = n O2 /n = 3/13 = 0,2308
Áp dụng công thức định luật Dalton thông qua phần mol của một thành phần, ta tính được áp suất riêng phần của từng khí trong xi lanh:
P N2 = 5*0,7692 = 3,846 atm.
P O2 = 5*0,2308 = 1,154 atm.
Như có thể thấy từ các số liệu thu được, tổng các áp suất này sẽ cho ra 5 atm. Áp suất riêng phần của mỗi khí tỷ lệ thuận với phần mol của nó trong hỗn hợp.
 Tiểu sử ngắn của Albert Einstein
Tiểu sử ngắn của Albert Einstein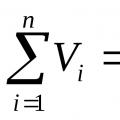 Định luật Dalton cho hỗn hợp khí: ví dụ về giải quyết vấn đề
Định luật Dalton cho hỗn hợp khí: ví dụ về giải quyết vấn đề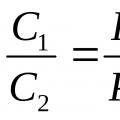 Hơi thở Định luật Boyle-Mariotte Định luật Boyle-Mariotte diễn ra không đổi
Hơi thở Định luật Boyle-Mariotte Định luật Boyle-Mariotte diễn ra không đổi