Атомът е. квантови числа
Всеки ден ние използваме някакви предмети: вземаме ги в ръце, извършваме всякакви манипулации върху тях - обръщаме ги, разглеждаме ги и накрая ги счупваме. Чудили ли сте се от какво са направени тези предмети? "Какво има да мислим? От метал / дърво / пластмаса / плат!" – с недоумение ще отговорят много от нас. Това е отчасти правилният отговор. И от какво се състоят тези материали - метал, дърво, пластмаса, плат и много други вещества? Днес ще обсъдим този въпрос.
Молекула и атом: определение
При познаващ човекотговорът на него е прост и банален: от атоми и молекули. Но някои хора се озадачават и започват да задават въпроси: "Какво са атом и молекула? Как изглеждат?" и т.н. Нека отговорим на тези въпроси по ред. Е, първо, какво са атом и молекула? Веднага да ви кажем, че тези определения не са едно и също нещо. Освен това те са напълно различни термини. И така, атомът е най-малката част от химичен елемент, който е носител на неговите свойства, частица материя с малка маса и размер. Молекулата е електрически неутрална частица, която се образува от няколко свързани атома.
Какво е атом: структура
Атомът се състои от електронна обвивка и (снимка). От своя страна ядрото се състои от протони и неутрони, а обвивката - от електрони. В атома протоните са положително заредени, електроните са отрицателно заредени, а неутроните изобщо не са заредени. Ако броят на протоните съответства, тогава атомът е електрически неутрален, т.е. ако докоснем вещество, образувано от молекули с такива атоми, няма да усетим и най-малкия електрически импулс. И дори тежките компютри няма да го хванат поради липсата на последния. Но се случва протоните да са повече от електроните и обратното. Тогава би било по-правилно да наричаме такива атоми йони. Ако в него има повече протони, то той е електрически положителен, но ако преобладават електроните, той е електрически отрицателен. Всеки конкретен атом има строго определен брой протони, неутрони и електрони. И може да се изчисли. Шаблонът за решаване на задачи за намиране на броя на тези частици изглежда така:
Chem. елемент - R (въведете име на елемент)
Протони (p) - ?
Електрони (e) - ?
Неутрони (n) - ?
Решение:
p = сериен номер на хим. елемент R в периодична систематях D.I. Менделеев
e = p
n \u003d A r (R) - № R
Какво е молекула: структура

Молекулата е най-малката частица химически, тоест вече директно влиза в състава му. Молекула определено веществосе състои от няколко еднакви или различни атома. Структурните характеристики на молекулите зависят от физичните свойства на веществото, в което те присъстват. Молекулите са съставени от електрони и атоми. Местоположението на последния може да се намери с помощта на структурната формула. ви позволява да определите хода на химическа реакция. Обикновено са неутрални електрически заряд), и те нямат несдвоени електрони (всички валенции са наситени). Те обаче също могат да бъдат таксувани, тогава те правилно име- йони. Молекулите също могат да имат несдвоени електрони и ненаситени валенции - в този случай те се наричат радикали.
Заключение

Сега знаете какво е атом и всички вещества без изключение са съставени от молекули, а последните от своя страна са изградени от атоми. Физичните свойства на веществото определят подреждането и свързването на атомите и молекулите в него.
От периода на античността до средата на 18 век науката е доминирана от идеята, че атомът е частица материя, която не може да бъде разделена. Английският учен, както и натуралистът Д. Далтън, определят атома като най-малкия компонент на химичния елемент. М. В. Ломоносов в своя атомна и молекулярна наукауспя да дефинира атома и молекулата. Той беше сигурен, че молекулите, които той нарече "корпускули", са изградени от "елементи" - атоми - и са в постоянно движение.
Д. И. Менделеев вярва, че тази субединица от вещества, които изграждат материалния свят, запазва всички свои свойства само ако не е подложена на разделяне. В тази статия ще определим атома като обект на микросвета и ще проучим неговите свойства.
Предпоставки за създаване на теория за строежа на атома
През 19 век твърдението за неделимостта на атома се счита за общоприето. Повечето учени смятат, че частиците на един химичен елемент при никакви обстоятелства не могат да се превърнат в атоми на друг елемент. Тези идеи послужиха като основа, върху която се основаваше дефиницията на атома до 1932 г. В края на 19 век са направени фундаментални открития в науката, които променят това мнение. На първо място, през 1897 г английски физикД. Дж. Томсън открива електрона. Този факт коренно промени представите на учените за неделимостта на съставната част на химичния елемент.
Как да докажем, че един атом е сложен
Още преди учените единодушно се съгласиха, че атомите нямат заряди. Тогава беше установено, че електроните лесно се освобождават от всеки химичен елемент. Те могат да бъдат намерени в пламък, те са носители на електрически ток, освобождават се от вещества по време на рентгенови лъчи.

Но ако електроните са част от всички атоми без изключение и са отрицателно заредени, тогава все още има някои частици в атома, които трябва да имат положителен заряд, в противен случай атомите не биха били електрически неутрални. Това помогна да се разкрие структурата на атома физическо явлениекато радиоактивност. Той даде правилното определение на атома във физиката, а след това и в химията.
Невидими лъчи
Френският физик А. Бекерел е първият, който описва феномена на излъчване от атоми на определени химични елементи, визуално невидими лъчи. Те йонизират въздуха, преминават през вещества, причиняват почерняване на фотоплаките. По-късно семейство Кюри установи това радиоактивни веществасе превръщат в атоми на други химични елементи (например уран - в нептуний).
Радиоактивното лъчение е разнородно по състав: алфа частици, бета частици, гама лъчи. По този начин явлението радиоактивност потвърди, че частиците на елементите на периодичната таблица имат сложна структура. Този факт беше причината за промените, направени в дефиницията на атома. От какви частици се състои атомът, предвид новите научни факти, получени от Ръдърфорд? Отговорът на този въпрос беше предложеният от учения ядрен модел на атома, според който електроните се въртят около положително заредено ядро.
Противоречия на модела на Ръдърфорд
Теорията на учения, въпреки изключителния си характер, не може обективно да дефинира атома. Нейните заключения противоречат на основните закони на термодинамиката, според които всички електрони, въртящи се около ядрото, губят енергията си и, както и да е, рано или късно трябва да попаднат в него. В този случай атомът се разрушава. Това всъщност не се случва, тъй като химичните елементи и частиците, от които са съставени, съществуват в природата много дълго време. Подобна дефиниция на атома, основана на теорията на Ръдърфорд, е необяснима, както и феноменът, който възниква при преминаване на горещи прости вещества решетка. В крайна сметка получените атомни спектри имат линейна форма. Това беше в конфликт с модела на Ръдърфорд за атома, според който спектрите трябваше да бъдат непрекъснати. Според концепциите на квантовата механика електроните в ядрото в момента се характеризират не като точкови обекти, а като имащи формата на електронен облак.

Най-голямата му плътност е в определен локус на пространството около ядрото и се счита за местоположението на частицата в даден момент от времето. Установено е също, че електроните в атома са подредени на слоеве. Броят на слоевете може да се определи, като се знае номерът на периода, в който се намира елементът в периодичната система на Д. И. Менделеев. Например един фосфорен атом съдържа 15 електрона и има 3 енергийни нива. Индикаторът, който определя броя на енергийните нива, се нарича главно квантово число.
Експериментално е установено, че най-ниска енергия имат електроните от най-близкото до ядрото енергийно ниво. Всяка енергийна обвивка е разделена на поднива, а те от своя страна на орбитали. Електроните, разположени на различни орбитали, имат еднаква форма на облак (s, p, d, f).
Въз основа на гореизложеното следва, че формата на електронния облак не може да бъде произволна. Тя е строго определена според орбиталата , Добавяме също, че състоянието на електрона в макрочастицата се определя от още две стойности - магнитни и спинови квантови числа. Първият се основава на уравнението на Шрьодингер и характеризира пространствената ориентация на електронния облак въз основа на триизмерността на нашия свят. Вторият индикатор е спиновото число, използва се за определяне на въртенето на електрона около оста му по посока на часовниковата стрелка или обратно на часовниковата стрелка.

Откриване на неутрона
Благодарение на работата на Д. Чадуик, извършена от него през 1932 г., в химията и физиката е дадено ново определение на атома. В експериментите си ученият доказа, че при разцепването на полония възниква радиация, причинена от частици, които нямат заряд, с маса 1,008665. Новата елементарна частица е наречена неутрон. Неговото откриване и изследване на неговите свойства позволи на съветските учени В. Гапон и Д. Иваненко да създадат нова теория за структурата на атомното ядро, съдържащо протони и неутрони.
Според новата теория определението за атом на материята имаше следващ изглед: е структурната единица на химичен елемент, състояща се от ядро, съдържащо протони и неутрони и електрони, движещи се около него. Броят на положителните частици в ядрото винаги е равен на поредния номер на химичния елемент в периодичната система.
По-късно професор А. Жданов потвърждава в своите експерименти, че под въздействието на тежко космическо лъчение атомните ядра се разделят на протони и неутрони. Освен това беше доказано, че силите, които задържат тези елементарни частици в ядрото, са изключително енергоемки. Те действат на много къси разстояния (от порядъка на 10 -23 cm) и се наричат ядрени. Както бе споменато по-рано, дори М. В. Ломоносов успя да дефинира атома и молекулата въз основа на известните му научни факти.

Понастоящем се счита за общоприет следният модел: атомът се състои от ядро и електрони, движещи се около него по строго определени траектории - орбитали. Електроните едновременно проявяват свойствата както на частици, така и на вълни, т.е. имат двойна природа. Почти цялата му маса е концентрирана в ядрото на атома. Състои се от протони и неутрони, свързани от ядрени сили.
Възможно ли е да се претегли атом
Оказва се, че всеки атом има маса. Например за водорода е 1,67x10 -24 g. Дори е трудно да си представим колко малка е тази стойност. За да намерят теглото на такъв обект, те не използват везни, а осцилатор, който е въглеродна нанотръба. За изчисляване на теглото на атом и молекула е по-удобна стойност относителна маса. Показва колко пъти теглото на една молекула или атом е по-голямо от 1/12 от въглероден атом, което е 1,66x10 -27 kg. Относителните атомни маси са дадени в периодичната система на химичните елементи и те нямат размери.
Учените добре знаят, че атомната маса на химичния елемент е средна стойностмасови числа на всички негови изотопи. Оказва се, че в природата единиците на един химичен елемент могат да имат различна маса. В този случай зарядите на ядрата на такива структурни частици са еднакви.
Учените са установили, че изотопите се различават по броя на неутроните в ядрото, а зарядът на ядрата им е еднакъв. Например хлорен атом с маса 35 съдържа 18 неутрона и 17 протона, а с маса 37 - 20 неутрона и 17 протона. Много химични елементи са смеси от изотопи. Например, такива прости вещества като калий, аргон, кислород съдържат в състава си атоми, представляващи 3 различни изотопа.
Определение за атомарност
Има няколко тълкувания. Помислете какво се разбира под този термин в химията. Ако атомите на всеки химичен елемент могат да съществуват поне за кратко време отделно, без да се стремят да образуват по-сложна частица - молекула, тогава те казват, че такива вещества имат атомна структура. Например, многоетапна реакция на хлориране на метан. Той се използва широко в химията на органичния синтез за получаване на най-важните халоген-съдържащи производни: дихлорметан, тетрахлорметан. Той разделя молекулите на хлора на атоми с висока реактивност. Те разрушават сигма връзките в молекулата на метана, осигурявайки верижна реакция на заместване.
Още един пример химичен процесимайки голямо значениев промишлеността използването на водороден прекис като дезинфектант и избелващ агент. Определянето на атомарния кислород, като продукт на разпадането на водороден прекис, се извършва както в живи клетки (под действието на ензима каталаза), така и в лабораторни условия. се определя качествено от високите си антиоксидантни свойства, както и от способността да унищожава патогенните агенти: бактерии, гъбички и техните спори.

Как е атомната обвивка
Вече разбрахме по-рано, че структурната единица на химичния елемент има сложна структура. Електроните се въртят около положително заредено ядро. Лауреат Нобелова наградаНилс Бор, базиран на квантова теориясветлина, създава своя собствена доктрина, в която характеристиките и определението на атома са следните: електроните се движат около ядрото само по определени стационарни траектории, докато не излъчват енергия. Доктрината на Бор доказва, че частиците на микрокосмоса, които включват атоми и молекули, не се подчиняват на законите, които са валидни за големите тела - обекти на макрокосмоса.
Структурата на електронните обвивки на макрочастиците е изследвана в трудовете по квантова физика от учени като Хунд, Паули, Клечковски. Така стана известно, че електроните го правят ротационни движенияоколо ядрото не е случаен, а по определени стационарни траектории. Паули установи, че в рамките на едно енергийно ниво на всяка от неговите орбитали s, p, d, f в електронни клетки не може да има повече от две отрицателно заредени частици с противоположни спинове + ½ и - ½.
Правилото на Хунд обяснява как орбиталите със същото енергийно ниво са правилно запълнени с електрони.
Правилото на Клечковски, наричано още правило n + l, обяснява как се запълват орбиталите на многоелектронните атоми (елементи от 5, 6, 7 периода). Всички горепосочени модели са обслужени теоретична обосновкасистема от химични елементи, създадена от Дмитрий Менделеев.
Степен на окисление
Това е фундаментално понятие в химията и характеризира състоянието на атом в молекула. Съвременната дефиниция на степента на окисление на атомите е следната: това е условният заряд на атом в молекула, който се изчислява въз основа на идеята, че молекулата има само йонен състав.
Степента на окисление може да бъде изразена като цяло или дробно число, с положително, отрицателно или нулеви стойности. Най-често атомите на химичните елементи имат няколко степени на окисление. Например, азотът има -3, -2, 0, +1, +2, +3, +4, +5. Но такъв химичен елемент като флуор във всичките му съединения има само едно състояние на окисление, равно на -1. Ако се представи просто вещество, тогава неговата степен на окисление е нула. Това химично количество е удобно за използване за класифициране на вещества и за описание на техните свойства. Най-често степента на окисление на атома се използва в химията при съставяне на уравнения за редокс реакции.
свойства на атомите
Благодарение на откритията квантова физика, модерна дефиницияатом, основана на теорията на Д. Иваненко и Е. Гапон, се допълва от следното научни факти. Структурата на ядрото на атома не се променя по време на химични реакции. Само стационарните електронни орбитали са обект на промяна. Тяхната структура може да обясни много физични и химични свойства на веществата. Ако електрон напусне стационарна орбита и отиде на орбита с по-висок енергиен индекс, такъв атом се нарича възбуден.

Трябва да се отбележи, че електроните не могат дълго времеда бъдат в такива необичайни орбитали. Връщайки се към стационарната си орбита, електронът излъчва квант енергия. Изследването на такива характеристики на структурните единици на химичните елементи като електронен афинитет, електроотрицателност, йонизационна енергия, позволи на учените не само да определят атома като най-важната частица на микросвета, но също така им позволи да обяснят способността на атомите да образуват стабилно и енергийно по-благоприятно молекулярно състояние на материята, което е възможно благодарение на създаването на различни видове устойчиви химическа връзка: йонни, ковалентно-полярни и неполярни, донорно-акцепторни (като разновидности ковалентна връзка) и метал. Последният определя най-важните физически и Химични свойствавсички метали.
Експериментално е установено, че размерът на атома може да варира. Всичко ще зависи от това в коя молекула е включен. Благодарение на рентгеновия дифракционен анализ е възможно да се изчисли разстоянието между атомите в химическо съединение, както и да разберете радиуса на структурната единица на елемента. Познавайки моделите на промяна на радиусите на атомите, включени в период или група химични елементи, е възможно да се предвидят техните физични и химични свойства. Например, в периоди с увеличаване на заряда на ядрото на атомите, техните радиуси намаляват („компресия на атома“), така че металните свойства на съединенията отслабват, а неметалните се увеличават.
По този начин знанията ви позволяват точно да определите физичните и химичните свойства на всички елементи, включени в периодичната система на Менделеев.
Отговор на редакциятаПрез 1913 г. датският физик Нилс Борпредлага своята теория за структурата на атома. Той взе за основа планетарния модел на атома, разработен от физика Ръдърфорд. В него атомът беше оприличен на обектите от макрокосмоса - планетна система, където планетите се движат по орбити около голяма звезда. По подобен начин в планетарния модел на атома електроните се движат по орбити около централно разположения тежко ядро.
Бор въвежда идеята за квантуване в теорията на атома. Според него електроните могат да се движат само по фиксирани орбити, съответстващи на определени енергийни нива. Именно моделът на Бор стана основа за създаването на съвременния квантово-механичен модел на атома. В този модел ядрото на атома, състоящо се от положително заредени протони и незаредени неутрони, също е заобиколено от отрицателно заредени електрони. Въпреки това, според квантовата механика, за един електрон е невъзможно да се определи някаква точна траектория или орбита на движение - има само област, в която има електрони с подобно енергийно ниво.
Какво има вътре в атома?
Атомите са съставени от електрони, протони и неутрони. Неутроните бяха открити след като физиците разработиха планетарния модел на атома. Едва през 1932 г., докато провежда серия от експерименти, Джеймс Чадуик открива частици, които нямат заряд. Липсата на заряд се потвърждава от факта, че тези частици не реагират по никакъв начин на електромагнитното поле.
Самото ядро на атома се образува от тежки частици - протони и неутрони: всяка от тези частици е почти две хиляди пъти по-тежка от електрона. Протоните и неутроните също са подобни по размер, но протоните имат положителен заряд, а неутроните изобщо нямат заряд.
От своя страна протоните и неутроните са изградени от елементарни частици, наречени кварки. IN съвременна физикаКварките са най-малките основни частици на материята.
Размерът на самия атом е многократно по-голям от размера на ядрото. Ако един атом се увеличи до размера на футболно игрище, тогава размерът на ядрото му може да бъде сравним с тенис топка в центъра на такова поле.
В природата има много атоми, които се различават по размер, маса и други характеристики. Група от атоми от един и същи вид се нарича химичен елемент. Към днешна дата са известни повече от сто химически елемента. Техните атоми се различават по размер, маса и структура.
Електрони вътре в атом
Отрицателно заредените електрони се движат около ядрото на атома, образувайки вид облак. Масивното ядро привлича електрони, но енергията на самите електрони им позволява да „избягат“ по-далеч от ядрото. Следователно, колкото по-голяма е енергията на един електрон, толкова по-далеч от ядрото е той.
Стойността на енергията на електрона не може да бъде произволна, тя съответства на точно определен набор от енергийни нива в атома. Тоест, енергията на електрона се променя стъпаловидно от едно ниво на друго. Съответно електронът може да се движи само в рамките на ограничена електронна обвивка, съответстваща на едно или друго енергийно ниво— това е смисълът на постулатите на Бор.
След като получи повече енергия, електронът „скача“ към по-висок слой от ядрото, губейки енергия, напротив, към по-нисък слой. По този начин облакът от електрони около ядрото е подреден под формата на няколко "изрязани" слоя.
История на идеите за атома
Самата дума "атом" идва от гръцката "неделима" и се връща към идеите на древногръцките философи за най-малката неделима част от материята. През Средновековието химиците са се убедили, че някои вещества не могат да бъдат допълнително разградени на съставните си елементи. Тези най-малки частици материя се наричат атоми. През 1860 г. на международния конгрес на химиците в Германия това определение е официално закрепено в световната наука.
IN края на XIXВ началото на 20 век физиците откриват субатомните частици и става ясно, че атомът всъщност не е неделим. Веднага бяха представени теории вътрешна структурана атома, един от първите от които е моделът на Томсън или моделът на "пудинг със стафиди". Според този модел малки електрони са били вътре в масивно положително заредено тяло, като стафиди в пудинг. Практическите експерименти на химика Ръдърфорд обаче опровергават този модел и го карат да създаде планетарен модел на атома.
Развитието на Бор на планетарния модел, заедно с откриването на неутроните през 1932 г., формира основата за съвременна теорияза структурата на атома. Следващите етапи в развитието на знанията за атома вече са свързани с физиката на елементарните частици: кварки, лептони, неутрино, фотони, бозони и др.
АТОМ, най-малката частица от вещество, която може да влезе в химична реакция. Всяко вещество има свой собствен набор от атоми. Едно време се смяташе, че атомът е неделим, но се състои от положително заредено ЯДРО, около което се въртят отрицателно заредени електрони. Ядрото (чието съществуване е установено през 1911 г. от Ернст РЪДЪРФОРД) се състои от плътно опаковани протони и неутрони. Той заема само малка част от пространството вътре в атома, но представлява почти цялата маса на атома. През 1913 г. Niels BOR предполага, че електроните се движат по фиксирани орбити. Оттогава изследванията в КВАНТОВАТА МЕХАНИКА доведоха до ново разбиране на орбитите: според ПРИНЦИПА НА НЕСИГУРНОСТТА на Хайзенберг точната позиция и МОМЕНТ на движение на субатомна частица не могат да бъдат известни едновременно. Броят на електроните в атома и тяхното разположение определят химичните свойства на елемента. Когато един или повече електрони се добавят или отнемат, се създава йон.
Масата на атома зависи от размера на ядрото. Той представлява най-голямата част от теглото на атома, тъй като електроните не тежат нищо. Например атомът на урана е най-тежкият атом, който се среща в природата.Той има 146 неутрона, 92 протона и 92 електрона. От друга страна, най-лекият е водородният атом, който има 1 протон и електрон. Урановият атом обаче, макар и 230 пъти по-тежък от водородния атом, е само три пъти по-голям по размер. Теглото на атома се изразява в единици атомна маса и се означава като u. Атомите са съставени от още по-малки частици, наречени субатомни (елементарни) частици. Основните са протони (положително заредени), неутрони (електрически неутрални) и >lsktrons (отрицателно "заредени). Клъстери от проунони и неутрони образуват ядро в центъра на атома на всички >msmstone (с изключение на водорода, който има само един протон).„Електроните“ се въртят наоколо! ядра на известно разстояние от него, съизмеримо с pa (мерки на атом. | (Ако, например, ядрото на атом на хелий беше с размерите на топка за тенис, тогава електроните биха били на разстояние 6 km от него , Има 112 различни вида атоми, толкова, колкото елементи n периодичната таблица. Атомите на елементите се отличават с атомния си номер и атомна маса. ЯДРОТО НА АТОМА Масата на атома се дължи главно на сравнително плътното ядро. I (ротоните и неутроните имат маса приблизително 1K4 () пъти по-голяма от електроните. Тъй като циклите са положително заредени, а неутроните са неутрални, ядрото на атома винаги е положително заредено. Тъй като противоположните заряди взаимно се привличат, ядрото задържа електроните в своите орбити. Руните и неутроните се състоят от още по-малки частици, кварки. Колкото повече енергия има един електрон. li "M, толкова по-далеч може да отиде, преодолявайки привличането на положително заредено ядро. В неутрален атом положителният заряд на електроните балансира положителния заряд на протоните на ядрото.Следователно премахването или добавянето на един електрон в агоме води до появата на зареден йон Електронните обвивки са разположени на фиксирани разстояния от ядрото в зависимост от тяхното енергийно ниво. Всяка черупка е номерирана, като се брои от ядрото. Никога няма повече от седем черупки на гоме и всяка от тях може да съдържа само определен брой електрони. Ако има достатъчно енергия, електронът може да скочи от една обвивка в друга, по-висока. Когато удари отново долната обвивка, тя излъчва радиация под формата на фотон. Електронът принадлежи към клас частици, наречени лептони, а неговата античастица се нарича позитрон.
ВЕРИЖНА ЯДРЕНА РЕАКЦИЯ. При ядрен взрив, например, ayumnoi oombs, неутрон удря ядро от уран 23b (тоест ядро с общ брой протони и неутрони, равен на ? 35). При: nom, неутронът се абсорбира и се създава уран. 236 Той е много нестабилен и се разделя на две по-малки ядра, което освобождава огромно количество енергия и няколко неутрона. наречени критични условия (количеството на уран-235 надвишава критичната маса ), тогава броят на неутронните сблъсъци ще бъде достатъчен, за да се развие реакцията със светкавична скорост, т.е. продължава верижна реакция. В ядрен реактор heplo, освободен по време на EUM процеса, се използва за нагряване на пара, която задвижва турбинен генератор за генериране на електричество.
Научно-технически енциклопедичен речник.
Синоними:Вижте какво е "ATOM" в други речници:
атоматом и... Руски правописен речник
- (гръцки атомос, от отрицателна част и том, отдел томос, сегмент). Безкрайно малка неделима частица, чиято съвкупност съставлява всяка физическо тяло. Речник чужди думивключени в руския език. Chudinov A.N., 1910. ATOM гръцки ... Речник на чуждите думи на руския език
атом- a м. atome m. 1. Най-малката неделима частица материя. Атомите не могат да бъдат вечни. Кантемир За природата. Ампер вярва, че всяка неделима частица материя (атом) съдържа присъщо количество електричество. DZ 1848 56 8 240. Нека бъде… … Исторически речникгалицизми на руския език
- (от гръцки atomos - неделим) най-малките съставни частици на материята, които изграждат всичко съществуващо, включително душата, образувана от най-фините атоми (Левкип, Демокрит, Епикур). Атомите са вечни, те не възникват и не изчезват, намирайки се в постоянно ... ... Философска енциклопедия
атом- Атом ♦ Атом Етимологично, атомът е неделима частица или частица, подлежаща само на спекулативно разделяне; неделим елемент (atomos) на материята. Демокрит и Епикур разбират атома в този смисъл. Съвременните учени са наясно, че това е ... ... Философски речникСпонвил
- (от гръцки atomos неделим) най-малката частица от химичен елемент, която запазва свойствата си. В центъра на атома има положително заредено ядро, в което е концентрирана почти цялата маса на атома; електроните се движат наоколо, образувайки електронни ... Голям енциклопедичен речник
Съпруг, грък неделима; материя в крайните граници на нейната делимост, невидима прашинка, от която уж са съставени всички тела, всяко вещество, сякаш от песъчинки. | Неизмерима, безкрайно малка прашинка, незначително количество. | Химиците имат думата ... ... РечникДалия
См … Речник на синонимите
АТОМ- (от гръцки atomos неделим). Думата А. се използва в съвременна наукав различни сетива. В повечето случаи А. наричат ограничаващото количество хим. елемент, по-нататъшното фрагментиране до рог води до загуба на индивидуалността на елемента, т.е. до остър ... ... Голяма медицинска енциклопедия
атом- атом Атомът е част от речта, като най-малък носител на химичните сили на пеещия химичен елемент. Vіdomo стилове на видове атоми, sílki на е химични елементи и техните изотопи. Електрически неутрален, съставен от ядра и електрони. Радиусът на атома ...... Гирничий енциклопедичен речник
Книги
- Водородният атом и неевклидовата геометрия, V.A. Фок. Тази книга ще бъде произведена в съответствие с вашата поръчка с помощта на технологията Print-on-Demand. Възпроизведено в оригиналния авторски правопис на изданието от 1935 г. (издателство „Издателство ...
- Водородният атом е най-простият от всички атоми. Продължение на теорията на Нилс Бор. Част 5. Честотата на фотонното излъчване съвпада със средната честота на електронното излъчване в прехода, А. И. Шидловски. Теорията на Бор за водородния атом („паралелна“ на квантово-механичния подход) е продължена по традиционния път на развитие на физиката, където на теория съжителстват наблюдаеми и ненаблюдаеми величини. За…
АТОМ [фр. atome, от лат. atomus, от гръцки?τομος (ουσ?α) - неделима (същност)], частица материя, най-малката частхимичен елемент, който е носител на неговите свойства. Атомите на всеки елемент са индивидуални по структура и свойства и са обозначени химически символиелементи (например водороден атом - Н, желязо - Fe, живак - Hg, уран - U и др.). Атомите могат да съществуват както в свободно състояние, така и в свързано състояние (виж Химическа връзка). Цялото разнообразие от вещества се дължи на различни комбинации от атоми помежду си. Свойствата на газообразните, течните и твърдите вещества зависят от свойствата на съставните им атоми. Всички физични и химични свойства на атома се определят от неговата структура и се подчиняват квантови закони. (За историята на развитието на учението за атома вижте статията Атомна физика.)
Обща характеристика на структурата на атомите. Атомът се състои от тежко ядро с положителен електрически заряд и леки електрони, които го заобикалят с отрицателни електрически заряди, които образуват електронните обвивки на атома. Размерите на атома се определят от размерите на неговата външна електронна обвивка и са големи в сравнение с размерите на атомното ядро. Характеристики на диаметри, площи напречно сечениеа обемите на атома и ядрото са:
Атом 10 -8 cm 10 -16 cm 2 10 -24 cm 3
Сърцевина 10 -12 cm 10 -24 cm 2 10 -36 cm 3
Електронните обвивки на атома нямат строго определени граници и стойностите на размерите на атома зависят в по-голяма или по-малка степен от методите за тяхното определяне.
Зарядът на ядрото е основната характеристика на атома, която определя принадлежността му към определен елемент. Зарядът на ядрото винаги е цяло число, кратно на положителния елементарен електрически заряд, равен на in абсолютна стойностзаряд на електрона -е. Зарядът на ядрото е +Ze, където Z е пореден номер ( атомно число). Z \u003d 1, 2, 3, ... за атоми на последователни елементи в периодичната система от химични елементи, т.е. за атоми H, He, Li, .... В неутрален атом ядро със заряд +Ze държи Z електрони с общ заряд - Ze. Един атом може да загуби или да спечели електрони и да стане положителен или отрицателен йон (k = 1, 2, 3, ... - множествеността на неговата йонизация). Атом на определен елемент често се нарича негови йони. При писане йоните се отличават от неутрален атом чрез индекса k + и k -; например O е неутрален кислороден атом, O +, O 2+, O 3+, ..., O 8+, O -, O 2- - неговите положителни и отрицателни йони. Комбинацията от неутрален атом и йони на други елементи със същия брой електрони образува изоелектронна серия, например серия от водородоподобни атоми H, He +, Li 2+, Be 3+, ....
Кратността на заряда на ядрото на атома елементарен заряд e получи обяснение въз основа на идеи за структурата на ядрото: Z е равно на броя на протоните в ядрото, зарядът на протона е +e. Масата на атома нараства с увеличаване на Z. Масата на ядрото на атома е приблизително пропорционална на масово числоА е общият брой на протоните и неутроните в ядрото. Масата на електрона (0,91 10 -27 g) е много по-малка (около 1840 пъти) от масата на протона или неутрона (1,67 × 10 -24 g), така че масата на атома се определя главно от масата на нейното ядро.
Атомите на даден елемент могат да се различават по масата на ядрото (броят на протоните Z е постоянен, броят на неутроните A-Z може да варира); такива разновидности на атоми на един и същи елемент се наричат изотопи. Разликата в масата на ядрото почти не влияе върху структурата на електронните обвивки на даден атом, която зависи от Z, и от свойствата на атома. Най-големите разлики в свойствата (изотопни ефекти) се получават за изотопите на водорода (Z = 1) поради голямата разлика в масите на обичайния лек водороден атом (A = 1), деутерий (A = 2) и тритий (A = 3 ).
Масата на един атом варира от 1,67 × 10 -24 g (за основния изотоп водороден атом, Z = 1, A = 1) до около 4 × 10 -22 g (за атоми трансуранови елементи). Най-точните стойности на атомните маси могат да бъдат определени чрез масспектроскопия. Масата на атома не е точно равна на сумата от масата на ядрото и масите на електроните, но малко по-малко - на масовия дефект ΔM = W / c 2, където W е енергията на образуване на атом от ядрото и електроните (енергия на свързване), c е скоростта на светлината. Тази корекция е от порядъка на масата на електрона m e за тежките атоми, а за леките атоми е незначителна (от порядъка на 10 -4 m e).
Енергията на атома и нейното квантуване. Поради малкия размер и голяма масаатомното ядро може приблизително да се разглежда като точка и да почива в центъра на масата на атома (общият център на масата на ядрото и електроните е разположен близо до ядрото, а скоростта на ядрото спрямо центъра на масата на атомът е малък в сравнение със скоростите на електроните). Съответно атомът може да се разглежда като система, в която N електрони със заряди - e се движат около неподвижен привличащ център. Движението на електрони в атома се извършва в ограничен обем, тоест е свързано. Общата вътрешна енергия на атома E е равна на сумата от кинетичните енергии T на всички електрони и потенциална енергия U - енергии на привличане от ядрото им и отблъскване една от друга.
Според теорията на атома, предложена през 1913 г. от Нилс Бор, във водороден атом един електрон със заряд -e се движи около неподвижен център със заряд +e. Според класическата механика кинетична енергиятакъв електрон е
където v е скоростта, p = m e v е импулсът (импулсът) на електрона. Потенциалната енергия (редуцирана до енергията на кулоновото привличане на електрон от ядрото) е равна на
и зависи само от разстоянието r на електрона от ядрото. Графично функцията U(r) е представена чрез крива, която намалява неограничено с намаляването на r, т.е., когато електронът се приближава до ядрото. Стойността на U(r) при r→∞ се приема за нула. За отрицателни стойности на общата енергия E = T + U< 0 движение электрона является связанным: оно ограничено в пространстве значениями r=r мaкc . При положителни стойностипълна енергия E \u003d T + U > 0, движението на електрона е свободно - може да отиде до безкрайност с енергия E \u003d T \u003d (1/2) m e v 2, което съответства на йонизиран водороден атом H +. По този начин неутрален водороден атом е система от електростатично свързани ядра и електрон с енергия E< 0.
Общата вътрешна енергия на атома E е неговата основна характеристика като квантова система (вижте Квантова механика). Атомът може да остане дълго време само в състояния с определена енергия – стационарни (инвариантни във времето) състояния. Вътрешната енергия на квантова система, състояща се от свързани микрочастици (включително атом), може да приеме една от дискретните (прекъснати) серии от стойности
Всяка от тези "допустими" енергийни стойности съответства на едно или повече стационарни квантови състояния. Системата не може да има междинни стойности на енергия (например лежаща между E 1 и E 2, E 2 и E 3 и т.н.), такава система се нарича квантована. Всяка промяна в E е свързана с квантов (скок) преход на системата от едно стационарно квантово състояние в друго (виж по-долу).
Възможните дискретни стойности (3) на енергията на атома могат да бъдат графично изобразени по аналогия с потенциалната енергия на тяло, повдигнато върху различни височини(до различни нива), под формата на диаграма на енергийните нива, където всяка енергийна стойност съответства на права линия, начертана на височина E i , i= 1, 2, 3, ... (фиг. 1). Най-ниското ниво E 1 , съответстващо на възможно най-ниската енергия на атома, се нарича основно ниво, а всички останали (E i > E 1), i = 2, 3, 4, ...) се наричат възбудени, тъй като за да се премине към тях (преход към съответните стационарни възбудени състояния от земята) е необходимо системата да се възбуди - да се информира отвън енергията E i -E 1 .
 Квантуването на енергията на атома е следствие от вълновите свойства на електроните. Съгласно принципа на корпускулярно-вълновия дуализъм движението на микрочастица с маса m със скорост v съответства на дължина на вълната λ = h/mv, където h е константата на Планк. За електрон в атом λ е от порядъка на 10 -8 cm, т.е. от порядъка на линейните размери на атома и е необходимо да се вземат предвид вълновите свойства на електрона в атома. Свързаното движение на електрон в атом е подобно на стояща вълна и не трябва да се разглежда като движение материална точкапо траекторията, а като сложен вълнов процес. За стояща вълнасамо в ограничена степен определени стойностидължината на вълната λ (и следователно честотата на трептене v). Според квантовата механика енергията на атом E е свързана с v чрез връзката E = hν и следователно може да приема само определени стойности. Свободното постъпателно движение на микрочастица, неограничено в пространството, например движението на електрон, отделен от атом (с енергия E> 0), е подобно на разпространението на пътуваща вълна в неограничен обем, за който всеки възможни са стойности на λ (и v). Енергията на такава свободна микрочастица може да приема всякакви стойности (не е квантована, има непрекъснат енергиен спектър). Такава непрекъсната последователност съответства на йонизиран атом. Стойността на E∞ = 0 съответства на йонизационната граница; разликата E ∞ -E 1 \u003d E йон се нарича йонизационна енергия (виж статията Йонизационен потенциал); за водороден атом тя е равна на 13,6 eV.
Квантуването на енергията на атома е следствие от вълновите свойства на електроните. Съгласно принципа на корпускулярно-вълновия дуализъм движението на микрочастица с маса m със скорост v съответства на дължина на вълната λ = h/mv, където h е константата на Планк. За електрон в атом λ е от порядъка на 10 -8 cm, т.е. от порядъка на линейните размери на атома и е необходимо да се вземат предвид вълновите свойства на електрона в атома. Свързаното движение на електрон в атом е подобно на стояща вълна и не трябва да се разглежда като движение материална точкапо траекторията, а като сложен вълнов процес. За стояща вълнасамо в ограничена степен определени стойностидължината на вълната λ (и следователно честотата на трептене v). Според квантовата механика енергията на атом E е свързана с v чрез връзката E = hν и следователно може да приема само определени стойности. Свободното постъпателно движение на микрочастица, неограничено в пространството, например движението на електрон, отделен от атом (с енергия E> 0), е подобно на разпространението на пътуваща вълна в неограничен обем, за който всеки възможни са стойности на λ (и v). Енергията на такава свободна микрочастица може да приема всякакви стойности (не е квантована, има непрекъснат енергиен спектър). Такава непрекъсната последователност съответства на йонизиран атом. Стойността на E∞ = 0 съответства на йонизационната граница; разликата E ∞ -E 1 \u003d E йон се нарича йонизационна енергия (виж статията Йонизационен потенциал); за водороден атом тя е равна на 13,6 eV.
Разпределение на електронната плътност. Точната позиция на електрона в атома в даден момент от време не може да бъде установена поради несигурността на съотношението. Състоянието на електрона в атома се определя от неговата вълнова функция, която по определен начин зависи от неговите координати; квадратът на модула на вълновата функция характеризира плътността на вероятността за намиране на електрон в дадена точка в пространството. вълнова функцияизрично е решението на уравнението на Шрьодингер.
По този начин състоянието на електрона в атома може да се характеризира с разпределението на неговия електрически заряд в пространството с определена плътност - разпределението на електронната плътност. Електроните са, така да се каже, "размазани" в пространството и образуват "електронен облак". Такъв модел характеризира по-правилно електроните в атома, отколкото моделът на точков електрон, движещ се по строго определени орбити (в теорията на атома на Бор). В същото време всяка такава орбита на Бор може да бъде свързана със специфично разпределение на електронната плътност. За основно енергийно ниво E 1, електронната плътност е концентрирана близо до ядрото; за възбудени енергийни нива E 2 , E 3 , E 4 ... се разпределя на все по-големи средни разстояния от ядрото. В многоелектронен атом електроните са групирани в обвивки, които обграждат ядрото на различни разстояния и се характеризират с определени разпределения на електронната плътност. Силата на свързване на електроните с ядрото във външните обвивки е по-малка, отколкото във вътрешните обвивки, а електроните са най-слабо свързани в най-външната обвивка, която има най-големи размери.
Отчитане на спина на електрона и спина на ядрото. В теорията на атома е много важно да се вземе предвид спинът на електрона - неговият собствен (спин) момент на импулс, от визуална гледна точка съответстващ на въртенето на електрона около собствената му ос (ако електронът се разглежда като малка частица). Сто собствен (спин) магнитен момент е свързан със спина на електрона. Следователно в атома е необходимо да се вземат предвид, наред с електростатичните взаимодействия, магнитните взаимодействия, определени от спиновия магнитен момент и орбиталния магнитен момент, свързан с движението на електрона около ядрото; магнитните взаимодействия са малки в сравнение с електростатичните. Влиянието на спина в многоелектронните атоми е най-съществено: запълването на електронните обвивки на атома с определен брой електрони зависи от спина на електроните.
Ядрото в атома може да има и свой механичен момент - ядреният спин, който е свързан с ядрен магнитен момент, стотици и хиляди пъти по-малък от електронния. Съществуването на спинове води до допълнителни, много малки взаимодействия между ядрото и електроните (виж по-долу).
Квантови състояния на водородния атом. Най-важна роля в квантовата теория на атома играе теорията за най-простия едноелектронен атом, състоящ се от ядро със заряд +Ze и електрон със заряд -e, тоест теорията за водорода атом H и водородоподобни йони He +, Li 2+, Be 3+, ..., обикновено наричани теорията на водородния атом. Чрез методите на квантовата механика е възможно да се получи точно и пълно описаниесъстояния на електрон в едноелектронен атом. Проблемът с многоелектронния атом се решава само приблизително; в този случай те изхождат от резултатите от решаването на проблема с едноелектронен атом.
Енергията на едноелектронен атом в нерелативистично приближение (без да се взема предвид спинът на електрона) е равна на
цяло число n = 1, 2, 3, ... определя възможните дискретни енергийни стойности - енергийни нива - и се нарича основно квантово число, R е константата на Ридберг, равна на 13,6 eV. Енергийните нива на атома се сближават (кондензират) към йонизационната граница Е ∞ = 0, съответстваща на n =∞. За водородоподобните йони се променя само скалата на енергийните стойности (с коефициент Z2). Енергията на йонизация на подобен на водород атом (енергия на свързване на електрони) е (в eV)
което дава за H, He +, Li 2+, ... стойностите 13.6 eV, 54.4 eV, 122.4 eV, ... .
Основната формула (4) съответства на израза U(r) = -Ze 2 /r за потенциалната енергия на електрона в електричното поле на ядро със заряд +Ze. Тази формула е получена за първи път от Н. Бор чрез разглеждане на движението на електрон около ядрото в кръгова орбита с радиус r и е точното решение на уравнението на Шрьодингер за такава система. Енергийните нива (4) съответстват на орбитите с радиус
където константата a 0 \u003d 0,529 10 -8 cm \u003d \u003d 0,529 A е радиусът на първата кръгова орбита на водородния атом, съответстваща на неговото основно ниво (този радиус на Бор често се използва като удобна единица за измерване на дължини в атомна физика). Радиусът на орбитите е пропорционален на квадрата на главното квантово число n 2 и обратно пропорционален на Z; за водородоподобни йони мащабът на линейните размери намалява с фактор Z в сравнение с водородния атом. Релативисткото описание на водородния атом, като се вземе предвид спинът на електрона, се дава от уравнението на Дирак.
Според квантовата механика състоянието на водородния атом се определя изцяло от дискретни стойностичетири физични величини: енергия Е; орбитален момент M l (моментът на импулса на електрона спрямо ядрото); проекции M lz на орбиталния импулс върху произволно избрана посока z; проекция M sz на въртящия момент ( собствен моментимпулс на електрона M s). Възможните стойности на тези физични величини от своя страна се определят съответно от квантовите числа n, l, m l , m s. В приближението, когато енергията на водороден атом се описва с формула (4), тя се определя само от основното квантово число n, което приема цели стойности 1, 2, 3, ... . Едно енергийно ниво с дадено n съответства на няколко състояния, които се различават по стойностите на орбиталното (азимутално) квантово число l = 0, 1, ..., n-1. Състоянията с дадени стойности на n и l обикновено се означават като 1s, 2s, 2p, 3s, ..., където числата показват стойността на n, а буквите s, p, d, f (по-нататък латиница) - стойности l = съответно 0, 1, 2, 3. За дадени n и l броят на различните състояния е 2 (2l + 1) - броят на комбинациите от стойности на магнитното орбитално квантовото число m l от магнитното спиново число m s (първото приема 2l + 1 стойности, второто - 2 стойности). Общият брой на различните състояния с дадени n и l е 2n 2 . Така всяко енергийно ниво на водороден атом съответства на 2,8, 18,…2n 2 (при n= 1, 2, 3, ...) различни стационарни квантови състояния. Ако само едно квантово състояние съответства на енергийно ниво, то се нарича неизродено, ако две или повече - изродено (виж Израждане в квантовата теория), а броят на такива състояния g се нарича степен или кратност на израждането (за неизродени енергийни нива g = 1). Енергийните нива на водородния атом са изродени и тяхната степен на изроденост е g n = 2n 2 .
За различните състояния на водородния атом се получава и различно разпределение на електронната плътност. Зависи от квантовите числа n, l и В същото време електронната плътност за s-състояния (l=0) е различна от нула в центъра, т.е. на мястото на ядрото, и не зависи от посока (сферично симетрична), а за останалите състояния (l>0) е равна на нула в центъра и зависи от посоката. Разпределението на електронната плътност за състоянията на водородния атом с n = 1, 2, 3 е показано на фигура 2; размерите на "електронния облак" нарастват в съответствие с формула (6) пропорционално на n2 (мащабът на фигура 2 намалява при преминаване от n = 1 към n = 2 и от n = 2 към n = 3). Квантовите състояния на електрона във водородоподобните йони се характеризират със същите четири квантови числа n, l, m l и m s, както във водородния атом. Разпределението на електронната плътност също се запазва, само че се увеличава с фактор Z.
 Действие върху атома на външни полета. Атомът като електрическа система във външни електрически и магнитни полета придобива допълнителна енергия. Електрическото поле поляризира атома - измества електронните облаци спрямо ядрото (вижте Поляризуемостта на атоми, йони и молекули), а магнитното поле ориентира по определен начин магнитния момент на атома, свързан с движението на електрона около ядрото (с орбитален момент M l) и неговия спин. Различните състояния на водородния атом със същата енергия E n във външно поле съответстват на различни стойности на допълнителната енергия ΔE, а дегенерираното енергийно ниво E n се разделя на няколко поднива. Както разделянето на енергийните нива в електрическо поле – ефектът на Старк – така и тяхното разделяне в магнитно поле – ефектът на Зееман – са пропорционални на силите на съответните полета.
Действие върху атома на външни полета. Атомът като електрическа система във външни електрически и магнитни полета придобива допълнителна енергия. Електрическото поле поляризира атома - измества електронните облаци спрямо ядрото (вижте Поляризуемостта на атоми, йони и молекули), а магнитното поле ориентира по определен начин магнитния момент на атома, свързан с движението на електрона около ядрото (с орбитален момент M l) и неговия спин. Различните състояния на водородния атом със същата енергия E n във външно поле съответстват на различни стойности на допълнителната енергия ΔE, а дегенерираното енергийно ниво E n се разделя на няколко поднива. Както разделянето на енергийните нива в електрическо поле – ефектът на Старк – така и тяхното разделяне в магнитно поле – ефектът на Зееман – са пропорционални на силите на съответните полета.
Малките магнитни взаимодействия вътре в атома също водят до разделяне на енергийните нива. За водородния атом и водородоподобните йони има спин-орбитално взаимодействие - взаимодействие на спиновите и орбиталните моменти на електрона; той предизвиква т. нар. фина структура на енергийните нива - разцепването на възбудените нива E n (при n>1) на поднива. За всички енергийни нива на водородния атом се наблюдава и свръхфина структура, дължаща се на много малки магнитни взаимодействия на ядрения спин с електронните моменти.
Електронни обвивки на многоелектронни атоми. Теорията за атом, съдържащ 2 или повече електрона, е фундаментално различна от теорията за водороден атом, тъй като в такъв атом има идентични частици, взаимодействащи помежду си - електрони. Взаимното отблъскване на електрони в многоелектронен атом значително намалява силата на връзката им с ядрото. Например, енергията на отделяне на един електрон в хелиев йон (He +) е 54,4 eV, докато в неутрален атом на хелий, в резултат на отблъскване на електрони, енергията на отделяне на един от тях намалява до 24,6 eV. За външните електрони на по-тежките атоми намаляването на силата на връзката им поради отблъскване от вътрешните електрони е още по-значимо. Важна роляв атомите с много електрони свойствата на електроните играят като идентични микрочастици (виж Принцип на идентичност) със спин s = 1/2, за които е валиден принципът на Паули. Съгласно този принцип в система от електрони не може да има повече от един електрон във всяко квантово състояние, което води до образуването на електронни обвивки на атома, изпълнени със строго определен брой електрони.
Като се има предвид неразличимостта на взаимодействащите електрони, има смисъл да се говори само за квантовите състояния на атома като цяло. Въпреки това, може приблизително да се разгледат квантовите състояния на отделните електрони и да се характеризира всеки от тях чрез набор от квантови числа n, l, m l и m s, подобно на електрон във водороден атом. В този случай енергията на електрона се оказва зависима не само от n, както при водородния атом, но и от l; все още не зависи от m l и m s. Електроните с дадени n и l в многоелектронен атом имат еднаква енергия и образуват определена електронна обвивка. Такива еквивалентни електрони и обвивки, образувани от тях, както и квантови състояния и енергийни нива с дадени n и l, се означават със символите ns, np, nd, nf, ... (за 1 = 0, 1, 2, 3, ...) и те говорят за 2p електрони, 3s обвивки и т.н.
Съгласно принципа на Паули, всеки 2 електрона в атом трябва да бъдат в различни квантови състояния и следователно да се различават с поне едно от четирите квантови числа n, l, m l и m s, а за еквивалентни електрони (n и l са еднакви) - по стойностите m l и m s . Броят на двойките m l , m s , т.е. броят на различните квантови състояния на електрона с дадени n и l, е степента на израждане на неговото енергийно ниво g l = 2 (2l+1) = 2, 6, 10, 14, ... . Той определя броя на електроните в напълно запълнени електронни обвивки. По този начин s-, p-, d-, f-, ... черупки са запълнени с 2, 6, 10, 14, ... електрони, независимо от стойността на n. Електроните с дадено n образуват слой, състоящ се от обвивки с l = 0, 1, 2, ..., n - 1 и запълнени с 2n 2 електрона, така наречения K-, L-, M, N-слой. При пълно завършване имаме:

Във всеки слой обвивките с по-малко l се характеризират с по-висока електронна плътност. Силата на връзката между електрона и ядрото намалява с увеличаване на n, а за дадено n - с увеличаване на l. Колкото по-слаб е свързаният електрон в съответната обвивка, толкова по-високо е енергийното му ниво. Ядро с дадено Z свързва електрони в ред на намаляване на силата на тяхната връзка: първо два електрона 1s, след това два електрона 2s, шест електрона 2p и т.н. конфигурация, например:
(броят на електроните в дадена обвивка се обозначава с индекса горе вдясно). Периодичността в свойствата на елементите се определя от сходството на външните електронни обвивки на атома. Например неутралните атоми P, As, Sb, Bi (Z = 15, 33, 51, 83) имат три p-електрона във външната електронна обвивка, като N атома, и са подобни на него по химични и много физични свойства .
Всеки атом се характеризира с нормална електронна конфигурация, получена, когато всички електрони в атома са най-силно свързани, и възбудени електронни конфигурации, когато един или повече електрони са по-свободно свързани - са на по-високи енергийни нива. Например за атом на хелий, наред с нормалния 1s2, са възможни възбудени електронни конфигурации: 1s2s, 1s2p, ... (един електрон е възбуден), 2s 2, 2s2p, ... (и двата електрона са възбудени). Определена електронна конфигурация съответства на едно енергийно ниво на атома като цяло, ако електронните обвивки са напълно запълнени (например нормалната конфигурация на атома е Ne 1s 2 2s 2 2р 6), и редица енергийни нива, ако има частично запълнени обвивки (например нормалната конфигурация на азотния атом е 1s 2 2s 2 2p 3, за която обвивката 2p е наполовина запълнена). При наличието на частично запълнени d- и f-обвивки, броят на енергийните нива, съответстващи на всяка конфигурация, може да достигне много стотици, така че схемата на енергийните нива на атом с частично запълнени обвивки е много сложна. Базовото енергийно ниво на атома е най-ниското ниво на нормалната електронна конфигурация.
Квантови преходи в атома. При квантови преходиатом се движи от един стабилно състояниена друго – от едно енергийно ниво на друго. При прехода от по-високо енергийно ниво E i към по-ниско Е на атома отдава енергия E i - E k , при обратния преход той я получава. Както при всяка квантова система, квантовите преходи за един атом могат да бъдат два вида: с излъчване (оптични преходи) и без излъчване (радиационни или неоптични преходи). Най-важната характеристика на квантовия преход е неговата вероятност, която определя колко често може да се случи този преход.
По време на квантови преходи с радиация, атомът абсорбира (преход E към → E i) или излъчва (преход E i → E към) електромагнитно излъчване. Електромагнитната енергия се абсорбира и излъчва от атом под формата на квант светлина - фотон - характеризиращ се с определена честотатрептения v, съгласно отношението:
където hv е енергията на фотона. Съотношението (7) е законът за запазване на енергията за микроскопични процеси, свързани с радиация.
Атом в основно състояние може да абсорбира само фотони, докато във възбудено състояние той може както да ги абсорбира, така и да ги излъчва. Свободен атом в основно състояние може да съществува неограничено време. Продължителността на престоя на атома във възбудено състояние (времето на живот на това състояние) е ограничена, атомът спонтанно (спонтанно), частично или напълно губи енергията на възбуждане, излъчвайки фотон и преминавайки към повече ниско нивоенергия; наред с такова спонтанно излъчване е възможно и стимулирано излъчване, което се случва, подобно на абсорбцията, под действието на фотони със същата честота. Времето на живот на възбуден атом е толкова по-кратко, колкото по-голяма е вероятността за спонтанен преход, за водороден атом е от порядъка на 10 -8 s.
Наборът от честоти v на възможните преходи с лъчение определя атомния спектър на съответния атом: наборът от честоти на преходите от долните към горните нива е неговият спектър на поглъщане, наборът от честоти на преходите от горните към долните нива е спектърът на излъчване . Всеки такъв преход атомен спектърсъответства на определена спектрална линия с честота v.
При нерадиационни квантови преходи атомът получава или отдава енергия, когато взаимодейства с други частици, с които се сблъсква в газ или е дългосрочно свързан в молекула, течност или твърдо вещество. В газ атомът може да се счита за свободен в интервалите от време между сблъсъци; по време на сблъсък (удар), атомът може да отиде на по-ниска или високо нивоенергия. Такъв сблъсък се нарича нееластичен (за разлика от еластичния сблъсък, при който се променя само кинетичната енергия движение напредатом, а вътрешната му енергия остава непроменена). важно специален случай- сблъсък на свободен атом с електрон; обикновено електронът се движи по-бързо от атома, времето за сблъсък е много кратко и може да се говори за електронен удар. Възбуждането на атом чрез електронен удар е един от методите за определяне на неговите енергийни нива.
Химически и физични свойстваатом. Повечето от свойствата на атома се определят от структурата и характеристиките на външните му електронни обвивки, в които електроните са относително слабо свързани с ядрото (енергии на свързване от няколко eV до няколко десетки eV). Структурата на вътрешните обвивки на атома, чиито електрони са много по-силно свързани (енергии на свързване от стотици, хиляди и десетки хиляди eV), се проявява само при взаимодействия на атома с бързи частици и фотони с висока енергия (повече от стотици eV). Такива взаимодействия определят рентгеновите спектри на атома и разсейването на бързите частици (виж Дифракция на частици). Масата на атома зависи от неговата механични свойствакогато един атом се движи като цяло - количеството движение, кинетична енергия. Различни резонансни и други физични свойства на атома зависят от механичните и свързаните с тях магнитни и електрически моменти на атома (виж Електронен парамагнитен резонанс, Ядрен магнитен резонанс, Ядрен квадруполен резонанс).
Електроните на външните обвивки на атома лесно се подлагат на външни влияния. Когато атомите се приближават един към друг, възникват силни електростатични взаимодействия, които могат да доведат до образуването на химична връзка. По-слабите електростатични взаимодействия на два атома се проявяват в тяхната взаимна поляризация - изместването на електроните спрямо ядрата, което е най-силно за слабо свързани външни електрони. Между атомите възникват поляризационни сили на привличане, които трябва да се вземат предвид вече при големи разстояния между тях. Поляризацията на атома възниква и във външни електрически полета; в резултат енергийните нива на атома се изместват и, което е особено важно, изродените енергийни нива се разделят (ефектът на Старк). Поляризацията на атома може да възникне под въздействието на електрическо полесветлинна (електромагнитна) вълна; зависи от честотата на светлината, което определя зависимостта от нея и коефициента на пречупване (виж Светлинна дисперсия), свързана с поляризуемостта на атома. Затворете връзкатаОптичните характеристики на атома с неговите електрически свойства са особено изразени в неговите оптични спектри.
Магнитните свойства на атомите се определят главно от структурата на техните електронни обвивки. Магнитният момент на атом зависи от неговия механичен момент (виж Магнито-механично съотношение), в атом с напълно запълнени електронни обвивки той е нула, точно както механичен момент. Атомите с частично запълнени външни електронни обвивки имат като правило ненулеви магнитни моменти и са парамагнитни. Във външно магнитно поле всички нива на атомите, в които магнитният момент не е равен на нула, се разделят - възниква ефектът на Зееман. Всички атоми имат диамагнетизъм, който се дължи на появата на магнитен момент в тях под действието на външно магнитно поле (т.нар. индуциран магнитен момент, подобен на електрическия диполен момент на атома).
С последователната йонизация на атома, т.е. с отделянето на неговите електрони, като се започне от най-външните по реда на увеличаване на силата на връзката им, всички свойства на атома, определени от неговата външна обвивка, се променят съответно. Все повече и повече здраво свързани електрони стават външни; в резултат на това способността на атома да се поляризира в електрическо поле е значително намалена, разстоянията между енергийните нива и честотите на оптичните преходи между тези нива се увеличават (което води до изместване на спектрите към все по-къси дължини на вълните). Редица свойства показват периодичност: свойствата на йони с подобни външни електрони се оказват сходни; например N 3+ (два 2s електрона) показват сходство с N 5+ (два 1s електрона). Това се отнася за характеристиките и относителното разположение на енергийните нива и за оптични спектри, до магнитните моменти на атома и т.н. Повечето рязка промянасвойства възниква, когато последният електрон бъде отстранен от външната обвивка, когато остават само напълно запълнени обвивки, например при преминаване от N 4+ към N 5+ (електронни конфигурации 1s 2 2s и 1s 2). В този случай йонът е най-стабилен и неговият общ механичен и общ магнитни моментиса равни на нула.
Свойствата на атома в свързано състояние (например част от молекула) се различават от свойствата на свободния атом. Свойствата на атома претърпяват най-големи промени, определени от най-външните електрони, които участват в добавянето на даден атом към друг. В същото време свойствата, определени от електроните на вътрешните обвивки, могат да останат практически непроменени, какъвто е случаят с рентгеновите спектри. Някои свойства на атома могат да се проявят относително малки промени, които могат да се използват за получаване на информация за природата на взаимодействията на свързаните атоми. Важен примерможе да служи като разделяне на енергийните нива на атома в кристали и сложни съединения, което се случва под действието на електрически полета, създадени от околните йони.
Експериментални методи за изследване на структурата на атома, неговите енергийни нива, взаимодействията му с други атоми, елементарни частици, молекулите, външните полета и т.н. са разнообразни, но основната информация се съдържа в неговите спектри. Методи атомна спектроскопиявъв всички диапазони на дължини на вълните, и по-специално методите на съвременната лазерна спектроскопия, правят възможно изучаването на все по-фини ефекти, свързани с атома. От началото на 19 век съществуването на атома е очевидно за учените, но експеримент за доказване на реалността на съществуването му е поставен от J. Perrin в началото на 20 век. С развитието на микроскопията стана възможно да се получат изображения на атоми на повърхността твърди вещества. Атомът е видян за първи път от Е. Мюлер (САЩ, 1955 г.) с помощта на изобретения от него полево-йонен микроскоп. Съвременните атомно-силови и тунелни микроскопи правят възможно получаването на изображения на твърди повърхности с добра разделителна способност на атомно ниво (виж Фигура 3).

Ориз. 3. Изображение на атомната структура на повърхността на силиция, получено от проф Оксфордския университет M. Kapstell с помощта на сканиращ тунелен микроскоп.
Така наречените екзотични атоми съществуват и се използват широко в различни изследвания, например мюонни атоми, т.е. атоми, в които всички или част от електроните са заменени с отрицателни мюони, мюоний, позитроний, както и адронни атоми, състоящи се от заредени пиони, каони, протони, дейтрони и др. Направени са и първите наблюдения на антиводороден атом (2002) - атом, състоящ се от позитрон и антипротон.
Лит .: Роден М. Атомна физика. 3-то изд. М., 1970; Фано У., Фано Л. Физика на атомите и молекулите. М., 1980; Shpolsky E.V. Атомна физика. 7-мо изд. М., 1984. Т. 1-2; Еляшевич М. А. Атомна и молекулярна спектроскопия. 2-ро изд. М., 2000.
 Преобразуване на десетична дроб в обикновена дроб и обратно: правило, примери
Преобразуване на десетична дроб в обикновена дроб и обратно: правило, примери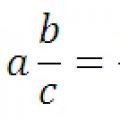 Преобразуване на десетични числа в обикновени дроби
Преобразуване на десетични числа в обикновени дроби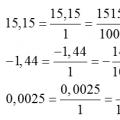 Преобразуване на обикновена дроб в десетична дроб и обратно, правила, примери
Преобразуване на обикновена дроб в десетична дроб и обратно, правила, примери