Кой учен е първият, който е получил чист водород. Кой е открил състава на водата
След работата на Дж. Блек много химици в различни лаборатории в Англия, Швеция, Франция и Германия започват да изучават газовете. Г. Кавендиш постигна голям успех. Цялата експериментална работа на този съвестен учен се основаваше на количествен метод на изследване. Той широко използва претеглянето на веществата и измерването на газовите обеми, ръководейки се от закона за запазване на масата. В първата работа на G. Cavendnsh по химията на газовете (1766) са описани методи за получаване и свойства.
"Горимият въздух" е бил известен преди (Р. Бойл, Н. Лемери). През 1745 г. М. В. Ломоносов например отбелязва, че „когато неблагородният метал се разтваря, особено в кисели алкохоли, от отвора на бутилката излизат горими пари, които не са нищо повече от флогистон“. Това е забележително в две отношения: първо, много години преди Кавендиш, М. В. Ломоносов стигна до извода, че „горимият въздух“ (т.е. водородът) е флогистон; второ, от горния цитат следва, че М. В. Ломоносов е приел учението за флогистона.
Но никой преди Г. Кавендиш не се опита да изолира "горимия въздух" и да изследва свойствата му. В химическия трактат Три произведения, съдържащи експерименти с изкуствени видове въздух (1766), той показа, че има газове, които се различават от въздуха, а именно, от една страна, „горски или свързан въздух“, който, както е установено от Г. Кавендиш се оказа 1,57 пъти по-тежък от обикновения въздух, от друга страна, "горимият въздух" е водород. Г. Кавендиш го получава чрез действието на разредени киселини и киселини върху различни метали. Фактът, че при действие върху (цинк, желязо) се отделя същият газ (водород), окончателно убеди Г. Кавендиш, че всички метали съдържат флогистон, който се отделя при превръщането на металите в "земи". Английският учен взе водород за чист флогистон, тъй като газът гори, без да оставя остатък, а металните оксиди, обработени с този газ, се редуцират до съответните метали при нагряване.
 Хенри Кавендиш
Хенри Кавендиш Г. Кавендиш, като привърженик на теорията за флогистона, смята, че той не е изместен от метала от киселината, а се освобождава в резултат на разлагането на "сложния" метал. Той представи реакцията на получаване на "горим въздух" от метали, както следва:
Какви методи и инструменти е използвал "бащата на химията на газообразните вещества" може да се види от следното. Напускайки Лийдс, Дж. Пристли, по молба на един от своите познати, му остави глинено корито, което той използва като пневматична баня в експериментите си върху състава на въздуха и което, Дж. Пристли иронично отбелязва, „не беше по-различно от коритата, в които перачките перат дрехи“. През 1772 г. Дж. Пристли заменя водата с живак в пневматична баня, което му позволява да получи за първи път в чиста форма и да изследва водоразтворими газове: „въздух на солна киселина“ () и „летлив алкален въздух“ - безцветен газ със задушлива остра миризма. Това беше този, който получи чрез нагряване на амониев хлорид:
2NH 4 Cl + CaO \u003d 2NH 3 + CaCl 2 + H 2
„Златният разсип, открит от Пристли, беше ... живачна баня“, пише У. Оствалд. „Една крачка напред от техническата страна на нещата – смяната на водата – е ключът към повечето от откритията на Пристли.“ Дж. Пристли забеляза, че ако електрическа искра премине през амоняк, тогава неговият обем рязко се увеличава. През 1785 г. К.-Л.Бертоле установява, че това се дължи на разлагането на амоняка на азот и водород. J. Priestley наблюдава, че взаимодействието на два силно миришещи газа (HCl и NH 3) произвежда бял прах без мирис (NH 4 Cl). През 1775 г. J. Priestley получава и c. 1796 г. - който той погрешно приема за чист флогистон.
История на откриването на водорода
Много изследователи са експериментирали с киселини. Наблюдавано е, че когато киселините действат върху някои метали, се отделят газови мехурчета. Полученият газ е силно запалим и е наречен "горим въздух".
Свойствата на този газ са подробно изследвани от английския учен Г. Кавендиш през 1766г. Той постави метали в разтвори на сярна и солна киселина и във всички случаи получи едно и също леко газообразно вещество, което по-късно беше наречено водород.
Английският учен Хенри Кавендиш веднъж се заел с нещо странно на пръв поглед: той започнал да издухва сапунени мехури. Но не беше забавно. Преди това той забеляза, че когато железните стружки се полеят със сярна киселина, се появяват много мехурчета от някакъв вид газ. Какъв е този газ?
Ученият го изведе от съда през тръби. Газът беше невидим. Има ли миризма? Не. После ги напълни със сапунени мехури. Качиха се лесно! Така че газът е по-лек от въздуха! И ако запалите газта, тя ще светне със синкава светлина. Но удивителното е, че при изгарянето се получавала вода! Хенри Кавендиш нарече новия газ горим въздух. В края на краищата той, като обикновения въздух, беше безцветен и без мирис. Всичко това се случва през втората половина на 18 век.
По-късно френският химик Антоан Лоран Лавоазие направи обратното: той получи "горим газ" от водата. Той също даде друго име на новия газ - водород, тоест "раждащ вода". Тогава учените установиха, че водородът е най-лекият от всички познати на хората вещества и неговите атоми са по-прости от всички останали.
Водородът е много разпространен. Той е част от всички живи същества, организми, растения, скали. То е навсякъде: не само на Земята, но и на други планети и звезди, на Слънцето; особено много в открития космос. Трансформациите, които се случват с водорода при гигантско налягане и температури от десетки милиони градуси, позволяват на Слънцето да излъчва топлина и светлина. Водородът образува най-различни съединения с въглерода: нефт и нефтени шисти, бензин и черен асфалт. Такива съединения се наричат въглеводороди. Водородът се използва широко при заваряване и рязане на метали. Ако към въглеродните и водородните съединения се добави кислород, се получават нови съединения - въглехидрати, например, вещества, които не са подобни едно на друго, като нишесте и захар. И ако комбинирате водород с азот, ще получите също газ - амоняк. Необходим е за производството на торове. Много от предимствата на водорода - екологичен, енергоемък, изобилен в природата - направиха възможно използването му като ракетно гориво. Същите характеристики на водорода го правят обещаващ като авиационно гориво.
Водородът е най-лекият, най-простият и най-разпространеният химичен елемент във Вселената. Той съставлява около 75% от общата маса на елементите в него. Водородът се намира в големи количества в звездите и планетите газови гиганти. Той играе ключова роля в реакциите на синтез, протичащи в звездите. Водородът е газ с молекулна формула H2. При стайна температура и нормално налягане водородът е газ без вкус, цвят и мирис. Под налягане и при силен студ водородът преминава в течно състояние. Водородът, съхраняван в това състояние, заема по-малко място, отколкото в неговата "нормална" газообразна форма. Течният водород се използва и като ракетно гориво. При свръхвисоко налягане водородът се втвърдява и става метален водород. Провеждат се изследвания в тази посока. Водородът се използва като алтернативно гориво за транспорта. Химическата енергия на водорода се освобождава, когато се изгаря по начин, подобен на този, използван в традиционните двигатели с вътрешно горене. На негова основа се създават и горивни клетки, в които процесът на образуване на вода и електричество участва в химическата реакция на водорода с кислорода. Той е потенциално опасен за хората, защото може да се запали при контакт с въздуха. Освен това този газ не е подходящ за дишане.
Водородът се използва в аеронавтиката от 1852 г., откакто първият дирижабъл, задвижван с водород, е създаден от Хенри Гифард. Водородните дирижабли по-късно са наречени "цепелини". Използването им е прекратено след катастрофата на дирижабъла Хинденбург през 1937 г. Катастрофата е причинена от пожар.
Водородът също се използва широко в петролната и химическата промишленост и често се използва за различни физически и инженерни задачи: например при заваряване и като охлаждаща течност. Молекулна формула на водороден пероксид H2O2. Това вещество често се използва за избелване на косата и като почистващ агент. Под формата на медицински разтвор се използва и за лечение на рани.
Тъй като водородът е 14 пъти по-лек от въздуха, ако напълните балони с него, те ще се отдалечат от Земята със скорост от 85 км в час, което е два пъти повече от скоростта на балоните, пълни с хелий, и шест пъти повече от скоростта на балоните пълни с природен газ..
химичен газ водороден пероксид
Библиография
- 1. http://www.5.km.ru/
- 2. http://hi-news.ru/science/ximiya-14-faktov-o-vodorode.html.
03.10.2015
Всички знаем, че най-разпространеният елемент в нашата вселена е водородът. Той е основната съставка на звездите. От всички атоми неговият дял е 88,6%. Процесите, протичащи на Земята, просто не са възможни без действието на водорода. Той, за разлика от много други елементи, е под формата на различни съединения. Неговата масова част от просто вещество във въздуха е незначителна.
Име на елемента на латиница Водородсе състои от две гръцки думи, преведено значение водаИ раждам- тоест раждането на водата. Така го нарича Лавоазие, но през XVII век. Академик В.М. Севергин реши да отбележи този елемент като "водообразуващо вещество". Името водород в Русия е предложено през 1824 г. от химика Соловьов, по сходство с "кислород". В химическата литература на Русия до 19 век можете да видите такива имена на елемента - горим газ, горим въздухили джакузи, водороден газ, създадено създание.
Дълго време експериментите за изследване и откриване на много газове бяха игнорирани, тъй като експериментаторите просто не забелязаха тези невидими вещества. Само с течение на времето се утвърди убеждението, че газът е същият материал, без изучаването на който не е възможно да се разбере напълно химическата основа на света. Откриването на водорода се случи в самото развитие на химията като наука. През XI-XII век при взаимодействието на метала с киселини се отделя газ. Парацелз, Ломоносов, Бойл и други учени и изобретатели са наблюдавали изгарянето му. Но основната част от тях през тези години беше ангажирана с теорията на флогистона.
Ломоносов през 1745 г., когато пише дисертацията си, описва производството на газ чрез действието на киселини върху металите. Хипотезата за флогистон е представена и от химика Хенри Кавендиш, който изучава по-подробно свойствата на водорода, давайки му името "горим въздух". Едва в края на 12-ти век, използвайки съвременни лабораторни инструменти, Лавоазие, заедно с Мьоние, извършват синтез на вода. Те направиха анализ на водна пара, която беше разложена с помощта на горещо желязо. Благодарение на този опит стана ясно, че водородът присъства в състава на водата, освен това може да се получи от нея.
Краят на XIII-XIX век бе белязан от едно откритие - беше установено, че водородният атом е доста лек, заедно с други елементи, беше обичайно да се разглежда теглото на този елемент като единица за сравнение. На атомната му маса е определена стойност 1. Когато Лавоазие представя таблицата на простите вещества, той приписва водорода там на 5 прости тела (водород, кислород, азот, светлина, топлина). Общоприето е, че тези вещества са от 3 природни царства и се считат за елементи на телата.
Освен откриването на самия елемент, по-късно учените откриват и неговите изотопи. Това се случи в по-ново време, през 1931 г. Група учени изследвали остатъка, който се е образувал при дългото изпаряване на водорода в течно състояние. По време на експеримента е открит водород, чийто атомен номер е 2. Дадено му е името Деутерий (втори). Само след 4 години, по време на продължителна електролиза на водата, беше открит още по-тежък изотоп, който беше наречен тритий (трети).
е газ, чието значение за съществуването на живот на планетата е започнало преди милиарди години. Според съвременните предположения водородът (H2) се е появил преди около 14 милиарда години. Той няма цвят или мирис и е най-лекият елемент в периодичната таблица на химичните елементи с атомна маса 1,00794. Водородът има шестоъгълна кристална структура и при 0° Целзий плътността му е 0,09099 g/l.
Може да се счита за "аристократичен" газ, тъй като е открит през 1766 г. от британския философ, физик и химик от благороден произход Хенри Кавендиш, а името си получава през 1783 г. благодарение на френския физик, също от благороден произход, Антоан Лавоазие. . Лорд Кавендиш предпочита да нарече откритието си „горим въздух“. Фантастично богатият лорд Каведиш бил толкова срамежлив и затворен, че едно от имотите му дори имало отделно стълбище към входа поради факта, че не можел да общува със слугите, особено с жените, с които бил особено срамежлив и общувал само чрез бележки. Според съвременните предположения Хенри Кавендиш е страдал от синдрома на Аспергер.
Що се отнася до Антоан Лавоазие, неговият край е тъжен: след всички важни научни трудове той е лишен от главата си от френските селяни с помощта на гилотина по време на Френската революция. Няколко седмици след инцидента те признаха грешката си и се извиниха на семейството на Антоан Лавоазие, а по-късно дори издигнаха статуя в негова чест. Но поради липса на средства главата на друг господин е прикрепена към статуята на Лавоазие. Изглежда доста иронично, нали?
Адаптивността е просто невероятна. Водородът може да произвежда електричество, поради което се използва в горивни клетки и, като най-чистия вариант, в двигатели с вътрешно горене.
Водородът възниква в резултат на Големия взрив и оттогава работи в различни сфери на Земята. През последните три и половина милиарда години той е участвал активно в производството на вода, както и в раждането и поддържането на клетъчния живот.
Днес водородът (H2) е обект на интензивно наблюдение в медицинските изследвания. Стотици научни изследвания са доказали терапевтичния потенциал на обогатената с водород вода за повече от 140 различни модела на заболявания.
Ето кратък преглед на някои от терапевтичните възможности на водорода и водородната вода:
- намалява повърхностното напрежение на клетките, което им позволява да усвояват по-добре хранителните вещества.
- Това е най-малкият с висока бионаличност.
- Водородът елиминира само най-разрушителните, превръщайки ги в безопасна вода без никакви токсични отпадъци.
- засилва действието на антиоксиданти като глутатион и супероксиддисмутаза.
- помага за осъществяването на правилната хидратация на клетките.
- Водородната вода намалява млечната киселина и по този начин облекчава мускулните болки по време и след тренировка.
- насърчава производството на АТФ в митохондриите.
- Водородната вода подобрява функцията на митохондриите в мозъка, като по този начин подобрява мозъчната дейност. Освен това поддържа баланса на захарта и холестерола.
- Водородната вода действа противовъзпалително и предпазва от вредното въздействие на радиацията. Следователно използването
Водород в природата
Има ли много водород в природата? Гледайки къде. В космоса водородът е основният елемент. Тя представлява около половината от масата на Слънцето и повечето други звезди. Съдържа се в газовите мъглявини, в междузвездния газ и е част от звездите. Във вътрешността на звездите ядрата на водородните атоми се превръщат в ядра на хелиеви атоми. Този процес протича с освобождаване на енергия; за много звезди, включително Слънцето, той служи като основен източник на енергия.
Например, най-близката до нас звезда в Галактиката, която познаваме под името "Слънце", е 70% от масата си водород. Във Вселената има няколко десетки хиляди пъти повече водородни атоми, отколкото всички атоми на всички метали взети заедно.
Водородът е широко разпространен в природата, съдържанието му в земната кора (литосфера и хидросфера) е 1% от теглото. Водородът е част от най-често срещаното вещество на Земята - вода (11,19% водород от маса), в съединенията, които изграждат въглища, нефт, природни газове, глина, както и животински и растителни организми (т.е. в състава на протеини, нуклеинови киселини, мазнини, въглехидрати и др.). Водородът е изключително рядък в свободно състояние; намира се в малки количества във вулканични и други природни газове. В атмосферата присъстват незначителни количества свободен водород (0,0001% от броя на атомите).
Задача номер 1. Попълнете таблицата "Намиране на водород в природата."
| В свободно състояние | В обвързано състояние |
| хидросфера - | |
| литосфера - | |
| биосфера - |
Откриване на водорода.
Водородът е открит през първата половина на 16 век от немския лекар и естествоизпитател Парацелз. В трудовете на химиците от XVI-XVIII век. се споменава „горим газ“ или „запалим въздух“, които в комбинация с обичайния дават експлозивни смеси. Получава се чрез въздействие върху някои метали (желязо, цинк, калай) с разредени разтвори на киселини - сярна и солна.
Първият учен, който описва свойствата на този газ, е английският учен Хенри Кавендиш. Той определя неговата плътност и изучава изгарянето във въздуха, но придържането към теорията на флогистона попречи на изследователя да разбере същността на протичащите процеси.
През 1779 г. Антоан Лавоазие получава водород чрез разлагане на водата чрез пропускане на парите й през нажежена желязна тръба. Лавоазие също доказа, че когато "горимият въздух" взаимодейства с кислорода, се образува вода и газовете реагират в обемно съотношение 2: 1. Това позволи на учения да определи състава на водата - H 2 O. Името на елемента е Водород- Лавоазие и колегите му образуват от гръцките думи " хидро" - вода и " gennio„Раждам. Руското име "водород" е предложено от химика М. Ф. Соловьов през 1824 г. - по аналогия с "кислород" на Ломоносов.
Задача номер 2. Напишете реакцията за получаване на водород от цинк и солна киселина в молекулна и йонна форма, направете OVR.
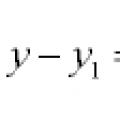 Уравнения на прави и криви в равнината
Уравнения на прави и криви в равнината Обобщено хомогенно уравнение Обобщени хомогенни уравнения от втори ред
Обобщено хомогенно уравнение Обобщени хомогенни уравнения от втори ред Благодарение на запетаята Поради факта, че в техните
Благодарение на запетаята Поради факта, че в техните