Karboksilne kiseline. Zasićene monokarboksilne kiseline
a) CH3-CH2-CH2-CH2-CH3
b) CH3-CH2-C(CH3)H-CH2-CH2-CH3
c) CH2=CH-CH2-CH2-CH2-CH3
d) CH3-CH2-CH=C(CH2-CH3)H-CH-CH2-CH3
e) CH≡C-CH2-CH2-C(CH3)H-CH3
e) CH3-C(CH3)2-CH3
Zadatak 2. Sastavite formule za tvari:
a) propan b) eten c) ciklopentan
d) benzen e) 2-metiloktan f) 3-etilheksen-1
opcija 2
Vježba 1. Imenuj tvari:
a) CH3-CH2-CH2-CH2-CH2-CH3
b) CH3-CH2-C(CH2-CH3)H-CH2-CH2-CH3
c) CH3-CH=CH-CH2-CH3
d) CH3-C≡C-C(CH3)H-CH2-CH3
e) CH3-CH2-C(CH3)2H-CH2-CH-CH2-CH3
Zadatak 2. Sastavite formule za tvari:
a) pentan b) propen c) cikloheksan
d) 4-metilpenten-2 e) 3-etilnonan f) metilbenzen
Ispitni rad "Izomerija ugljikovodika"
· Što je izomerija? Koje su tvari izomeri?
· Brojevi koji su korijeni u tvorbi imena molekula ugljikovodika.
· Sufiksi koji pokazuju prisutnost jednostavnih, dvostrukih, trostrukih veza između ugljikovih atoma i njihov položaj u molekuli ugljikovodika.
· Što je radikal i kako se prikazuje u nazivu tvari?
opcija 1
Vježba 1
a) CH3-CH2-CH=CH2
b) CH3-CH2-CH2-CH3
c) CH3-CH2-C(CH3)=CH2
d) CH3-C(CH3)=CH2
e) CH2=C(CH3)-CH3
Zadatak 2. Napiši formule za sve moguće izomere pentana. Imenujte ih.
opcija 2
Vježba 1. Koje su od prikazanih tvari izomeri? Zapiši njihove formule i imenuj ih. Postoje li drugi izomeri ovog sastava?
a) CH3-CH2-CH2-CH2-CH3
b) CH3-CH=CH-CH2-CH3
c) CH3-C(CH3)=CH-CH3
d) CH3-CH=C(CH3)-CH3
e) CH3-C(CH3)H-CH=CH2
e) CH3-C≡C-CH2-CH3
Zadatak 2. Napiši formule za sve moguće izomere butena. Imenujte ih.
Ispitni rad “Homologija ugljikovodika”.
Kada se pripremate za rad, morate ponoviti:
- Što je homologija? Koje se tvari nazivaju homolozima? Što je homološka razlika? Opće formule homolognih nizova ugljikovodika. Što je izomerija? Koje su tvari izomeri?
- Brojevi koji su korijeni u tvorbi imena molekula ugljikovodika. Sufiksi koji pokazuju prisutnost jednostavnih, dvostrukih, trostrukih veza između ugljikovih atoma i njihov položaj u molekuli ugljikovodika. Što je radikal i kako se prikazuje u nazivu tvari?
opcija 1
Vježba 1. Koje su od prikazanih tvari homolozi? Zapiši njihove formule i imenuj ih.
a) CH3-CH2-CH=CH2
b) CH3-CH2-CH2-CH3
c) CH3-CH2-C(CH3)=CH2
d) CH3-C(CH3)=CH2
e) CH2=C(CH3)–CH2-CH2-CH3
Zadatak 2. Napiši formule za četiri homologa pentana. Imenujte ih.
opcija 2
Vježba 1. Koje su od prikazanih tvari izomeri? Zapiši njihove formule i imenuj ih. Postoje li drugi izomeri ovog sastava?
a) CH3-CH2-CH2-CH2-CH3
b) CH3-CH=CH-CH2-CH3
c) CH3-C(CH3)=CH-CH3
d) CH3-CH=C(CH3)-CH3
e) CH3-CH=CH-CH3
e) CH3-CH=CH-CH2-CH2-CH3
Zadatak 2. Napiši formule za četiri homologa pentena. Imenujte ih.
KEMIJSKE REAKCIJE U ORGANSKIM TIJELIMA. 10. razred
Radite u dobrom raspoloženju
b) CH3 – CH2 – CH2 - CH3 + H2 "
c) CH3-CH2-CH2-CH = CH2 + HCl "
d) CH3-CH2-CH2-CH2-CH3 + HCl "
e) CH3 - C º C – CH2 – CH2 - CH3 + Cl2 "
e) CH2 = CH - CH3 + H2O "
g) CH2 = C = CH - CH3 + H2 "
h) CH3-CH2-CH3 + Cl2 "
i) CH3-CH2-CH2-CH2-CH2-OH "H2O +…
j) CH3 - CH2 – CH3 "H2 +…
l) CH3 – CH2 – CH2 – CH2 – CH3 "
Vrste kemijskih reakcija.
https://pandia.ru/text/78/654/images/image022_57.gif" width="87" height="10 src=">2. CH3 – CH2 – CH2 – OH H2SO4, °t CH3 – CH2 = CH2 + H2O
3. CH º C - CH2 – CH3 +2 H2 ® CH3 – CH2 – CH2 –CH3
 |
4. + Cl2® + HCl.
5. CH2 = CH2 + Cl2 ® CH2Cl – CH2Cl.
Koja je ovo vrsta reakcije:
1. CH2 = CH – CH3 + HCl ® CH3 – CHCl - CH3
https://pandia.ru/text/78/654/images/image026_61.gif" width="75" height="10 src=">5. CH3 – CH2 – CH2 – CH2 –CH3 Al Cl3, 450 °C CH3 – CH2 – CH –CH3
Koja je ovo vrsta reakcije:
https://pandia.ru/text/78/654/images/image028_58.gif" width="51" height="50">1.
2.CH3 – CH2 – CH2 – CH2 –CH2 –CH3 Al Cl3, 450 °C CH3 –CH2 –CH2 –CH –CH3
https://pandia.ru/text/78/654/images/image030_54.gif" width="106" height="51 src="> N C H2- OH CH3 H
6 . HO-CH2CH2CH CH2CH2 - OH
 7
. CH3CH2CH2 CH2CH2 CH2CH2OH
7
. CH3CH2CH2 CH2CH2 CH2CH2OH
Test na temu "Alkoholi"
Riješite lanac pretvorbi, imenujte X i Y. propanol-1 → X → Y → 2,3-dimetilbutan Navedite alken koji zadovoljava uvjete zadatka. Napiši jednadžbu reakcije. alken + H2O → 3-metilbutanol-2 Napiši strukturne formule alkohola: butil, izobutil, sec-butil, tert-butil. Koliko izomernih tercijarnih alkohola može imati sastav C6H13OH? Napravite jednadžbe reakcija u skladu s lancem transformacija, navedite uvjete reakcija, navedite sve tvari u lancu:CaC2 → C2H2 → CH3CH= O
Al4C3→ CH4→ CH3Cl→ C2H6→ C2H4 →C2H5OH → C2H5ONa
↓
C2H5Br → Vidi zadatak br. 5 propanol-1 → 1-brompropan → n-heksan → benzen → izopropilbenzen. Monohidrični alkohol sadrži 52,2% ugljika i 13% vodika po težini. Odredite molekulsku formulu alkohola i dokažite da je on primarni. 12 g zasićenog monohidričnog alkohola zagrijano je s koncentriranom sumpornom kiselinom i dobiveno je 6,3 g alkena. Prinos alkena bio je 75% od teoretski mogućeg. Odredite formulu polaznog alkohola. Kolika se masa 1,3 butadiena može dobiti iz 230 litara etanola (gustoće 80 kg/m3), ako je maseni udio etanola u otopini 95 %, a iskorištenje produkta 60 % od teorijski mogućeg. Izgaranjem 76 g višehidroksilnog alkohola dobiveno je 67,2 litre ugljičnog monoksida (IV) i 72 g vode. Odredite molekulsku formulu alkohola.
Opcija 1 Napiši jednadžbe reakcije: 1. CH3 – CH 2 - COOH + CH3 CH 2 - OH ↔ 2. CH3 - CH - COOH + CH3 CH 2 CH 2 CH 2 - OH ↔ |
Opcija br. 2 Napiši jednadžbe reakcije: 1. CH3 - COOH + CH3 CH 2 CH 2 - OH ↔ 2. CH3 - CH - CH2 - COOH + C 3H7 - OH ↔ Koja se od ovih reakcija odvija najbrže? Zašto? |
Opcija br. 3 Napiši jednadžbe reakcije: 1. CH3 – CH 2 – CH 2 - COOH + CH3 CH 2 CH 2 - OH ↔ 2. CH3 - CH 2 – CH 2 - COOH + CH3 - CH – CH 2 - CH3 ↔ Koja se od ovih reakcija odvija najbrže? Zašto? |
Opcija br. 4 Napiši jednadžbe reakcije: 1. CH3 - COOH + CH3 CH 2 CH 2 CH 2 CH 2 - OH ↔ 2. CH3- CH 2 - CH 2 - CH – COOH + CH3 - OH ↔ Koja se od ovih reakcija odvija najbrže? Zašto? |
Izvedite molekulsku formulu tvari ako je C 40%, H 6,7%, O 53,3%. Relativna molekulska masa tvari je 180. Izvedite molekulsku formulu ugljikovodika, maseni udio vodika je 17,25%, ugljika je 82,75%. Relativna gustoća ove tvari u zraku je 22. Izvedite molekulsku formulu ugljikovodika, maseni udio vodika je 14,3%, ugljika je 85,7%. Relativna gustoća ove tvari u odnosu na vodik je 28. Izvedite molekulsku formulu tvari ako je C 52,17%, H 13,05%, O 34,78%. Relativna molekularna težina tvari je –23. Izvedite molekulsku formulu ugljikovodika, maseni udio ugljika je 80%. Relativna gustoća ove tvari u odnosu na vodik je 15. Izvedite molekulsku formulu ugljikovodika maseni udio vodika je 20 %; Relativna gustoća ove tvari u zraku je 1,035. Izvedite molekulsku formulu ugljikovodika, maseni udio vodika je 7,69%, ugljika 92,31%. Relativna gustoća ove tvari u odnosu na vodik je 39. Izvedite molekulsku formulu ugljikovodika u kojem je maseni udio vodika 14,3 %. Relativna gustoća ove tvari u odnosu na vodik je 21.
Zadatak 2.
Feromon za uzbunu mrava stolara sadrži ugljikovodik. Kakva je struktura ugljikovodika ako njegovim krekiranjem nastaju pentan i penten, a izgaranjem 10 mola ugljičnog dioksida.
Rješavanje problema
1. Pri kloriranju 4 g alkana u prvom stupnju oslobodilo se 5,6 litara klorovodika. Koji je alkan uzet za kloriranje?
2. Za izgaranje 1 litre alkana bilo je potrebno 6,5 litara kisika. Koji je ovo alkan?
3. Dehidrogenacijom 11 g alkana nastaje alken i 0,5 g vodika. Izvedite formulu alkana.
Arenski zadaci.
1. Acetilen je prošao preko aktivnog ugljena na temperaturi od 6000 C. Dobivena tekućina je reagirala s bromom u prisutnosti FeBr3 katalizatora. Organski produkt je tada reagirao s bromometanom i metalnim natrijem. Dobiveni spoj je oksidiran otopinom kalijevog permanganata. Napiši jednadžbe za sve reakcije. Definirajte konačni proizvod. U odgovoru navedite molarnu masu konačnog proizvoda.
2. Reakcijom popilena volumena 11,2 litre (n.o.) s klorovodikom i daljnjom reakcijom dobivenog produkta s benzenom u prisutnosti AlCl3 katalizatora, dobiven je organski spoj mase 45 g. Izračunajte njegov prinos kao postotak jedan teorijski.
Zadaci
№1. Pri spaljivanju organske tvari mase 12 g dobiva se CO2 mase 26,4 g i H2O mase 14,4 g. Relativna gustoća tvari u zraku je 2,07. Odredite formulu.
№2. Koliki će se volumen acetilena dobiti iz 200 g kalcijevog karbida ako sadrži 5% nečistoća?
ZADACI 10. RAZRED
1. Izračunajte iskorištenje Wurtzove reakcije ako iz 21 g bromometana nastane 2 litre etana.
2. Kad je 20 litara butadiena hidrogenirano, nastalo je 14 litara butana. Izračunajte iskorištenje reakcije hidrogenacije. Koliki je volumen vodika reagirao?
3.Kolika je količina zraka potrebna za sagorijevanje 1 kg benzina? Sastav benzina odgovara formuli C8H18.
4.Koji će volumen kisika biti potreban za spaljivanje 100 litara prirodnog plina koji sadrži 90% metana i 10% etana po volumenu?
Zadaci 10. razred
Odredite masene udjele svakog elementa u molekuli :
Etil alkohol
Octena kiselina
Acetaldehid
Odredite molekulsku formulu organskog spoja ako sadrži 40 % ugljika, 6,7 % vodika i 53,3 % kisika po masi, a molarna mu je masa 60 g/mol.
ZADACI 10. RAZRED
Kada je 100 g tehničkog kalcijevog karbida reagiralo s vodom, oslobođeno je 31,4 litre acetilena. Izračunajte maseni udio nečistoća u kalcijevom karbidu. Za Wurtzovu reakciju korištena je mješavina plinova volumena 200 ml koja se sastoji od etana i kloroetana u omjeru 1:3. Koji će se ugljikovodik i u kojoj količini (težinski) dobiti? Kolika se masa bromovodika može dodati u 15 g smjese butana i butena-1 u omjeru 1:2?
Zadatak 1.
Zadatak 2. Gustoća vodika tvari sastava ugljik - 54,55%, vodik - 9,09% i kisik - 36,36% je 22. Izvedite molekulsku formulu tvari.
Zadatak 3. Smjesa benzena i cikloheksana mase 4,39 g obezboji bromnu vodu mase 125 g s masenim udjelom broma 3,2%. Odredite postotak benzena u smjesi.
Problemi produkata izgaranja organskih tvari
Problem 1c. Izgaranjem organske tvari mase 4,8 g nastalo je 3,36 litara CO2 (n.o.) i 5,4 g vode. Gustoća pare organske tvari za vodik je 16. Odredite molekulsku formulu ispitivane tvari.
Problem 2c. Izgaranjem organske tvari mase 6,9 g nastalo je 13,2 CO2 (n.o.) i 8,1 g vode. Gustoća pare organske tvari u zraku je 1,59. Odredite molekulsku formulu ispitivane tvari.
Problem 3c. Izgaranjem organske tvari mase 4,8 g nastalo je 6,6 g CO2 (n.o.) i 5,4 g vode. Gustoća pare organske tvari za vodik je 16. Odredite molekulsku formulu ispitivane tvari.
Problem 4c. Pri spaljivanju organske tvari mase 2,3 g nastalo je 4,4 g CO2 (n.s.) i 2,7 g vode. Gustoća pare organske tvari u zraku je 1,59. Odredite molekulsku formulu ispitivane tvari.
Problem 5c. Izgaranjem organske tvari mase 1,3 g nastalo je 4,4 g CO2 (n.o.) i 0,9 g vode. Gustoća pare organske tvari za vodik je 39. Odredite molekulsku formulu ispitivane tvari.
Problem 6c. Izgaranjem organske tvari mase 4,2 g nastalo je 13,2 CO2 (n.o.) i 5,4 g vode. Gustoća pare organske tvari u zraku je 2,9. Odredite molekulsku formulu ispitivane tvari.
Zadaci sastavljanja pravih formula tvari.
1. Nađite najjednostavniju formulu ugljikovodika ako je poznato da ugljikovodik sadrži 80% ugljika i 20% vodika.
2. . Nađite pravu formulu ugljikovodika ako se zna da ugljikovodik sadrži 82,76% ugljika, a 1 litra njegove pare ima masu 2,59 g.
3.Organska tvar sadrži 84,5% ugljika i 15,49% vodika. Odredite formulu te tvari ako joj je gustoća pare u zraku 4,9.
4. Maseni udio ugljika u ugljikovodiku je 83,3%. Relativna gustoća pare ove tvari u odnosu na vodik je 36.
5. Ugljikovodik, čiji je maseni udio ugljika 85,7%, ima gustoću pare za vodik 28. Odredite pravu formulu tvari.
6. Ugljikovodik čiji je maseni udio vodika 14,3 % ima gustoću vodika 21. Odredite pravu formulu tvari.
7. Maseni udio vodika u ugljikovodiku je 11,1%. Relativna gustoća pare ove tvari u zraku je 1,863. Pronađite pravu formulu tvari.
8. Organska tvar sadrži 52,17% ugljika i 13,04% vodika. Gustoća pare za vodik je 23. Pronađite pravu formulu tvari.
Zadaci (izvesti formule tvari)
1. Za snažne učenike (razina A)
1. Odredite formulu plinovitog ugljikovodika ako se pri njegovom potpunom izgaranju od 0,7 g dobije 1,12 l ugljičnog monoksida (IV) i 0,9 g vode. Gustoća pare za vodik je 42.
2. Pri izgaranju 28 ml plina dobije se 84 ml ugljičnog monoksida (IV) i 67,5 ml vode. Koja je molekulska formula plina ako se zna da je njegova relativna gustoća za vodik 21?
3. Izgaranjem organske tvari supstituirane klorom, koja sadrži atome ugljika, vodika i halogena, dobiveno je 0,22 g ugljičnog monoksida (IV) i 0,09 g vode. Za određivanje klora iz istog uzorka dobiven je srebrov klorid čija je masa iznosila 1,435 g. Odredite formulu tvari.
4. Izgaranjem 3,3 g organske tvari koja sadrži klor dobiva se 1,49 l ugljičnog monoksida (IV) i 1,2 g vode. Nakon pretvaranja cjelokupnog klora sadržanog u određenoj količini tvari u srebrov klorid, dobiva se 9,56 g srebrovog klorida. Gustoća pare tvari za vodik je 49,5. Odredite pravu formulu tvari koja se proučava.
5. Pri izgaranju 5,76 g tvari nastalo je 2,12 g sode; 5,824 l ugljičnog monoksida (IV) i 1,8 g vode. Odredite molekulsku formulu tvari.
2. Za srednje učenike (razina B)
1. Spoj koji se sastoji od ugljika i vodika spaljen je i dobiveno je 55 g ugljičnog dioksida i 27 g vode. Koja je formula spoja ako mu je gustoća pare u zraku 2,48?
2. Pri spaljivanju organske tvari mase 6,2 g nastaje ugljikov monoksid (IV) mase 8,8 g i voda mase 5,4 g. Relativna gustoća pare te tvari prema vodiku je 31. Koja je molekulska formula te tvari. ?
3. Spalili smo organsku tvar koja je sadržavala kisik mase 4,81 O2. Kvantitativnom analizom utvrđeno je da su ugljični monoksid (IV) mase 6,613 g i vode mase 5,411 g u zraku iznosili 1,103. Odredite molekulsku formulu tvari.
4. Pri izgaranju 4,6 g tvari nastaje 8,8 g ugljičnog monoksida (IV) i 5,4 g vode. Gustoća pare ove tvari u zraku je 1,59. Odredite molekulsku formulu ove tvari.
Izgaranjem 4,4 g ugljikovodika dobiveno je 13,2 g ugljikovog monoksida (IV). Relativna gustoća tvari u zraku je 1,52. Odredite molekulsku formulu ove tvari.
3. Za slabe učenike (razina C)
1. Maseni udjeli ugljika, vodika i fluora u tvari su redom: 0,6316; 0,1184; 0,2500. Relativna gustoća tvari u zraku je 2,62. Odredite molekulsku formulu tvari.
2. Gustoća vodika tvari sastava ugljik - 54,55%, vodik - 9,09% i kisik - 36,36% je 22. Izvedite molekulsku formulu tvari.
3. Odredite molekulsku formulu zasićenog ugljikovodika ako je njegova parna gustoća za vodik 22, a maseni udio ugljika 0,82.
4. Odredite molekulsku formulu ugljikovodika iz niza etilena, ako je poznato da je maseni udio ugljika u njemu 85,7%, a gustoća pare za vodik 28.
5. Godine 1825. Michael Faraday otkrio je ugljikovodik sastava u plinu za osvjetljavanje: C - 92,3%; N - 7,7 %. Gustoća njegove pare u zraku je 2,69. Koja je molekulska formula tvari?
Zadaci. Ugljikohidrati.
Svaki - 10 bodova.
1. Koliko je šećerne tvari s masenim udjelom saharoze 0,2 /20%/ hidrolizirano ako je dobiveno 1 kg glukoze?
2. W škroba u krumpiru je 20%. Kolika je masa glukoze koja se može dobiti preradom 1600 kg krumpira, uzimajući u obzir da je prinos glukoze u postocima od teorijski mogućeg 75% Mr.
/element škrobne veze /=162/.
3. Tijekom alkoholnog vrenja iz 2 mola glukoze nastao je ugljikov monoksid /1U/, koji je zatim prešao u 602 ml otopine lužine s masenim udjelom kalijevog hidroksida 1,33 g/ml. Izračunajte masu soli koja je nastala u otopini. Koja tvar je ostala u višku? Izračunajte njegovu količinu.
4. Pri vrenju 200 g tehničke glukoze dobiven je maseni udio nešećernih tvari u kojem je bilo 10%, 96% alkohola. Gustoća otopine alkohola je 0,8 g/ml. Izračunajte masu i volumen nastale otopine alkohola.
5. Izračunajte masu otopine 63% dušične kiseline potrebnu za dobivanje 50 g trinitroceluloze.
6. Izračunajte volumen CO2 koji nastaje izgaranjem 1620 kg škroba, Mr / element. Škrobne jedinice/=162
7. Tijekom dnevnog svjetla list repe površine 1 dm2 može apsorbirati ugljikov monoksid /1U/ volumena 44,8 ml/n. u./. Kolika masa glukoze nastaje kao rezultat fotosinteze?
8. Maseni udio celuloze u drvu = 50%. Kolika se masa alkohola može dobiti vrenjem glukoze, koja nastaje hidrolizom piljevine mase 810 kg? Napominjemo da se alkohol oslobađa iz reakcijskog sustava u obliku otopine s masenim udjelom vode od 8%. Prinos etanola zbog gubitaka u proizvodnji je 70%.
9. Glukoza se u medicini često koristi u obliku otopina različitih koncentracija, koje služe kao izvor tekućine i hranjivog materijala, a također pomažu u neutralizaciji i uklanjanju otrova iz tijela. Izračunajte u kojoj masi otopine glukoze s masenim udjelom 5% treba otopiti 120 g da se dobije otopina s masenim udjelom glukoze 8%.
3. Koliko ima izomernih tetrametilbenzena?
Jedan tri četiri šest
4. Koliko najbližih homologa ima toluen?
Jedan četiri pet osam
5 . Napiši opću formulu aromatskih ugljikovodika koji sadrže dva benzenska prstena koji nemaju zajedničke vrhove:
(S P H2 P-6)2 C P H2 P-14 C P H2 P-2 C P H2 P(C6H5)2
6. Aromatični ugljikovodici gore zadimljenim plamenom jer...
1. sadrže mali maseni udio vodika
3. otrovni su
4. ne sadrže atome kisika.
7. Pronađite pogrešku u svojstvima benzena:
Bezbojna hlapljiva tekućina, otrovna, ugodnog mirisa, otapa masti.
Klasifikacija
a) Prema bazičnosti (tj. broju karboksilnih skupina u molekuli):
Jednobazni (monougljik) RCOOH; Na primjer:
CH3CH2CH2COOH;
NOOS-CH 2 -COOH propandioinska (malonska) kiselina

Trobazični (trikarboksilni) R(COOH) 3 itd.
b) Prema strukturi ugljikovodičnog radikala:
Alifatski
ograničiti; na primjer: CH3CH2COOH;
nezasićen; na primjer: CH 2 = CHCOOH propenska (akrilna) kiselina

Aliciklički, na primjer:

Aromatski, na primjer:

Zasićene monokarboksilne kiseline
(monobasic saturated carboxylic acids) - karboksilne kiseline u kojima je zasićeni ugljikovodični radikal vezan na jednu karboksilnu skupinu -COOH. Svi oni imaju opću formulu C n H 2n+1 COOH (n ≥ 0); ili CnH 2n O 2 (n≥1)
Nomenklatura
Sustavni nazivi jednobazičnih zasićenih karboksilnih kiselina dani su imenom odgovarajućeg alkana uz dodatak sufiksa - ova i riječi kiselina.
1. HCOOH metanska (mravlja) kiselina
2. CH 3 COOH etanska (octena) kiselina
3. CH 3 CH 2 COOH propanska (propionska) kiselina
Izomerija
Skeletna izomerija u radikalu ugljikovodika se očituje, počevši od butanske kiseline, koja ima dva izomera:

Međuklasna izomerija pojavljuje se počevši od octene kiseline:
CH3-COOH octena kiselina;
H-COO-CH3 metil format (metilni ester mravlje kiseline);
HO-CH2-COH hidroksietanal (hidroksiocteni aldehid);
HO-CHO-CH2 hidroksietilen oksid.
Homologne serije
Trivijalno ime |
IUPAC naziv |
|
Mravlja kiselina |
Metanska kiselina |
|
Octena kiselina |
Etanska kiselina |
|
Propionska kiselina |
Propanska kiselina |
|
Maslačna kiselina |
Butanska kiselina |
|
Valerijska kiselina |
Pentanska kiselina |
|
Kaproinska kiselina |
Heksanska kiselina |
|
Enantska kiselina |
Heptanska kiselina |
|
kaprilna kiselina |
Oktanska kiselina |
|
Pelargonska kiselina |
Nonanska kiselina |
|
Kaprinska kiselina |
dekanska kiselina |
|
Undeciklička kiselina |
Undekanska kiselina |
|
Palmitinska kiselina |
Heksadekanska kiselina |
|
Stearinska kiselina |
oktadekanska kiselina |
Kiselinski ostaci i kiselinski radikali
Kiselinski ostatak |
Kiselinski radikal (acil) |
|
UNDC |
NSOO- |
|
CH3COOH |
CH 3 COO- |
|
CH3CH2COOH |
CH 3 CH 2 COO- |
|
CH3(CH2)2COOH |
CH 3 (CH 2) 2 COO- |
|
CH3 (CH2)3COOH |
CH 3 (CH 2) 3 COO- |
|
CH3 (CH2)4COOH |
CH 3 (CH 2) 4 COO- |
Elektronska struktura molekula karboksilne kiseline

Pomak gustoće elektrona prema karbonilnom atomu kisika prikazanom u formuli uzrokuje snažnu polarizaciju O-H veze, uslijed čega je olakšano odvajanje vodikovog atoma u obliku protona - u vodenim otopinama proces kiseline dolazi do disocijacije:
RCOOH ↔ RCOO - + H +
U karboksilatnom ionu (RCOO -) postoji p, π-konjugacija slobodnog para elektrona atoma kisika hidroksilne skupine s p-oblacima koji tvore π-vezu, što rezultira delokalizacijom π-veze i jednolikom raspodjela negativnog naboja između dva atoma kisika:

U tom smislu, karboksilne kiseline, za razliku od aldehida, nisu karakterizirane reakcijama dodavanja.
Fizička svojstva

Vrelišta kiselina znatno su viša od vrelišta alkohola i aldehida s istim brojem ugljikovih atoma, što se objašnjava stvaranjem cikličkih i linearnih asocijata između molekula kiselina zahvaljujući vodikovim vezama:
Kemijska svojstva
I. Svojstva kiselina
Jakost kiselina opada sljedećim redoslijedom:
HCOOH → CH 3 COOH → C 2 H 6 COOH → ...
1. Reakcije neutralizacije
CH 3 COOH + KOH → CH 3 COOC + n 2 O
2. Reakcije s bazičnim oksidima
2HCOOH + CaO → (HCOO) 2 Ca + H 2 O
3. Reakcije s metalima
2CH 3 CH 2 COOH + 2Na → 2CH 3 CH 2 COONa + H 2
4. Reakcije sa solima slabijih kiselina (uključujući karbonate i bikarbonate)
2CH 3 COOH + Na 2 CO 3 → 2CH 3 COONa + CO 2 + H 2 O
2HCOOH + Mg(HCO 3) 2 → (HCOO) 2 Mg + 2SO 2 + 2H 2 O
(HCOOH + HCO 3 - → HCOO - + CO2 + H2O)
5. Reakcije s amonijakom
CH 3 COOH + NH 3 → CH 3 COONH 4
II. Supstitucija -OH skupine
1. Interakcija s alkoholima (reakcije esterifikacije)

2. Interakcija s NH 3 pri zagrijavanju (nastaju kiselinski amidi)

Amidi kiselina  hidroliziraju u kiseline:
hidroliziraju u kiseline:

ili njihove soli:

3. Stvaranje kiselih halogenida
Najveću važnost imaju kiselinski kloridi. Reagensi za kloriranje - PCl 3, PCl 5, tionil klorid SOCl 2.

4. Stvaranje kiselinskih anhidrida (intermolekulska dehidracija)

Anhidridi kiselina također nastaju reakcijom kiselinskih klorida s bezvodnim solima karboksilnih kiselina; u ovom slučaju moguće je dobiti miješane anhidride različitih kiselina; Na primjer:

III. Reakcije supstitucije vodikovih atoma na α-ugljikovom atomu

Značajke strukture i svojstava mravlje kiseline
Struktura molekule

Molekula mravlje kiseline, za razliku od drugih karboksilnih kiselina, u svojoj strukturi sadrži aldehidnu skupinu.
Kemijska svojstva
Mravlja kiselina prolazi kroz reakcije karakteristične i za kiseline i za aldehide. Pokazujući svojstva aldehida, lako se oksidira u ugljičnu kiselinu:
Konkretno, HCOOH se oksidira otopinom amonijaka Ag 2 O i bakrovim (II) hidroksidom Cu(OH) 2, tj. daje kvalitativne reakcije na aldehidnu skupinu:

Zagrijavanjem s koncentriranom H 2 SO 4 mravlja kiselina se raspada na ugljikov monoksid (II) i vodu:

Mravlja kiselina je primjetno jača od drugih alifatskih kiselina jer je karboksilna skupina u njoj vezana za atom vodika, a ne za alkilni radikal koji donira elektron.
Metode dobivanja zasićenih monokarboksilnih kiselina
1. Oksidacija alkohola i aldehida
Opća shema oksidacije alkohola i aldehida:
Kao oksidansi se koriste KMnO 4, K 2 Cr 2 O 7, HNO 3 i drugi reagensi.
Na primjer:
5C 2 H 5 OH + 4KMnO 4 + 6H 2 S0 4 → 5CH 3 COOH + 2K 2 SO 4 + 4MnSO 4 + 11H 2 O
2. Hidroliza estera

3. Oksidativno cijepanje dvostrukih i trostrukih veza u alkenima i alkinima

Metode dobivanja HCOOH (specifične)
1. Reakcija ugljikovog monoksida (II) s natrijevim hidroksidom
CO + NaOH → HCOONa natrijev format
2HCOONa + H 2 SO 4 → 2HCOON + Na 2 SO 4
2. Dekarboksilacija oksalne kiseline

Metode za proizvodnju CH 3 COOH (specifične)
1. Katalitička oksidacija butana

2. Sinteza iz acetilena

3. Katalitička karbonilacija metanola

4. Octeno-kisela fermentacija etanola
Tako se dobiva jestiva octena kiselina.
Dobivanje viših karboksilnih kiselina
Hidroliza prirodnih masti

Nezasićene monokarboksilne kiseline
Najvažniji predstavnici
Opća formula alkenskih kiselina: C n H 2n-1 COOH (n ≥ 2)
CH 2 =CH-COOH propenska (akrilna) kiselina

Više nezasićene kiseline
Radikali ovih kiselina ulaze u sastav biljnih ulja.
C 17 H 33 COOH - oleinska kiselina, odn cis-oktadien-9-oična kiselina

Trans-Izomer oleinske kiseline naziva se elaidinska kiselina.
C 17 H 31 COOH - linolna kiselina, odn cis, cis-oktadien-9,12-oična kiselina

C 17 H 29 COOH - linolenska kiselina, odn cis, cis, cis-oktadekatrien-9,12,15-oična kiselina
Uz opća svojstva karboksilnih kiselina, nezasićene kiseline karakteriziraju reakcije adicije na višestrukim vezama u radikalu ugljikovodika. Dakle, nezasićene kiseline, poput alkena, hidrogeniraju se i obezbojavaju bromnu vodu, na primjer:

Odabrani predstavnici dikarboksilnih kiselina
Zasićene dikarboksilne kiseline HOOC-R-COOH
HOOC-CH 2 -COOH propandioinska (malonska) kiselina, (soli i esteri - malonati)
HOOC-(CH 2) 2 -COOH butadioična (jantarna) kiselina, (soli i esteri - sukcinati)
HOOC-(CH 2) 3 -COOH pentadioična (glutarna) kiselina, (soli i esteri - glutorati)
HOOC-(CH 2) 4 -COOH heksadioična (adipinska) kiselina, (soli i esteri - adipati)
Značajke kemijskih svojstava
Dikarboksilne kiseline su u mnogočemu slične monokarboksilnim kiselinama, ali su jače. Na primjer, oksalna kiselina je gotovo 200 puta jača od octene kiseline.
Dikarboksilne kiseline se ponašaju kao dibazične kiseline i tvore dva niza soli - kisele i neutralne:
HOOC-COOH + NaOH → HOOC-COONa + H 2 O
HOOC-COOH + 2NaOH → NaOOC-COONa + 2H 2 O
Zagrijavanjem oksalna i malonska kiselina lako se dekarboksiliraju:

1) Imenujte spojeve prema IUPAC-ovoj supstitucijskoj nomenklaturi (a-p):
(CH3)2CH-C(CH3)2-CH(CH3)-C2H5; CH3-CH=C(CH3)2;
CH3-CH(OH)-CH(OH)-CH3; (CH3)2CH-CH=O;
CH3-CH2-O-C3H7; C6H5-CH2-CH2-COOH;
(CH3)2CH-CH=C(CH3)2; CH3-C-CH(CH3)2;
(CH3)2CH-CO-CH=CH2; CH3CH-C(OH)(CH3)-CH2-CH2Cl;
CH3-CH(OH)-CH2-COOH; OHC-CH=CH-O-CH2-CH3;
(CH3)2C=CH-C(CH3)-C2H5; NOOC-CH2-CH(NH2)-COOH;
CH3-CHCI-CH2-CH=O; CH≡C-C(CH3)2-CO-CH3;
CH2=CH-C(CH3)=CH2; C6H5CH=C(CH3)2;
CH2OH-(CH2)2-COOH; (CH3)2C=C(CH3)-CO-CH2-OSH3;
CH3CH=C(CH3)-C=CH; (CH3)3C-CCI2 –CH2-CH2OH;
(CH3)2CH-CH(OH) –CH2-CO-C(CH3)3; ;
NOOS-C(CH3)2-COOH; H2C=CH-CHO;
C3H7-(CH2)2 –CH=CH-C3H7; (CH3)3C-CH(OH)–C(CH3)3;
H3C-CO-CH (CH3) - CH (OH) - CH2 - CH (C2H5) - CH2OH;
(CH3)3C-CO-H2C-CHO; H3C - CH (OH) - CH (CH3) - COOH;
C2H5-CO-CH2-CO-COOH; H2C=CH-(CH2)3-C≡CH;
H3C-O-C3H7; ![]() ;
;
CH3-CH(NH2)-CH2-COOH; CHBr2-CH=C(CH3)2;
OHC-(CH2)4-CO-CH3; HC≡S-S(SN 3) 2 -S≡SN;
![]() ; CH2OH-CH(OH)-CH2-CH2OH;
; CH2OH-CH(OH)-CH2-CH2OH;
![]() ; (C2H5)2CH-CH(C2H5)2;
; (C2H5)2CH-CH(C2H5)2;
CH2=CH-CH=CH2; CH2=C(C3H7)-COOH;
H3C-CO-CH (C2H5)-CH3; C2H5-O-CH2-(CH2)3-CHO;
H3C-CO-(CH2)2-CH=CH2; CH2(OH)-CH(OH)-C2H5;
NH2-CH2-CH2-CHO; (CH3)2C(OH)-CH2-CH2-COOH;
CH C-CH2-C C-CH3; ![]() ;
;
CH2(OH)-CH2-COOH; (CH3)3C-CC-CH=C(CH3)2;
OSN-CH2-CH2-CHO; H3C-CH(OH)-CH=CH2;
C2H5-CH2-O-C(CH3)2-CH3; ![]() ;
;
CH2=C=CH2; (CH3)2C = C(CH3)-C3H7;
CH3-C(CH3)2-COOH; CH2(OH)-CH(OH)-CHO;
CH3-CH2-C C-CO-CH3; ;
CH3-CO-C(CH3)3; (CH3)3C-CO-CH2-CH(CH3)-CH(CH3)2;
CH2=CH-CH2-CH2-COOH; CH C-CH2-OSH 3;
CH2N02-CH2-CH=CH-CH2CI; ![]() ;
;
CH3-O-C(CH3)3; CH3-CH(OH)-CH(CH3)2;
C2H5-CO-CHO; HOCH2-CH2-CO-CH2-CH2CI;
(CH3)2CH-COOH; ;
ONS-SNO; NS ≡ S-S ≡ CH;
CH2 = C(CH3)-COOH; CH2(OH)-CH(OH)-CH2-CH2OH;
CH3-CO-CH2-CH2-CH3; ;
P)
(CH3)3C-OH; SVg3-CH(OH)-SVg3;
ONS-CH2-CH2-CHO; CH(COOH)3;
CH3-CH=CH-C C-CH3; .
2. Napiši strukturne formule sljedećih spojeva (a-p):
a) etandial, 2-metilbuten-1; i) 2-metilcikloheksanol, 1-pentenin-4;
b) 2-propanol, butandioična kiselina, j) 2-karboksipentandioična kiselina, 3-fenilpropanol-1;
c) 3-oksopentanal, 1,3-heksadien; k) sec – propilbenzen, 2-aminoheksanska kiselina;
d) 3-hidroksipropanska kiselina, 3-heptin; m) butandion, heksatrien-1,3,5;
e) 2-butenska kiselina, 2-hidroksiheksanon-3; m) 1,4-pentadiin, 3-hidroksibutanska kiselina;
f) 1,2-dimetilbenzen, metilpropanal; o) 2-metilcikloheksanol, propenska kiselina;
g) hidroksietanska kiselina, cikloheksanon; n) 4-fenil-2-butenska kiselina; 2-tert-butilpentadien-1,4.
h) 1,3-propandiol, 3-butenal;
Domaća zadaća 2. Kemijska veza. Međusobni utjecaj atoma u molekulama organskih spojeva
1. Odredite tipove hibridizacije atoma ugljika, kisika i dušika u molekulama niže navedenih spojeva. Grafički prikažite, uzimajući u obzir oblik i prostornu orijentaciju atomskih orbitala atoma, dijagram elektronske strukture - i - veza (atomsko-orbitalni model) u ovim spojevima (a-p):
a) buten-1-u-3; e) butanal; l) propen-2-ol-l;
b) 1-klorobutanol-2; g) propadien-1,2; l) 2-klorpropen;
c) pentadien-1,4; h) heksen-1-on-3; n) 2-aminopropanal;
d) penten-l-ol-3; i) butandion; o) metoksieten;
e) propanon; j) 2-metilpropen; n) penten-4-al.
2. Grafički označite elektroničke efekte u vezama ispod. Na primjeru jednog spoja razmotrite vrste konjugacije i napišite njegovu mezoformulu (a-p):
a) CC13 - C(CH3)3; CH2=CH-CH=O; i) CH3-CH=CH-C2H5; CH2=CH-O-CH3;
b) CH3-CHON-CH2-CH=CH2; CH≡C-C≡N; j) CF3-CH=CH2; CH2 = CH-NH-CH3;
c) CH2NH2 - CH2COOH; CH2 = CH –NH2; l) CF3-CH2-CH=CH2; CH2=CH-Br;
d) CH3-CH(OH)-CO-CH3; CH3-CH=CH-Cl; l) VgCH2-CH=CH2; CH3-(CH=CH)2-CH3;
e) CH2=CH-CH2-CHO; CH2=CH-OH; m) CH30-CH2-C CH; CH2=CH-C≡N;
e) CH3-CC-C2H5; ; o) CH3-CO-CH2-CH=CH2; ;
g) CF3-COOH; ; n) CH2OH - CH2COOH; .
h) CH2N02 - CH2COOH; CH2=CH-CH=CH2;
Domaća zadaća 3. Izomerija organskih spojeva
1. Za navedene spojeve navedite 2-3 primjera strukturnih izomera raznih vrsta (a-p). Imenujte izomere koristeći IUPAC supstitucijsku nomenklaturu. Navedite kojim klasama spojeva pripadaju ti izomeri.
a) brompentin; f) ciklopentanol; l) etilciklopentan;
b) butenol; g) cikloheksan; m) heksen;
c) heksanol; h) heksanon; n) heksen;
d) jodopentanol; i) butanal; o) hidroksipentanska kiselina;
e) heptadien; j) okten; n) cikloheksanon.
Napišite projekcijske formule geometrijskih izomera (cis-, trans- ili Z-, E-) za navedene spojeve (a-p). Usporedite svojstva geometrijskih izomera (stabilnost, polarnost, vrelište).
a) 3-metilpenten -2; e) 2-kloroheksen-2; l) 3-brom-2-kloroheksen-2;
b) heksen-3; g) penten-2; m) 2-pentenol-1;
c) 3-nitroheksen-3; h) 4-metilcikloheksanol; m) 1,2-dikloropropen;
d) 1-klorobuten-1; i) 2,3-diklorheksen-2; o) 1,2-diklorcikloheksan;
e) 4-bromhepten-3; j) hepten-2; n) 1,3-dimetilciklobutan.
Odredite u kojem obliku optičkih izomera postoje navedeni spojevi (enantiomeri, dijastereomeri, mezoforme) (a-p). Navedite Fischerove projekcijske formule za ove izomere. Imenovati izomere (R, S –izomeri); pokazuju koji su izomeri optički neaktivni.
a) 2-brompronanol-1; f) 1,4-pentandiol; l) 2,2,3-triklorobutan;
b) 1,2,3-butantriol; g) 1,2-diklorbutan; l) 2,3-pentandiol;
c) 3-metilpentanol-2; h) 2,3-dihidroksibutanska kiselina; n) 2-aminobutanska kiselina;
d) 3,4-diklorheksan; i) 2,3-butandiol; o) 2-aminopropanska kiselina;
e) 3-bromobuten-1; j) 2,3-diaminopentan; n) 2-metilbutanal.
(zasićeni ugljikovodici)
Uz razmatranje kemije zasićenih ugljikovodika, ovo poglavlje također ocrtava neka temeljna načela koja su ključna za praktičnu upotrebu reakcija svih klasa organskih spojeva.
Ugljikovodici su spojevi dviju vrsta elemenata: ugljika i vodika. Razlikuju se u strukturi ugljikovog kostura i u prirodi veza između ugljikovih atoma.
Klasifikacija ugljikovodika


2.1. Homologni niz alkana
alkani– ugljikovodici otvorenog lanca (alifatski), u čijim su molekulama ugljikovi atomi u prvom valentnom stanju ( sp 3) i povezani su jednostavnom (jednostrukom) -vezom međusobno i s atomima vodika, zasićeni ili zasićeni ugljikovodici(S n H 2 n +2).
Njihov najjednostavniji predstavnik je metan CH4. Niz (niz) spojeva koji se međusobno razlikuju po jednoj ili više skupina – CH 2 – naziva se homologni niz, a članovi tog niza homolozi. Grupa – CH 2 – naziva se homološka razlika.
Koncept homologije omogućio je sistematizaciju ogromnog broja spojeva i uvelike pojednostavio proučavanje organske kemije. Homolozi su spojevi iste strukture, sličnih kemijskih svojstava i redovito varirajućih fizikalnih svojstava (Tablica 4).
Homologni niz alkana naziva se metanski niz po imenu prvog predstavnika. Imena prva četiri člana niza su trivijalna: počevši od petog (pentan), njihova su imena sastavljena od grčkih brojeva:
1 – mono 5 – penta 9 – nona (lat.)
Tablica 4
Homologni niz metana (C n H 2 n+2) s normalnim (nerazgranatim) lancem
|
Ime |
Broj izomera |
|||||
|
Triacontan |
CH 3 – CH 3 CH 3 – CH 2 – CH 3 CH3-(CH2)2–CH3 CH3-(CH2)3–CH3 CH3-(CH2)4–CH3 CH3-(CH2)5–CH3 CH3-(CH2)6–CH3 CH3-(CH2)7–CH3 CH 3 – (CH 2) 8 – CH 3 CH 3 – (CH 2) 18 – CH 3 CH 3 – (CH 2) 28 – CH 3 |
2.2. Izomerija i nomenklatura alkana
Ovisno o svom položaju u lancu, atom ugljika može biti primarni (vezan za jedan C, "terminalni"), sekundarni (vezan za dva Cs), tercijarni (vezan za tri Cs) i kvaternarni (vezan za četiri Cs):

Formula označava atome ugljika: I – primarni, II – sekundarni, III – tercijarni, IV – kvaternarni.
A atomi vodika povezani s tim ugljikom također se nazivaju primarni, sekundarni i tercijarni (nema kvaternarnog H).
Ova pozicija je vrlo važna za organsku kemiju, budući da različite jakosti C–H veza (za I, II i III, redom, 410, 395 i 380 kJ/mol) uvelike određuju smjer eliminacije i supstitucije. Ovo objašnjava pravilo A.M Zaitseva (1841–1910):
Prvi koji se eliminira (zamjenjuje) je tercijarni vodik, zatim sekundarni i na kraju primarni.
Mogućnost postojanja razgranatih struktura javlja se prvi put u slučaju butana ( n= 4) (vidi stranicu 9 - A1a), te s daljnjim povećanjem n broj mogućih izomera raste vrlo brzo (vidi tablicu 4). Ugljikovodični lanci normalne strukture sadrže samo primarne i sekundarne ugljike. Razgranati lanci sadrže najmanje jedan tercijarni (ili kvarterni) ugljik:
CH 3 – CH 2 – CH 2 – CH 2 – CH 3


izopentan neopentan
Prefiks "iso" koristi se za imenovanje spojeva u kojima su dvije metilne skupine na kraju lanca; prefiks "neo" označava prisutnost tri metilne skupine na kraju lanca.

 Korpuskularna i valna svojstva čestica
Korpuskularna i valna svojstva čestica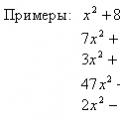 Mrežno rješenje jednadžbi X 5 0
Mrežno rješenje jednadžbi X 5 0 Zasićene monokarboksilne kiseline
Zasićene monokarboksilne kiseline