Maursyre har egenskaper til aldehyder. Maursyre strukturell kjemisk formel
Metansyre.
Kjemiske egenskaper
Kjemisk formel for maursyre: HCOOH. Dette er en av de første representantene for monobasic karbonsett. Stoffet ble først isolert i 1670 fra en skog (rød) maur. I naturlige omgivelser funnet i giften til bier, brennesler og nåler av bartrær, sekret av maneter, frukt.
Fysiske egenskaper
Den racemiske formelen for metansyre er: CH2O2. Stoff kl normale forhold har utseendet til en fargeløs væske, som er svært løselig i, aceton , toluen Og benzen . Molar masse= 46,02 gram per mol. Etere (etyleter og metyleter) og salter av metan til-du fikk navnet formater .
Kjemiske egenskaper
Av strukturformel Maursyre kan trekke konklusjoner og dens kjemiske egenskaper. maursyre i stand til å vise egenskaper satt og noen av egenskapene til aldehyder (reduktive reaksjoner).
Under oksidasjonen av maursyre frigjøres for eksempel karbondioksid aktivt. Stoffet brukes som konserveringsmiddel (kode E236). Maursyre interagerer med eddiksyre (konsentrert) og dekomponert til karbonmonoksid og vanlig vann med varmeavgivelse. Kjemisk forbindelse reagerer med natriumhydroksid . Stoffet interagerer ikke med saltsyre, sølv, natriumsulfat og så videre.
Innhenting av maursyre
Stoffet dannes som et biprodukt ved oksidasjon butan og produksjon eddiksyre . Det kan også oppnås ved hydrolyse formamid Og metylformiat (med overflødig vann); når CO er hydrert i nærvær av noe alkali. Kvalitativ reaksjonå oppdage metansyre kan tjene som en reaksjon på algedigs . Ammoniakk kan fungere som et oksidasjonsmiddel oksidløsning sølv og Cu(OH)2. En sølvspeilreaksjon brukes.
Bruk av maursyre
Stoffet brukes som et antibakterielt middel og et konserveringsmiddel i tilberedning av fôr for langtidslagring, midlet bremser prosessene med forfall og forfall betydelig. Den kjemiske forbindelsen brukes i prosessen med farging av ull; som insektmiddel i birøkt; i løpet av noen kjemiske reaksjoner(fungerer som et løsemiddel). I Mat industri verktøyet er merket E236. I medisin brukes syre i kombinasjon med ("pervomur" eller perminsyre ) som antiseptisk middel , for behandling av sykdommer i leddene.
farmakologisk effekt
Lokalbedøvelse, distraherende, anti-inflammatorisk, lokalt irriterende, forbedrer vevsmetabolismen.
Farmakodynamikk og farmakokinetikk
Metansyre, når den påføres overflaten av epidermis, irriterer Nerveender hud, muskelvev, aktiverer spesifikke refleksreaksjoner, stimulerer produksjonen nevropeptider Og enkefaliner . Dette reduserer smertefølsomheten og øker vaskulær permeabilitet. Stoffet stimulerer frigjøringsprosessene kininer Og histamin , utvider blodårene, stimulerer immunologiske prosesser.
Indikasjoner for bruk
Legemidlet brukes til å behandle instrumenter og utstyr før operasjon. Stoffet brukes lokalt som en del av løsninger for behandling av revmatiske smerter, isjias , periartritt , poly- Og monoartritt .
Kontraindikasjoner
Produktet skal ikke brukes hvis det finnes på påføringsstedet, hvis det er sår og skrubbsår på huden.
Strukturformel
Sann, empirisk eller grov formel: CH2O2
Den kjemiske sammensetningen av maursyre
Molekylvekt: 46,025
maursyre(systematisk navn: metanoic acid) - den første representanten i en serie av mettet monobasisk karboksylsyrer. Registrert som mattilsetning under betegnelsen E236. Maursyre fikk navnet sitt fordi den først ble isolert i 1670 av den engelske naturforskeren John Ray fra røde skogmaur. I naturen finnes det også i bier, i brennesle, nåler.
Formel: HCOOH
Fysiske og termodynamiske egenskaper
Under normale forhold er maursyre en fargeløs væske. Løselig i aceton, benzen, glyserin, toluen. Blandbar med vann, dietyleter, etanol.
Kvittering
- Et biprodukt i produksjonen av eddiksyre ved væskefaseoksidasjon av butan.
- metanoloksidasjon
- Reaksjonen av karbonmonoksid med natriumhydroksid: NaOH + CO → HCOONa → (+H 2 SO 4, −Na 2 SO 4) HCOOH Dette er den viktigste industrielle metoden, som utføres i to trinn: i det første trinnet, karbon monoksid under trykk på 0,6-0,8 MPa føres gjennom natriumhydroksid oppvarmet til 120-130 °C; i det andre trinnet behandles natriumformiat med svovelsyre og vakuumdestillasjon av produktet utføres.
- Dekomponering av glyserolestere av oksalsyre. For å gjøre dette varmes vannfri glyserin med oksalsyre, mens vann destilleres av og oksalsyreestere dannes. Ved videre oppvarming brytes esterne ned, frigjør karbondioksid og danner maursyreestere som etter dekomponering med vann gir maursyre og glyserol.
Sikkerhet
Faren for maursyre avhenger av konsentrasjonen. I henhold til klassifiseringen til EU har en konsentrasjon på opptil 10% en irriterende effekt, mer enn 10% - etsende. 100 % flytende maursyre forårsaker alvorlige kjemiske brannskader ved kontakt med huden. Hvis selv en liten mengde av det kommer på huden, forårsaker det alvorlig smerte, det berørte området blir først hvitt, som om det er dekket med frost, så blir det som voks, en rød kant vises rundt det. Syre trenger lett inn i fettlaget i huden, så vask av det berørte området med en løsning av brus må gjøres umiddelbart. Kontakt med konsentrert maursyredamp kan forårsake skade på øyne og luftveier. Tilfeldig treff inne selv fortynnede løsninger forårsaker fenomener med alvorlig nekrotisk gastroenteritt. Maursyre behandles raskt og skilles ut av kroppen. Imidlertid forårsaker maursyre og formaldehyd produsert ved metanolforgiftning skade på synsnerven og fører til blindhet.
Dissosiasjonskonstant: 1,772 10 −4 . Maursyre, i tillegg til sure egenskaper, viser også noen av egenskapene til aldehyder, spesielt reduserende. Ved å gjøre det oksideres det til karbondioksid. For eksempel:
2KMnO 4 + 5HCOOH + 3H 2 SO 4 → K 2 SO 4 + 2MnSO 4 + 5CO 2 + 8H 2 O
Ved oppvarming med sterke dehydreringsmidler (H 2 SO 4 (kons.) eller P 4 O 10) spaltes til vann og karbonmonoksid: HCOOH → (t) CO + H 2 O Maursyre reagerer med en ammoniakkløsning av sølvoksid HCOOH + 2OH - -> 2Ag + (NH 4) 2CO 3 + 2NH 3 + H 2 O Interaksjon av maursyre med natriumhydroksid. HCOOH + NaOH \u003d HCOONa + H 2 O
Å være i naturen
I naturen finnes maursyre i nåler, brennesler, frukt, kaustiske sekreter fra maneter, bier og maur. Maursyre ble først isolert i 1670 av den engelske naturforskeren John Ray fra røde skogmaur, noe som forklarer navnet. I store mengder maursyre dannes som et biprodukt av væskefaseoksidasjonen av butan og lett bensinfraksjon ved produksjon av eddiksyre. Maursyre oppnås også ved hydrolyse av formamid (~35 % av verdens totale produksjon); prosessen består av flere trinn: karbonylering av metanol, interaksjon av metylformiat med vannfri NH 3 og påfølgende hydrolyse av det dannede formamidet med 75 % H 2 SO 4 . Noen ganger brukes direkte hydrolyse av metylformiat (reaksjonen utføres i overskudd av vann eller i nærvær av tertiært amin), CO-hydratisering i nærvær av alkali (syren er isolert fra saltet ved påvirkning av H 2 SO 4), dehydrogenering av CH 3 OH i dampfasen i nærvær av katalysatorer som inneholder, så vel som Zr, Zn, Cr,, Mg, etc. (metoden har ingen industrielle verdier).
applikasjon
Maursyrederivater
Salter og estere av maursyre kalles formater.
Maursyre er i stand til å fungere både som et oksiderende og reduserende kjemikalie på samme tid, noe som muliggjør et bredt spekter av bruksområder. gitt stoff ikke bare innen medisin, men også innen industri. Dette er den sterkeste karboksylsyren, som ble avlet frem i 1671 takket være den engelske naturforskeren John Ray. Han oppdaget stoffet i kroppen (i bukkjertlene) til røde maur, tok det deretter i den nødvendige mengden for studier og beskrev alle egenskapene til kjemikaliet. Maursyre finnes også i nåler, brennesler, noen frukter, i sekretet fra silkeormslarver og andre insekter. I store mengder kan stoffet oppnås syntetisk.
Kjemiske egenskaper til maursyre
Dette kjemikaliet har en stor fordel i forhold til andre syrer, da det er både en karboksylsyre og et aldehyd. UNUN er kjemisk formel et stoff som er registrert under nummeret E236 og brukes som tilsetningsstoff i industrien. Maursyre er en fargeløs væske med en karakteristisk sterk lukt. Dens derivater er formater (estere og salter) og formaldehyd. Bemerkelsesverdig løselig i aceton, glyserin, toluen og benzenmaursyre. Stoffets kjemiske egenskaper gjør at det kan blandes med dietyleter, vann og etanol.

Bruk av maursyre

Er syre trygt?
Syre i konsentrert form er svært farlig, for selv med en liten kontakt med huden kan det forårsake brannskader. I tillegg, i motsetning til andre lignende kjemikalier, ødelegger dette stoffet til og med det subkutane fettlaget! I tilfelle brannskader, behandle det berørte området med en elementær løsning av salt eller brus så snart som mulig. Syredamp kan forårsake uopprettelig skade menneskelig helse spesielt for øynene og luftveiene. Hvis kjemikaliet kommer inn i kroppen i store mengder, fører det til skade på synsnerven, hoste, halsbrann, blindhet, nekrotiserende gastroenteritt, nyre- og leversykdom. Det skal sies at i små doser blir maursyre raskt bearbeidet til Menneskekroppen og blir tatt ut av det. Ved lav konsentrasjon har konserveringsmidlet E236 en lokalbedøvelse, anti-inflammatorisk og sårhelende effekt.
Fysiske og termodynamiske egenskaper
Under normale forhold er maursyre en fargeløs væske.
| Molekylær masse | 46,03 |
| Smeltepunkt | 8,25°C |
| Koketemperatur | 100,7°C |
| Løselighet | Løselig i |
| Tetthet ρ | 1,2196 g/cm³ (ved 20°C) |
| Damptrykk | 120 (ved 50 °C) |
| Brytningsindeks | 1,3714
(temperaturkoeffisient for brytningsindeks 3,8 10 -4, gyldig i temperaturområdet 10-30°C) |
| Standard entalpi for formasjon ΔH | −409,19 kJ/mol (l) (ved 298 K) |
| Standard Gibbs formasjonsenergi G | −346 kJ/mol (l) (ved 298 K) |
| Standard entropi for utdanning S | 128,95 J/mol K (l) (ved 298 K) |
| Standard molar C s | 98,74 J/mol K (l) (ved 298 K) |
| Entalpi av smelting ΔH pl | 12,72 kJ/mol |
| Kokende entalpi ΔH kip | 22,24 kJ/mol |
| Brennverdi -ΔH° 298 (sluttstoff CO 2 , H 2 O) | 254,58 kJ/mol |
| Antall mol H 2 O per 1 mol HCOOH | m, mol HCOOH per 1 kg H 2 O | -AHm, kJ/mol |
|---|---|---|
| 1 | 55,51 | 0,83 |
| 2 | 27,75 | 0,87 |
| 3 | 18,50 | 0,79 |
| 4 | 13,88 | 0,71 |
| 5 | 11,10 | 0,67 |
| 6 | 9,25 | 0,62 |
| 8 | 6,94 | 0,58 |
| 10 | 5,55 | 0,56 |
| 15 | 3,70 | 0,55 |
| 20 | 2,78 | 0,55 |
| 30 | 1,85 | 0,56 |
| 40 | 1,39 | 0,57 |
| 50 | 1,11 | 0,60 |
| 75 | 0,740 | 0,65 |
| 100 | 0,555 | 0,66 |
| ∞ | 0,0000 | 0,71 |
Kvittering
1. Hvordan biprodukt i produksjon ved væskefaseoksidasjon.
Dette er den viktigste industrielle metoden, som utføres i to trinn: i det første trinnet føres karbonmonoksid ved et trykk på 0,6-0,8 MPa gjennom natriumhydroksid oppvarmet til 120-130 °C; i det andre trinnet behandles natriumformiat og produktet vakuumdestilleres.
Sikkerhet
Maursyre er den farligste fettsyren! I motsetning til uorganiske syrer som svovelsyre, trenger den lett gjennom fettlaget i huden, vask av det berørte området med en brusløsning må gjøres umiddelbart!
Maursyre, når selv en liten mengde av det kommer på huden, forårsaker svært alvorlig smerte, det berørte området blir først hvitt, som om det er dekket med rimfrost, blir deretter som voks, en rød kant vises rundt det. Etter en stund avtar smertene. Berørt vev blir til en skorpe opptil flere millimeter tykk, helbredelse skjer først etter noen få uker.
Damp fra selv noen få dråper maursyre kan forårsake alvorlig øye- og luftveisirritasjon.
Kjemiske egenskaper
: 1,772·10 -4.
Maursyre, i tillegg til sure egenskaper, viser også noen egenskaper, spesielt reduserende. Samtidig oksideres det til karbondioksid. For eksempel:
2KMnO 4 + 5HCOOH + 3H 2 SO 4 → K 2 SO 4 + 2MnSO 4 + 5CO 2 + 8H 2 O
Ved oppvarming med sterke dehydreringsmidler (H 2 SO 4 (kons.) eller P 4 O 10) blir det til
Maursyre er et sterkt reduksjonsmiddel, siden den inneholder en aldehydgruppe:
HCOOH + 2OH ® (NH 4) 2 CO 3 + 2Ag + 2NH 3 + H 2 O
(reaksjon av et sølvspeil);
HCOOH + 2Сu(OH) 2® CO 2 + Cu 2 O + 3H 2 O;
HCOOH + Cl2® CO2 + 2HCl.
I motsetning til andre mettede karboksylsyrer, er maursyre ustabil overfor virkningen av konsentrert svovelsyre og salpetersyre: UNUN ![]() CO + H 2 O.
CO + H 2 O.
Alle dikarboksylsyrer er faste krystallinske stoffer, løselig i vann. Den gjensidige påvirkningen av atomer i molekylene til dikarboksylsyrer fører til at de er sterkere syrer enn monobasiske syrer. Dibasiske syrer går inn i alle reaksjoner som er karakteristiske for monobasiske syrer, og gir to serier med derivater. Spesifisiteten til strukturen deres fører til reaksjoner som bare er iboende for dem. termisk dekomponering. Oksalsyre og malonsyre gjennomgår dekarboksylering ved oppvarming, resten danner sykliske anhydrider:
LEOS–COOH CO 2 + HCOO

Spesielle egenskaper til umettede karboksylsyrer
De kjemiske egenskapene til umettede karboksylsyrer skyldes både egenskapene til karboksylgruppen og egenskapene til dobbeltbindingen. Spesifikke egenskaper besittes av syrer med en dobbeltbinding lokalisert nær karboksylgruppen - a, b-umettede syrer. For disse syrene går tilsetning av hydrogenhalogenider og hydrering mot Markovnikovs regel:
CH 2 \u003d CH-COOH + HBr ® CH 2 Br-CH 2 -COOH
Polymerer av akryl- og metakrylsyrer, så vel som deres estere er mye brukte strukturelle materialer (plexiglass, plexiglass).
Egenskaper til hydroksysyrer
Hydroksysyrer går inn i reaksjoner som er karakteristiske for karboksylsyrer og alkoholer, og har også spesifikke egenskaper. De er sterkere syrer enn de tilsvarende karboksylsyrene. Dette forklares av eksistensen av en intramolekylær hydrogenbinding mellom OH- og COOH-gruppene i a- og b-hydroksysyrer; sterkere Hydrogenbinding danner et karboksylatanion som følge av dissosiasjonen av hydroksysyrer. Med salter av noen metaller, f.eks. Fe(III), Cu(II), a-hydroksysyrer danner komplekse forbindelser.

Spesiell eiendom hydroksysyrer - deres transformasjon ved oppvarming.
1. a-aminosyrer - intermolekylær dehydrering, dimerisering, dannelse laktider :

2. b-aminosyrer - intramolekylær dehydrering, dannelse umettede syrer :
2. g og d-aminosyrer - intermolekylær dehydrering, dannelse laktoner :
![]()
Dannelsen av laktoner med en mer fjerntliggende hydroksylgruppe(mer enn 7 karbonatomer i et molekyl) er vanskelig.
Hydroksysyrer er vidt distribuert i naturen, deres rester er en del av sfingolipidene til dyr og planter. Hydroksysyrer spiller viktig rolle V biokjemiske prosesser. Sitronsyre og eplesyre er nøkkelprodukter i syklusen trikarboksylsyrer; b- og g-hydroksysyrer er mellomprodukter av fettsyremetabolismen, og melkesyre er et mellomprodukt av karbohydratmetabolismen.
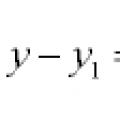 Ligninger av linjer og kurver i planet
Ligninger av linjer og kurver i planet Generalisert homogen likning Generaliserte homogene likninger av andre orden
Generalisert homogen likning Generaliserte homogene likninger av andre orden Takket være kommaet På grunn av det faktum at i deres
Takket være kommaet På grunn av det faktum at i deres