Электронная формула молекулы бензола. Электронное строение бензола
Арены - это углеводороды с общей формулой С n H 2 n - 6 в молекулах которых есть одно или несколько бензольных колец.
СТРОЕНИЕ БЕНЗОЛА
Главным представителем аренов является бензол - С 6 Н 6 . По составу это соединение непредельное, до полного насыщения всех связей атомов углерода не хватает 8 атомов водорода. В 1911 г бензол был получен из циклогексана (реакция Зелинского), что явилось доводом в пользу гипотезы о циклическом строении бензола. Позже была осуществлена обратная реакция - гидрирование бензола (реакция Сабатье). В 1865 г немецкий химик А.Кекуле предложил структурную формулу бензола:
Согласно формуле Кекуле бензол имеет 3 двойные связи и, следовательно, должен вступать в реакции присоединения. Однако, бензол не дает типичных для непредельных соединений реакций (не обесцвечивает бромную воду и раствор перманганата калия). Этот факт находится в противоречии с формулой Кекуле. Кроме того , эта формула не объясняет высокой устойчивости бензольного кольца.
Согласно современным представлениям молекула бензола имеет строение плоского шестиугольника с равными сторонами. Атомы углерода в бензоле находятся в состоянии sp 2 - гибридизации. При этом гибридные орбитали образуют обычные  - связи, а негибридная - перекрывается с двумя другими негибридными орбиталями соседних углеродных атомов. В результате образуется единое облако делокализованных
- связи, а негибридная - перекрывается с двумя другими негибридными орбиталями соседних углеродных атомов. В результате образуется единое облако делокализованных  - электронов (рис 5). В результате такого равномерного перекрывания 2р - орбиталей всех шести углеродных атомов происходит "выравнивание" простых и двойных связей, то есть в молекуле бензола отсутствуют классические двойные и одинарные связи. Для того чтобы подчеркнуть выравненность - электронной плотности в молекуле бензола предложена следующая структурная формула:
- электронов (рис 5). В результате такого равномерного перекрывания 2р - орбиталей всех шести углеродных атомов происходит "выравнивание" простых и двойных связей, то есть в молекуле бензола отсутствуют классические двойные и одинарные связи. Для того чтобы подчеркнуть выравненность - электронной плотности в молекуле бензола предложена следующая структурная формула:
Арены имеют и тривиальное название "ароматические углеводороды". Понятие "ароматичности" не связано с запахом углеводородов, хотя многие из них обладают им. Под "ароматичностью" понимают некоторые особенности строения углеводородов, главной из которых является равномерное распределение - электронной плотности в молекуле. Кроме того, ароматические соединения подчиняются правилу Э.Хюккеля: плоские моноциклические соединения , имеющие сопряженную систему - электронов, могут быть ароматическими, если число этих электронов равно 4п+2 (где п=0,1,2 и т.д.).
ИЗОМЕРИЯ И НОМЕНКЛАТУРА АРЕНОВ
По систематической номенклатуре арены рассматривают как производные бензола. Названия образуются от названий радикалов боковых цепей с добавлением окончания бензол.
СН 3 С 2 Н 5
метилбензол этилбензол
В случае если в бензольном кольце имеется два заместителя, то они могут отличаться своим взаимным расположением в кольце. Так, при замещении двух водородных атомов на метильные радикалы могут образоваться три изомера (орто-, мета- и пара-).
СН 3 СН 3 СН 3


 СН 3
СН 3
Орто-ксилол мета-ксилол пара-ксилол
(1,2 - диметилбензол) (1,3-диметилбензол) (1,4 - диметилбензол)
Нумерацию бензольного кольца ведут таким образом, чтобы сумма цифр была наименьшей. Многие арены имеют тривиальные названия , которые применяются очень часто (метилбензол - толуол; диметилбензол - ксилол).
Изомерия в гомологическом ряду бензола может быть связана как числом и строением заместителей, так и с их положением в бензольном кольце.
СВОЙСТВА АРЕНОВ
1. Химические свойства бензола.
Несмотря на формальную непредельность для бензола более характерны реакции замещения. Это объясняется особенностями строения бензольного кольца. В присутствии катализаторов FeBr 3 , AlCl 3 может идти замещение атомов водорода в молекуле бензола на атомы галогенов. Эти реакции идут практически в обычных условиях.
C
6
H
6
+
Br
2
FeBr
3
C
6
H
5
Br
+
HBr
При взаимодействии с бензола азотной кислотой в присутствии концентрированной серной кислоты в качестве водоотнимающего средства идет образование нитробензола:
C
6
H
6
+
HNO
3
50
C
C
6
H
5
NO
2
+
H
2
O
В присутствии безводного хлорида алюминия в качестве катализатора может протекать реакция алкилирования
бензола (Реакция Фриделя - Крафтса).
В результате к бензольному кольцу присоединяется углеводородный радикал.
AlCl 3
Н + Cl CH 3 СН 3 + HCl
Реакции присоединения менее характерны для бензола, но они есть. Так, каталитическое гидрирование бензола идет в присутствии никелевых (150 о) или платиновых (50 о) катализаторов. Бензол при этом превращается в циклогексан.
3Н 2
При сильном освещении (УФ - облучение) в отсутствие кислорода бензол способен присоединять хлор, образуя производное циклогексана - гексахлорциклогексан (гексахлоран).
С 6 Н 6 + 3Н 2 hv C 6 H 6 Cl 6
В реакциях присоединения происходит разрушение ароматической системы.
2.Химические свойства гомологов бензола.
Гомологи бензола химически более активны чем сам бензол. Это объясняется влиянием углеводородного радикала на бензольное кольцо. Радикалы являются электродонорными заместителями, то есть они подают электроны в бензольное кольцо, нарушая равномерное распределение электронной плотности в кольце в орто - и пара - положениях. В этих положениях повышается электронная плотность и облегчается вхождение заместителей. Так, например , толуол (метилбензол) нитруется очень легко, даже без нагревания. При этом идет образования тринитротолуола.


3HNO 3 NO 2 NO 2 + 3H 2 O
Галогенирование гомологов бензола идет по-разному в зависимости от условий реакции. При освещении галоген замещает водород в радикале, а в присутствии катализатора - встраивается в бензольное кольцо:
CH 3 CH 2 Cl


Cl 2 hv + HCl


Cl 2 + HCl
Известно, что влияние атомов и групп атомов в молекулах органических веществ взаимно. Поэтому в молекулах гомологов бензола не только радикалы влияют на активность бензольного кольца, но и кольцо влияет на активность радикалов. В частности снижают устойчивость радикалов к окислению. Если, например, прилить раствор перманганата калия к толуолу и нагреть смесь , то фиолетовая окраска раствора постепенно исчезнет. Это происходит вследствие окисления метильной группы.
В реакции окисления толуола перманганатом калия метильная группа окисляется в карбоксильную - образуется бензойная кислота. Схема этой реакции выглядит следующим образом:

 СН 3 СООН
СН 3 СООН

Остальные продукты реакции будут зависеть от выбранного окислителя и среды в которой протекает реакция. Подобным образом окисляются и другие гомологи с одной боковой цепью. Гомологи, содержащие две боковые цепи, дают двухосновную фталевую кислоту.


СН 3 СООН
СН 3 СООН
Бензол и его гомологи горят на воздухе коптящим сильно пламенем, что связано с высоким процентным содержанием углерода.
2С 6 Н 6 + 15О 2 12СО 2 + 6Н 2 О
3. Физические свойства аренов.
Низшие члены гомологического ряда бензола - чаще всего жидкости, обладающие характерным запахом. Углеводороды , в состав которых входит не более одного бензольного кольца, как правило, легче воды. Арены в воде нерастворимы, но хорошо растворяются в органических растворителях, и сами являются таковыми. Физические свойства некоторых представителей аренов приведены ниже в таблице.
СПОСОБЫ ПОЛУЧЕНИЯ АРЕНОВ
В промышленности 90 % получаемого бензола выделяют при переработке каменноугольной смолы при ее фракционировании. Другим источником получения аренов является нефть, которые выделяют из нее простой перегонкой, пиролизом , а также каталитическим крекингом.
Ароматизация парафинов (каталитический риформинг):
СН 3 СН 3


Pt, 350 o C
метилциклогексан метилбензол
При дегидрировании циклогексана подобным образом образуется бензол.
Гомологи бензола могут быть получены по реакции Фриделя - Крафтса (см. раздел свойства бензола).
Реакция Вюрца - Фиттига . Эта реакция подобна реакции Вюрца в ряду алканов:



+ 2Na + Br C 2 H 5 + 2NaBr
Br C 2 H 5
Синтез из солей ароматических карбоновых кислот:
![]()
С 6 Н 5 СООNa + NaO H t C 6 H 6 + Na 2 CO 3
6. Синтез из ацетилена. Реакция Зелинского.
3 СН СН
АРЕНЫ В ПРИРОДЕ. ПРИМЕНЕНИЕ АРЕНОВ.
Изредка арены в свободном виде входят в состав нефтей. Кроме того, они образуют сложные структуры в составе углей. Арены очень широко применяются в различных отраслях промышленности. Бензол является сырьем для производства различных химических продуктов: нитробензола, анилина, хлорбензола, стирола. Толуол используется для производства красителей , лекарственных и взрывчатых веществ (тол, тротил), а также является исходным продуктом при получении синтетических моющих средств, капролактама. Является хорошим растворителем. Ксилолы используются для получения веществ являющихся исходным сырьем для производства синтетических волокон (лавсана).
МНОГОЯДЕРНЫЕ АРЕНЫ
Многоядерные ароматические соединения содержат несколько бензольных колец. В зависимости от характера строения различают соединения с конденсированными и неконденсированными бензольными ядрами. Простейшими и практически важными являются нафталин и антрацен.


НАФТАЛИН



- АНТРАЦЕН
Нафталин - бесцветное кристаллическое вещество, довольно летучее (температура плавления - 80 о С). Служит сырьем для синтеза фталевого ангидрида, фталевой кислоты и других продуктов. Применяется в быту для отпугивания моли и других насекомых. В химическом поведении имеет много общего с бензолом , но в реакции замещения вступает легче, чем сам бензол.
Антрацен - кристаллическое вещество с температурой плавления 213 о С. Получается из каменноугольной смолы. Большое значение имеют различные производные антрацена. К ним, например, относятся антрахинон, ализарин и т.д. Ализарин - самый распространенный из диоксиантрахиноновых красителей, применяется для крашения шерсти и хлопка. Впервые ализарин выделили из корня марены. Ализарин - протравный краситель. По алюминиевой протраве он красит в ярко - красный цвет , по хромовой - в коричневый, по железной - в фиолетовый.
ЗАДАНИЯ И УПРАЖНЕНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ ТЕМЫ
Какие углеводороды называются аренами?
Охарактеризуйте особенности строения молекулы бензола.
Назовите важнейшие способы получения аренов, приведите соответствующие уравнения реакций.
На примере бензола охарактеризуйте важнейшие химические свойства аренов. Объясните , почему для бензола более характерны реакции замещения. Объясните, почему в обычных условиях бензол устойчив к действию окислителей.
В чем отличия в химических свойствах гомологов бензола от свойств самого бензола. Объясните, чем обусловлены эти отличия.
Составьте формулы следующих веществ: бромбензол; 1,3 - диметилбензол; 1,3 - диметил 4 - хлорбензол; пропилбензол; 1,3 - динитробензол.
Составьте уравнения реакций взаимодействия:
Метилбензола с водородом;
Метилбензола с хлором (при освещении);
Этилбензола с азотной кислотой
Бензола с хлорэтаном (в присутствии хлорида алюминия)
Бензол, полученный дегидрированием циклогексана объемом 151 мл и плотностью 0,779 г/мл, подвергли хлорированию при освещении. Образовалось хлоропроизводное массой 300 г. Определите выход продукта реакции.
Какой объем воздуха (при н.у.) потребуется для сжигания 1,4 - диметилбензола массой 5,3 г? Объемная доля кислорода в воздухе составляет 21%.
85 г бензола прореагировало с концентрированной азотной кислотой массой 160 г. Какой продукт образовался, и какова его масса.
Какой объем водорода (н.у.) образуется при циклизации и дегидрировании н-гексана объемом 200 мл и плотностью 0,66 г/мл? Реакция протекает с выходом 65 %.
При окислении смеси бензола и толуола раствором перманганата калия при нагревании получено после подкисления 8,54 г одноосновной органической кислоты. При взаимодействии этой кислоты с избытком водного раствора гидрокарбоната натрия выделился газ, объем которого в 19 раз меньше объема такого же газа , полученного при полном сгорании исходной смеси углеводородов. Определите состав исходной смеси (в % по массе).
Газ, выделившийся при получении бромбензола из 22,17 мл бензола (плотность - 0,8 г/мл), ввели в реакцию с 4,48 л изобутена. Какие соединения образовались и какова их масса, если учесть, что выход бромбензола составил 80% от теоретического, а реакция с изобутеном идет с количественным выходом.
Смесь бензола, циклогексана и циклогексена при обработке бромной водой присоединяет 16 г брома; при каталитическом дегидрировании исходной смеси образуется 39 г бензола и водород, объем которого в два раза меньше объема водорода необходимого для полного гидрирования исходной смеси углеводородов. Определите состав исходной смеси.
Раздаточный материал к лекции 5





Лекция 5
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
КЛЮЧЕВЫЕ СЛОВА: ароматические углеводороды, арены, sp2-гибридизация, единое p-электронная облако, круговое сопряжение, ионный механизм реакции замещения, электрофильное замещение, нитрование, галогенирование, алкилирование по Фриделю-Крафтсу, алкилирование алкенами, гидрирование, окисление.
СТРОЕНИЕ МОЛЕКУЛЫ БЕНЗОЛА. АРОМАТИЧНОСТЬ
Ароматические углеводороды (арены) – это углеводороды, молекулы которых содержат одно или несколько бензольных колец.
Простейшим представителем ароматических углеводородов является бензол, молекулярная формула которого С 6 Н 6 . Установлено, что все атомы углерода в молекуле бензола лежат в одной плоскости, образуя правильный шестиугольник (рис. 1). Каждый атом углерода связан с одним атомом водорода. Длины всех связей углерод-углерод одинаковы и составляют 0,139 нм.
Формулы а) и б) предложил в 1865 г немецкий химик Август Кекуле. Несмотря на то, что они недостаточно точно передают строение молекулы бензола, их используют до сих пор и называют формулами Кекуле.
Исторически название «ароматические углеводороды» сложилось потому, что многие производные бензола, которые первыми были выделены из природных источников, обладали приятным запахом.
В настоящее время под понятием «ароматичность» подразумевают, прежде всего, особый характер реакционной способности веществ, обусловленный, в свою очередь, особенностями строения молекул этих соединений.
В чем же состоят эти особенности?
В соответствии с молекулярной формулой С 6 Н 6 бензол является ненасыщенным соединением, и можно ожидать, что для него были бы характерны типичные для алкенов реакции присоединения. Однако в условиях, в которых алкены быстро вступают в реакции присоединения, бензол не реагирует или реагирует медленно. Бензол не дает и характерных качественных реакций, свойственных непредельным углеводородам:онне обесцвечивает бромную воду и водный раствор перманганата калия.
Такой характер реакционной способности объясняется наличием в ароматическом кольце сопряженной системы – единого p -электронного облака.
В молекуле бензола каждый атом углерода находится в состоянии sp 2 -гибридизации и связан тремя s -связями с двумя атомами углерода и одним атомом водорода. Четвертый валентный электрон атома углерода находится на p -орбитали, перпендикулярной плоскости молекулы. В молекуле бензола происходит боковое перекрывание р -орбиталей каждого атома углерода с р -орбиталями обоих соседних атомов углерода (рис. 2). В результате такого сопряжения образуется единое p-электронное облако , расположенное над и под плоскостью бензольного кольца – осуществляется круговое сопряжение .
Такая циклическая система с общим облаком из шести электронов очень устойчива, энергетически выгодна; поэтому бензол преимущественно вступает в те реакции, в которых ароматическое кольцо сохраняется.
 а а
|  б б
|
Рис. 2. Электронное строение молекулы бензола: а) схема перекрывания р -орбиталей; б) единое p-электронное облако.
Подчеркнем еще раз, что в молекуле бензола нельзя выделить трех двойных и трех простых связей. Электронная плотность распределяется в молекуле равномерно, и все связи между атомами углерода оказываются совершенно одинаковыми. Поэтому нужно помнить, что формула Кекуле, которая часто используется для изображения бензола, условна и не отражает реального строения его молекулы.
Итак, ароматическимиявляются соединения, в молекулах которых имеется устойчивая циклическая группировка с особым характером связи. Имея молекулярную формулу, указывающую на высокую степень ненасыщенности, эти вещества, однако, не реагируют как ненасыщенные, а вступают преимущественно в реакции замещения с сохранением ароматической системы.
ГОМОЛОГИ БЕНЗОЛА,
ИЗОМЕРИЯ, НОМЕНКЛАТУРА
Общая формула гомологического ряда ароматических углеводородов C n H 2 n -2 .
Ближайшим гомологом бензола является метилбензол. Чаще употребляют его тривиалное название – толуол:

Бензол и толуол не имеют ароматических изомеров. Для этих веществ характерна лишь межклассовая изомерия . Так, соответствуют молекулярной формуле С 6 Н 6 и, следовательно, изомерны бензолу непередельные нециклические углеводороды, содержащие две тройных или две двойные и одну тройную связи в молекуле, например:
![]()
![]()
Начиная с аренов с восьмью атомами углерода появляется возможность изомерии, связанной с составом и взаимным расположением углеводородныхрадикалов. Если с бензольным кольцом связаны два заместителя, то они могут находиться в трех различных положениях относительно друг друга: рядом (такое положение обозночают приставкой орто- ), через один атом углерода (мета- ), и напротив друг друга (пара- ). Диметилбензол, стуктурные формулы изомеров которого приведены ниже, имеет тривиальное название ксилол.
Таким образом, молекулярной формуле С 8 Н 8 отвечают четыре изомерных ароматических углеводорода:



Строение бензола
Бензол впервые был выделен М. Фарадеем в 1825 году из конденсата, выпавшего из светильного газа, используемого для освещения городских улиц Лондона. Фарадей назвал это жидкое легкоподвижное вещество с резким запахом «карбюрированным водородом» (carburated hydrogen). Важно при этом отметить, что уже тогда было установлено, что бензол состоит из равных частей углерода и водорода.
Несколько позже, в 1834 году, Митчерлих получил бензол декарбоксилированием бензойной кислоты. Он же установил элементный состав полученного соединения – С 6 Н 6 – и предложил свое название для него – бензин . Однако с этим названием не согласился Либих. Ему показалось, что это название ставит бензол в один ряд с такими далекими от него веществами как хинин и стрихнин. По мнению Либиха более удачным названием для нового соединения является бензол , посколькуоно показывает близость бензола по свойствам к маслам (от немецкого оl – масло). Были и другие предложения. Поскольку бензол был выделен Фарадеем из светильного газа, то Лоран предложил (1837 г.) для него название фено от греческого «несущий свет». Это название не утвердилось, однако именно от него произошло название одновалентного остатка бензола – фенил .
Углеводороду Фарадея не повезло. Все предложенные для него названия оказались ущербными. Из либиховского названия «бензол» следует, что соединение содержит гидроксильную группу, которой там нет. Точно так же митчерлиховский «бензин» не содержит функциональную азотсодержащую группу. Более того, существование различных названий привело к разделению химиков. В немецкой и русской научной литературе утвердилось название «бензол», а в английской и французской – «бензен» (bensene , toluene , xylene ).
На первый взгляд кажется, что установить строение бензола не представляет больших трудностей. В состав молекулы бензола входит лишь два элемента, на шесть атомов углерода приходится шесть атомов водорода. К тому же физические и химические свойства бензола изучены весьма обстоятельно. Однако эта работа затянулась на многие десятилетия и завершилась лишь в 1931 году.
Наиболее трудные барьеры к познанию структуры бензола были преодолены выдающимся немецким химиком Кекуле. С высоты современных знаний трудно понять и оценить значение выдвинутой им гипотезы, согласно которой молекула бензола имеет циклическое строение (1865 г.). Однако именно это предположение, при совокупном рассмотрении с числом изомеров у моно- и дизамещенных бензолов, привело Кекуле к известной формуле. По Кекуле бензол представляет собой шестичленное циклическое соединение с тремя чередующимися двойными связями, т.е. циклогексатриен
Именно эта структура согласуется с существованием одного и только одного монозамещенного бензола и трех изомеров дизамещенных бензолов

C момента появления структуры Кекуле началась ее критика, которую она, к сожалению, вполне заслуживала. Уже отмечалось, что характерная особенность ароматических соединений - присущий им ароматический характер. Структура Кекуле для бензола оказалась не в состоянии объяснить эту особенность ароматических соединений. В ряде случаев она не могла также объяснить отсутствия изомеров, в то время как формула циклогексатриена для бензола допускала их существование. Так, орто -замещенных бензолов может быть два изомера

однако обнаружить их не удалось. Сразу же отметим, что для преодоления этого затруднения Кекуле предложил рассматривать бензол как циклогексатриен с подвижными, не закрепленными, двойными связями. В результате быстрого преобразования I во II и наоборот бензол ведет себя как структура как бы состоящая из равных количеств I и II .
Итак, основной недостаток бензола Кекуле – невозможность объяснить на его основе ароматический характер соединений, содержащих в своей молекуле бензольное кольцо. Если бы бензол был циклогексатриеном, т.е. соединением с тремя двойными связями, то он должен был бы:
Легко окисляться даже холодным водным раствором КMnO 4 ,
Уже при комнатной температуре присоединять бром и легко вступать в другие реакции электрофильного присоединения,
Быстро гидрироваться водородом в присутствии никеля при комнатной температуре,
В эти реакции бензол вступает неохотно, не так как алкены. А вот реакции замещения - весьма характерны для соединений ароматического ряда. Отсюда следует, что бензол не может быть циклогексатриеном и формула Кекуле не отражает истинного строения бензола . Основной недостаток бензола Кекуле – присутствие в нем двойных связей. Если бы их не было, то и не следовало бы ожидать от бензола проявления свойств, характерных для алкенов. В этой связи становится понятным, почему все дальнейшие попытки «усовершенствовать» формулу Кекуле носили форму лишить ее двойных связей, сохранив при этом за бензолом циклическое строение. Таковы формулы III – VII , предложенные Клаусом (1867 г.), Дьюаром (1867 г.), Армстронгом – Байером (1887 г.), Тиле (1899 г.) и Ладенбургом (1869 г.)

Ни одна из этих формул не могла объяснить всех свойств, присущих бензолу. Это стало возможным только с развитием квантовой химии.
Согласно современным представлениям о строении бензола его молекула представляет собой плоский правильный шестиугольник, на вершинах которого расположены углеродные атомы, находящиеся в sp 2 –гибридном состоянии. Каждый из шести углеродных атомов за счет трех тригональных гибридных орбиталей образует две σ -связи с соседними углеродами и еще одну связь с водородом. Все эти связи расположены в одной плоскости под углом 120 0 друг к другу. В гибридизации участвуют лишь два из трех р -электронов углеродных атомов. Поэтому после образования σ -связей у каждого из шести углеродов бензольного кольца остается еще по одному р -электрону. Из истории установления строения бензола, растянувшегося на многие десятилетия, видно насколько трудно пробивало себе дорогу представление, что р -электроны способны перекрываться друг с другом не только попарно с образованием π -связей. При некоторых обстоятельствах возможно перекрывание облаков р- электронов как с соседом справа, так и с соседом слева

Это становится возможным, если молекула имеет циклическое строение, расстояния между углеродами одинаковы и оси р -электронов параллельны между собой. Последнее условие соблюдается, если молекула имеет плоское строение.
При таком построении молекулы бензола углеродные атомы связаны между собой не ординарными и не двойными связями. Эти связи, скорее всего, следовало бы отнести к «полуторным». Не лишним будет упомянуть, что согласно результатам рентгеноструктурного анализа кристаллического бензола все углерод-углеродные связи в бензоле имеют одинаковую длину 0.14 нм, которая является промежуточной между простой (0,154 нм) и двойной (0,134 нм) связями.
Таким образом, согласно современным представлениям в бензоле нет типичных двойных связей между углеродами. Следовательно, от такого соединения и не следует ожидать проявления свойств, обусловленных двойными связями. В то же время нельзя отрицать значительной непредельности молекулы бензола. Циклоалкан с шестью углеродами (циклогексан) содержит 12 водородных атомов, в то время как у бензола их всего 6. Отсюда следует, что формально бензол мог бы иметь три двойные связи и в реакциях присоединения вести себя как циклотриен. Действительно, в условиях реакций присоединения бензол присоединяет по три молекулы водорода, галогенов или озона.
В настоящее время в научно-технической литературе используется два графических изображения бензола

Одно из них подчеркивает непредельный характер бензола, а другое – его ароматичность.
Как же увязать строение бензола с его характерными свойствами, главным образом, с его ароматическим характером? Почему бензол проявляет уникальную термодинамическую устойчивость?
В свое время было показано, что алкены довольно легко присоединяют молекулу водорода и превращаются в алканы. Эта реакция протекает с выделением тепла, около 125,61 кДж на каждую двойную связь, и носит название - теплоты гидрирования. Попробуем использовать теплоту гидрирования для оценки термодинамической устойчивости бензола.
Реально существующие циклогексен, циклогексадиен и бензол гидрируются в циклогексан

Теплота гидрирования циклогексена составила 119,75 кДж. Тогда ожидаемое значение для циклогексадиена должно составить 119,75 х 2=239,50 кДж (в действительности 231,96 кДж). Если бы бензол имел три двойные связи (циклогексатриен Кекуле), то теплота гидрирования для него должна была бы быть 119,75 х 3=359,25 кДж. Экспериментальное же значение в последнем случае разительно отличается от ожидаемого. При гидрировании бензола выделяется лишь 208.51 кДж тепла, что меньше ожидаемого значения на 359,25 – 208.51=150,73 кДж. Эта энергия носит название энергии резонанса . Если при гидрировании бензола выделяется на 150,73 кДж меньше энергии от ожидаемого значения, то это означает лишь то, что сам бензол уже изначально содержит на 150,73 кДж меньше энергии, чем гипотетический циклогексатриен. Отсюда следует, что бензол не может иметь строения циклогексатриена. Стабильность молекулы бензола на величину энергии резонанса есть результат отсутствия в ней изолированных двойных связей и наличия единого электронного облака секстета р -электронов.
Приобретая благодаря выгодам своего строения высокую термодинамическую устойчивость, бензол в ходе химических реакций всячески стремится сохранить эту устойчивость. Понятно, что это может быть реализовано только при условии сохранения при химической реакции бензольного кольца в неизменном виде. Такую возможность предоставляют лишь реакции замещения и именно по этой причине для соединений ароматического ряда более характерны реакции замещения, чем присоединения. В ходе реакций электрофильного присоединения ароматическое соединение перестает быть ароматическим, теряет исключительную стабильность вместе с энергией резонанса, обуславливающей как раз эту стабильность. По этой причине ароматические соединения вступают в реакции присоединения гораздо труднее, чем, например, алкены. Другая особенность реакций присоединения с участием ароматических соединений – это их бескомпромиссность. Они либо не вступают в реакции присоединения, либо присоединяют сразу все. Об этом свидетельствует тот факт, что не удается получить из бензола продукты частичного гидрирования или хлорирования. Если уже эти реакции идут, то протекают таким образом, что сразу получаются продукты полного гидрирования или хлорирования

Такое развитие событий связано с тем, что единое электронное облако шести р -электронов у бензола или существует или не существует, промежуточные варианты для него исключены.
Первая группа реакций реакции замещения. Мы говорили, что арены не имеют кратных связей в структуре молекулы, а содержат сопряженную систему из шести электронов, которая очень стабильна и придает дополнительную прочность бензольному кольцу. Поэтому в химических реакциях происходит в первую очередь замещение атомов водорода, а не разрушение бензольного кольца.
С реакциями замещения мы уже сталкивались при разговоре об алканах , но для них эти реакции шли по радикальному механизму, а для аренов характерен ионный механизм реакций замещения.
Первое химическое свойство галогенирование. Замещение атома водорода на атом галогена хлора или брома.
Реакция идет при нагревании и обязательно с участием катализатора. В случае с хлором это может быть хлорид алюминия или хлорид железа три. Катализатор поляризует молекулу галогена, в результате чего происходит гетеролитический разрыв связи и получаются ионы.
Положительно заряженный ион хлора и вступает в реакцию с бензолом.
Если реакция происходит с бромом, то катализатором выступает бромид железа три или бромид алюминия.

Важно отметить, что реакция происходит с молекулярным бромом, а не с бромной водой. С бромной водой бензол не реагирует.
У галогенирования гомологов бензола есть свои особенности. В молекуле толуола метильная группа облегчает замещение в кольце, реакционная способность повышается, и реакция идет в более мягких условиях, то есть уже при комнатной температуре.

Важно отметить, что замещение всегда происходит в орто- и пара-положениях, поэтому получается смесь изомеров.
Второе свойство нитрование бензола, введение нитрогруппы в бензольное кольцо.
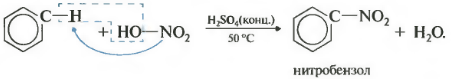
Образуется тяжелая желтоватая жидкость с запахом горького миндаля нитробензол, поэтому реакция может быть качественной на бензол. Для нитрования используется нитрующая смесь концентрированной азотной и серной кислот. Реакция проводится при нагревании.
Напомню, что для нитрования алканов в реакции Коновалова использовалась разбавленная азотная кислота без добавления серной.
При нитровании толуола, также как и при галогенировании, образуется смесь орто- и пара- изомеров.
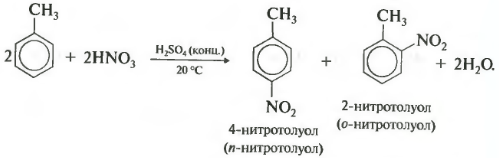
Третье свойство алкилирование бензола галогеналканами.

Эта реакция позволяет ввести углеводородный радикал в бензольное кольцо и может считаться способом получения гомологов бензола. В качестве катализатора используется хлорид алюминия, способствующий распаду молекулы галогеналкана на ионы. Также необходимо нагревание.
Четвертое свойство алкилирование бензола алкенами.

Таким способом можно получить, например, кумол или же этилбензол. Катализатор хлорид алюминия.
2. Реакции присоединения к бензолу
Вторая группа реакций реакции присоединения. Мы говорили, что эти реакции не характерны, но они возможны при достаточно жестких условиях с разрушением пи-электронного облака и образованием шести сигма-связей.
Пятое свойство в общем списке гидрирование, присоединение водорода.
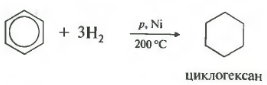
Температура, давление, катализатор никель или платина. Таким же образом способен реагировать толуол.
Шестое свойство хлорирование. Обратите внимание, что речь идет именно о взаимодействии с хлором, поскольку бром в эту реакцию не вступает.

Реакция протекает при жестком ультрафиолетовом облучении. Образуется гексахлорциклогексан, другое название гексахлоран, твердое вещество.
Важно помнить, что для бензола не возможны реакции присоединения галогеноводородов (гидрогалогенирование) и присоединение воды (гидратация).
3. Замещение в боковой цепи гомологов бензола
Третья группа реакций касается только гомологов бензола это замещение в боковой цепи.
Седьмое свойство в общем списке галогенирование по альфа-атому углерода в боковой цепи.

Реакция происходит при нагревании или облучении и всегда только по альфа-углероду. При продолжении галогенирования, второй атом галогена снова встанет в альфа-положение.
4. Окисление гомологов бензола
Четвертая группа реакций окисление.
Бензольное кольцо слишком прочное, поэтому бензол не окисляется перманганатом калия не обесцвечивает его раствор. Это очень важно помнить.
Зато гомологи бензола окисляются подкисленным раствором перманганата калия при нагревании. И это восьмое химическое свойство.
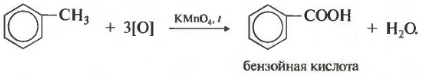
Получается бензойная кислота. Наблюдается обесцвечивание раствора. При этом, какой бы длинной не была углеродная цепь заместителя, всегда происходит ее разрыв после первого атома углерода и альфа-атом окисляется до карбоксильной группы с образованием бензойной кислоты. Оставшаяся часть молекулы окисляется до соответствующий кислоты или, если это только один атом углерода, до углекислого газа.
Если гомолог бензола имеет больше одного углеводородного заместителя у ароматического кольца, то окисление происходит по тем же правилам окисляется углерод, находящийся в альфа-положении.

В данном примере получается двухосновная ароматическая кислота, которая называется фталевая кислота.
Особым образом отмечу окисление кумола, изопропилбензола, кислородом воздуха в присутствии серной кислоты.

Это так называемый кумольный способ получения фенола. Как правило, сталкиваться с этой реакцией приходится в вопросах, касающихся получения фенола. Это промышленный способ.
Девятое свойство горение, полное окисление кислородом. Бензол и его гомологи сгорают до углекислого газа и воды.
Запишем уравнение горения бензола в общем виде.
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле арена, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO 2 . Молекул воды будет в два раза меньше, чем атомов водорода, то есть (2n-6)/2, а значит n-3.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n-3 из воды, итого 3n-3. Слева атомов кислорода столько же 3n-3, а значит молекул в два раза меньше, потому как в состав молекулы входят два атома. То есть (3n-3)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания гомологов бензола в общем виде.
Понятие «бензольное кольцо» сразу требует расшифровки. Для этого необходимо хотя бы коротко рассмотреть строение молекулы бензола. Первая структура бензола была предложена в 1865 г. немецким ученым А. Кекуле:
К наиболее важным ароматическим углеводородам относятся бензол С 6 Н 6 и его гомологи: толуол С 6 Н 5 СН з, ксилол С 6 Н 4 (СН з) 2 и др.; нафталин C 10 H 8 , антрацен С 14 Н 10 и их производные.
Атомы углерода в молекуле бензола образуют правильный плоский шестиугольник, хотя обычно его рисуют вытянутым.
Окончательно строение молекулы бензола подтверждено реакцией образования его из ацетилена. В структурной формуле изображается по три одинарных и три двойных чередующихся углерод-углеродных связей. Но такое изображение не передает истинного строения молекулы. В действительности углерод-углеродные связи в бензоле равноценны, и они обладают свойствами, не похожими на свойства ни одинарных, ни двойных связей. Эти особенности объясняются электронным строением молекулы бензола.
Электронное строение бензола
Каждый атом углерода в молекуле бензола находится в состоянии sp 2 -гибридизации. Он связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. В результате образуется плоский шестиугольник: все шесть атомов углерода и все σ-связи С-С и С-Н лежат в одной плоскости. Электронное облако четвертого электрона (р-электрона), не участвующего в гибридизации, имеет форму гантели и ориентировано перпендикулярно к плоскости бензольного кольца. Такие р-электронные облака соседних атомов углерода перекрываются над и под плоскостью кольца.

В результате шесть р-электронов образуют общее электронное облако и единую химическую связь для всех атомов углерода. Две области большой электронной плоскости расположены по обе стороны плоскости σ-связей.

p-Электронное облако обусловливает сокращение расстояния между атомами углерода. В молекуле бензола они одинаковы и равны 0,14 нм. В случае простой и двойной связи эти расстояния составили бы соответственно 0,154 и 0,134 нм. Значит, в молекуле бензола нет простых и двойных связей. Молекула бензола - устойчивый шестичленный цикл из одинаковых СН-групп, лежащих в одной плоскости. Все связи между атомами углерода в бензоле равноценны, чем и обусловлены характерные свойства бензольного ядра. Наиболее точно это отражает структурная формула бензола в виде правильного шестиугольника с окружностью внутри (I). (Окружность символизирует равноценность связей между атомами углерода.) Однако часто пользуются и формулой Кекуле с указанием двойных связей (II):

Бензольное ядро обладает определенной совокупностью свойств, которую принято называть ароматичностью.
Гомологический ряд, изомерия, номенклатура
Условно арены можно разделить на два ряда. К первому относят производные бензола (например, толуол или дифенил), ко второму - конденсированные (полиядерные) арены (простейший из них - нафталин):

Гомологический ряд бензола имеет общую формулу С n Н 2 n -6 . Гомологи можно рассматривать как производные бензола, в котором один или несколько атомов водорода замещены различными углеводородными радикалами. Например, С 6 Н 5 -СН 3 - метилбензол или толуол, С 6 Н 4 (СН 3) 2 - диметилбензол или ксилол, С 6 Н 5 -С 2 Н 5 - этилбензол и т.д.

Так как в бензоле все углеродные атомы равноценны, то у первого его гомолога - толуола - изомеры отсутствуют. У второго гомолога - диметилбензола - имеются три изомера, отличающиеся взаимным расположением метильных групп (заместителей). Это орто- (сокращенно о-), или 1,2-изомер, в нем заместители находятся у соседних атомов углерода. Если заместители разделены одним атомом углерода, то это мета- (сокращенно м-) или 1,3-изомер, а если они разделены двумя атомами углерода, то это пара- (сокращенно п-) или 1,4-изомер. В названиях заместители обозначаются буквами (о-, м-, п-) или цифрами.

Физические свойства
Первые члены гомологического ряда бензола - бесцветные жидкости со специфическим запахом. Плотность их меньше 1 (легче воды). В воде нерастворимы. Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Арены горят коптящим пламенем ввиду высокого содержания углерода в их молекулах.
Химические свойства
Ароматичность определяет химические свойства бензола и его гомологов. Шестиэлектронная π-система является более устойчивой, чем обычные двухэлектронные π-связи. Поэтому реакции присоединения менее характерны для ароматических углеводородов, чем для непредельных углеводородов. Наиболее характерными для аренов являются реакции замещения. Таким образом, ароматические углеводороды по своим химическим свойствам занимают промежуточное положение между предельными и непредельными углеводородами.
I. Реакции замещения
1. Галогенирование (с Cl 2 , Вr 2)

2. Нитрование

3. Сульфирование

4. Алкилирование (образуются гомологи бензола) - реакции Фриделя-Крафтса

Алкилирование бензола происходит также при его взаимодействии с алкенами:

Дегидрированием этилбензола получают стирол (винилбензол):

II. Реакции присоединения
1. Гидрирование

2. Хлорирование

III. Реакции окисления
1. Горение
2С 6 Н 6 + 15O 2 → 12СO 2 + 6Н 2 O
2. Окисление под действием КМnO 4 , К 2 Сr 2 O 7 , HNO 3 и др.
Не происходит химической реакции (сходство с алканами).
Свойства гомологов бензола
В гомологах бензола различают ядро и боковую цепь (алкильные радикалы). По химическим свойствам алкильные радикалы подобны алканам; влияние бензольного ядра на них проявляется в том, что в реакциях замещения всегда участвуют атомы водорода у атома углерода, непосредственно связанного с бензольным ядром, а также в более легкой окисляемости С-Н связей.

Влияние электронодонорного алкильного радикала (например, -СН 3) на бензольное ядро проявляется в повышении эффективных отрицательных зарядов на атомах углерода в орто- и пара-положениях; в результате облегчается замещение связанных с ними атомов водорода. Поэтому гомологи бензола могут образовывать тризамещенные продукты (а бензол обычно образует монозамещенные производные).
 Получение применение альдегидов и кетонов
Получение применение альдегидов и кетонов Теория упругости лекции. Основы теории упругости. Задача теории упругости
Теория упругости лекции. Основы теории упругости. Задача теории упругости Значение баязид ii в словаре кольера
Значение баязид ii в словаре кольера