Химическая связь. Типы химических связей
Химическая связь
Все взаимодействия, приводящие к объединению химических частиц (атомов, молекул, ионов и т. п.) в вещества делятся на химические связи и межмолекулярные связи (межмолекулярные взаимодействия).
Химические связи - связи непосредственно между атомами. Различают ионную, ковалентную и металлическую связь.
Межмолекулярные связи - связи между молекулами. Это водородная связь, ион-дипольная связь (за счет образования этой связи происходит, например, образование гидратной оболочки ионов), диполь-дипольная (за счет образования этой связи объединяются молекулы полярных веществ, например, в жидком ацетоне) и др.
Ионная связь
- химическая связь, образованная за счет электростатического притяжения разноименно заряженных ионов. В бинарных соединениях (соединениях двух элементов) она образуется в случае, когда размеры связываемых атомов сильно отличаются друг от друга: одни атомы большие, другие маленькие - то есть одни атомы легко отдают электроны, а другие склонны их принимать (обычно это атомы элементов, образующих типичные металлы и атомы элементов, образующих типичные неметаллы); электроотрицательность таких атомов также сильно отличается.
Ионная связь ненаправленная и не насыщаемая.
Ковалентная связь - химическая связь, возникающая за счет образования общей пары электронов. Ковалентная связь образуется между маленькими атомами с одинаковыми или близкими радиусами. Необходимое условие - наличие неспаренных электронов у обоих связываемых атомов (обменный механизм) или неподеленной пары у одного атома и свободной орбитали у другого (донорно-акцепторный механизм):
| а) | H· + ·H H:H | H-H | H 2 | (одна общая пара электронов; H одновалентен); |
| б) | NN | N 2 | (три общие пары электронов; N трехвалентен); | |
| в) | H-F | HF | (одна общая пара электронов; H и F одновалентны); | |
| г) | NH 4 + | (четыре общих пары электронов; N четырехвалентен) |
- По числу общих электронных пар ковалентные связи делятся на
- простые (одинарные) - одна пара электронов,
- двойные - две пары электронов,
- тройные - три пары электронов.
Двойные и тройные связи называются кратными связями.
По распределению электронной плотности между связываемыми атомами ковалентная связь делится на неполярную и полярную . Неполярная связь образуется между одинаковыми атомами, полярная - между разными.
Электроотрицательность
- мера способности атома в веществе притягивать к себе общие электронные пары.
Электронные пары полярных связей смещены в сторону более электроотрицательных элементов. Само смещение электронных пар называется поляризацией связи. Образующиеся при поляризации частичные (избыточные) заряды обозначаются + и -, например: .
По характеру перекрывания электронных облаков ("орбиталей") ковалентная связь делится на -связь и -связь.
-Связь образуется за счет прямого перекрывания электронных облаков (вдоль прямой, соединяющей ядра атомов), -связь - за счет бокового перекрывания (по обе стороны от плоскости, в которой лежат ядра атомов).
Ковалентная связь обладает направленностью и насыщаемостью, а также поляризуемостью.
Для объяснения и прогнозирования взаимного направления ковалентных связей используют модель гибридизации.
Гибридизация атомных орбиталей и электронных облаков
- предполагаемое выравнивание атомных орбиталей по энергии, а электронных облаков по форме при образовании атомом ковалентных связей.
Чаще всего встречается три типа гибридизации: sp
-, sp
2 и sp
3 -гибридизация. Например:
sp
-гибридизация - в молекулах C 2 H 2 , BeH 2 , CO 2 (линейное строение);
sp
2 -гибридизация - в молекулах C 2 H 4 , C 6 H 6 , BF 3 (плоская треугольная форма);
sp
3 -гибридизация - в молекулах CCl 4 , SiH 4 , CH 4 (тетраэдрическая форма); NH 3 (пирамидальная форма); H 2 O (уголковая форма).
Металлическая связь
- химическая связь, образованная за счет обобществления валентных электронов всех связываемых атомов металлического кристалла. В результате образуется единое электронное облако кристалла, которое легко смещается под действием электрического напряжения - отсюда высокая электропроводность металлов.
Металлическая связь образуется в том случае, когда связываемые атомы большие и потому склонны отдавать электроны. Простые вещества с металлической связью - металлы (Na, Ba, Al, Cu, Au и др.), сложные вещества - интерметаллические соединения (AlCr 2 , Ca 2 Cu, Cu 5 Zn 8 и др.).
Металлическая связь не обладает направленностью насыщаемостью. Она сохраняется и в расплавах металлов.
Водородная связь - межмолекулярная связь, образованная за счет частичного акцептирования пары электронов высокоэлектроотрицательнного атома атомом водорода с большим положительным частичным зарядом. Образуется в тех случаях, когда в одной молекуле есть атом с неподеленной парой электронов и высокой электроотрицательностью (F, O, N), а в другой - атом водорода, связанный сильно полярной связью с одним из таких атомов. Примеры межмолекулярных водородных связей:
H—O—H ··· OH 2 , H—O—H ··· NH 3 , H—O—H ··· F—H, H—F ··· H—F.
Внутримолекулярные водородные связи существуют в молекулах полипептидов, нуклеиновых кислот, белков и др.
Мерой прочности любой связи является энергия связи.
Энергия связи
- энергия необходимая для разрыва данной химической связи в 1 моле вещества. Единица измерений - 1 кДж/моль.
Энергии ионной и ковалентной связи - одного порядка, энергия водородной связи - на порядок меньше.
Энергия ковалентной связи зависит от размеров связываемых атомов (длины связи) и от кратности связи. Чем меньше атомы и больше кратность связи, тем больше ее энергия.
Энергия ионной связи зависит от размеров ионов и от их зарядов. Чем меньше ионы и больше их заряд, тем больше энергия связи.
Строение вещества
По типу строения все вещества делятся на молекулярные и немолекулярные . Среди органических веществ преобладают молекулярные вещества, среди неорганических - немолекулярные.
По типу химической связи вещества делятся на вещества с ковалентными связями, вещества с ионными связями (ионные вещества) и вещества с металлическими связями (металлы).
Вещества с ковалентными связями могут быть молекулярными и немолекулярными. Это существенно сказывается на их физических свойствах.
Молекулярные вещества состоят из молекул, связанных между собой слабыми межмолекулярными связями, к ним относятся: H 2 , O 2 , N 2 , Cl 2 , Br 2 , S 8 , P 4 и другие простые вещества; CO 2 , SO 2 , N 2 O 5 , H 2 O, HCl, HF, NH 3 , CH 4 , C 2 H 5 OH, органические полимеры и многие другие вещества. Эти вещества не обладают высокой прочностью, имеют низкие температуры плавления и кипения, не проводят электрический ток, некоторые из них растворимы в воде или других растворителях.
Немолекулярные вещества с ковалентными связями или атомные вещества (алмаз, графит, Si, SiO 2 , SiC и другие) образуют очень прочные кристаллы (исключение - слоистый графит), они нерастворимы в воде и других растворителях, имеют высокие температуры плавления и кипения, большинство из них не проводит электрический ток (кроме графита, обладающего электропроводностью, и полупроводников - кремния, германия и пр.)
Все ионные вещества, естественно, являются немолекулярными. Это твердые тугоплавкие вещества, растворы и расплавы которых проводят электрический ток. Многие из них растворимы в воде. Следует отметить, что в ионных веществах, кристаллы которых состоят из сложных ионов, есть и ковалентные связи, например: (Na +) 2 (SO 4 2-), (K +) 3 (PO 4 3-), (NH 4 +)(NO 3-) и т. д. Ковалентными связями связаны атомы, из которых состоят сложные ионы.
Металлы (вещества с металлической связью) очень разнообразны по своим физическим свойствам. Среди них есть жидкость (Hg), очень мягкие (Na, K) и очень твердые металлы (W, Nb).
Характерными физическими свойствами металлов является их высокая электропроводность (в отличие от полупроводников, уменьшается с ростом температуры), высокая теплоемкость и пластичность (у чистых металлов).
В твердом состоянии почти все вещества состоят из кристаллов. По типу строения и типу химической связи кристаллы ("кристаллические решетки") делят на атомные (кристаллы немолекулярных веществ с ковалентной связью), ионные (кристаллы ионных веществ), молекулярные (кристаллы молекулярных веществ с ковалентной связью) и металлические (кристаллы веществ с металлической связью).
Задачи и тесты по теме "Тема 10. "Химическая связь. Строение вещества"."
- Типы химической связи - Строение вещества 8–9 класс
Уроков: 2 Заданий: 9 Тестов: 1
Определите тип химической связи и запишите схему её образования для веществ с формулами:
а) S 2 , К 2 O и H 2 S;
б) N 2 , Li 3 N и Cl 3 N.
Ответ
В молекуле S 2 связь ковалентная неполярная, т.к. она образована атомами одного и того же элемента. Схема образования связи будет следующей:
Сера — элемент главной подгруппы VI группы. Ее атомы имеют по 6 электронов на внешней оболочке. Непарных электронов будет: 8 − 6 = 2.
В молекуле К 2 O связь ионная, т.к. она образована атомами элементов металла и неметалла.
Калий — элемент I группы главной подгруппы, металл. Его атому легче отдать 1 электрон, чем принять недостающие 7:
K 0 атом − 1e − → K +1 ион
Кислород — элемент главной подгруппы VI группы, неметалл. Его атому легче принять 2 электрона, которых не хватает до завершения уровня, чем отдать 6 электронов:
O 0 атом + 2e − → O -2 ион
Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2(2·1). Чтобы атомы калия отдали 2 электрона, их нужно взять 2, чтобы атомы кислорода смогли принять 2 электрона, необходим только 1 атом:

В молекуле H 2 S связь ковалентная полярная, т.к. она образована атомами элементов с различной ЭО. Схема образования связи будет следующей:
Сера-элемент главной подгруппы VI группы. Ее атомы имеют по 6 электронов на внешней оболочке. Непарных электронов будет: 8 − 6 = 2
Водород — элемент главной подгруппы I группы. Его атомы содержат по 1 электрону на внешней оболочке. Непарным является I электрон (для атома водорода завершенным является двухэлектронный уровень).

Общие электронные пары смещены к атому серы, как более электроотрицательному
![]()
В молекуле N 2 связь ковалентная неполярная, т.к. она образована атомами одного и того же элемента. Схема образования связи следующая:
Азот — элемент главной подгруппы V группы. Его атомы имеют 5 электронов на внешней оболочке. Непарных электронов: 8 − 5 = 3.

В молекуле Li 3 N связь ионная, т.к. она образована атомами элементов металла и неметалла.
Литий — элемент главной подгруппы I группы, металл. Его атому легче отдать 1 электрон, чем принять недостающие 7:
Li 0 атом − 1e − → Li +1 ион
Азот — элемент главной подгруппы У группы, неметалл. Его атому легче принять 3 электрона, которых не хватает до завершения внешнего уровня, чем отдать пять электронов с внешнего уровня:
N 0 атом + 3e − → N -3 ион
Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 3(3·1). Чтобы атомы лития отдали 3 электрона, необходимо 3 атома, чтобы атомы азота смогли принять 3 электрона, необходим только один атом:
![]()
В молекуле NCl 3 связь ковалентная полярная, т.к. она образована атомами элементов-неметаллов с различными значениями ЭО. Схема образования связи следующая:
Азот — элемент главной подгруппы V группы. Его атомы имеют по 5 электронов на внешней оболочке. Непарных электронов будет: 8 − 5 = 3.
Хлор — элемент главной подгруппы VII группы. Его атомы содержат по 7 электронов на внешней оболочке. Непарным остается 1 электрон.

Общие электронные пары смещены к атому азота, как более электроотрицательному:

Химическая связь.
определение химической связи;
типы химических связей;
метод валентных связей;
основные характеристики ковалентной связи;
механизмы образования ковалентной связи;
комплексные соединения;
метод молекулярных орбиталей;
межмолекулярные взаимодействия.
ОПРЕДЕЛЕНИЕ ХИМИЧЕСКОЙ СВЯЗИ
Химической связью называют взаимодействие между атомами, приводящее к образованию молекул или ионов и прочному удерживанию атомов друг около друга.
Химическая связь имеет электронную природу, т. е. осуществляется за счёт взаимодействия валентных электронов. В зависимости от распределения валентных электронов в молекуле, различают следующие виды связей: ионная, ковалентная, металлическая и др. Ионную связь можно рассматривать как предельный случай ковалентной связи между атомами, резко отличающимися по природе.
ТИПЫ ХИМИЧЕСКОЙ СВЯЗИ
Ионная связь.
Основные положения современной теории ионной связи.
Ионная связь образуется при взаимодействии элементов, резко отличающихся друг от друга по свойствам, т. е. между металлами и неметаллами.
Образование химической связи объясняется стремлением атомов к достижению устойчивой восьмиэлектронной внешней оболочки (s 2 p 6).
Ca: 1s 2 2s 2 p 6 3s 2 p 6 4s 2
 Ca 2+ :
1s 2 2s 2 p 6 3s
2
p
6
Ca 2+ :
1s 2 2s 2 p 6 3s
2
p
6
Cl: 1s 2 2s 2 p 6 3s 2 p 5
 Cl – :
1s 2 2s 2 p 6 3s
2
p
6
Cl – :
1s 2 2s 2 p 6 3s
2
p
6
Образовавшиеся разноименно заряженные ионы удерживаются друг около друга за счёт электростатического притяжения.
Ионная связь не направленная.
Чисто ионной связи не существует. Так как энергия ионизации больше энергии сродства к электрону, то полного перехода электронов не происходит даже в случае пары атомов с большой разницей электроотрицательностей. Поэтому можно говорить о доле ионности связи. Наибольшая ионность связи имеет место во фторидах и хлоридах s-элементов. Так, в кристаллахRbCl,KCl,NaClиNaFона равна 99, 98, 90 и 97% соответственно.
Ковалентная связь.
Основные положения современной теории ковалентной связи.
Ковалентная связь образуется между элементами, сходными по свойствам, то есть, неметаллами.
Каждый элемент предоставляет для образования связей 1 электрон, причём спины электронов должны быть антипараллельными.
Если ковалентная связь образована атомами одного и того же элемента, то эта связь не полярная, т. е. общая электронная пара не смещена ни к одному из атомов. Если же ковалентная связь образована двумя разными атомам, то общая электронная пара смещена к наиболее электроотрицательному атому, это полярная ковалентная связь .
При образовании ковалентной связи происходит перекрывание электронных облаков взаимодействующих атомов, в результате, в пространстве между атомами возникает зона повышенной электронной плотности, притягивающая к себе положительно заряженные ядра взаимодействующих атомов, и удерживающая их друг около друга. Вследствие этого снижается энергия системы (рис. 14). Однако при очень сильном сближении атомов возрастает отталкивание ядер. Поэтому имеется оптимальное расстояние между ядрами (длина связи ,l св), при котором система имеет минимальную энергию. При таком состоянии выделяется энергия, называемая энергией связи – Е св.

Рис. 14. Зависимость энергии систем из двух атомов водорода с параллельными (1) и антипараллельными (2) спинами от расстояния между ядрами (Е – энергия системы, Е св – энергия связи,r– расстояние между ядрами,l – длина связи).
Для описания ковалентной связи используют 2 метода: метод валентных связей (ВС) и метод молекулярных орбиталей (ММО).
МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ.
В основе метода ВС лежат следующие положения:
1. Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам. Комбинации таких двухэлектронных двухцентровых связей, отражающие электронную структуру молекулы, получили название валентных схем.
2. Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
Для наглядного изображения валентных схем обычно пользуются следующим способом: электроны, находящиеся во внешнем электронном слое обозначают точками, располагаемыми вокруг химического символа атома. Общие для двух атомов электроны показывают точками, помещаемыми между их химическими символами; двойная или тройная связь обозначается соответственно двумя или тремя парами общих точек:
N:
1s 2 2s
2
p
3
;

C: 1s 2 2s 2 p 4
Из приведенных схем видно, что каждая пара электронов, связывающая два атома, соответствует одной черточке, изображающей ковалентную связь в структурных формулах:

Число общих электронных пар, связывающих атом данного элемента с другими атомами, или, иначе говоря, число образуемых атомом ковалентных связей, называется ковалентностью по методу ВС. Так, ковалентность водорода равна 1, азота – 3.
По способу перекрывания электронных облаков, связи бывают двух видов: - связь и - связь.
- связь возникает при перекрывании двух электронных облаков по оси, соединяющей ядра атомов.
Рис. 15. Схема образования - связей.
- связь образуется при перекрывании электронных облаков по обе стороны от линии, соединяющей ядра взаимодействующих атомов.

Рис. 16. Схема образования - связей.
ОСНОВНЫЕ ХАРАКТЕРИСТИКИ КОВАЛЕНТНОЙ СВЯЗИ.
1. Длина связи, ℓ. Это минимальное расстояние между ядрами взаимодействующих атомов, которое соответствует наиболее устойчивому состоянию системы.
2. Энергия связи, E min – это то количество энергии, которое необходимо затратить для разрыва химической связи и для удаления атомов за пределы взаимодействия.
3. Дипольный момент связи, ,=qℓ.
Дипольный момент служит количественной
мерой полярности молекулы. Для неполярных
молекул дипольный момент равен 0, для
неполярных не равен 0. Дипольный момент
многоатомной молекулы равен векторной
сумме диполей отдельных связей:
,=qℓ.
Дипольный момент служит количественной
мерой полярности молекулы. Для неполярных
молекул дипольный момент равен 0, для
неполярных не равен 0. Дипольный момент
многоатомной молекулы равен векторной
сумме диполей отдельных связей:

4. Ковалентная связь характеризуется направленностью. Направленность ковалентной связи определяется необходимостью максимального перекрывания в пространстве электронных облаков взаимодействующих атомов, которые приводят к образованию наиболее прочных связей.
Так как эти -связи строго ориентированы в пространстве, в зависимости от состава молекулы они могут находиться под определенным углом друг к другу – такой угол называется валентным.
Двухатомные молекулы имеют линейное строение. Многоатомные молекулы имеют более сложную конфигурацию. Рассмотрим геометрию различных молекул на примере образования гидридов.
1. VIгруппа, главная подгруппа (кроме кислорода), Н 2 S, Н 2 Sе, Н 2 Те.
S1s 2 2s 2 р 6 3s 2 р 4
У водорода в образовании связи участвует электрон с s-АО, у серы – 3р у и 3р z . Молекула Н 2 Sимеет плоское строение с углом между связями 90 0 . .

Рис 17. Строение молекулы Н 2 Э
2. Гидриды элементов Vгруппы, главной подгруппы: РН 3 , АsН 3 ,SbН 3 .
Р 1s 2 2s 2 р 6 3s 2 р 3 .
В образовании связи принимают участие: у водорода s-АО, у фосфора - р у, р х и р z АО.
Молекула РН 3 имеет форму тригональной пирамиды (в основании – треугольник).

Рис 18. Строение молекулы ЭН 3
5. Насыщаемость ковалентной связи - это число ковалентных связей, которые может образовывать атом. Оно ограничено, т.к. элемент обладает ограниченным количеством валентных электронов. Максимальное число ковалентных связей, которые может образовывать данный атом в основном или возбуждённом состоянии, называется его ковалентностью.
Пример: водород – одноковалентен, кислород – двухковалентен, азот – трёхковалентен и т. д.
Некоторые атомы могут повышать свою ковалентность в возбуждённом состоянии за счёт разъединения спаренных электронов.
Пример. Be 0 1s 2 2s 2

У атома бериллия в возбужденном состоянии один валентный электрон находится на 2p-АО и один электрон на 2s-АО, то есть ковалентностьBe 0 = 0 а ковалентностьBe* = 2. В ходе взаимодействия происходит гибридизация орбиталей.
Гибридизация - это выравнивание энергии различных АО в результате смешения перед химическим взаимодействием. Гибридизация - условный прием, позволяющий предсказать структуру молекулы при помощи комбинации АО. В гибридизации могут принимать участие те АО, энергии которых близки.
Каждому виду гибридизации соответствует определенная геометрическая форма молекул.
В случае гидридов элементов IIгруппы главной подгруппы в образовании связи участвуют две одинаковыеsр-гибридные орбитали. Подобный тип связи называетсяsр-гибридизация.

Рис 19. Молекула ВеН 2 .sp-Гибридизация.
sp-Гибридные орбитали имеют несимметричную форму, в сторону водорода направлены удлиненные части АО с валентным углом, равным 180 о. Поэтому молекула ВеН 2 имеет линейное строение (рис.).
Строение молекул гидридов элементов IIIгруппы главной подгруппы рассмотрим на примере образования молекулыBH 3 .
B 0 1s 2 2s 2 p 1

Ковалентность B 0 = 1, ковалентностьB* = 3.
В образовании связей принимают участие три sр-гибридные орбитали, которые образуются в результате перераспределения электронных плотностейs-АО и двух р-АО. Такой тип связи называетсяsр 2 - гибридизацией. Валентный угол приsр 2 - гибридизации равен 120 0 , поэтому молекула ВН 3 имеет плоское треугольное строение.

Рис.20. Молекула BH 3 . sp 2 -Гибридизация.
На примере образования молекулы СH 4 рассмотрим строение молекул гидридов элементовIVгруппы главной подгруппы.
C 0 1s 2 2s 2 p 2

Ковалентность C 0 = 2, ковалентностьC* = 4.
У углерода в образовании химической связи участвуют четыре sр-гибридные орбитали, образованные в результате перераспределения электронных плотностей междуs-АО и тремя р-АО. Форма молекулы СН 4 - тетраэдр, валентный угол равен 109 о 28`.

Рис. 21. Молекула СН 4 .sp 3 -Гибридизация.
Исключениями из общего правила являются молекулы Н 2 О иNН 3 .
В молекуле воды углы между связями равны 104,5 о. В отличии от гидридов других элементов этой группы, вода имеет особые свойства, она полярна, диамагнитна. Все это объясняется тем, что в молекуле воды тип связиsр 3 . То есть в образовании химической связи участвуют четыреsр - гибридные орбитали. На двух орбиталях находится по одному электрону, эти орбитали взаимодействуют с водородом, на двух других орбиталях находится по паре электронов. Наличие этих двух орбиталей и объясняет уникальные свойства воды.
В молекуле аммиака углы между связями равны примерно 107,3 о, то есть форма молекулы аммиака - тетраэдр, тип связиsр 3 . В образовании связи у молекулы азота принимает участие четыре гибридныеsр 3 -орбитали. На трех орбиталях находится по одному электрону, эти орбитали связаны с водородом, на четвертой АО находится неподеленная пара электронов, которая обуславливает уникальность молекулы аммиака.
МЕХАНИЗМЫ ОБРАЗОВАНИЯ КОВАЛЕНТНОЙ СВЯЗИ.
МВС позволяет различать три механизма образования ковалентной связи: обменный, донорно-акцепторный, дативный.
Обменный механизм . К нему относят те случаи образования химической связи, когда каждый из двух связываемых атомов выделяет для обобществления по одному электрону, как бы обмениваясь ими. Для связывания ядер двух атомов нужно, чтобы электроны находились в пространстве между ядрами. Эта область в молекуле называется областью связывания (область наиболее вероятного пребывания электронной пары в молекуле). Чтобы произошел обмен не спаренными электронами у атомов необходимо перекрывание атомных орбиталей (рис. 10,11). В этом и заключается действие обменного механизма образования ковалентной химической связи. Атомные орбитали могут перекрываться только в том случае, если они обладают одинаковыми свойствами симметрии относительно межъядерной оси (рис. 10, 11, 22).

Рис. 22. Перекрывание АО, не приводящее к образованию химической связи.
Донорно-акцепторный и дативный механизмы .
Донорно-акцепторный механизм связан с передачей неподеленной пары электронов от одного атома на вакантную атомную орбиталь другого атома. Например, образование иона - :

Вакантная р-АО в атоме бора в молекуле BF 3 акцептирует пару электронов от фторид-иона (донор). В образовавшемся анионе четыре ковалентные связи В-Fравноценны по длине и энергии. В исходной молекуле все три связи В-Fобразовались по обменному механизму.
Атомы, внешняя оболочка которых состоит только из s- или р-электронов, могут быть либо донорами, либо акцепторами неподеленной пары электронов. Атомы, у которых валентные электроны находятся и наd-АО, могут одновременно выступать и в роли доноров, и в роли акцепторов. Чтобы различить эти два механизма ввели понятия дативного механизма образования связи.
Простейший пример проявления дативного механизма - взаимодействие двух атомов хлора.
Два атома хлора в молекуле хлора образуют ковалентную связь по обменному механизму, объединяя свои неспаренные 3р-электроны. Кроме того, атом Сl- 1 передает неподеленную пару электронов 3р 5 - АО атому Сl- 2 на вакантную 3d-АО, а атом Сl- 2 такую же пару электронов на вакантную 3d-АО атома Сl- 1. Каждый атом выполняет одновременно функции акцептора и донора. В этом и есть дативный механизм. Действие дативного механизма повышает прочность связи, поэтому молекула хлора прочнее молекулы фтора.
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ.
По принципу донорно-акцепторного механизма образуется огромный класс сложных химических соединений - комплексные соединения.
Комплексные соединения - это соединения, имеющие в своем составе сложные ионы, способные к существованию как в кристаллическом виде, так и в растворе, включающие центральный ион или атом, связанный с отрицательно заряженными ионами или нейтральными молекулами ковалентными связями, образованными по донорно-акцепторному механизму.
Структура комплексных соединений по Вернеру.
Комплексные соединения состоят из внутренней сферы (комплексный ион) и внешней сферы. Связь между ионами внутренней сферы осуществляется по донорно-акцепторному механизму. Акцепторы называются комплексообразователями, ими часто могут быть положительные ионы металлов (кроме металлов IAгруппы), имеющие вакантные орбитали. Способность к комплексообразованию возрастает с увеличением заряда иона и уменьшением его размера.
Доноры электронной пары называются лигандами или аддендами. Лигандами являются нейтральные молекулы или отрицательно заряженные ионы. Количество лигандов определяется координационным числом комплексообразователя, которое, как правило, равно удвоенной валентности иона-комплексообразователя. Лиганды бывают монодентантными и полидентантными. Дентантность лиганда определяется числом координационных мест, которые лиганд занимает в координационной сфере комплексообразователя. Например, F - - монодентантный лиганд,S 2 O 3 2- - бидентантный лиганд. Заряд внутренней сферы равен алгебраической сумме зарядов составляющих ее ионов. Если внутренняя сфера имеет отрицательный заряд – это анионный комплекс, если положительный – катионный. Катионные комплексы называют по имени иона-комплексообразователя по-русски, в анионных комплексах комплексообразователь называется по-латыни с добавлением суффикса –ат . Связь между внешней и внутренней сферами в комплексном соединении – ионная.
Пример: K 2 – тетрагидроксоцинкат калия, анионный комплекс.
2- - внутренняя сфера
2K + - внешняя сфера
Zn 2+ - комплексообразователь
OH – - лиганды
координационное число – 4
связь между внешней и внутренней сферами ионная:
K 2 = 2K + + 2- .
связь между ионом Zn 2+ и гидроксильными группами – ковалентная, образованная по донорно-акцепторному механизму:OH – - доноры,Zn 2+ - акцептор.
Zn 0: … 3d 10 4s 2
Zn 2+ : … 3d 10 4s 0 p 0 d 0

Типы комплексных соединений :
1. Аммиакаты - лиганды молекулы аммиака.
Cl 2 – хлорид тетраамминмеди (II). Аммиакаты получают действием аммиака на соединения, содержащие комплексообразователь.
2. Гидроксосоединения - лиганды ОН - .
Na – тетрагидроксоалюминат натрия. Получают гидроксокомплексы действием избытка щелочи на гидроксиды металлов, обладающие амфотерными свойствами.
3. Аквакомплексы - лиганды молекулы воды.
Cl 3 – хлорид гексааквахрома (III). Аквакомплексы получают взаимодействием безводных солей с водой.
4. Ацидокомплексы - лиганды анионы кислот – Cl - ,F - ,CN - ,SO 3 2- ,I – ,NO 2 – ,C 2 O 4 – и др.
K 4 – гексацианоферрат (II) калия. Получают взаимодействием избытка соли, содержащей лиганд на соль, содержащую комплексообразователь.
МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ.
МВС
достаточно хорошо объясняет образование
и структуру многих молекул, но этот
метод не универсален. Например, метод
валентных связей не даёт удовлетворительного
объяснения существованию иона
 ,
хотя еще в конце XIX
века было установлено существование
довольно прочного молекулярного иона
водорода
,
хотя еще в конце XIX
века было установлено существование
довольно прочного молекулярного иона
водорода
 :
энергия разрыва связи составляет здесь
2,65эВ. Однако никакой электронной пары
в этом случае образовываться не может,
поскольку в состав иона
:
энергия разрыва связи составляет здесь
2,65эВ. Однако никакой электронной пары
в этом случае образовываться не может,
поскольку в состав иона
 входит всего один электрон.
входит всего один электрон.
Метод молекулярных орбиталей (ММО) позволяет объяснить ряд противоречий, которые нельзя объяснить, используя метод валентных связей.
Основные положения ММО.
При взаимодействии двух атомных орбиталей, образуются две молекулярные орбитали. Соответственно, при взаимодействии n-атомных орбиталей, образуется n-молекулярных орбиталей.
Электроны в молекуле в равной степени принадлежат всем ядрам молекулы.
Из двух образовавшихся молекулярных орбиталей, одна обладает более низкой энергией, чем исходная, это связывающая молекулярная орбиталь , другая обладает более высокой энергией чем исходная, это разрыхляющая молекулярная орбиталь .
В ММО используют энергетические диаграммы без масштаба.
При заполнении энергетических подуровней электронами, используют те же правила, что и для атомных орбиталей:
принцип минимальной энергии, т.е. в первую очередь заполняются подуровни, обладающие меньшей энергией;
принцип Паули: на каждом энергетическом подуровне не может быть больше двух электронов с антипараллельными спинами;
правило Хунда: заполнение энергетических подуровней идёт таким образом, чтобы суммарный спин был максимальным.
Кратность связи. Кратность связи в ММО определяется по формуле:
 ,
когда К p
= 0, связь не образуется.
,
когда К p
= 0, связь не образуется.
Примеры.
1. Может ли существовать молекула Н 2 ?

Рис. 23. Схема образования молекулы водорода Н 2 .
Вывод: молекула Н 2 будет существовать, так как кратность связи Кр > 0.
2. Может ли существовать молекула Не 2 ?

Рис. 24. Схема образования молекулы гелия He 2 .
Вывод: молекула Не 2 не будет существовать, так как кратность связи Кр = 0.
3. Может ли существовать частица Н 2 + ?

Рис. 25. Схема образования частицы Н 2 + .
Частица Н 2 + может существовать, так как кратность связи Кр > 0.
4. Может ли существовать молекула О 2 ?

Рис. 26. Схема образования молекулы О 2 .
Молекула О 2 существует. Из рис.26 следует, что у молекулы кислорода имеется два неспаренных электрона. За счет этих двух электронов молекула кислорода парамагнитна.
Таким образом метод молекулярных орбиталей объясняет магнитные свойства молекул.
МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ.
Все межмолекулярные взаимодействия можно разделить на две группы: универсальные испецифические . Универсальные проявляются во всех молекулах без исключения. Эти взаимодействия часто называютсвязью или силами Ван-дер-Ваальса . Хотя эти силы слабые (энергия не превышает восемь кДж/моль), они являются причиной перехода большинства веществ из газообразного состояния в жидкое, адсорбции газов поверхностями твердых тел и других явлений. Природа этих сил электростатическая.
Основные силы взаимодействия:
1). Диполь – дипольное (ориентационное) взаимодействие существует между полярными молекулами.
Ориентационное взаимодействие тем больше, чем больше дипольные моменты, меньше расстояния между молекулами и ниже температура. Поэтому чем больше энергия этого взаимодействия, тем до большей температуры нужно нагреть вещество, чтобы оно закипело.
2). Индукционное взаимодействие осуществляется, если в веществе имеется контакт полярных и неполярных молекул. В неполярной молекуле индуцируется диполь в результате взаимодействия с полярной молекулой.
Cl + - Cl - … Al + Cl - 3
Энергия этого взаимодействия возрастает с увеличением поляризуемости молекул, то есть способности молекул к образованию диполя под воздействием электрического поля. Энергия индукционного взаимодействия значительно меньше энергии диполь-дипольного взаимодействия.
3). Дисперсионное взаимодействие – это взаимодействие неполярных молекул за счет мгновенных диполей, возникающих за счет флуктуации электронной плотности в атомах.
В ряду однотипных веществ дисперсионное взаимодействие возрастает с увеличением размеров атомов, составляющих молекулы этих веществ.
4) Силы отталкивания обусловлены взаимодействием электронных облаков молекул и проявляются при их дальнейшем сближении.
К специфическим межмолекулярным взаимодействиям относятся все виды взаимодействий донорно-акцепторного характера, то есть, связанные с переносом электронов от одной молекулы к другой. Образующаяся при этом межмолекулярная связь обладает всеми характерными особенностями ковалентной связи: насыщаемостью и направленностью.
Химическая связь, образованная положительно поляризованным водородом, входящим в состав полярной группы или молекулы и электроотрицательным атомом другой или той же молекулы, называется водородной связью. Например, молекулы воды можно представить следующим образом:

Сплошные черточки – ковалентные полярные связи внутри молекул воды между атомами водорода и кислорода, точками обозначены водородные связи. Причина образования водородных связей состоит в том, что атомы водорода практически лишены электронных оболочек: их единственные электроны смещены к атомам кислорода своих молекул. Это позволяет протонам, в отличие от других катионов, приближаться к ядрам атомов кислорода соседних молекул, не испытывая отталкивания со стороны электронных оболочек атомов кислорода.
Водородная связь характеризуется энергией связи от 10 до 40 кДж/моль. Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, т.е. их ассоциацию в димеры или полимеры, которые в ряде случаев существуют не только в жидком состоянии вещества, но сохраняются и при переходе его в пар.
Например, фтороводород в газовой фазе существует в виде димера.

В сложных органических молекулах существуют как межмолекулярные водородные связи так и внутримолекулярные водородные связи.

Молекулы с внутримолекулярными водородными связями не могут вступать в межмолекулярные водородные связи. Поэтому вещества с такими связями не образуют ассоциатов, более летучи, имеют более низкие вязкости, температуры плавления и кипения, чем их изомеры, способные образовывать межмолекулярные водородные связи.
Часть I
1. Связь между атом-ионами в металлах и сплавах за счёт обобществлённых внешних электронов называется металлической.
2. Схема образования металлической связи:
3. Заполните таблицу «Типы химической связи».

Часть II
1. Установите соответствие между типом химической связи и формулами веществ. Из букв, соответствующих правильным ответам, вы составите название первого металлического сплава, который использовал человек: бронза.

2. Из ряда формул веществ:
- выберите те, которые соответствуют электронной формуле вещества, представленной в общем виде.

3. Напишите формулы веществ, образованных элементами 2-го периода с помощью всех типов химической связи.
Запишите схемы образования веществ с ионной и ковалентной полярной химической связью.

4. Исключите «лишнее».

5. Верны ли следующие утверждения?
А. Природа любой химической связи электростатическая.
Б. В одном веществе может быть только один вид химической связи.
4) оба суждения неверны
6. Между атомами элементов с порядковыми номерами 11 и 9 образуется химическая связь:
1) ионная
7. Верны ли следующие суждения?
А. Химический элемент кальций образует вещества, в которых наблюдаются все типы химических связей.
Б. Вещество кальций Са и нитрид кальция Ca3N2 образованы соответственно с помощью металлической и ковалентной неполярной связей.
4) оба суждения неверны
Типы химической связи.
Ионная связь
8 класс
Являяcь многие годы вашим подписчиком, всегда с интересом знакомлюсь с публикациями разработок уроков, внеклассных мероприятий, дидактических материалов. Из многих публикаций удается почерпнуть интересные идеи, на основе которых разрабатываю собственные уроки.
Имея возможность самостоятельно определять последовательность изучения материала в курсе химии, после изучения темы «Периодический закон и периодическая система химических элементов Д.И.Менделеева на основе строения атомов» считаю необходимым изучение материала по теме «Строение вещества». Рассмотрение темы «Строение вещества» в 8-м классе позволяет на более глубоком уровне изучать последующие темы курса, например «Галогены», «Щелочные металлы» и др.
Предлагаю вашему вниманию разработку урока по теме «Ионная связь». Урок построен таким образом, чтобы учащиеся, повторив ранее изученный материал, успешно освоили новый. Надеюсь, что разработка урока будет полезна коллегам – учителям химии, позволит сделать уроки интересными, организовать самостоятельную творческую работу ребят.
Задачи урока. Образовательные: повторение, коррекция и закрепление знаний по теме «Строение атомов»; закрепление понятий «электроотрицательность», «ковалентная полярная связь» и «ковалентная неполярная связь»; введение понятий «ионы», «ионная связь»; изучение нового типа химической связи – ионной связи, ее природы и условий образования; обучение навыкам сравнения схем строения нейтральных атомов и ионов.
Развивающие: развитие навыков составления электронных схем образования химических связей, соединений с ионным типом связи и определения количества электронов в ионах; развитие умений определения типа связи на основании анализа состава химического соединения.
Оборудование. Периодическая система химических элементов, карточки с формулами веществ (H 2 O, Br 2 , CO 2 , O 3 , HCl, HNO 3 , P 4 , CS 2 , H 2 SO 4 , S 8), раздаточные материалы, цветные сигнальные карточки с цифрами: красная – 1, синяя – 2, фиолетовая – 3.
Тип урока. Комбинированный (80 мин.)
ХОД УРОКА
Повторение ранее изученного материала
Учитель. Сегодня нам с вами предстоит покорить одну из важнейших вершин науки химии – вершину «Химическая связь». Чтобы начать восхождение, нужно к нему подготовиться, собрать рюкзаки, в которые сложить все необходимые знания. Для начала посмотрим, как вы это делаете самостоятельно.
Собираем рюкзаки. Учащимся предлагается выполнить самостоятельную работу с последующей самопроверкой. Самостоятельная работа решает задачу актуализации знаний, играет роль входной диагностики (определение готовности учащихся к дальнейшей работе по теме).
Задание учащиеся получают на карточках. Два ученика с хорошим уровнем подготовки работают за отдельным столом, выполняя работу маркерами на листах формата А4. По окончании работы они вывешивают их на доску. Два хорошо подготовленных ученика комментируют выполненную работу, отвечают на уточняющие вопросы учителя и одноклассников. Остальные ученики класса проверяют свою работу самостоятельно, по ходу комментирования.
Ученики, выполнившие работу и прокомментировавшие ее, получают оценки.
Самостоятельная работа
Задание 1. По электронной формуле определите положение элемента в периодической системе, назовите его.
В а р и а н т I. 1s 2 2s 2 2p 6 3s 2 3p 4 .
В а р и а н т II. 1s 2 2s 1 .
Задание 2. Исходя из положения элементов в периодической системе, сравните их электроотрицательность и поставьте между ними знак <, >, =.
В а р и а н т I.
1) ЭО (Br) * ЭО (Li);
2) ЭО (Al) * ЭО (Cl);
3) ЭО (S) * ЭО (O).
В а р и а н т II.
1) ЭО (Mg) * ЭО (F);
2) ЭО (C) * ЭО (O);
3) ЭО (I) * ЭО (Cl).
Задание 3. Определите количество электронов на внешнем уровне в атомах.
В а р и а н т I. Cl, K, P.
В а р и а н т II. Ca, S, F.
Задание 4. Определите, сколько электронов не хватает каждому атому до завершения внешнего уровня.
В а р и а н т I. C, S, Cl.
В а р и а н т II. O, P, I.
Задание 5. Закончите предложение.
В а р и а н т I. Ковалентная неполярная связь образуется между …………………. .
В а р и а н т II. Ковалентная полярная связь образуется между …………………… .
Ответы к самостоятельной работе
Задание 1.
В а р и а н т I. Электронная формула 1s 2 2s 2 2p 6 3s 2 3p 4 соответствует атому серы. Элемент находится в 3-м периоде в VI группе.
В а р и а н т II. Электронная формула 1s 2 2s 1 соответствует атому лития. Элемент находится во 2-м периоде в I группе.
Задание 2.
В а р и а н т I.
1) ЭО (Br) > ЭО (Li);
2) ЭО (Al) < ЭО (Cl);
3) ЭО (S) < ЭО (O).
В а р и а н т II.
1) ЭО (Mg) < ЭО (F);
2) ЭО (C) < ЭО (O);
3) ЭО (I) < ЭО (Сl).
Задание 3.
В а р и а н т I. Cl – 7, K – 1, P – 5.
В а р и а н т II. Ca – 2, S – 6, F – 7.
Задание 4.
В а р и а н т I. C – 4, S – 2, Cl – 1.
В а р и а н т II. O – 2, P – 3, I – 1.
Задание 5.
В а р и а н т I. Ковалентная неполярная связь образуется между атомами с одинаковой электроотрицательностью, например между атомами одного химического элемента-неметалла.
В а р и а н т II. Ковалентная полярная связь образуется между атомами, у которых электроотрицательность отличается незначительно, между разными атомами химических элементов-неметаллов.
Учитель. Задание выполнено хорошо, однако некоторые ребята допустили ошибки. Давайте еще раз повторим основные понятия и проверим умения составлять электронные схемы образования ковалентной связи, чтобы наш рюкзак был собран правильно.
1-я группа. Учащиеся, выполнившие самостоятельную работу без ошибок (по результатам самопроверки), выполняют проверочную работу на оценку.
Ц е л ь. Применение знаний в новой ситуации.
Проверочная работа
В а р и а н т I.
1. Составьте формулы веществ, состоящих из двух элементов, электронные формулы атомов которых: а) 1s 2 2s 2 2p 3 ; б) 1s 1 . Укажите тип химической связи в этих молекулах и составьте электронные схемы ее образования.
2. На основании положения элементов в периодической системе расположите их в порядке возрастания электроотрицательности их атомов:
а) S, Cl, O, K; б) F, P, Сa, N.
В а р и а н т II.
1. Составьте формулы возможных веществ, состоящих из двух элементов, электронные формулы атомов которых: а) 1s 2 2s 2 2p 6 3s 2 3p 4 ; б) 1s 1 . Укажите тип химической связи в этих молекулах и составьте электронные схемы ее образования.
2. На основании положения элементов в периодической системе расположите их в порядке возрастания электроотрицательности их атомов: а) Cl, I, Li, Al; б) C, N, Si, Ba.
2-я группа. Учащиеся, допустившие ошибки, составляют рассказ, заполняя пропуски предложенными словами и фразами. В случае затруднения пользуются учебником, записями в тетради.
Ц е л ь. Повторение, коррекция и закрепление знаний.
Клише рассказа
В периодической системе элементы расположены по группам и периодам. Общее количество электронов в атоме равно …........ . Номер периода соответствует...… . Номер группы показывает ………. . Завершенный внешний уровень содержит …........ .
Электроотрицательность – это способность атомов притягивать к себе электроны от других атомов. В периодах слева направо электроотрицательность …..….... , в главных подгруппах сверху вниз – …................ .
Ковалентная неполярная связь образуется между ……..….... . Ковалентная полярная связь образуется между…............ .
С л о в а и ф р а з ы:
1) между атомами одного химического элемента-неметалла,
2) число электронов на внешнем уровне элементов главных подгрупп,
3) увеличивается,
4) порядковому номеру элемента,
5) восемь электронов,
6) уменьшается,
7) количеству энергетических уровней,
8) между разными атомами химических элементов-неметаллов.
1-я группа сдает работы на проверку учителю, оценки будут объявлены на следующем уроке.
2-я группа проверяет свои работы при прослушивании ответа одного из учеников. При необходимости даются пояснения.
Ответы на проверочную работу
1-я группа В а р и а н т I.
1. Электронные формулы соответствуют: а) 1s 2 2s 2 2p 3 – атому азота; б) 1s 1 – атому водорода. Эти элементы образуют следующие соединения – N 2 , H 2 , NH 3 . В молекулах N 2 , H 2 – ковалентная неполярная связь; в молекуле NH 3 – ковалентная полярная связь.
2. На основании положения элементов в периодической системе электроотрицательность возрастает в следующем порядке: а) K, S, Cl, O; б) Ca, P, N, F.
В а р и а н т II.
1. Электронные формулы соответствуют а) 1s 2 2s 2 2p 6 3s 2 3p 4 – атому серы; б) 1s 1 – атому водорода. Эти элементы образуют следующие соединения: S 2 , H 2 , Н 2 S. В молекулах S 2 , H 2 – ковалентная неполярная связь; в молекуле Н 2 S – ковалентная полярная связь.
Электронные схемы образования.
S 2 * :
Н 2 S:
2. На основании положения элементов в периодической системе электроотрицательность возрастает в следующем порядке: а) Li, Al, I, Cl; б) Ba, Si, C, N.
2-я группа В периодической системе элементы расположены по группам и периодам. Общее количество электронов в атоме равно порядковому номеру элемента . Номер периода соответствует количеству энергетических уровней. Номер группы показывает число электронов на внешнем уровне для элементов главных подгрупп. Завершенный внешний уровень содержит восемь электронов.
Электроотрицательность – это способность атомов притягивать к себе электроны от других атомов. В периодах слева направо электроотрицательность увеличивается, в главных подгруппах сверху вниз – уменьшается .
Ковалентная неполярная связь образуется между атомами одного химического элемента-неметалла. Ковалентная полярная связь образуется между разными атомами химических элементов-неметаллов.
Учитель. Итак, рюкзаки собраны, начинаем наше восхождение. Однако в пути нас поджидают препятствия. И первое препятствие – «водопад» веществ.
На доске картина с изображением водопада. На водопаде прикреплены карточки с химическими формулами: H 2 O, Br 2 , CO 2 , O 3 , HCl, HNO 3 , P 4 , CS 2 , H 2 SO 4 , S 8 .
Задание. Чтобы преодолеть водопад, предлагается распределить вещества по типам химической связи.
В а р и а н т I. Выписать в тетрадь вещества с ковалентной полярной связью.
В а р и а н т II. Выписать вещества с ковалентной неполярной связью.
Проверка осуществляется фронтально.
Ответ . Вещества с ковалентной полярной связью – H 2 O, CO 2 , HCl, HNO 3 ,CS 2 , H 2 SO 4 .
Вещества с ковалентной неполярной связью – Br 2 , O 3 , P 4 , S 8 .
Учитель. Замечательно, мы успешно преодолели водопад, но впереди нас поджидает новое препятствие. На узкой горной тропе образовался «завал» из электронных схем.
Задание. Определить, какая из схем правильно отражает механизм образования химической связи.
В а р и а н т I. OF 2

В а р и а н т II. BCl 3

Электронные схемы написаны на обратной стороне доски. У каждого учащегося три цветные сигнальные карты с номерами. Учащиеся поднимают карточки с номером правильного ответа. Если допущены ошибки, проводится коррекционная работа.
Учитель. Молодцы, нам удалось пройти по узкой горной тропе, и мы продолжаем восхождение. Внимание! Впереди возникла пещера. Любопытные альпинисты обнаружили в ней интересную находку – ларчик и загадочное письмо.
Продолжить путешествие мы сможем только тогда, когда отгадаем, что находится в этом ларчике. Что ж, давайте остановимся на привал и прочитаем письмо.
На столе учителя «ларчик», запечатанный сургучной печатью. Рядом с ним свернутое письмо. Ученику предлагается прочитать письмо.
Ученик (читает текст письма). Из вещества, спрятанного в этой коробке, можно получить металл, который легко режется ножом, мнется как пластилин и хранится только под слоем керосина. Из него можно также получить удушливый и ядовитый газ желто-зеленого цвета, который используют для обеззараживания воды. Но обычно мы используем это вещество иначе. Оно в каждом доме, на каждом столе. В древние времена говорили, что оно дороже золота, поскольку без золота можно прожить, а без него нельзя. По русскому обычаю дорогих гостей встречают этим веществом, тем самым желают им здоровья, а просыпать его – значит потерять здоровье, потерпеть неудачу.
Учитель. О каком таинственном веществе идет речь в письме? Какие вещества из него получают?
Учащиеся угадывают вещество, дают ему химическое название – поваренная соль, хлорид натрия. Указывают, что из него можно получить металлический натрий и газообразный хлор. Из «ларчика» достается образец минерала, показывается учащимся.
Учитель. Какое отношение это вещество имеет к нашему уроку?
Ученик. Поскольку мы изучаем тему «Химическая связь», то необходимо выяснить, как она образуется между атомами в хлориде натрия и к какому типу ее следует отнести.
Изучение нового материала
Учитель. Молодцы. Цель нашего урока – познакомиться с новым типом химической связи – ионной, выяснить ее природу и условия образования. Мы научимся строить электронные схемы образования соединений с ионным типом химической связи, определять общее количество электронов в ионах.
Тема урока и формула поваренной соли записываются в тетрадь.
Учитель. Рассмотрим на примере хлорида натрия образование ионной связи. Запишем уравнение, отражающее взаимодействие атомов натрия и хлора:
Составьте самостоятельно в тетрадях схемы строения атомов натрия и хлора. Определите число спаренных и неспаренных электронов на последнем уровне в атомах.
Na +11 1s 2 2s 2 2p 6 3s 1 ;
Сl +17 1s 2 2s 2 2p 6 3s 2 3p 5 .
Атомы натрия и хлора имеют по одному неспаренному электрону. При сближении этих атомов до определенного расстояния происходит перекрывание электронных облаков неспаренных электронов и образуется общее для двух атомов электронное облако. Но поскольку электроотрицательность хлора намного больше, чем натрия, то общая электронная пара полностью смещается к атому хлора. В результате перехода электрона от атома натрия к атому хлора появляются противоположно заряженные частицы: атом хлора приобретает отрицательный заряд, атом натрия – положительный.
(Вводится понятие «ион», «ионная связь», определения записываются в тетрадь.)
Частицы, которые образуются в результате перехода электронов от одного атома к другому, называются ионами .
![]()
Na 0 – 1e -> Na 1+ , Cl 0 + 1e -> Cl 1– .
Заряд иона определяется количеством отданных или принятых электронов. Отрицательно заряженный ион заключается в квадратные скобки.
Химическая связь, которая возникает между ионами в результате электростатического взаимодействия, называется ионной .
Давайте рассмотрим схемы строения ионов натрия и хлора и определим общее количество электронов в каждом ионе:
Na 1+ +11 , 1s 2 2s 2 2p 6 3s 0 (10 электронов );
Cl 1– +17 , 1s 2 2s 2 2p 6 3s 2 3p 6 (18 электронов ).
Проверим наши главные выводы .
Ионы – это заряженные частицы, в которые превратились атомы в результате отдачи или присоединения электронов.
Связь, которая возникает в результате электростатического взаимодействия между ионами, называется ионной.
Ионная связь возникает между атомами металлов и неметаллов , электороотрицательность которых сильно отличается (более чем на две единицы). Ионная связь – это крайний случай ковалентной полярной связи.
В пути наш багаж знаний пополнился. Продолжим движение к вершине. Но неожиданно возникает новая преграда. Впереди густые «заросли» из химических формул, через которые можно пробраться, если удалить вещества с ионным типом химической связи.
На доске написаны формулы:
СCl 4 , Na 2 SO 4 , I 2 , LiBr, F 2 , CaCl 2 , KI, Na 2 S, Mg(NO 3) 2 , SO 2 , Cl 2 , BaO, I 2 , N 2 , MgS.
Учащимся предлагается выписать в тетрадь соединения с ионным типом связи.
Проверка фронтальная. Один ученик зачитывает формулы, которые записал в тетрадь, остальные ученики – проверяют. Учителем даются пояснения по веществам, состоящим из трех химических элементов и имеющим два вида связи.
Ответ. Na 2 SO 4 , LiBr, CaCl 2 , KI, Na 2 S, Mg(NO 3) 2 , BaO, MgS.
Учитель. Нам удалось проложить тропинку сквозь густые заросли, мы очень близки к цели. Давайте соберем все наши знания и поднимемся на вершину.
Под руководством учителя закрепляется умение составлять схемы образования ионной связи, определять заряды ионов, количество электронов в ионах на примере соединений: а) KF; б) Na 2 S; в) BeO.

Далее учащиеся выполняют подобную работу самостоятельно, выбрав из предложенных формул две любые: а) LiBr; б) CaCl 2 ; в) MgS; г) Мg 3 N 2 *. Одновременно у доски работают три ученика. Задание со звездочкой (*) на данном уроке не объясняется и не проверяется, объяснение будет дано на заседании химического кружка.
Проверка результатов проводится фронтально.
Закрепление материала
Учитель. Мы проделали трудный, но интересный путь, вершина «Химическая связь» покорена. Я поздравляю вас, вы приложили много усилий, чтобы ее достичь, показали ваши знания, проявили находчивость, были дружными, помогали друг другу в трудный момент. А теперь пора в обратный путь.
Учащимся предлагается выполнить проверочную работу. Ц е л ь: оперативный контроль знаний. Результаты выполнения будут использованы при планировании индивидуальной коррекционной работы с учащимися.
Проверочная работа
1. Определите количество электронов на внешнем уровне в атомах.
В а р и а н т I. F, B, Ca.
В а р и а н т II. Se, Al, C.
2. Укажите количество электронов, которое примет атом для завершения своего внешнего уровня.
В а р и а н т I. S, P, Si.
В а р и а н т II. F, N, O.
3. Укажите тип химической связи в соединениях.
В а р и а н т I. CH 4 , K 2 O, F 2 .
В а р и а н т II. PCl 3 , O 3 , Al 2 O 3 .
4. Составьте электронные схемы образования химической связи, укажите заряды ионов и определите количество электронов в каждом виде атомов и ионов.
В а р и а н т I. а) KBr; б) AlCl 3 .
В а р и а н т II. а) MgI 2 ; б) NaBr.
Заполните таблицу.
Таблица
| Атом | Количество электронов | Ион | Количество электронов |
| … | …………… | … | ………… |
| … | …………… | … | ………… |
| … | …………… | … | ………… |
| … | …………… | … | ………… |
5*. Проанализируйте рисунок и впишите недостающие формулы.

Ответы к проверочной работе
Задание 1.
В а р и а н т I. F – 7, B – 3, Ca – 2.
В а р и а н т II. Se – 6, Al – 3, C – 4.
Задание 2.
В а р и а н т I. S – 2, P – 3, Si – 4.
В а р и а н т II. F – 1, N – 3, O – 2.
Задание 3.
В а р и а н т I. В соединениях: CH 4 – ковалентная полярная химическая связь, K 2 O – ионная связь, F 2 – ковалентная неполярная связь.
В а р и а н т II. В соединениях: PCl 3 – ковалентная полярная связь, O 3 – ковалентная неполярная связь, Al 2 O 3 – ионная связь.
Задание 4.
В а р и а н т I.
а) Для KBr:
K 0 – 1e -> K 1+ , Br 0 + 1e -> Br 1– .
б) Для AlCl 3:
Al 0 – 3e -> Al 3+ , Cl 0 + 1e -> Cl 1– .
Атом Количество электронов Ион Количество электронов Al 0 13 Al 3+ 10 Cl 0 17 Cl 1– 18 K 0 19 K 1+ 18 Br 0 35 Br 1– 36 В а р и а н т II.
а) Для MgF 2:
Mg 0 – 2e -> Mg 2+ , F 0 + 1e -> F 1– .
б) Для NaBr:
Na 0 – 1e -> Na 1+ , Br 0 + 1e -> Br 1– .
Атом Количество электронов Ион Количество электронов Mg 0 12 Mg 2+ 10 I 0 53 I 1– 54 Na 0 11 Na 1+ 10 Br 0 35 Br 1– 36 Задание 5* (рассматривается на заседании химического кружка).
Ответы могут быть следующие: KCl, KH, Na 2 O, NaCl (могут быть и другие соединения металлов с приведенными в центральной части рисунка неметаллами, т.е. соединения с ионной связью).
Подведение итогов.
Выставление оценок.
Домашнее задание. Гузей Л.С. Химия. Вопросы. Задачи. Упражнения. 8–9 классы. § 18.3, упр. 1, 2, 3 – письменно.
* Двухатомные молекулы S 2 образуются при нагревании паров серы до высокой температуры. – Прим. ред.

 Метрическая таблица. Метрическая система мер. Устройство международной системы единиц СИ
Метрическая таблица. Метрическая система мер. Устройство международной системы единиц СИ Воинские звания на флоте по возрастанию
Воинские звания на флоте по возрастанию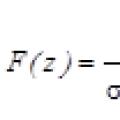 Сборник лабораторных работ по информатике
Сборник лабораторных работ по информатике