Химические свойства. Получение
Получение карбоновых кислот
I . В промышленности
1. Выделяют из природных продуктов
(жиров, восков, эфирных и растительных масел)
2. Окисление алканов:
2CH 4 + + 3O 2 t,kat → 2HCOOH + 2H 2 O
метанмуравьиная кислота
2CH 3 -CH 2 -CH 2 -CH 3 + 5O 2 t,kat,p →4CH 3 COOH + 2H 2 O
н-бутануксусная кислота
3. Окисление алкенов:
CH 2 =CH 2 + O 2 t,kat → CH 3 COOH
этилен
СH 3 -CH=CH 2 + 4[O] t,kat → CH 3 COOH + HCOOH (уксусная кислота+муравьиная кислота )
4. Окисление гомологов бензола (получение бензойной кислоты):
C 6 H 5 -C n H 2n+1 + 3n[O] KMnO4,H+ → C 6 H 5 -COOH + (n-1)CO 2 + nH 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 -COOH + 3K 2 SO 4 + 6MnSO 4 + 14H 2 O
толуолбензойная кислота
5.Получение муравьиной кислоты:
1 стадия: CO + NaOH t , p →HCOONa ( формиат натрия – соль )
2 стадия : HCOONa + H 2 SO 4 → HCOOH + NaHSO 4
6. Получение уксусной кислоты:
CH 3 OH + CO t,p →CH 3 COOH
Метанол
II . В лаборатории
1. Гидролиз сложных эфиров:
2. Из солей карбоновых кислот :
R-COONa + HCl → R-COOH + NaCl
3. Растворением ангидридов карбоновых кислот в воде:
(R-CO) 2 O + H 2 O → 2 R-COOH
4. Щелочной гидролиз галоген производных карбоновых кислот:

III . Общие способы получения карбоновых кислот
1. Окисление альдегидов:
R-COH + [O] → R-COOH
Например, реакция «Серебряного зеркала» или окисление гидроксидом меди (II ) – качественные реакции альдегидов
2. Окисление спиртов:
R-CH 2 -OH + 2[O] t,kat → R-COOH + H 2 O
3. Гидролиз галогензамещённых углеводородов, содержащих три атома галогена у одного атома углерода.

4. Из цианидов (нитрилов) – способ позволяет наращивать углеродную цепь:
СH 3 -Br + Na-C≡N → CH 3 -CN + NaBr
CH 3 -CN - метилцианид (нитрил уксусной кислоты)
СH 3 -CN + 2H 2 O t → CH 3 COONH 4
ацетат аммония
CH 3 COONH 4 + HCl → CH 3 COOH + NH 4 Cl
5. Использование реактива Гриньяра
R-MgBr + CO 2 →R-COO-MgBr H2O → R-COOH + Mg(OH)Br
ПРИМЕНЕНИЕ КАРБОНОВЫХ КИСЛОТ
Муравьиная кислота – в медицине - муравьиный спирт (1,25% спиртовой раствор муравьиной кислоты), в пчеловодстве, в органическом синтезе, при получении растворителей и консервантов; в качестве сильного восстановителя.
Уксусная кислота – в пищевой и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров). В домашнем хозяйстве как вкусовое и консервирующее вещество.
Масляная кислота – для получения ароматизирующих добавок, пластификаторов и флотореагентов.
Щавелевая кислота – в металлургической промышленности (удаление окалины).
Стеариновая C 17 H 35 COOH и пальмитиновая кислота C 15 H 31 COOH – в качестве поверхностно-активных веществ, смазочных материалов в металлообработке.
Олеиновая кислота C 17 H 33 COOH – флотореагент и собиратель при обогащении руд цветных металлов.
Отдельные представители
одноосновных предельных карбоновых кислот
Муравьиная кислота
впервые была
выделена в XVII веке из красных лесных муравьев. Содержится также в соке жгучей
крапивы. Безводная муравьиная кислота – бесцветная жидкость с острым запахом и
жгучим вкусом, вызывающая ожоги на коже. Применяется в текстильной
промышленности в качестве протравы при крашении тканей, для дубления кож, а
также для различных синтезов.
Уксусная
кислота
широко распространена в природе – содержится в выделениях
животных (моче, желчи, испражнениях), в растениях (в зеленых листьях).
Образуется при брожении, гниении, скисании вина, пива, содержится в кислом
молоке и сыре. Температура плавления безводной уксусной кислоты + 16,5°C,
кристаллы ее прозрачны как лед, поэтому ее называют ледяной уксусной кислотой.
Впервые получена в конце XVIII века русским ученым Т. Е. Ловицем. Натуральный
уксус содержит около 5% уксусной кислоты. Из него приготовляют уксусную
эссенцию, используемую в пищевой промышленности для консервирования овощей,
грибов, рыбы. Уксусная кислота широко используется в химической промышленности
для различных синтезов.
Представители ароматических и непредельных карбоновых кислот
Бензойная кислота
C
6 H
5 COOH
- наиболее важный представитель
ароматических кислот. Распространена в природе в растительном мире: в
бальзамах, ладане, эфирных маслах. В животных организмах она содержится в
продуктах распада белковых веществ. Это кристаллическое вещество, температура
плавления 122°C, легко возгоняется. В холодной воде растворяется плохо. Хорошо
растворяется в спирте и эфире.
Ненасыщенные непредельные кислоты с одной двойной связью в молекуле имеют общую формулу C n H 2 n -1 COOH .
Высокомолекулярные непредельные кислоты
часто
упоминаются диетологами (они называют их ненасыщенными). Самая распространенная
из них – олеиновая
СН 3 –(СН 2) 7 –СН=СН–(СН 2) 7 –СООН
или C
17 H
33 COOH
. Она представляет собой бесцветную жидкость,
затвердевающую на холоде.
Особенно важны полиненасыщенные кислоты с несколькими двойными связями: линолевая
СН 3 –(СН 2) 4 –(СН=СН–СН 2) 2 –(СН 2) 6 –СООН
или C
17 H
31 COOH
с двумя двойными связями, линоленовая
СН 3 –СН 2 –(СН=СН–СН 2) 3 –(СН 2) 6 –СООН
или C
17 H
29 COOH
с тремя двойными связями и арахидоновая
СН 3 –(СН 2) 4 –(СН=СН–СН 2) 4 –(СН 2) 2 –СООН
с четырьмя двойными связями; их часто называют незаменимыми жирными кислотами.
Именно эти кислоты обладают наибольшей биологической активностью: они участвуют
в переносе и обмене холестерина, синтезе простагландинов и других жизненно
важных веществ, поддерживают структуру клеточных мембран, необходимы для работы
зрительного аппарата и нервной системы, влияют на иммунитет. Отсутствие в пище
этих кислот тормозит рост животных, угнетает их репродуктивную функцию,
вызывает различные заболевания. Линолевую и линоленовую кислоты организм
человека сам синтезировать не может и должен получать их готовыми с пищей (как
витамины). Для синтеза же арахидоновой кислоты в организме необходима линолевая
кислота. Полиненасыщенные жирные кислоты с 18 атомами углерода в виде эфиров
глицерина находятся в так называемых высыхающих маслах – льняном, конопляном,
маковом и др. Линолевая кислота
C
17 H
31 COOH
и линоленовая
кислота
C
17 H
29 COOH
входят в состав
растительных масел. Например, льняное масло содержит около 25% линолевой
кислоты и до 58% линоленовой.
Сорбиновая (2,4-гексадиеновая) кислота СН 3 –СН=СН–СН=СНСООН была получена из ягод рябины (на латыни – sorbus). Эта кислота – прекрасный консервант, поэтому ягоды рябины не плесневеют.
Простейшая непредельная кислота, акриловая СН 2 =СНСООН, имеет острый запах (на латыни acris – острый, едкий). Акрилаты (эфиры акриловой кислоты) используются для получения органического стекла, а ее нитрил (акрилонитрил) – для изготовления синтетических волокон.
Называя вновь выделенные кислоты, химики, нередко, дают волю фантазии. Так, название ближайшего гомолога акриловой кислоты, кротоновой
СН 3 –СН=СН–СООН, происходит вовсе не от крота, а от растения Croton tiglium , из масла которого она была выделена. Очень важен синтетический изомер кротоновой кислоты – метакриловая кислота СН 2 =С(СН 3)–СООН, из эфира которой (метилметакрилата), как и из метилакрилата, делают прозрачную пластмассу – оргстекло.
Непредельные карбоновые кислоты способны к реакциям присоединения:
СН 2 =СН-СООН + Н 2 → СН 3 -СН 2 -СООН
СН 2 =СН-СООН + Сl 2 → СН 2 Сl -СНСl -СООН
ВИДЕО:
СН 2 =СН-СООН + HCl → СН 2 Сl -СН 2 -СООН
СН 2 =СН-СООН + Н 2 O → НО-СН 2 -СН 2 -СООН
Две последние реакции протекают против правила Марковникова.
Непредельные карбоновые кислоты и их производные способны к реакциям полимеризации.
Как уже было сказано в гл. 8, сильные окислители, такие, как перманганат калия, превращают первичные спирты в карбоновые кислоты. Альдегиды окисляются еще легче, чем спирты:
Например:

Окисление боковой цепи ароматических соединений
Ароматические соединения, имеющие в боковой цепи атом водорода в -положении к бензольному кольцу, в жестких условиях окисляются до карбоновых кислот. При этом боковая цепь, независимо от числа атомов углерода, превращается в карбоксильную группу СООН (подробнее об этом речь шла в гл. 9):

Например:

Синтезы с участием малонового эфира
Широкое применение в синтезе карбоновых кислот и построении нового углеродного скелета находят реакции с участием малонового эфира. Последовательность реакций состоит из алкилирования диэтилового эфира малоновой кислоты (его часто называют просто малоновым) с последующим декарбоксилированием. Первая стадия синтеза такова:

Основание используется для отрыва протона из -положения диэтилмалоната. При этом образуется нуклеофил, способный взаимодействовать с галогеналканом . В результате реакции замещения радикал R оказывается соединенным с атомом углерода, который несет отрицательный заряд. При необходимости эту процедуру можно повторить, введя в малоновый эфир второй заместитель

После введения в малоновый эфир одного или двух заместителей полученное вещество может быть подвергнуто различным превращениям. Ниже показан интересующий нас путь получения монокарбоновых кислот:

Алкилированный малоновый эфир гидролизуют до соответствующей дикарбоновой кислоты. (Подробнее о гидролизе сложных эфиров речь пойдет ниже.) При нагревании дикарбоновая кислота легко теряет молекулу диоксида углерода и превращается в монокарбоновую кислоту. Процесс удаления карбоксильной группы называется декарбоксилированием.
Примером такого синтеза карбоновых кислот является синтез вальпроевой кислоты - эффективного противосудорожного препарата:


Карбоксилирование реактивов Гриньяра
Карбоновые кислоты можно получать из реактивов Гриньяра и диоксида углерода (см. гл. 3):

В этой реакции образуется кислота, в молекуле которой имеется на один углеродный атом больше, чем в исходных галогеналкане и реактиве Гриньяра.

Карбоновые кислоты получают окислением первичных спиртов или альдегидов, энергичным окислением алкилбензолов или карбоксилированием реактивов Гриньяра. Синтезы с малоновым эфиром используют для получения карбоновых кислот с более длинным углеродным скелетом, чем у любого из исходных соединений.

Классификация
а) По основности (т. е. числукарбоксильных групп в молекуле):
Одноосновные (монокарбоновые) RCOOH; например:
СН 3 СН 2 СН 2 СООН;
НООС-СН 2 -СООН пропандиовая (малоновая) кислота

Трехосновные (трикарбоновые) R(COOH) 3 и т. д.
б) По строению углеводородного радикала:
Алифатические
предельные; например: СН 3 СН 2 СООН;
непредельные; например: СН 2 =СНСООН пропеновая(акриловая) кислота

Алициклические, например:

Ароматические, например:

Предельные монокарбоновые кислоты
(одноосновные насыщенные карбоновые кислоты) – карбоновые кислоты, в которых насыщенный углеводородный радикал соединен с одной карбоксильной группой -COOH. Все они имеют общую формулу C n H 2n+1 COOH (n ≥ 0); или CnH 2n O 2 (n≥1)
Номенклатура
Систематические названия одноосновных предельных карбоновых кислот даются по названию соответствующего алкана с добавлением суффикса - овая и слова кислота.
1. НСООН метановая (муравьиная) кислота
2. СН 3 СООН этановая (уксусная) кислота
3. СН 3 СН 2 СООН пропановая (пропионовая) кислота
Изомерия
Изомерия скелета в углеводородном радикале проявляется, начиная с бутановой кислоты, которая имеет два изомера:

Межклассовая изомерия проявляется, начиная с уксусной кислоты:
CH 3 -COOH уксусная кислота;
H-COO-CH 3 метилформиат (метиловый эфир муравьиной кислоты);
HO-CH 2 -COH гидроксиэтаналь (гидроксиуксусный альдегид);
HO-CHO-CH 2 гидроксиэтиленоксид.
Гомологический ряд
Тривиальное название |
Название по ИЮПАК |
|
Муравьиная кислота |
Метановая кислота |
|
Уксусная кислота |
Этановая кислота |
|
Пропионовая кислота |
Пропановая кислота |
|
Масляная кислота |
Бутановая кислота |
|
Валериановая кислота |
Пентановая кислота |
|
Капроновая кислота |
Гексановая кислота |
|
Энантовая кислота |
Гептановая кислота |
|
Каприловая кислота |
Октановая кислота |
|
Пеларгоновая кислота |
Нонановая кислота |
|
Каприновая кислота |
Декановая кислота |
|
Ундециловая кислота |
Ундекановая кислота |
|
Пальмитиновая кислота |
Гексадекановая кислота |
|
Стеариновая кислота |
Октадекановая кислота |
Кислотные остатки и кислотные радикалы
Кислотный остаток |
Кислотный радикал (ацил) |
|
НСООН |
НСОО- |
|
СН 3 СООН |
СН 3 СОО- |
|
СН 3 СН 2 СООН |
СН 3 СН 2 СОО- |
|
СН 3 (СН 2) 2 СООН |
СН 3 (СН 2) 2 СОО- |
|
СН 3 (СН 2) 3 СООН |
СН 3 (СН 2) 3 СОО- |
|
СН 3 (СН 2) 4 СООН |
СН 3 (СН 2) 4 СОО- |
Электронное строение молекул карбоновых кислот

Показанное в формуле смещение электронной плотности в сторону карбонильного атома кислорода обусловливает сильную поляризацию связи О-Н, в результате чего облегчается отрыв атома водорода в виде протона - в водных растворах происходит процесс кислотной диссоциации:
RCOOH ↔ RCOO - + Н +
В карбоксилат-ионе (RCOO -) имеет место р, π-сопряжение неподеленной пары электронов атома кислорода гидроксильной группы с р-облаками, образующими π- связь, в результате происходит делокализация π- связи и равномерное распределение отрицательного заряда между двумя атомами кислорода:

В связи с этим для карбоновых кислот, в отличие от альдегидов, не характерны реакции присоединения.
Физические свойства

Температуры кипения кислот значительно выше температур кипения спиртов и альдегидов с тем же числом атомов углерода, что объясняется образованием циклических и линейных ассоциатов между молекулами кислот за счет водородных связей:
Химические свойства
I. Кислотные свойства
Сила кислот уменьшается в ряду:
НСООН → СН 3 СООН → C 2 H 6 COOH → ...
1. Реакции нейтрализации
СН 3 СООН + КОН → СН 3 СООК + н 2 O
2. Реакции с основными оксидами
2HCOOH + СаО → (НСОО) 2 Са + Н 2 O
3. Реакции с металлами
2СН 3 СН 2 СООН + 2Na → 2СН 3 СН 2 COONa + H 2
4. Реакции с солями более слабых кислот (в т. ч. с карбонатами и гидрокарбонатами)
2СН 3 СООН + Na 2 CO 3 → 2CH 3 COONa + CO 2 + Н 2 O
2НСООН + Mg(HCO 3) 2 → (НСОО) 2 Мg + 2СO 2 + 2Н 2 O
(НСООН + НСО 3 - → НСОО - + СO2 +Н2O)
5. Реакции с аммиаком
СН 3 СООН + NH 3 → CH 3 COONH 4
II. Замещение группы -ОН
1. Взаимодействие со спиртами (реакции этерификации)

2. Взаимодействие с NH 3 при нагревании (образуются амиды кислот)

Амиды кислот  гидролизуются с образованием кислот:
гидролизуются с образованием кислот:

или их солей:

3. Образование галогенангидридов
Наибольшее значение имеют хлорангидриды. Хлорирующие реагенты - PCl 3 , PCl 5 , тионилхлорид SOCl 2 .

4. Образование ангидридов кислот (межмолекулярная дегидратация)

Ангидриды кислот образуются также при взаимодействии хлорангидридов кислот с безводными солями карбоновых кислот; при этом можно получать смешанные ангидриды различных кислот; например:

III. Реакции замещения атомов водорода у α-углеродного атома

Особенности строения и свойств муравьиной кислоты
Строение молекулы

Молекула муравьиной кислоты, в отличие от других карбоновых кислот, содержит в своей структуре альдегидную группу.
Химические свойства
Муравьиная кислота вступает в реакции, характерные как для кислот, так и для альдегидов. Проявляя свойства альдегида, она легко окисляется до угольной кислоты:
В частности, НСООН окисляется аммиачным раствором Ag 2 O и гидроксидом меди (II) Сu(ОН) 2 , т. е. дает качественные реакции на альдегидную группу:

При нагревании с концентрированной H 2 SO 4 муравьиная кислота разлагается на оксид углерода (II) и воду:

Муравьиная кислота заметно сильнее других алифатических кислот, так как карбоксильная группа в ней связана с атомом водорода, а не с электроно-донорным алкильным радикалом.
Способы получения предельных монокарбоновых кислот
1. Окисление спиртов и альдегидов
Общая схема окисления спиртов и альдегидов:
В качестве окислителей используют KMnO 4 , K 2 Cr 2 O 7 , HNO 3 и другие реагенты.
Например:
5С 2 Н 5 ОН + 4KMnO 4 + 6H 2 S0 4 → 5СН 3 СООН + 2K 2 SO 4 + 4MnSO 4 + 11Н 2 O
2. Гидролиз сложных эфиров

3. Окислительное расщепление двойных и тройных связей в алкенах и в алкинах

Способы получения НСООН (специфические)
1. Взаимодействие оксида углерода (II) с гидроксидом натрия
СO + NaOH → HCOONa формиат натрия
2HCOONa + H 2 SO 4 → 2НСООН + Na 2 SO 4
2. Декарбоксилирование щавелевой кислоты

Способы получения СН 3 СООН (специфические)
1. Каталитическое окисление бутана

2. Синтез из ацетилена

3. Каталитическое карбонилирование метанола

4. Уксуснокислое брожение этанола
Так получают пищевую уксусную кислоту.
Получение высших карбоновых кислот
Гидролиз природных жиров

Непредельные монокарбоновые кислоты
Важнейшие представители
Общая формула алкеновых кислот: C n H 2n-1 COOH (n ≥ 2)
CH 2 =CH-COOH пропеновая (акриловая) кислота

Высшие непредельные кислоты
Радикалы этих кислот входят в состав растительных масел.
C 17 H 33 COOH - олеиновая кислота, или цис -октадиен-9-овая кислота

Транс -изомер олеиновой кислоты называется элаидиновой кислотой.
C 17 H 31 COOH - линолевая кислота, или цис, цис -октадиен-9,12-овая кислота

C 17 H 29 COOH - линоленовая кислота, или цис, цис, цис -октадекатриен-9,12,15-овая кислота
Кроме общих свойств карбоновых кислот, для непредельных кислот характерны реакции присоединения по кратным связям в углеводородном радикале. Так, непредельные кислоты, как и алкены, гидрируются и обесцвечивают бромную воду, например:

Отдельные представители дикарбоновых кислот
Предельные дикарбоновые кислоты HOOC-R-COOH
HOOC-CH 2 -COOH пропандиовая (малоновая) кислота, (соли и эфиры - малонаты)
HOOC-(CH 2) 2 -COOH бутадиовая (янтарная) кислота, (соли и эфиры - сукцинаты)
HOOC-(CH 2) 3 -COOH пентадиовая (глутаровая) кислота, (соли и эфиры - глутораты)
HOOC-(CH 2) 4 -COOH гексадиовая (адипиновая) кислота, (соли и эфиры - адипинаты)
Особенности химических свойств
Дикарбоновые кислоты во многом сходны с монокарбоновыми, однако являются более сильными. Например, щавелевая кислотасильнее уксусной почти в 200 раз.
Дикарбоновые кислоты ведут себя как двухосновные и образуют два ряда солей - кислые и средние:
HOOC-COOH + NaOH → HOOC-COONa + H 2 O
HOOC-COOH + 2NaOH → NaOOC-COONa + 2H 2 O
При нагревании щавелевая и малоновая кислоты легко декарбоксилируются:

Карбоновыми кислотами называют производные углеводородов, содержащие одну или несколько карбоксильных групп.
Число карбоксильных групп характеризует основность кислоты.
В зависимости от количества карбоксильных групп карбоновые кислоты подразделяются на одноосновные карбоновые кислоты (содержат одну карбоксильную группу), двухосновные (содержат две карбоксильные группы) и многоосновные кислоты.
В зависимости от вида радикала, связанного с карбоксильной группой, карбоновые кислоты делятся на предельные, непредельные и ароматические. Предельные и непредельные кислоты объединяют под общим названием кислоты алифатического или жирного ряда.
Одноосновные карбоновые кислоты
1.1 Гомологический ряд и номенклатура
Гомологический ряд одноосновных предельных карбоновых кислот (иногда их называют жирными кислотами) начинается с муравьиной кислоты
Формула гомологического ряда
Номенклатура ИЮПАК разрешает сохранять для многих кислот их тривиальные названия, которые обычно указывают на природный источник, из которого была выделена та или иная кислота, например, муравьиная, уксусная, масляная, валериановая и т.д.
Для более сложных случаев названия кислот производят от названия углеводородов с тем же числом атомов углерода, что и в молекуле кислоты, с добавлением окончания -овая и слова кислота. Муравьиная кислота Н-СООН называется метановой кислотой, уксусная кислота СН 3 -СООН - этановой кислотой и т. д.
Таким образом, кислоты рассматриваются как производные углеводородов, одно звено которых превращено в карбоксил:

При составлении названий кислот с разветвленной цепью по рациональной номенклатуре их рассматривают как производные уксусной кислоты, в молекуле которой атомы водорода замещены радикалами, например, триметилуксусная кислота (СН 3) 3 С – СООН.
1.2 Физические свойства карбоновых кислот
Только с чисто формальных позиций можно рассматривать карбоксильную группу как комбинацию карбонильной и гидроксильной функций. Фактически их взаимное влияние друг на друга таково, что полностью изменяет их свойства.
Обычная для карбонила поляризация двойной связи С=0 сильно возрастает за счет дополнительного стягивания свободной электронной пары с соседнего атома кислорода гидроксильной группы:

Следствием этого является значительное ослабление связи О-Н в гидроксиле и легкость отщепления атома водорода от него в виде протона (Н +). Появление пониженной электронной плотности (δ+) на центральном углеродном атоме карбоксила приводит также к стягиванию σ-электронов соседней связи С-С к карбоксильной группе и появлению (как у альдегидов и кетонов) пониженной электронной плотности (δ +) на α-углеродном атоме кислоты.
Все карбоновые кислоты обладают кислой реакцией (обнаруживается индикаторами) и образуют соли с гидроксидами, оксидами и карбонатами металлов и с активными металлами:
Карбоновые кислоты в большинстве случаев в водном растворе диссоциированы лишь в малой степени и являются слабыми кислотами, значительно уступая таким кислотам, как соляная, азотная и серная. Так, при растворении одного моля в 16 л воды степень диссоциации муравьиной кислоты равна 0,06, уксусной кислоты - 0,0167, в то время как соляная кислота при таком разбавлении диссоциирована почти полностью.
Для большинства одноосновных карбоновых кислот рК а = 4,8, только муравьиная кислота имеет меньшую величину рК а (около 3,7), что объясняется отсутствием электронодонорного эффекта алкильных групп.
В безводных минеральных кислотах карбоновые кислоты протонируются по кислороду с образованием карбкатионов:

Сдвиг электронной плотности в молекуле недиссоциированной карбоновой кислоты, о котором говорилось выше, понижает электронную плотность на гидроксильном атоме кислорода и повышает ее на карбонильном. Этот сдвиг еще больше увеличивается в анионе кислоты:

Результатом сдвига является полное выравнивание зарядов в анионе, который фактически существует в форме А - резонанс карбоксилат-аниона.
Первые четыре представителя ряда карбоновых кислот - подвижные жидкости, смешивающиеся с водой во всех отношениях. Кислоты, в молекуле которых содержится от пяти до девяти атомов углерода (а также изомасляная кислота), - маслянистые жидкости, растворимость их в воде невелика.
Высшие кислоты (от С 10) - твердые тела, практически нерастворимы в воде, при перегонке в обычных условиях они разлагаются.
Муравьиная, уксусная и пропионовая кислоты имеют острый запах; средние члены ряда обладают неприятным запахом, высшие кислоты запаха не имеют.

На физических свойствах карбоновых кислот сказывается значительная степень ассоциации вследствие образования водородных связей. Кислоты образуют прочные водородные связи, так как связи О-Н в них сильно поляризованы. Кроме того, карбоновые кислоты способны образовывать водородные связи с участием атома кислорода карбонильного диполя, обладающего значительной электроотрицательностью. Действительно, в твердом и жидком состоянии карбоновые кислоты существуют в основном в виде циклических димеров:
Такие димерные структуры сохраняются в некоторой степени даже в газообразном состоянии и в разбавленных растворах в неполярных растворителях.
Окисление насыщенных углеводородов кислородом на специальных катализаторах до карбоновых кислот осуществляют в промышленности, однако селективностью этот способ не отличается. Как правило, получаются смеси карбоновых кислот, поскольку при окислении происходит разрыв различных углерод-углеродных связей.
Значительно более селективным является окисление алкенов сильными окислителями. При нагревании алкенов, имеющих по одному атому водорода у каждого атома углерода двойной связи, со щелочным раствором перманганата калия образуется смесь двух карбоновых кислот. Если же алкен симметричный, то образуются две молекулы одной карбоновой кислоты. Такое же окисление можно осуществить и при нагревании алкенов с концентрированной азотной кислотой.
![]()
Аналогично при окислении щелочным раствором перманганата калия алкинов получают карбоновые кислоты. Так, например, уксусную кислоту можно получить, окисляя либо 2-бутен, либо 2-бутин.

Алкилбензолы окисляют до бензойной кислоты либо кислородом на катализаторах (в промышленности), либо нагреванием с перманганатом калия. Например, кипячение толуола с водным раствором перманганата калия с последующим подкислением раствора приводит к бензойной кислоте.

Карбоновые кислоты могут быть получены также окислением первичных спиртов или альдегидов. В качестве окислителей обычно используют соединения хрома в высшей степени окисления, например, хромовый ангидрид, перманганат калия в щелочной среде, концентрированную азотную кислоту. Альдегиды легко окисляются и другими окислителями, напрмер, аммиачным раствором оксида серебра (реакция «серебряного зеркала»).

1.2. Синтез карбоновых кислот из галогенопроизводных
1.2.1.Синтез карбоновых кислот через нитрилы
Алкилгалогениды взаимодействием с цианидом натрия превращают в алкилцианиды, которые являются нитрилами карбоновых кислот. Последние гидролизуют в кислой среде до карбоновых кислот.

Таким образом, происходит двухстадийное замещение атома галогена в молекуле галогенопроизводного на карбоксильную группу. Так, для получения валериановой кислоты (5 атомов углерода) необходимо исходить из бутилгалогенида.
1-бромбутан нитрил валериановая кислота
валериановой кислоты
1.2.2. Синтез карбоновых кислот реакцией Гриньяра
Реактивы Гриньяра, которые получают из галогенопроизводных взаимодействием с металлическим магнием, представляют собой нуклеофильные реагенты. Поэтому для синтеза из них карбоновых кислот используют реакцию карбоксилирования с помощью электрофильного диоксида углерода.
Для получения этим методом бензойной кислоты в качестве исходного галогенопроизводного необходимо взять, например, бромбензол, который реакцией с магнием, последующим взаимодействием фенилмагнийбромида с диоксидом углерода и заключительным гидролизом магниевой соли превращают в бензойную кислоту.
1.3. Гидролиз производных карбоновых кислот
Подобно нитрилам и солям, о гидролизе которых речь уже шла, и другие производные карбоновых кислот гидролизуются до карбоновых кислот. Реакции могут катализироваться как кислотами, так и щелочами. Например, при гидролизе метилового эфира пропановой кислоты, катализируемом сильной минеральной кислотой, образуется пропановая кислота и метанол.
При нагревании ацетанилида (фениламида уксусной кислоты) с водным раствором едкого натра получается ацетат натрия и анилин.
Гидролиз молекулы ангидрида бензойной кислоты приводит к образованию двух молекул бензойной кислоты.

Подробнее о катализе и механизме гидролиза речь будет идти в разделах, посвященных производным карбоновых кислот

 История древнего китая доклад, сообщение Где жили древние люди китая
История древнего китая доклад, сообщение Где жили древние люди китая Уроки химии Йодом смочим мы обильно, чтобы было все стерильно
Уроки химии Йодом смочим мы обильно, чтобы было все стерильно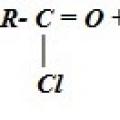 Химические свойства. Получение. Получение карбоновых кислот Получение карбоновых кислот окислением углеводородов
Химические свойства. Получение. Получение карбоновых кислот Получение карбоновых кислот окислением углеводородов