Газови закони. Дишане. Законът на Бойл-Мариот Законът на Бойл-Мариот се осъществява при постоянна
Законът е формулиран по следния начин: произведението от обема на дадена маса газ и неговото налягане при постоянна температура е постоянна величина. Математически този закон може да бъде написан така:
P 1 V 1 = P 2 V 2 или PV = const (1)
От закона на Бойл-Мариот следват следните последствия: плътността и концентрацията на газ при постоянна температура е право пропорционална на налягането, под което се намира газът:
(2);
 (3) ,
(3) ,
Където д 1 – плътност, C 1 – концентрация на газ под налягане P 1; д 2 и C 2 са съответните стойности под налягане P 2 .
Пример 1.Газов цилиндър с капацитет 0,02 m 3 съдържа газ под налягане 20 atm. Какъв обем ще заеме газът, ако вентилът на бутилката се отвори, без да се промени температурата му? Крайно налягане 1 атм.
Пример 2.Сгъстен въздух се подава в газхолдер (резервоар за събиране на газ) с обем 10 m3. Колко време ще отнеме да се изпомпва до налягане от 15 atm, ако компресорът засмуква 5,5 m 3 атмосферен въздух на минута при налягане от 1 atm? Температурата се приема за постоянна.
Пример 3. 112 g азот под налягане 4 atm заемат обем от 20 литра. Какво налягане трябва да се приложи, така че концентрацията на азот да стане 0,5 mol/l, при условие че температурата остане непроменена?
1.1.2 Законите на Гей-Люсак и Шарл
Gay-Lussac установи, че при постоянно налягане, с повишаване на температурата с 1°C, обемът на дадена маса газ се увеличава с 1/273 от обема си при 0°C.
Математически този закон е написан:
 (4)
,
(4)
,
Където V-обем газ при температура t°С, а V 0 – обем газ при 0°C.
Чарлз показа, че налягането на дадена маса газ, когато се нагрее с 1°C при постоянен обем, се увеличава с 1/273 от налягането, което газът има при 0°C. Математически този закон е написан по следния начин:
 (5)
,
(5)
,
където P 0 и P са газовите налягания съответно при температури 0С и tС.
При замяна на скалата на Целзий със скалата на Келвин, връзката между тях се установява чрез отношението T = 273 + T, формулите на законите на Гей-Люсак и Чарлз са значително опростени.
Закон на Гей-Люсак:при постоянно налягане обемът на дадена маса газ е право пропорционален на неговата абсолютна температура:
 (6)
.
(6)
.
Законът на Чарлз:при постоянен обем налягането на дадена маса газ е право пропорционално на неговата абсолютна температура:
 (7)
.
(7)
.
От законите на Гей-Лусак и Чарлз следва, че при постоянно налягане плътността и концентрацията на газ са обратно пропорционални на неговата абсолютна температура:
 (8)
,
(8)
,
 (9) .
(9) .
Където д 1 и C 1 - плътност и концентрация на газ при абсолютна температура T 1, д 2 и C 2 са съответните стойности при абсолютна температура T 2 .
Пример 4.При 20ºC обемът на газа е 20,4 ml. Какъв обем ще заеме газът, когато се охлади до 0°C, ако налягането остане постоянно?
Примеп 5. При 9°C налягането вътре в кислородния цилиндър е 94 atm. Изчислете колко се повишава налягането в цилиндъра, ако температурата се повиши до 27ºC?
Пример 6.Плътност на хлорния газ при 0ºСи налягане 760 mm Hg. Изкуство. равно на 3,220 g/l. Намерете плътността на хлора, приемайки го за идеален газ, при 27ºС при същото налягане.
Пример 7.При нормални условия концентрацията на въглероден окис е 0,03 kmol/m3. Изчислете при каква температура масата на 10 m 3 въглероден окис ще бъде равна на 7 kg?
Комбиниран закон на Бойл-Мариот-Чарлз-Гей-Лусак.
Формулировката на този закон: за дадена маса газ произведението от налягането и обема, разделено на абсолютната температура, е постоянно за всички промени, настъпващи в газа. Математическа нотация:
 (10)
(10)
където V 1 е обемът и P 1 е налягането на дадена маса газ при абсолютна температура T 1 , V 2 - обем и P 2 - налягане на същата маса газ при абсолютна температура T 2.
Едно от най-важните приложения на единния закон за газа е „довеждане на обема на газа до нормални условия“.
Пример 8.Газ при 15°C и налягане 760 mmHg. Изкуство. заема обем от 2 литра. Доведете обема на газа до нормални условия.
За да улесните подобни изчисления, можете да използвате коефициентите на преобразуване, дадени в таблиците.
Пример 9.В газомерът над водата има 7,4 литра кислород при температура 23°C и налягане 781 mm Hg. Изкуство. Налягането на водните пари при тази температура е 21 mmHg. Изкуство. Какъв обем ще заема кислородът в газомера при нормални условия?
Промяна на един от макроскопичните параметри на вещество с определена маса - налягане R,сила на звука V или температура T - предизвиква промени в други параметри.
Ако всички величини, характеризиращи състоянието на газа, се променят едновременно, тогава експериментално е трудно да се установят определени закономерности. По-лесно е първо да се изследват процеси, в които масата и един от трите параметъра - R,V или T - остават непроменени. Количествените зависимости между два параметъра на газ с еднаква маса с постоянна стойност на третия параметър се наричат газови закони.
Законът на Бойл-Мариот
Първият закон за газа е открит от английския учен Р. Бойл (1627-1691) през 1660 г. Работата на Бойл е наречена „Нови експерименти относно въздушна пружина“. Наистина, газът се държи като компресирана пружина; това може да се провери чрез компресиране на въздух в обикновена велосипедна помпа.
Бойл изследва промяната в налягането на газа като функция на обема при постоянна температура. Процесът на промяна на състоянието на термодинамична система при постоянна температура се нарича изотермичен (от гръцките думи isos - равен, therme - топлина). За да се поддържа постоянна температура на газ, е необходимо той да може да обменя топлина с голяма система, в която се поддържа постоянна температура - термостат. Атмосферният въздух може да служи като термостат, ако температурата му не се променя забележимо по време на експеримента.
Бойл наблюдава промяната в обема на въздуха, уловен в дълга извита тръба от живачен стълб (фиг. 3.6, а). Първоначално нивата на живак в двата крака на тръбата бяха еднакви и налягането на въздуха беше равно на атмосферното (760 mm Hg). Докато добавя живак към дългото коляно на тръбата, Бойл забелязва, че обемът на въздуха е наполовина, когато разликата в нивата в двата лакътя се окаже равна ч = 760 mm и следователно налягането на въздуха се удвои (фиг. 3.6, б).Това доведе Бойл до идеята, че обемът на дадена маса газ и неговото налягане са обратно пропорционални.
а) б)
Допълнителни наблюдения върху промяната в обема при добавяне на различни порции живак потвърдиха това заключение.
Независимо от Бойл, малко по-късно френският учен Е. Мариот (1620-1684) стига до същите изводи. Следователно намереният закон беше наречен закон на Бойл-Мариот. Съгласно този закон налягането на дадена маса (или количество) газ при постоянна температура е обратно пропорционално на обема на газа:  .
.
Ако стр 1 - налягане на газа при обем V 1 , И стр 2 - неговото налягане при обем V 2 , Че
 (3.5.1)
(3.5.1)
Следва, че стр 1 V л = стр 2 V 2 , или
 (3.5.2)
(3.5.2)
при t =конст.
Произведението от налягането на газ с дадена маса и неговия обем е постоянно, ако температурата не се променя.
Този закон е валиден за всякакви газове, както и за смеси от газове (например въздух).
Можете да проверите валидността на закона на Бойл-Мариот, като използвате устройството, показано на фигура 3.7. Запечатаният гофриран съд е свързан към манометър, който отчита налягането вътре в съда. Чрез завъртане на винта можете да промените обема на съда. Обемът може да се прецени с линийка. Чрез промяна на обема и измерване на налягането можете да видите, че уравнение (3.5.2) е изпълнено.

Подобно на други физични закони, законът на Бойл-Мариот е приблизителен. При налягане няколкостотин пъти по-голямо от атмосферното налягане отклоненията от този закон стават значителни.
На графиката на налягането спрямо обема всяко състояние на газ съответства на една точка.
Изотерми
Процесът на промяна на налягането на газа в зависимост от обема се изобразява графично с помощта на крива, наречена изотерма (фиг. 3.8). Газовата изотерма изразява обратната връзка между налягане и обем. Крива от този вид се нарича хипербола. Различните изотерми съответстват на различни постоянни температури, тъй като по-висока температура при същия обем съответства на по-високо налягане*. Следователно, изотермата, съответстваща на по-висока температура T2, лежи над изотермата, съответстваща на по-ниската температура t 1.
* Това ще бъде обсъдено по-подробно по-късно.

Законът на Бойл-Мариот е един от основни закони на физиката и химията, който свързва промените в налягането и обема на газообразните вещества. С помощта на нашия калкулатор е лесно да решавате прости задачи по физика или химия.
Законът на Бойл-Мариот
Законът за изотермичния газ е открит от ирландски учен Робърт Бойл, който провежда експерименти с газове под налягане. Използвайки U-образна тръба и обикновен живак, Бойл установява прост принцип, че във всеки даден момент продуктът от налягането и обема на газа е постоянен. Говорейки на сух математически език, законът на Бойл-Мариот гласи това при постоянна температура произведението на налягането и обема е постоянно:
За да се поддържа постоянно съотношение, количествата трябва да се променят в различни посоки: с колко пъти едно количество намалява, с толкова пъти се увеличава друго. Следователно налягането и обемът на газ са обратно пропорционални и законът може да бъде пренаписан, както следва:
P1×V1 = P2×V2,
където P1 и V1 са съответно началните стойности на налягането и обема, а P2 и V2 са крайните стойности.
Приложение на закона на Бойл-Мариот
Най-добрата илюстрация на проявата на открития от Бойл закон е потапянето на пластмасова бутилка под вода. Известно е, че ако газът се постави в цилиндър, тогава налягането върху веществото ще се определя само от стените на цилиндъра. Друг е въпросът, когато това е пластмасова бутилка, която лесно променя формата си. На повърхността на водата (налягане 1 атмосфера) затворена бутилка ще запази формата си, но когато се потопи на дълбочина 10 m, налягане от 2 атмосфери ще действа върху стените на съда, бутилката ще започне да се свива , а обемът на въздуха ще намалее наполовина. Колкото по-дълбоко е потопен пластмасовият контейнер, толкова по-малък обем ще заема въздухът в него.
Тази проста демонстрация на закона за газа илюстрира важен момент за много гмуркачи. Ако на повърхността на водата въздушен цилиндър има капацитет от 20 литра, тогава при гмуркане на дълбочина 30 м въздухът вътре ще бъде компресиран три пъти, следователно въздухът за дишане на такава дълбочина ще бъде три пъти по-малко отколкото на повърхността.
Отвъд темата за гмуркането, законът на Бойл-Мариот в действие може да се наблюдава в процеса на компресиране на въздух в компресор или в разширяването на газовете при използване на помпа.
Нашата програма е онлайн инструмент, който улеснява изчисляването на пропорцията за всеки газов изотермичен процес. За да използвате инструмента, трябва да знаете произволни три количества и калкулаторът автоматично ще изчисли необходимото.
Примери за това как работи калкулаторът
Училищна задача
Нека разгледаме проста училищна задача, в която трябва да намерите първоначалния обем на газ, ако налягането се промени от 1 на 3 атмосфери и обемът намалее до 10 литра. И така, имаме всички данни за изчислението, които трябва да бъдат въведени в съответните клетки на калкулатора. В резултат на това откриваме, че първоначалният обем газ е 30 литра.
Повече за гмуркането
Да си спомним пластмасова бутилка. Да си представим, че сме потопили бутилка, пълна с 19 литра въздух, на дълбочина 40 м. Как ще се промени обемът на въздуха на повърхността? Това е по-труден проблем, но само защото трябва да преобразуваме дълбочината в налягане. Знаем, че на повърхността на водата атмосферното налягане е 1 бар, а при потапяне във вода налягането се увеличава с 1 бар на всеки 10 м. Това означава, че на дълбочина 40 м бутилката ще бъде под налягане от приблизително 5 атмосфери . Имаме всички данни за изчислението и в резултат ще видим, че обемът на въздуха на повърхността ще се увеличи до 95 литра.
Заключение
Законът на Бойл-Мариот се среща доста често в живота ни, така че несъмнено ще ви трябва калкулатор, който автоматизира изчисленията, използвайки тази проста пропорция.
Основните закони на идеалните газове се използват в техническата термодинамика за решаване на редица инженерни проблеми в процеса на разработване на конструкторска и технологична документация за авиационно оборудване и авиационни двигатели; тяхното производство и експлоатация.
Тези закони първоначално са получени експериментално. Впоследствие те са извлечени от молекулярно-кинетичната теория за структурата на телата.
Законът на Бойл-Мариотустановява зависимостта на обема на идеален газ от налягането при постоянна температура. Тази зависимост е изведена от английския химик и физик Р. Бойл през 1662 г., много преди появата на кинетичната теория на газа. Независимо от Бойл, същият закон е открит от Е. Мариот през 1676г. Закон на Робърт Бойл (1627 - 1691), английски химик и физик, който установи този закон през 1662 г., и Едме Мариот (1620 - 1684), френски физик, който установи този закон през 1676 г.: произведението на обема на дадена маса на идеален газ и неговото налягане е постоянно при постоянна температураили.
Законът на Бойл-Мариот се нарича и гласи това при постоянна температура налягането на газа е обратно пропорционално на неговия обем.
Да приемем при постоянна температура на определена маса газ:
V 1 – обем газ при налягане Р 1 ;
V 2 – обем газ при налягане Р 2 .
Тогава според закона можем да пишем
Като заместим стойността на специфичния обем в това уравнение и вземем масата на този газ T= 1 кг, получаваме
стр 1 v 1 =стр 2 v 2 или pv= конст .(5)
Плътността на газа е реципрочната на неговия специфичен обем:
тогава уравнение (4) ще приеме формата
тоест, плътностите на газовете са право пропорционални на техните абсолютни налягания. Уравнение (5) може да се разглежда като нов израз на закона на Бойл-Мариот, който може да се формулира, както следва: произведението на налягането и специфичния обем на определена маса от същия идеален газ за различните му състояния, но при една и съща температура, е постоянна стойност.
Този закон може лесно да се получи от основното уравнение на кинетичната теория на газовете. Замяна на броя на молекулите на единица обем в уравнение (2) със съотношението н/V (V– обем на дадена маса газ, н– брой молекули в обем) получаваме
Тъй като за дадена маса газ стойностите нИ β са постоянни, след това при постоянна температура T=констза произволно количество газ уравнението на Бойл-Мариот ще има формата
pV = конст, (7)
и за 1 кг газ
pv = const.
Нека изобразим графично в координатната система Р – vпромяна в газовото състояние.
Например, налягането на дадена маса газ с обем 1 m 3 е равно на 98 kPa, след което, използвайки уравнение (7), определяме налягането на газ с обем 2 m 3
Продължавайки изчисленията, получаваме следните данни: V(m3) е равно на 1; 2; 3; 4; 5; 6; съответно Р(kPa) е равно на 98; 49; 32,7; 24,5; 19,6; 16.3. Използвайки тези данни, изграждаме графика (фиг. 1).
Ориз. 1. Зависимост на налягането на идеалния газ от обема при
постоянна температура
Получената крива - хипербола, получена при постоянна температура - се нарича изотерма, а процес, протичащ при постоянна температура, се нарича изотермичен. Законът на Бойл-Мариот е приблизителен и при много високи налягания и ниски температури е неприемлив за топлотехнически изчисления.
Закон Гей-Лусакопределя зависимостта на обема на идеалния газ от температурата при постоянно налягане. (Законът на Жозеф Луис Гей-Лусак (1778 - 1850), френски химик и физик, който за първи път установи този закон през 1802 г.: обемът на дадена маса идеален газ при постоянно налягане нараства линейно с повишаване на температурата, това е , къде е специфичният обем; β е коефициентът на обемно разширение, равен на 1/273,16 за 1 o C.) Законът е установен експериментално през 1802 г. от френския физик и химик Жозеф Луис Гей-Люсак, на когото е кръстен. Изследвайки експериментално термичното разширение на газовете, Гей-Люсак откри, че при постоянно налягане обемите на всички газове се увеличават при нагряване почти еднакво, т.е. с повишаване на температурата с 1 ° C обемът на определена маса газ се увеличава с 1/273 от обема, който тази маса газ заема при 0°C.
Увеличаването на обема при нагряване с 1 °C със същото количество не е случайно, а изглежда е следствие от закона на Бойл-Мариот. Първоначално газът се нагрява при постоянен обем с 1 °C, налягането му нараства с 1/273 от първоначалното. Тогава газът се разширява при постоянна температура, като налягането му намалява до първоначалното, а обемът му се увеличава със същото количество. Означавайки обема на определена маса газ при 0°C с V 0 и при температура T°C в VtНека напишем закона по следния начин:
Законът на Гей-Люсак може да бъде представен и графично.
Ориз. 2. Зависимост на обема на идеален газ от температурата при константа
налягане
Използвайки уравнение (8) и приемайки температурата равна на 0°C, 273°C, 546°C, изчисляваме обема на газа, равен на, съответно V 0 , 2V 0 , 3V 0 . Нека нанесем температурите на газа по абсцисната ос в определен условен мащаб (фиг. 2), а газовите обеми, съответстващи на тези температури, по ординатната ос. Свързвайки получените точки на графиката, получаваме права линия, представляваща зависимостта на обема на идеалния газ от температурата при постоянно налягане. Тази линия се нарича изобара, а процесът, протичащ при постоянно налягане, е изобарен.
Нека се обърнем отново към графиката на промените в обема на газа спрямо температурата. Нека продължим правата линия, докато се пресече с оста x. Пресечната точка ще съответства на абсолютната нула.
Да приемем, че в уравнение (8) стойността Vt= 0, тогава имаме:
но тъй като V 0 ≠ 0, следователно, къде е T= – 273°C. Но – 273°C=0K, което трябваше да се докаже.
Нека представим уравнението на Гей-Лусак във формата:
Спомняйки си, че 273+ T=Tи 273 K=0°C, получаваме:
Заместване на стойността на специфичния обем в уравнение (9) и вземане T=1 кг, получаваме:
Съотношението (10) изразява закона на Гей-Люсак, който може да се формулира по следния начин: при постоянно налягане, специфичните обеми на еднакви маси на същия идеален газ са право пропорционални на неговите абсолютни температури. Както може да се види от уравнение (10), законът на Гей-Лусак гласи това че частното от специфичния обем на дадена маса газ, разделено на неговата абсолютна температура, е постоянна стойност при дадено постоянно налягане.
Уравнението, изразяващо закона на Гей-Лусак, има общ вид
и може да се получи от основното уравнение на кинетичната теория на газовете. Уравнение (6) ще бъде представено във формата
при стр=констполучаваме уравнение (11). Законът на Гей-Люсак се използва широко в технологиите. Така въз основа на закона за обемното разширение на газовете е създаден идеален газов термометър за измерване на температури в диапазона от 1 до 1400 K.
Законът на Чарлзустановява зависимостта на налягането на дадена маса газ от температурата при постоянен обем Законът на Жан Шарл (1746 - 1823), френски учен, който установява този закон за първи път през 1787 г. и усъвършенстван от J. Gay -Lussaccombe през 1802 г.: налягането на идеален газ с постоянна маса и обем нараства линейно при нагряване,тоест къде Р o – налягане при T= 0°C.
Чарлз установи, че при нагряване в постоянен обем налягането на всички газове нараства почти еднакво, т.е. с повишаване на температурата с 1 °C, налягането на всеки газ се увеличава точно с 1/273 от налягането, което дадена маса газ има при 0 °C. Нека означим налягането на определена маса газ в съд при 0°C с Р 0 и при температура T° през стр T. При повишаване на температурата с 1°C налягането нараства с, а при повишаване на температурата с T°C налягането се повишава с. Налягане при температура T°Равно на началното плюс увеличение на налягането или
Формула (12) ви позволява да изчислите налягането при всяка температура, ако е известно налягането при 0°C. При инженерните изчисления много често се използва уравнението (законът на Чарлз), което лесно се получава от съотношението (12).
Тъй като и 273 + T = Tили 273 K = 0°C = T 0
При постоянен специфичен обем абсолютните налягания на идеален газ са право пропорционални на абсолютните температури. Обръщайки средните членове на пропорцията, получаваме
Уравнение (14) е израз на закона на Чарлз в обща форма. Това уравнение може лесно да се извлече от формула (6)
При V=констполучаваме общото уравнение на закона на Чарлз (14).
За да начертаем зависимостта на дадена маса газ от температурата при постоянен обем, използваме уравнение (13). Нека, например, при температура 273 K = 0°C налягането на определена маса газ е 98 kPa. Според уравнението налягането при температури от 373, 473, 573 °C ще бъде съответно 137 kPa (1,4 kgf/cm2), 172 kPa (1,76 kgf/cm2), 207 kPa (2,12 kgf/cm2). Използвайки тези данни, изграждаме графика (фиг. 3). Получената права линия се нарича изохор, а процесът, протичащ при постоянен обем, се нарича изохор.
Ориз. 3. Зависимост на налягането на газа от температурата при постоянен обем
Закон на Бойл-Мариот (изотерма), един от основните газови закони, който описва изотермичните процеси в идеалните газове. Установено е от учени Р. Бойл през 1662 г. и Е. Мариот през 1676 г. независимо един от друг по време на експериментално изследване на зависимостта на налягането на газа от неговия обем при постоянна температура.
Съгласно закона на Бойл-Мариот при постоянна температура (T=const), обемът (V) на дадена маса (m) на идеален газ е обратно пропорционален на неговото налягане (p):
pV = const = C при T = const и m = const
Константата C е пропорционална на масата на газа (броя молове) и неговата абсолютна температура. С други думи: произведението от обема на дадена маса на идеален газ и неговото налягане е постоянно при постоянна температура. Законът на Бойл-Мариот важи стриктно за идеален газ. За реалните газове законът на Бойл-Мариот е изпълнен приблизително. Почти всички газове се държат като идеални газове при не твърде високо налягане и не твърде ниски температури.
Законът на Бойл-Мариот следва от кинетичната теория на газовете, когато се приема, че размерите на молекулите са незначителни в сравнение с разстоянието между тях и няма междумолекулно взаимодействие. При високи налягания е необходимо да се въведат корекции за силите на привличане между молекулите и за обема на самите молекули. Подобно на уравнението на Clayperon, законът на Бойл-Мариот описва граничния случай на поведението на реален газ, по-точно описан от уравнението на Ван дер Ваалс. Прилагането на закона може да се наблюдава приблизително в процеса на компресиране на въздуха от компресор или в резултат на разширяването на газа под буталото на помпата при изпомпването му от съд.
Термодинамичен процес, протичащ при постоянна температура, се нарича изотермичен. Изображението му на графиката (фиг. 1) се нарича изотерма.
Фиг. 1
Законът на Гей-Люсак. Изобар
През 1802 г. френският учен Ж. Гей-Люсак експериментално открива зависимостта на обема на газа от температурата при постоянно налягане. Данните са в основата на закона за газа на Гей-Люсак.
Формулировката на закона на Гей-Люсак е следната: за дадена маса газ съотношението на обема на газа към неговата температура е постоянно, ако налягането на газа не се променя. Тази връзка се записва математически, както следва:
V/T=const, ако P=const и m=const
Този закон може да се наблюдава приблизително, когато газът се разширява при нагряване в цилиндър с подвижно бутало. Постоянното налягане в цилиндъра се осигурява от атмосферното налягане върху външната повърхност на буталото. Друго проявление на закона на Гей-Люсак в действие е балонът. Законът на Гей-Люсак не се спазва в областта на ниски температури, близки до температурата на втечняване (кондензация) на газовете.
Законът е валиден за идеален газ. Работи добре за разредени газове, които са близки до идеалните по свойства. Температурата на газа трябва да е достатъчно висока.
Графично тази зависимост в V-T координати се изобразява като права линия, излизаща от точката T=0. Тази права линия се нарича изобара. Различните налягания съответстват на различни изобари. Процесът на промяна на състоянието на термодинамична система при постоянно налягане се нарича изобарен (фиг. 2 графика на изобарен процес).

Фиг.2
Законът на Чарлз. Изохора
През 1787 г. френският учен Дж. Чарлз експериментално открива зависимостта на налягането на газа от температурата при постоянен обем. Данните са в основата на закона за газа на Чарлз.
Формулировката на закона на Чарлз е следната: за дадена маса газ съотношението на налягането на газа към неговата температура е постоянно, ако обемът на газа не се променя. Тази връзка се записва математически, както следва:
P/T=const, ако V=const и m=const
Този закон може приблизително да се наблюдава, когато налягането на газа се увеличи във всеки контейнер или в електрическа крушка при нагряване. Изохорният процес се използва в газовите термометри с постоянен обем. Законът на Чарлз не се спазва в областта на ниски температури, близки до температурата на втечняване (кондензация) на газовете.
Законът е валиден за идеален газ. Работи добре за разредени газове, които са близки до идеалните по свойства. Температурата на газа трябва да е достатъчно висока. Процесът трябва да е много бавен
Графично тази зависимост в P-T координатите се изобразява като права линия, излизаща от точката T=0. Тази права линия се нарича изохора. Различните изохори съответстват на различни обеми. Процесът на промяна на състоянието на термодинамична система при постоянен обем се нарича изохоричен. Фиг. 3 (графика на изохоричен процес).
 Кратка биография на алберт айнщайн
Кратка биография на алберт айнщайн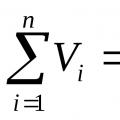 Закон на Далтон за смес от газове: примери за решаване на задачи
Закон на Далтон за смес от газове: примери за решаване на задачи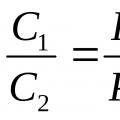 Дишане. Законът на Бойл-Мариот Законът на Бойл-Мариот се осъществява при постоянна
Дишане. Законът на Бойл-Мариот Законът на Бойл-Мариот се осъществява при постоянна