Grunnleggende emner i kjemi for 8. Kjemitimer
En kjemiarbeidsbok for 8. klasse Gabrielyan er et sett med ferdige hjemmeoppgaver, inkludert løste problemer, beregnede reaksjonsligninger, hentet fra O.S. Gabrielyans lærebok, som er det klassiske grunnlaget for å studere kjemi i 8. klasse i russiske ungdomsskoler.
Kjemibok for klasse 8 Gabrielyan O.S. 2013–2019
Problemer og reaksjonsligninger i et kjemikurs er vanskelige praktiske oppgaver som ikke alle skoleelever klarer første gang. Åttendeklassinger kan oppleve spesielle vanskeligheter når de forbereder lekser: I 8. klasse får elevene tildelt en ganske stor mengde lekser, noe som ikke lar dem kaste bort mye tid på å forberede hvert emne.
Vår nettside tilbyr skolebarn GDZ i kjemi for 8. klasse Gabrielyan, som lar elevene:
- gjør leksene dine godt;
- forstå mekanismene for problemløsning;
- konsolidere teoretisk materiale studert i klassen;
- forberede seg til prøver og eksamener i faget.
Basert på ferdige svar og løsninger kan foreldre sjekke barnas fremgang i kjemi og hjelpe dem med leksene.
Vår ressurs har et sett med betydelige fordeler:
- den nødvendige læreboken kan enkelt finnes gjennom søkefeltet;
- ved å klikke på problemnummeret i tabellen, kan du umiddelbart gå til det elektroniske svaret;
- Siden er ikke bare tilgjengelig på datamaskiner – den har en oppdatert versjon for nettbrett og telefoner.
Vi overvåker databasen med løsere for oppdateringer og streber etter å sikre at det finnes flere nettbaserte svar for én oppgave.
Svar fra GDZ lærebok om kjemi for klasse 8 Gabrielyan
Foreløpig er læreplanen for videregående skoler i Russland satt sammen på grunnlag av læreboken av Gabielyan O.S., utgitt av Drofa forlag i 2013.
Læreboken består av en innledende del (6 avsnitt) og 5 hovedkapitler som dekker så viktige emner som:
- Atomstruktur og atomforbindelser av kjemiske elementer;
- Enkle stoffer, deres egenskaper;
- Blandinger av stoffer og løsninger;
- Ionebytterreaksjoner;
- Redoks prosesser.
Læreboka inkluderer to kjemiske verksteder (laboratoriearbeid). Alle deler av læreboken er støttet av praktiske spørsmål, oppgaver og øvelser som lar deg effektivt mestre teorien om emnet.
Stikkord: Kjemi 8. klasse. Alle formler og definisjoner, symboler for fysiske mengder, måleenheter, prefikser for å angi måleenheter, forhold mellom enheter, kjemiske formler, grunnleggende definisjoner, kort, tabeller, diagrammer.
1. Symboler, navn og måleenheter
noen fysiske mengder brukt i kjemi
| Fysisk mengde | Betegnelse | Enhet |
| Tid | t | Med |
| Press | s | Pa, kPa |
| Mengde av stoff | ν | muldvarp |
| Masse av stoff | m | kg, g |
| Massefraksjon | ω | Dimensjonsløs |
| Molar masse | M | kg/mol, g/mol |
| Molar volum | Vn | m 3 /mol, l/mol |
| Volum av stoff | V | m 3, l |
| Volumfraksjon | Dimensjonsløs | |
| Relativ atommasse | A r | Dimensjonsløs |
| MR | Dimensjonsløs | |
| Relativ tetthet av gass A til gass B | D B (A) | Dimensjonsløs |
| Tetthet av materie | R | kg/m 3, g/cm 3, g/ml |
| Avogadros konstant | N A | 1/mol |
| Absolutt temperatur | T | K (Kelvin) |
| Temperatur i Celsius | t | °C (grader Celsius) |
| Termisk effekt av en kjemisk reaksjon | Q | kJ/mol |

2. Forhold mellom enheter av fysiske størrelser

3. Kjemiske formler i 8. klasse
4. Grunnleggende definisjoner i 8. klasse

- Atom- den minste kjemisk udelelige partikkel av et stoff.
- Kjemisk element- en viss type atom.
- Molekyl- den minste partikkelen av et stoff som beholder sin sammensetning og kjemiske egenskaper og består av atomer.
- Enkle stoffer- stoffer hvis molekyler består av atomer av samme type.
- Komplekse stoffer- stoffer hvis molekyler består av atomer av forskjellige typer.
- Kvalitativ sammensetning av stoffet viser hvilke atomer av grunnstoffer den består av.
- Kvantitativ sammensetning av stoffet viser antall atomer til hvert grunnstoff i dets sammensetning.
- Kjemisk formel- konvensjonell registrering av den kvalitative og kvantitative sammensetningen av et stoff ved bruk av kjemiske symboler og indekser.
- Atommasseenhet(amu) - en måleenhet for atommasse, lik massen av 1/12 av et karbonatom 12 C.
- Muldvarp- mengden av et stoff som inneholder et antall partikler lik antall atomer i 0,012 kg karbon 12 C.
- Avogadros konstant (Na = 6*10 23 mol -1) - antall partikler inneholdt i en mol.
- Molar masse av et stoff (M ) er massen til et stoff tatt i en mengde på 1 mol.
- Relativ atommasse element EN r - forholdet mellom massen til et atom i et gitt grunnstoff m 0 til 1/12 av massen til et karbonatom 12 C.
- Relativ molekylvekt stoffer M r - forholdet mellom massen til et molekyl av et gitt stoff og 1/12 av massen til et karbonatom 12 C. Den relative molekylmassen er lik summen av de relative atommassene til de kjemiske elementene som danner forbindelsen, ta hensyn til antall atomer til et gitt grunnstoff.
- Massefraksjon kjemisk element ω(X) viser hvilken del av den relative molekylmassen til stoff X som utgjøres av et gitt grunnstoff.
ATOMMOLEKYLÆR UNDERVISNING
1. Det finnes stoffer med molekylær og ikke-molekylær struktur.
2. Det er hull mellom molekylene, hvis størrelser avhenger av stoffets aggregeringstilstand og temperatur.
3. Molekyler er i kontinuerlig bevegelse.
4. Molekyler er bygd opp av atomer.
6. Atomer er preget av en viss masse og størrelse.
Under fysiske fenomener blir molekyler bevart, under kjemiske fenomener blir de som regel ødelagt. Atomer omorganiseres under kjemiske fenomener, og danner molekyler av nye stoffer.

LOV OM KONSTANT SAMMENSETNING AV STOFFER
Hvert kjemisk rent stoff med molekylær struktur, uavhengig av fremstillingsmetoden, har en konstant kvalitativ og kvantitativ sammensetning.
VALENS
Valens er egenskapen til et atom i et kjemisk element for å feste eller erstatte et visst antall atomer i et annet element.

KJEMISK REAKSJON
En kjemisk reaksjon er et fenomen som fører til at andre stoffer dannes fra ett stoff. Reaktanter er stoffer som inngår i en kjemisk reaksjon. Reaksjonsprodukter er stoffer som dannes som følge av en reaksjon.
Tegn på kjemiske reaksjoner:
1. Frigjøring av varme (lys).
2. Endring i farge.
3. Lukt vises.
4. Dannelse av sediment.
5. Gassutløsning.
Element hydrogen
I sin nye kjemivideotime vil professor Dmitry Ivanovich fortelle nysgjerrige TV-seere om grunnstoffet hydrogen.
Ved å svare på et spørsmål fra TV-seeren Vsevolod Makarov, vil Dmitry Ivanovich forklare hvorfor grunnstoffet hydrogen kan finnes i to celler i D.I.-tabellen samtidig. Mendeleev. Det viser seg at hele poenget ligger i hans evne til å være i forskjellige tilstander. Men for å forstå alt riktig, må du selvfølgelig først huske prinsippet om strukturen til selve det periodiske systemet og forskjellene mellom gruppene av elementer i denne tabellen. Da blir alt umiddelbart klart.
Også fra denne videokjemitimen vil TV-seere lære at grunnstoffet hydrogen er det vanligste grunnstoffet i universet. Hvor er han ikke! Selv solen består av tre fjerdedeler av den!
Å bruke grunnstoffet hydrogen som drivstoff åpner for spennende utsikter! Tross alt er de skadelige konsekvensene av å brenne slikt drivstoff for miljøet minimale, om ikke fraværende. Derfor kan bruken av slikt drivstoff i stor skala i betydelig grad hjelpe menneskeheten med å løse miljøproblemer.
Leksjonsemne:"Syrer, deres sammensetning, klassifisering og betydning."
Leksjonens mål:
Pedagogisk:
Vurder sammensetningen og klassifiseringen av syrer;
Fortsett å utvikle evnen til å skrive ned formlene for stoffer i hovedklassene av uorganiske forbindelser;
Fortsett å utvikle ferdighetene til å bestemme graden av oksidasjon av kjemiske elementer i forbindelser;
Pedagogisk:
Fortsett utviklingen av elevenes tenkeferdigheter: sammenligne, analysere, trekke konklusjoner;
Fortsett å utvikle eksperimentelle arbeidsferdigheter;
Fortsette utviklingen av generelle pedagogiske ferdigheter;
Utvikle interesse for faget.
Pedagogisk:
Fremme en kultur for kunnskapsarbeid og samarbeid;
Fremme en følelse av ansvar og nøyaktighet;
Bidra til å skape et gunstig psyko-emosjonelt klima i klasserommet.
Leksjonstype: kombinert
Læringsmetoder: verbal (historie, forklaring, samtale);
Illustrerende;
Demonstrasjon;
Delvis søk, problembasert, forskning.
Utstyr og reagenser: bærbar PC, projektor, interaktiv tavle, presentasjon, prøver av syrer: saltsyre, svovelsyre, askorbinsyre, eddiksyre, sitronsyre, reagensrør, reagensrørstativ, indikatorer, notatbøker, arbeidsark, tabeller med syreformler.
I løpet av timene:
Org. øyeblikk
Oppdatering av kunnskap.
? Gutter, vi har begynt å studere klasser av uorganiske forbindelser. Hvilke klasser av stoffer har vi allerede blitt kjent med?(Oksider, hydrider og flyktige hydrogenforbindelser, baser).
CaO, SO 2 , Fe 2 OM 3 , Na 2 Å, Cl 2 OM 7 (lysbilde 1).
? Hvilke formler ser du?
? Hvilke stoffer kalles oksider?
? Hvilken klasse tilhører følgende stoffer: KOH, Al(OH) 3 , Ba(OH) 2 , Cu(OH) 2 ?
? Hvilke stoffer regnes som baser?
? Hva bestemmer antall hydroksylgrupper i basen?(Avhengig av oksidasjonstilstanden til metallet.)
(lysbilde 2). Tic Tac Toe "Foundations"
Finn vinnerbanen som består av basisformlene.
Spillebane nr. 1 Spillebane nr. 2
Nevn disse årsakene.? Hva har fundamentene i den første spillebanen til felles og hvordan skiller de seg fra fundamentene som ligger på spillebanen nr. 2?(I det første spillefeltet - løselige baser, i det andre - uløselige.)
Gi eksempler
? Hva er egenskapene til løselige baser? Hvilke forholdsregler bør tas ved håndtering av alkalier?
Sammensatt klassifiseringsoppgave.(lysbilde 3)
Klassifiser stoffene nedenfor i tre grupper. Gi navn til disse gruppene
CaO, Al(OH) 3 , CuO, HCl, H 2 Å, Cl 2 OM 7 , Fe(OH) 2 , NR 3 , NaOH, H 2 SÅ 4 .
Lære nytt stoff
I den tredje gruppen plasserte du stoffer som fortsatt er ukjente for deg, som tilhører klassen syrer. Det er med stoffer av denne klassen vi skal bli kjent i dag. Så temaet for leksjonen vår er "Syrer: sammensetning, klassifisering og mening."Skriv ned emnet for leksjonen i arbeidsboken din. (lysbilde 4).
? Hva trenger vi å vite om syrer?(Sammensetning, formler, navn, klassifiseringer, betydning, sikkerhetsforskrifter).
En rekke syrer (lysbilde 5).
Syrestudieplan (lysbilde 6).
Sammensatt.
Klassifisering.
Nomenklatur og tilsvarende oksider
Betydning og anvendelse.
Sikkerhetsregler ved arbeid med syrer.
Sammensetning av syrer (lysbilde 7).
Du ser formlene for tre syrer: saltsyreHCl , gemsN 2 SÅ 4 og fosforsyrerN 3 RO 4 . Hva har de til felles?
Ja, dette er tilstedeværelsen i deres sammensetning av hydrogenatomer, som alle tre formlene begynner med. Resten kalles syreresten.
Syrer – komplekse stoffer hvis molekyler består av hydrogenatomer og en syrerest.
Klassifisering av syrer
A) ved tilstedeværelse av oksygen . (lysbilde 8)
? Legg merke til forskjellene i syrerestene til de to gruppene av syrer på tavlen. Hva er denne forskjellen?
Det er riktig, de sure restene av svovelsyre, salpetersyre, fosforsyre og perklorsyre inneholder oksygen, og de sure restene av saltsyre, hydrobromsyre, svovelsyre og flussyre inneholder ikke oksygen.
Tilstedeværelsen av oksygen eller dets fravær er et av tegnene på klassifiseringen av syrer. I henhold til dette kriteriet er syrer delt inn i to grupper:oksygenfri Ogoksygenholdig. Gi eksempler på oksygenfrie og oksygenholdige syrer fra tabellen.
B) Klassifisering av syrer etter basicitet . (lysbilde 9).
? Se på syreformlene på tavlen. De er delt inn i tre grupper etter bestemte kriterier. Hva tror du dette skiltet er?
Grunnleggende – antall hydrogenatomer i en syre.
Gi eksempler på monobasiske, dibasiske og tribasiske syrer fra tabellen.
Ved antall hydrogenatomer kan du bestemme den totale ladningen til syreresten, som, når den er oppløst i vann, danner et negativt ladet ion.
Hydrogen, når det er oppløst, danner et positivt ladet ion, hvis ladning er +1. Betegnelsen på en iones ladning har sine egne egenskaper.
B) Klassifisering av syrer etter løselighet i vann (Lysbilde 10).
Forresten, evnen til å oppløses i vann er et annet tegn på klassifiseringen av syrer. På dette grunnlaget er alle syrer delt inn i to grupper: løselige og uløselige. La oss gi eksempler ved å bruke løselighetstabellen.
Graden av oksidasjon av grunnstoffer i syrer og oksidene som tilsvarer syrer. (Lysbilde 11).
1 −1 +1 − 2 +1 X − 2 +5 − 2
HCl H 2 S H 3 RO 4 → S 2 OM 5 - fosforsyre
(+1) 3+x + (−2) · 4 = 0
x - 5 = 0
X = + 5
1 + 3 − 2 +3 − 2
N 3 RO 3 → S 2 OM 3 - fosforsyre
Identifiser oksidene som tilsvarer syrer.(Lysbilde 12).
N 2 SÅ 4 → SÅ 3 Н NR 3 → N 2 OM 5
N 2 SÅ 3 → SÅ 2 Н NR 2 → N 2 OM 3
Nomenklatur av syrer
Anoksiske syrer:
En vokal legges til navnet på det syredannende elementet"O"
og ordene "hydrogensyre"
HCl- saltsyreN 2 S – hydrosulfidsyre
Oksygenholdige syrer:
Suffikset er lagt til det russiske navnet på det syredannende elementet:
Hvis elementet viserhøyere CO(lik gruppenummer)
+6
– "-n" og slutten "-aya":H 2 SÅ 4
svovelsyre
Hvis elementet CO under høyest +4
– "-ist" og slutten "-aya":H 2 SÅ 3
svovelsyrling
Syrenes betydning i naturen og menneskelivet (lysbilde 13-14).
Syrer i naturen
Syrer i menneskelivet
I menneskekroppen
I å lage mat
I medisin
I den nasjonale økonomien
Sur nedbør
Sikkerhetsregler ved arbeid med syrer (Lysbilde 15-16).
På 1800-tallet bodde og arbeidet vitenskapsmannen Justus Liebig i Tyskland. Han var en eksperimentør fra Gud, fra en tidlig alder hjalp han entusiastisk faren med å forberede lakk, maling og medisiner. En dag, under en gresktime, eksploderte Liebigs ryggsekk med kvikksølvfulminat. Faren forsikret seg om at gutten ikke ble utsolgt til gymsalen, og gjorde ham i lære hos en farmasøyt. Noen måneder senere visste den tretten år gamle kjemikeren bedre enn læreren hvordan man sammensatte medisiner. Etter nok en eksplosjon ble han kastet ut, men han ga ikke opp studiene i kjemi og i en alder av 23 ble han professor ved Universitetet i Giessen. Slik beskriver Karl Vogt, en kjemiker som jobbet med Liebig, ett tilfelle. «Liebig kommer inn, holder en flaske med en jordpropp i hendene. «Kom igjen, bare hånden din», sier han til Vogt og tar på hånden hans med en våt kork. «Er det ikke sant, det brenner? – spør Liebig rolig. "Jeg har akkurat fått vannfri maursyre." Synes du Liebig håndterte syrer riktig?
(Nei. Når du arbeider med kjemikalier, må du være forsiktig: fjern håret, rull opp ermene, hell ikke mer enn 1-2 ml løsninger, hold glasset med etiketten opp.)
? Hvordan kan du bestemme syre uten å ty til ekstreme metoder?
Konsolidering av kunnskap
Laboratorieerfaring
INSTRUKSJONSKORT:
Arbeidsform: dampbad.
Driftstid – 8-10 minutter.
Trening:
Studer fargen på indikatorer i sure miljøer.
Utstyr og reagenser:
3 reagensglass med saltsyre og 3 reagensglass med sitronsyre, væskeindikatorer: lakmus, fenolftalein og metyloransje, glassstaver.
Sikkerhetsreguleringer:
Merk følgende! Det er nødvendig å jobbe med syrer nøye, da du kan bli brent eller forgiftet. Hvis syre kommer på huden din, vask den av med en vannstråle.
Gjennomføring av eksperimentet og rapportering av resultatene:
1. gruppe:
Tilsett en dråpe fenolftalein i et reagensrør med saltsyre. Rør med en glassstang. Noter observasjonsresultatene i tabellen.
Tilsett en dråpe metyloransje i det andre reagensglasset med saltsyre. Rør med en glassstang. Noter observasjonsresultatene i tabellen.
Tilsett en dråpe lakmus i det 3. reagensglasset med saltsyre. Rør med en glassstang. Noter observasjonsresultatene i tabellen.
Gruppe 2:
Tilsett en dråpe fenolftalein i et reagensrør med sitronsyre. Rør med en glassstang. Noter observasjonsresultatene i tabellen.
Tilsett en dråpe metyloransje i det andre reagensglasset med sitronsyre. Rør med en glassstang. Noter observasjonsresultatene i tabellen.
Tilsett en dråpe lakmus i det tredje reagensglasset med sitronsyre. Rør med en glassstang. Noter observasjonsresultatene i tabellen.
Effekt av syrer på indikatorer
Diskusjon av resultater og formulering av konklusjoner:Hvilke indikatorer endret fargen i syrer?(Lakmus og metyloransje).
? Så du de samme fargeendringene til disse indikatorene i begge syrene?(Ja).
? Hvilken farge fikk lakmus og metyloransje i både saltsyre og sitronsyre?
(Lakmus ble rød og metyloransje ble rosa).
Basert på eksperimentene som er utført, trekker vi følgende konklusjoner:
uavhengig av type syre (organisk eller uorganisk), endrer indikatorene fargen den samme; som betyr at alle syrer har like egenskaper.
?
Hva henger dette sammen med?(Med tilstedeværelse av hydrogenatomer).
Hvis du har tid. Oppgave på lysbilde 18
Oppsummering. Speilbilde.
Oppsummering av leksjonen. Karaktersetting.
Fortsett setningen
I dag i timen lærte jeg...
Jeg lærte…
Det var ikke klart for meg...
Dette er en leksjon for meg...
Det vekket interesse...
Vanskeligheter oppsto når...
Hjemmelekser. §20, s. 102-107, lær formler og navn på syrer, oppgave 6 ("Arbeidsark"), oppgave 1, s. 107 (lærebok).
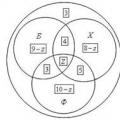 Euler-sirkler er figurer som konvensjonelt representerer sett
Euler-sirkler er figurer som konvensjonelt representerer sett Grunnleggende emner i kjemi for 8
Grunnleggende emner i kjemi for 8 Kunstakademiet i Praha
Kunstakademiet i Praha