Μια ουσία που αποχρωματίζει το βρωμιούχο νερό. Βρωμιούχο νερό: οι ιδιότητες και τα χαρακτηριστικά του
Το Br 2 σε κανονική θερμοκρασία είναι ένα καφέ-καφετί βαρύ υγρό που σχηματίζει τοξικούς κόκκινο-καφέ ατμούς με πικάντικη οσμή. Η διαλυτότητα του βρωμίου στο νερό είναι μεγαλύτερη από αυτή του χλωρίου. κορεσμένο διάλυμαΤο Br 2 στο νερό ονομάζεται " βρωμιούχο νερό».
Δωρεάν I 2 σε κανονική θερμοκρασία - μαύρο-γκρι με μωβ απόχρωση στερεός, έχει αισθητή μεταλλική λάμψη. Το ιώδιο εξαχνώνεται εύκολα, έχει μια περίεργη μυρωδιά (ο ατμός ιωδίου, όπως και το βρώμιο, είναι πολύ δηλητηριώδης). Η διαλυτότητα του I 2 στο νερό είναι η μικρότερη μεταξύ όλων των αλογόνων, αλλά διαλύεται καλά σε αλκοόλη και άλλους οργανικούς διαλύτες.
Πώς να πάρει
1. Το βρώμιο και το ιώδιο εξάγονται από το θαλασσινό νερό, τις υπόγειες άλμης και τα νερά γεωτρήσεων, όπου περιέχονται με τη μορφή ανιόντων Br - και I -. Η επιλογή των ελεύθερων αλογόνων πραγματοποιείται χρησιμοποιώντας διάφορα οξειδωτικά, τις περισσότερες φορές περνούν αέριο χλώριο:
2NaI + Cl 2 \u003d I 2 + 2NaCl
2NaBr + Cl 2 \u003d Br 2 + 2NaCI
2. Σε εργαστηριακές συνθήκεςγια να λάβετε τα Br 2 και I 2 χρησιμοποιήστε, για παράδειγμα, τις ακόλουθες αντιδράσεις:
2NaBr + MnO 2 + 2H 2 SO 4 = Br 2 ↓ + MnSO 4 + Na 2 SO 4 + 2H 2 O
bHBr + 2H 2 SO 4 = 3Br 2 ↓ + S↓ + 4H 2 O
2HI + H 2 SO 4 \u003d I 2 ↓ + SO 2 + 2H 2 O
Χημικές ιδιότητες
Με Χημικές ιδιότητεςτο βρώμιο και το ιώδιο είναι παρόμοια με το χλώριο. Οι διαφορές σχετίζονται κυρίως με τις συνθήκες αντίδρασης. Σημειώνουμε μερικά σημαντικά χαρακτηριστικά χημικές αντιδράσειςπου περιλαμβάνει Br 2 και I 2 .
Το Br 2 είναι ένα πολύ ισχυρό οξειδωτικό
Το βρώμιο είναι υγρό, σε αντίθεση με το αέριο Cl 2, επομένως η συγκέντρωση των μορίων σε αυτό είναι υψηλότερη. Αυτό εξηγεί την ισχυρότερη οξειδωτική δράση του υγρού βρωμίου. Για παράδειγμα, όταν ο σίδηρος και το αλουμίνιο έρχονται σε επαφή με αυτό, εμφανίζεται ανάφλεξη ακόμη και σε συνηθισμένες θερμοκρασίες.
Νερό βρωμίου - ένα αντιδραστήριο για τη διεξαγωγή ποιοτικών αντιδράσεων
Το βρωμιούχο νερό έχει ένα κίτρινο-καφέ χρώμα, το οποίο εξαφανίζεται γρήγορα εάν το διαλυμένο Br 2 αντιδράσει με οποιαδήποτε ουσία. Ο "αποχρωματισμός βρωμίου νερού" είναι μια δοκιμή για την παρουσία σε διάλυμα ενός αριθμού ανόργανων και οργανικών ουσιών.
1. Ανίχνευση αναγωγικών παραγόντων σε διαλύματα
Το αέριο και διαλυμένο σε νερό SO 2 και H 2 S, καθώς και διαλυτά θειώδη και σουλφίδια αποχρωματίζουν το βρωμιούχο νερό:
Br 2 + Na 2 SO 3 + H 2 O \u003d 2HBr + Na 2 SO 4
Br 2 + H 2 S \u003d 2HBr + S ↓
3Br 2 + Na 2 S + ZN 2 O \u003d 6HBr + Na 2 SO 3
2. Ανίχνευση πολλαπλών δεσμών άνθρακα-άνθρακα
Ποιοτική ανταπόκριση σε απεριόριστη ΟΡΓΑΝΙΚΕΣ ΕΝΩΣΕΙΣ- αποχρωματισμός του βρωμιούχου νερού:
R-CH=CH-R" + Br 2 → R-CHBr-CHBr-R"
3. Ανίχνευση φαινόλης και ανιλίνης σε οργανικά διαλύματα
Η φαινόλη και η ανιλίνη αλληλεπιδρούν εύκολα με το βρωμιούχο νερό και τα προϊόντα της αντίδρασης δεν διαλύονται σε οργανικούς διαλύτες, επομένως σχηματίζουν ιζήματα:
C 6 H 5 OH + ZBr 2 → C 6 H 2 Br 3 OH ↓ + ZHBr 2
С 6 Н 5 NH 2 + ЗВr 2 → С 6 H 2 Br 3 NH 2 ↓ + ЗНВr
Αντίδραση ιωδίου-αμύλου σε ποιοτική ανάλυση
Ανιόντα I - οξειδώνονται πολύ εύκολα τόσο από ισχυρούς όσο και από ασθενείς οξειδωτικούς παράγοντες:
2I - -2e - → I 2
Ακόμη και μικρές ποσότητες του I 2 που απελευθερώνεται μπορούν να ανιχνευθούν χρησιμοποιώντας ένα διάλυμα αμύλου, το οποίο αποκτά ένα χαρακτηριστικό βρώμικο μπλε χρώμα παρουσία του I 2 . Η αντίδραση ιωδίου-αμύλου χρησιμοποιείται για τη διεξαγωγή όχι μόνο ποιοτική ανάλυσηαλλά και ποσοτικά.
Αντιδράσεις που περιλαμβάνουν το I2 ως αναγωγικό παράγοντα
Τα άτομα ιωδίου έχουν χαμηλότερη συγγένεια ηλεκτρονίων και τιμές EO από άλλα αλογόνα. Από την άλλη πλευρά, η εκδήλωση κάποιας μεταλλικότητας στο ιώδιο εξηγείται από μια σημαντική μείωση της ενέργειας ιοντισμού, λόγω της οποίας τα άτομά του δίνουν ηλεκτρόνια πολύ πιο εύκολα. Σε αντιδράσεις με ισχυρούς οξειδωτικούς παράγοντες, το ιώδιο συμπεριφέρεται ως αναγωγικός παράγοντας, για παράδειγμα:
I 2 + I0HNO 3 \u003d 2HIO 3 + 10NO 2 + 4H 2 O
I 2 + 5H 2 O 2 \u003d 2HIO 3 + 4H 2 O
I 2 + 5Cl 2 + 6H 2 O \u003d 2HIO 3 + 10HCl
Υδροβρωμιούχο και υδροιώδιο
Το HBr και το HI είναι πολύ παρόμοια σε φυσικές και χημικές ιδιότητες με το HCl, επομένως, πρέπει να δίνεται προσοχή μόνο σε πρακτικά σημαντικές διαφορές που πρέπει να λαμβάνονται υπόψη κατά τη λήψη αυτών των ουσιών.
Θερμική αστάθεια HBr και HI
Τα μόρια HBr και HI είναι λιγότερο σταθερά από το HCl, επομένως η σύνθεσή τους από απλές ουσίεςδύσκολο λόγω της αναστρεψιμότητας της αντίδρασης (ειδικά στην περίπτωση του HI).
H 2 + I 2 → 2HI
Τα ανιόντα Br - και I - είναι ισχυρότεροι αναγωγικοί παράγοντες από τα ανιόντα Cl -.
Η HCI λαμβάνεται με τη δράση του συζ. H 2 SO 4 σε χλωρίδια (για παράδειγμα, στερεό NaCl). Το υδροβρώμιο και το υδροιώδιο δεν μπορούν να ληφθούν με αυτόν τον τρόπο, αφού οξειδώνονται με συμπ. H 2 SO 4 σε ελεύθερα αλογόνα:
2KVg + 2H 2 SO 4 \u003d Br 2 + SO 2 + 2H 2 O + K 2 SO 4
6KI + 4H 2 SO 4 \u003d 3I 2 + S + 4H 2 O + 3K 2 SO 4
Λήψη HBr και HI:
1) από βρωμίδια και ιωδίδια
Είναι απαραίτητο να εκτοπιστούν τα HBr και HI από τα άλατά τους με μη πτητικό μη οξειδωτικό φωσφορικό οξύ
KVg + H 3 PO 4 \u003d HBr + KN 2 PO 4
2) υδρόλυση αλογονιδίων μη μετάλλων
KI + H 3 PO 4 \u003d HI + KN 2 PO 4
3) αναγωγή ελεύθερων αλογόνων σε υδατικά διαλύματα
РВr 3 + ЗН 2 O = H 3 PO 3 + ЗНВr
PI 3 + ZN 2 O \u003d H 3 PO 3 + 3HI
Br 2 + SO 2 + 2H 2 O \u003d 2HBr + H 2 SO 4
l 2 + H 2 S = 2HI + S↓
4Br 2 + BaS + 4Н 2 O = 8HBr + BaSO 4
Το βρώμιο είναι μια ουσία που, όπως ο υδράργυρος, βρίσκεται σε θερμοκρασία δωματίου υγρή κατάσταση. Είναι πολύ τοξικό αλλά χρησιμοποιείται ευρέως σε χημική βιομηχανίακαι εργαστήρια. Ανήκει στην ομάδα των αλογόνων, αλλά πιο αδύναμο από το χλώριο. Όταν περνά μέσα από το νερό, σχηματίζει ένα διάλυμα που ονομάζεται βρωμιούχο νερό.
Βρωμίου και παρασκευή βρωμιούχου νερού
Το ίδιο το στοιχείο είναι ένα κόκκινο-καφέ υγρό με ισχυρό, άσχημη μυρωδιά. Δεν αξίζει να το αναπνεύσετε, καθώς μπορεί να δηλητηριαστείτε και σχεδόν κανείς δεν θα έχει τέτοια επιθυμία. Το ίδιο το όνομα μιλάει για αυτή την ιδιότητα, επειδή το βρώμιο σε μετάφραση από τα αρχαία ελληνικά σημαίνει "βρωμάει", "βρωμάει".
Το μόριο είναι διατομικό και ο τύπος του είναι Br 2 . Το ίδιο το στοιχείο βρέθηκε το 1826 και έφερε φήμη στον ανακάλυψε του, τον νεαρό δάσκαλο Antoine Balard. Το βρώμιο διανέμεται παντού, αλλά κυρίως στο θαλασσινό νερό και στις αλμυρές λίμνες. Δεν είναι η ίδια η ουσία που χρησιμοποιείται στην παραγωγή και τα εργαστήρια, αλλά το διάλυμά της, που παρασκευάζεται εύκολα.
Παρασκευάστε διάλυμα βρωμιούχου νερού μόνο σε απαγωγέα καπνού λόγω των δηλητηριωδών ατμών. Για να το κάνετε αυτό, πάρτε βρώμιο σε όγκο ενός χιλιοστόλιτρου και ρίξτε το σε νερό (αποσταγμένο, διαφορετικά θα πάρετε πολλές περιττές ακαθαρσίες) με όγκο 250 χιλιοστόλιτρων, ανακατεύοντας εντατικά με μια γυάλινη ράβδο. Το βρωμιούχο νερό είναι έτοιμο.Πρέπει να το αποθηκεύσετε μόνο σε σκούρο γυαλί, ερμητικά κλεισμένο. Προσοχή, γιατί, σε επαφή με το δέρμα, το βρώμιο προκαλεί σοβαρά και επώδυνα εγκαύματα. Εάν συμβεί επαφή, ξεπλύνετε αμέσως την πληγείσα περιοχή με νερό.
Σύνθεση βρωμίου νερού
Ιδιότητες χημικές και φυσικές
Με εμφάνισηΤο βρωμιούχο νερό είναι ένα πορτοκαλοκίτρινο υγρό που έχει πάρει τη δυσάρεστη οσμή του από τη βασική ουσία. Η θερμοκρασία στην οποία το διάλυμα παγώνει είναι αρκετά χαμηλή. Ακόμα και στους -20°C είναι υγρό.

Όπως όλα τα διαλύματα αλογόνου, το βρωμιούχο νερό είναι ένας εξαιρετικός οξειδωτικός παράγοντας, αλλά πιο αδύναμος από ένα διάλυμα χλωρίου. Οξειδώνει μέταλλα και πολλές οργανικές ενώσεις, συμπεριλαμβανομένων των φαινολών. Και η προσθήκη περισσότερου βρωμίου σε αυτό οδηγεί σε μείωση του pH.
Εφαρμογή
Το βρωμιούχο νερό χρησιμοποιείται σε βιομηχανικά εργαστήρια. Μία από τις ποιοτικές απαντήσεις στο ακόρεστους υδρογονάνθρακεςείναι ακριβώς η αλληλεπίδραση αλκενίων και αλκυνίων με διάλυμα βρωμιούχου νερού. Ως αποτέλεσμα, η σύνθεση αποχρωματίζεται. Σπάζοντας διπλούς και τριπλούς δεσμούς, ενώνει βρώμιο, σχηματίζοντας ενώσεις βρωμίου.
Αποχρωματισμός του βρωμιούχου νερού εμφανίζεται επίσης όταν αντιδρά με ακόρεστα έλαια. Περιέχουν επίσης διπλούς και τριπλούς δεσμούς. Η αλληλεπίδραση του ιωδιούχου καλίου με το βρωμιούχο νερό οδηγεί σε αποχρωματισμό του πρώτου και σταδιακή απελευθέρωση μορίων ελεύθερο ιώδιο(Ι 2). Μπορεί να πραγματοποιηθεί με βρωμιούχο νερό ποιοτική αντίδρασηγια την παρουσία CuCl, θα εμφανιστεί κοκκίνισμα όταν προστεθεί μικρή ποσότητα διαλύματος αμμωνίας.

Στην ιατρική, το βρωμιούχο νερό χρησιμοποιείται για την παρασκευή φαρμάκων. Υπήρχε ένας θρύλος ότι στο φαγητό των στρατιωτών προστίθεται βρώμιο για να μειώσει την ισχύ. Αλλά δεν υπάρχει λόγος για αυτή τη δήλωση, καθώς οι ουσίες που περιέχουν βρώμιο δεν έχουν καμία επίδραση στην ανδρική δύναμη. Απλώς ενεργούν νευρικό σύστημαως ηρεμιστικό και ήπιο υπνωτικό χάπι.
Αλλά όταν χρησιμοποιείτε φαρμακευτικές ουσίες που περιέχουν βρώμιο, πρέπει να είστε πολύ προσεκτικοί, καθώς η παρατεταμένη χρήση μπορεί να προκαλέσει μια ασθένεια όπως ο βρωμισμός. Τα κύρια συμπτώματα της νόσου είναι μια γενική κατάρρευση, που συνοδεύεται από εξάνθημα στο δέρμα και έλλειψη όρεξης. Για να ομαλοποιηθεί η κατάσταση, είναι επείγον να αφαιρεθεί από το σώμα δραστική ουσία. Για αυτό, συνταγογραφούν ένας μεγάλος αριθμός απόυγρά και τρόφιμα υπέροχο περιεχόμενοάλατα.
Το βρώμιο νερό χρησιμοποιείται επίσης στην κατασκευή - σε διαφορετικά στάδια της παραγωγής ουσιών που προστατεύουν τα υφάσματα, το ξύλο και τα οικοδομικά υλικά από τις φλόγες. Αυτές οι ουσίες ονομάζονται επίσης επιβραδυντικά φλόγας.Το βρωμιούχο νερό και τα βρωμίδια χρησιμοποιούνται σε πτήσεις, για την οξείδωση καυσίμου πυραύλων, στην παραγωγή πετρελαίου, σε γεωργία(παραγωγή φυτοφαρμάκων και εντομοκτόνων).
Είναι σύνηθες να γράφουμε μέσω ενός τέτοιου τύπου - Br2, αν και είναι σε διάλυμα με τη μορφή ενός μείγματος δύο οξέων - HBrO (υποχλωρώδες οξύ) και HBr. Αυτή η ένωση έχει ένα κίτρινο-πορτοκαλί χρώμα και είναι αρκετά χαμηλή θερμοκρασίαπάγωμα. Είναι ένας ισχυρός οξειδωτικός παράγοντας που είναι ικανός να οξειδώνει κατιόντα τέτοιων μετάλλων σε αλκαλικό περιβάλλον - Cr +3, Mn +3, Fe +2, Co + 2, Ni +3. Η προσθήκη Br 2 μειώνει τιμή pHδιάλυμα (pH), επειδή βρωμιούχο νερό περιέχει ελεύθερα οξέα.
Αυτή είναι μια χημικά δραστική ουσία που μπορεί να αλληλεπιδράσει τόσο με ανόργανα όσο και με οργανική ύλη. Σκεφτείτε μερικά χημικές διεργασίεςμε αυτή τη σύνδεση.
Ο αποχρωματισμός του βρωμιούχου νερού εξυπηρετεί τα πάντα Για να πραγματοποιηθεί ένα τέτοιο πείραμα, είναι απαραίτητο να αναμειχθεί μια μικρή ποσότητα οποιουδήποτε αλκενίου ή αλκινίου σε δοκιμαστικό σωλήνα με Br 2 . Κατά τη διάρκεια αυτής της αντίδρασης, άτομα βρωμίου προστίθενται στη θέση της ρήξης του διπλού ή τριπλού δεσμού. Η εξαφάνιση του κίτρινου-πορτοκαλί χρώματος κατά τη διάρκεια αυτής της αλληλεπίδρασης είναι απόδειξη του ακόρεστου του υδρογονάνθρακα που λαμβάνεται.

Η χημική αντίδραση «φαινόλη - βρωμιούχο νερό» χρησιμοποιείται για την κατακρήμνιση ενώσεων υποκατεστημένων με βρώμιο από διαλύματα. Εάν αυτή η αλληλεπίδραση των ουσιών πραγματοποιηθεί σε άνυδρο περιβάλλον, τότε ο σχηματισμός της τριβρωμοφαινόλης θα διαρκέσει μερικές ημέρες. Ως εκ τούτου, μια μικρή ποσότητα Η 2 Ο προστίθεται ως καταλύτης.
Βρωμιούχο νερό στο εργαστήριο παρασκευάζεται ως εξής: 250 ml απεσταγμένου νερού προστίθενται σε 1 ml βρωμίου, ενώ αναδεύεται έντονα. Το παρασκευασμένο διάλυμα αποθηκεύεται σε ερμητικά κλειστό σκούρο γυάλινο δοχείο. Εάν το παρασκευασμένο Br 2 αποθηκεύεται στο φως ή σε ελαφριά φιάλη, θα απελευθερωθεί οξυγόνο λόγω της περιεκτικότητας σε υποβρωμικό οξύ. Οι εργασίες για την προετοιμασία του αντιδραστηρίου πραγματοποιούνται σε απαγωγέα καπνού. Δεδομένου ότι το ίδιο το βρώμιο είναι δηλητηριώδες και το βρώμιο νερό το περιέχει, πρέπει να δίνεται προσοχή όταν εργάζεστε με αυτό.

Είναι επίσης απαραίτητο να ληφθεί υπόψη το γεγονός ότι όταν το Br 2 μπαίνει στο δέρμα, εμφανίζεται σοβαρός κνησμός και με παρατεταμένη έκθεση μπορεί να εμφανιστούν έλκη. Εάν η ουσία έρθει σε επαφή με το δέρμα, θα πρέπει να πλυθεί μεγάλο ποσόνερό, και στη συνέχεια Με μεγάλη επιφάνεια τραύματος ή βαθιές βλάβες της επιδερμίδας, το δέρμα λιπαίνεται επιπλέον με μια αλοιφή, η οποία περιλαμβάνει NaHCO 3 .
Το βρωμιούχο νερό χρησιμοποιείται ευρέως σε χημική ανάλυσηκαι σύνθεση βιολογικών παρασκευασμάτων. Έτσι, χρησιμοποιείται στην παραγωγή που περιέχει βρώμιο φάρμακα. Και εδώ χρειάζεται προσοχή, γιατί. η παρατεταμένη χρήση τους μπορεί να οδηγήσει σε ασθένεια - βρωμισμό. Τα κύρια συμπτώματα είναι η απάθεια, ο λήθαργος, η εμφάνιση δερματικού εξανθήματος. Για την ταχύτερη απομάκρυνση των ιόντων βρωμίου από τον οργανισμό ακολουθείται δίαιτα με υψηλή περιεκτικότητα σε αλάτι και άφθονα υγρά. Το βρωμιούχο νερό χρησιμοποιείται επίσης στα ενδιάμεσα στάδια της παραγωγής επιβραδυντικών φλόγας - ουσιών που προστατεύουν από την ανάφλεξη. Εμποτίζουν υφάσματα, ξύλο, οικοδομικό υλικό.
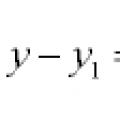 Εξισώσεις γραμμών και καμπυλών στο επίπεδο
Εξισώσεις γραμμών και καμπυλών στο επίπεδο Γενικευμένη ομοιογενής εξίσωση Γενικευμένες ομοιογενείς εξισώσεις δεύτερης τάξης
Γενικευμένη ομοιογενής εξίσωση Γενικευμένες ομοιογενείς εξισώσεις δεύτερης τάξης Χάρη στο κόμμα Λόγω του ότι σε τους
Χάρη στο κόμμα Λόγω του ότι σε τους