Kemija je znanost o materiji. Lekcije iz kemije Obilno ćemo ga namočiti u jod da sve bude sterilno.
Kad čujemo riječ "kemija", odmah zamislimo osobu okruženu tikvicama i epruvetama ispunjenim tvarima svih vrsta boja. Zapisuje nerazumljive simbole koji nam se čine kao hijeroglifi. Suočavamo se s pitanjem kakva je to znanost, koje probleme proučava? Odgovor je vrlo jednostavan, predmet kemije su tvari.
Kemija je znanost o tvarima, njihovim svojstvima i pretvorbama u druge tvari.
Kao i svaka znanost, kemija ima svoju povijest razvoja. Prva kemijska znanja pojavila su se prije naše ere, u starom Egiptu. Egipćani su posjedovali kemijsku znanost, koju su nazivali "Svetom umjetnošću". Neki recepti za izradu parfema i lijekova koriste se i danas. Zasigurno ste čuli za alkemičare i kamen mudraca uz pomoć kojeg svaki metal možete pretvoriti u zlato.
U suvremenom shvaćanju pojam "kemija" može se čuti u nekoliko tumačenja: kemija kao znanost, kao i proizvodi kemijske proizvodnje (jednom riječju, kemija). Ne možemo zamisliti naše postojanje bez kemikalija. Ujutro se probudimo, idemo se umiti: sapun i pasta za zube čekaju nas u kupaonici. Mirisni čaj i hrskave žitarice za doručak. Odjeću, obuću, školski pribor i još mnogo toga dobivamo zahvaljujući kemijskim tehnologijama.
Ali možemo reći i da je kemija štetna. Više puta smo čuli o kiselim kišama, smrti morskog života zbog izlijevanja nafte, nitratima u povrću i voću itd.
Kemija je usko povezana s čovječanstvom i njegov je sastavni dio. Kako ne bismo naštetili našem planetu, potrebno je primjenjivati kemijska znanja i racionalno koristiti tvari.
Zahvaljujući svojoj svestranosti, kemija se koristi u svim područjima:
- Medicina: lijekovi, cjepiva, umjetni organi, kozmetika;
- Umjetnost: slikarstvo, arhitektura, fotografija, izrada nakita, kovanje, lijevanje;
- Poljoprivreda: gnojivo, proizvodi za suzbijanje štetočina;
- Forenzika: identifikacija osoba pomoću DNK, otisaka prstiju, određivanje sastava otrovnih i eksplozivnih tvari;
- Građevinarstvo: proizvodnja građevinskog materijala, prerada drva;
- Metalurgija: nijedna industrija ne postoji bez metala. Metali i legure okružuju nas posvuda;
- U svakodnevnom životu: kućna kemikalija pri pripremanju večere koristimo se i kemijskim znanjem;
- Prehrambena industrija: mliječni proizvodi, mesni proizvodi, umaci, slastice itd.;
- Zaštita okoliša. Trenutno je akutan problem zaštite okoliša. Ljudske aktivnosti imaju štetan učinak na planet. Ali uz pomoć kemijskog znanja, koje se temelji na svojstvima tvari, znanstvenici pronalaze načine za pročišćavanje vode, tla i zraka od štetnih tvari.

()
Kemija je vrlo široka znanost i uključuje mnoge dijelove koji imaju svoju svrhu i proučavaju tvari, njihovu strukturu i svojstva.
- Anorganska kemija ili se još naziva i kemija nežive prirode. Predmet proučavanja: kemijski elementi i njihovi spojevi;
- Biokemija proučava procese koji se odvijaju u organizmima tijekom metabolizma, disanja itd.;
- Organska kemija ili kemija ugljika. Ovaj fascinantan dio predstavlja niz spojeva zbog jedinstvenih svojstava ugljika;
- Fizikalna kemija ispituje obrasce reakcija;
- Analitička kemija, zahvaljujući kvalitativnoj i kvantitativnoj analizi, omogućuje vam proučavanje smjesa.
Da biste svladali kemijsko znanje, morate učiti fiziku, biologiju i matematiku. Kao što se može vidjeti iz dijagrama, kemija se usko preklapa s drugim znanostima.

()
Atomsko-molekularna znanost. Najsitnije čestice
Kao i svaka znanost, kemija ima svoje pojmove i pojmove koji se proučavaju tijekom tečaja. Ovi pojmovi vam neće biti novi; upoznali ste se s njima na satovima fizike i prirodoslovlja. A mi ćemo govoriti o atomima, molekulama, kemijskim elementima i tvarima. Ovi pojmovi temelj su atomsko-molekularne znanosti.
Pogledajmo detaljnije svaki koncept.
Atom
Sigurno ste u udžbeniku ili učionici kemije vidjeli periodni sustav kemijskih elemenata (PSCE). Ima drugačiji izgled i strukturu s kojom ćete se kasnije detaljno upoznati. Klasični prikaz periodnog sustava kemijskih elemenata prikazan je na slici.

()
Iz lekcija iz prirodoslovlja znate da su atomi građevni blokovi svemira.
Atom je najmanja čestica kemijskog elementa koja je odgovorna za njegova svojstva i kemijski je nedjeljiva.
Trenutno je poznato 126 vrsta atoma - kemijskih elemenata. Kakav je odnos između kemijskog elementa i atoma? Kemijski element sastoji se od atoma određene vrste. Koja je razlika između ovih pojmova? Zašto alkemičari nisu mogli pronaći kamen mudraca? Zašto se željezo ili bakar ne pretvaraju u zlato? Da bismo odgovorili na ova pitanja, potrebno je razmotriti strukturu atoma.
Apsolutno svaki atom ima pozitivno nabijenu jezgru i negativne elektrone koji rotiraju oko nje.

(prevela administracija stranice)
Najteža stvar u atomu je jezgra, koja se sastoji od protona (imaju + naboj) i neutrona (0 naboja).
Atom nema naboj, drugim riječima neutralan je.
Broj protona = broj elektrona
Da biste saznali broj čestica, potrebno je odrediti redni broj elementa u PSCE.
Na primjer, ako atom sadrži 10 elektrona i 10 protona, gledajući periodni sustav, vidjet ćemo da taj skup čestica odgovara kemijskom elementu neonu. Kemijski element zlato ima 79 protona i 79 elektrona. Sastav atoma, točnije, broj protona ne mijenja se tijekom kemijskih reakcija. Upravo iz tog razloga alkemičari nisu mogli pronaći recept za kamen mudraca.
Atomi (poput slova koja se spajaju u slogove, a zatim u riječi) kombiniraju se u molekule.
Molekula
Molekula – najmanja čestica materije
Kako nastaju molekule? Povucimo opet analogiju sa slovima. Da biste napravili riječ koja je čitljiva i smislena, potrebna vam je određena kombinacija slova i jasna pravila. Ista stvar se događa kada se formira molekula. Atomi su spojeni u molekulu pomoću kemijskih veza. Svojstva molekula ovise o tome koji atomi elemenata ulaze u njihov sastav, kao io tome kako su međusobno povezani.
Pogledajmo na primjeru molekula tvari koje tvore atomi kisika, to su kisik i ozon. Obje ove molekule tvore atomi kemijskog elementa kisika, ali sastav ozona, čija je kemijska formula O 3, uključuje 3 atoma kisika, a molekula kisika, formula tvari O 2, sadrži dva atoma kemijskog elementa kisika.

()
Ova pojava se naziva alotropija. To je fenomen postojanja jednostavnih tvari koje tvore isti kemijski element, ali različitih svojstava i strukture.
Rekorder u nastanku alotropskih oblika je ugljik koji postoji u obliku dijamanta, grafita, karbina, fulerena i ugljikovih nanocijevi.
Kao što možete vidjeti iz definicije, atomi i molekule su čestice, ali koja je njihova razlika? Povucimo opet analogiju sa slovima i riječima. Slova su atomi, riječi su molekule. Slova se ne mogu sastojati od riječi, kao što atomi ne mogu biti sastavljeni od molekula.

()
Molekula sumporovog dioksida SO2 sastoji se od jednog atoma sumpora i dva atoma kisika. Molekula amonijaka sastoji se od jednog atoma dušika i tri atoma vodika, itd.
Dakle, vidimo da se sve tvari sastoje od atoma kemijskih elemenata. Živa i neživa priroda također je spoj kemijskih elemenata.
Ioni
Što se događa s atomom ako dobije ili izgubi elektrone? Postaje nabijena čestica.

()
Ioni- čestice koje su pozitivno ili negativno nabijene.
Sumirajući sve navedeno, izdvojimo glavne postavke atomsko-molekularne znanosti, koja je temelj u kemiji, fizici i prirodnim znanostima:
- Tvari se sastoje od molekula;
- Atomi su dio molekule;
- Atome i molekule karakterizira spontano kretanje;
- Tijekom kemijskih reakcija mijenja se sastav molekule i nastaju nove tvari.
Supstanca. Razvrstavanje tvari
O djelovanju kemijskih elemenata ovisi hoće li postojati u slobodnom obliku ili će biti dio tvari.
Tvar je skup atoma, atomskih čestica ili molekula koji se nalaze u određenom agregacijskom stanju.
Supstance se dijele na jednostavne i složene.
Definicija je vrlo jednostavna i lako se pamti.

()
Prirodno se postavlja pitanje: po čemu se složena tvar razlikuje od mješavine jednostavnih i složenih tvari?

( )
Slika pokazuje:
A) molekule jednostavne tvari kisika O 2;
B) molekule jednostavne tvari vodika H 2;
C) smjesa jednostavnih tvari O 2 i H 2;
D) molekula složene tvari voda H 2 O;
D) smjesa molekula jednostavne tvari vodik H 2 i složene tvari H 2 O.
Smjese nastaju fizičkim djelovanjem, kao što je miješanje strugotine željeza i vode, a složene tvari nastaju kemijskim djelovanjem, poput hrđe na željezu uzrokovane međudjelovanjem željeza i vode.
Ovisno o tome od kojih su čestica tvari građene, razlikuju se na molekularne i nemolekularne strukture.
Lekcija je razvijena za obrazovni kompleks G.E. Ruđitiša, F.G. Feldman.
Glavni cilj ove lekcije je poopćavanje i učvršćivanje znanja učenika o osnovnim kemijskim pojmovima; aktiviranje kognitivne aktivnosti i povećanje motivacije učenika za proučavanje kemije. Razvoj interesa učenika za kemiju i aktivacija njihove kognitivne aktivnosti, koristeći nestandardne oblike igre obrazovnih aktivnosti. Nastava se izvodi u obliku turnira.
IKT se koristi u nastavi; potreba za korištenjem računalne prezentacije diktirana je sljedećim razlozima:
- Organizacija različitih vrsta studentskih aktivnosti.
- Sredstvo za osiguravanje vidljivosti i zbijanja materijala.
- Organizacija samotestiranja bez gubljenja vremena.
- Omogućuje vam ekonomično korištenje vremena lekcije
Metode: verbalna, vizualna, korištenje ICT-a, problemsko-tražilačka.

Ciljevi utakmice:
- ponavljanje naučenog gradiva iz kemije radi uklanjanja praznina i pripreme za predviđenu provjeru znanja;
- razvijanje i jačanje interesa za kemiju, širenje vidika učenika, povećanje razine njihove kulture;
- razvoj komunikacijskih sposobnosti, povjerenja i lakoće u komunikaciji;
- njegovanje odgovornog odnosa prema zajedničkim aktivnostima.


Ciljana publika: za 8. razred
Ovaj se razvoj može koristiti u proučavanju redoks reakcija u 11. razredu. Sadrži opis laboratorijskog rada koji demonstrira vizualni učinak transformacije spojeva kroma i mangana u različitim okolinama.
Razvoj će također pomoći učitelju da objasni učenicima kako se oksidacijska stanja kroma i mangana mijenjaju ovisno o okruženju otopine i koji spojevi ovih elemenata nastaju u različitim uvjetima. Razvoj sadrži zadatke za učvršćivanje gradiva.


Izrada lekcije iz kemije u 8. razredu ciljevi su:
usustaviti značenje naziva i sastav složenih tvari;
formirati znanja učenika o sastavu baza, valenciji hidrokso skupine, fizikalnim i kemijskim svojstvima lužina i njihovoj pripravi;
razvijati vještine učenika za uspoređivanje tvari i isticanje zajedničkih značajki u sastavu i svojstvima baza.
Ciljevi lekcije:
razvoj vještina za karakteriziranje sastava baza pomoću formula i njihovo razlikovanje od drugih složenih tvari;
uvježbavanje ispravnosti sastavljanja i bilježenja jednadžbi kemijskih reakcija, uključujući reakcije neutralizacije;
razvijanje vještina za točan rad s kemikalijama u skladu sa sigurnosnim propisima. Ova lekcija je izrađena prema nastavnim metodama autora E.E. Minchenkova.


Ciljana publika: za nastavnike
Ovaj razvoj lekcije na temu "Periodni zakon i periodni sustav kemijskih elemenata D.I. Mendelejev u svjetlu teorije strukture atoma" sastavljen je za obrazovni kompleks Gara N.N., udžbenik Kemija-11 (Rudzitis G.E.). Lekcija je namijenjena učenicima 11. razreda. Metodički razvoj uključuje sažetak lekcije kemije u 11. razredu + prezentaciju.
U prezentaciji je prikazano ilustrirano teorijsko gradivo te kontrolno-mjerni materijal za praćenje znanja i vještina.


Koncert lekcije iz kemije u 10. razredu prema nastavnim materijalima Gabrielyan O.S. s prezentacijom s aktivnim poveznicama na video iskustva.
Ciljevi lekcije:
- proučavati kemijska svojstva jednobazičnih karboksilnih kiselina na primjeru octene kiseline;
- prisjetiti se međusobnog utjecaja atoma u molekulama karboksilnih kiselina, nomenklatura;
- razvijati logično razmišljanje, sposobnost generaliziranja i izvlačenja zaključaka; pregledati osnovna sigurnosna pravila; uvježbati vještine rukovanja laboratorijskom opremom;
- njegovati kulturu govora, sposobnost slušanja i pravilnog izražavanja svojih misli.


Ciljana publika: za 10. razred
Misaoni eksperiment, kao jedan od najneobičnijih zadataka u završnom ocjenjivanju učenika, izaziva značajne poteškoće u realizaciji. Uvjeti zadatka često uključuju opis određene kemijske pojave popraćen određenim znakovima. Za što potpunije rješavanje zadataka ove vrste od učenika se traži poznavanje kemijskih svojstava tvari, njihovih naziva, odnosno razumijevanje bilo koje kemijske terminologije i sposobnost izražavanja procesa koji se odvijaju u obliku pisanja reakcijskih jednadžbi. Važno je da nastavnik, kada se priprema za ovaj oblik ispita, može navesti učenike na razumijevanje ključnih riječi u opisu eksperimenta. Ovaj metodički materijal namijenjen je pripremi za zadatke ovog tipa.


Ciljana publika: za 11. razred
Metodološki razvoj lekcije na temu "Kiseline" uključuje prezentaciju i bilješke lekcije. Lekcija proučavanja novog materijala o temi upoznaje učenike s klasom anorganskih spojeva - kiselina, njihovom općom formulom, klasifikacijom, distribucijom u prirodi. Studenti će također imati priliku upoznati se s bazičnim anorganskim kiselinama.
8. razred
Lekcija 1
"Predmet kemija"
Ciljevi lekcije. Obrazovni:upoznati učenike s predmetom kemija; dati ideju o kemiji kao egzaktnoj znanosti, ne bez lirizma; iznijeti stajališta o podrijetlu riječi "kemija"; pokazati odnos kemije s drugim znanostima.
Obrazovni: razvoj kognitivnog interesa za predmet; upoznavanje učenika s dostignućima suvremene znanosti i biografijama velikih kemičara.
Obrazovni: njegovanje ljubavi prema domovini, ponosa na dostignuća i uspjehe naše zemlje u oblasti nauke; poticanje pažljivog odnosa prema vlastitom zdravlju; poticanje poštovanja prema različitim stajalištima drugih ljudi.
Oprema i reagensi.portreti J.Ya.Mendeleeva, R.A.Kekule, N.N.Arrhenius, R.Wood, N.N. stalci s epruvetama, kemijske čaše, kliješta za tiglice, alkoholna lampa, porculanska šalica, čunjasta tikvica, iver; voda, otopina amonijaka, otopina octene kiseline, etilni alkohol, benzin, kuhinjska sol, šećer, škrob, brašno, komadići leda, vata, riječni pijesak, piljevina, parafin, bakreni sulfat, željezne strugotine, bakrene strugotine, crveni fosfor, sumpor , otopine KI, Pb(NO 3) 2, KOH, CuSO 4, NaOH, FeCl 3, Na 2 SO 4, BaCl 2, HCl, Na 2 CO 3, CaCl 2 , lakmus, fenolftalein, amonijev dikromat.
1. Organizacijski trenutak.
Uvod u razred.
2. Obnavljanje znanja.
Kakve asocijacije kod vas izaziva riječ "kemija"?
Kojoj skupini znanosti pripada znanost “kemija”?
Već znate kako se prevode riječi “geografija”, “geometrija”, “biologija”, a kako se prevodi riječ “kemija”?
3. Informacije.
Postoji nekoliko stajališta o podrijetlu riječi "kemija".
a) Hmi (egipatski) – “crna” zemlja. Drevni naziv Egipta, odakle je nastala kemijska znanost.
b) Keme (egipatski) – “crna” znanost. Alkemija kao mračna, đavolska znanost (usporedi s vještičarenjem – vještičarenjem temeljenim na djelovanju zlih duhova).
c) Huma (starogrčki) – “lijevanje” metala; isti korijen i grčki humos - "sok".
d) Kim (stari kineski) - "zlato". Tada se kemija može tumačiti kao "stvaranje zlata".
4. Zagrijte se.
Iako je kemija složena znanost, već puno znate iz drugih znanosti, iz životnog iskustva. Uvjerit ćemo se i sami: ponuđena su vam pitanja iz raznih tema kolegija kemije 8., 9., 10. razreda. Tko želi odgovoriti?
Kviz pitanja "Je li kemija stvarno tako komplicirana?"
Zašto pušemo u šibicu kada je želimo ugasiti?
(Izdahnuti zrak sadrži CO 2.)
Zašto se požar benzina ne može ugasiti vodom?
(Benzin je lakši od vode i ne miješa se s njom.)
Kako nositi 1 litru vode na dlanu, a da ne prolijete ni kap?
(Smrzni se u led.)
Što je toplije: tri majice ili trostruko deblja košulja?
(Tri košulje.)
U kojem se moru ne možeš utopiti? Zašto?
(U Mrtvom moru je vrlo slano.)
Što je teže: 1 kg željeza ili 1 kg vate?
(Jednaki su.)
Od 1 g kojeg metala se može izvući žica duga 2,5 km?
(Napravljen od zlata.)
Je li moguće napuniti samo polovicu spremnika zrakom?
(Zabranjeno je.)
Što znači izraz "voda s pačjih leđa"?
(Voda ne kvasi perje ptica močvarica.)
Koji metalni spojevi daju planetu Mars crvenu nijansu?
(Spojevi željeza.)
Tri identične goruće svijeće bile su istovremeno prekrivene s tri staklenke zapremine 0,4 l, 0,6 l i 1 l. Što će se dogoditi?
(Što je staklenka manja, to će se svijeća ranije ugasiti.)
Dakle, što je kemija?
Kemija je znanost o tvarima, njihovim svojstvima, transformacijama i pojavama koje te transformacije prate
Supstanca – to je ono od čega je tijelo sazdano.
Tijelo - Ovo je dio tvari ograničene prostorom.
vježba:
- Iz navedenog popisa odredi tvar ili tijelo:
čavao, staklo, staklo, lijevak, željezo, ravnalo, škrob, Al žica.
- Navedite tvari od kojih su građena tijela:
potkova, vilica, ravnalo, epruveta, nalivpero
- O kojim tvarima možemo reći:
A) u normalnim uvjetima - bezbojna tekućina bez okusa, mirisa, t kip. = 100°C, stvrdnjava na 0°C. Zašto?
B) crvenkasta krutina koja dobro provodi struju, ima visoku duktilnost i omogućuje proizvodnju tanke žice.
Dakle, govorimo vam o svojstvima tvari
Svojstva − to su svojstva po kojima se neke tvari razlikuju od drugih ili su međusobno slične.
Svojstva su fizikalna i kemijska.
Fizičke - boja, okus, miris, agregatno stanje, električna i toplinska vodljivost, talište i vrelište, gustoća.
5. Igra "Pogodi supstancu."
Što je kemija bez eksperimenata? Naravno, i sami želite “prevariti”! Poznajete li tvari? Možete li ih razlikovati?
Provjerimo…
Na učiteljevom stolu za demonstraciju nalaze se tri pladnja s tvarima -
u jednoj jedinoj bezbojnoj prozirnoj tekućini,
drugi sadrži samo bijele krutine,
u trećem - raznobojne čvrste tvari.
Supstanca
1. pladanj. U malim čašama: voda, otopina amonijaka, otopina octene kiseline, etilni alkohol, benzin.
2. pladanj. U malim čašama nalaze se bijele tvari: kuhinjska sol, šećer, škrob, brašno, komadići leda, vata.
3. pleh. U malim čašama nalaze se čvrste raznobojne tvari: riječni pijesak, piljevina, parafin, bakreni sulfat, željezne strugotine, bakrene strugotine, crveni fosfor, sumpor.
Potrebna su nam tri volontera kao eksperimentatori koji će pokušati identificirati predložene tvari, pazeći da objasne njihovo djelovanje.
Učitelj upozorava učenike na pridržavanje sigurnosnih pravila pri izvođenju pokusa.
Učenici pokušavaju identificirati tvari.
6. Informacije. Zanimljivosti iz života znanstvenika kemičara.
Prikazani su portreti znanstvenika.
Berzeliusov kuhar.
Stanovnici jednog gradića u kojem je živio i radio slavni švedski znanstvenik J.Ya upitali su jednom svog kuhara: "Što točno radi vaš gospodar?"
“Ne mogu točno reći,” odgovorila je, “Uzme veliku tikvicu s nekom tekućinom, ulije je u malu, protrese je, ulije u još manju, ponovno protrese i ulije u vrlo malu jedan..."
"I onda?"
“A onda sve izlije!”
Demonstracija
Za pokus se uzimaju 4 tikvice različitih veličina. U veliku tikvicu najprije se ulije bezbojna otopina lužine, a u manju tikvicu otopina fenolftaleina. Otopina lužine se ulije u tikvicu s fenolftaleinom, otopina postaje grimiznocrvena. U treću tikvicu, još manju, ulije se mala otopina klorovodične kiseline veće koncentracije od otopine lužine, a zatim se u nju ulije obojena otopina lužine. U trećoj tikvici otopina gubi boju. A kada se cijela smjesa ulije u vrlo malu tikvicu koja sadrži malo koncentrirane otopine lužine, otopina opet poprima grimiznu boju.
Majstor za kofere.
D. I. Mendeljejev volio je uvezivati knjige, lijepiti okvire za portrete i izrađivati kofere. Obično je za te radove kupovao u Gostinom Dvoru. Jednog dana, dok je birao pravi proizvod, začuo je iza sebe: “Tko je ovaj časni gospodin?” “Treba poznavati takve ljude”, odgovorio je službenik s poštovanjem u glasu. “Ovo je majstor kofera Mendeljejev!”
Dobar prijatelj.
Jednog dana kolega je došao vidjeti Roberta Bunsena. Razgovarali su sat i pol. I gost se spremao otići, kad odjednom Bunsen reče: “Ne možete zamisliti koliko je moje pamćenje slabo. Uostalom, kad sam te vidio, mislio sam da si Kekule!” Posjetitelj ga je začuđeno pogledao i uzviknuo: “Ali ja sam Kekule!”
Svante Arrhenius.
Svante Arrhenius se vrlo rano počeo debljati. Ispričao je ovu priču vezanu uz svoj višak kilograma. Jednog dana, znanstvenici su se okupili u središnjem hotelu Berlina na još jednoj debati. Arrhenius je ostavio kaput u garderobi i otvorio vrata kako bi se pridružio svojim kolegama, ali ga je garderobijerka zaustavila riječima: “Idete krivim putem, gospodine, mesnica je u blizini!”
Na poslu.
Američki fizičar Robert Wood započeo je karijeru kao asistent u laboratoriju. Jednog je dana njegov šef ušao u prostoriju ispunjenu bukom i zveketom pumpi i opreme i tamo zatekao Wooda, zadubljenog u čitanje kriminalističkog romana. Šefovom ogorčenju nije bilo kraja.
- Gospodine Wood! - povikao je, raspaljen gnjevom, - Ti... Dopuštaš li si čitati detektivku?!
- Zaboga, oprosti mi! – bilo je neugodno Woodu. – Ali uz takvu buku, poezija se jednostavno ne percipira!
Herojska zabava profesora Zinina.
Je li u Rusiji bilo napada na studente? Grubljeg nasilja nije bilo, ali su učitelji, iako rijetko, koristili šamare po glavi. Poznati akademik N.N.Zinin ne samo da je grdio neoprezne studente, već ih je i tukao. Nitko se time nije uvrijedio, jer... smio dati sitniš akademiku. Ali nije bilo lovaca koji bi poduzeli mjere odmazde. Zinin je imao veliku fizičku snagu i mogao je stisnuti protivnika u takav zagrljaj da ovaj dugo nije mogao doći k sebi.
7. Čuda s vlastitim rukama.
Na stolovima učenika nalaze se stalci s dvije epruvete.
I sami ste izvrsni eksperimentatori, uz pomoć jednostavnih tehnika možete stvarati čuda. Vaš zadatak je međusobno pomiješati sadržaje epruveta.
Učitelj objašnjava učenicima pravila sigurnosti pri izvođenju pokusa.
Otopine su odabrane na takav način da u svakom slučaju ili ispadaju talozi različitih boja, ili se oslobađa plin, ili se mijenja boja.
Učenici izvode pokus i promatraju promjene koje se događaju. (Na primjer, otopine kalijevog jodida i olovnog(II) nitrata; kalijevog hidroksida i bakrovog(II) sulfata; natrijevog sulfata i barijevog klorida; lakmusova i natrijeva hidroksida; octena kiselina i natrijev karbonat itd.)
8. Igrajmo se...
Igra "Pogodi što?"
PRVA TVAR
1) U davna vremena ovu tvar nazivali su vladaricom života i smrti. Žrtvovan je bogovima, a ponekad i štovan kao božanstvo.
(5 bodova.)
2) Služio je kao mjera bogatstva, moći, postojanosti, moći, a smatran je čuvarom mladosti i ljepote.
(4 boda.)
3) Prema vjerovanjima, ima sposobnost pomoći čovjeku u svim njegovim poslovima, spasiti ga od nevolja i nesreća.
(3 boda.)
4) "Rodit će se iz vode, ali se boje vode."
(2 boda.)
5) Široko se koristi u svakodnevnom životu, u kuhanju, u obradi kože, u tekstilnoj industriji i dr.
(1 bod.)
(Odgovor. Sol.)
DRUGA TVAR
1) Stari Egipćani su ga zvali "vaaepere", što znači "rođen na nebu".
(5 bodova.)
2) Stari Kopti su ga zvali "kamen neba".
(4 boda.)
3) Proizvodi izrađeni od njega bili su cijenjeniji od zlata. Samo su vrlo bogati ljudi mogli imati prstenje i broševe od njega.
(3 boda.)
4) Alkemičari su ga smatrali toliko prostim metalom da se s njim nije isplatilo raditi.
(2 boda.)
5) Stoljeće je nazvano po njemu. To je duktilni meki metal.
(1 bod.)
(Odgovor: željezo.)
9. “Jeste li znali da...”
Učitelj, nastavnik, profesor. Sada ćemo učiti o dostignućima moderne znanosti, o zanimljivim otkrićima u području kemije i srodnih znanosti.
Nano (od grčkog nanos – patuljak) – milijarditi dio nečega. Područje znanosti koje proučava svojstva predmeta veličine 10–9 m. Nanotehnologija manipulira pojedinačnim česticama veličine od 1 do 100 nm, a također razvija uređaje sličnih veličina. Sada su stvoreni prašci i suspenzije koji poboljšavaju rad motora i mehanizama. Premazi izrađeni od materijala izrađenih pomoću nanotehnologije sprječavaju hrđu i pomažu da se materijal samočisti ili da se ne smoči vodom. Prvi nanoroboti mogu putovati kroz tijelo životinja. Vodik se može sigurno skladištiti pomoću nanocijevi. U budućnosti će biti moguće dizajnirati bilo koje molekule i stvoriti ultra-čvrste materijale. U medicini se planira stvoriti ciljane lijekove koji prodiru u zahvaćeno tkivo ili tumor; korištenje nanorobota za dijagnostiku i liječenje gotovo svih bolesti, uzgoj tkiva i organa. U elektronici, to je stvaranje subminijaturnih elektroničkih uređaja, savitljivih zaslona, elektroničkog papira, novih vrsta motora i gorivih ćelija.
Mnogi glaciolozi vjeruju da se debljina polarnih ledenih ploča smanjuje nesmanjenom brzinom. Tijekom 5 godina, količina leda koja godišnje otječe u Atlantik gotovo se udvostručila, što je jednako porastu razine Svjetskog oceana za 0,5 mm godišnje. Antarktika od 2002. do 2005. godine izgubili u prosjeku 152 km godišnje 3 led. Do 2100. razina mora mogla bi porasti za 4-6 m od sadašnje razine.
Grčki i latinski natpisi ispisani na kamenju prije 2000 godina nečitljivi su zbog erozije. Kako bi obnovili natpise, znanstvenici su upotrijebili metodu fluorescencije: kada X-zrake bombardiraju površinu, atomi se pobuđuju i zatim vraćaju u stanje mirovanja, emitirajući vidljivu svjetlost. To omogućuje prepoznavanje tragova olova ili željeza koje je ostavilo dlijeto antičkog autora.
Ruski kemičari smislili su kako reciklirati plastične boce, a sintetizirali su i novo punilo za gume i polimere. Vodikovo gorivo proizvodit će čistu vodu umjesto ispušnih plinova.
U SAD-u je razvijen prozirni polimerni premaz za zidove na koji se ništa ne lijepi. Ovo je tvar teflonskog tipa. Na takvoj površini nemoguće je pisati ili crtati bojama, kredom ili flomasterom. Premaz se može koristiti za zaštitu dna morskih plovila od obraštanja i trupova zrakoplova od zaleđivanja.
10. Zabavni demonstracijski pokusi.
Učitelj, nastavnik, profesor. Danas je bilo vaše prvo upoznavanje s kemijom. Naravno, čekate nešto neobično, prekrasno. Pokušat ću se transformirati u mađioničara i pokazati vam čuda kemije.
Učitelj demonstrira doživljaje.
“Dim bez vatre.”
Dvije čaše se navlaže koncentriranim otopinama amonijaka i klorovodične kiseline, a zatim se prinesu jedna do druge. Promatraju dim bez vatre.
“Iz jedne čaše – gazirana voda, sok od maline i mlijeko.”
Bezbojne prozirne otopine klorovodične kiseline, kalcijevog klorida i fenolftaleina uliju se u tri jednake čaše. Otopina natrijeva karbonata ulije se u porculansku šalicu. Zatim se natrijev karbonat izlije iz šalice u svaku od tri čaše redom. U prvom od njih brzo se oslobađa plin ("karbonizacija"), u drugom se pojavljuje bijeli talog ("mlijeko"), au trećem otopina postaje grimizna zbog promjene boje indikatora u alkalnom otopina (“sok od maline”).
“Vatrootporni šal.”
Rupčić se navlaži u vodi, a zatim u etilnom alkoholu. Pomoću hvataljki za tiglu prinese se gorućoj alkoholnoj lampi i zapali. Unatoč ogromnom plamenu, šal na kraju ostaje netaknut, jer... alkohol se zapali i izgori prije nego što se zapali vlažna krpa.
“Vulkan na stolu.”
Na grlo čunjaste tikvice stavlja se porculanska šalica. Stavite veliki list papira ispod tikvice. Amonijev dikromat se ulije u šalicu i sredina se lagano navlaži alkoholom. Zapale "vulkan" gorućim iverjem. Reakcija se odvija burno, stvarajući dojam erupcije vulkana iz čijeg kratera izlijevaju vruće mase.
11. Sažimanje lekcije.
D/z: §- 1 str. 13 broj 3,4
 Povijest drevne Kine izvješće, poruka Gdje su živjeli drevni ljudi Kine
Povijest drevne Kine izvješće, poruka Gdje su živjeli drevni ljudi Kine Lekcije iz kemije Obilno ćemo ga namočiti u jod da sve bude sterilno.
Lekcije iz kemije Obilno ćemo ga namočiti u jod da sve bude sterilno.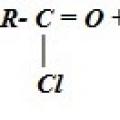 Kemijska svojstva. Priznanica. Dobivanje karboksilnih kiselina Dobivanje karboksilnih kiselina oksidacijom ugljikovodika
Kemijska svojstva. Priznanica. Dobivanje karboksilnih kiselina Dobivanje karboksilnih kiselina oksidacijom ugljikovodika