Fisherove projekcijske formule. Praktični vodič kroz kemiju. Fisherova strukturna formula
Tvari koje mogu rotirati ravninu polarizacije svjetlosti koja prolazi kroz njih nazivaju se optički aktivan. Sama ova pojava se zove optička aktivnost. Optički aktivne tvari postoje u obliku parova optički antipodi ili enantiomeri, koji se razlikuju (pod jednakim uvjetima - ista koncentracija, ista duljina puta svjetlosnog snopa u tvari) u predznaku rotacije ravnine polarizacije svjetlosti.
Molekule optički aktivnih tvari imaju svojstvo kiralnost- enantiomeri se međusobno odnose kao original i njegova zrcalna slika (nekompatibilni u bilo kakvoj rotaciji). Najčešće je za pojavu kiralnosti neophodna prisutnost u molekuli. kiralni atom ugljika ( kiralni ili asimetričan centar) - u stanju sp 3 hibridizacije i ima četiri različita supstituenta:
Ekvimolarna smjesa enantiomera nema optičku aktivnost. Ova smjesa se zove racemična smjesa ili racemat.
Ako molekula sadrži nekoliko kiralnih centara, vrlo ju je teško prikazati u projekciji sličnoj prethodnoj slici. U ovom slučaju koriste se projekcijske formule E. Fischera.
Broj stereoizomera u slučaju nekoliko kiralnih centara može se odrediti formulom 2n, gdje je n broj kiralnih ugljikovih atoma. U slučaju aldotetroza, koje imaju dva kiralna centra, postoje 4 stereoizomera:

Molekule 1 i 2, 3 i 4 su enantiomeri. Molekule 2 i 4, 1 i 3, 2 i 3 nisu enantiomeri, ali su stereoizomeri.
Stereoizomeri koji nisu enantiomeri nazivaju se dijastereomeri.
Dijastereomeri se razlikuju po kemijskim i fizičkim svojstvima i mogu se odvojiti konvencionalnim kemijskim metodama.
Broj stereoizomera može biti manji od 2 n ako postoji mezoforme. Mezo oblik se javlja ako molekula ima unutarnje ravnine simetrije. Na primjer, vinska kiselina ima tri stereoizomera:

Ako su izomeri 1 i 2 par enantiomera, tada su 3 i 4 ista stvar - molekula ima unutarnju ravninu simetrije, prikazanu točkastom linijom. Mezo oblik je u biti intramolekularni racemat. Zaista, gornji dio 3 (iznad isprekidane linije) je zrcalna slika donjeg dijela. Mezo oblik optičke aktivnosti nema.
Nomenklatura optičkih izomera
Prve tvari za koje je otkriven i proučavan fenomen optičke izomerije bili su ugljikohidrati i aminokiseline. Stoga se povijesno razvilo da su stereoizomeri ovih spojeva određeni pripadnošću jednom ili drugom steričkom nizu i eritro-treo izomerima. Za veze drugih klasa koristite koncept apsolutna konfiguracija kiralnog centra.
Fischerove projekcijske formule
Fischerove formule jedan su od načina prikazivanja trodimenzionalne strukture kiralnog centra na ravnini. Uzmimo par enantiomera i konstruirajmo Fischerovu projekciju za desnokretnu molekulu:
Izaberimo smjer iz kojeg ćemo promatrati molekulu - to je prikazano strelicom:
U ovom slučaju, veze C-A i C-E usmjerene su prema nama; one su, u skladu s pravilima pisanja Fisherove formule, prikazane vodoravnom linijom. Veze C-B i C-D usmjerene su od nas i prikazane su okomitom crtom. Kao rezultat, Fisherova projekcija će izgledati kao (1):

Trenutno su i okomite i vodoravne crte prikazane kao čvrste, ugljikov atom nije nacrtan - sjecište linija implicira kiralni centar, kao rezultat toga, projekcija (2) je općenito prihvaćena.
Ako promatramo istu molekulu s druge strane, možemo dobiti još jednu Fischerovu projekciju:

Općenito, za danu molekulu može se nacrtati dvanaest Fischerovih projekcija. Kako bi se dobivene projekcije međusobno usporedile, potrebno je uzeti u obzir da Fisherove projekcije dopuštaju niz transformacija na sebi.
Transformacije koje čuvaju izvornu formulu1. Parni broj permutacija. Pod preraspodjelom podrazumijevamo zamjenu mjesta bilo koja dva supstituenta. Na primjer, u formuli 2b možete prvo promijeniti D i A (prva permutacija), a zatim E i D (koji sada stoji umjesto A) - to će biti druga permutacija, kao rezultat 2b se transformira u 2. Primjetno je da se radi o istom.

2. Rotirajte projekciju u ravnini crtanja za 180, 360, 540 itd. stupnjevi:

3. Cikličko preuređivanje: ostavite jedan supstituent (bilo koji) na mjestu, preostala tri presložite u krug - u smjeru kazaljke na satu ili suprotno od njega. Ova operacija je ekvivalentna dvjema permutacijama, ali ponekad se ispostavlja da je prikladnija.
 Transformacije koje vode do enantiomera
Transformacije koje vode do enantiomera
1. Neparan broj permutacija - zamijenite D i E - jedna permutacija, uz pomoć zrcala prikazanog okomitom točkastom linijom lako je provjeriti da se radi o enantiomerima.

2. Rotirajte u ravnini crtanja za 90, 270, 450, itd. stupnjeva. Zarotirajmo 2b 90o u smjeru suprotnom od kazaljke na satu:

U dobivenoj formuli napravit ćemo paran broj permutacija - zamijenit ćemo B i E, A i D. Uspoređujući 2b i ono što se dogodilo, vidimo da je to enantiomer.
3. Odraz u ogledalu ili gledanje u svjetlo.
Standardna Fischerova projekcijaU standardnoj Fischerovoj projekcijskoj notaciji, glavni lanac ili ciklus prikazan je okomitom linijom, a numeriranje ugljikovih atoma (IUPAC) u lancu ide od vrha prema dolje.
Ove se formule obično koriste za prostorni prikaz molekula koje sadrže asimetrični atom ugljika : ovo je tetraedar ( sp 3-hibridni) atom ugljika vezan na četiri različita atoma ili grupe atoma.
Za prikaz formule projekcije, tetraedarski model molekule postavljen je tako da je asimetrični atom u ravnini crteža, a dvije veze iz asimetričnog ugljikovog atoma leže u horizontalnoj ravnini koja strši prema promatraču iz ravnine crteža. . Druge dvije veze trebaju biti smještene u vertikalnoj ravnini koja se proteže od promatrača izvan ravnine crtanja.
Kada se koriste Fischerove projekcije, simbol za asimetrični ugljikov atom obično se izostavlja:
Uvijek treba imati na umu da su Fisherove formule projekcije na ravninu i ne smiju se smatrati prostornim modelima.
Stoga se moraju pridržavati sljedećih pravila:
formula projekcije koja odgovara određenom stereoizomeru ne može se ukloniti iz ravnine crteža i ne može se zarotirati u ravnini za 90 o i 270 o;
formula se može rotirati za 180°

Ako se položaj jedne atomske skupine ne promijeni, tada se ostale tri mogu rotirati u smjeru kazaljke na satu ili suprotno:

4.2. Optička aktivnost* i kiralnost
Optička aktivnost odnosi se na svojstvo, sposobnost tvari da rotira (odstupa za određeni kut) ravninu polarizirane svjetlosti.
Rotacija ravnine polarizacije događa se u smjeru kazaljke na satu (desna rotacija) ili suprotno od kazaljke na satu (lijeva rotacija).
Za spoj koji sadrži jedan asimetrični atom ugljika moguća su dva izomera koji su međusobno povezani kao objekt i njegova zrcalna slika, kao što se vidi na primjeru mliječne kiseline.


Dva izomera, od kojih je svaki zrcalna slika drugog, nazivaju se optički ili zrcalni izomeri .
Takav par zrcalnih izomera naziva se enantiomeri ili optički antipodi .
Enantiomeri imaju ista fizička svojstva, osim smjera rotacije ravnine polarizacije: odbijaju polariziranu svjetlost pod istim kutom, ali u suprotnim smjerovima.
Spojevi koji su nekompatibilni sa svojom zrcalnom slikom nazivaju se kiralni .
Kiralnost (od cheir - ruka) je osnovni pojam stereokemije, koji označava svojstvo predmeta da bude nekompatibilan sa svojom zrcalnom slikom; je preduvjet za optičku aktivnost molekula.
Smjesa tvari koja se sastoji od jednakih količina oba enantiomera naziva se racemična smjesa . Optička aktivnost takve smjese je 0.
Stereoizomeri koji nisu enantiomeri nazivaju se dijastereomeri (za detalje vidi dolje, odjeljak 4.4.).
Dakle, sve kiralne molekule su molekule optički aktivnih spojeva.
Postoji korespondencija jedan na jedan između kiralnosti i optičke aktivnosti. Karakteristična značajka kiralnih molekula je nepostojanje osi, centra i ravnine simetrije, koje su elementi simetrije .
Os simetrije. Ako rotacija oko osi koja prolazi kroz molekulu pod kutom od 2π/n=360 o/n ponovno dovede molekulu u prvobitno stanje, tada se takva os naziva os simetrije n-tog reda S n . Jasno je da uz vrijednost n=1 u svakom slučaju rotacija oko osi vraća molekulu u prvobitno stanje.
Na primjer, molekula vode (a) ima os simetrije drugog reda (n=2), klorometan (b) ima treći red, a kod benzena (c) uz šest osi smještenih u ravnini ciklusa (n =2), postoji još jedna os (n=6), koja je okomita na ravninu ciklusa.

Ravnina simetrije. Ako ravnina koja prolazi kroz molekulu (objekt) dijeli na dva dijela, međusobno povezana kao zrcalni izomeri, tada se to naziva ravnina simetrije . Voda ima dvije ravnine simetrije, a klorometan tri.

Centar simetrije i- ovo je točka u središtu molekule, na jednakoj udaljenosti od koje se dvije ekvivalentne, ekvivalentne točke dane molekule nalaze na istoj ravnoj liniji.
Molekula ne može imati više od jednog centra simetrije.
Dakle, sa stajališta prisutnosti ili odsutnosti elemenata simetrije u molekulama, uobičajeno je govoriti o kiralnost I ahalnost . U većini slučajeva njihovo se značenje podudara s pojmovima "asimetrije" i "simetrije". Međutim, kiralnost je puno širi koncept od asimetrije, budući da kiralna molekula može sadržavati neke elemente simetrije. Iz istog razloga se u stereokemiji pojam "asimetrični" atom vrlo često zamjenjuje pojmom "centar kiralnosti". Stoga kiralnost treba shvatiti kao svojstvo objekta da bude nekompatibilan sa svojom zrcalnom slikom. Akiralna molekula sadrži najmanje jedan element simetrije (bilo središte ili ravninu simetrije). Poseban slučaj ahiralnosti je kiralnost: sposobnost, svojstvo akiralne molekule da se jednokratnom promjenom jednog strukturnog fragmenta pretvori u kiralnu. U pravilu je takva operacija moguća ako postoji prokiralni centar – odnosno centar koji sadrži dva različita i dva ista supstituenta. Zamjena jednog od ovih identičnih supstituenata drugim, različitim od svih postojećih, pretvara ovaj centar u kiralni:

Konfiguracija i konformacija
Stereoizomeri mogu varirati konfiguracije (konfiguracijski izomeri) ili konformacije (konformacijski izomeri).
Konfiguracija– prostorni raspored atoma i/ili atomskih skupina oko kiralnog središta, ravnine dvostruke veze ili ravnine prstena i karakteriziranje određenog stereoizomera. Ovaj koncept je uglavnom kvalitativne prirode i u biti odražava stereokemijsko obilježje specifičnog rasporeda atoma u prostoru oko kiralnog središta dane molekule.
Parovi spojeva koji su konfiguracijski izomeri prikazani su u nastavku:

konformacija*- određena geometrija molekule, zbog unutarnje rotacije atoma ili atomskih skupina oko jednostavnih veza. U tom slučaju stereokemijska konfiguracija molekule ostaje nepromijenjena.
Newmanove projekcije koriste se za opisivanje konformacija. Za etan su moguće dvije granične konformacije: pomračena (I) i inhibirana (II).

Butan se razlikuje od etana po prisutnosti dviju metilnih skupina, pa je stoga za ovu molekulu moguć veći broj inhibiranih konformacija, kao što je prikazano u nastavku. Stabilnija konformacija I označena je kao anti-: ovdje su metilne skupine što je moguće udaljenije jedna od druge (diedarski kut je 180 o). Druge dvije konformacije su kose, ili drugačije gauche konformacije (II i III), u kojima metilne skupine tvore kut od 60°:

3.Fisherove projekcijske formule
Za prikaz molekula s asimetričnim atomima ugljika na i-ravnini često se koriste projekcije koje je u 18E1 predložio E. Fischer.
Razmotrimo princip njihove konstrukcije na primjeru molekule bromofluorklorometana. Polazna točka za konstruiranje Fischeoa projekcija je prostorni model molekule ili njezina klinasta projekcija.
Postavimo molekulu na takav način da samo atom ugljika molekule bromfluorklorometana ostane u ravnini crteža, kao što je prikazano na slici:
Projicirajmo sve atome na ravninu crtanja (Br i CL odozdo prema gore, jer se nalaze ispod ravnine crtanja, a F i H odozgo prema dolje). Kako bi se rezultirajuća projekcija razlikovala od strukturne formule, slažemo se da ne prikazujemo asimetrični atom ugljika. On podrazumijeva se u Fisherovoj projekciji na sjecištu okomite i vodoravne linije:

Kao što se može vidjeti iz gornjeg primjera, Fischerova projekcija je konstruirana na takav način da su veze asimetričnog atoma sa supstituentima prikazane okomitim i vodoravnim (ali ne nagnutim!) linijama.
Kada koristite Fisherove projekcije, važno je upamtiti da okomita linija u njima prikazuje veze koje se udaljavaju od nas, a vodoravna linija prikazuje veze usmjerene prema nama . To dovodi do sljedećih pravila za korištenje Fischerovih projekcija:
Navedene operacije s Fischerovim projekcijama nije moguće izvesti jer dovode do antipodne projekcije.
Primjeri.
a) Parni broj parnih permutacija. Zamijenimo položaje atoma F i CI, Br i H u molekuli bromofluorklorometana:

b) Kružni raspored tri supstituenta. Izvedimo kružno preuređivanje atoma halogena. Atom vodika ostavljamo netaknutim:

Kod konstruiranja Fischerovih projekcijskih formula za molekule koje sadrže nekoliko ugljikovih atoma, molekula se postavlja tako da je ugljikov lanac postavljen okomito. Postavljen na vrh najviše oksidiran atom ugljika (u pravilu je ovaj atom dio karbonilne CH=O ili karboksilne COOH skupine):

IV. R,S - Nomenklatura stereoizomera.
Budući da enantiomeri imaju različite apsolutne konfiguracije, ta se razlika mora prenijeti u njihovim nazivima. Najčešći pristup za nomenklaturu stereozomera predložili su R. Cahn, C. Ingold i V. Prelog (R.S.Cahn, C.Ingold, V.Prelog, Angew.Chem. (1966), B.78, S.413-447, V. Prelog, G.Helmehen, Angew.Chem (1982), B.94, S.614-631). Njihov pristup temelji se na tzv. pravilu slijeda, prema kojem supstituenti na asimetričnom atomu dodjeljuje se različit staž. Zatim se razmatra smjer u kojem seniornost supstituenata smanjuje za određenu orijentaciju molekule u odnosu na promatrača. Ovisno o tome kako prednost pada (u smjeru kazaljke na satu ili suprotno od kazaljke na satu), konfiguracija središta kiralnosti označena je kao R ili S.
1. Načela R,S-nomenklature
Razmotrimo glavne faze postupka imenovanja apsolutne konfiguracije na primjeru enantiomera bromofluorklorometana (12) i (13).
Prva faza je odrediti redoslijed prvenstva supstituenata na asimetričnom atomu.
Seniornost izotopa određenog elementa raste s povećanjem njihovog masenog broja.
U skladu s tim imamo sljedeći redoslijed prvenstva supstituenata u molekulama bromofluorklorometana:
Br>CI>F>H
Najstariji zamjenik bit će označen slovom a, sljedeći po stažu slovom b. itd. (odnosno, tijekom prijelaza a b c d prvenstvo se smanjuje):

Druga faza. Postavljamo molekulu na takav način da je najniži supstituent uklonjen od promatrača (u ovom slučaju bit će zaklonjen atomom ugljika) i promatramo molekulu duž osi veze ugljika s najnižim supstituentom:

Treća faza. Odredite u kojem smjeru SLAPOVI staž zastupnika koji su u našem vidnom polju. Ako se opadanje staža događa u smjeru kazaljke na satu, označavamo ga slovom R (od latinskog "rectus" desno). Ako staž pada u smjeru suprotnom od kazaljke na satu, konfiguracija se označava slovom S (od latinskog "sinister" - lijevo).

Postoji i mnemoničko pravilo prema kojem se smanjenje seniornosti supstituenata u R-izomeru događa u istom smjeru u kojem je napisan vrh slova R, au S-izomeru - u istom smjeru u kojem na vrhu slova S je napisano:
Sada možemo napisati puna imena enantiomera, koja jasno pokazuju njihovu apsolutnu konfiguraciju:
Treba naglasiti da označavanje konfiguracije sterzoizomera kao R ili S ovisi o redoslijedu prvenstva sva četiri supstituenta na asimetričnom atomu. Dakle, u dolje prikazanim molekulama prostorni raspored atoma F, CI i Br u odnosu na skupinu X je isti:

U navedenim primjerima ne možemo govoriti o obraćenju apsolutna konfiguracija, budući da početni spoj i produkt reakcije nisu izomeri (vidi gore, str. 20). U isto vrijeme, transformacija jednog enantiomera u drugi je obrat apsolutne konfiguracije:

S Među organskim spojevima postoje tvari koje mogu rotirati ravninu polarizacije svjetlosti. Ta se pojava naziva optička aktivnost, a pripadajuće tvari nazivaju se optički aktivan. Optički aktivne tvari pojavljuju se u parovima optički antipodi- izomeri, čija su fizikalna i kemijska svojstva ista u normalnim uvjetima, s izuzetkom jedne stvari - znaka rotacije ravnine polarizacije: jedan od optičkih antipoda skreće ravninu polarizacije udesno (+, dekstrorotatorni izomer), drugi ulijevo (-, lijevorotatorni).
Optička izomerija pojavljuje se kada molekula sadrži asimetrični atom ugljika. Ovo je naziv za ugljikov atom vezan na četiri različita supstituenta. Moguća su dva tetraedarska rasporeda supstituenata oko asimetričnog atoma. Obje prostorne forme ne mogu se spojiti nikakvom rotacijom; jedan od njih je zrcalna slika drugog.
Vrsta izomerije koja se razmatra naziva se optička izomerija
, zrcalna izomerija
ili enantiomerizam
. Obje zrcalne forme čine par optičkih antipoda ili enantiomeri
.
Broj prostornih izomera određen je Fischerovom formulom N = 2 n, gdje je n broj asimetričnih centara.
Projekcijske formule
Da biste konvencionalno prikazali asimetrični atom na ravnini, koristite projekcijske formule E. Fishera. Dobivaju se projiciranjem na ravninu atoma kojima je pridružen asimetrični atom. U ovom slučaju, sam asimetrični atom obično se izostavlja, zadržavajući samo križne linije i supstituentske simbole. Da bi se zapamtio prostorni raspored supstituenata, u formulama projekcije često se čuva isprekidana okomita linija (gornji i donji supstituenti uklanjaju se izvan ravnine crteža), ali to se često ne radi. Ispod su različiti načini za pisanje formule projekcije koja odgovara lijevom modelu na prethodnoj slici:

Evo nekoliko primjera projekcijskih formula:

Nazivi tvari pokazuju njihove predznake rotacije. To znači, na primjer, da lijevi antipod butanola-2 ima prostornu konfiguraciju izraženu upravo gornjom formulom, a njegova zrcalna slika odgovara desnokretnom butanolu-2. Konfiguracija optičkih antipoda određena je eksperimentalno.
Smjesa koja se sastoji od jednakih količina obaju antipoda naziva se racemat. Optički je neaktivan i ima izvrsne vrijednosti fizikalnih konstanti.
U principu, svaki optički antipod može se prikazati s dvanaest (!) različitih projekcijskih formula - ovisno o tome na kojem se položaju nalazi model pri konstruiranju projekcije, s koje ga strane promatramo. Kako bi se standardizirale projekcijske formule, uvedena su određena pravila za njihovo pisanje. Dakle, glavna funkcija, ako je na kraju lanca, obično se nalazi na vrhu, glavni lanac je prikazan okomito.
Pravila za pretvaranje formula projekcije:
1. Formule se mogu rotirati za 180° u ravnini crtanja bez promjene njihovog stereokemijskog značenja:

2. Dva (ili bilo koji paran broj) preraspodjele supstituenata na jednom asimetričnom atomu ne mijenjaju stereokemijsko značenje formule:

3. Jedna (ili bilo koji neparan broj) permutacija supstituenata u asimetričnom središtu dovodi do formule za optički antipod:

4. Rotacija od 90° u ravnini crtanja pretvara formulu u antipod, osim ako se istovremeno ne promijeni uvjet za položaj supstituenata u odnosu na ravninu crtanja, tj. nemojte uzeti u obzir da se sada bočni supstituenti nalaze iza ravnine crtanja, a gornji i donji ispred nje. Ako koristite formulu s točkastom linijom, tada će vas promijenjena orijentacija točkaste linije izravno podsjetiti na ovo:

5. Umjesto permutacija, projekcijske formule mogu se transformirati rotiranjem bilo koja tri supstituenta u smjeru kazaljke na satu ili suprotno od njega; četvrti supstituent ne mijenja svoj položaj (ova operacija je ekvivalentna dvjema permutacijama):

6. Formule projekcije ne mogu se izvesti iz ravnine crteža.
Ostale vrste optički aktivnih tvari
Ovaj odjeljak navodi neke druge klase organskih spojeva koji također pokazuju optičku aktivnost (tj. postoje kao parovi optičkih antipoda).
Atom ugljika nema monopol na stvaranje kiralnih centara u molekulama organskih spojeva. Središte kiralnosti također mogu biti atomi silicija, kositra i tetrakovalentnog dušika u kvaternarnim amonijevim solima i tercijarnim aminoksidima:

U tim spojevima središte asimetrije ima tetraedarsku konfiguraciju, poput asimetričnog atoma ugljika. Postoje, međutim, i spojevi s drugačijom prostornom strukturom kiralnog središta.
piramidalni konfiguracija su kiralni centri koje tvore atomi trovalentnog dušika, fosfora, arsena, antimona i sumpora. U načelu, središte asimetrije može se smatrati tetraedarskim ako se slobodni elektronski par heteroatoma uzme kao četvrti supstituent:

Također se može pojaviti optička aktivnost bez kiralni centar, zbog kiralnosti strukture cijele molekule kao cjeline ( molekularna kiralnost ili molekularna asimetrija ). Najtipičniji primjeri su prisutnost kiralna os ili kiralna ravnina .
Kiralna os pojavljuje se, na primjer, u alenima koji sadrže različite supstituente na sp 2-hibridni atomi ugljika. Lako je vidjeti da su spojevi u nastavku nekompatibilne zrcalne slike, a time i optički antipodi:

Druga klasa spojeva koji imaju kiralnu os su optički aktivni bifenili, koji imaju orto-pozicije imaju glomazne supstituente koji ometaju slobodnu rotaciju oko C-C veze koja povezuje benzenske prstenove:

Kiralna ravnina karakteriziran činjenicom da se može razlikovati između "gornje" i "donje", kao i "desne" i "lijeve" strane. Primjer spojeva s kiralnom ravninom je optički aktivan trans- ciklookten i optički aktivni derivat ferocena:

dijastereomerija
Spojevi s nekoliko asimetričnih atoma imaju važne značajke koje ih razlikuju od prethodno razmatranih jednostavnijih optički aktivnih tvari s jednim centrom asimetrije.
Pretpostavimo da u molekuli neke tvari postoje dva asimetrična atoma; označimo ih uvjetno kao A i B. Lako je vidjeti da su moguće molekule sa sljedećim kombinacijama (N = 2 2 = 4):
Molekule 1 i 2 su par optičkih antipoda; isto vrijedi i za par molekula 3 i 4. Ako međusobno usporedimo molekule iz različitih parova antipoda - 1 i 3, 1 i 4, 2 i 3, 2 i 4, vidjet ćemo da navedeni parovi nisu optički antipodi: konfiguracija jednog asimetričnog atoma je ista, konfiguracija drugog nije ista. Ovo su parovi dijastereomeri , tj. prostorni izomeri, Ne čineći međusobno optičke antipode.
Dijastereomeri se međusobno razlikuju ne samo po optičkoj rotaciji, već i po svim drugim fizikalnim konstantama: imaju različita tališta i vrelišta, različitu topljivost itd. Razlike u svojstvima dijastereomera često nisu manje od razlika u svojstvima između strukturnih izomera .
Primjer spoja ove vrste bila bi kloromalična kiselina (2 različita kiralna centra):

Njegovi stereoizomerni oblici imaju sljedeće projekcijske formule:

| eritro-forme | treo-forme |
Naslovi eritro- I trio- potječu od naziva ugljikohidrata eritroza i treoza. Ovi se nazivi koriste za označavanje relativnog položaja supstituenata u spojevima s dva asimetrična atoma: eritro -izomeri su oni kod kojih se u standardnoj projekcijskoj formuli s jedne strane (desno ili lijevo, dva kraja slova E) pojavljuju dva identična bočna supstituenta; trio -izomeri imaju identične bočne supstituente na različitim stranama projekcijske formule. Dva eritro- izomeri su par optičkih antipoda; kada se pomiješaju nastaje racemat. Par optičkih izomera su i treo- obrasci; oni također stvaraju racemat kada se miješaju, koji se razlikuje po svojstvima od racemata eritro- oblicima. Dakle, postoje ukupno četiri optički aktivna izomera kloromalične kiseline i dva racemata.
Broj stereoizomera može se smanjiti zbog djelomične simetrije koja se pojavljuje u nekim strukturama. Primjer je vinska kiselina u kojoj je broj pojedinačnih stereoizomera smanjen na tri. Njihove projekcijske formule:

| ja | Ia | II | III |
Formula I je identična formuli Ia, budući da u nju prelazi rotacijom za 180° u ravnini crteža i stoga ne predstavlja novi stereoizomer. Ta se optički neaktivna modifikacija naziva mezo oblik . Sve optički aktivne tvari imaju mezo oblike s nekoliko identičnih (tj. povezanih s identičnim supstituentima) asimetričnih centara. Projekcijske formule mezoformi uvijek se mogu prepoznati po tome što se vodoravnom crtom mogu podijeliti na dvije polovice koje su, napisane na papiru, formalno identične, au stvarnosti su zrcalne (ravnina unutarnje simetrije):

Formule II i III prikazuju optičke antipode vinske kiseline; njihovim miješanjem nastaje optički neaktivan racemat – grožđana kiselina.
Nomenklatura optičkih izomera
Najjednostavniji, najstariji, ali još uvijek u uporabi sustav nomenklature optičkih antipoda temelji se na usporedbi projekcijske formule nazvanog antipoda s projekcijskom formulom određene standardne tvari odabrane kao "ključ". Dakle, za α-hidroksi kiseline i α-aminokiseline, ključ je gornji dio njihove projekcijske formule (u standardnoj notaciji):

Konfiguracija svih α-hidroksi kiselina koje imaju hidroksilnu skupinu lijevo u standardnoj pisanoj formuli Fischerove projekcije označena je znakom L; ako se hidroksil nalazi u formuli projekcije desno - znak D
Ključ za označavanje konfiguracije spojeva je gliceraldehid:

U molekulama šećera oznaka D- ili L- odnosi se na konfiguraciju niži asimetrično središte.
Sustav D-,L- oznaka ima značajne nedostatke: prvo, oznaka D- ili L- označava konfiguraciju samo jednog asimetričnog atoma; drugo, za neke spojeve dobivaju se različiti simboli, ovisno o tome uzima li se kao ključ gliceraldehidni ili hidroksikiselinski ključ, na primjer:

Ovi nedostaci ključnog sustava ograničavaju njegovu trenutnu upotrebu na tri klase optički aktivnih tvari: šećere, aminokiseline i hidroksi kiseline. Dizajniran za opću upotrebu R,S-sustav Kahn, Ingold i Prelog.
Da bi se odredila R- ili S-konfiguracija optičkog antipoda, potrebno je rasporediti tetraedar supstituenata oko asimetričnog atoma ugljika na način da najniži supstituent (obično vodik) ima smjer "od promatrača". Ako se tijekom prijelaza u krugu tri preostala zamjenika od najstarijeg do srednjeg po seniorstvu i zatim do najmlađeg dogodi u smjeru suprotnom od kazaljke na satu - Ovo S -izomer (povezan s istim pokretom ruke pri pisanju slova S), ako u smjeru kazaljke na satu - Ovo R- izomer (povezan s pokretom ruke pri pisanju slova R).
Za određivanje seniornosti supstituenata na asimetričnom atomu koriste se pravila za izračunavanje atomskih brojeva, o kojima smo već raspravljali u vezi sa Z,E nomenklaturom geometrijskih izomera.
Za odabir R, S-oznaka prema projekcijskoj formuli, potrebno je parnim brojem permutacija (koje, kao što znamo, ne mijenjaju stereokemijsko značenje formule), rasporediti supstituente tako da najmlađi od njih (obično vodik) je na dnu projekcijske formule. Tada seniornost preostala tri supstituenta, padajući u smjeru kazaljke na satu, odgovara oznaci R, suprotno od kazaljke na satu - oznaci S:

II.1. Konformacije (rotacijska izomerija)
Prijelaz s najjednostavnijeg organskog ugljikovodika, metana, na njegov najbliži homolog, etan, postavlja probleme prostorne strukture za čije rješenje nije dovoljno poznavanje parametara o kojima se govori u odjeljku. U stvari, bez mijenjanja veznih kutova ili duljina veza, može se zamisliti mnogo geometrijskih oblika molekule etana, koji se međusobno razlikuju po međusobnoj rotaciji ugljikovih tetraedara oko C-C veze koja ih povezuje. Kao rezultat ove rotacije, rotirajući izomeri (konformeri) . Energija različitih konformera nije ista, ali je energetska barijera koja razdvaja različite rotacijske izomere mala za većinu organskih spojeva. Stoga je u normalnim uvjetima, u pravilu, nemoguće fiksirati molekule u jednoj strogo definiranoj konformaciji: obično nekoliko rotacijskih oblika koji se lako pretvaraju jedni u druge koegzistiraju u ravnoteži.
Metode za grafički prikaz konformacija i njihova nomenklatura su sljedeće. Počnimo s molekulom etana. Za njega se može predvidjeti postojanje dviju konformacija koje se maksimalno razlikuju po energiji. Dolje su prikazani kao perspektivne projekcije (1) ("pilanske koze"), bočne projekcije (2) i Newmanove formule (3).
U perspektivnoj projekciji (1a, 1b) spoj C-C treba zamisliti kako ide u daljinu; Atom ugljika lijevo je blizu promatrača, a atom ugljika desno je dalje od njega.
U bočnoj projekciji (2a, 2b) četiri H-atoma leže u ravnini crteža; Atomi ugljika zapravo se pružaju donekle izvan ove ravnine, ali se obično jednostavno smatra da leže u ravnini crteža. “Podebljane” klinaste veze zadebljanjem klina označavaju izlaz iz ravnine prema promatraču atoma prema kojem je zadebljanje okrenuto. Isprekidani klinasti spojevi označavaju udaljenost od promatrača.
U Newmanovoj projekciji (3a, 3b), molekula se promatra duž C-C veze (u smjeru označenom strelicom u formulama 1a, b). Tri linije koje divergiraju pod kutom od 120° od središta kruga označavaju veze ugljikovog atoma najbližeg promatraču; linije koje "strše" iza kruga su veze udaljenog atoma ugljika.
Konformacija prikazana lijevo naziva se zamračen : Ovaj naziv nas podsjeća da su atomi vodika obje CH 3 skupine jedan nasuprot drugome. Pomračena konformacija ima povećanu unutarnju energiju i stoga je nepovoljna. Konformacija prikazana desno naziva se inhibiran , što implicira da je slobodna rotacija oko C-C veze "inhibirana" u ovom položaju, tj. molekula postoji pretežno u ovoj konformaciji.
Minimalna energija potrebna za potpuno okretanje molekule oko određene veze naziva se rotacijska barijera za ovu vezu. Rotacijska barijera u molekuli poput etana može se izraziti u smislu promjene potencijalne energije molekule kao funkcije promjene diedarski (torzijski) kut sustava. Diedralni kut (označen tau) prikazan je na slici ispod:

Profil energije rotacije oko C-C veze u etanu prikazan je na sljedećoj slici. Rotacija "stražnjeg" atoma ugljika prikazana je promjenom diedarskog kuta između dva prikazana atoma vodika. Radi jednostavnosti, preostali atomi vodika su izostavljeni. Rotacijska barijera koja razdvaja dva oblika etana je samo 3 kcal/mol (12,6 kJ/mol). Minimumi krivulje potencijalne energije odgovaraju inhibiranim konformacijama, a maksimumi okludiranim konformacijama. Budući da na sobnoj temperaturi energija nekih molekularnih sudara može doseći 20 kcal/mol (oko 80 kJ/mol), ova se barijera od 12,6 kJ/mol lako prevlada i rotacija u etanu se smatra slobodnom.

Naglašavamo da svaka točka na krivulji potencijalne energije odgovara određenoj konformaciji. Točke koje odgovaraju minimumima odgovaraju konformacijskim izomerima, tj prevladavajuće komponente u mješavini svih mogućih konformacija .
Kako molekula postaje složenija, povećava se broj mogućih konformacija koje se znatno razlikuju u energiji. Da, za n-butan se već može prikazati u šest konformacija, koje se razlikuju u relativnom rasporedu CH 3 skupina, tj. rotacija oko središnje veze C-C. Dolje su konformacije n-butana prikazane kao Newmanove projekcije. Lijevo prikazane konformacije (osjenčane) su energetski nepovoljne; praktično se ostvaruju samo one inhibirane.

Različite pomračene i inhibirane konformacije butana nisu iste u energiji. Odgovarajuće energije svih konformacija nastalih tijekom rotacije oko središnje C-C veze prikazane su u nastavku:



Kako molekula postaje složenija, povećava se broj mogućih konformacija.
Dakle, konformacije su različiti neidentični prostorni oblici molekule koji imaju određenu konfiguraciju. Konformeri su stereoizomerne strukture koje su u pokretnoj ravnoteži i sposobne su za međupretvorbu rotirajući oko jednostavnih veza.
Ponekad prepreka takvim transformacijama postane dovoljno visoka da odvoji stereoizomerne oblike (primjer: optički aktivni bifenili;). U takvim slučajevima više se ne govori o konformerima, nego o stvarnom postojanju stereoizomeri .
II.2. Geometrijska izomerija
Važna posljedica krutosti dvostruke veze (odsutnost rotacije oko nje) je postojanje geometrijski izomeri . Najčešći od njih su cis-trans izomeri spojevi etilenskog niza koji sadrže nejednake supstituente na nezasićenim atomima. Najjednostavniji primjer su izomeri butena-2.

Geometrijski izomeri imaju istu kemijsku strukturu (isti poredak kemijskih veza), razlikuju se u prostornom rasporedu atoma, u konfiguracije . Ova razlika stvara razliku u fizičkim (kao i kemijskim) svojstvima. Geometrijski izomeri, za razliku od konformera, mogu se izolirati u čistom obliku i postojati kao pojedinačne, stabilne tvari. Za njihovu međusobnu transformaciju obično je potrebna energija reda veličine 125-170 kJ/mol (30-40 kcal/mol). Ta se energija može prenijeti zagrijavanjem ili zračenjem.
U najjednostavnijim slučajevima, nomenklatura geometrijskih izomera ne predstavlja nikakve poteškoće: cis- oblici su geometrijski izomeri u kojima identični supstituenti leže na istoj strani ravnine pi veze, trans- izomeri imaju identične supstituente na različitim stranama ravnine pi veze. U složenijim slučajevima koristi se Z,E-nomenklatura . Njegovo glavno načelo: naznačiti konfiguraciju naznačiti cis-(Z, od njemačkog Zusammen - zajedno) ili trans-(E, od njemačkog Entgegen - suprotno) položaj viši zamjenici s dvostrukom vezom.
U Z,E sustavu, supstituenti s višim atomskim brojem smatraju se starijima. Ako su atomi izravno povezani s nezasićenim ugljikom isti, tada prelaze na "drugi sloj", ako je potrebno - na "treći sloj" itd.
Razmotrimo primjenu pravila Z,E-nomenklature na dva primjera.

| ja | II |
Počnimo s formulom I, gdje sve rješavaju atomi “prvog sloja”. Posloživši njihove atomske brojeve, nalazimo da su viši supstituenti svakog para (brom u gornjem dijelu formule i dušik u donjem dijelu) u trans-položaj, otuda stereokemijska oznaka E:
 E-1-bromo-1-kloro-2-nitroeten
E-1-bromo-1-kloro-2-nitroeten
Za određivanje stereokemijske oznake strukture II potrebno je tražiti razlike u “višim slojevima”. U prvom sloju se skupine CH 3, C 2 H 5, C 3 H 7 ne razlikuju. U drugom sloju, CH 3 skupina ima zbroj atomskih brojeva od tri (tri vodikova atoma), dok C 2 H 5 i C 3 H 7 skupine imaju po 8. To znači da se CH 3 skupina ne uzima u obzir - mlađi je od druga dva. Dakle, starije skupine su C 2 H 5 i C 3 H 7, to je u cis-položaj; stereokemijska oznaka Z.
 Z-3-metilhepten-3
Z-3-metilhepten-3
Ako bi trebalo odrediti koja je skupina starija - C 2 H 5 ili C 3 H 7, trebalo bi ići na atome "trećeg sloja"; zbroj atomskih brojeva u ovom sloju za obje skupine bio bi jednak na 3 odnosno 8, tj. C3H7 je stariji od C2H5. U složenijim slučajevima određivanja prvenstva moraju se uzeti u obzir dodatni uvjeti, kao što su: atom povezan dvostrukom vezom broji se dva puta, povezan trostrukom vezom - tri puta; Od izotopa stariji je onaj teži (deuterij je stariji od vodika) i neki drugi.
Imajte na umu da oznaka Z Ne su sinonimi cis- oznake, poput oznake E, ne odgovaraju uvijek lokaciji trans-, Na primjer:

cis- 1,2-diklorpropen-1 cis- 1,2-diklor-1-brompropen-1
Z-1,2-diklorpropen-1 E-1,2-diklor-1-brompropen-1
Kontrolni zadaci
1. Bombicol - feromon (seksualni atraktant) svilene bube - je E-10-Z-12-heksadekadienol-1. Nacrtajte njegovu strukturnu formulu.
2. Imenujte sljedeće spojeve koristeći Z,E nomenklaturu:

II.3. Optička izomerija (enantiomerija)
Među organskim spojevima postoje tvari koje mogu rotirati ravninu polarizacije svjetlosti. Ta se pojava naziva optička aktivnost, a pripadajuće tvari nazivaju se optički aktivan . Optički aktivne tvari pojavljuju se u parovima optički antipodi - izomeri, čija su fizikalna i kemijska svojstva identična u normalnim uvjetima, s izuzetkom jedne stvari - znaka rotacije ravnine polarizacije. (Ako jedan od optičkih antipoda ima, na primjer, specifičnu rotaciju [NAPOMENA 1] +20 o, tada drugi ima specifičnu rotaciju od -20 o).
II.4. Projekcijske formule
Da biste konvencionalno prikazali asimetrični atom na ravnini, koristite projekcijske formule E. Fishera . Dobivaju se projiciranjem na ravninu atoma kojima je pridružen asimetrični atom. U ovom slučaju, sam asimetrični atom obično se izostavlja, zadržavajući samo križne linije i supstituentske simbole. Da bi se zapamtio prostorni raspored supstituenata, u formulama projekcije često se čuva isprekidana okomita linija (gornji i donji supstituenti uklanjaju se izvan ravnine crteža), ali to se često ne radi. Ispod su različiti načini za pisanje formule projekcije koja odgovara lijevom modelu na prethodnoj slici:

Evo nekoliko primjera projekcijskih formula:

(+)-alanin (-)-butanol (+)-gliceraldehid
Imena tvari pokazuju njihove predznake rotacije: to znači, na primjer, da lijevi antipod butanola-2 ima prostorna konfiguracija , izražen upravo gornjom formulom, a njegova zrcalna slika odgovara desnorotirajućem butanolu-2. Definicija konfiguracije optički antipod provodi se eksperimentalno [BILJEŠKA 3].
U principu, svaki optički antipod može se prikazati s dvanaest (!) različitih projekcijskih formula - ovisno o tome kako je model postavljen tijekom projekcije i s koje ga strane gledamo. Kako bi se standardizirale projekcijske formule, uvedena su određena pravila za njihovo pisanje. Dakle, glavna funkcija, ako je na kraju lanca, obično se nalazi na vrhu, glavni lanac je prikazan okomito.
Kako biste usporedili "nestandardne" napisane projekcijske formule, morate znati sljedeća pravila za transformaciju projekcijskih formula.
1. Formule se mogu rotirati za 180° u ravnini crtanja bez promjene njihovog stereokemijskog značenja:

2. Dva (ili bilo koji paran broj) preraspodjele supstituenata na jednom asimetričnom atomu ne mijenjaju stereokemijsko značenje formule:

3. Jedna (ili bilo koji neparan broj) permutacija supstituenata u asimetričnom središtu dovodi do formule za optički antipod:

4. Rotacija od 90° u ravnini crtanja pretvara formulu u antipodnu, osim ako se istovremeno ne promijeni uvjet za položaj supstituenata u odnosu na ravninu crtanja, tj. nemojte uzeti u obzir da se sada bočni supstituenti nalaze iza ravnine crtanja, a gornji i donji ispred nje. Ako koristite formulu s točkastom linijom, tada će vas promijenjena orijentacija točkaste linije izravno podsjetiti na ovo:

5. Umjesto permutacija, projekcijske formule mogu se transformirati rotiranjem bilo koja tri supstituenta u smjeru kazaljke na satu ili suprotno od njega; četvrti supstituent ne mijenja svoj položaj (ova operacija je ekvivalentna dvjema permutacijama):

6. Formule projekcije ne mogu se izvesti iz ravnine crteža (tj. ne možete ih, na primjer, ispitivati "na svjetlu" sa poleđine papira - u ovom slučaju će se promijeniti stereokemijsko značenje formule).
II.5. Racemati
Ako formula tvari sadrži asimetrični atom, to ne znači da će takva tvar imati optičku aktivnost. Ako se asimetrični centar pojavi tijekom normalne reakcije (supstitucija u CH 2 skupini, adicija na dvostrukoj vezi, itd.), tada je vjerojatnost stvaranja obje antipodne konfiguracije ista. Stoga, unatoč asimetriji svake pojedine molekule, rezultirajuća tvar ispada optički neaktivna. Ova vrsta optički neaktivne modifikacije, koja se sastoji od jednake količine obaju antipoda, naziva se racemati [BILJEŠKA 4] .
II.6. dijastereomerija
Spojevi s nekoliko asimetričnih atoma imaju važne značajke koje ih razlikuju od prethodno razmatranih jednostavnijih optički aktivnih tvari s jednim centrom asimetrije.
Pretpostavimo da u molekuli neke tvari postoje dva asimetrična atoma; Nazovimo ih uvjetno A i B. Lako je vidjeti da su moguće molekule sa sljedećim kombinacijama:
Molekule 1 i 2 su par optičkih antipoda; isto vrijedi i za par molekula 3 i 4. Ako međusobno usporedimo molekule iz različitih parova antipoda - 1 i 3, 1 i 4, 2 i 3, 2 i 4, vidjet ćemo da navedeni parovi nisu optički antipodi: konfiguracija jednog asimetričnog atoma je ista, konfiguracija drugog nije ista. Sve su to parovi dijastereomeri , tj. prostorni izomeri, Ne čineći međusobno optičke antipode.
Dijastereomeri se međusobno razlikuju ne samo po optičkoj rotaciji, već i po svim drugim fizikalnim konstantama: imaju različita tališta i vrelišta, različitu topljivost itd. Razlike u svojstvima dijastereomera često nisu manje od razlika u svojstvima između strukturnih izomera .
Primjer spoja ove vrste je kloromalična kiselina

Njegovi stereoizomerni oblici imaju sljedeće projekcijske formule:

eritro- oblicima treo- oblicima
Naslovi eritro- I trio- potječu od naziva ugljikohidrata eritroza i treoza. Ovi se nazivi koriste za označavanje relativnog položaja supstituenata u spojevima s dva asimetrična atoma: eritro -izomeri oni su oni za koje se dva identična bočna supstituenta pojavljuju u standardnoj projekcijskoj formuli na jednoj strani (desnoj ili lijevoj); trio -izomeri imaju identične bočne supstituente na različitim stranama projekcijske formule [BILJEŠKA 5].
Dva eritro- izomeri su par optičkih antipoda; kada se pomiješaju nastaje racemat. Par optičkih izomera su i treo- obrasci; oni također stvaraju racemat kada se miješaju, koji se razlikuje po svojstvima od racemata eritro- oblicima. Dakle, postoje ukupno četiri optički aktivna izomera kloromalične kiseline i dva racemata.
Daljnjim povećanjem broja asimetričnih centara povećava se i broj prostornih izomera, a svaki novi asimetrični centar udvostručuje broj izomera. Određuje se formulom 2 n, gdje je n broj asimetričnih centara.
Broj stereoizomera može se smanjiti zbog djelomične simetrije koja se pojavljuje u nekim strukturama. Primjer je vinska kiselina u kojoj je broj pojedinačnih stereoizomera smanjen na tri. Njihove projekcijske formule:

Formula I je identična formuli Ia: pretvara se u nju kada se zakrene za 180° u ravnini crteža i stoga ne predstavlja novi stereoizomer. Ovo je optički neaktivna modifikacija - mezo oblik . Za razliku od racemata koji se može podijeliti na optičke antipodi, mezo- oblik je temeljno neuništiv: svaka od njegovih molekula ima jedno asimetrično središte jedne konfiguracije, a drugo - suprotno. Kao rezultat toga dolazi do intramolekularne kompenzacije rotacije obaju asimetričnih centara.
mezo- Sve optički aktivne tvari imaju oblike s nekoliko identičnih (tj. povezanih s identičnim supstituentima) asimetričnih centara [BILJEŠKA 6]. Projekcijske formule mezo- forme se uvijek mogu prepoznati po tome što se uvijek mogu vodoravnom linijom podijeliti na dvije polovice koje su, kada su napisane na papiru, formalno jednake, au stvarnosti su zrcalne:

Formule II i III prikazuju optičke antipode vinske kiseline; njihovim miješanjem nastaje optički neaktivan racemat – grožđana kiselina.
II.7. Nomenklatura optičkih izomera
Najjednostavniji, najstariji, ali još uvijek u uporabi sustav nomenklature optičkih antipoda temelji se na usporedbi projekcijske formule nazvanog antipoda s projekcijskom formulom određene standardne tvari odabrane kao "ključ". Dakle, za alfa hidroksi kiseline i alfa aminokiseline, ključ je gornji dio njihove projekcijske formule (u standardnoj notaciji):

L- hidroksi kiseline (X = OH) D- hidroksi kiseline (X = OH)
L-aminokiseline (X = NH 2) D- aminokiseline (X = NH 2)
Konfiguracija svih alfa-hidroksi kiselina koje imaju hidroksilnu skupinu s lijeve strane u standardnoj pisanoj formuli Fischerove projekcije označena je znakom L; ako se hidroksil nalazi u formuli projekcije desno - znak D[BILJEŠKA 7] .
Ključ za određivanje konfiguracije šećera je gliceraldehid:

L-(-)-gliceraldehid D-(+)-gliceraldehid
U molekulama šećera oznaka D- ili L- odnosi se na konfiguraciju niži asimetrično središte.
Sustav D-,L- oznaka ima značajne nedostatke: prvo, oznaka D- ili L- označava konfiguraciju samo jednog asimetričnog atoma; drugo, za neke spojeve dobivaju se različiti simboli, ovisno o tome uzima li se kao ključ gliceraldehidni ili hidroksikiselinski ključ, na primjer:

Ovi nedostaci ključnog sustava ograničavaju njegovu trenutnu upotrebu na tri klase optički aktivnih tvari: šećere, aminokiseline i hidroksi kiseline. Dizajniran za opću upotrebu "R,S-sustav Kahn, Ingold i Prelog [BILJEŠKA 8].
Da bi se odredila R- ili S-konfiguracija optičkog antipoda, potrebno je rasporediti tetraedar supstituenata oko asimetričnog atoma ugljika na način da najniži supstituent (obično vodik) ima smjer "od promatrača". Tada ako se dogodi kretanje tijekom prijelaza u krug tri preostala supstituenta od najstarijeg do prosječnog po stažu i zatim do najmlađeg u smjeru suprotnom od kazaljke na satu - Ovo R -izomer (povezan s istim pokretom ruke pri pisanju slova R), ako u smjeru kazaljke na satu - Ovo S- izomer (povezan s istim pokretom ruke pri pisanju slova S).
Za određivanje seniornosti supstituenata na asimetričnom atomu koriste se pravila za izračunavanje atomskih brojeva, koja smo već razmatrali u vezi s Z,E nomenklaturom geometrijskih izomera (vidi).
Za odabir R, S-oznaka prema projekcijskoj formuli, potrebno je parnim brojem permutacija (koje, kao što znamo, ne mijenjaju stereokemijsko značenje formule), rasporediti supstituente tako da najmlađi od njih (obično vodik) je na dnu projekcijske formule. Tada senioritet preostala tri supstituenta, padajući u smjeru kazaljke na satu, odgovara oznaci R, suprotno od kazaljke na satu - oznaci S [NAPOMENA 9]:

Kontrolni zadaci
3. Odredite konfiguraciju asimetričnog centra askorbinske kiseline (vitamin C) (prema R,S-nomenklatura i u usporedbi s gliceraldehidom):

4. Alkaloid efedrin ima formulu:

Dajte naziv ovoj vezi pomoću R,S- nomenklatura.
5. Cistein - neesencijalna aminokiselina koja je uključena u regulaciju metaboličkih procesa L-l-amino-2-merkaptopropionska kiselina. Nacrtajte njegovu strukturnu formulu i dajte mu naziv R,S- nomenklatura.
6. Levomicetin (antibiotik širokog spektra) je D(-)-treo-l-p-nitrofenil-2-dikloracetilamino-propandiol-l,3. Nacrtajte njegovu strukturu u obliku Fischerove projekcijske formule.
7. Synestrol je sintetski estrogenski lijek nesteroidne strukture. Dajte mu naziv navodeći njegovu stereokemijsku konfiguraciju:

II.8. Stereokemija cikličkih spojeva
Kada se lanac ugljikovih atoma zatvori u planarni ciklus, kutovi veze ugljikovih atoma prisiljeni su odstupati od svoje normalne tetraedarske vrijednosti, a veličina tog odstupanja ovisi o broju atoma u ciklusu. Što je veći kut odstupanja valentnih veza, to je veća rezerva energije molekule, to je ciklus manje stabilan. Međutim, samo tročlani ciklički ugljikovodik (ciklopropan) ima ravnu strukturu; Polazeći od ciklobutana, molekule cikloalkana imaju neplanarnu strukturu, što smanjuje “napetost” u sustavu.
Molekula cikloheksana može postojati u nekoliko konformacija u kojima su zadržani "normalni" kutovi veze (radi jednostavnosti, prikazani su samo atomi ugljika):

Energetski najpovoljnija konformacija je konformacija I – forma tzv "fotelje". Konformacija II - "uvijanje" - zauzima međupoložaj: nepovoljniji je od konformacije stolice (zbog prisutnosti zatamnjenih atoma vodika u njemu), ali povoljniji od konformacije III. Konformacija III - "kupka" - najmanje povoljan od ova tri zbog značajnog odbijanja vodikovih atoma usmjerenih prema gore.
Razmatranje dvanaest C-H veza u konformaciji stolice omogućuje nam da ih podijelimo u dvije skupine: šest aksijalni veze usmjerene naizmjenično gore i dolje, i šest ekvatorijalni veze usmjerene na strane. U monosupstituiranim cikloheksanima, supstituent može biti u ekvatorijalnom ili aksijalnom položaju. Ove dvije konformacije obično su u ravnoteži i brzo prelaze jedna u drugu kroz konformaciju uvijanja:

Ekvatorijalna konformacija (e) obično je energetski siromašnija i stoga povoljnija od aksijalne konformacije (a).
Kada se supstituenti (bočni lanci) pojavljuju u prstenovima, osim problema konformacije samog prstena, istraživač se suočava i s problemima konfiguracije supstituenata : dakle, u slučaju prisutnosti dva identična ili različita supstituenta, cis-trans-izomer. Imajte na umu da govoreći o cis-trans-konfiguracija supstituenata ima smisla samo kada se primjenjuje na zasićene male i srednje prstenove (do C 8): u prstenovima s velikim brojem jedinica pokretljivost postaje toliko značajna da rasprave o cis- ili trans- pozicije poslanika gube smisao.
Dakle, klasičan primjer su stereoizomerne ciklopropan-1,2-dikarboksilne kiseline. Postoje dvije stereoizomerne kiseline: jedna od njih ima t.t. 139 o C, može tvoriti ciklički anhidrid i stoga je cis-izomer. Druga stereoizomerna kiselina tal. 175 o C, ne stvara ciklički anhidrid; Ovaj trans-izomer [NAPOMENA 10]:

Dvije stereoizomerne 1,2,2-trimetilciklopentan-1,3-dikarboksilne kiseline su u istom međusobnom odnosu. Jedna od njih, kamforna kiselina, t.t. 187 o C, stvara anhidrid i stoga je cis-izomer. Drugi je izokamforna kiselina, t.t. 171 o C, - ne stvara anhidrid, ovo trans-izomer:
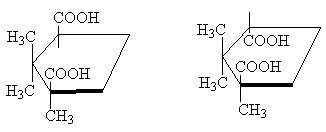
cis-trans-
Iako molekula ciklopentana zapravo nije ravna, radi jasnoće ju je zgodno prikazati u ravnom obliku, kao na gornjoj slici, imajući na umu da u cis- izomer ima dva supstituenta na jednoj strani ciklusa , i u trans-izomer- na suprotnim stranama ciklusa .
Disupstituirani derivati cikloheksana također mogu postojati u cis ili trans obliku:
Atom ugljika nema monopol na stvaranje kiralnih centara u molekulama organskih spojeva. Središte kiralnosti također mogu biti atomi silicija, kositra i tetrakovalentnog dušika u kvaternarnim amonijevim solima i tercijarnim aminoksidima:

U tim spojevima središte asimetrije ima tetraedarsku konfiguraciju, poput asimetričnog atoma ugljika. Postoje, međutim, i spojevi s drugačijom prostornom strukturom kiralnog središta.
Kiralni centri formirani od atoma trovalentnog dušika, fosfora, arsena, antimona i sumpora imaju piramidalnu konfiguraciju. U načelu, središte asimetrije može se smatrati tetraedarskim ako se slobodni elektronski par heteroatoma uzme kao četvrti supstituent:

Također se može pojaviti optička aktivnost bez kiralni centar, zbog kiralnosti strukture cijele molekule kao cjeline ( molekularna kiralnost ili molekularna asimetrija ). Najtipičniji primjeri su prisutnost kiralna os ili kiralna ravnina .
Kiralna os pojavljuje se, na primjer, u alenima koji sadrže različite supstituente na sp 2-hibridni atomi ugljika. Lako je vidjeti da su spojevi u nastavku zrcalne slike, a time i optički antipodi:

Os kiralnosti je na slikama prikazana strelicom.
Druga klasa spojeva koji imaju kiralnu os su optički aktivni bifenili, koji imaju orto-pozicije imaju glomazne supstituente koji ometaju slobodnu rotaciju oko C-C veze koja povezuje arenske prstenove:

Kiralna ravnina karakteriziran činjenicom da se može razlikovati između "gornje" i "donje", kao i "desne" i "lijeve" strane. Primjer spojeva s kiralnom ravninom je optički aktivan trans- ciklooktena i optički aktivnog derivata ferocena.
 General Rokhlin: život i smrt Antipov A
General Rokhlin: život i smrt Antipov A Proza o Drugom svjetskom ratu. Vojna proza. Rotiramo Zemlju! Zaustavljanje zla Vladimir Kontrovsky
Proza o Drugom svjetskom ratu. Vojna proza. Rotiramo Zemlju! Zaustavljanje zla Vladimir Kontrovsky