Хімічний зв'язок. Типи хімічних зв'язків
Хімічний зв'язок
Усі взаємодії, що призводять до об'єднання хімічних частинок(атомів, молекул, іонів тощо) у речовини поділяються на хімічні зв'язки та міжмолекулярні зв'язки (міжмолекулярні взаємодії).
Хімічні зв'язки- Зв'язки безпосередньо між атомами. Розрізняють іонний, ковалентний та металевий зв'язок.
Міжмолекулярні зв'язки- Зв'язок між молекулами. Це водневий зв'язок, іон-дипольний зв'язок (за рахунок утворення цього зв'язку відбувається, наприклад, утворення гідратної оболонки іонів), диполь-дипольний (за рахунок утворення цього зв'язку поєднуються молекули полярних речовин, наприклад, в рідкому ацетоні) та ін.
Іонний зв'язок- Хімічний зв'язок, утворений за рахунок електростатичного тяжіння різноіменно заряджених іонів. У бінарних сполук(з'єднаннях двох елементів) вона утворюється у разі, коли розміри зв'язуваних атомів сильно відрізняються один від одного: одні атоми великі, інші маленькі - тобто одні атоми легко віддають електрони, а інші схильні їх приймати (зазвичай це атоми елементів, що утворюють типові метали і атоми елементів, що утворюють типові неметали); електронегативність таких атомів також сильно відрізняється.
Іонний зв'язок ненаправлений і не насичений.
Ковалентний зв'язок- Хімічний зв'язок, що виникає за рахунок утворення загальної пари електронів. Ковалентний зв'язок утворюється між маленькими атомами з однаковими чи близькими радіусами. Необхідна умова- Наявність неспарених електронів у обох зв'язуваних атомів (обмінний механізм) або неподіленої пари в одного атома і вільної орбіталі в іншого (донорно-акцепторний механізм):
| а) | H · + · H H:H | H-H | H 2 | (Одна загальна пара електронів; H одновалентний); |
| б) | NN | N 2 | (три загальні пари електронів; N тривалентний); | |
| в) | H-F | HF | (одна загальна пара електронів; H і F одновалентні); | |
| г) | NH 4+ | (чотири загальні пари електронів; N чотиривалентний) |
- За кількістю загальних електронних пар ковалентні зв'язки поділяються на
- прості (одинарні)- одна пара електронів,
- подвійні- Дві пари електронів,
- потрійні- Три пари електронів.
Подвійні та потрійні зв'язки називаються кратними зв'язками.
За розподілом електронної щільності між атомами, що зв'язуються, ковалентний зв'язок ділиться на неполярнуі полярну. Не полярний зв'язокутворюється між однаковими атомами, полярна – між різними.
Електронегативність- міра здатності атома в речовині притягувати себе загальні електронні пари.
Електронні пари полярних зв'язків зміщені у бік електронегативних елементів. Саме усунення електронних пар називається поляризацією зв'язку. часткові (надлишкові) заряди, що утворюються при поляризації, позначаються + і -, наприклад: .
За характером перекриття електронних хмар ("орбіталей") ковалентний зв'язок ділиться на -зв'язок і -зв'язок.
-Зв'язок утворюється за рахунок прямого перекривання електронних хмар (вздовж прямої, що з'єднує ядра атомів);
Ковалентний зв'язок має спрямованість і насичуваність, а також поляризується.
Для пояснення та прогнозування взаємного спрямування ковалентних зв'язків використовують модель гібридизації.
Гібридизація атомних орбіталейта електронних хмар- передбачуване вирівнювання атомних орбіталей за енергією, а електронних хмар за формою при утворенні атомом ковалентних зв'язків.
Найчастіше зустрічається три типи гібридизації: sp-, sp 2 та sp 3-гібридизація. Наприклад:
sp-гібридизація - в молекулах C 2 H 2 BeH 2 CO 2 (лінійна будова);
sp 2-гібридизація - в молекулах C 2 H 4 , C 6 H 6 BF 3 (плоска трикутна форма);
sp 3-гібридизація - у молекулах CCl 4 , SiH 4 , CH 4 (тетраедрична форма); NH 3 (пірамідальна форма); H 2 O (кутова форма).
Металевий зв'язок- хімічний зв'язок, утворений за рахунок усуспільнення валентних електронів всіх атомів металевого кристала, що зв'язуються. В результаті утворюється єдина електронна хмара кристала, яка легко зміщується під дією електричної напруги- Звідси висока електропровідність металів.
Металевий зв'язок утворюється в тому випадку, коли атоми, що зв'язуються, великі і тому схильні віддавати електрони. Прості речовини з металевим зв'язком- метали (Na, Ba, Al, Cu, Au та ін), складні речовини- інтерметалеві сполуки (AlCr 2 , Ca 2 Cu, Cu 5 Zn 8 та ін.).
Металевий зв'язок не має спрямованості насичуваності. Вона зберігається у розплавах металів.
Водневий зв'язок- міжмолекулярний зв'язок, утворений за рахунок часткового акцептування пари електронів високоелектронегативного атома атомом водню з великим позитивним частковим зарядом. Утворюється в тих випадках, коли в одній молекулі є атом з неподіленою парою електронів та високою електронегативністю (F, O, N), а в іншій - атом водню, пов'язаний сильно полярним зв'язком з одним з таких атомів. Приклади міжмолекулярних водневих зв'язків:
H-O-H ··· OH 2 , H-O-H ··· NH 3 , H-O-H ··· F-H, H-F ··· H-F.
Внутрішньомолекулярні водневі зв'язки існують у молекулах поліпептидів, нуклеїнових кислот, білків та ін.
Мірою міцності будь-якого зв'язку є енергія зв'язку.
Енергія зв'язку- енергія необхідна для розриву даної хімічного зв'язкув 1 моле речовини. Одиниця вимірів – 1 кДж/моль.
Енергії іонної та ковалентного зв'язку- одного порядку, енергія водневого зв'язку- На порядок менше.
Енергія ковалентного зв'язку залежить від розмірів зв'язуваних атомів (довжини зв'язку) та від кратності зв'язку. Чим менше атоми і більша кратність зв'язку, тим більша її енергія.
Енергія іонного зв'язку залежить від розмірів іонів та їх зарядів. Чим менше іони і більше їх заряд, тим більша енергія зв'язку.
Будова речовини
За типом будови всі речовини поділяються на молекулярніі немолекулярні. Серед органічних речовинпереважають молекулярні речовини, серед неорганічних – немолекулярні.
За типом хімічного зв'язку речовини поділяються на речовини з ковалентними зв'язками, речовини з іонними зв'язками (іонні речовини) та речовини з металевими зв'язками (метали).
Речовини з ковалентними зв'язками можуть бути молекулярними та немолекулярними. Це суттєво позначається на їхніх фізичних властивостях.
Молекулярні речовини складаються з молекул, пов'язаних між собою слабкими міжмолекулярними зв'язками, до них відносяться: H 2 , O 2 , N 2 , Cl 2 , Br 2 , S 8 , P 4 та інші прості речовини; CO 2 , SO 2 , N 2 O 5 , H 2 O, HCl, HF, NH 3 , CH 4 , C 2 H 5 OH, органічні полімери та багато інших речовин. Ці речовини не мають високої міцності, мають низькі температуриплавлення та кипіння, не проводять електричний струмдеякі з них розчиняються у воді або інших розчинниках.
Немолекулярні речовини з ковалентними зв'язками або атомні речовини (алмаз, графіт, Si, SiO 2 , SiC та інші) утворюють дуже міцні кристали (виняток - шаруватий графіт), вони нерозчинні у воді та інших розчинниках, мають високі температури плавлення та кипіння, більшість з них не проводить електричний струм (крім графіту, що володіє електропровідністю, та напівпровідників - кремнію, германію та ін.)
Усі іонні речовини, звісно, є немолекулярними. Це тверді тугоплавкі речовини, розчини та розплави яких проводять електричний струм. Багато з них розчиняються у воді. Слід зазначити, що в іонних речовинах, кристали яких складаються зі складних іонів, є ковалентні зв'язки, наприклад: (Na +) 2 (SO 4 2-), (K +) 3 (PO 4 3-), (NH 4 + )(NO 3-) тощо. буд. Ковалентними зв'язками пов'язані атоми, у тому числі складні іони.
Метали (речовини з металевим зв'язком)дуже різноманітні за своїми фізичними властивостями. Серед них є рідина (Hg), дуже м'які (Na, K) та дуже тверді метали (W, Nb).
Характерними фізичними властивостямиметалів є їхня висока електропровідність (на відміну від напівпровідників, зменшується зі зростанням температури), висока теплоємність і пластичність (у чистих металів).
У твердому стані майже всі речовини складаються із кристалів. За типом будови та типом хімічного зв'язку кристали (" кристалічні грати") ділять на атомні(кристали не молекулярних речовинз ковалентним зв'язком), іонні(кристали іонних речовин), молекулярні(кристали молекулярних речовин з ковалентним зв'язком) та металеві(Кристали речовин з металевим зв'язком).
Завдання та тести на тему "Тема 10. "Хімічний зв'язок. Будова речовини"."
- Типи хімічного зв'язку - Будова речовини 8-9 клас
Уроків: 2 Задань: 9 Тестів: 1
Визначте тип хімічного зв'язку та запишіть схему її утворення для речовин із формулами:
а) S 2 , До 2 O та H 2 S;
б) N 2 , Li 3 N та Cl 3 N.
Відповідь
У молекулі S 2 зв'язок ковалентний неполярний, т.к. вона утворена атомами одного й того самого елемента. Схема освіти зв'язку буде такою:
Сірка - елемент головної підгрупи VI групи. Її атоми мають по 6 електронів на зовнішній оболонці. Непарних електронів буде: 8 − 6 = 2.
У молекулі До 2 O зв'язок іонний, т.к. вона утворена атомами елементів металу та неметалу.
Калій - елемент І групи головної підгрупи, метал. Його атому легше віддати 1 електрон, ніж прийняти відсутні 7:
K 0 атом − 1e − → K +1 іон
Кисень - елемент головної підгрупи VI групи, неметал. Його атому легше прийняти 2 електрони, яких не вистачає до завершення рівня, ніж віддати 6 електронів:
O 0 атом + 2e − → O -2 іон
Знайдемо найменше загальне кратне між зарядами іонів, що утворилися, воно дорівнює 2(2·1). Щоб атоми калію віддали 2 електрони, їх потрібно взяти 2, щоб атоми кисню змогли прийняти 2 електрони, необхідний тільки 1 атом:

У молекулі H 2 S зв'язок ковалентний полярний, т.к. вона утворена атомами елементів із різною ЕО. Схема освіти зв'язку буде такою:
Сірка-елемент головної підгрупи VI групи. Її атоми мають по 6 електронів на зовнішній оболонці. Непарних електронів буде: 8 − 6 = 2
Водень - елемент головної підгрупи І групи. Його атоми містять по 1 електрону на зовнішній оболонці. Непарним є I електрон (для атома водню завершеним є двоелектронний рівень).

Загальні електронні пари зміщені до атома сірки, як більш електронегативного
![]()
У молекулі N 2 зв'язок ковалентний неполярний, т.к. вона утворена атомами одного й того самого елемента. Схема освіти зв'язку така:
Азот – елемент головної підгрупи V групи. Його атоми мають 5 електронів на зовнішній оболонці. Непарних електронів: 8 − 5 = 3.

У молекулі Li 3 N іонний зв'язок, т.к. вона утворена атомами елементів металу та неметалу.
Літій - елемент головної підгрупи І групи, метал. Його атому легше віддати 1 електрон, ніж прийняти відсутні 7:
Li 0 атом − 1e − → Li +1 іон
Азот - елемент головної підгрупи У групи, неметал. Його атому легше прийняти 3 електрони, яких не вистачає до завершення зовнішнього рівня, ніж віддати п'ять електронів із зовнішнього рівня:
N 0 атом + 3e − → N -3 іон
Знайдемо найменше загальне кратне між зарядами іонів, що утворилися, воно дорівнює 3(3·1). Щоб атоми літію віддали 3 електрони, необхідно 3 атоми, щоб атоми азоту змогли прийняти 3 електрони, необхідний тільки один атом:
![]()
У молекулі NCl 3 зв'язок ковалентний полярний, т.к. вона утворена атомами елементів-неметалів з різними значеннямиЕО. Схема освіти зв'язку така:
Азот – елемент головної підгрупи V групи. Його атоми мають по 5 електронів на зовнішній оболонці. Непарних електронів буде: 8 − 5 = 3.
Хлор – елемент головної підгрупи VII групи. Його атоми містять 7 електронів на зовнішній оболонці. Непарним залишається 1 електрон.

Загальні електронні пари зміщені до атома азоту, як електронегативного:

Хімічний зв'язок.
визначення хімічного зв'язку;
типи хімічних зв'язків;
метод валентних зв'язків;
основні характеристики ковалентного зв'язку;
механізми утворення ковалентного зв'язку;
комплексні з'єднання;
метод молекулярних орбіталей;
міжмолекулярні взаємодії
ВИЗНАЧЕННЯ ХІМІЧНОГО ЗВ'ЯЗКУ
Хімічний зв'язокназивають взаємодію між атомами, що призводить до утворення молекул або іонів та міцного утримування атомів один біля одного.
Хімічна зв'язок має електронну природу, т. е. здійснюється рахунок взаємодії валентних електронів. Залежно від розподілу валентних електронів у молекулі, розрізняють такі види зв'язків: іонний, ковалентний, металевий та ін. Іонний зв'язок можна розглядати як граничний випадок ковалентного зв'язку між атомами, що різко відрізняються за природою.
ТИПИ ХІМІЧНОГО ЗВ'ЯЗКУ
Іонний зв'язок.
Основні положення сучасної теоріїіонного зв'язку.
Іонний зв'язок утворюється при взаємодії елементів, що різко відрізняються один від одного за властивостями, тобто між металами та неметалами.
Утворення хімічного зв'язку пояснюється прагненням атомів досягнення стійкої восьмиелектронної зовнішньої оболонки (s 2 p 6).
Ca: 1s 2 2s 2p 6 3s 2p 6 4s 2
 Ca 2+ : 1s 2 2s 2 p 6 3s 2
p 6
Ca 2+ : 1s 2 2s 2 p 6 3s 2
p 6
Cl: 1s 2 2s 2p 6 3s 2p 5
 Cl – : 1s 2 2s 2 p 6 3s 2
p 6
Cl – : 1s 2 2s 2 p 6 3s 2
p 6
Різноіменно заряджені іони, що утворилися, утримуються один біля одного за рахунок електростатичного тяжіння.
Іонний зв'язок не спрямований.
Чисто іонного зв'язку немає. Так як енергія іонізації більша за енергію спорідненості до електрона, то повного переходу електронів не відбувається навіть у разі пари атомів з великою різницею електронегативностей. Тому можна говорити про частку іонності зв'язку. Найбільша іонність зв'язку має місце у фторидах та хлоридах s-елементів. Так, у кристалах RbCl, KCl, NaCl і NaF вона дорівнює 99, 98, 90 і 97% відповідно.
Ковалентний зв'язок.
Основні положення сучасної теорії ковалентного зв'язку.
Ковалентний зв'язок утворюється між елементами, подібними за властивостями, тобто неметалами.
Кожен елемент надає для освіти зв'язків 1 електрон, причому спини електронів мають бути антипаралельними.
Якщо ковалентна зв'язок утворена атомами однієї й тієї ж елемента, цей зв'язок не полярна, т. е. загальна електронна пара не зміщена до жодного з атомів. Якщо ж ковалентний зв'язок утворений двома різними атомами, то загальна електронна пара зміщена до найбільш електронегативного атома, це полярний ковалентний зв'язок.
При утворенні ковалентного зв'язку відбувається перекриття електронних хмар взаємодіючих атомів, в результаті, в просторі між атомами виникає зона підвищеної електронної щільності, що притягує до себе позитивно заряджені ядра взаємодіючих атомів, і утримує їх один біля одного. Внаслідок цього знижується енергія системи (рис. 14). Проте за дуже сильному зближенні атомів зростає відштовхування ядер. Тому є оптимальна відстань між ядрами ( довжина зв'язку,lсв), у якому система має мінімальну енергію. За такого стану виділяється енергія, звана енергією зв'язку – Е св.

Мал. 14. Залежність енергії систем двох атомів водню з паралельними (1) і антипаралельними (2) спинами від відстані між ядрами (Е – енергія системи, Е св – енергія зв'язку, r – відстань між ядрами, l- Довжина зв'язку).
Для опису ковалентного зв'язку використовують 2 методи: метод валентних зв'язків (ВС) та метод молекулярних орбіталей (ММО).
МЕТОД ВАЛЕНТНИХ ЗВ'ЯЗКІВ.
В основі методу ЗС лежать такі положення:
1. Ковалентний хімічний зв'язок утворюється двома електронами з протилежно спрямованими спинами, причому цей електронна параналежить двом атомам. Комбінації таких двоелектронних двоцентрових зв'язків, що відбивають електронну структуру молекули, отримали назву валентних схем.
2. Ковалентний зв'язок тим міцніший, чим більшою мірою перекриваються електронні хмари, що взаємодіють.
Для наочного зображення валентних схем зазвичай користуються наступним способом: електрони, що знаходяться у зовнішньому електронному шарі, позначають точками, що розташовуються навколо хімічного символу атома. Загальні для двох атомів електрони показують точками, що поміщаються між ними хімічними символами; подвійний чи потрійний зв'язок позначається відповідно двома чи трьома парами загальних точок:
N: 1s 2 2s 2
p 3
;

C: 1s 2 2s 2 p 4
З наведених схем видно, що кожна пара електронів, що зв'язує два атоми, відповідає одній рисці, що зображує ковалентний зв'язок у структурних формулах:

Число загальних електронних пар, що зв'язують атом даного елемента з іншими атомами, або, інакше кажучи, число ковалентних зв'язків, що утворюються атомом, називається ковалентністюза методом ЗС. Так, ковалентність водню дорівнює 1, азоту – 3.
За способом перекриття електронних хмар, зв'язки бувають двох видів: - зв'язок та - зв'язок.
- зв'язок виникає при перекриванні двох електронних хмар по осі, що з'єднує ядра атомів.
Мал. 15. Схема освіти – зв'язків.
- зв'язок утворюється при перекриванні електронних хмар по обидва боки від лінії, що з'єднує ядра атомів, що взаємодіють.

Мал. 16. Схема освіти – зв'язків.
ОСНОВНІ ХАРАКТЕРИСТИКИ КОВАЛЕНТНОГО ЗВ'ЯЗКУ.
1. Довжина зв'язку, ℓ. Це мінімальна відстань між ядрами атомів, що взаємодіють, яка відповідає найбільш стійкому стану системи.
2. Енергія зв'язку, E min - це кількість енергії, яку необхідно витратити для розриву хімічного зв'язку і для видалення атомів за межі взаємодії.
3. Дипольний момент зв'язку,  ,=qℓ. Дипольний момент є кількісною мірою полярності молекули. Для неполярних молекул дипольний момент дорівнює 0, для неполярних не дорівнює 0. Дипольний момент багатоатомної молекули дорівнює векторній сумі диполів окремих зв'язків:
,=qℓ. Дипольний момент є кількісною мірою полярності молекули. Для неполярних молекул дипольний момент дорівнює 0, для неполярних не дорівнює 0. Дипольний момент багатоатомної молекули дорівнює векторній сумі диполів окремих зв'язків:

4. Ковалентний зв'язок характеризується спрямованістю. Спрямованість ковалентного зв'язку визначається необхідністю максимального перекривання у просторі електронних хмар взаємодіючих атомів, що призводять до утворення найбільш міцних зв'язків.
Так як ці зв'язки строго орієнтовані в просторі, залежно від складу молекули вони можуть знаходитися під певним кутом один до одного - такий кут називається валентним.
Двохатомні молекули мають лінійну будову. Багатоатомні молекули мають складнішу конфігурацію. Розглянемо геометрію різних молекул з прикладу утворення гідридів.
1. VIгрупа, головна підгрупа (крім кисню), Н2S, Н2Sе, Н2Те.
S1s 2 2s 2 р 6 3s 2 р 4
У водню в освіті зв'язку бере участь електрон з s-АТ, у сірки - 3р у і 3р z. Молекула Н 2 плоска будоваз кутом між зв'язками 90 0 . .

Рис 17. Будова молекули Н 2 Е
2. Гідриди елементів V-групи, головної підгрупи: РН 3 , АsН 3 ,SbН 3 .
Р 1s 2 2s 2 р 6 3s 2 р 3 .
В освіті зв'язку беруть участь: у водню s-АТ, у фосфору - р у, р х і р z АТ.
Молекула РН 3 має форму тригональної піраміди (основу – трикутник).

Рис 18. Будова молекули ЕН 3
5. Насичуваністьковалентний зв'язок - це число ковалентних зв'язків, які може утворювати атом. Воно обмежене, т.к. елемент має обмежену кількість валентних електронів. Максимальна кількість ковалентних зв'язків, які може утворювати цей атом в основному або збудженому стані, називається його ковалентністю.
Приклад: водень - одноковалентен, кисень - двоковалентен, азот - триковалентен і т.д.
Деякі атоми можуть підвищувати свою ковалентність у збудженому стані рахунок роз'єднання спарених електронів.
приклад. Be 0 1s 2 2s 2

У атома берилію у збудженому стані один валентний електрон знаходиться на 2p-АТ і один електрон на 2s-АО, тобто ковалентність Be 0 = 0 а ковалентність Be * = 2. У ході взаємодії відбувається гібридизація орбіталей.
Гібридизація- це вирівнювання енергії різних АТ у результаті змішування перед хімічною взаємодією. Гібридизація – умовний прийом, що дозволяє передбачити структуру молекули за допомогою комбінації АТ. У гібридизації можуть брати участь ті АТ, енергії яких близькі.
Кожному виду гібридизації відповідає певна геометрична форма молекул.
У разі гідридів елементів II групи головної підгрупи в освіті зв'язку беруть участь дві однакові sр-гібридні орбіталі. Подібний типзв'язку називається sр-гібридизація.

Рис 19. Молекула ВеН 2. Sp-Гібридизація.
sp-Гібридні орбіталі мають несиметричну форму, у бік водню направлені подовжені частини АТ з валентним кутом, рівним 180 про. Тому молекула ВеН 2 має лінійну будову (рис.).
Будова молекул гідридів елементів III групи головної підгрупи розглянемо з прикладу утворення молекули BH 3 .
B 0 1s 2 2s 2 p 1

Ковалентність B0 = 1, ковалентність B * = 3.
В освіті зв'язків беруть участь три sр-гібридні орбіталі, які утворюються в результаті перерозподілу електронних щільностей s-АТ та двох р-АТ. Такий тип зв'язку називається 2р - гібридизацією. Валентний кут приsр 2 - гібридизації дорівнює 120 0 тому молекула ВН 3 має плоску трикутну будову.

Рис.20. Молекула BH 3 . sp 2 -Гібридизація.
На прикладі утворення молекули СH 4 розглянемо будову молекул гідридів елементів IV групи головної підгрупи.
C 0 1s 2 2s 2 p 2

Ковалентність C 0 = 2, ковалентність C * = 4.
У вуглецю в освіті хімічного зв'язку беруть участь чотири sр-гібридні орбіталі, утворені в результаті перерозподілу електронних щільностей між s-АТ та трьома р-АТ. Форма молекули СН 4 - тетраедр, валентний кут дорівнює 109 про 28`.

Мал. 21. Молекула СН 4. sp 3 -Гібридизація.
Винятками з загального правилає молекули Н 2 Про і NН 3 .
У молекулі води кути між зв'язками дорівнюють 104,5 про. На відміну від гідридів інших елементів цієї групи вода має особливі властивості, вона полярна, діамагнітна. Усе це пояснюється лише тим, що у молекулі води тип связиsр 3 . Тобто в освіті хімічного зв'язку беруть участь чотири - гібридні орбіталі. На двох орбіталях знаходиться по одному електрону, ці орбіталі взаємодіють із воднем, на двох інших орбіталях знаходиться по парі електронів. Наявність цих двох орбіталей пояснює унікальні властивості води.
У молекулі аміаку кути між зв'язками дорівнюють приблизно 107,3 про, тобто форма молекули аміаку - тетраедр, тип зв'язку 3 . В утворенні зв'язку у молекули азоту бере участь чотири гібридні sр 3 -орбіталі. На трьох орбіталях знаходиться по одному електрону, ці орбіталі пов'язані з воднем, на четвертій АТ знаходиться неподілена пара електронів, що зумовлює унікальність молекули аміаку.
МЕХАНІЗМИ ОСВІТИ КОВАЛЕНТНОГО ЗВ'ЯЗКУ.
МВС дозволяє розрізняти три механізми утворення ковалентного зв'язку: обмінний, донорно-акцепторний, дативний.
Обмінний механізм. До нього відносять ті випадки утворення хімічного зв'язку, коли кожен з двох атомів, що зв'язуються, виділяє для усуспільнення по одному електрону, як би обмінюючись ними. Для зв'язування ядер двох атомів потрібно, щоб електрони перебували у просторі між ядрами. Ця область у молекулі називається областю зв'язування (область найбільш можливого перебування електронної пари в молекулі). Щоб відбувся обмін не спареними електронами, у атомів необхідне перекривання атомних орбіталей (рис. 10,11). У цьому полягає дія обмінного механізму освіти ковалентного хімічного зв'язку. Атомні орбіталі можуть перекриватися тільки в тому випадку, якщо вони мають однакові властивості симетрії щодо міжядерної осі (рис. 10, 11, 22).

Мал. 22. Перекриття АТ, що не призводить до утворення хімічного зв'язку.
Донорно-акцепторний та дативний механізми.
Донорно-акцепторний механізм пов'язаний із передачею неподіленої пари електронів від одного атома на вакантну атомну орбіталь іншого атома. Наприклад, освіта іона - :

Вакантна р-АТ в атомі бору в молекулі BF 3 акцептує пару електронів від фторид-іону (донор). У аніоні, що утворився, чотири ковалентні зв'язки В-Fрівноцінні по довжині і енергії. У вихідній молекулі всі три зв'язку В-F утворилися за обмінним механізмом.
Атоми, зовнішня оболонка яких складається лише з s-або р-електронів, можуть бути донорами, або акцепторами неподіленої пари електронів. Атоми, у яких валентні електрони перебувають і наd-АТ, можуть одночасно виступати і ролі донорів, й у ролі акцепторів. Щоб розрізнити ці два механізми запровадили поняття дативного механізму освіти зв'язку.
Найпростіший приклад прояву дативного механізму – взаємодія двох атомів хлору.
Два атоми хлору в молекулі хлору утворюють ковалентний зв'язок обмінного механізму, об'єднуючи свої неспарені 3р-електрони. Крім того, атом Сl-1 передає неподілену пару електронів 3р 5 - АТ атому Сl-2 на вакантну 3d-АТ, а атом Сl-2 таку ж пару електронів на вакантну 3d-АТ атома Сl-1. Кожен атом виконує одночасно функції акцептора та донора. У цьому є дативний механізм. Дія дативного механізму підвищує міцність зв'язку, тому молекула хлору міцніша за молекулу фтору.
КОМПЛЕКСНІ СПОЛУКИ.
За принципом донорно-акцепторного механізму утворюється величезний клас складних хімічних сполук- Комплексні з'єднання.
Комплексні сполуки - це сполуки, що мають у своєму складі складні іони, здатні до існування як у кристалічному вигляді, так і в розчині, що включають центральний іон або атом, пов'язаний з негативно зарядженими іонами або нейтральними ковалентними молекулами зв'язками, утвореними за донорно-акцепторним механізмом.
Структура комплексних з'єднань за Вернером.
Комплексні з'єднання складаються з внутрішньої сфери (комплексний іон) та зовнішньої сфери. Зв'язок між іонами внутрішньої сфери здійснюється за донорно-акцепторним механізмом. Акцептори називаються комплексоутворювачами, ними часто можуть бути позитивні іони металів (крім металів IAгрупи), що мають вакантні орбіталі. Здатність до комплексоутворення зростає із збільшенням заряду іона та зменшенням його розміру.
Донори електронної пари називаються лігандами чи аддендами. Лігандами є нейтральні молекули чи негативно заряджені іони. Кількість лігандів визначається координаційним числом комплексоутворювача, яке, як правило, дорівнює подвоєній валентності іона-комплексоутворювача. Ліганди бувають монодентантними та полідентантними. Дентантність ліганду визначається кількістю координаційних місць, які ліганд займає у координаційній сфері комплексоутворювача. Наприклад, F - монодентантний ліганд, S 2 O 3 2 - бидентантний ліганд. Заряд внутрішньої сфери дорівнює алгебраїчній сумізарядів складових її іонів. Якщо внутрішня сфера має негативний заряд– це аніонний комплекс, якщо позитивний – катіонний. Катіонні комплекси називають на ім'я іона-комплексоутворювача російською, в аніонних комплексах комплексоутворювач називається латиною з додаванням суфікса - ат. Зв'язок між зовнішньою та внутрішньою сферами у комплексному поєднанні – іонний.
Приклад: K 2 - тетрагідроксоцінкат калію, аніонний комплекс.
2 - внутрішня сфера
2K+ - зовнішня сфера
Zn 2+ - комплексоутворювач
OH – - ліганди
координаційне число – 4
зв'язок між зовнішньою та внутрішньою сферами іонний:
K 2 = 2K + + 2-.
зв'язок між іоном Zn 2+ та гідроксильними групами– ковалентна, утворена за донорно-акцепторним механізмом: OH – - донори, Zn 2+ - акцептор.
Zn 0: … 3d 10 4s 2
Zn 2+ : … 3d 10 4s 0 p 0 d 0

Типи комплексних з'єднань:
1. Аміакати – ліганди молекули аміаку.
Cl 2 - хлорид тетрааммінмеді (II). Аміакати одержують дією аміаку на сполуки, що містять комплексоутворювач.
2. Гідросполучення - ліганди ВІН - .
Na – тетрагідроксоалюмінат натрію. Отримують гідроксокомплекси дією надлишку лугу на гідроксиди металів, що володіють амфотерними властивостями.
3. Аквакомплекси – ліганди молекули води.
Cl 3 – хлорид гексааквахрому (ІІІ). Аквакомплекси отримують взаємодією безводних солей з водою.
4. Ацидокомплекси - ліганди аніони кислот – Cl - ,F - ,CN - ,SO 3 2- ,I - ,NO 2 - ,C 2 O 4 - та ін.
K 4 – гексаціаноферрат (ІІ) калію. Отримують взаємодією надлишку солі, що містить ліганд на сіль, що містить комплексоутворювач.
МЕТОД МОЛЕКУЛЯРНИХ ОРБІТАЛІВ.
МВС досить добре пояснює освіту та структуру багатьох молекул, але цей метод не універсальний. Наприклад, метод валентних зв'язків не дає задовільного пояснення існуванню іона.  , хоча ще наприкінці ХІХ століття було встановлено існування досить міцного молекулярного іона водню
, хоча ще наприкінці ХІХ століття було встановлено існування досить міцного молекулярного іона водню  : енергія розриву зв'язку становить тут 2,65 еВ. Однак жодної електронної пари у цьому випадку утворюватися не може, оскільки до складу іону
: енергія розриву зв'язку становить тут 2,65 еВ. Однак жодної електронної пари у цьому випадку утворюватися не може, оскільки до складу іону  входить лише один електрон.
входить лише один електрон.
Метод молекулярних орбіталей (ММО) дозволяє пояснити ряд протиріч, які не можна пояснити, використовуючи метод валентних зв'язків.
Основні положення ММО.
При взаємодії двох атомних орбіталей утворюються дві молекулярні орбіталі. Відповідно, при взаємодії n-атомних орбіталей утворюється n-молекулярних орбіталей.
Електрони в молекулі в рівного ступеняналежать усім ядрам молекули.
З двох утворених молекулярних орбіталей, одна має нижчу енергію, ніж вихідна, це сполучна молекулярна орбіталь, інша має більш високу енергію ніж вихідна, це розпушуюча молекулярна орбіталь.
У ММО використовують енергетичні діаграми без масштабу.
При заповненні енергетичних підрівнів електронами використовують ті ж правила, що і для атомних орбіталей:
принцип мінімальної енергії, тобто. насамперед заповнюються підрівні, що мають меншу енергію;
принцип Паулі: на кожному енергетичному підрівні не може бути більше двох електронів із антипаралельними спинами;
правило Хунду: заповнення енергетичних підрівнів іде таким чином, щоб сумарний спин був максимальним.
Кратність зв'язку. Кратність зв'язкуу ММО визначається за формулою:
 , коли p = 0, зв'язок не утворюється.
, коли p = 0, зв'язок не утворюється.
приклади.
1. Чи може існувати молекула Н2?

Мал. 23. Схема утворення молекули водню Н2.
Висновок: молекула Н 2 існуватиме, оскільки кратність зв'язку Кр>0.
2. Чи може існувати молекула Не 2?

Мал. 24. Схема утворення молекули гелію He2.
Висновок: молекула Не 2 нічого очікувати існувати, оскільки кратність зв'язку Кр = 0.
3. Чи може існувати частка Н2+?

Мал. 25. Схема утворення частки Н2+.
Частка Н 2+ може існувати, оскільки кратність зв'язку Кр>0.
4. Чи може існувати молекула О2?

Мал. 26. Схема утворення молекули О2.
Молекула О2 існує. З рис.26 випливає, що у молекули кисню є два неспарені електрони. За рахунок цих двох електронів молекула кисню є парамагнітною.
Таким чином, метод молекулярних орбіталей пояснює магнітні властивостімолекул.
МІЖМОЛЕКУЛЯРНА ВЗАЄМОДІЯ.
Усі міжмолекулярні взаємодії можна поділити на дві групи: універсальніі специфічні. Універсальні виявляються у всіх молекулах без винятку. Ці взаємодії часто називають зв'язком або силами Ван-дер-Ваальса. Хоча ці сили слабкі (енергія не перевищує вісім кДж/моль), вони є причиною переходу більшості речовин із газоподібного стану в рідкий, адсорбції газів поверхнями твердих тіл та інших явищ. Природа цих сил є електростатичною.
Основні сили взаємодії:
1). Диполь – дипольна (орієнтаційна) взаємодіяіснує між полярними молекулами.
Орієнтаційна взаємодія тим більше, що більше дипольні моменти, менше відстані між молекулами і нижче температура. Тому чим більша енергія цієї взаємодії, тим до більшої температури потрібно нагріти речовину, щоб вона закипіла.
2). Індукційна взаємодіяздійснюється, якщо речовині є контакт полярних і неполярних молекул. У неполярній молекулі індукується диполь внаслідок взаємодії з полярною молекулою.
Cl + - Cl - … Al + Cl - 3
Енергія цієї взаємодії зростає із збільшенням поляризуемості молекул, тобто здатності молекул до утворення диполя під впливом електричного поля. Енергія індукційної взаємодії значно менша за енергію диполь-дипольної взаємодії.
3). Дисперсійна взаємодія– це взаємодія неполярних молекул з допомогою миттєвих диполів, що виникають з допомогою флуктуації електронної щільності в атомах.
У ряді однотипних речовин дисперсійна взаємодія зростає із збільшенням розмірів атомів, що становлять молекули цих речовин.
4) Сили відштовхуванняобумовлені взаємодією електронних хмар молекул і виявляються за її подальшого зближення.
До специфічних міжмолекулярних взаємодій відносяться всі види взаємодій донорно-акцепторного характеру, тобто пов'язані з перенесенням електронів від однієї молекули до іншої. Міжмолекулярний зв'язок, що при цьому утворюється, має всі характерні особливості ковалентного зв'язку: насичуваність і спрямованість.
Хімічний зв'язок, утворений позитивно поляризованим воднем, що входить до складу полярної групи або молекули та електронегативним атомом іншої або тієї ж молекули, називається водневим зв'язком. Наприклад, молекули води можна представити так:

Суцільні риси – ковалентні полярні зв'язки всередині молекул води між атомами водню та кисню, точками позначені водневі зв'язки. Причина утворення водневих зв'язків у тому, що атоми водню практично позбавлені електронних оболонок: їх єдині електрони зміщені до атомів кисню своїх молекул Це дозволяє протонам, на відміну інших катіонів, наближатися до ядрам атомів кисню сусідніх молекул, не відчуваючи відштовхування із боку електронних оболонок атомів кисню.
Водневий зв'язок характеризується енергією зв'язку від 10 до 40 кДж/моль. Однак цієї енергії достатньо, щоб викликати асоціацію молекул,тобто. їх асоціацію в димери або полімери, які в ряді випадків існують не тільки в рідкому стані речовини, але зберігаються при переході його в пар.
Наприклад, фтороводород у газовій фазі існує у вигляді димеру.

У складних органічних молекуліснують як міжмолекулярні водневі зв'язки, так і внутрішньомолекулярні водневі зв'язки.

Молекули з внутрішньомолекулярними водневими зв'язками що неспроможні вступати у міжмолекулярні водневі зв'язки. Тому речовини з такими зв'язками не утворюють асоціатів, летючі, мають нижчі в'язкості, температури плавлення і кипіння, ніж їх ізомери, здатні утворювати міжмолекулярні водневі зв'язки.
Частина I
1. Зв'язок між атомами-іонами в металах і сплавах за рахунок узагальнених зовнішніх електронівназивається металевою.
2. Схема утворення металевого зв'язку:
3. Заповніть таблицю "Типи хімічного зв'язку".

Частина II
1. Встановіть відповідність між типом хімічного зв'язку та формулами речовин. З літер, що відповідають правильним відповідям, ви складете назву першого металевого сплаву, який використовував чоловік: бронза.

2. З ряду формул речовин:
- Виберіть ті, які відповідають електронній формулі речовини, представленій у загальному вигляді.

3. Напишіть формули речовин, утворених елементами 2-го періоду за допомогою всіх типів хімічного зв'язку.
Запишіть схеми утворення речовин з іонним та ковалентним полярним хімічним зв'язком.

4. Виключіть "зайве".

5. Чи правильні такі твердження?
А. Природа будь-якого хімічного зв'язку електростатична.
Б. В одній речовині може бути лише один вид хімічного зв'язку.
4) обидві судження невірні
6. Між атомами елементів з порядковими номерами 11 та 9 утворюється хімічний зв'язок:
1) іонна
7. Чи вірні такі міркування?
А. Хімічний елемент кальцій утворює речовини, у яких спостерігаються всі типи хімічних зв'язків.
Б. Речовина кальцій Са та нітрид кальцію Ca3N2 утворені відповідно за допомогою металевого та ковалентного неполярного зв'язків.
4) обидві судження невірні
Типи хімічного зв'язку.
Іонний зв'язок
8 клас
Є багато років вашим передплатником, завжди з цікавістю знайомлюся з публікаціями розробок уроків, позакласних заходів, дидактичних матеріалів. З багатьох публікацій вдається почерпнути цікаві ідеїна основі яких розробляю власні уроки.
Маючи можливість самостійно визначати послідовність вивчення матеріалу в курсі хімії, після вивчення теми. Періодичний законта періодична система хімічних елементівД.І.Менделєєва на основі будови атомів» вважаю необхідним вивченняматеріалу на тему «Будова речовина». Розгляд теми «Будова речовина» у 8-му класі дозволяє на більш глибокому рівні вивчати наступні теми курсу, наприклад «Галогени», « Лужні метали" та ін.
Пропоную вашій увазі розробку уроку на тему «Іонний зв'язок». Урок побудований таким чином, щоб учні, повторивши вивчений раніше матеріал, успішно освоїли новий. Сподіваюся, що розробка уроку буде корисною колегам – вчителям хімії, дозволить зробити уроки цікавими, організувати самостійну творчу роботухлопців.
Завдання уроку. Освітні:повторення, корекція та закріплення знань на тему «Будова атомів»; закріплення понять «електронегативність», «ковалентний полярний зв'язок» та «ковалентний неполярний зв'язок»; запровадження понять «іони», «іонний зв'язок»; вивчення нового типу хімічного зв'язку – іонного зв'язку, його природи та умов освіти; навчання навичок порівняння схем будови нейтральних атомів та іонів.
Розвиваючі:розвиток навичок складання електронних схем освіти хімічних зв'язків, сполук з іонним типом зв'язку та визначення кількості електронів у іонах; розвиток умінь визначення типу зв'язку виходячи з аналізу складу хімічної сполуки.
Устаткування.Періодична система хімічних елементів, картки з формулами речовин (H 2 O, Br 2 , CO 2 , O 3 , HCl, HNO 3 , P 4 , CS 2 , H 2 SO 4 , S 8), роздаткові матеріали, кольорові сигнальні картки із цифрами: червона – 1, синя – 2, фіолетова – 3.
Тип уроку.Комбінований (80 хв.)
ХІД УРОКУ
Повторення раніше вивченого матеріалу
Вчитель. Сьогодні ми маємо підкорити одну з найважливіших вершин науки хімії – вершину «Хімічний зв'язок». Щоб розпочати сходження, потрібно до нього підготуватися, зібрати рюкзаки, в які скласти все необхідні знання. Спочатку подивимося, як ви це робите самостійно.
Збираємо рюкзаки.Учням пропонується виконати самостійну роботуз наступною самоперевіркою. Самостійна робота вирішує завдання актуалізації знань, грає роль вхідної діагностики (визначення готовності учнів до подальшої роботи на тему).
Завдання учні одержують на картках. Два учні з хорошим рівнемпідготовки працюють за окремим столом, виконуючи роботу маркерами на аркушах формату А4 Після закінчення роботи вони вивішують на дошку. Два добре підготовлені учні коментують виконану роботу, відповідають на уточнюючі питання вчителя та однокласників. Інші учні класу перевіряють свою роботу самостійно, під час коментування.
Учні, які виконали роботу та прокоментували її, отримують оцінки.
Самостійна робота
Завдання 1. За електронною формулою визначте положення елемента у періодичній системі, назвіть його.
Варіант I. 1 s 2 2s 2 2p 6 3s 2 3p 4 .
Варіант II. 1 s 2 2s 1 .
Завдання 2. Виходячи з положення елементів у періодичній системіпорівняйте їх електронегативність і поставте між ними знак<, >, =.
Варіант I.
1) ЕО (Br) * ЕО (Li);
2) ЕО (Al) * ЕО (Cl);
3) ЕО (S) * ЕО (O).
Варіант II.
1) ЕО (Mg) * ЕО (F);
2) ЕО (C) * ЕО (O);
3) ЕО (I) * ЕО (Cl).
Завдання 3. Визначте кількість електронів на зовнішньому рівнів атомах.
Варіант I. Cl, K, P.
Варіант II. Ca, S, F.
Завдання 4. Визначте, скільки електронів не вистачає кожному атому до завершення зовнішнього рівня.
Варіант I. C, S, Cl.
Варіант II. O, P, I.
Завдання 5. Закінчіть пропозицію.
Варіант I. Ковалентний неполярний зв'язок утворюється між …………………. .
Варіант II. Ковалентний полярний зв'язок утворюється між …………………… .
Відповіді до самостійної роботи
Завдання 1.
Варіант I. Електронна формула 1 s 2 2s 2 2p 6 3s 2 3p 4 відповідає атому сірки. Елемент знаходиться у 3-му періоді у VI групі.
Варіант II. Електронна формула 1 s 2 2s 1 відповідає атому літію. Елемент знаходиться у 2-му періоді у I групі.
Завдання 2.
Варіант I.
1) ЕО (Br) > ЕО (Li);
2) ЕО (Al)< ЭО (Cl);
3) ЕО (S)< ЭО (O).
Варіант II.
1) ЕО (Mg)< ЭО (F);
2) ЕО (C)< ЭО (O);
3) ЕО (I)< ЭО (Сl).
Завдання 3.
Варіант I. Cl – 7, K – 1, P – 5.
Варіант II. Ca – 2, S – 6, F – 7.
Завдання 4.
Варіант I. C - 4, S - 2, Cl - 1.
Варіант II. O - 2, P - 3, I - 1.
Завдання 5.
Варіант I. Ковалентний неполярний зв'язок утворюється між атомами з однаковою електронегативністю, наприклад, між атомами одного хімічного елемента-неметалу.
Варіант II. Ковалентний полярний зв'язок утворюється між атомами, у яких електронегативність відрізняється незначною мірою, між різними атомами хімічних елементів-неметалів.
Вчитель. Завдання виконане добре, проте деякі хлопці припустилися помилок. Давайте ще раз повторимо основні поняття та перевіримо вміння складати електронні схеми освіти ковалентного зв'язку, щоб наш рюкзак було зібрано правильно.
1-ша група. Учні, які виконали самостійну роботу без помилок (за результатами самоперевірки), виконують перевірочну роботу на оцінку.
Ціль. Застосування знань у новій ситуації.
Перевірочна робота
Варіант I.
1. Складіть формули речовин, що складаються із двох елементів, електронні формули атомів яких: а) 1 s 2 2s 2 2p 3; б) 1 s 1 . Вкажіть тип хімічного зв'язку в цих молекулах та складіть електронні схеми її утворення.
2. На підставі положення елементів у періодичній системі розташуйте їх у порядку зростання електронегативності їх атомів:
а) S, Cl, O, K; б) F, P, Са, N.
Варіант II.
1. Складіть формули можливих речовин, що складаються із двох елементів, електронні формули атомів яких: а) 1 s 2 2s 2 2p 6 3s 2 3p 4; б) 1 s 1 . Вкажіть тип хімічного зв'язку в цих молекулах та складіть електронні схеми її утворення.
2. На підставі положення елементів у періодичній системі розташуйте їх у порядку зростання електронегативності їх атомів: а) Cl, I, Li, Al; б) C, N, Si, Ba.
2-я група. Учні, які припустилися помилок, становлять розповідь, заповнюючи пропуски запропонованими словами та фразами. У разі складнощів користуються підручником, записами у зошиті.
Ціль. Повторення, корекція та закріплення знань.
Кліше оповідання
У періодичній системі елементи розташовані за групами та періодами. Загальна кількість електронів в атомі дорівнює ……….. . Номер періоду відповідає…… . Номер групи показує ………. . Завершений зовнішній рівень містить ……….. .
Електронегативність - це здатність атомів притягувати до себе електрони з інших атомів. У періодах ліворуч праворуч електронегативність …..….... , у основних підгрупах зверху донизу – …................ .
Ковалентний неполярний зв'язок утворюється між ……..….... . Ковалентний полярний зв'язок утворюється між ............... .
Слова і фрази:
1) між атомами одного хімічного елемента-неметалу,
2) кількість електронів на зовнішньому рівні елементів головних підгруп,
3) збільшується,
4) порядковому номер елементу,
5) вісім електронів,
6) зменшується,
7) кількості енергетичних рівнів,
8) між різними атомами хімічних елементів-неметалів.
1-ша група здає роботи на перевірку вчителеві, оцінки будуть оголошені на наступному уроці.
2-а група перевіряє свої роботи під час прослуховування відповіді одного з учнів. За потреби даються пояснення.
Відповіді на перевірочну роботу
1-я група Варіант I.
1. Електронні формуливідповідають: а) 1 s 2 2s 2 2p 3 – атом азоту; б) 1 s 1 – атом водню. Ці елементи утворюють такі сполуки – N 2 , H 2 , NH 3 . У молекулах N 2 , H 2 - ковалентний неполярний зв'язок; у молекулі NH 3 – ковалентний полярний зв'язок.
2. З положення елементів у періодичної системі електронегативність зростає у такому порядку: а) K, S, Cl, O; б) Ca, P, N, F.
Варіант II.
1. Електронні формули відповідають: а) 1 s 2 2s 2 2p 6 3s 2 3p 4 – атому сірки; б) 1 s 1 – атом водню. Ці елементи утворюють такі сполуки: S 2 , H 2 , Н 2 S. У молекулах S 2 , H 2 - ковалентний неполярний зв'язок; у молекулі Н 2 S – ковалентний полярний зв'язок.
Електронні схеми освіти
S 2 * :
Н 2 S:
2. З положення елементів у періодичної системі електронегативність зростає у такому порядку: а) Li, Al, I, Cl; б) Ba, Si, C, N.
2-я група У періодичній системі елементи розташовані за групами та періодами. Загальна кількість електронів в атомі дорівнює порядковому номеру елемента. Номер періоду відповідає кількості енергетичних рівнів.Номер групи показує число електронів на зовнішньому рівні для елементів основних підгруп.Завершений зовнішній рівень містить вісім електронів.
Електронегативність - це здатність атомів притягувати до себе електрони з інших атомів. У періодах зліва направо електронегативність збільшується,у головних підгрупах зверху донизу – зменшується.
Ковалентний неполярний зв'язок утворюється між атомами одного хімічного елемента-неметалу.Ковалентний полярний зв'язок утворюється між різними атомами хімічних елементів-неметалів.
Вчитель. Отже, рюкзаки зібрані, починаємо наше сходження. Проте в дорозі на нас чекають перешкоди. І перша перешкода – «водоспад» речовин.
На дошці картини із зображенням водоспаду. На водоспаді прикріплені картки з хімічними формулами: H2O, Br2, CO2, O3, HCl, HNO3, P4, CS2, H2SO4, S8.
Завдання. Щоб здолати водоспад, пропонується розподілити речовини за типами хімічного зв'язку.
Варіант I. Виписати в зошит речовини з ковалентним полярним зв'язком.
Варіант II. Виписати речовини з ковалентним неполярним зв'язком.
Перевірка здійснюється передньо.
Відповідь. Речовини з ковалентним полярним зв'язком – H 2 O, CO 2 , HCl, HNO 3 ,CS 2 , H 2 SO 4 .
Речовини з ковалентним неполярним зв'язком – Br 2 , O 3 , P 4 , S 8 .
Вчитель. Чудово, ми успішно подолали водоспад, але попереду на нас чекає нова перешкода. На вузькій гірській стежці утворився завал з електронних схем.
Завдання. Визначити, яка із схем правильно відображає механізм утворення хімічного зв'язку.
Варіант I. OF 2

Варіант II. BCl 3

Електронні схеми написані на зворотній сторонідошки. У кожного учня три кольорові сигнальні карти з номерами. Учні піднімають картки з номером правильної відповіді. Якщо припустилися помилок, проводиться корекційна робота.
Вчитель. Молодці нам вдалося пройти вузькою гірською стежкою, і ми продовжуємо сходження. Увага! Попереду з'явилася печера. Цікаві альпіністи виявили в ній цікаву знахідку – скриньку та загадковий лист.
Продовжити подорож ми зможемо лише тоді, коли відгадаємо, що знаходиться в цьому скриньці. Що ж, давайте зупинимося на привал і прочитаємо листа.
На столі вчителя «скринька», запечатана сургучною печаткою. Поруч із ним згорнутий лист. Учню пропонується прочитати листа.
Учень (читає листа). З речовини, захованої в цій коробці, можна отримати метал, який легко ріжеться ножем, мається як пластилін і зберігається тільки під шаром гасу. З нього можна також отримати задушливий та отруйний газ жовто-зеленого кольору, який використовують для знезараження води. Але зазвичай ми використовуємо цю речовину інакше. Воно у кожному будинку, на кожному столі. У давнину говорили, що воно дорожче за золото, оскільки без золота можна прожити, а без нього не можна. За російським звичаєм дорогих гостей зустрічають цією речовиною, тим самим бажають їм здоров'я, а прокидатися - значить втратити здоров'я, зазнати невдачі.
Вчитель. Про яку таємничу речовину йдеться у листі? Які речовини з нього одержують?
Учні вгадують речовину, дають їй хімічна назва– кухонна сіль, хлорид натрію. Вказують, що з нього можна одержати металевий натрій та газоподібний хлор. З «скриньки» дістається зразок мінералу, показується учням.
Вчитель. Яке відношення ця речовина має до нашого уроку?
Учень. Оскільки ми вивчаємо тему «Хімічний зв'язок», необхідно з'ясувати, як він утворюється між атомами в хлориді натрію і якого типу його слід віднести.
Вивчення нового матеріалу
Вчитель. Молодці. Мета нашого уроку – познайомитися з новим типом хімічного зв'язку – іонним, з'ясувати її природу та умови освіти. Ми навчимося будувати електронні схеми утворення сполук з іонним типом хімічного зв'язку, визначати Загальна кількістьелектронів у іонах.
Тема уроку та формула кухонної солізаписуються у зошит.
Вчитель. Розглянемо з прикладу хлориду натрію освіту іонного зв'язку. Запишемо рівняння, що відображає взаємодію атомів натрію та хлору:
Складіть самостійно у зошитах схеми будови атомів натрію та хлору. Визначте число спарених та неспарених електронів на останньому рівні в атомах.
Na +11 1 s 2 2s 2 2p 6 3s 1 ;
Сl +17 1 s 2 2s 2 2p 6 3s 2 3p 5 .
Атоми натрію та хлору мають по одному неспареному електрону. При зближенні цих атомів до певної відстанівідбувається перекриття електронних хмар неспарених електронів і утворюється загальна для двох атомів електронна хмара. Але оскільки електронегативність хлору набагато більша, ніж натрію, то загальна електронна пара повністю зміщується до атома хлору. Внаслідок переходу електрона від атома натрію до атома хлору з'являються протилежно заряджені частинки: атом хлору набуває негативного заряду, атом натрію – позитивний.
(Вводиться поняття «іон», «іонний зв'язок», визначення записуються в зошит.)
Частинки, що утворюються в результаті переходу електронів від одного атома до іншого, називаються іонами.
![]()
Na 0 – 1 e-> Na 1+ , Cl 0 + 1 e-> Cl 1-.
Заряд іона визначається кількістю відданих чи прийнятих електронів. Негативно заряджений іон полягає у квадратних дужках.
Хімічний зв'язок, який виникає між іонами внаслідок електростатичної взаємодії, називається іонної.
Давайте розглянемо схеми будови іонів натрію та хлору та визначимо загальну кількість електронів у кожному іоні:
Na 1+ +11 , 1 s 2 2s 2 2p 6 3s 0 (10 електронів);
Cl 1– +17 , 1 s 2 2s 2 2p 6 3s 2 3p 6 (18 електронів).
Перевіримо наші головні висновки.
Іони – це заряджені частинки, на які перетворилися атоми внаслідок віддачі чи приєднання електронів.
Зв'язок, що виникає внаслідок електростатичної взаємодії між іонами, називається іонним.
Іонний зв'язок виникає між атомами металів та неметалів, електоронегативність яких сильно відрізняється (більш ніж на дві одиниці). Іонний зв'язок – крайній випадок ковалентного полярного зв'язку.
Дорогою наш багаж знань поповнився. Продовжимо рух до вершини. Але зненацька виникає нова перешкода. Попереду густі «зарості» з хімічних формул, якими можна пробратися, якщо видалити речовини з іонним типом хімічного зв'язку.
На дошці написані формули:
СCl 4 , Na 2 SO 4 , I 2 , LiBr, F 2 , CaCl 2 , KI, Na 2 S, Mg(NO 3) 2 , SO 2 , Cl 2 , BaO, I 2 , N 2 , MgS.
Учням пропонується виписати у зошит з'єднання з іонним типом зв'язку.
Перевірка фронтальна. Один учень зачитує формули, які записав у зошит, решта учнів – перевіряють. Вчителем даються пояснення щодо речовин, що складаються з трьох хімічних елементів і мають два види зв'язку.
Відповідь. Na 2 SO 4 LiBr, CaCl 2 KI, Na 2 S, Mg(NO 3) 2 BaO, MgS.
Вчитель. Нам вдалося прокласти стежку крізь густі чагарники, ми дуже близькі до мети. Давайте зберемо всі наші знання та піднімемося на вершину.
Під керівництвом вчителя закріплюється вміння складати схеми освіти іонного зв'язку, визначати заряди іонів, кількість електронів у іонах з прикладу сполук: а) KF; б) Na 2 S; в) BeO.

Далі учні виконують подібну роботу самостійно, вибравши із запропонованих формул дві будь-які: а) LiBr; б) CaCl 2; в) MgS; г) Мg 3 N 2 *. Одночасно біля дошки працюють троє учнів. Завдання із зірочкою (*) на даному уроціне пояснюється та не перевіряється, пояснення буде дано на засіданні хімічного гуртка.
Перевірка результатів проводиться передньо.
Закріплення матеріалу
Вчитель. Ми пройшли важкий, але цікавий шлях, вершина «Хімічний зв'язок» підкорена. Я вітаю вас, ви доклали багато зусиль, щоб її досягти, показали ваші знання, виявили винахідливість, були дружними, допомагали один одному у скрутний момент. А тепер настав час у зворотний шлях.
Учням пропонується виконати перевірочну роботу. Ціль: оперативний контрользнань. Результати виконання будуть використані під час планування індивідуальної корекційної роботи з учнями.
Перевірочна робота
1. Визначте кількість електронів на зовнішньому рівні атомів.
Варіант I. F, B, Ca.
Варіант II. Se, Al, C.
2. Вкажіть кількість електронів, які прийме атом для завершення свого зовнішнього рівня.
Варіант I. S, P, Si.
Варіант II. F, N, O.
3. Вкажіть тип хімічного зв'язку у сполуках.
Варіант I. CH 4 , K 2 O, F 2 .
Варіант II. PCl 3 , O 3 , Al 2 O 3 .
4. Складіть електронні схеми утворення хімічного зв'язку, вкажіть заряди іонів та визначте кількість електронів у кожному вигляді атомів та іонів.
Варіант I. а) KBr; б) AlCl 3 .
Варіант II. а) MgI 2; б) NaBr.
Заповніть таблицю.
Таблиця
| атом | Кількість електронів | Іон | Кількість електронів |
| … | …………… | … | ………… |
| … | …………… | … | ………… |
| … | …………… | … | ………… |
| … | …………… | … | ………… |
5*. Проаналізуйте малюнок і впишіть відсутні формули.

Відповіді до перевірочній роботі
Завдання 1.
Варіант I. F - 7, B - 3, Ca - 2.
Варіант II. Se – 6, Al – 3, C – 4.
Завдання 2.
Варіант I. S - 2, P - 3, Si - 4.
Варіант II. F – 1, N – 3, O – 2.
Завдання 3.
Варіант I. У сполуках: CH 4 – ковалентний полярний хімічний зв'язок, K 2 O – іонний зв'язок, F 2 – ковалентний неполярний зв'язок.
Варіант II. У з'єднаннях: PCl 3 – ковалентний полярний зв'язок, O 3 – ковалентний неполярний зв'язок, Al 2 O 3 – іонний зв'язок.
Завдання 4.
Варіант I.
а) Для KBr:
K 0 – 1 e-> K 1+ , Br 0 + 1 e-> Br 1-.
б) Для AlCl 3:
Al 0 – 3 e-> Al 3+ , Cl 0 + 1 e-> Cl 1-.
атом Кількість електронів Іон Кількість електронів Al 0 13 Al 3+ 10 Cl 0 17 Cl 1- 18 K 0 19 K 1+ 18 Br 0 35 Br 1- 36 Варіант II.
а) Для MgF 2:
Mg 0 – 2 e-> Mg 2+ , F 0 + 1 e-> F 1-.
б) Для NaBr:
Na 0 – 1 e-> Na 1+ , Br 0 + 1 e-> Br 1-.
атом Кількість електронів Іон Кількість електронів Mg 0 12 Mg 2+ 10 I 0 53 I 1- 54 Na 0 11 Na 1+ 10 Br 0 35 Br 1- 36 Завдання 5* (Розглядається на засіданні хімічного гуртка).
Відповіді можуть бути наступні: KCl, KH, Na 2 O, NaCl (можуть бути й інші з'єднання металів з наведеними в центральній частині малюнка неметалами, тобто з'єднання з іонним зв'язком).
Підбиття підсумків.
Виставлення оцінок.
Домашнє завдання.Гузей Л.С.Хімія. Запитання. Завдання. Вправи. 8-9 класи. § 18.3, упр. 1, 2, 3 – письмово.
* Двохатомні молекули S 2 утворюються при нагріванні парів сірки до високої температури. – Прим. ред.

 Що таке морфологічний аналіз слова: приклад на всіх частинах мови
Що таке морфологічний аналіз слова: приклад на всіх частинах мови Які іменники не мають?
Які іменники не мають?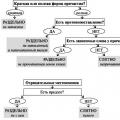 Правила написання не з короткими дієприкметниками
Правила написання не з короткими дієприкметниками