Закон ласощі було прийнято щодо.
Головна
У деяких випадках речовини, що виходять в результаті реакції, або взаємодіють між собою, або розпадаються, і тоді в системі одночасно протікають дві реакції: пряма (утворюються продукти реакції) та зворотна (знову синтезуються вихідні речовини). У разі збігу швидкостей прямого та зворотного процесів у аналізованій системі настає рівновага, яка називається хімічною. Це динамічна рівновага, оскільки сама реакція не припиняється, але утворюється і розпадається одночасно однакова кількість речовини. При постійних температурі та тиску така ситуація може зберігатися досить довго. У графічному вигляді вона представлена нижче. Під еквівалентною швидкістю мається на увазі якась константа, що дорівнює одночасно швидкостям прямої та зворотної реакції.
Принцип усунення хімічної рівноваги

Принцип усунення (зсуву) рівноваги відкрив у 1884 році Ле Шательє. Пізніше його узагальнив Карл Фердинанд Браун (1887). Тому нині він має здвоєну назву — принцип Ле Шательє-Брауна. Цей закон використовується як у хімії, так і в термодинаміці, електродинаміці, екології та біохімії. Існує багато формулювань, але суть кожного з них зводиться до наступного: «При наданні на систему, яка перебуває в рівноважному стані, будь-якого впливу, хімічна рівновага зміщується таким чином, щоб компенсувати цю зміну (тобто система намагатиметься відновити баланс) ». Цей принцип можна наочно продемонструвати за допомогою наступної системи. Є пружина, що прикріплена до нерухомої опори. У стані спокою ця система перебуває у рівновазі. Якщо пружину розтягнути, то рівновага зміститься у бік зовнішнього впливу. Однак при цьому в системі також зростає протидія. І в якийсь момент сили протидії та зовнішнього впливу стають рівними один одному, внаслідок чого настає новий рівноважний стан.
Принцип Ле Шательє можна використовувати тільки для систем, що знаходяться в рівновазі, інакше результати аналізу будуть неправильними. Існують три основні параметри, зміна яких викликає усунення хімічної рівноваги: тиск, температура та концентрація хімічних речовин.
Зміна температури - найчастіша причина зсуву хімічної рівноваги, що цілком зрозуміло, адже на цей фактор вплинути набагато легше, ніж, наприклад, тиск. Тут слід згадати, що реакції поділяються на два типи термічного ефекту. Серед них такі: екзотермічні (з виділенням тепла) та ендотермічні (з його поглинанням). Як зміщуватиметься в цьому випадку хімічна рівновага? Принцип Ле Шательє в цьому випадку зводиться до наступного: зі збільшенням температури рівновага зміщується у бік реакції, що проходить із поглинанням тепла, а при її зменшенні, відповідно, у протилежний бік. Так, якщо для реакції, зображеної нижче, підвищити температуру, рівновага зрушить у праву сторону.
Більшість прямих реакцій екзотермічні, а зворотних - ендотермічні (це не правило, а, швидше, спостереження, з якого можна знайти безліч винятків).
Тиск
Зі зміною тиску трансформується наступний параметр системи - її обсяг (він збільшується або зменшується), тому вплив за допомогою цього параметра особливо впливає на системи, в яких присутні гази. В цьому випадку принцип хімічної рівноваги полягає у наступному. Якщо тиск у системі збільшується, то рівновага зсувається у бік скорочення числа молекул газу, а при зменшенні тиску рівновага рухається у протилежному напрямку. Якщо кількість молекул газу під час реакції не змінюється, то рівновага не зміщується при зміні тиску, як, наприклад, наступної реакції.

Однак на практиці такий принцип вірний лише для ідеальних газів, оскільки всі реальні мають різну стисливість. Таким чином, навіть якщо кількість молекул газу залишається незмінною, рівновага може залежати від тиску. Насправді це буде помітно при високих тисках. У разі рідких та твердих речовин зміна тиску фактично не впливає на рівновагу через малі обсяги, які займають такі речовини. Під час розгляду змішаних систем враховують лише молекули газу.
Зміщення рівноваги в системі внаслідок зміни концентрації будь-якої речовини, що бере участь у реакції
Під час зміни концентрації будь-якої речовини принцип Ле Шательє працює в такий спосіб. При збільшенні концентрації продуктів реакції рівновага зміщується у бік зворотної реакції, при зменшенні кількості речовин, що утворюються, рівновага рухається в протилежний бік.

Що буде, якщо додати інертний газ
Змінити об'єм системи можна не тільки стиснувши її або послабивши тиск, але й шляхом додавання інертного газу, який не вступатиме в реакцію. Що буде з системою при додаванні до неї, наприклад, гелію? Насправді, швидше за все, нічого не станеться, оскільки співвідношення речовин, що беруть участь у реакції, не зміниться, а для ходу процесу має значення не загальний тиск системи, а парціальне кожного компонента.
Вплив каталізаторів
На зміщення хімічної рівноваги кількість каталізатора і його наявність впливу не надають. Це відбувається через те, що це елемент однаково прискорює і пряму, і зворотну реакцію, зберігаючи рівновагу у системі незмінним.
Спосіб вивчення хімічної рівноваги
Детальний розгляд хімічних рівноваг дуже важливий для повного розуміння процесу. Одним із найчастіше застосовуваних прийомів є так званий метод заморожування рівноваг. Так, відбувається швидке охолодження системи, що у збалансованому стані. Рівнавага просто не встигає зміститися, а при низьких температурах швидкість більшості процесів уповільнюється практично до нуля. Завдяки цьому можна повністю проаналізувати склад суміші при будь-якій температурі (концентрації речовин, що беруть участь у реакції, при нулі градусів відповідатиме кількості компонентів за тієї температури, з якою почалося зниження). Такий досвід проводять кілька разів із реакціями, що протікають в обох напрямках.
Чи існує повна незворотність
Цілком зрушити хімічну рівновагу в один бік неможливо. Навіть при абсолютному зміщенні, що здається, завжди залишиться невелика кількість молекул, які будуть вступати в зворотну реакцію.

На практиці практично всі реакції оборотні, а наскільки сильно буде видно цей ефект, часто залежить від температури (нерідко рівновагу просто зміщено в один бік, тому воно стає помітним лише при зміні умов). Саме через цю поширеність оборотних хімічних реакцій вивчення рівноваги особливо важливе.
Приклади синтезів, у яких під час виробництва зміщується хімічна рівновага
На виробництві хімічна рівновага зазвичай зміщують у напрямі прямої реакції для отримання, відповідно, продуктів реакції. Існує безліч прикладів таких синтезів: одержання аміаку, оксиду сірки (VI), оксиду азоту (II) тощо.
Зміна зовнішніх умов може призвести до зміни термодинамічних параметрів та функцій, що характеризують систему, порушуючи стан рівноваги. У системі починаються процеси, що призводять до нового стану рівноваги коїться з іншими рівноважними параметрами. Покажемо на прикладі. У реакторі знаходиться суміш газів N 2 , Н 2 і NH 3 в стані рівноваги:
Введемо в реактор за ізотермічних умов додаткова кількість N 2 , тобто. збільшимо його концентрацію. Константа дорівнює- 2
весія До=---^ залишиться незмінною, оскільки не залежить
[М 2 ПН 2 ] 3
від концентрації. Це можливо тільки в результаті зміни величин рівноважних концентрацій: збільшення призведе до зменшення [Н 2] за рахунок додаткової взаємодії частини введеного водню з азотом, відповідно збільшиться . Зміна параметрів системи, що призводить її до нового стану рівноваги шляхом переважного перебігу прямого або зворотного процесів, називається зміщенням хімічної рівновагивідповідно у прямому чи зворотному напрямку. У прикладі відбулося зміщення рівноваги в прямому напрямку.
Якісні завдання усунення хімічної рівноваги можуть бути вирішені і без термодинамічних чи кінетичних розрахунків за допомогою правила, яке сформулював у 1884 р. Ле Шательє.
Воно отримало назву принципу Ле Шательє (незалежно від Ле Шательє цей принцип було сформульовано 1887 р. Брауном): якщо на систему, що перебуває в стані рівноваги, надати якийсь зовнішній вплив, то в результаті протікання процесів у системі рівновага зміститься в напрямку, що призводить до зменшення наданого впливу.
При збільшенніконцентрації будь-якої речовини, що знаходиться в рівновазі (наприклад NH 3 у розглянутій вище системі), рівновага зміщується у бік витратицієї речовини (у зворотному напрямку). При зменшенніконцентрації будь-якої речовини (наприклад Н 2) рівновага зміщується убік освітицієї речовини (тобто в даному випадку також у зворотному напрямку).
Розглянемо вплив тиску процес синтезу аміаку (4.51). Нехай тиск у реакторі збільшили за допомогою стиснення у 2 рази. В ізотермічних умовах обсяг при цьому зменшиться вдвічі, отже, концентрації всіх компонентів зростуть удвічі. До зміни тиску швидкість прямої реакції становила

Після стиску вона стала
тобто. збільшилася у 16 разів. Швидкість зворотної реакції також збільшилася:
але лише 4 разу. Отже, рівновага змістилася у напрямі.
Відповідно до принципу Ле Шательє зі збільшенням тиску шляхом стискування системи рівновагу зрушується у бік зменшення кількості молекул газів, тобто. у бік зниження тиску (у наведеному прикладі у напрямі); при зменшенні тиску рівновага зсувається у бік зростання кількості молекул газів, тобто. у бік збільшення тиску (у наведеному прикладі у зворотному напрямку). Якщо реакція протікає без зміни кількості молекул газів, рівновага не порушується під час стиснення або розширення системи. Так, наприклад, у системі
Н2(г) + 12(г) 2Н1(г) при зміні тиску рівновага не порушується; Вихід HI від тиску не залежить.
Тиск практично не впливає на рівновагу реакцій, що протікають без участі газової фази, оскільки рідини та тверді речовини майже не стисливі. Однак при надвисоких тисках відбувається зміщення рівноваги у бік щільнішої упаковки частинок в кристалічній решітці. Наприклад, графіт, одна з алотропічних модифікацій вуглецю (щільність р = 2,22 г/см 3), при тиску порядку 10 ю Па (10 5 атм) і температурі близько 2000 ° С переходить в алмаз, іншу модифікацію вуглецю з більш щільною упаковкою атомів (р = 3,51 г/см 3).
При підвищенні температури рівновага зміщується у бік ендотермічної реакції, а при зниженні - у бік екзотермічної реакції. Наприклад, синтез аміаку (рівняння 4.51) є екзотермічну реакцію (ДН^ 98 = -92,4 кДж). Тому при підвищенні температури рівновага в системі Н 2 - N 2 - NH 3 зрушується вліво - у бік розкладання аміаку, оскільки цей процес йде з поглинанням теплоти. Навпаки, синтез оксиду азоту (II) є ендотермічною реакцією:
Тому при підвищенні температури рівновага в системі N 2 - Про 2- NO зрушується праворуч - у бік освіти N0.
Характер зміщення під впливом зовнішніх впливів можна прогнозувати застосовуючи принцип Ле Шательє: якщо на систему, що знаходиться в рівновазі виявляється вплив з-за, то рівновага в системі зміщується так, щоб послабити зовнішній вплив.
1. Вплив концентрацій.
Підвищення концентрації однієї з реагуючих речовин зміщує рівновагу реакції у бік витрати речовини.
Зниження концентрації – у бік утворення речовини.
2. Вплив температури.
Підвищення температури зміщує рівновагу у бік реакції, що йде з поглинанням теплоти (ендотермічної), а зниження температури зміщує рівновагу у бік реакції, що йде із виділенням теплоти (екзотермічної).
3. Вплив тиску.
Підвищення тиску зміщує рівновагу у бік реакції, що йде зі зменшенням обсягу і, навпаки, зниження тиску – у бік реакції, що йде зі збільшенням обсягу.
3.1. Приклади розв'язання задач.
приклад 1.Як зміниться швидкість реакції, яка протікає в закритій посудині, якщо збільшити тиск у 4 рази?
2NO(р.)+Про 2 (р.)= 2NO 2
Рішення: збільшити тиск у 4 рази означає збільшить і концентрацію газів у стільки ж разів.
Визначаємо швидкість реакції до підвищення тиску.
V 1 = K * C 2 NO * CO 2
Визначаємо швидкість реакції після підвищення тиску.
V 2 = K*(4C NO) 2 * (4CO 2) = 64 K*C 2 NO *CO 2
Визначаємо у скільки разів зросла швидкість реакції
V2 = 64 * K * C 2 NO *CO 2 = 64
V1 K*C 2 NO*CO 2
Відповідь: швидкість реакції зросла у 64 рази.
приклад 2.У скільки разів зросте швидкість реакції при підвищенні температури з 20 до 50 С0. Температурний коефіцієнт дорівнює 3.
Рішення: за правилом Вант - Гоффа Vт 2 = Vт 1 * γ T 2 -T 1 /10
За умовою завдання потрібно визначити Vт 2
Підставимо дані у формулу:
Vт 2 = T 2 - T 1 / 10 = 3 (50-20) / 10 = 3 3 = 27
Відповідь: швидкість реакції зросла у 27 разів.
приклад 3.Обчислення константи рівноваги реакції щодо рівноважних концентрацій реагуючих речовин та визначення їх вихідних концентрацій.
При синтезі аміаку N 2 + ЗН 2 == 2NН 3 рівновага встановилася при наступних концентраціях речовин, що реагують (моль/л): C N 2 = 2,5; C H 2 = 1,8; C NH 3 = 3,6. Розрахуйте константу рівноваги цієї реакції та концентрації азоту та водню.
Рішення: визначаємо константу рівноваги цієї реакції:
K * C = C 2 NH 3 = (3,6) 2 = 0,89
C N 2 *C 3 H 3 2,5*(1,8) 3
Вихідні концентрації азоту та водню знаходимо на основі рівняння реакції. На утворення двох молей NH 3 витрачається один моль азоту, але в освіту 3,6 молей аміаку знадобилося 3,6/2=1,8 моля азоту. Враховуючи рівноважну концентрацію азоту,
знаходимо його початкову концентрацію:
C вихN 2 = 2,5 + 1,8 = 4,3 моль/л
На утворення двох молей NH3 необхідно витратити 3 моля водню, а частка отримання 3,6 моля аміаку потрібно
3 * 3,6 / 2 = 5,4 моля.
C вихН 2 = 1,8 + 5,4 = 7,2 моль/л
Відповідь: C N 2 = 4,3
приклад 4.Константа рівноваги гомогенної системи
СО (г) + Н 2 O (г) == СО 2 (г) + Н 2 (г)
при 850 0 С дорівнює 1. Обчисліть концентрації всіх речовин при рівновазі, якщо вихідні концентрації: вих = 3 моль/л, вих = 2 моль/л.
Рішення: при рівновазі швидкості прямої та зворотної реакцій рівні, а відношення констант цих швидкостей є також величина постійна і називається константою рівноваги даної системи:
V пр = K 1;
V обр = K 2;
K дорівнює = K 1 =
K 2
За умови завдання дано вихідні концентрації, тоді як вираз K дорівнює входять лише рівноважні концентрації всіх речовин системи. Припустимо, що на момент рівноваги концентрації дорівнює = х моль/л. Відповідно до рівняння системи кількість молей водню, що утворився, при цьому буде також х моль/л. По стільки ж молей (х моль/л) СО і Н 2 Про витрачається для освіти х молей СО 2 і Н 2 . Отже, рівноважні концентрації всіх чотирьох речовин:
Рівн = [Н 2] дорівнює = х моль/л,
Рівн = (3 - х) моль/л,
[Н 2 O] дорівнює = (2 - х) моль/л.
Знаючи константу рівноваги, знаходимо значення х, а потім і вихідні концентрації всіх речовин:
1 = х 2
х 2 = 6 - 2х - 3х + х 2; 5х = 6, х = 1,2 моль/л
Таким чином, шукані рівноважні концентрації:
Рівн = 1,2 моль/л.
[Н 2] дорівнює = 1,2 моль/л.
Рівн = 3 - 1,2 = 1,8 моль / л.
[Н 2 О] дорівнює = 2 - 1,2 = 0,8 моль/л.
Приклад 5.Ендотермічна реакція розкладання пентахлориду фосфору протікає за рівнянням:
РСl 5 (г) == PCl 3 (г) + Сl 2 (г); ΔН = + 129,7 кДж.
Як треба змінити: а) температуру; б) тиск; в) концентрацію, щоб усунути рівновагу у бік прямої реакції - розкладання РСl 5 ?
Рішення: зміщенням або зсувом хімічної рівноваги називають зміну, рівноважних концентрацій реагуючих речовин в результаті зміни однієї з умов реакції. Напрямок, в якому змістилася рівновага, визначається за принципом Ле-Шательє: а) оскільки реакція розкладання РС1 5 ендотермічна (ΔН > 0), то для змішування рівноваги у бік прямої реакції потрібно підвищити температуру; 6) оскільки в цій системі розкладання РСl 5 веде до збільшення обсягу (з однієї молекули газу утворюються дві газоподібні молекули), то для зміщення рівноваги у бік прямої реакції треба зменшити тиск; в) зміщення рівноваги у зазначеному напрямку можна досягнути, як збільшенням концентрації РСl 5 так і зменшенням концентрації PCl 3 або Cl 2 .
Усунення хімічної рівноваги.
Зміна температури реакції, концентрацій реагентів, тиску системі (тільки для газів) призводять до порушення рівності , отже, порушення стану рівноваги у системі. Через деякий час рівність швидкостей прямої та зворотної реакцій знову відновлюється. Однак, рівноважні концентрації в нових умовах реакції набувають нових значень.
Перехід системи з одного рівноважного стану до іншого називається зміщенням рівноваги.
Усунення рівноваги визначається закономірністю, відомою під назвою принципу Ле-Шательє, тобто. принцип рухомої рівноваги: якщо на систему, що знаходиться в рівновазі, впливають ззовні шляхом зміни будь-якої з умов, що визначають положення рівноваги, то рівновага зміщується в напрямку того процесу, протікання якого послаблює ефект виробленого впливу.
Вплив концентрацій реагуючих речовин на стан рівноваги
Збільшення концентрації, або, відповідно до принципу Ле-Шательє, викликає зсув рівноваги вправо, а збільшення концентрації - вліво.
Отже, збільшення концентрацій вихідних речовин викликає усунення хімічної рівноваги у бік збільшення продуктів реакції, а збільшення концентрацій продуктів реакції – у бік збільшення реагентів.
Вплив тиску на стан хімічної рівноваги
Тиск істотно впливає тільки на газоподібні системи, тому що тільки в них можлива велика зміна обсягу рівноважної системи.
При збільшенні тиску підвищуються концентрації речовин, що реагують, а значить, і швидкість хімічної реакції.
При взаємодії газоподібних речовин можна подати три випадки.
1. Сумарна кількість молей вихідних речовин дорівнюєсумарного числа молей продуктів реакції.
Якщо збільшити тиск у системі вдвічі, то, відповідно, обсяг зменшиться вдвічі, отже, збільшаться вдвічі концентрації газів. Швидкості прямої та зворотної реакцій зростають, але в рівну кількість разів. Тому в цьому випадку усунення стану хімічної рівноваги в системі не станеться.
Отже, якщо обсяги вихідних та кінцевих продуктів реакції рівніто зміна тиску не порушує стан хімічної рівноваги в системі.
2. Сумарна кількість молей вихідних речовин більше
У цьому випадку сумарні обсяги газів, що вступають у реакцію, більші від сумарних обсягів газоподібних продуктів реакції. Таким чином, ця реакція протікає із зменшенням обсягу.
При підвищенні тиску системі рівновагу зміщується убік меншого числа молей, тобто. у бік утворення аміаку.
3. Сумарна кількість молей вихідних речовин меншеніж сумарне число молей продуктів реакції.
Якщо при рівновазі підвищити тиск у системі, то ця система чинитиме протидію, прагнучи до початкового стану. Хімічна рівновага зміститься у бік зворотної реакції, що супроводжується зниженням тиску. Якщо за рівноваги знизити тиск у системі, то рівновага зміститься у бік прямий реакції, що призводить до підвищення тиску, тобто. зросте концентрація діоксиду азоту.
Таким чином, підвищення тиску зрушує рівновагу у бік менших обсягів, а зниження тиску – у бік більших обсягів.
Вплив температури на стан рівноваги
Відповідно до принципу Ле-Шательє, підвищення температури в системі викликає усунення хімічної рівноваги у бік ендотермічного процесу, а зменшення температури – у бік екзотермічного процесу.
Отже, необхідно знати тепловий ефект реакції. Напрямок усунення рівноваги визначається знаком теплового ефекту реакції, а ступінь усунення рівноваги – величиною ΔН, тобто. що більше ΔН, то сильніший вплив температури.
Визначимо, як впливає температура на напрямок усунення рівноваги в системі:
Т.к. пряма реакція - екзотермічна, то при нагріванні системи хімічна рівновага зміщуватиметься вліво, а при охолодженні - вправо.
При величині ΔН, близька до нульового значення, температура практично не впливає на стан хімічної рівноваги.
Для вибору оптимальних умов протікання хімічної реакції необхідно враховувати як вплив на рівновагу всіх чинників: температури, тиску, концентрації, а й їх вплив на швидкість процесів.
Приклад: одержання аміаку
Утворення аміаку супроводжується зменшенням числа молей, тому змістити рівновагу праворуч можна шляхом збільшення тиску. Оскільки реакція екзотермічна, її слід проводити за низьких температур. Але нижче 400?С швидкість хімічної реакції дуже мала, і стан рівноваги настає через великий проміжок часу. Отже процес стає нерентабельним. Тому синтез аміаку проводять при підвищеному тиску (приблизно 30-50МПа) та при температурі 400-500°С. Як каталізатор використовують губчасте залізо. Таким чином, економічно вигідніше проводити технологічний процес із меншим виходом продукту, але за більш короткий термін.
Каталізатор не впливає стан хімічного рівноваги у системі.
Вплив температури
У кожній оборотній реакції один із напрямків відповідає екзотермічному процесу, а інший – ендотермічному.
N 2 + 3H 2 ⇄ 2NH 3 + Q
Пряма реакція – екзотермічна, а зворотна реакція – ендотермічна.
Вплив зміни температури на положення хімічної рівноваги підпорядковується наступним правилам: При підвищенні температури хімічна рівновага зміщується у напрямку ендотермічної реакції, при зниженні температури – у напрямку екзотермічної реакції.
Вплив тиску
У всіх реакціях за участю газоподібних речовин, що супроводжуються зміною обсягу за рахунок зміни кількості речовини при переході від вихідних речовин до продуктів, положення рівноваги впливає тиск в системі.
Вплив тиску на положення рівноваги підпорядковується наступним правилам: При підвищенні тиску рівновага зсувається у напрямку утворення речовин (або вихідних продуктів) з меншим обсягом; при зниженні тиску рівновагу зсувається у напрямку утворення речовин з більшим об'ємом:
N 2 + 3H 2 ↔ 2NH 3
Таким чином, під час переходу від вихідних речовин до продуктів обсяг газів зменшився вдвічі. Значить, при підвищенні тиску рівновага зміщується у бік утворення NH 3 про що свідчать наступні дані для реакції синтезу аміаку при 400°С:
Вплив концентрації
Вплив концентрації на стан рівноваги підпорядковується наступним правилам:
- У разі підвищення концентрації однієї з вихідних речовин рівновагу зрушується у бік освіти продуктів реакції;
- При підвищенні концентрації одного з продуктів реакції рівновага зсувається у напрямку утворення вихідних речовин.
Примітки
Wikimedia Foundation.
2010 .
Дивитися що таке "Принцип Ле Шательє - Брауна" в інших словниках:
Принцип Ле Шательє Брауна (1884 р.) якщо систему, що у стійкому рівновазі, впливати ззовні, змінюючи якесь із умов рівноваги (температура, тиск, концентрація, зовнішнє електромагнітне поле), то…
Принцип Ле Шательє Брауна (1884 р.) якщо систему, що у рівновазі, впливати ззовні, змінюючи якесь із умов (температура, тиск, концентрація), то рівновага зміщується в такий спосіб, щоб зменшити зміну. Анрі… … Вікіпедія- Le Šateljė ir Brauno principas statusas T sritis chemija apibrėžtis Principas, pagal kurį pusiausviroji sistema, kintant išorės sąlygoms, pati mažina išorės poveikį. atitikmenys: англ. Le Chatellier Braun principle rus. принцип Ле Шательє-Брауна … Chemijos terminų aiškinamasis žodynas
Анрі Луї Ле Шательє (фр. Henri Louis Le Chatelier; 8 жовтня 1850, Париж 17 вересня 1936, Мірібель ліз Ешель) французький фізик і хімік. Зміст 1 Біографія … Вікіпедія
 Головні герої та їх характеристика у повісті «Дитинство» (Л
Головні герої та їх характеристика у повісті «Дитинство» (Л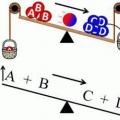 Зміщення хімічної рівноваги
Зміщення хімічної рівноваги Види УУД та прийоми формування у молодших школярів (Циганкова А
Види УУД та прийоми формування у молодших школярів (Циганкова А