Дайте повну характеристику таких хімічних процесів горіння. Класифікація хімічних реакцій
ХІМІКО-ТЕХНОЛОГІЧНИЙ ПРОЦЕС І ЙОГО ЗМІСТ
Хіміко-технологічний процес є сукупністю операцій, що дозволяють отримати цільовий продукт з вихідної сировини. Всі ці операції входять до складу трьох основних стадій, характерних для кожного хіміко-технологічного процесу.
На першій стадії проводять операції, необхідні підготовки вихідних реагентів до проведення хімічної реакції. Реагенти переводять, зокрема, у найбільш реакційний стан. Наприклад, відомо, що швидкість хімічних реакцій залежить від температури, тому часто реагенти до проведення реакції нагрівають. Газоподібну сировину підвищення ефективності процесу зменшення розмірів апаратури піддають компримированию до певного тиску. Щоб усунути побічні явища та отримати продукт високої якості, вихідну сировину піддають очищенню від сторонніх домішок, користуючись методами, заснованими на відмінності фізичних властивостей (розчинність у різних розчинниках, щільність, температури конденсації та кристалізації тощо). При очищенні сировини та реакційних сумішей широко застосовують явища тепло- та масообміну, гідромеханічні процеси. Можуть бути використані і хімічні методи очищення, засновані на хімічних реакціях, внаслідок яких непотрібні домішки перетворюються на легко відокремлені речовини.
Відповідним чином підготовлені реагенти на наступній стадії піддають хімічній взаємодії, яка може складатися з кількох етапів. У проміжках між цими етапами іноді необхідно знову використовувати тепломасообмінні та інші фізичні процеси. Наприклад, при виробництві сірчаної кислоти діоксид сірки частково окислюють до триоксиду, потім реакційну суміш охолоджують, витягають з неї шляхом абсорбції триоксид сірки і знову спрямовують на окислення.
В результаті хімічних реакцій отримують суміш продуктів (цільових, побічних, попутних) і реагентів, що не прореагували. Заключні операції останньої стадії пов'язані з поділом цієї суміші, для чого знову застосовують гідромеханічні, тепло-і масообмінні процеси, наприклад: фільтрування, центрифугування, ректифікацію, абсорбцію, екстракцію і т.д. сировину, що не прореагувала, знову використовують у процесі, організуючи його рецикл.
На всіх етапах, особливо на заключних, проводять також рекуперацію вторинних матеріальних та енергетичних ресурсів. Потоки газоподібних та рідких речовин, що потрапляють у навколишнє середовище, піддають очищенню та знешкодженню від небезпечних домішок. Тверді відходи або направляють на подальшу переробку, або розміщують для зберігання в безпечних для навколишнього середовища умовах.
Таким чином, хіміко-технологічний процес загалом – це складна система, що складається з одиничних пов'язаних між собою процесів (елементів) та взаємодіє з навколишнім середовищем.
Елементами хіміко-технологічної системи є перелічені вище процеси тепло- та масообміну, гідромеханічні, хімічні тощо. буд. Їх розглядають як поодинокі процеси хімічної технології.
p align="justify"> Важливою підсистемою складного хіміко-технологічного процесу є хімічний процес.
Хімічний процес являє собою одну або кілька хімічних реакцій, що супроводжуються явищами перенесення теплоти, маси та імпульсу, що впливають як один на одного, так і на перебіг хімічної реакції.
Аналіз одиничних процесів, їхнього взаємного впливу дозволяє розробити технологічний режим.
p align="justify"> Технологічним режимом називається сукупність технологічних параметрів (температури, тиску, концентрацій реагентів і т. д.), що визначають умови роботи апарату або системи апаратів (технологічної схеми).
Оптимальні умови ведення процесу – це поєднання основних параметрів (температури, тиску, складу вихідної реакційної суміші тощо), що дозволяє отримати найбільший вихід продукту з високою швидкістю або забезпечити найменшу собівартість при дотриманні умов раціонального використання сировини та енергії та мінімізації можливої шкоди навколишнього середовища. середовище.
Поодинокі процеси протікають у різних апаратах – хімічних реакторах, абсорбційних та ректифікаційних колонах, теплообмінниках тощо. буд. Окремі апарати з'єднані у технологічну схему процесу.
Технологічна схема - раціонально побудована система одиничних апаратів, з'єднаних різними видами зв'язків (прямих, зворотних, послідовних, паралельних), що дозволяє одержати заданий продукт заданої якості із природної сировини або напівфабрикатів.
Технологічні схеми бувають відкритими та закритими, можуть містити байпасні (обвідні) потоки та рецикли, що дозволяють підвищувати ефективність функціонування хіміко-технологічної системи загалом.
Розробка та побудова раціональної технологічної схеми – важливе завдання хімічної технології.
Класифікація хімічних реакцій, що лежать в основі промислових хіміко-технологічних процесів
У сучасній хімії відома велика кількість різних хімічних реакцій. Чимало їх ми здійснюються у промислових хімічних реакторах і, отже, стають об'єктом вивчення хімічної технології.
Щоб полегшити вивчення близьких за природою явищ, у науці заведено їх класифікувати за загальними ознаками. Залежно від цього, які ознаки взято у своїй за основу, є кілька видів класифікації хімічних реакцій.
Важливим видом класифікації є класифікація за механізму здійснення реакції.Розрізняють прості (одностадійні) та складні (багатостадійні) реакції, зокрема паралельні, послідовні та послідовно-паралельні.
Простими називають реакції, реалізації яких потрібно подолання лише енергетичного бар'єру (одна стадія).
Складні реакції включають кілька паралельних або послідовних стадій (простих реакцій).
Реальні одностадійні реакції трапляються надзвичайно рідко. Однак деякі складні реакції, що проходять через низку проміжних стадій, зручно вважати формально простими. Це можливо в тих випадках, коли проміжні продукти реакції в умовах цієї задачі не виявляються.
Класифікація реакцій за молекулярністювраховує, скільки молекул бере участь у елементарному акті реакції; розрізняють моно-, бі- та тримолекулярні реакції.
Вид кінетичного рівняння (залежність швидкості реакції від концентрацій реагентів) дозволяє проводити класифікацію по порядку реакції.Порядком реакції називається сума показників ступенів концентрацій реагентів у кінетичному рівнянні. Існують реакції першого, другого, третього, дробового порядків.
Хімічні реакції розрізняють також за тепловим ефектом.При протіканні екзотермічних реакцій, що супроводжуються виділенням теплоти ( Q> 0), відбувається зменшення ентальпії реакційної системи ( ∆H < 0); при протекании эндотермических реакций, сопровождающихся поглощением теплоты (Q< 0), відбувається збільшення ентальпії реакційної системи ( ∆H> 0).
Для вибору конструкції хімічного реактора та способів управління проведенням процесу важливе значення має фазовий складреакційної системи
Залежно від того, скільки (одну або кілька) фаз утворюють вихідні реагенти та продукти реакції, хімічні реакції ділять на гомофазні та гетерофазні.
Гомофазними називають реакції, у яких вихідні реагенти, стабільні проміжні речовини та продукти реакції знаходяться в межах однієї фази.
Гетерофазними називають реакції, у яких вихідні реагенти, стабільні проміжні речовини та продукти реакції утворюють більш ніж одну фазу.
Залежно від зони протіканняреакції поділяються на гомогенні та гетерогенні реакції.
Поняття «гомогенна» та «гетерогенна» реакції не збігаються з поняттями «гомофазний» та «гетерофазний» процеси. Гомогенность і гетерогенність реакції відбиває певною мірою її механізм: чи протікає реакція обсягом якоїсь однієї фази чи поверхні розділу фаз. Гомофазність та гетерофазність процесу дозволяють лише судити про фазовий склад учасників реакції.
У разі гомогенних реакцій реагенти та продукти знаходяться в одній фазі (рідкої або газоподібної) та реакція протікає в обсязі цієї фази. Наприклад, окислення оксиду азоту киснем повітря у виробництві азотної кислоти – газофазна реакція, а реакції етерифікації (отримання ефірів з органічних кислот та спиртів) – рідкофазні.
При протіканні гетерогенних реакцій щонайменше один з реагентів або продуктів знаходиться у фазовому стані, що відрізняється від фазового стану інших учасників, і при її аналізі обов'язково повинна враховуватися поверхня розділу фаз. Наприклад, нейтралізація кислоти лугом – це гомофазний гомогенний процес. Каталітичний синтез аміаку – це гомофазний гетерогенний процес. Окислення вуглеводнів у рідкій фазі газоподібним киснем являє собою гетерофазний процес, але хімічна реакція, що протікає, є гомогенною. Гашення вапна СаО + Н 2 Про Са(ОН) 2 , при якому всі три учасники реакції утворюють окремі фази, а реакція йде на межі розділу води та оксиду кальцію, є гетерофазним гетерогенним процесом.
Залежно від того, застосовуються або не застосовуються для зміни швидкості реакції, спеціальні речовини – каталізатори, розрізняють каталітичніі некаталітичніреакції та відповідно хіміко-технологічні процеси. Переважна більшість хімічних реакцій, на яких ґрунтуються промислові хіміко-технологічні процеси, – це каталітичні реакції.
І класифікація сталей
- якість;
- хімічний склад;
- Призначення;
- Мікроструктура;
- міцність.
Якість сталі
За хімічним складом
Вуглецеві сталі постійних домішок
Таблиця 1.3.
Вуглецевої сталі
Легуючі елементи добавкамиабо присадками
Леговані сталі низьколеговані(До 2,5 мас.%), леговані(від 2,5 до 10 мас.%) та високолеговані «хромиста»
За призначенням сталі
Конструкційними низько-(або мало-)і середньовуглецевими.
Інструментальнимивисоковуглецевими.
і (З особливими властивостями – ).
і
і підвищеної теплостійкості швидкорізальних сталей.
Звичайної якості,
Конструкційні сталі,
Інструментальні сталі,
6) підшипникові (шарикопідшипникові) сталі,
7) швидкорізальні сталі(Високолеговані, високоякісні інструментальні сталі з підвищеним вмістом вольфраму).
8) автоматні, тобто.підвищеної (або високої) оброблюваності, сталі.
Аналіз складу маркувальних груп сталей, що історично склалися, показує, що застосовувані системи маркування дозволяють кодувати п'ять класифікаційних ознак, а саме: якість, хімічний склад, призначення, ступінь розкислення,а також спосіб отримання заготовок(автоматні або, в окремих випадках, ливарні). Зв'язок маркувальних груп та класів сталей ілюструється нижньою частиною блок-схеми на рис.1.
СИСТЕМА МАРКУВАЛЬНИХ ГРУП, ПРАВИЛА МАРКУВАННЯ ТА ПРИКЛАДИ МАРОК СТАЛІВ
| Вуглеродні | ЗВИЧАЙНОЇ ЯКОСТІ | |||||||
| Група сталі | Гарантія постачання | МАРКИ | ||||||
| А | за хімічним складом | Ст0 | Ст1 | Ст2 | СтЗ | Ст4 | Ст5 | Ст6 |
| Б | за механічними властивостями | БСт0 | БСт1 | БСт2 | БСтЗ | БСт4 | БСт5 | БСт6 |
| У | за механічними властивостями та хімічним складом | ВСтО | ВСт1 | ВСт2 | ВСтЗ | ВСт4 | ВСт5 | ВСт6 |
| Концентрація вуглецю, мас. % | 0,23 | 0,06-0,12 | 0,09-0,15 | 0,14-0,22 | 0,18-0,27 | 0,28-0,37 | 0,38-0,49 | |
| ЯКІСНІ ВИСОКОЯКІСНІ | КОНСТРУКЦІЙНІ | ПРИКЛАДИ МАРОК | ||||||
| Марка: двозначне число СОТИХ Часток відсотка вуглецю + вказівка ступеня розкислення | 05 08кп 10 15 18кп 20А 25пс ЗОА 35 40 45 50 55 ... 80 85 Примітки: 1) відсутність покажчика ступеня розкислення означає «сп»; 2) "А" в кінці марки показує, що сталь - високоякісна | |||||||
| ІНСТРУМЕНТАЛЬНІ | МАРКИ | |||||||
| Марка: символ "У" + число ДЕСЯТИХ ДОЛІЙ відсотка вуглецю | У7 У7А У8 УВА У9 У9А У10 У10А У12 У12А | |||||||
| ЛЕГОВАНІ | ЯКІСНІ ВИСОКОЯКІСНІ | КОНСТРУКЦІЙНІ | ПРИКЛАДИ МАРОК | |||||
| Марка: двозначне число СОТИХ ДОЛІЙ відсотка вуглецю + символ легуючого елемента + ціла кількість його відсотків | 09Г2 10ХСНД 18Г2АФпс 20Х 40Г 45ХН 65С2ВА 110Г13Л Примітки: 1) цифра «1» як покажчик концентрації ≤ 1 мас.% легуючого елемента не ставиться; 2) марка 110Г13Л - одна з небагатьох, в якій число сотих часток відсотка вуглецю - тризначне | |||||||
| ІНСТРУМЕНТАЛЬНІ | ПРИКЛАДИ МАРОК | |||||||
| Марка: число ДЕСЯТИХ ДОЛІЙ відсотка вуглецю + символ легуючого елемента+ ціла кількість його відсотків | Примітки: 1) число «10» як покажчик «десяти десятих» мас.% вуглецю не ставиться; 2) «-Ш» наприкінці марки показує, що сталь - особливо високоякісна, отримана, наприклад, методом електрошлаковогопереплаву (але не тільки) |
Вуглецеві конструкційні сталі звичайної якості
Конкретні сталі зазначеної маркувальної групи позначаються за допомогою дволітерного поєднання. «Ст»яке є ключовим (системотворчим) у аналізованій маркувальній групі. Марки сталей цієї групи відразу впізнаються за цим символом.
За символом «Ст» без пробілу слідує цифра, що вказує номермарки – від «0» до "6".
Зростання номера марки відповідає зростанню вмісту вуглецю в сталі, проте не вказує на його конкретне значення. Допустимі межі концентрації вуглецю в сталях кожної марки показані в табл. 1.5. Вміст вуглецю в сталях вуглецевих звичайної якостіне перевищує 0,5 мас.%. Такі сталі є доевтектоїдними за структурним критерієм, і, отже, конструкційними за призначенням.
Після цифри слідує одне з трьох буквосполучень: «кп», «пс», «сп», що показує ступінь розкислення сталі.
Перед символом «Ст» можуть стояти великі літери «А», «Б» чи «В» або може бути ніяких символів. У такий спосіб передається інформація про приналежність сталі до однієї з так званих «груп постачання»: А, Бабо У, - Залежно від того, який з нормованих показників сталі гарантується постачальником.
Сталь групи Апоставляється з гарантією хімічного складу або заданих ГОСТом допустимих значень концентрації вуглецю та домішок. Літера "А" часто в марці не ставиться і її відсутність за замовчуваннямозначає гарантію хімічного складу. Споживач сталі, не маючи інформації про механічні властивості, може формувати їх шляхом відповідної термообробки, вибір режимів якої потребує знання хімічного складу.
Сталь групи Бпоставляється із гарантією необхідних механічних властивостей. Споживач сталі може визначити оптимальне застосування в конструкціях за відомими характеристиками механічних властивостей без попередньої термообробки.
Сталь групи Упоставляється з гарантією як хімічного складу, і механічних властивостей. Використовується споживачем головним чином для створення зварних конструкцій. Знання механічних властивостей дозволяє прогнозувати поведінку навантаженої конструкції в зонах, далеких від зварних швів, а знання хімскладу дає можливість передбачати і, по необхідності, виправляти термообробкою механічні властивості власне зварних швів.
Приклади запису марок вуглецевої сталі звичайної якостівиглядають наступним чином: ВСт3пс, БСт6сп, Ст1кп .
Шарикопідшипникові сталі
Сталі для підшипників мають власне маркування, за призначенням складають особливу групу конструкційних сталей, хоча за складом та властивостями вони близькі до інструментальних сталей. Термін «кулькопідшипникові» визначає їхню вузьку область призначення – підшипники кочення (не тільки кулькові, але також роликові та голчасті). Для її маркування було запропоновано абревіатуру «ШХ» – шарикопідшипникова хромиста, - за якою ставиться число десятих часток відсоткасередньої концентрації хрому. З раніше відомих марок ШХ6, ШХ9 і ШХ15 у вживанні залишилася марка ШХ15. Відмінність шарикопідшипникової сталі від аналогічної інструментальної – у більш жорстких вимогах до кількості неметалевих включень та рівномірності розподілу карбідів у мікроструктурі.
Удосконалення сталі ШХ15 шляхом введення в неї додаткових легуючих добавок (кремнію та марганцю) своєрідно відбилося у маркуванні – поширенням на специфічнусистему пізніших правил позначення легуючих елементів у складі легованих сталей: ШХ15СГ, ШХ20СГ.
Швидкорізальні сталі
Швидкорізальні сталі специфічно маркуються початковою літерою російського алфавіту "Р", що відповідає першому звуку в англійському слові rapid – швидкий, швидкий. Далі слідує ціле число відсотків вольфраму. Як уже було сказано, найбільш поширеною раніше маркою швидкорізальної сталі була Р18.
У зв'язку з дефіцитністю та дорожнечею вольфраму стався перехід на вольфрамомолібденову сталь Р6М5 без азоту та Р6АМ5 з азотом. Аналогічно підшипниковим сталям, сталося злиття (своєрідна «гібридизація») двох систем маркування. Розробка та освоєння нових швидкорізальних сталей з кобальтом і ванадієм збагатило арсенал «гібридних» марок: Р6АМ5Ф3, Р6М4К8, 11Р3АМ3Ф2 – а також призвело до появи взагалі безвольфрамових швидкорізальних сталей, які маркуються і в специфічній системі (Р0М2Ф1 - 9Х6М3Ф3АГСТ-Ш, 9Х4М3Ф2АГСТ-Ш.
Класифікація чавунів
Чавунами називають сплави заліза з вуглецем, що мають у своєму складі більше 2,14 мас.% С.
Чавуни виплавляють для переділу в сталь (передільні), для отримання феросплавів, що відіграють роль легуючих присадок, а також високотехнологічні сплави для отримання виливків (ливарні).
Вуглець може знаходитися в чавуні у вигляді двох високовуглецевих фаз – цементиту (Fe 3 C) та графіту, а іноді одночасно у вигляді цементиту та графіту. Чавун, в якому присутній тільки цементит, дає світлий блискучий злам і тому називається білим. Присутність графіту надає зламу чавуну сірого кольору. Однак не всякий чавун із графітом відноситься до класу так званих сірихчавунів. Між білими та сірими чавунами лежить клас половинчастихчавунів.
Половинчастимичавунами називають чавуни, у структурі яких, незважаючи на графітизацію, хоча б частково зберігся цементит ледебуриту, а, отже, присутній власне ледебурит – евтектична структурна складова, що має специфічний вид.
До сіримвідносять чавуни, в яких повністю розпався цементит ледебуриту, і останнього у структурі не стало. Сірий чавун складається з графітних включеньі металевої основи. Ця металева основа являє собою перлітну (евтектоїдну), ферито-перлітну (доевтектоїдну) або феритну (маловуглецеву) сталь. Зазначеній послідовності видів металевої основи сірих чавунів відповідає дедалі більший ступінь розпаду цементиту, що входить до складу перліту.
Антифрикційні чавуни
Приклади марок: АЧС-1, АЧС-2, АЧС-3.
Спеціальні леговані жаростійкі, корозійностійкіі жароміцнічавуни:
ПРИКЛАДИ МАРОК СПЕЦІАЛЬНИХ СІРІХ чавунів
Класифікація та маркування
металокерамічних твердих сплавів
Металокерамічними твердими сплавами називають сплави, виготовлені методом порошкової металургії (металокераміки) і які складаються з карбідів тугоплавких металів: WC, TiC, TaC, – з'єднаних пластичною металевою зв'язкою, найчастіше кобальтом.
Нині у Росії виготовляють тверді сплави трьох груп: вольфрамові, титановольфрамові та титанотанталовольфрамові, що містять як зв'язок кобальт.
Через дорожнечу вольфраму розроблені тверді сплави, які зовсім не містять карбіду вольфраму. Як тверду фазу вони містять тільки карбід титануабо карбонітрид титану- Ti(NC). Роль пластичного зв'язування виконує нікель-молібденова матриця. Класифікація твердих сплавів представлена блок-схемою.
Відповідно до п'яти класів металокерамічних твердих сплавів існуючі правила маркування утворюють п'ять маркувальних груп.
Вольфрамові (іноді звані вольфрамокобальтовими) тверді сплави
Приклади: ВК3, ВК6, ВК8, ВК10.
Титановольфрамові (іноді звані титановольфрамокобальтовими) тверді сплави
Приклади: Т30К4, Т15К6, Т5К10, Т5К12.
Титанотанталовольфрамові (іноді звані титанотантало-вольфрамокобальтовими) тверді сплави
Приклади: ТТ7К12, ТТ8К6, ТТ10К8, ТТ20К9.
Іноді в кінці марки через дефіс додають літери або буквосполучення, що характеризують дисперсність частинок карбідів у порошку:
КЛАСИФІКАЦІЯ ТВЕРДИХ МЕТАЛОКЕРАМІЧНИХ СПЛАВІВ
Зарубіжні аналоги деяких вітчизняних марок легованих сталей наведено у таблиці 1.1.
Таблиця 1.1.
Зарубіжні аналоги низки вітчизняних марок легованих сталей
| Росія, ГОСТ | Німеччина, DIN * | США, ASTM * | Японія, ЛS * |
| 15Х | 15Cr3 | SCr415 | |
| 40Х | 41Сг4 | SСг440 | |
| 30ХМ | 25СгМо4 | SСМ430,SСМ2 | |
| 12ХГ3А | 14NiCr10 ** | – | SNC815 |
| 20ХДНМ | 21NiСгМо2 | SNСМ220 | |
| 08X13 | Х7Сr1З** | 410S | SUS410S |
| 20X13 | Х20Сг13 | SUS420J1 | |
| 12X17 | Х8Сг17 | 430 (51430 ***) | SUS430 |
| 12Х18Н9 | Х12СгNi8 9 | SUS302 | |
| 08Х18Н10Т | Х10CrNiTi18 9 | .321 | SUS321 |
| 10Х13СЮ | Х7CrA133** | 405 ** (51405) *** | SUS405** |
| 20Х25Н20С2 | Х15CrNiSi25 20 | 30314,314 | SСS18, SUH310 ** |
* DIN (Deutsche Industrienorm), ASTM (American Societi for Testing Materials), JIS (Japaneese industrial Standart).
** Сталь, близька за складом; *** Стандарт SAE
Характеристика класифікаційних ознак
І класифікація сталей
До сучасних класифікаційних ознак сталей відносяться такі:
- якість;
- хімічний склад;
- Призначення;
- металургійні особливості виробництва;
- Мікроструктура;
- Традиційний спосіб зміцнення;
- традиційний спосіб отримання заготовок чи деталей;
- міцність.
Коротко охарактеризуємо кожен із них.
Якість сталівизначається насамперед вмістом шкідливих домішок – сірки та фосфору – і характеризується за 4-ма категоріями (див. табл. 1.2).
За хімічним складомсталі умовно поділяють на вуглецеві (нелеговані) сталі та леговані.
Вуглецеві сталіне містять спеціально запроваджених легуючих елементів. Елементи, що містяться в вуглецевих сталях, крім вуглецю, належать до так званих постійних домішок. Їхня концентрація повинна знаходитися в межах, що визначаються відповідними державними стандартами (ГОСТами). У таблиці 1.3. дають усереднені граничні значення концентрації деяких елементів, що дозволяють відносити ці елементи до розряду домішок, а не легуючих елементів. Конкретні межі вмісту домішок у вуглецевих сталях дають ДСТУ.
Таблиця 1.3.
ГРОМАДНІ КОНЦЕНТРАЦІЇ ДЕЯКИХ ЕЛЕМЕНТІВ, ЩО ДОПОВОЛЯЮТЬ ВРАХУВАТИ ЇХ ПОСТІЙНИМИ ПРИМІСЯМИ
Вуглецевої сталі
Легуючі елементи, іноді звані легуючими добавкамиабо присадками, спеціально вводяться в сталь для отримання необхідної структури та властивостей.
Леговані сталіпідрозділяються за сумарною концентрацією легуючих елементів, крім вуглецю, низьколеговані(До 2,5 мас.%), леговані(від 2,5 до 10 мас.%) та високолеговані(більше 10 мас.%) при вмісті в останніх заліза не менше 45 мас.%. Зазвичай легуючий елемент, що вводиться, дає легованій сталі відповідну назву: «хромиста»- легована хромом, "кремниста" - кремнієм, "хромокремниста" - хромом і кремнієм одночасно і т.д.
Крім того, виділяють також ще сплави на основі заліза, коли у складі матеріалу заліза менше 45%, але його більш будь-якого іншого легуючого елемента.
За призначенням сталіпідрозділяють на конструкційні та інструментальні.
Конструкційнимивважаються сталі, що застосовуються виготовлення різних деталей машин, механізмів і конструкцій в машинобудуванні, будівництві і приладобудуванні. Повинні мати необхідну міцність і в'язкість, а також, якщо потрібно, комплекс спеціальних властивостей (корозійну стійкість, парамагнетизм і т. д.). Як правило, конструкційні сталі є низько-(або мало-)і середньовуглецевими.Твердість не є для них вирішальною механічною характеристикою.
Інструментальниминазиваються сталі, що застосовуються для обробки матеріалів різанням або тиском, а також виготовлення вимірювального інструменту. Повинні мати високу твердість, зносостійкість, міцність і ряд інших специфічних властивостей, наприклад, теплостійкість. Необхідною умовою отримання високої твердості є підвищений вміст вуглецю, тому інструментальні сталі, за рідкісними винятками, завжди є високовуглецевими.
Усередині кожної групи має місце більш детальний поділ за призначенням. Конструкційні сталі поділяють на будівельні, машинобудівніі сталі спеціального застосування(З особливими властивостями – жароміцні, жаростійкі, корозійностійкі, немагнітні).
Інструментальні сталі поділяють на сталі для різального інструменту, штампові сталіі сталі для вимірювального інструменту
Загальною експлуатаційною властивістю інструментальних сталей є висока твердість, що забезпечує опір інструменту деформації та стирання його поверхні. У той же час до сталей для ріжучого інструменту пред'являється специфічна вимога - зберігати високу твердість при підвищених температурах (до 500 ... 600 º С), що розвиваються в ріжучій кромці при великих швидкостях різання. Вказана здатність сталі називається її теплостійкістю (або червоностійкістю). За вказаним критерієм сталі для різального інструменту поділяють на нетеплостійкі, напівтеплостійкі, теплостійкіі підвищеної теплостійкості. Дві останні групи відомі у техніці під назвою швидкорізальних сталей.
Від штампових сталей, окрім високої твердості, потрібна велика в'язкість, оскільки штамповий інструмент працює в умовах ударного навантаження. Крім того, інструмент для гарячого штампування, стикаючись із нагрітими металевими заготовками, при тривалій роботі може розігріватися. Тому сталі для гарячого штампування повинні бути ще й теплостійкими.
Сталі для вимірювального інструменту, крім високої зносостійкості, що забезпечує точність розмірів протягом тривалого терміну служби, повинні гарантувати стабільність розмірів інструментів незалежно від температурних умов експлуатації. Інакше кажучи, вони мають дуже невелике значення коефіцієнта теплового розширення.
Класифікація неорганічних речовин із прикладами сполук
Тепер проаналізуємо представлену вище класифікаційну схему детальніше.
Як ми бачимо, перш за все неорганічні речовини поділяються на простіі складні:
Простими речовинами називають такі речовини, що утворені атомами лише одного хімічного елемента. Наприклад, простими речовинами є водень H 2 , кисень O 2 залізо Fe, вуглець С і т.д.
Серед простих речовин розрізняють метали, неметалиі благородні гази:
Металиутворені хімічними елементами, які розташовані нижче діагоналі бор-астат, а також усіма елементами, що знаходяться в побічних групах.
Шляхетні газиутворені хімічними елементами групи VIIIA.
Неметалиутворені відповідно хімічними елементами, розташованими вище діагоналі бор-астат, за винятком усіх елементів побічних підгруп та шляхетних газів, розташованих у VIIIA групі:
Назви простих речовин найчастіше збігаються із назвами хімічних елементів, атомами яких вони утворені. Однак для багатьох хімічних елементів поширене таке явище, як алотропія. Алотропією називають явище, коли один хімічний елемент здатний утворювати декілька простих речовин. Наприклад, у разі хімічного елемента кисню можливе існування молекулярних сполук з формулами O2 та O3. Першу речовину прийнято називати киснем так само, як і хімічний елемент, атомами якого вона утворена, а друга речовина (O 3) називається озоном. Під простою речовиною вуглецем може матися на увазі будь-яка з його алотропних модифікацій, наприклад, алмаз, графіт або фулерени. Під простою речовиною фосфор можуть розумітися такі його алотропні модифікації, як білий фосфор, червоний фосфор, чорний фосфор.
Складні речовини
Складними речовинами називають речовини, утворені атомами двох чи більше хімічних елементів.
Так, наприклад, складними речовинами є аміак NH 3 , сірчана кислота H 2 SO 4 , гашене вапно Ca(OH) 2 і безліч інших.
Серед складних неорганічних речовин виділяють 5 основних класів, а саме оксиди, основи, амфотерні гідроксиди, кислоти та солі:
Оксиди - Складні речовини, утворені двома хімічними елементами, один з яких кисень у ступені окислення -2.
Загальна формула оксидів може бути записана як Е x O y де Е - символ будь-якого хімічного елемента.
Номенклатура оксидів
Назва оксиду хімічного елемента будується за принципом:
Наприклад:
Fe 2 O 3 - оксид заліза (III); CuO - оксид міді (II); N 2 O 5 - оксид азоту (V)
Нерідко можна зустріти інформацію про те, що в дужках вказується валентність елемента, проте це не так. Так, наприклад, ступінь окислення азоту N 2 O 5 дорівнює +5, а валентність, як це не дивно, дорівнює чотирьом.
Якщо хімічний елемент має єдиний позитивний ступінь окиснення в сполуках, то ступінь окиснення не вказується. Наприклад:
Na 2 O - оксид натрію; H 2 O - оксид водню; ZnO – оксид цинку.
Класифікація оксидів
Оксиди за їх здатністю утворювати солі при взаємодії з кислотами або основами поділяють відповідно на солеутворюючіі несолетворні.
Несолетворних оксидів небагато, всі вони утворені неметалами в ступені окислення +1 та +2. Список несолетворних оксидів слід запам'ятати: CO, SiO, N 2 O, NO.
Солеутворюючі оксиди в свою чергу поділяються на основні, кислотніі амфотерні.
Основними оксидаминазивають такі оксиди, які за взаємодії з кислотами (або кислотними оксидами) утворюють солі. До основних оксидів відносять оксиди металів у ступені окислення +1 та +2, за винятком оксидів BeO, ZnO, SnO, PbO.
Кислотними оксидаминазивають такі оксиди, які при взаємодії із основами (або основними оксидами) утворюють солі. Кислотними оксидами є практично всі оксиди неметалів за винятком несолетворних CO, NO, N 2 O, SiO, а також усі оксиди металів у високих ступенях окиснення (+5, +6 та +7).
Амфотерними оксидаминазивають оксиди, які можуть реагувати як з кислотами, так і з основами, і в результаті цих реакцій утворюють солі. Такі оксиди виявляють подвійну кислотно-основну природу, тобто можуть виявляти властивості як кислотних, і основних оксидів. До амфотерних оксидів відносяться оксиди металів у ступенях окиснення +3, +4, а також як винятки оксиди BeO, ZnO, SnO, PbO.
Деякі метали можуть утворювати всі три види солеутворювальних оксидів. Наприклад, хром утворює основний оксид CrO, амфотерний оксид Cr 2 O 3 і кислотний оксид CrO 3 .
Як бачимо, кислотно-основні властивості оксидів металів безпосередньо залежить від ступеня окислення металу в оксиді: що більше ступінь окислення, тим більше виражені кислотні властивості.
Основи
Основи — сполуки з формулою виду Me(OH) x , де xнайчастіше дорівнює 1 чи 2.
Винятки: Be(OH) 2 , Zn(OH) 2 , Sn(OH) 2 і Pb(OH) 2 не належать до основ, незважаючи на ступінь окислення металу +2. Дані сполуки є амфотерними гідроксидами, які ще будуть розглянуті в цьому розділі детальніше.
Класифікація основ
Підстави класифікують за кількістю гідроксогруп в одній структурній одиниці.
Підстави з однією гидроксогрупой, тобто. виду MeOH, називають однокислотними основами,із двома гидроксогруппами, тобто. виду Me(OH) 2 відповідно, двокислотнимиі т.д.
Також підстави поділяють на розчинні (луги) та нерозчинні.
До луг відносяться виключно гідроксиди лужних та лужноземельних металів, а також гідроксид талію TlOH.
Номенклатура основ
Назва основи будується за наступним принципом:
Наприклад:
Fe(OH) 2 - гідроксид заліза (II),
Cu(OH) 2 - гідроксид міді (II).
У тих випадках, коли метал у складних речовинах має постійний рівень окислення, вказувати її не потрібно. Наприклад:
NaOH - гідроксид натрію,
Ca(OH) 2 - гідроксид кальцію і т.д.
Кислоти
Кислоти - Складні речовини, молекули яких містять атоми водню, здатні заміщатися на метал.
Загальна формула кислот може бути записана як H x A, де H - атоми водню, здатні заміщатися на метал, а A - кислотний залишок.
Наприклад, до кислот відносяться такі сполуки, як H 2 SO 4 HCl, HNO 3 HNO 2 і т.д.
Класифікація кислот
За кількістю атомів водню, здатних заміщатися на метал, кислоти поділяються на:
- О дноосновні кислоти: HF, HCl, HBr, HI, HNO 3;
- д вухосновні кислоти: H2SO4, H2SO3, H2CO3;
- т рехосновні кислоти: H 3 PO 4 , H 3 BO 3 .
Слід зазначити, що кількість атомів водню у разі органічних кислот найчастіше відбиває їх основність. Наприклад, оцтова кислота з формулою CH 3 COOH, незважаючи на наявність 4 атомів водню в молекулі, є не чотирьох-, а одноосновною. Основність органічних кислот визначається кількістю карбоксильних груп (-COOH) у молекулі.
Також за наявністю кисню в молекулах кислоти поділяють на безкисневі (HF, HCl, HBr і т.д.) і кисневмісні (H 2 SO 4 HNO 3 H 3 PO 4 і т.д.). Кисневмісні кислоти називають також оксокислотами.
Більш детально про класифікацію кислот можна почитати.
Номенклатура кислот та кислотних залишків
Нижченаведений список назв і формул кислот і кислотних залишків обов'язково слід вивчити.
У деяких випадках полегшити запам'ятовування може низка таких правил.
Як бачимо з таблиці вище, побудова систематичних назв безкисневих кислот виглядає так:
Наприклад:
HF - фтороводородна кислота;
HCl - хлороводнева кислота;
H 2 S - сірководнева кислота.
Назви кислотних залишків безкисневих кислот будуються за принципом:
Наприклад, Cl - хлорид, Br - бромід.
Назви кисневмісних кислот отримують додаванням до назви кислотоутворюючого елемента різних суфіксів та закінчень. Наприклад, якщо кислотоутворюючий елемент у кисневмісній кислоті має вищий ступінь окислення, то назва такої кислоти будується таким чином:
Наприклад, сірчана кислота H 2 S +6 O 4 хромова кислота H 2 Cr +6 O 4 .
Усі кисневмісні кислоти можуть бути класифіковані як кислотні гідроксиди, оскільки в їх молекулах виявляються гідроксогрупи (OH). Наприклад, це видно з нижченаведених графічних формул деяких кисневмісних кислот:
Таким чином, сірчана кислота інакше може бути названа як гідроксид сірки (VI), азотна кислота гідроксид азоту (V), фосфорна кислота гідроксид фосфору (V) і т.д. При цьому число у дужках характеризує ступінь окислення кислотоутворюючого елемента. Такий варіант назв кисневмісних кислот багатьом може здатися вкрай незвичним, проте зрідка такі назви можна зустріти в реальних КІМ ЕГЕ з хімії в завданнях на класифікацію неорганічних речовин.
Амфотерні гідроксиди
Амфотерні гідроксиди — гідроксиди металів, які виявляють подвійну природу, тобто. здатні виявляти як властивості кислот, і властивості основ.
Амфотерними є гідроксиди металів у ступенях окиснення +3 та +4 (як і оксиди).
Також як винятки до амфотерних гідроксидів відносять сполуки Be(OH) 2 , Zn(OH) 2 , Sn(OH) 2 і Pb(OH) 2 , незважаючи на ступінь окислення металу в них +2.
Для амфотерних гідроксидів трьох-і чотиривалентних металів можливе існування орто- та мета-форм, що відрізняються один від одного на одну молекулу води. Наприклад, гідроксид алюмінію (III) може існувати в орто-формі Al(OH) 3 або мета-формі AlO(OH) (метагідроксід).
Оскільки, як уже було сказано, амфотерні гідроксиди виявляють як властивості кислот, так і властивості основ, їх формула та назва можуть бути записані по-різному: або як у основи, або як у кислоти. Наприклад:
Солі
Солі - Це складні речовини, до складу яких входять катіони металів та аніони кислотних залишків.
Так, наприклад, до солей відносяться такі сполуки як KCl, Ca(NO 3) 2 , NaHCO 3 і т.д.
Представлене вище визначення описує склад більшості солей, проте існують солі, які під нього. Наприклад, замість катіонів металів до складу солі можуть входити катіони амонію або його похідні органічні. Тобто. до солей відносяться такі сполуки, як, наприклад, (NH 4) 2 SO 4 (сульфат амонію), + Cl - (хлорид метиламонію) і т.д.
Також суперечать визначенню солей вище клас про комплексних солей, які будуть розглянуті наприкінці цієї теми.
Класифікація солей
З іншого боку, солі можна розглядати як продукти заміщення катіонів водню H + в кислоті на інші катіони або як продукти заміщення гідроксид-іонів в підставах (або амфотерних гідроксидах) на інші аніони.
При повному заміщенні утворюються так звані середніабо нормальнісолі. Наприклад, при повному заміщенні катіонів водню в сірчаній кислоті на катіони натрію утворюється середня (нормальна) сіль Na 2 SO 4 а при повному заміщенні гідроксид-іонів в основі Ca(OH) 2 на кислотні залишки нітрат-іони утворюється середня (нормальна) сіль Ca(NO 3) 2 .
Солі, одержувані неповним заміщенням катіонів водню у двоосновній (або більше) кислоті на катіони металу, називають кислими. Так, при неповному заміщенні катіонів водню в сірчаній кислоті катіони натрію утворюється кисла сіль NaHSO 4 .
Солі, які утворюються при неповному заміщенні гідроксид-іонів у двокислотних (або більше) основах, називають осн. оними солями. Наприклад, при неповному заміщенні гідроксид-іонів в основі Ca(OH) 2 на нітрат-іони утворюється осн овна сіль Ca(OH)NO 3 .
Солі, що складаються з катіонів двох різних металів та аніонів кислотних залишків тільки однієї кислоти, називають подвійними солями. Так, наприклад, подвійними солями є KNaCO 3 KMgCl 3 і т.д.
Якщо сіль утворена одним типом катіонів та двома типами кислотних залишків, такі солі називають змішаними. Наприклад, змішаними солями є сполуки Ca(OCl)Cl, CuBrCl тощо.
Існують солі, які не підпадають під визначення солей як продуктів заміщення катіонів водню в кислотах на катіони металів або продуктів заміщення гідроксид-іонів в основах на аніони кислотних залишків. Це комплексні солі. Так, наприклад, комплексними солями є тетрагидроксоцинкат-і тетрагідроксоалюмінат натрію з формулами Na 2 і Na відповідно. Розпізнати комплексні солі серед інших найчастіше можна за наявності квадратних дужок у формулі. Однак потрібно розуміти, що, щоб речовину можна було віднести до класу солей, до її складу повинні входити будь-які катіони, крім (або замість) H + , а з аніонів повинні бути будь-які аніони крім (або замість) OH - . Так, наприклад, з'єднання H 2 не відноситься до класу комплексних солей, оскільки при його дисоціації з катіонів у розчині присутні тільки катіони водню H + . За типом дисоціації цю речовину слід скоріше класифікувати як безкисневу комплексну кислоту. Аналогічно, до солей не належить з'єднання OH, т.к. дане з'єднання складається з катіонів + і гідроксид-іонів OH - , тобто. його слід вважати комплексною основою.
Номенклатура солей
Номенклатура середніх та кислих солей
Назва середніх та кислих солей будується за принципом:
Якщо ступінь окислення металу у складних речовинах постійна, її не вказують.
Назви кислотних залишків було дано вище під час розгляду номенклатури кислот.
Наприклад,
Na 2 SO 4 - сульфат натрію;
NaHSO 4 - гідросульфат натрію;
CaCO 3 - карбонат кальцію;
Ca(HCO 3) 2 - гідрокарбонат кальцію і т.д.
Номенклатура основних солей
Назви основних солей будуються за принципом:
Наприклад:
(CuOH) 2 CO 3 - гідроксокарбонат міді (II);
Fe(OH) 2 NO 3 - дигідроксонітрат заліза (III).
Номенклатура комплексних солей
Номенклатура комплексних сполук значно складніша, і для здачі ЄДІ багато чого знати з номенклатури комплексних солей не потрібно.
Слід вміти називати комплексні солі, які отримують взаємодією розчинів лугів з амфотерними гідроксидами. Наприклад:
*Однаковими кольорами у формулі та назві позначені відповідні один одному елементи формули та назви.
Тривіальні назви неорганічних речовин
Під тривіальними назвами розуміють назви речовин не пов'язані, або слабко пов'язані зі складом і будовою. Тривіальні назви обумовлені, зазвичай, або історичними причинами або фізичними чи хімічними властивостями даних сполук.
Список тривіальних назв неорганічних речовин, які необхідно знати:
| Na 3 | кріоліт |
| SiO 2 | кварц, кремнезем |
| FeS 2 | пірит, залізний колчедан |
| CaSO 4 ∙2H 2 O | гіпс |
| CaC2 | карбід кальцію |
| Al 4 C 3 | карбід алюмінію |
| KOH | їдке калі |
| NaOH | їдкий натр, каустична сода |
| H 2 O 2 | перекис водню |
| CuSO 4 ∙5H 2 O | мідний купорос |
| NH 4 Cl | нашатир |
| CaCO 3 | крейда, мармур, вапняк |
| N 2 O | звеселяючий газ |
| NO 2 | бурий газ |
| NaHCO 3 | харчова (питна) сода |
| Fe 3 O 4 | залізна окалина |
| NH 3 ∙H 2 O (NH 4 OH) | нашатирний спирт |
| CO | чадний газ |
| CO 2 | вуглекислий газ |
| SiC | карборунд (карбід кремнію) |
| PH 3 | фосфін |
| NH 3 | аміак |
| KClO 3 | бертолетова сіль (хлорат калію) |
| (CuOH) 2 CO 3 | малахіт |
| CaO | негашене вапно |
| Ca(OH) 2 | гашене вапно |
| прозорий водний розчин Ca(OH) 2 | вапняна вода |
| завись твердого Ca(OH) 2 у його водному розчині | вапняне молоко |
| K 2 CO 3 | поташ |
| Na 2 CO 3 | кальцинована сода |
| Na 2 CO 3 ∙10H 2 O | кристалічна сода |
| MgO | палена магнезія |
Хімічні елементи, з яких складається жива і нежива природа, перебувають у постійному русі, оскільки безперервно змінюються речовини, які з цих елементів.
Хімічні реакції (від лат. реакція - протидія, відсіч) - це дію у відповідь речовин на вплив інших речовин і фізичних факторів (температури, тиску, випромінювання та ін).
Однак такому визначенню відповідають також і фізичні зміни, що відбуваються з речовинами, - кипіння, плавлення, конденсація та ін. вихідних речовин утворюються нові речовини.
Хімічні реакції безперервно відбуваються як усередині нашого організму, так і в навколишньому світі. Безліч реакцій прийнято класифікувати за різними ознаками. Згадаймо з курсу 8 класу ознаки, з якими ви вже знайомі. Для цього звернемося до лабораторного досвіду.
Лабораторний досвід №3
Заміщення залізом міді у розчині сульфату міді (II)
Налийте в пробірку 2 мл розчину сульфату міді (II) і помістіть канцелярську кнопку або скріпку. Що спостерігаєте? Запишіть рівняння реакції у молекулярній та іонній формах. Розгляньте окисно-відновні процеси. На основі молекулярного рівняння віднесіть цю реакцію до тієї чи іншої групи реакцій на підставі таких ознак:
Тепер перевірте себе. CuSO 4 + Fe = FeSO 4 + Су.
|
Ми підійшли до дуже важливого поняття хімії - «швидкість хімічної реакції». Відомо, що одні хімічні реакції протікають дуже швидко, інші за значні проміжки часу. При додаванні розчину нітрату срібла до розчину хлориду натрію практично миттєво випадає білий сирний осад:
AgNO 3 + NaCl = NaNO 3 + AgCl ↓.
З величезними швидкостями протікають реакції, що супроводжуються вибухом (рис. 11, 1). Навпаки, повільно ростуть у кам'яних печерах сталактити та сталагміти (рис. 11, 2), корродують (іржавіють) сталеві вироби (рис. 11, 3), руйнуються під дією кислотних дощів палаци та статуї (рис. 11, 4).
Мал. 11.
Хімічні реакції, що протікають з величезними швидкостями (1) та дуже повільно (2-4)
| Під швидкістю хімічної реакції розуміють зміну концентрації речовин, що реагують, в одиницю часу: V p = C1 - C2/t. |
У свою чергу, під концентрацією розуміють відношення кількості речовини (як ви знаєте, вона вимірюється в молях) до об'єму, яку вона займає (у літрах). Звідси неважко вивести одиницю виміру швидкості хімічної реакції - 1 моль/(л з).
Вивчає швидкість хімічної реакції особливий розділ хімії, який називають хімічною кінетикою.
Знання її закономірностей дозволяє керувати хімічною реакцією, змушуючи її протікати швидше чи повільніше.
Від яких чинників залежить швидкість хімічної реакції?
1. Природа реагуючих речовин. Звернемося до експерименту.
Лабораторний досвід №4
Залежність швидкості хімічної реакції від природи речовин, що реагують на прикладі взаємодії кислот з металами
| Налийте в дві пробірки по 1-2 мл соляної кислоти і помістіть: в 1-у гранулу цинку, в 2-у шматок заліза такого ж розміру. Природа якого реагенту впливає на швидкість взаємодії кислоти з металом? Чому? Запишіть рівняння реакцій у молекулярній та іонній формах. Розгляньте їх із позиції окислення-відновлення. Далі помістіть в дві інші пробірки по однаковій гранули цинку і прилийте до них розчини кислот однакової концентрації: в 1-у - соляної кислоти, в 2-ю - оцтової. Природа якого реагенту впливає на швидкість взаємодії кислоти з металом? Чому? Запишіть рівняння реакцій у молекулярній та іонній формах. Розгляньте їх із позиції окислення-відновлення. |
2. Концентрація реагуючих речовин. Звернемося до експерименту.
Лабораторний досвід №5
Залежність швидкості хімічної реакції від концентрації речовин, що реагують на прикладі взаємодії цинку з соляною кислотою різної концентрації
Неважко зробити висновок: що вище концентрація реагуючих речовин, то вище і швидкість взаємодії з-поміж них.
Концентрацію газоподібних речовин для гомогенних виробничих процесів підвищують, збільшуючи тиск. Наприклад, так чинять при виробництві сірчаної кислоти, аміаку, етилового спирту.
Фактор залежності швидкості хімічної реакції від концентрації реагуючих речовин враховується як з виробництва, а й у інших галузях життєдіяльності людини, наприклад, у медицині. Хворим із захворюваннями легень, у яких швидкість взаємодії гемоглобіну крові з киснем повітря низька, полегшують дихання за допомогою кисневих подушок.
3. Площа зіткнення реагуючих речовин. Експеримент, що ілюструє залежність швидкості хімічної реакції цього чинника, може бути виконаний за допомогою наступного досвіду.
Лабораторний досвід №6
Залежність швидкості хімічної реакції від площі дотику реагуючих речовин
Для гетерогенних реакцій: чим більша площа дотику реагуючих речовин, тим вища швидкість реакції.
У цьому ви могли переконатись на особистому досвіді. Щоб розпалити багаття, ви під дрова підкладали дрібні тріски, а під них - зім'ятий папір, від якого і загорялося все багаття. Навпаки, гасіння пожежі водою полягає у зменшенні площі дотику предметів, що горять, з повітрям.
На виробництві цей фактор враховують спеціально, використовують так званий киплячий шар. Тверде речовина підвищення швидкості реакції подрібнюють майже до стану пилу, та був через нього пропускають знизу друге речовина, зазвичай газоподібне. Проходження його через дрібнороздроблену тверду речовину створює ефект кипіння (звідси і назва методу). Киплячий шар використовується, наприклад, при виробництві сірчаної кислоти та нафтопродуктів.
Лабораторний досвід №7
Моделювання «киплячого шару»
4. Температура. Звернемося до експерименту.
Лабораторний досвід №8
Залежність швидкості хімічної реакції від температури реагуючих речовин на прикладі взаємодії оксиду міді (II) з розчином сірчаної кислоти різної температури
Неважко зробити висновок: чим вища температура, тим більша швидкість реакції.
Перший лауреат Нобелівської премії голландський хімік Я. X. Вант-Гофф сформулював правило:
На виробництві використовуються, як правило, високотемпературні хімічні процеси: при виплавці чавуну та сталі, варінні скла та мила, виробництві паперу та нафтопродуктів тощо (рис. 12).

Мал. 12.
Високотемпературні хімічні процеси: 1 – виплавка чавуну; 2 - варіння скла; 3 – виробництво нафтопродуктів
П'ятий фактор, від якого залежить швидкість хімічної реакції, – каталізатори. З ним ви познайомитеся у наступному параграфі.
Нові слова та поняття
- Хімічні реакції та його класифікація.
- Ознаки класифікації хімічних реакцій.
- Швидкість хімічної реакції та фактори, від яких вона залежить.
Завдання для самостійної роботи
- Що таке хімічна реакція? У чому полягає суть хімічних процесів?
- Дайте повну класифікаційну характеристику наступних хімічних процесів:
- а) горіння фосфору;
- б) взаємодії розчину сірчаної кислоти з алюмінієм;
- в) реакції нейтралізації;
- г) утворенню оксиду азоту (IV) з оксиду азоту (II) та кисню.
- На основі особистого досвіду наведіть приклади хімічних реакцій, що протікають із різною швидкістю.
- Що таке швидкість хімічної реакції? Від яких чинників залежить?
- Наведіть приклади впливу різних факторів на біохімічні та виробничі хімічні процеси.
- На основі особистого досвіду наведіть приклади впливу різних факторів на хімічні реакції, що протікають у повсякденному житті.
- Чому продукти харчування зберігають у холодильнику?
- Хімічну реакцію почали проводити за нормальної температури 100 °З, потім підняли до 150 °З. Температурний коефіцієнт цієї реакції дорівнює 2. У скільки разів зросте швидкість хімічної реакції?
Хімічні реакції слід відрізняти від ядерних реакцій. В результаті хімічних реакцій загальна кількість атомів кожного хімічного елемента та його ізотопний склад не змінюються. Інша справа ядерні реакції - процеси перетворення атомних ядер в результаті їх взаємодії з іншими ядрами або елементарними частинками, наприклад перетворення алюмінію на магній:
27 13 Аl + 1 1 Н = 24 12 Мg + 4 2 Не
Класифікація хімічних реакцій багатопланова, тобто у її основу може бути покладено різні ознаки. Але під будь-якою з таких ознак можуть бути віднесені реакції між неорганічними, так і між органічними речовинами.
Розглянемо класифікацію хімічних реакцій за різними ознаками.
I. За кількістю та складом реагуючих речовин
Реакції без зміни складу речовин.
У неорганічній хімії до таких реакцій можна віднести процеси одержання алотропних модифікацій одного хімічного елемента, наприклад:
С (графіт) ↔ С (алмаз)
S (ромбічна) ↔ S (моноклінова)
Р (білий) ↔ Р (червоний)
Sn (біле олово) ↔ Sn (сіре олово)
3O 2 (кисень) ↔ 2O 3 (озон)
В органічній хімії до цього типу реакцій можуть бути віднесені реакції ізомеризації, які йдуть без зміни як якісного, а й кількісного складу молекул речовин, наприклад:
1. Ізомеризація алканів.
Реакція ізомеризації алканів має велике практичне значення, так як вуглеводні ізобудування мають меншу здатність до детонації.
2. Ізомеризація алкенів.
3. Ізомеризація алкінів (реакція А. Є. Фаворського).
CH 3 - CH 2 - С= - СН ↔ СН 3 - С= - С- СН 3
етилацетилен диметнлацетилен
4. Ізомеризація галогеналканів (А. Є. Фаворський, 1907).
5. Ізомеризація ціаніту амонію при нагріванні.

Вперше сечовина була синтезована Ф. Велером у 1828 р. ізомеризацією ціанату амонію при нагріванні.
Реакції, що йдуть зі зміною складу речовини
Можна виділити чотири типи таких реакцій: з'єднання, розкладання, заміщення та обміну.
1. Реакції сполуки - це такі реакції, при яких із двох і більше речовин утворюється одна складна речовина
У неорганічній хімії все різноманіття реакцій сполуки можна розглянути, наприклад, на прикладі реакцій одержання сірчаної кислоти із сірки:
1. Одержання оксиду сірки (IV):
S + O 2 = SO - із двох простих речовин утворюється одна складна.
2. Одержання оксиду сірки (VI):
SO 2 + 0 2 → 2SO 3 - із простої та складної речовин утворюється одна складна.
3. Одержання сірчаної кислоти:
SO 3 + Н 2 O = Н 2 SO 4 - із двох складних речовин утворюється одна складна.
Прикладом реакції сполуки, при якій одна складна речовина утворюється більш ніж з двох вихідних, може бути заключна стадія отримання азотної кислоти:
4NО 2 + O 2 + 2Н 2 O = 4НNO 3
В органічній хімії реакції сполуки прийнято називати реакціями приєднання. Все різноманіття таких реакцій можна розглянути на прикладі блоку реакцій, що характеризують властивості ненасичених речовин, наприклад етилену:
1. Реакція гідрування - приєднання водню:
CH 2 = CH 2 + Н 2 → Н 3 -СН 3
етен → етан
2. Реакція гідратації – приєднання води.
3. Реакція полімеризації.
2. Реакції розкладання - це такі реакції, у яких з однієї складної речовини утворюється кілька нових речовин.
У неорганічній хімії все різноманіття таких реакцій можна розглянути на блоці реакцій одержання кисню лабораторними способами:
1. Розкладання оксиду ртуті(II) - з однієї складної речовини утворюються дві прості.
2. Розкладання нітрату калію - з однієї складної речовини утворюються одна проста і одна складна.
3. Розкладання перманганату калію - з однієї складної речовини утворюються дві складні і одна проста, тобто три нові речовини.
В органічній хімії реакції розкладання можна розглянути на блоці реакцій отримання етилену в лабораторії та промисловості:
1. Реакція дегідратації (відщеплення води) етанолу:
З 2 H 5 OH → CH 2 =CH 2 + H 2 O
2. Реакція дегідрування (відщеплення водню) етану:
CH 3 -CH 3 → CH 2 = CH 2 + H 2
або СН 3 -СН 3 → 2С + ДТ 2
3. Реакція крекінгу (розщеплення) пропану:
CH 3 -СН 2 -СН 3 → СН 2 = СН 2 + СН 4
3. Реакції заміщення - це реакції, у яких атоми простої речовини заміщають атоми якогось елемента у складному речовині.
У неорганічній хімії прикладом таких процесів може бути блок реакцій, що характеризують властивості, наприклад, металів:
1. Взаємодія лужних або лужноземельних металів із водою:
2Na + 2Н 2 O = 2NаОН + Н 2
2. Взаємодія металів із кислотами в розчині:
Zn + 2НСl = ZnСl 2 + Н 2
3. Взаємодія металів із солями в розчині:
Fе + СuSO 4 = FеSO 4 + Сu
4. Металотермія:
2Аl + Сr 2 O 3 → Аl 2 O 3 + 2Сr
Предметом вивчення органічної хімії є прості речовини, лише сполуки. Тому як приклад реакції заміщення наведемо найбільш характерну властивість граничних сполук, зокрема метану - здатність його атомів водню заміщатися на атоми галогену. Інший приклад - бромування ароматичного з'єднання (бензолу, толуолу, аніліну).
С 6 Н 6 + Вr 2 → С 6 Н 5 Вr + НВr
бензол → бромбензол
Звернімо увагу на особливість реакції заміщення в органічних речовин: у результаті таких реакцій утворюються не проста і складна речовина, як у неорганічній хімії, а дві складні речовини.
В органічній хімії до реакцій заміщення відносять деякі реакції між двома складними речовинами, наприклад нітрування бензолу. Вона є формально реакцією обміну. Те, що це реакція заміщення, стає зрозумілим лише під час розгляду її механізму.
4. Реакції обміну - це такі реакції, при яких дві складні речовини обмінюються своїми складовими частинами
Ці реакції характеризують властивості електролітів і в розчинах протікають за правилом Бертолле, тобто тільки в тому випадку, якщо в результаті утворюється осад, газ або речовина, що малодисоціює (наприклад, Н 2 O).
У неорганічній хімії це може бути блок реакцій, що характеризують, наприклад, властивості лугів:
1. Реакція нейтралізації, що йде з утворенням солі та води.
2. Реакція між лугом і сіллю, що йде з утворенням газу.
3. Реакція між лугом і сіллю, що йде з утворенням осаду:
СuSO 4 + 2КОН = Сu(ОН) 2 + До 2 SO 4
або в іонному вигляді:
Сu 2+ + 2OН - = Сu(ОН) 2
В органічній хімії можна розглянути блок реакцій, що характеризують, наприклад, властивості оцтової кислоти:
1. Реакція, що йде з утворенням слабкого електроліту - Н2O:
СН 3 СООН + NаОН → Nа(СН3СОО) + Н 2 O
2. Реакція, що йде з утворенням газу:
2СН 3 СООН + СаСО 3 → 2СН 3 СОО + Са 2+ + СО 2 + Н 2 O
3. Реакція, що йде з утворенням осаду:
2СН 3 СООН + К 2 SO 3 → 2К(СН 3 СОО) + Н 2 SO 3
2СН 3 СООН +SiO → 2СН 3 СОО + Н 2 SiO 3
ІІ. За зміною ступенів окиснення хімічних елементів, що утворюють речовини
За цією ознакою розрізняють такі реакції:
1. Реакції, що йдуть зі зміною ступенів окислення елементів, або окислювально-відновлювальні реакції.
До них відноситься безліч реакцій, у тому числі всі реакції заміщення, а також ті реакції з'єднання та розкладання, в яких бере участь хоча б одна проста речовина, наприклад:
1. Mg 0 + H + 2 SO 4 = Mg +2 SO 4 + H 2

2. 2Mg 0 + O 0 2 = Mg +2 O -2

Складні окиснювально-відновні реакції складаються за допомогою методу електронного балансу.
2KMn +7 O 4 + 16HCl - = 2KCl - + 2Mn +2 Cl - 2 + 5Cl 0 2 + 8H 2 O

В органічній хімії яскравим прикладом окисно-відновних реакцій можуть бути властивості альдегідів.
1. Вони відновлюються у відповідні спирти:


Альдекіди окислюються у відповідні кислоти:


2. Реакції, що йдуть без зміни ступенів окиснення хімічних елементів.
До них, наприклад, відносяться всі реакції іонного обміну, а також багато реакцій сполуки, багато реакцій розкладання, реакції етерифікації:
НСООН + CHgOH = НСООСН 3 + H 2 O
ІІІ. По тепловому ефекту
По тепловому ефекту реакції ділять на екзотермічні та ендотермічні.
1. Екзотермічні реакції протікають із виділенням енергії.
До них відносяться майже всі реакції сполуки. Рідкісний виняток становлять ендотермічні реакції синтезу оксиду азоту(II) з азоту та кисню та реакція газоподібного водню з твердим йодом.
Екзотермічні реакції, що протікають із виділенням світла, відносять до реакцій горіння. Гідрування етилену – приклад екзотермічної реакції. Вона йде за кімнатної температури.
2. Ендотермічні реакції протікають із поглинанням енергії.
Очевидно, що до них відноситимуться майже всі реакції розкладання, наприклад:
1. Випалення вапняку
2. Крекінг бутану
Кількість виділеної або поглиненої в результаті реакції енергії називають тепловим ефектом реакції, а рівняння хімічної реакції із зазначенням цього ефекту називають термохімічним рівнянням:
Н 2(г) + З 12(г) = 2НС 1(г) + 92,3 кДж
N 2(г) + O 2(г) = 2NO(г) - 90,4 кДж
IV. За агрегатним станом реагуючих речовин (фазового складу)
За агрегатним станом реагуючих речовин розрізняють:
1. Гетерогенні реакції - реакції, в яких реагуючі речовини та продукти реакції знаходяться у різних агрегатних станах (у різних фазах).
2. Гомогенні реакції - реакції, в яких реагуючі речовини та продукти реакції знаходяться в одному агрегатному стані (в одній фазі).
V. За участю каталізатора
За участю каталізатора розрізняють:
1. Некаталітичні реакції, що йдуть без участі каталізатора.
2. Каталітичні реакції, що йдуть за участю каталізатора. Оскільки всі біохімічні реакції, які у клітинах живих організмів, йдуть з участю особливих біологічних каталізаторів білкової природи - ферментів, всі вони ставляться до каталітичних чи, точніше, ферментативним. Слід зазначити, що понад 70% хімічних виробництв використовують каталізатори.
VI. У напрямку
У напрямку розрізняють:
1. Необоротні реакції протікають у умовах лише одному напрямі. До них можна віднести всі реакції обміну, що супроводжуються утворенням осаду, газу або малодисоціюючої речовини (води) та всі реакції горіння.
2. Оборотні реакції в даних умовах протікають одночасно у двох протилежних напрямках. Таких реакцій переважна більшість.
В органічній хімії ознака оборотності відображають назви – антоніми процесів:
Гідрування - дегідрування,
Гідратація - дегідратація,
Полімеризація – деполімеризація.
Зворотні всі реакції етерифікації (протилежний процес, як ви знаєте, має назву гідролізу) і гідролізу білків, складних ефірів, вуглеводів, полінуклеотидів. Оборотність цих процесів є основою найважливішого властивості живого організму - обміну речовин.
VII. За механізмом перебігу розрізняють:
1. Радикальні реакції йдуть між утворюються в ході реакції радикалами та молекулами.
Як ви вже знаєте, при всіх реакціях відбувається розрив старих та утворення нових хімічних зв'язків. Спосіб розриву зв'язку у молекулах вихідної речовини визначає механізм (шлях) реакції. Якщо речовина утворена за рахунок ковалентного зв'язку, то можуть бути два способи розриву зв'язку: гемолітичний і гетеролітичний. Наприклад, для молекул Сl 2 СН 4 і т. д. реалізується гемолітичний розрив зв'язків, він призведе до утворення частинок з неспареними електронами, тобто вільних радикалів.
Радикали найчастіше утворюються, коли розриваються зв'язки, при яких загальні електронні пари розподілені між атомами приблизно однаково (неполярний ковалентний зв'язок), проте багато полярних зв'язків також можуть розриватися подібним чином, зокрема тоді, коли реакція проходить в газовій фазі і під дією світла , як, наприклад, у разі розглянутих вище процесів - взаємодії 12 і СН 4 - . Радикали дуже реакційноздатні, оскільки прагнуть завершити свій електронний шар, забравши електрон в іншого атома чи молекули. Наприклад, коли радикал хлору стикається з молекулою водню, він викликає розрив загальної електронної пари, що зв'язує атоми водню, і утворює ковалентний зв'язок з одним з атомів водню. Другий атом водню, ставши радикалом, утворює загальну електронну пару з неспареним електроном атома хлору з молекули Сl 2 , що руйнується, в результаті чого виникає радикал хлору, який атакує нову молекулу водню і т. д.
Реакції, які є ланцюгом послідовних перетворень, називають ланцюговими реакціями. За розробку теорії ланцюгових реакцій два видатних хіміка - наш співвітчизник Н. Н. Семенов та англієць С. А. Хіншелвуд були удостоєні Нобелівської премії.
Аналогічно протікає і реакція заміщення між хлором та метаном:

За радикальним механізмом протікають більшість реакцій горіння органічних та неорганічних речовин, синтез води, аміаку, полімеризація етилену, вінілхлориду та ін.
2. Іонні реакції йдуть між вже наявними або такими, що утворюються в ході реакції іонами.
Типові іонні реакції – це взаємодія між електролітами у розчині. Іони утворюються як при дисоціації електролітів у розчинах, а й під впливом електричних розрядів, нагрівання чи випромінювань. γ-Промені, наприклад, перетворюють молекули води та метану на молекулярні іони.
За іншим іонним механізмом відбуваються реакції приєднання до алкенів галогеноводородів, водню, галогенів, окислення та дегідратація спиртів, заміщення спиртового гідроксилу на галоген; реакції, що характеризують властивості альдегідів та кислот. Іони у разі утворюються при гетеролітичному розриві ковалентних полярних зв'язків.
VIII. За видом енергії,
ініціює реакцію, розрізняють:
1. Фотохімічні реакції. Їх ініціює світлова енергія. Крім розглянутих вище фотохімічних процесів синтезу НСl або реакції метану з хлором, до них можна віднести одержання озону у тропосфері як вторинного забруднювача атмосфери. У ролі первинного у разі виступає оксид азоту(IV), який під впливом світла утворює радикали кисню. Ці радикали взаємодіють із молекулами кисню, у результаті виходить озон.
Утворення озону йде весь час, поки достатньо світла, тому що NO може взаємодіяти з молекулами кисню з утворенням того ж NO 2 . Накопичення озону та інших вторинних забруднювачів атмосфери може призвести до появи фотохімічного смогу.
До цього виду реакцій належить і найважливіший процес, що протікає в рослинних клітинах - фотосинтез, назва якого говорить сама за себе.
2. Радіаційні реакції. Вони ініціюються випромінюваннями великої енергії - рентгенівськими променями, ядерними випромінюваннями (γ-променями, а-частинками - Не 2+ та ін.). За допомогою радіаційних реакцій проводять дуже швидку радіополімеризацію, радіоліз (радіаційне розкладання) і т.д.
Наприклад, замість двостадійного одержання фенолу з бензолу, його можна отримувати взаємодією бензолу з водою під дією радіаційних випромінювань. При цьому з молекул води утворюються радикали [ON] і [H], з якими і реагує бензол з утворенням фенолу:
З 6 Н 6 + 2[ВІН] → З 6 Н 5 ВІН + Н 2 O
Вулканізація каучуку може бути проведена без сірки з використанням радіовулканізації, і отримана гума буде нітрохи не гіршою за традиційну.
3. Електрохімічні реакції. Їх ініціює електричний струм. Крім добре відомих вам реакцій електролізу вкажемо також реакції електросинтезу, наприклад реакції промислового отримання неорганічних окислювачів
4. Термохімічні реакції. Їх ініціює теплова енергія. До них відносяться всі ендотермічні реакції та безліч екзотермічних реакцій, для початку яких необхідна початкова подача теплоти, тобто ініціювання процесу.
Розглянута вище класифікація хімічних реакцій відбито схемою.
Класифікація хімічних реакцій, як та інші класифікації, умовна. Вчені домовилися розділити реакцію певні типи за виділеними ними ознаками. Але більшість хімічних перетворень можна зарахувати до різних типів. Наприклад, складемо характеристику процесу синтезу аміаку.
Це реакція сполуки, окислювально-відновна, екзотермічна, оборотна, каталітична, гетерогенна (точніше, гетерогенно-каталітична), що протікає із зменшенням тиску в системі. Для успішного управління процесом необхідно враховувати усі наведені відомості. Конкретна хімічна реакція завжди багатоякісна, її характеризують різні ознаки.

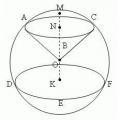 Сфера, куля, сегмент та сектор
Сфера, куля, сегмент та сектор Спеціальність «Сестринська справа» (бакалаврат)
Спеціальність «Сестринська справа» (бакалаврат) Найпростіші властивості інтегралів
Найпростіші властивості інтегралів