Cấu trúc của nhóm cacboxyl. Một đoạn trích mô tả đặc điểm của nhóm cacboxyl
Axit cacboxylic là dẫn xuất hydrocarbon có chứa một hoặc nhiều nhóm cacboxyl.
Số lượng nhóm cacboxyl đặc trưng cho tính bazơ của axit.
Tùy thuộc vào số lượng nhóm cacboxyl, axit cacboxylic được chia thành axit cacboxylic đơn chức (chứa một nhóm cacboxyl), dibasic (chứa hai nhóm cacboxyl) và axit đa bazơ.
Tùy thuộc vào loại gốc liên kết với nhóm cacboxyl, axit cacboxylic được chia thành bão hòa, không bão hòa và thơm. Axit bão hòa và không bão hòa được kết hợp dưới tên chung là axit béo hoặc axit béo.
Axit cacboxylic đơn chức
1.1 Dãy tương đồng và danh pháp
Chuỗi tương đồng của axit cacboxylic bão hòa đơn chức (đôi khi được gọi là axit béo) bắt đầu bằng axit formic
Công thức dãy đồng đẳng
Danh pháp IUPAC cho phép nhiều axit giữ lại các tên thông thường của chúng, thường chỉ ra nguồn tự nhiên mà từ đó một axit cụ thể được phân lập, ví dụ, formic, acetic, butyric, valeric, v.v..
Đối với những trường hợp phức tạp hơn, tên của axit được lấy từ tên của hydrocacbon có cùng số nguyên tử cacbon như trong phân tử axit, có thêm đuôi -mới và lời nói axit. Axit formic H-COOH được gọi là axit methanoic, axit axetic CH 3 -COOH được gọi là axit ethanoic, v.v.
Do đó, axit được coi là dẫn xuất của hydrocacbon, một đơn vị trong đó được chuyển thành cacboxyl:

Khi tổng hợp tên của các axit mạch nhánh theo danh pháp hợp lý, chúng được coi là dẫn xuất của axit axetic, trong phân tử mà các nguyên tử hydro được thay thế bằng các gốc, ví dụ, axit trimethylacetic (CH 3) 3 C - COOH.
1.2 Tính chất vật lý của axit cacboxylic
Chỉ từ quan điểm hình thức thuần túy, nhóm carboxyl mới có thể được coi là sự kết hợp của các chức năng carbonyl và hydroxyl. Trên thực tế, ảnh hưởng lẫn nhau của chúng đến mức làm thay đổi hoàn toàn tính chất của chúng.
Độ phân cực của liên kết đôi C=0, thường thấy ở cacbonyl, tăng lên rất nhiều do sự co lại của cặp electron tự do khỏi nguyên tử oxy lân cận của nhóm hydroxyl:

Hậu quả của điều này là sự suy yếu đáng kể của liên kết O-H trong hydroxyl và dễ dàng tách nguyên tử hydro khỏi nó dưới dạng proton (H +). Sự xuất hiện mật độ electron giảm (δ+) trên nguyên tử carbon trung tâm của carboxyl cũng dẫn đến sự co lại của các electron σ của liên kết C-C lân cận với nhóm carboxyl và sự xuất hiện (như trong aldehyd và xeton) của một chất khử mật độ electron (δ+) trên nguyên tử α-cacbon của axit.
Tất cả các axit cacboxylic đều có tính axit (được phát hiện bằng chất chỉ thị) và tạo thành muối với hydroxit, oxit và cacbonat của kim loại và với kim loại hoạt động:
Axit cacboxylic trong hầu hết các trường hợp trong dung dịch nước chỉ phân ly ở mức độ nhỏ và là axit yếu, kém hơn đáng kể so với các axit như hydrochloric, nitric và sulfuric. Như vậy, khi hòa tan một mol trong 16 lít nước thì độ phân ly của axit formic là 0,06, axit axetic là 0,0167, trong khi axit clohydric với độ pha loãng như vậy gần như phân ly hoàn toàn.
Đối với hầu hết các axit cacboxylic đơn chức rK MỘT = 4,8, chỉ có axit formic có giá trị pKa thấp hơn (khoảng 3,7), điều này được giải thích là do không có hiệu ứng nhường electron của các nhóm alkyl.
Trong axit khoáng khan, axit cacboxylic được proton hóa ở oxy để tạo thành cacbocation:

Sự thay đổi mật độ electron trong phân tử axit cacboxylic không phân ly, đã được đề cập ở trên, làm giảm mật độ electron trên nguyên tử oxy hydroxyl và tăng mật độ electron trên nguyên tử oxy carbonyl. Sự dịch chuyển này còn tăng thêm trong anion axit:

Kết quả của sự dịch chuyển là sự cân bằng hoàn toàn các điện tích trong anion, thực chất tồn tại ở dạng cộng hưởng anion A - carboxylate.
Bốn đại diện đầu tiên của loạt axit cacboxylic là chất lỏng di động, có thể trộn với nước về mọi mặt. Axit, phân tử chứa từ năm đến chín nguyên tử carbon (cũng như axit isobutyric), là chất lỏng nhờn, độ hòa tan trong nước thấp.
Các axit cao hơn (từ C 10) là chất rắn, thực tế không hòa tan trong nước và trong quá trình chưng cất trong điều kiện bình thường, chúng bị phân hủy.
Axit formic, axetic và propionic có mùi hăng; Các thành phần ở giữa của dãy có mùi khó chịu, các axit cao hơn không có mùi.

Các tính chất vật lý của axit cacboxylic bị ảnh hưởng bởi mức độ liên kết đáng kể do sự hình thành liên kết hydro. Axit tạo thành liên kết hydro mạnh vì liên kết O-H trong chúng có độ phân cực cao. Ngoài ra, axit cacboxylic có khả năng hình thành liên kết hydro với sự tham gia của nguyên tử oxy của lưỡng cực carbonyl, có độ âm điện đáng kể. Thật vậy, ở trạng thái rắn và lỏng, axit cacboxylic tồn tại chủ yếu ở dạng chất nhị trùng tuần hoàn:
Các cấu trúc dimeric như vậy được giữ lại ở một mức độ nào đó ngay cả ở trạng thái khí và trong dung dịch loãng trong dung môi không phân cực.
Nhóm cacboxyl (cacboxyl) -COOH là nhóm hóa trị một chức năng, là một phần của axit cacboxylic và xác định tính chất axit của chúng.
Cấu trúc của nhóm cacboxyl
Nhóm carboxyl kết hợp hai nhóm chức - carbonyl (>C=O) và hydroxyl (-OH), ảnh hưởng lẫn nhau.
Tính chất axit của axit cacboxylic là do sự dịch chuyển mật độ electron sang oxy cacbonyl và dẫn đến sự phân cực bổ sung (so với rượu) của liên kết O-H.
Trong dung dịch nước, axit cacboxylic phân ly thành các ion:
R-COOH = R-COO − + H +
Độ hòa tan trong nước và nhiệt độ sôi cao của axit là do sự hình thành liên kết hydro liên phân tử.
Khi trọng lượng phân tử tăng lên, độ hòa tan của axit trong nước giảm.
| Đây là một bài viết dự thảo về hóa học hữu cơ. Bạn có thể giúp dự án bằng cách thêm vào nó. |
Viết nhận xét về bài viết “Nhóm cacboxyl”
Một đoạn trích mô tả đặc điểm của nhóm cacboxyl
Vài ngày trước khi Rostov rời đi, một buổi lễ cầu nguyện đã được lên lịch tại nhà thờ nhân dịp quân đội Nga giành được chiến thắng, và Nicholas đã đến dự thánh lễ. Anh ta đứng sau thống đốc một chút và với sự điềm tĩnh chính thức, suy nghĩ về nhiều chủ đề khác nhau, anh ta đã chịu đựng sự phục vụ của mình. Khi buổi lễ cầu nguyện kết thúc, vợ của thống đốc gọi ông đến gặp bà.- Cậu có thấy công chúa không? - cô nói và chỉ đầu vào người phụ nữ mặc đồ đen đứng sau dàn hợp xướng.
Nikolai ngay lập tức nhận ra Công chúa Marya không phải bởi vẻ ngoài có thể nhìn thấy từ dưới chiếc mũ của cô ấy mà bởi cảm giác thận trọng, sợ hãi và thương hại ngay lập tức khiến anh choáng ngợp. Công chúa Marya, rõ ràng đang chìm đắm trong suy nghĩ, đang làm những cây thánh giá cuối cùng trước khi rời nhà thờ.
Nikolai ngạc nhiên nhìn mặt cô. Đó chính là khuôn mặt mà anh đã từng thấy trước đây, cùng một biểu hiện chung của công việc tinh thần, nội tâm, tinh tế ở trong đó; nhưng bây giờ nó được chiếu sáng theo một cách hoàn toàn khác. Trên người anh có một biểu hiện cảm động về nỗi buồn, lời cầu nguyện và hy vọng. Như đã xảy ra trước đây với sự có mặt của Nikolai trước sự chứng kiến của cô, anh, không đợi lời khuyên của vợ thống đốc mới đến gặp cô, không tự hỏi liệu địa chỉ của anh gửi cho cô ở nhà thờ này có tốt, đàng hoàng hay không, anh đã đến gặp cô và nói rằng anh đã có. nghe về nỗi đau buồn của cô ấy và thông cảm với anh ấy bằng cả trái tim. Vừa nghe thấy giọng nói của anh, đột nhiên một tia sáng chiếu vào mặt cô, đồng thời soi sáng nỗi buồn và niềm vui của cô.
Axit cacboxylic là những hợp chất có chứa nhóm cacboxyl:
Axit cacboxylic được phân biệt:
- axit cacboxylic đơn chất;
- axit dibasic (dicarboxylic) (2 nhóm UNS).
Tùy thuộc vào cấu trúc của chúng, axit cacboxylic được phân biệt:
- béo;
- béo tuần hoàn;
- thơm.
Ví dụ về axit cacboxylic.


Điều chế axit cacboxylic.
1. Oxy hóa rượu bậc nhất bằng thuốc tím và kali dicromat:

2. Quá trình thủy phân các hydrocacbon được thế halogen chứa 3 nguyên tử halogen trên một nguyên tử cacbon:
3. Điều chế axit cacboxylic từ xyanua:
Khi đun nóng, nitrile thủy phân tạo thành amoni axetat:
Khi axit hóa, axit kết tủa:
4. Sử dụng thuốc thử Grignard:
5. Thủy phân este:
6. Thủy phân axit anhydrit:
7. Các phương pháp cụ thể để thu được axit cacboxylic:
Axit formic được tạo ra bằng cách đun nóng cacbon(II) monoxit với natri hydroxit dạng bột dưới áp suất:
Axit axetic được tạo ra bởi quá trình oxy hóa xúc tác butan với oxy trong khí quyển:
Axit benzoic thu được bằng cách oxy hóa các chất tương đồng đơn thế bằng dung dịch kali permanganat:
Phản ứng của Canniciaro. Benzaldehyde được xử lý bằng dung dịch natri hydroxit 40-60% ở nhiệt độ phòng.

Tính chất hóa học của axit cacboxylic.
Trong dung dịch nước, axit cacboxylic phân ly:

Cân bằng dịch chuyển mạnh về bên trái vì axit cacboxylic yếu.
Các chất thay thế ảnh hưởng đến tính axit do hiệu ứng cảm ứng. Các nhóm thế như vậy kéo mật độ electron về phía chúng và xảy ra hiệu ứng cảm ứng âm (-I) lên chúng. Sự rút mật độ điện tử dẫn đến sự gia tăng tính axit của axit. Các nhóm thế nhường electron tạo ra điện tích cảm ứng dương.

1. Sự hình thành muối. Phản ứng với oxit bazơ, muối của axit yếu và kim loại hoạt động:

Axit cacboxylic yếu vì axit khoáng thay thế chúng khỏi các muối tương ứng:
2. Sự hình thành các dẫn xuất chức năng của axit cacboxylic:
3. Este khi đun nóng axit với rượu với sự có mặt của axit sunfuric - phản ứng este hóa:
4. Sự hình thành amit, nitriles:
3. Tính chất của axit được xác định bởi sự có mặt của gốc hydrocarbon. Nếu phản ứng xảy ra với sự có mặt của phốt pho đỏ, nó sẽ tạo thành sản phẩm sau:
4. Phản ứng cộng.

8. Khử carboxyl. Phản ứng được thực hiện bằng cách nung chảy chất kiềm với muối kim loại kiềm của axit cacboxylic:
9. Axit dibasic dễ dàng bị loại bỏ CO2 khi đun nóng:
Tài liệu bổ sung về chủ đề: Axit cacboxylic.
Máy tính hóa học |
|
| Hóa học trực tuyến trên trang web của chúng tôi để giải các bài toán và phương trình. | |
Nhóm carboxyl kết hợp hai nhóm chức năng - carbonyl và hydroxyl, ảnh hưởng lẫn nhau. Sự ảnh hưởng này được truyền qua hệ thống giao diện sp 2 nguyên tử O–C–O.
Cấu trúc điện tử của nhóm –COOH mang lại cho axit cacboxylic các tính chất vật lý và hóa học đặc trưng.
1. Sự dịch chuyển mật độ electron sang nguyên tử oxy carbonyl gây ra sự phân cực bổ sung (so với rượu và phenol) của liên kết O–H, quyết định độ linh động của nguyên tử hydro ( tính chất axit).
Trong dung dịch nước, axit cacboxylic phân ly thành các ion:
Tuy nhiên, axit cacboxylic nói chung là axit yếu: trong dung dịch nước muối của chúng bị thủy phân mạnh.
Video thí nghiệm "Axit cacboxylic là chất điện li yếu".
2. Mật độ electron (δ+) trên nguyên tử cacbon trong nhóm cacboxyl giảm làm cho các phản ứng có thể xảy ra sự thay thế nucleophin nhóm -OH.
3. Nhóm -COOH do nguyên tử cacbon tích điện dương nên làm giảm mật độ electron trên gốc hydrocarbon liên kết với nó, tức là. có liên quan đến anh ấy sự rút electron phó Trong trường hợp axit bão hòa, nhóm cacboxyl thể hiện -TÔI -Tác dụng, và ở dạng không bão hòa (ví dụ CH 2 =CH-COOH) và thơm (C 6 H 5 -COOH) - -TÔI Và -M -các hiệu ứng.
4. Nhóm carboxyl, là chất nhận điện tử, gây ra sự phân cực bổ sung của liên kết C–H ở vị trí (α-) lân cận và làm tăng tính linh động của nguyên tử α-hydro trong các phản ứng thay thế ở gốc hydrocarbon.
Xem thêm “Trung tâm phản ứng trong phân tử axit cacboxylic”.
Các nguyên tử hydro và oxy trong nhóm carboxyl -COOH có khả năng hình thành liên kết hydro liên phân tử, điều này quyết định phần lớn đến tính chất vật lý axit cacboxylic.
Do sự liên kết của các phân tử, axit cacboxylic có điểm sôi và nóng chảy cao. Trong điều kiện bình thường chúng tồn tại ở trạng thái lỏng hoặc rắn.
Ví dụ, đại diện đơn giản nhất là axit formic HCOOH - một chất lỏng không màu có bp. 101 °C, và axit axetic khan tinh khiết CH 3 COOH, khi được làm lạnh đến 16,8 °C, biến thành tinh thể trong suốt giống như nước đá (do đó có tên là axit băng).
Video thí nghiệm "Axit axetic băng".
Axit thơm đơn giản nhất - axit benzoic C 6 H 5 COOH (mp 122,4 ° C) - dễ dàng thăng hoa, tức là. chuyển sang trạng thái khí, bỏ qua trạng thái lỏng. Khi nguội đi, hơi của nó thăng hoa thành tinh thể. Tính chất này được sử dụng để làm sạch một chất khỏi tạp chất.
Video thí nghiệm "Thăng hoa của axit benzoic."
Độ hòa tan của axit cacboxylic trong nước là do sự hình thành liên kết hydro liên phân tử với dung môi:
Các chất tương đồng thấp hơn C 1 -C 3 có thể trộn với nước ở bất kỳ tỷ lệ nào. Khi gốc hydrocarbon tăng lên, độ hòa tan của axit trong nước giảm. Các axit cao hơn, ví dụ, palmitic C 15 H 31 COOH và stearic C 17 H 35 COOH, là những chất rắn không màu, không hòa tan trong nước.
CARBOXYL, nhóm CARBOXYL [carbo... + gr. có tính axit] – nhóm đơn nguyên tử COOH, đặc trưng cho chất hữu cơ, được gọi là. axit cacboxylic, ví dụ, axit axetic CH3COOH Từ điển lớn các từ nước ngoài. Nhà xuất bản “IDDK”, 2007… Từ điển từ nước ngoài của tiếng Nga
NHÓM CARBOXYL- (carboxyl), axit COOH nhóm C có trong (xem); số K.g xác định tính bazơ của axit... Bách khoa toàn thư bách khoa lớn
Nhóm carboxy, carboxyl, một nhóm hóa trị một đặc trưng của axit cacboxylic. Bao gồm các nhóm carbonyl và hydroxyl (OH) (do đó có tên: carb + oxyl) ... Từ điển bách khoa bách khoa lớn
Carboxyl, nhóm chức hóa trị một của axit cacboxylic) và xác định tính chất axit của chúng... Bách khoa toàn thư vĩ đại của Liên Xô
nhóm cacboxyl- cacboxyl... Từ điển đồng nghĩa hóa học I
Một gr đơn trị. COOH, sự hiện diện của nó quyết định sự liên kết của tổ chức. hợp chất thành axit cacboxylic. Ví dụ: axit axetic CH3COOH. Khi thay thế hydro bằng kim loại, muối được hình thành; khi thay thế hydro bằng gốc hydro... ... Bách khoa toàn thư địa chất
Benzyl axetat có nhóm chức ete (màu đỏ), nhóm acetyl (màu xanh lá cây) và nhóm benzyl (màu cam). Đoạn cấu trúc nhóm chức của chất hữu cơ ... Wikipedia
nhóm chức năng- Nhóm chức Nhóm chức Một đoạn cấu trúc của phân tử đặc trưng cho một loại hợp chất hữu cơ nhất định và xác định tính chất hóa học của nó. Ví dụ về các nhóm chức: azide, hydroxyl, carbonyl,... ... Từ điển giải thích tiếng Anh-Nga về công nghệ nano. - M.
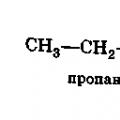 Một đoạn trích mô tả đặc điểm của nhóm cacboxyl
Một đoạn trích mô tả đặc điểm của nhóm cacboxyl Làng Potemkin - huyền thoại hay hiện thực?
Làng Potemkin - huyền thoại hay hiện thực? Những hố sụt lớn nhất được biết đến
Những hố sụt lớn nhất được biết đến