Как появилось название лунная. Происхождение луны
ТРИВИАЛЬНЫЕ НАЗВАНИЯ ВЕЩЕСТВ. В течение многих веков и тысячелетий люди использовали в своей практической деятельности множество самых разнообразных веществ. Немало их упомянуто и в Библии (это и драгоценные камни, и красители, и различные благовония). Конечно, каждому из них давалось название. Конечно, оно не имело ничего общего с составом вещества. Иногда название отражало внешний вид или особое свойство, реальное или вымышленное. Типичный пример – алмаз. По-гречески damasma – покорение, укрощение, damao – сокрушаю; соответственно, adamas – несокрушимый (интересно, что и по-арабски «аль-мас» – твердейший, самый твердый). В древности этому камню приписывали чудесные свойства, например, такое: если между молотом и наковальней положить кристаллик алмаза, то скорее они разлетятся вдребезги, чем повредится «царь камней». На самом деле алмаз очень хрупок и совершенно не выдерживает ударов. А вот слово «бриллиант» реально отражает свойство ограненного алмаза: по-французски brilliant – блестящий.
Множество названий веществ придумали алхимики. Некоторые из них сохранились и по сей день. Так, название элемента цинка (в русский язык его ввел М.В.Ломоносов) происходит, вероятно, от древнегерманского tinka – «белый»; действительно, самый распространенный препарат цинка – оксид ZnO имеет белый цвет. В то же время алхимики придумали множество самых фантастических названий – частично в силу своих философских взглядов, частично – чтобы засекретить результаты своих опытов. Например, тот же оксид цинка они называли «философской шерстью» (это вещество алхимики получали в виде рыхлого порошка). Другие названия основывались на способах получения вещества. Например, метиловый спирт называли древесным спиртом, а ацетат кальция – «пригорело-древесной солью» (при получении обоих веществ использовали сухую перегонку древесины, что, конечно, приводило к ее обугливанию – «пригоранию»). Очень часто одно и то же вещество получало несколько названий. Например, даже к концу 18 в. для сульфата меди существовало четыре названия, для карбоната меди – десять, для углекислого газа – двенадцать!
Неоднозначным было и описание химических процедур. Так, в работах М.В.Ломоносова можно встретить упоминание о «распущенном подонке», что может смутить современного читателя (хотя в поваренных книгах порой попадаются рецепты, по которым надо «распустить килограмм сахара в литре воды», а «подонок» означает просто «осадок»).
В настоящее время названия веществ регламентируются правилами химической номенклатуры (от латинского nomenclatura – роспись имен). В химии номенклатурой называют систему правил, пользуясь которыми, каждому веществу можно дать «имя» и, наоборот, зная «имя» вещества, записать его химическую формулу. Разработать единую, однозначную, простую и удобную номенклатуру – дело непростое: достаточно сказать, что и сегодня среди химиков нет на этот счет полного единства. Вопросами номенклатуры занимается специальная комиссия Международного союза теоретической и прикладной химии – ИЮПАК (по начальным буквам английского названия International Union of Pure and Applied Chemistry). А национальные комиссии разрабатывают правила применения рекомендаций ИЮПАК к языку своей страны. Так, в русском языке старинный термин «окись» был заменен на международный «оксид», что нашло отражение и в школьных учебниках.
С разработкой системы национальных названий химических соединений связаны и анекдотические истории. Например, в 1870 комиссия по химической номенклатуре Русского физико-химического общества обсуждала предложение одного химика называть соединения по тому же принципу, по какому в русском языке строятся имена, отчества и фамилии. Например: Калий Хлорович (KCl), Калий Хлорович Трикислов (KClO 3), Хлор Водородович (HCl), Водород Кислородович (Н 2 О). После долгих прений комиссия постановила: отложить обсуждение этого вопроса до января, не указав при этом, – какого года. С тех пор комиссия к этому вопросу больше не возвращалась.
Современной химической номенклатуре более двух веков. В 1787 знаменитый французский химик Антуан Лоран Лавуазье представил Академии наук в Париже результаты работы возглавляемой им комиссии по созданию новой химической номенклатуры. В соответствии с предложениями комиссии, новые названия были даны химическим элементам, а также сложным веществам с учётом их состава. Названия элементов подбирались так, чтобы они отражали особенности их химических свойств. Так, элемент, который ранее Пристли называл «дефлогистированным воздухом», Шееле – «огненным воздухом», а сам Лавуазье – «жизненным воздухом», по новой номенклатуре получил название кислорода (тогда считали, что в состав кислот обязательно входит этот элемент). Кислоты получили название от соответствующих элементов; в результате «селитряная дымистая кислота» превратилась в азотную, а «купоросное масло» в серную кислоту. Для обозначения солей стали использовать названия кислот и соответствующих металлов (или аммония).
Принятие новой химической номенклатуры позволило систематизировать обширный фактический материал, чрезвычайно облегчило изучение химии. Несмотря на все изменения, основные принципы, заложенные Лавуазье, сохранились до наших дней. Тем не менее и среди химиков, и особенно среди непрофессионалов сохранилось множество так называемых тривиальных (от лат. trivialis – обыкновенный) названий, которые иногда употребляются неверно. Например, плохо почувствовавшему себя человеку предлагают «понюхать нашатыря». Для химика это – нонсенс, так как нашатырь (хлорид аммония) – соль без запаха. В данном случае нашатырь перепутан с нашатырным спиртом, который действительно имеет резкий запах и возбуждает дыхательный центр.
Массу тривиальных названий химических соединений до сих пор используют художники, технологи, строители (охра, мумия, сурик, киноварь, глёт, пушонка и т.д.). Еще больше тривиальных названий среди лекарственных средств. В справочниках можно встретить до десятка и более различных синонимов для одного и того же препарата, что связано в основном с фирменными названиями, принятыми в разных странах (например, отечественный пирацетам и импортный ноотропил, венгерский седуксен и польский реланиум и т.п.).
Химики тоже часто пользуются тривиальными названиями веществ, иногда довольно любопытных. Например, 1,2,4,5-тетраметилбензол имеет тривиальное название «дурол», а 1,2,3,5-тетраметилбензол – «изодурол». Тривиальное название намного удобнее, если для всех очевидно, о чем идет речь. Например, даже химик никогда не назовет обычный сахар «альфа-D-глюкопиранозил-бета-D-фруктофуранозидом», а использует тривиальное название этого вещество – сахароза. И даже в неорганической химии систематическое, строго по номенклатуре, название многих соединений может быть громоздким и неудобным, например: О 2 – дикислород, О 3 – трикислород, Р 4 О 10 – декаоксид тетрафосфора, Н 3 РО 4 – тетраоксофосфат(V) водорода, ВаSО 3 – триоксосульфат бария, Cs 2 Fe(SO 4) 2 – тетраоксосульфат(VI) железа(II)-дицезия и т.д. И хотя систематическое название полностью отражает состав вещества, на практике пользуются тривиальными названиями: озон, фосфорная кислота и т.д.
Среди химиков распространены также именные названия многих соединений, особенно комплексных солей, таких как соль Цейзе K.H 2 O – по имени датского химика Вильяма Цейзе. Такие краткие названия очень удобны. Например, вместо «нитрозодисульфонат калия» химик скажет «соль Фреми», вместо «кристаллогидрат двойного сульфата аммония-железа(II)» – соль Мора и т.д.
В таблице приведены наиболее распространенные тривиальные (бытовые) названия некоторых химических соединений, за исключением узкоспециальных, устаревших, медицинских терминов, и названий минералов, а также их традиционные химические названия.
| Таблица 1. ТРИВИАЛЬНЫЕ (БЫТОВЫЕ) НАЗВАНИЯ НЕКОТОРЫХ ХИМИЧЕСКИХ СОЕДИНЕНИЙ | ||
| Тривиальное название | Химическое название | Формула |
| Алебастр | Гидрат сульфата кальция (2/1) | 2CaSO 4 . H 2 O |
| Ангидрит | Сульфат кальция | CaSO 4 |
| Аурипигмент | Сульфид мышьяка | As 2 S 3 |
| Белила свинцовые | Основной карбонат свинца | 2PbCO 3 . Pb(OH) 2 |
| Белила титановые | Оксид титана(IV) | TiO 2 |
| Белила цинковые | Оксид цинка | ZnO |
| Берлинская лазурь | Гексацианоферрат(II) железа(III)-калия | KFe |
| Бертолетова соль | Хлорат калия | KClO 3 |
| Болотный газ | Метан | СН 4 |
| Бура | Тетрагидрат тетрабората натрия | Na 2 B 4 O 7 . 10H 2 O |
| Веселящий газ | Оксид азота(I) | N 2 O |
| Гипосульфит (фото) | Пентагидрат тиосульфата натрия | Na 2 S 2 O 3 . 5Н 2 О |
| Глауберова соль | Декагидрат сульфата натрия | Na 2 SO 4 . 10H 2 O |
| Глёт свинцовый | Оксид свинца(II) | PbO |
| Глинозем | Оксид алюминия | Al 2 O 3 |
| Горькая соль | Гептагидрат сульфата магния | MgSO 4 . 7H 2 O |
| Едкий натр (каустик) | Гидроксид натрия | NaOH |
| Едкое кали | Гидроксид калия | КОН |
| Желтая кровяная соль | Тригидрат гексацианоферрата(III) калия | K 4 Fe(CN) 6 . 3H 2 O |
| Желтый кадмий | Сульфид кадмия | CdS |
| Жженая магнезия | Оксид магния | MgO |
| Известь гашеная (пушонка) | Гидроксид кальция | Са(ОН) 2 |
| Известь жженая (негашеная, кипелка) | Оксид кальция | СаО |
| Каломель | Хлорид ртути(I) | Hg 2 Cl 2 |
| Карборунд | Карбид кремния | SiC |
| Квасцы | Додекагидраты двойных сульфатов 3- и 1-валентных металлов или аммония (например, алюмокалиевые квасцы) | M I M III (SO 4) 2 . 12H 2 O (M I –катионы Na, K, Rb, Cs, Tl, NH 4 ; M III – катионы Al, Ga, In, Tl, Ti, V, Cr, Fe, Co, Mn, Rh, Ir) |
| Киноварь | Сульфид ртути | HgS |
| Красная кровяная соль | Гексацианоферрат(II) калия | K 3 Fe(CN) 6 |
| Кремнезем | Оксид кремния | SiO 2 |
| Купоросное масло (аккумуляторная кислота) | Серная кислота | H 2 SО4 |
| Купоросы | Кристаллогидраты сульфатов ряда двухвалентных металлов | M II SO 4 . 7H 2 O (M II – катионы Fe, Co, Ni, Zn, Mn) |
| Ляпис | Нитрат серебра | AgNO 3 |
| Мочевина | Карбамид | CO(NH 2) 2 |
| Нашатырный спирт | Водный раствор аммиака | NH 3 . x H 2 O |
| Нашатырь | Хлорид аммония | NH 4 Cl |
| Олеум | Раствор оксида серы(III) в серной кислоте | H 2 SO 4 . x SO 3 |
| Пергидроль | 30%-ный водный раствор пероксида водорода | Н 2 О 2 |
| Плавиковая кислота | Водный раствор фтороводорода | HF |
| Поваренная (каменная) соль | Хлорид натрия | NaCl |
| Поташ | Карбонат калия | К 2 СО 3 |
| Растворимое стекло | Нонагидрат силиката натрия | Na 2 SiO 3 . 9H 2 O |
| Свинцовый сахар | Тригидрат ацетата свинца | Pb(CH 3 COO) 2 . 3H 2 O |
| Сегнетова (сеньетова) соль | Тетрагидрат тартрата калия-натрия | KNaC 4 H 4 O 6 . 4H 2 O |
| Селитра аммиачная | Нитрат аммония | NH 4 NO 3 |
| Селитра калиевая (индийская) | Нитрат калия | KNO 3 |
| Селитра норвежская | Нитрат кальция | Ca(NO 3) 2 |
| Селитра чилийская | Нитрат натрия | NaNO 3 |
| Серная печень | Полисульфиды натрия | Na 2 Sx |
| Сернистый газ | Оксид серы(IV) | SO 2 |
| Серный ангидрид | Оксид серы(VI) | SO 3 |
| Серный цвет | Тонкий порошок серы | S |
| Силикагель | Высушенный гель кремниевой кислоты | SiO 2 . x H 2 O |
| Синильная кислота | Циановодород | HCN |
| Сода кальцинированная | Карбонат натрия | Na 2 CO 3 |
| Сода каустическая (см. Едкий натр) | ||
| Сода питьевая | Гидрокарбонат натрия | NaHCO 3 |
| Станиоль | Оловянная фольга | Sn |
| Сулема | Хлорид ртути(II) | HgCl 2 |
| Суперфосфат двойной | Гидрат дигидрофосфата кальция | Са(Н 2 РО 4) 2 . Н 2 О |
| Суперфосфат простой | То же в смеси с СаSO 4 | |
| Сусальное золото | Сульфид олова(IV) или золотая фольга | SnS 2 , Au |
| Сурик свинцовый | Оксид свинца(IV)- дисвинца(II) | Pb 3 O 4 (Pb 2 II Pb IV O 4) |
| Сурик железный | Оксид дижелеза(III)-железа(II) | Fe 3 O 4 (Fe II Fe 2 III)O 4 |
| Сухой лед | Твердый оксид углерода(IV) | CO 2 |
| Хлорная известь | Смешанный хлорид- гипохлорит кальция | Ca(OCl)Cl |
| Угарный газ | Оксид углерода(II) | СО |
| Углекислый газ | Оксид углерода(IV) | СО 2 |
| Фосген | Карбонилдихлорид | COCl 2 |
| Хромовая зелень | Оксид хрома(III) | Cr 2 O 3 |
| Хромпик (калиевый) | Дихромат калия | K 2 Cr 2 O 7 |
| Ярь-медянка | Основной ацетат меди | Cu(OH) 2 . x Cu(CH 3 COO) 2 |
Илья Леенсон
Свод правил, как надо называть то или иное химическое соединение, называется химической номенклатурой. Первоначально названия химических веществ появлялись без каких-либо правил и систематики — такие названия сейчас называются «тривиальными». Многие названия, которые употребляются уже сотни, а иногда и тысячи лет (например, уксусная кислота), в ходу и сейчас.
Какая номенклатура лучше
С тех пор как химия стала наукой, предпринимались неоднократные попытки систематизировать химические названия. На данный момент существует множество химических номенклатур, популярных в большей или меньшей степени. Наиболее распространенной являются «Рациональная номенклатура» для неорганических соединений и «Правила номенклатуры органических соединений IUPAC 1957». Тем не менее, абсолютно универсальной системы названий нет, разные организации, научные издания и даже страны отдают предпочтение той или иной номенклатуре, поэтому практически любая номенклатура содержит таблицы синонимов. Например, воду можно называть дигидрогена монооксид или H2O, а серную кислоту — тетраоксосульфат диводорода или H2SO4. В таблице Менделеева у каждого элемента есть два названия, к примеру, русское и международное обозначение: олово и Sn (Stannum), серебро и Ag (Argentum).
В России употребляются разные номенклатуры. Роспатент рекомендует использовать Chemical Abstracts, в ГОСТе используются правила ИЮПАК (Международный союз теоретической и прикладной химии). При этом считается разумным для давно известных веществ использовать устоявшиеся тривиальные названия: сода, вода, лимонная кислота , а вот для новых веществ, особенно органических, сложного состава, лучше использовать систематические названия, в которых отражено строение соединения.
Систематика для неорганических веществ
 Названия неорганических соединений основываются на русских названиях элементов или использовании корней традиционных латинских названий: нитрид от Nitrogenium, дикислород, бромид, оксид от Oxygenium, сульфид от sulfur, карбонат от Carboneum и т.п. Для указания числа атомов в соединении используются приставки, например, моно- (один), ди- (два), тетра- (четыре), дека- (десять), додека- (двенадцать). Для неопределенного числа пишут п- (поли-).
Названия неорганических соединений основываются на русских названиях элементов или использовании корней традиционных латинских названий: нитрид от Nitrogenium, дикислород, бромид, оксид от Oxygenium, сульфид от sulfur, карбонат от Carboneum и т.п. Для указания числа атомов в соединении используются приставки, например, моно- (один), ди- (два), тетра- (четыре), дека- (десять), додека- (двенадцать). Для неопределенного числа пишут п- (поли-).
Названия химического вещества отражает его химическую формулу, состоящую из реальных или условных ионов. Названия читаются справа налево. Число ионов указывается с помощью приставки либо степенью окисления римской цифрой в скобках:
SnO2 — диоксид олова, оксид олова (IV);
SnO — монооксид олова, оксид олова (II).
Для известных веществ используются устоявшиеся названия: вода, аммиак, сероводород, озон, кислород, фтороводород и т. д.
Названия кислот и щелочей
Названия кислот состоят из названия образующего вещества и слова «кислота»: угольная кислота, азотная кислота, соляная кислота. Для менее известных кислот используются правила построения названия для комплексных соединений. Например, борофтористоводородная кислота HBF4 еще называется тетрафтороборная кислота.
Названия щелочей состоят из названия металла и слова «гидроксид (гидроокись)»: гидроксид натрия, гидроокись кальция.
Названия солей
Составляются из названия кислотного остатка и металла. Главным является кислотный остаток. Для кислородосодержащих солей используется суффикс «-ат/-ит», для не содержащих кислород — «-ид». Например, NaBr — бромид натрия , K2CO3 — карбонат калия.
Для кислородосодержащих солей используются различные суффиксы и приставки, показывающие степень окисления кислотного остатка.
За основу взят суффикс «-ат»,
при понижении степени окисления, используется сначала суффикс «-ит», потом, в дополнение к суффиксу «-ит», приставка «гипо-». 
Для более высокой степени окисления суффикс «-ат» дополняется приставкой «пер-». Например,
NaClO4 — перхлорат натрия,
NaClO3 — хлорат натрия,
NaClO2 — хлорит натрия,
NaClO — гипохлорит натрия.
Для кислых, оснóвных солей, кристаллогидратов и некоторых других групп существуют свои групповые названия и правила образования. Например, для кристаллогидратов используют слово «гидрат» перед названием соли. Квасцы — это общее название класса двойных сульфатов, например, KAl(SO4)2*12H2O — алюмокалиевые квасцы .
Для органических веществ используются номенклатурные правила, отражающие строение этих соединений. Мы рассмотрим их в наших следующих статьях.
Относительная молекулярная масса - масса (а. е. м.) 6,02 × 10 23 молекул сложного вещества. Численно равна молярной массе, но отличается размерностью.
- Атомы в молекулах соединены друг с другом в определённой последовательности. Изменение этой последовательности приводит к образованию нового вещества с новыми свойствами.
- Соединение атомов происходит в соответствии с их валентностью.
- Свойства веществ зависят не только от их состава, но и от «химического строения», то есть от порядка соединения атомов в молекулах и характера их взаимного влияния. Наиболее сильно влияют друг на друга атомы, непосредственно связанные между собой.
Тепловой эффект реакции - это теплота, которая выделяется или поглощается системой при течении в ней химической реакции. В зависимости от того, происходит реакция с выделением теплоты или сопровождается поглощением теплоты, различают экзо-и эндотермические реакции. К первым, как правило, относятся все реакции соединения, а ко вторым - реакции разложения.
Скорость химической реакции - изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства.
Внутренняя энергия системы - суммарная энергия внутренней системы, включающая энергию взаимодействия и движения молекул, атомов, ядер, электронов в атомах, внутриядерную и другие виды энергии, кроме кинетической и потенциальной энергии системы, как целого.
Стандартная энтальпия (теплота) образования сложного вещества - тепловой эффект реакции образования 1 моля этого вещества из простых веществ, находящихся в устойчивом агрегатном состоянии при стандартных условиях (= 298 К и давлении 101 кПа).
С начала времен люди интересовались составом, строением и взаимодействием всего, что их окружает. Эти знания объединены в единую науку - химию. В статье рассмотрим, что это такое, разделы химии и необходимость ее изучения.
и зачем ее изучать?
Химия является одной из нескольких областей естествознания, наукой о веществах. Она занимается изучением:
- строения и состава веществ;
- свойств элементов окружающего мира;
- превращений веществ, которые зависят от их свойств;
- изменения состава вещества в ходе химической реакции;
- законов и закономерностей изменений веществ.
Химия рассматривает все элементы с точки зрения атомно-молекулярного состава. Она тесно связана с биологией и физикой. Также существует множество областей науки, которые являются пограничными, то есть изучаются, например, и химией, и физикой. К таковым относятся: биохимия, квантовая химия, химическая физика, геохимия, физическая химия и другие.
Основными разделами химии в литературе считаются:
- Органическая химия.
- Неорганическая химия.
- Биохимия.
- Физическая химия.
- Аналитическая химия.
Органическая химия
Химию можно классифицировать по признаку изучаемых веществ на:
- неорганическую;
- органическую.
Первую область изучения рассмотрим в следующем пункте. Почему органическую химию выделили в отдельный раздел? Потому что она занимается исследованием соединений углерода и веществ, в состав которых он входит. На сегодня известно около 8 млн таких соединений.
Углерод может соединяться с большинством элементов, но чаще всего взаимодействует с:
- кислородом;
- углеродом;
- азотом;
- серой;
- марганцем;
- калием.
Также элемент отличается способностью образовывать длинные цепочки. Подобные связи обеспечивают многообразие органических соединений, которые важны для существования живого организма.
Цели и методы, которым следует предмет органической химии:
- выделение отдельных индивидуальных и особенных веществ их растительных и живых организмов, а также из ископаемого сырья.
- очистка и синтез ;
- определение структуры вещества в природе;
- изучение протекания химической реакции, ее механизмы, особенности, и результаты;
- определение взаимосвязей и зависимостей между структурой органического вещества и его свойствами.
Разделы органической химии включают:
Неорганическая химия
Раздел неорганической химии занимается изучением состава, структуры и взаимодействий всех веществ, не содержащих углерод. На сегодня насчитывается более 400 тысяч неорганических веществ. Благодаря именно этому разделу науки обеспечивается создание материалов для современной техники.
Исследования и изучение веществ неорганической химии основывается на периодическом законе, а также периодической системе Д. И. Менделеева. Наука изучает:
- простые вещества (металлы и неметаллы);
- сложные вещества (оксиды, соли, кислоты, нитриты, гидриды и другие).
Задачи науки:

Физическая химия
Физическая химия является самым обширным разделом химии. Она занимается изучением общих законов и превращений веществ с помощью методов физики. Для этого применяются теоретические и экспериментальные из них.
Физическая химия включает знания о:
- строении молекул;
- химической термодинамике;
- химической кинетике;
- катализе.
Разделы физической химии следующие:

Аналитическая химия
Аналитическая химия - раздел химии, который развивает теоретическую базу химического анализа. Наука занимается разработкой методов идентификации, разделения, обнаружения и определения химических соединений и установлением химического состава материалов.
Аналитическую химию можно классифицировать в зависимости от решаемых задач на:
- Качественный анализ - определяет, какие вещества находятся в образце, их форму и сущность.
- Количественный анализ - определяет содержание (концентрацию) компонентов в исследуемом образце.
Если требуется проанализировать неизвестную пробу, то сначала применяется качественный анализ, а потом количественный. Они проводятся химическими, инструментальными и биологическими методами.

Биохимия
Биохимия - раздел химии, который исследует химический состав живых клеток и организмов, а также базовые их жизнедеятельности. Наука является достаточно молодой и находится на стыке биологии и химии.
Биохимия занимается исследованием таких соединений:
- углеводы;
- липиды;
- белки;
- нуклеиновые кислоты.
Разделы биохимии:

Химическая технология
Является разделом химии, который изучает экономичные и экологически обоснованные методы переработки природных материалов для их потребления и использования в производстве.
Наука подразделяется на:
- Органическую химическую технологию, которая занимается переработкой горючих ископаемых, получением синтетических полимеров, лекарств и иных веществ.
- Неорганическую химическую технологию, которая занимается переработкой минерального сырья (кроме металлической руды), получением кислот, минеральных удобрений и щелочей.
В химической технологии происходит множество процессов (периодических или непрерывных). Они разделяются на основные группы:

Протекание некоторых химических процессов и свойства отдельных веществ вызывают необычный интерес людей.
Вот некоторые из них:
- Галлий. Это интересный материал, который имеет свойство плавиться при комнатной температуре. По виду похож на алюминий. Если ложку из галлия опустить в жидкость по температуре выше 28 градусов по Цельсию, то она расплавится и потеряет форму.
- Молибден. Этот материал был обнаружен во время Первой мировой войны. Исследования его свойств показали высокую прочность вещества. Позднее из него была изготовлена легендарная пушка «Большая Берта». Ее ствол не деформировался от перегрева при стрельбе, что упростило использование орудия.
- Вода. Известно, что вода в чистом виде H 2 O не встречается в природе. Благодаря своим свойствам, она впитывает все, что встречается на пути. Поэтому истинно чистую жидкость можно получить только в лаборатории.
- Также известно еще одно особенное свойство воды - ее реакция на изменение окружающего мира. Исследования показали, что вода из одного источника при разных воздействиях (магнитном, при включенной музыке, рядом с людьми), меняет свою структуру.
- Меркаптан. Это соединение сладкого, горького и кислого вкусов, которое было обнаружено после исследования грейпфрута. Установлено, что человек замечает этот вкус при концентрации 0,02 нг/л. То есть достаточно на объем воды в 100 тыс. тонн добавить 2 мг меркаптана.
Можно сказать, что химия - неотъемлемая часть научного знания человечества. Она интересна и многогранна. Именно благодаря химии люди имеют возможность пользоваться множеством предметов современного окружающего мира.
Самая главная загадка Луны заключается в ее происхождении. Мы до сих пор не знаем, откуда взялась Луна. Но гипотез происхождения Луны предостаточно. Давайте рассмотрим их.
Но сначала
О Луне
У Земли есть только один спутник – Луна. Он движется вокруг Земли по орбите на среднем расстоянии от нее в 376 284 км.
Сила тяготения Земли постепенно замедляет вращение Луны вокруг своей оси, так что теперь Луна обходит весь свой путь вокруг Земли точно за такое же время, какое занимает один ее оборот вокруг своей оси. Такое синхронное вращение означает, что мы, глядя на Луну с Земли, всегда видим только одну ее сторону. Обратную сторону Луны удалось увидеть только космонавтам и космическим кораблям.
Поскольку Луна движется вокруг Земли, Солнце освещает различные доли ее поверхности.

Посмотрите на картинку. Вы видите на ней, как выглядит Луна из одной и той же точки Земли, находясь в разных точках своей орбиты: лунный серп, половина лунного диска (первая четверть), прибывающая Луна, полнолуние, убывающая Луна, половиналунного диска (последняя четверть), лунный серп.
Луна имеет очень большой размер относительно Земли. Диаметр Луны на экваторе (в средней части) равен 3475 км, это чуть меньше четверти диаметра Земли. Поэтому некоторые астрономы даже считают, что систему Земля-Луна надо рассматривать как двойную планету.
Но вернемся все-таки к вопросуо происхождении Луны.
Гипотезы о происхождении Луны
Гипотеза первая
На ранних стадиях существования Земли у нее была система колец вроде той, что имеется у Сатурна. Возможно, Луна образовалась из них?
Гипотеза вторая (центробежного разделения)
Когда Земля была еще совсем юной и состояла из расплавленных пород, она вращалась так быстро, что из-за этого растянулась, приобрела форму груши, а затем верхняя часть этой «груши» оторвалась и превратилась в Луну. Эту гипотезу в шутку называют «дочерней».
Гипотеза третья (столкновения)
Когда Земля была молодой, она подверглась удару какого-то небесного тела, размер которого составлял половину размера самой Земли. В результате этого столкновения огромное количество вещества было выброшено в космическое пространство, а впоследствии из него сформировалась Луна.
Гипотеза четвертая (захвата)
Земля и Луна образовались независимо, в разных частях Солнечной системы. Когда Луна проходила близко к земной орбите, она была захвачена гравитационным полем Земли и стала её спутником. Эту гипотезу в шутку называют «супружеской».
Гипотеза пятая (совместного образования)
Земля и Луна образовались одновременно, в непосредственной близости друг от друга (в шутку - «сестринская» гипотеза).
Гипотеза шестая (многих лун)
Несколько маленьких лун были захвачены гравитацией Земли, затем они столкнулись друг с другом, разрушились, и из их обломков образовалась нынешняя Луна.
Гипотеза седьмая (испарения)
Из расплавленной протоземли были выпарены в пространство значительные массы вещества, которое затем остыло, сконденсировалось на орбите и образовало протолуну.
Каждая из этих гипотез имеет свои «за» и свои «против». В настоящее время основной и более приемлемой считается гипотеза столкновения. Рассмотрим ее подробнее.
Эта гипотеза была предложена Уильямом Хартманом и Дональдом Дэвисом в 1975 году. По их предположению, протопланета (её назвали Тейя ) размером примерно с Марс столкнулась с прото-Землей на ранней стадии её формирования, когда Земля имела примерно 90 % нынешней массы. Удар пришёлся не по центру, а под углом, почти по касательной. В результате большая часть вещества ударившегося объекта и часть вещества земной мантии были выброшены на околоземную орбиту. Из этих обломков собралась прото-Луна и начала обращаться по орбите с радиусом около 60 000 км. Земля в результате удара получила резкий прирост скорости вращения (один оборот за 5 часов) и заметный наклон оси вращения.
Почему именно эта гипотеза о происхождении Луны считается основной? Она хорошо объясняет все известные факты о химическом составе и строении Луны, а также и физические параметры системы Луна-Земля. Первоначально большие сомнения вызывала возможность столь удачного соударения (косой удар, невысокая относительная скорость) такого крупного тела с Землей. Но затем было предположено, что Тейя сформировалась на орбите Земли. Такой сценарий хорошо объясняет и низкую скорость столкновения, и угол удара, и нынешнюю, почти точно круговую орбиту Земли.
Но и у этой гипотезы есть свои уязвимые места, как, впрочем, у каждой гипотезы (ведь ГИПОТЕЗА в переводе с древнегреческого обозначает «предположение»).
Так вот, уязвимость этой гипотезы состоит в следующем: у Луны очень маленькое железо-никелевое ядро - оно составляет всего 2-3 % от общей массы спутника. А металлическое ядро Земли составляет около 30 % массы планеты. Для объяснения дефицита железа на Луне приходится принимать допущение, что ко времени столкновения (4,5 млрд. лет назад) и на Земле, и на Тейе уже выделилось тяжёлое железное ядро и образовалась лёгкая силикатная мантия. Но однозначных геологических подтверждений этому допущению не найдено.
И второе: если бы Луна так или иначе оказалась на орбите Земли в столь далёкое время и после этого не претерпевала существенных потрясений, то на её поверхности, по расчётам, успел бы скопиться многометровый слой оседающей из космоса пыли, что не было подтверждено при посадках космических аппаратов на лунную поверхность.

Итак…
До 60-х годов XX века главными гипотезами происхождения Луны были три: центробежного отделения, захвата и совместного образования. Одной из главных целей американских лунных экспедиций 1960-1970 годов было найти доказательства одной из этих гипотез. Первые же полученные данные обнаружили серьёзные противоречия со всеми тремя гипотезами. Но во время полётов «Аполлонов» ещё не существовало гипотезы гигантского столкновения. Именно она и является сейчас господствующей .
 Воля: функции, понятие, основные признаки
Воля: функции, понятие, основные признаки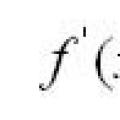 Геометрический и механический смысл производной
Геометрический и механический смысл производной Свойства степеней при сложении
Свойства степеней при сложении